无机化学氧族元素全解
无机化学_15氧族全解
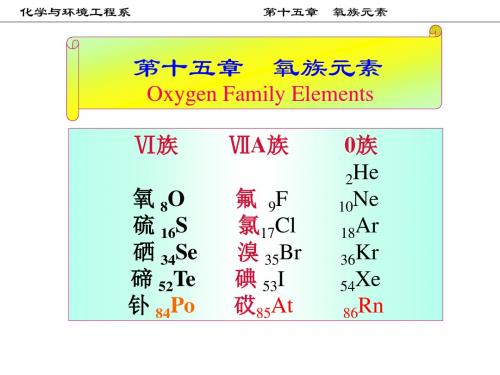
第十五章 氧族元素
氧族元素
氮族元素概述
氧族 (VIA) 元素 存在 价层电子构 型 电负性 氧化值 O 非金属 S Se 准金属 Te Po 放射性金属
金属性逐渐增强,非金属性减弱 单质或矿物 共生于重金属硫化物中
2s22p4 3.44
-2, (- 1)
3s23p4 2.58 ±2,4,6 分子 晶体
实验室制法
BaO2+H2SO4=BaSO4↓+H2O2 BaO2+CO2+H2O=BaCO3↓+H2O2
阳极:2HSO4-=S2O82-+2H++2e阴极:2H+ + 2e-=H2↑
工业制法
S2O82-+2H2O=H2O2+2HSO4-
化学与环境工程系
第十五章 氧族元素
乙基蒽醌法
只要求了解
H2O2 是一种重要的化学试剂,常用做 漂白剂和消毒剂, 3% 的过氧化氢称为双 氧水,用于伤口消毒。在航天工业上, 可作为火箭发射的燃料。
化学与环境工程系
乙醚
第十五章 氧族元素
Cr2O72- + 2H2O2 + 2H+ == 5H2O + 2CrO5
(蓝色加合物)
此反应用于铬酸根的检验,加合 物不稳定,在水溶液中很快分解, 常加入一些乙醚萃取,使其稳定. 不稳定性 过氧化氢受热、遇光或重金属离子Mn2+、Fe3+、Cr3+分解: 2H2O2====2H2O+O2 它在碱性介质中的分解更快,应保存在棕色瓶中,放于阴 凉地方,还可加入些稳定剂如锡酸钠、焦磷酸钠或8-羟基 喹啉等。
电负性:氧仅次于氟
熔点、沸点、随半径的增大而增 大;第一电离势和电负性则变小。
无机化学教学课件16章氧族元素

氧元素的电负性很大,仅次于氟元素,因此氧元素在大多数含氧化合 物中的氧化值为 -2。
硫、硒、碲的价电子层中均有空 d 轨道,当与电负性比较大的元素化 合时,空 d 轨道也可以成键,这些元素的氧化值可呈现 +2、+4、+6。
为了保护臭氧层,国际社会多次召开会议,要求各国减少并逐步禁止 氟氯烃等消耗臭层物质。
(2) 性质
A 物理性质
它是一种非常毒的蓝色气体,有特殊的腥臭味;少量O3可以净化 空气、大量O3对人体有害。液态O3是深蓝色,固态O3是暗紫色,由于 O3的极化作用与极化率都大于O2,所以其熔、沸点比O2高,比O2易溶 于水,有颜色。吸收紫外线。
水在任何生命体中占50~90%。 水在人体血液中占80%,在肌肉中占35%,若 一个人活到七十岁,那么他一生饮水约为25吨。 水分子的分子轨道表示为:
(s
s
)
2
(s
z
)
2
(s
non x
)
2
(p
non y
)
2
H2O的纯化:离子交换除钙,镁离子; 由于同位素1H、3H(T,只存在于核蜕变过程)、2H(D)和16O、
16-3 硒、碲及其化合物 Selenium, Te and their compounds
16-0 概述
p区及氧族元素在周期
表中的位置
第 16 族(VIIA)元素也称氧族元素,由氧、硫、硒、碲和钋五种 元素组成。氧和硫元素是典型的非金属元素,硒和碲元素是准金属元素, 钋元素是放射性金属元素。
16-0-1 天然资源
无机化学:氧族元素

碳酸汞、氧化汞等 12
1. 氧( O2)
VB:
O 2s2 2px1 2py2 2pz1
|
|
O 2s2 2px1 2py2 2pz1 即O=O 应为“反磁性”。
MO:
(
1s
)
2
(
1s
)
2
(
2
s
)
2
(
2s
)
2
(
2
px
)2
2 2
py pz
2 2
(2) 不稳定性
K2 10-25
2H 2O2 2H 2O O2 ,Δ r Hm -196kJ mol -1
22
(3)氧化还原性
酸性条件: O2 0.682V H2O2 1.77V H2O
碱性条件:HO
2
H 2O
3e
3OH
,
E 0.87V
H 2O2 2Fe 2 2H 2Fe 3 2H 2O
H 2O2 PbS(s, 黑) PbSO 4 (s,白) 4H 2O
5H 2O 2
2MnO
4
6H
2Mn
2
5O 2
8H
2O
3H 2O2
2Cr(OH)
4
2OH -
2CrO
24
8H 2O
可见:H2O2氧化性强,还原性弱;
是不造成二次污染的杀菌剂。
24
性质:(1) 不稳定性
2O3 3O2
(2) 氧化性
Δr H m 286 kJ mol -1
课件无机化学15_氧族元素

15-2 氧 及 其 化 合 物 15-2-1 氧 气 单 质
1.O2有何结构特点?该结构可使其具有何种 反应性? 2.何谓单线态氧?单线态氧有何结构特点?对 人体的生理过程有何影响?
15-2-1 氧 气 单 质
1.O2有何结构特点?该结构可使其具有何种反 应性? 结构特点:在π轨道中有不成对的单电子, O2分子具有偶数电子同时又显示顺磁性。 反应性: 形成离子型、共价型、O22-、O2-
H2O2的检验:
在酸性溶液中过氧化氢能使重铬酸盐生成二
过氧合铬的氧化物,即Cr(O2)2O或CrO5,生成
的CrO5显蓝色,在乙醚中比较稳定,检验时在
乙醚层中显蓝色,可以相互检验。
4H2O2+H2Cr2O7===2Cr(O2)2O+5H2O 2Cr(O2)2O+7H2O2+6H+===2Cr3++7O2↑+10H2O
OH 乙基蒽醇 O C2H5 + H2O2
15-2-4 过 氧 化 氢
2.H2O2有哪些主要性质? 热稳定性差 弱酸性 氧化还原性 形成过氧化链(过氧链转移)
H2O2的不稳定性和酸性: H2O2的分解速率随OH-浓度的增大而加 快,某些金属离子也可催化H2O2的分解(如
Mn2+、Fe2+、Cu2+)。
O O O
O O O
• •
ห้องสมุดไป่ตู้
Π
4 3
15-2-3 臭 氧
2.比较O3和O2的价键结构,说明为什么氧化性 O3>O2,热稳定性O3<O2?
15-2-4 过 氧 化 氢
1.H2O2有哪几种制备方法? 2.H2O2有哪些主要性质? 3.从电极电势说明:H2O2作氧化剂和还原剂 的相对强弱?H2O2作氧化剂还原剂有何优点?
无机化学第十三章 氧族元素

第十三章氧族元素§本章摘要§1.氧氧气和氧化物臭氧过氧化氢氧元素的成键特征2.硫和硫化物单质硫硫化氢和氢硫酸硫化物3.硫的含氧化合物S(IV)的含氧化合物S(VI)的含氧化合物硫的其它价态含氧化合物4.硒和碲氧 O:存在形式 O2(大气圈)、H2O (水圈)、SiO2及硅酸盐,其它含氧化合物(岩石圈)。
丰度 48.6 %,居第 1 位。
硫 S:天然单质硫矿;硫化物矿。
方铅矿 PbS,闪锌矿 ZnS;硫酸盐矿:石膏 CaSO4〃2H2O,芒硝 Na2SO4〃10H2O,重晶石 BaSO4,天青石 SrSO4,占0.048% 居第16位硒 Se:硒铅矿 PbSe,硒铜矿 CuSe碲 Te:碲铅矿 PbTe 为%钋 Po:放射性元素,本章不做介绍。
§1. 氧一.氧气和氧化物1 氧气的制备加热含氧化合物制氧气2BaO2→(加热)2BaO + O22NaNO3→(加热) 2NaNO2+ O2最常见的是催化分解 KClO3,工业上制取 O2的方法是分馏液化空气。
b.p. N2 77 K , O290 K2 氧气的性质常温下,无色无味无臭气体,在 H2O中溶解度很小,O2为非极性分子,H2O为极性溶剂。
在水中有水合氧分子存在。
水中少量氧气是水生动植物赖以二臭氧1 臭氧的分子结构臭氧的分子式为 O3,价层电子总数: 6 + 0×2 = 6, 3对,2个配体,价层电子对构型:三角形,中心氧原子的杂化方式:sp2不等性杂化。
中心的 2Pz 轨道和两个配体的 2Pz 轨道均垂直于分子平面,互相重叠,共有 4 个电子(中心 2 个,配体 1 个× 2 )在这 3 个 Pz 轨道中运动,形成 3 中心 4 电子大Π键,表示成。
画出上述大Π键的分子轨道图,以2 臭氧的产生、性质和存在在高温和放电的条件下,O2可以变成 O3。
如雷雨季节里闪电,产生的高压放电,可引发反应 3 O2——2 O3O3淡蓝色,有鱼腥气味,由于分子有极性,在水中的溶解度比 O2大些。
第十六章-氧族元素PPT课件
11
第11页/共78页
第十六章 氧族元素
性质二:强氧化性
§16.2 氧、臭氧
O3是一种极强的氧化剂,氧化能力仅次于F2。
O3 2H 2e O2 H2O EA 2.08V
O3 H2O 2e
性质 性质一:强氧化性
性质二:还原性
性质三:不稳定性
性质四:二元弱酸
21
第21页/共78页
第十六章 氧族元素
性质一:强氧化性 • 酸性溶液
§16.3 H2O2O2 来自.6824 H2O2 1.776 H2O
• 碱性溶液
O2 0.076 HO2 0.878 OH
H2O2无论在酸性溶液还是在碱性溶液中都是强氧 化剂。
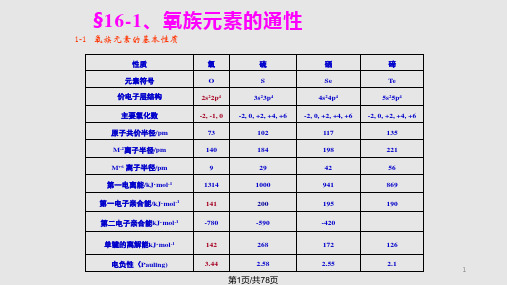
§16-1、氧族元素的通性
1-1 氧族元素的基本性质
性质 元素符号 价电子层结构 主要氧化数 原子共价半径/pm M-2离子半径/pm M+6 离子半径/pm 第一电离能/kJ·mol-1 第一电子亲合能/kJ·mol-1 第二电子亲合能kJ·mol-1
氧 O 2s22p4 -2, -1, 0 73 140 9 1314 141
-420
单键的离解能kJ·mol-1
142
268
172
126
电负性(Pauling)
3.44
2.58
2.55
2.1
1
第1页/共78页
第十六章 氧族元素
§16.1 通性
1-2 氧族元素的成键特征
• 能结合两个电子形成氧化数为-2的阴离子,表现出非 金属元素特性。
• 非金属活泼性弱于卤素。
无机化学——氧族元素

无机化学——氧族元素无机化学,氧族元素氧族元素是周期表中第16族元素,包括氧、硫、硒、碲和钋。
这些元素的电子构型都是 ns2 np4,因此它们在化学性质上有些相似。
本文将重点讨论氧族元素的性质和应用。
首先,氧族元素的化学性质主要受到它们的电子构型的影响。
由于氧族元素的 np4 外层电子非常稳定,因此它们都倾向于接受两个电子,形成-2 价的阴离子。
这使得氧族元素在化合物中通常呈现-2 价,例如氧化物(O2-)、硫化物(S2-)等。
然而,这并不意味着氧族元素只能形成-2 价,它们还可以形成其他价态,如+4、+6等。
氧族元素参与的化学反应主要包括氧化反应和还原反应。
它们在氧化反应中往往是氧化剂,能够接受电子使其他物质发生氧化。
例如,氧气(O2)是最常见的氧化剂,可以与其他物质反应生成氧化产物。
氧化剂的强弱顺序为:O2>S>Se>Te>Po。
在还原反应中,氧族元素的化合物可以接受电子,发生还原。
例如,硫酸(H2SO4)可以被还原成二氧化硫(SO2)。
氧族元素在生物和环境中起着非常重要的作用。
氧是地球上最常见的元素之一,占据大气中的21%。
它是细胞呼吸和许多生物代谢反应的关键组分,在维持生命中起着至关重要的作用。
此外,氧还参与水的形成和氧化燃烧等重要过程。
硫是地球上第10常见的元素,在自然界中以硫化物和硫酸盐的形式广泛存在。
硫化物在地下矿床中存在,如铅、锌和铜的硫化物,通过提取和加工可以得到对应的金属。
硫酸是一种重要的化学品,在工业生产中广泛应用,如肥料、造纸、皮革制品等。
硒在生物体内有重要的生理作用,是人体中一种必需的微量元素。
它参与抗氧化作用和免疫反应,对维持机体正常生理功能起着重要的作用。
然而,长期摄入过多的硒会导致中毒,因此硒的摄入量需要控制在适当的范围内。
碲是一种具有金属和非金属特性的半金属元素。
它在半导体工业中有重要应用,用于制造太阳能电池和热敏电阻等器件。
此外,碲还具有光电效应和光敏化学反应的特性,在一些领域具有潜在的应用前景。
大学无机化学氧族元素全解

空气和水是制取O2的主要原料,工业上使用的氧气大约有97% 的氧是从空气中提取的
工业上制取氧,主要是通过物理方法液化空气,然后分馏制 氧。把所得的氧压入高压钢瓶中储存,便于运输和使用。此方 法制得的O2气,纯度高达99.5%。
实验室,由氧化物或含氧酸盐制备
(1) NaNO 3 热分解: 2NaNO 3 === 2NaNO 2 + O 2
液态氧的化学活性相当高,可与许多金属、非金属,特别 是有机物接触时,易发生爆炸性反应。因此,储存、运输 和使用液氧时须格外小心。
2021/2/11
7
2.3 氧的结构、性质和用途
Hale Waihona Puke • 氧化性E0 (O2/H2O) = +1.23V, E0 (O2/OH-) = +0.40V ,
O2 + NH3 → H2O + N2 或 NO
1. 分子结构
O
:O.
. O:
O3 电偶极矩μ≠0, 3个O原子不在同一直线 上;∠OOO=116.8º,键长为 127.8pm, 使 O3 分子呈等腰三角形状。 中心O原子sp2杂
化。
2021/2/11
9
2.4 臭氧
根据分子轨道法处理: O 3 分子中 三个 O 原子的这组平行的 p 轨道进行线性组合成三个分子轨道,一个是成键轨道(1),另 一个是非键轨道(2),第三个是反键轨道(3),轨道的能量依 次升高。
在,约占大气质量的23%,几乎所有这些氧都来自水和二氧化碳
在绿色植物中发生的光合作用, 其净反应可表示为:
H2O + CO2 + hO2+(碳水化合物) 自然界中的氧含有三种同位素,即O16,O17和O18,在普通氧中,
无机化学-第三章-氧族元素
2、硫的化学性质
1)与许多金属 直接化合
2Al3S Al2S3 HgS HgS
2)与氢、氧、碳、 卤素(碘除外)、 磷等直接作用
S3F2(过量) SF6 SCl2 ΔSCl2
SO2 SO2
3)与氧化性酸作用
S + 6HNO3(浓) H2SO4 + 6NO2+2H2O
4)与碱的作用
3S + 6NaOH 2Na2S + Na2SO3 + 3H2O
(二)、三氧化硫、硫酸及其盐
1、SO3 无色,易挥发固体 固体有三种结构复杂的变体
性质:强氧化性 10SO3 + 4P = 10SO2 + P4O10 SO3 + 2KI = K2SO3 + I2
溶于浓硫酸得发烟硫酸(H2SO4·xSO3)
SO3中的大π键 S:
3p4 3s2
2O: 2 s2
pz 2p4
3CuS+ 8HNO3→3S+2NO+3Cu(NO3)2+4H2O 3HgS+2HNO3+12HCl →3S+2NO+3H2[HgCl4]+4H2O
HgS + Na2S = Na2[HgS2]
3)多硫化物
碱金属(包括NH4+)硫化物水溶液能溶解单质硫生成多硫化物。
Na2S+(x-1)S = Na2Sx (Sx)2-随着硫链的变长颜色:黄→橙→红
二、硫化氢和硫化物
1)硫化氢
结构:H2S结构与H2O相似(键角谁大?) 性质:弱酸性 ( Ka1=8.9×10-8 Ka2=7.1×10-19) 强还原性:
0.3002V
EA
SO24
0.1576V H SO
13章-氧族元素解析

Ag2O+HO2-=2Ag+OH-+ O2↑ 2024/7/11 41
介质对H2O2氧化还原性的影响
H2O2+2NaOH+MnSO4=MnO2↓+Na2SO4 +2H2O
H2O2+H2SO4+MnOM2=nM2+n(强SO酸4+性O)2↑-+浅2粉H溶2
所有液态、固态物质中最大(调节气温)。
3.与同族其它氢化物相比,熔、沸点;熔化热; 蒸发热等异常高。
4.密度 4℃(277K)最大,1.0g·cm-3
T下降,密度减小(?)。(一般物质热胀冷 缩,T下降,体积减小,密度增大)
2024/7/11 27
2024/7/11 28
2024/7/11 29
2024/7/11 33
五、水的化学性质
1.热分解 2H2O=2H2+O2 △Hθ=483.6kJ·mol-1 2.水合作用 H3O+ Fe(H2O)62+ CuSO4·5H2O 3.水解作用
Ca3N2+6H2O=Ca(OH)2+NH3↑ PCI5+4H2O=H3PO4+5HCI SbCI3+H2O=SbOCI↓+2HCI SO3+H2O=H2SO4 2B+6H2O(g)=2H3BO3+3H2↑ 2024/7/11 34
2024/7/11
4
1.空气液化 (97%) 物理方法液化空气,然后分馏制氧。
2.电解水(3%) 3.氧化物或含氧酸盐的热分解
HgO→Hg+O2 ; BaO2→BaO+O2 NaNO3→NaNO2+O2 ;
大学无机化学基础第15章-氧族元素PPT课件
的生 条成 件离 :域
1.这些原子都在同一平面上; 2.每一原子有一互相平行的p轨道;
3.p电子的数目小于p轨道的数目的两倍。
键
.
21
第三节 过氧化氢(Hydrogen Peroxide)
3-1 结构和制备
制备方法 结构
1、实验室制备:
BaO2+H2SO4=BaSO4↓+H2O2 BaO2+CO2+H2O=BaCO3↓+H2O2
现出它的强氧化性
4,6 4,6 4,6
熔点/K
54.6 386
490
1663 --
沸点/K
90
718
958
--
--
第一电离势/(kJ·mol-1) 1520
1006
941
869
818
第一亲合势/(kJ·mol-1) 141
200.4 194.9 190.14 130
第二亲合势/(kJ·mol-1) -780
或 4CrO5+12H+=4Cr3+ +7O2↑+6H2O
此反应用于铬酸根的检验,加合
物不稳定,常加入一些乙醚萃取,
水溶液中很快分解:
.
25
过氧链转移反应:
过氧链 -O-O- 取代了酸根中的双键 氧,此反应可用于鉴定过氧链的存在。
.
26
4. H2O2的不稳定性 过氧化氢受热、遇光(紫外光) 或重金属离子(Mn2+ 、Fe3+ 、Cr3+)都会分解:
:O2 +Pt+3F2 =O2+[PtF6]比较: Xe+PtF6=XePtF6
以臭氧分子或者是以氧 分子成键的化合物都具 有强氧化性
上大 无机化学A 第十一章氧族元素

O O
4、H2O2的检验
O
在酸性溶液中过氧化氢能使重铬酸盐生成二过氧 合铬的氧化物,即Cr(O2)2O或CrO5,生成的CrO5显蓝 色,在乙醚中比较稳定,检验时在乙醚层中显蓝色, 可以相互检验。 4H2O2+H2Cr2O7===2Cr(O2)2O+5H2O 2Cr(O2)2O+7H2O2+6H+===2Cr3++7O2↑+10H2O
氧族通性
氧族元素的氧化态
电子构型
O S Se Te Po [He]2s22p4 [Ne]3s23p4 [Ar]4s24p4 [Kr]5s25p4 [Xe]6s26p4
常见氧化态
-2,-1,0, -2,-1,0,+2,+4,+6 -2,0,+4,+6 -2,+2,0,+4,+6 +2,+6
第二节 氧、臭氧
升华硫
单质硫
弹性硫
斜方硫和单斜硫都易溶于CS2、苯和环已烷 中,都是由S8环状分子组成的。在这个环状分子 中,每个硫原子以sp3杂化轨道与另外两个硫原子 形成共价单键相联结。
S8环状结构
此外还有升华硫、弹性硫等。
硫化氢、硫化物及多硫化物
一、硫化氢 实验室制备 FeS+H2SO4(稀)===FeSO4+H2S↑ 2、结构 与H2O相似,但极性弱、无氢键。 3、弱酸性 硫化氢水溶液具有弱酸性: Ka1=9.1×10-8、Ka2=1.1×10-12。 4、一些重要反应 硫化氢的水溶液比气体硫化氢更具有还原性,氧化剂能把 它氧化成S或硫酸,但不能氧化成SO2。 H2S+I2===S+2H++2IH2S+4Br2+4H2O===H2SO4+8HBr 2MnO4- +5H2S+6HCl===2MnCl2+2Cl-+5S+8H2O
无机化学课件--氧族全解51页PPT

•
6、黄金时代是在我们的前面,而不在 我们的 后面。
•
7、心急吃不了热汤圆。
•
8、你可以很有个性,但某些时候请收 敛。
•
9、只为成功找方法,不为失败找借口 (蹩脚 的工人 总是说 工具不 好)。
•
10、只要下定决心克服恐惧,便几乎 能克服 任何恐 惧。因 为,请 记住, 除了在 脑海中 ,恐惧 无处藏 身。-- 戴尔. 卡耐基 。
▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
谢谢!
51
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O3结构:
•• Π 4 3
中心O:sp2杂化形成
未杂化的三个 p 轨道互相平 行,以“肩并肩”的方式相 互重叠,形成三中心四电子 大πΠ键 。
键角:117o
μ=1.8×10-30C•m
惟一极性单质
4 3
中
的
成键电子
不固定在
2
个原子之
间,是不
定或离域大π键。
臭氧分子中无单电子——反磁性物质。
7
大π键形成条件
2、 硫化氢和硫化物
硫化氢 结 性构质::HH2S2S是结无构色与,H有2O腐相蛋似味,剧毒气体。稍 溶于水,室温时饱和浓度为 0.1mol·L-1。水溶液 呈酸性,为二元弱酸。
最重要的性质是它的还原性:
0.3002V
A SO24- 0.1576V H2SO3
与空2气H 2(SO+2)3反O 2应:完全
过氧化物
含氧酸
+ H2O2(浓) →
含氧酸盐
过氧酸 过氧酸盐
(易水解为H2O2)
例如:H2SO4+H2O2(浓) → H2SO5+H2O
含氧酸去羟基,剩余部分为酰基。如,HO-SO2(含羟硫酰基)H-O-O-H中 H 被酰基取代得过氧酸,
取代一个氢称过一酸,取代两个氢称过二酸。 11
12.4 硫及其化合物
熔 沸 点:
单质Te
H2O H2S H2Se H2Te
小
大
大
小
弱
强
最高 小
大
3
氧族元素的标准电极电势图
氧气是一个较好的氧化剂。
4
12.2 氧和臭氧
1. 氧( O2)
氧是无色无味的气体,在90K时凝聚为淡蓝色 的液体,冷却到54K时凝结为蓝色的固体。氧在水 中的溶解度很小,在193K时,1L水中只能溶解 30mL的氧气。
0.4497V S 0.144V 0.3478V
2H2O + 2SO2
H2S
2H2S + O2 不完全 2H2O + S
14
•与中等强度氧化剂作用
H2S + 2Fe 3+ S + 2Fe2+ + 2H +
Fe2S3
FeS
H2S + X2 S + 2X - + 2H + (X = Cl, Br, I)
Se
Te
Po
准金属
放射性金属
共生于重金属硫化物中
4s24p4 5s25p4
6s26p4
2.55 2.10
2.0
氧化值 -2, (-1) ±2,4,6 ±2,4,6 2,4,6
晶体
分子 晶体
分子 晶体
红硒 (分子晶体)
灰硒 (链状晶体)
链状 晶体
2,6
金属 晶体
2
单质Se
H2R 化学活性: 稳 定 性: 酸 性:
SnS 棕,SnS2 黄,As2S3 黄,As2S5 黄, Sb2S3橙, Sb2S5橙, MnS 肉,ZnS 白, CdS 黄。 易水解:最易水解的化合物是
Cr2S3和Al2S3
2M3+ + 3S2- + 6H2O 2M(OH)3 + 3H2S (M = Al, Cr)
O3 + H2O + 2e- O2 + 2OH- B = 1.23V
O3 + 2I - + 2H + I2 + O2 + H 2O
8
12.3 过氧化氢(H2O2)94o结构: Nhomakorabea97pm
H
97 o
O 149pm O
97 o
H
性质: •弱酸性
H2O2
HO-2 + H+ K 1 = 2.0×10-12,K 2 10-25
5H 2O2
+
2MnO
4
+
6H +
2Mn
2+
+
5O 2
+ 8H 2O
碱性:HO
2
+
H2O
+
2e -
3OH - , B = 0.87V
3H 2O2
+
2Cr(OH)
4
+
2OH -
2CrO
24
+ 8H 2O
可见:H2O2氧化性强,还原性弱; 是不会造成二次污染的杀菌剂。 10
•过氧链转移反应
酸性氧化物
臭氧大部分集中在距地面15km~35km处, 即臭氧层,并在约25km处出现浓度的极大 值。平流层臭氧吸收了大部份太阳辐射,阻 挡有害的紫外辐射到达地面,使地球生物免 受紫外线的伤害,而透过的少量紫外辐射, 又可杀菌防病,保护了人类和地球生物。
放电的条件下,空气中的氧气可转化为臭氧:
3O2 噲垐无垐自声垐发放电垎垐 2 O3 6
分子轨道电子排布式:
(σ
1s
)2
(σ
* 1s
)
2
(σ
2s
)
2
(σ
*
2s
)
2
(σ
2
p
)
2
(π
2
p
)
4
(π
*
2
p
)
2
酸性:(氧化性强) O2 + 4H+ + 4e-
碱性:O2 + 2H2O + 4e-
O O •
•
••• •••
• •
顺磁性
2H2O = 1.23 V 4OH- = 0.401V
5
2. 臭氧(O3):O2的同素异形体 臭氧是一种淡蓝色的气体,有鱼腥味。
▲这些原子(3个或3个以上)在同一平面上。 ▲每一个原子有一个相互平行的 p 轨道。 ▲ p 电子数目必须小于 p 轨道数目的2倍。
O3性质:
•不稳定性 2O 3 3O 2 Δ r H m = -285 .4kJ • mol -1
•氧化性
O3 + 2H+ + 2e- O2 + H2O A = 2.03V
1、硫的同素异形体:
结构: S:sp3杂化 形成环状S8分子。
物理性质:
硫有几种同素异形体
斜方硫
密度/gcm-3 2.06
颜色
黄色
稳定性 < 94.5℃
单斜硫
1.99 浅黄色 > 94.5℃
弹性硫
190℃的熔融硫 用冷水速冷
S(斜方) 94.5oC S(单斜) 190C 弹性硫 12
斜
单
方
斜
硫
硫
弹性硫的形成 13
第 12 章 氧族元素
Chapter 12 Oxygen Group Elements
12.1 氧族元素通性 12.2 氧和臭氧 12.3 过氧化氢 12.4 硫及其化合物
12.1 氧族元素通性
氧族
(VIA) 元素
O
S
非金属
存在 单质或矿物
价层电 子构型
2s22p4
3s23p4
电负性 3.44 2.58
H2O2 + Ba(OH)2
BaO2 + 2H2O
•不稳定性
2H 2O 2
2H2O + O2 △ rHm = -196kJ mol-1 9
•氧化还原性
酸性:O2 0.695V H2O2 1.776V H2O
H2O2 + 2Fe 2+ + 2H + 2Fe 3+ + 2H 2O
4H 2O2 + PbS(s, 黑) PbSO 4 (s,白) + 4H 2O
•与强氧化剂反应 产物: S
SO24-
H2S + 4X2 (Cl2,Br2 ) + 4H2O H2SO4 + 8HX
5H2S
+
2MnO
4
+
6H+
2Mn2+
+
5S
+
8H2O
5H2S + 8Mn O-4 +14H+ 8Mn2+ + 5SO42- +12H2O
15
金属硫化物
颜 色:(大多数为黑色,少数需要特殊记忆)
