高考化学 镁及其化合物 培优练习(含答案)及答案解析
高考化学培优易错试卷(含解析)之镁及其化合物附详细答案

高考化学培优易错试卷(含解析)之镁及其化合物附详细答案一、镁及其化合物1.已知A为单质,B、C、D、E为化合物,它们之间存在如下转化关系:(1)若A为非金属单质,B为镁条在空气中燃烧的产物之一,其与水反应可生成气体C,D为无色气体,在空气中可变成红棕色,C与HCl气体反应生成E时产生大量白烟,则B 的化学式为,由C转化为D的化学方程式为,上述反应中属于氧化还原反应的有。
(2)若A为生活中常见的金属单质,B为A与盐酸反应的产物,C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,将C滴入沸水中可得E的胶体,则由B转化为C的离子方程式为,加热蒸干并灼烧C的溶液可得D的原因是。
【答案】(1)Mg3N24NH3+ 5O2 4NO +6H2O ①②③⑤(2)2Fe2++Cl2= 2Fe3++2Cl-FeCl3水解吸热,且水解产物HCl易挥发,从而彻底水解生成Fe(OH)3,灼烧时分解生成Fe2O3。
【解析】试题分析:(1)镁条在空气中燃烧的主要产物有氧化镁和氮化镁,因B可与水反应生成气体C,所以A为N2,B为Mg3N2,C为NH3,D在空气中由无色变红棕色,故D为NO,NH3与HCl气体反应生成NH4Cl时产生大量白烟,所以E为NH4Cl。
根据反应过程中是否存在元素化合价变化,可判断出氧化还原反应有①②③⑤。
(2)由C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,且B为A与盐酸反应的产物,可判断A为Fe,B为FeCl2,C为FeCl3,D为Fe2O3,E为Fe(OH)3。
考点:元素化合物2.X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物。
它们在一定条件下可以发生如图所示的转化关系(均不是在溶液中进行的反应)以下每空中填入一种即可)。
(1)当X、Y均为金属时,X的化学式为_____________,Z为____________(填名称)。
化学镁及其化合物的专项培优练习题(含答案)附答案

化学镁及其化合物的专项培优练习题(含答案)附答案一、镁及其化合物1.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。
若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:表1 生成氢氧化物沉淀的pH物质开始沉淀沉淀完全Fe(OH)3 2.7 3.7Fe(OH)27.69.6﹡Mn(OH)28.39.8Mg(OH)29.611.1﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去表2 原料价格表物质价格/(元·吨-1)漂液(含25.2%NaClO)450双氧水(含30%H2O2)2400烧碱(含98%NaOH)2100纯碱(含99.5%Na2CO3)600(1)在步骤②中加入的试剂X,最佳的选择是____________,其作用是_________________;(2)在步骤③中加入的试剂应是_______________________;之所以要控制pH=9.8,其目的是___________________________________________________________。
(3)在步骤④中加入的试剂Z应是________________;(4)在步骤⑤中发生反应的化学方程式是_____________________________________________。
【答案】漂液(或NaClO) 将Fe2+氧化为Fe3+烧碱(或NaOH) 使Fe3+、Mn2+沉淀完全,又尽量减少Mg2+的损失纯碱(或Na2CO3) MgCO3+H2O Mg(OH)2↓+CO2↑【解析】【分析】为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO。
培优镁及其化合物辅导专题训练及答案解析

培优镁及其化合物辅导专题训练及答案解析一、镁及其化合物1.已知A为单质,B、C、D、E为化合物,它们之间存在如下转化关系:(1)若A为非金属单质,B为镁条在空气中燃烧的产物之一,其与水反应可生成气体C,D为无色气体,在空气中可变成红棕色,C与HCl气体反应生成E时产生大量白烟,则B 的化学式为,由C转化为D的化学方程式为,上述反应中属于氧化还原反应的有。
(2)若A为生活中常见的金属单质,B为A与盐酸反应的产物,C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,将C滴入沸水中可得E的胶体,则由B转化为C的离子方程式为,加热蒸干并灼烧C的溶液可得D的原因是。
【答案】(1)Mg3N24NH3+ 5O2 4NO +6H2O ①②③⑤(2)2Fe2++Cl2= 2Fe3++2Cl-FeCl3水解吸热,且水解产物HCl易挥发,从而彻底水解生成Fe(OH)3,灼烧时分解生成Fe2O3。
【解析】试题分析:(1)镁条在空气中燃烧的主要产物有氧化镁和氮化镁,因B可与水反应生成气体C,所以A为N2,B为Mg3N2,C为NH3,D在空气中由无色变红棕色,故D为NO,NH3与HCl气体反应生成NH4Cl时产生大量白烟,所以E为NH4Cl。
根据反应过程中是否存在元素化合价变化,可判断出氧化还原反应有①②③⑤。
(2)由C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,且B为A与盐酸反应的产物,可判断A为Fe,B为FeCl2,C为FeCl3,D为Fe2O3,E为Fe(OH)3。
考点:元素化合物2.A、B、C、D 均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):(1)若 A 是一种金属,C 是淡黄色固体,C 的阴阳离子个数比为_______;(2)若 A 为淡黄色固体单质,写出 D 的浓溶液与铜反应的化学方程式_______;(3)若 A 是化合物,C 是红棕色气体,则 A 的化学式为_____;C 转化为 D 的过程中,氧化剂与还原剂的质量比为_____。
高考化学 镁及其化合物 培优练习(含答案)

高考化学镁及其化合物培优练习(含答案)一、镁及其化合物1.以硼镁泥(主要成分为MgSiO3、Fe2O3及少量A l2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:己知:①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:pH值Mg(OH)2Mn(OH)2MnO(OH)2Fe(OH)2Al(OH)3Fe(OH)3开始沉淀时9.37.17.87.6 3.7 2.3沉淀完全时10.810.89.89.6 4.7 3.7②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为__________。
a.将硼镁泥制成浆料b.降低浸取温度c.用盐酸多次浸取(2)“浸取”时,MgSi O3与盐酸反应的化学方程式为_________________________。
(3)“除铁、铝”时,需调节溶液pH范围为_________________________。
(4)“除Mn2+”时发生反应的离子方程式为_________________________;过滤3所得滤渣中含有MnO(OH)2和__________。
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是________________。
【答案】ac MgSi O3+2HCl+(n-l)H2O=MgCl2+Si O2·n H2O4.7<pH<7.1Mn2++H2O2+2O H-=MnO(OH)2↓+H2O Mg(OH)2氨水挥发加剧,导致溶液中氨水浓度降低。
【解析】(1)此处主要考查反应速率的影响因素,所以要想加快酸溶解速率可以从外因浓度、温度、接触面积等考虑,可以采取升温、把硼镁泥粉碎、搅拌等措施,答案选ac。
(2)根据滤渣1可知:MgSiO3与盐酸反应生成SiO2·nH2O,还有产物MgCl2、H2O方程式为MgSiO3+2HCl+(n-l)H2O=MgCl2+SiO2·nH2O(3)加入双氧水后,Fe2+转化为Fe3+,要使Fe3+、Al3+完全沉淀,pH必须大于或等于4.7,Mn2+不沉淀,pH小于或等于7.1,所以答案为4.7<pH<7.1(4)Mn2+在碱性下被H2O2氧化生成MnO(OH)2,H2O2被还原为H2O,离子方程式为Mn2++H2O2+2OH-=MnO(OH)2↓+H2O 。
备战高考化学 镁及其化合物 培优练习(含答案)附答案

备战高考化学镁及其化合物培优练习(含答案)附答案一、镁及其化合物1.A、B、C、D 均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):(1)若 A 是一种金属,C 是淡黄色固体,C 的阴阳离子个数比为_______;(2)若 A 为淡黄色固体单质,写出 D 的浓溶液与铜反应的化学方程式_______;(3)若 A 是化合物,C 是红棕色气体,则 A 的化学式为_____;C 转化为 D 的过程中,氧化剂与还原剂的质量比为_____。
(4)若 A 为黑色固体单质,C 是空气中的主要温室气体。
C 还可以转化为 A,写出该反应的化学方程式______。
【答案】1:2 2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O NH3 1:2 CO2+2Mg2MgO+C 【解析】【分析】(1)若A为活泼金属元素的单质,C是淡黄色固体,应为Na2O2,再结合物质构成作答;(2)常温下A为淡黄色固体单质,即说明A是S,则B是SO2,C是SO3,D是硫酸;(3)若C是红棕色气体,应为NO2,则D为HNO3,B为NO,A为NH3;(4)若A为黑色固体单质,C是空气中的主要温室气体,则为CO2,C 还可以转化为 A,则推知A为C,B为CO,D为H2CO3,据此分析作答。
【详解】根据上述分析可知,(1)C为Na2O2,因1 mol Na2O2中含2 mol Na+和1 mol 过氧根离子,则其阴阳离子个数比为1:2,故答案为1:2;(2)D是硫酸,D的浓溶液与铜反应的化学方程式为:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O,故答案为2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O;(3)C为NO2,D为HNO3,C转化为D的方程式为3NO2+H2O=2HNO3+NO,由方程式可知氧化剂与还原剂均为NO2,其质量比等于对应的NO2物质的量之比,为1:2,故答案为NH3;1:2;(4)A为C,C为CO2,C 可以与镁粉反应转化为 A,其化学方程式为:CO2+2Mg2MgO+C,故答案为CO2+2Mg2MgO+C。
高考化学 镁及其化合物 培优 易错 难题练习(含答案)附答案

高考化学镁及其化合物培优易错难题练习(含答案)附答案一、镁及其化合物1.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。
若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:表1 生成氢氧化物沉淀的pH物质开始沉淀沉淀完全Fe(OH)3 2.7 3.7Fe(OH)27.69.6﹡Mn(OH)28.39.8Mg(OH)29.611.1﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去表2 原料价格表物质价格/(元·吨-1)漂液(含25.2%NaClO)450双氧水(含30%H2O2)2400烧碱(含98%NaOH)2100纯碱(含99.5%Na2CO3)600(1)在步骤②中加入的试剂X,最佳的选择是____________,其作用是_________________;(2)在步骤③中加入的试剂应是_______________________;之所以要控制pH=9.8,其目的是___________________________________________________________。
(3)在步骤④中加入的试剂Z应是________________;(4)在步骤⑤中发生反应的化学方程式是_____________________________________________。
【答案】漂液(或NaClO) 将Fe2+氧化为Fe3+烧碱(或NaOH) 使Fe3+、Mn2+沉淀完全,又尽量减少Mg2+的损失纯碱(或Na2CO3) MgCO3+H2O Mg(OH)2↓+CO2↑【解析】【分析】为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO。
高考化学镁及其化合物(大题培优)附答案

高考化学镁及其化合物(大题培优)附答案一、镁及其化合物1.某同学用含结晶水的正盐X(四种短周期元素组成的纯净物)进行了如下实验:实验中观测到:混合气甲呈无色并被蒸馏水全部吸收;固体乙为纯净物;在步骤③中,取1/10溶液丙,恰好中和需消耗0.00200molNaOH;另取一定量的溶液丙,加入少量K2FeO4固体,产生黄绿色气体。
请回答:(1)X的化学式是__________,步骤①的化学方程式是______________________________。
(2)溶液丙与K2FeO4固体反应的化学方程式是_____________________________________。
【答案】MgCl2·6H2O MgCl2·6H2O MgO+2HC1↑+5H2O↑2K2FeO4+16HC1=4KCl+ 2FeCl3+ 3Cl2↑+8H2O【解析】【分析】据题意知,含结晶水的正盐X共含有四种短周期元素,经灼烧所得的混合气体中含有水蒸气,混合气甲经步骤②、③、④得白色沉淀,可判断混合气甲中有氯元素,由混合气甲呈无色并被蒸馏水全部吸收,且溶液丙可以被NaOH溶液中和、与少量K2FeO4反应能生成黄绿色气体,可得混合气体甲中含有HCl气体。
结合正盐X灼烧得到混合气体甲和固体乙可推知X含有H、O、Cl和一种金属元素。
依题意经计算可知混合气体甲中:n(HCl)=0.02mol,n(H2O)=mol=0.05mol。
又因盐X为正盐,并且所含元素均为短周期元素,可知其阴离子为氯离子,阳离子可能为Na+、Mg2+或Al3+。
若是钠离子,则X灼烧时无法产生HCl气体,不符合题意,而氯化镁晶体和氯化铝晶体灼烧后得到的分别是氧化酶和氧化铝,根据固体乙的质量计算可知阳离子为Mg2+,固体乙为MgO,n(MgO)-0.01mol,故X为MgCl2·6H2O,据此解答。
【详解】据题意知,含结晶水的正盐X共含有四种短周期元素,经灼烧所得的混合气体中含有水蒸气,混合气甲经步骤②、③、④得白色沉淀,可判断混合气甲中有氯元素,由混合气甲呈无色并被蒸馏水全部吸收,且溶液丙可以被NaOH溶液中和、与少量K2FeO4反应能生成黄绿色气体,可得混合气体甲中含有HCl气体。
高考化学培优(含解析)之镁及其化合物附详细答案

高考化学培优(含解析)之镁及其化合物附详细答案一、镁及其化合物1.有关物质的转化关系如下图所示(部分物质和条件已略去)。
A是金属单质,D是非金属单质,B、F是气体且B无色无味,G是最常见的无色液体。
请回答下列问题:(1)C的化学式为:______________。
(2)B的电子式为:______________。
(3)写出③的离子方程式:__________________。
(4)写出②的化学方程式,并用“单线桥”标出电子转移的方向和数目________________。
【答案】MgO H2O+3NO2=== 2H++2NO3-+NO【解析】A是金属单质在无色气体B中燃烧生成非金属单质D,则A是Mg、B是CO2、C是MgO、D是C;碳可以和浓硫酸、浓硝酸在加热条件下反应生成CO2,结合F与水化合能生成E,可知E为浓硝酸,F为NO2;(1)C的化学式为MgO;(2)CO2是共价化合物,其的子式为;(3)NO2溶解于水生成硝酸和NO的离子方程式为H2O+3NO2=== 2H++2NO3-+NO;(4)碳与浓硝酸反应生成CO2的反应是氧化还原反应,其反应化学方程式及电子转移的方向和数目为。
点睛:此类题的解答一般有以下步骤:思维起点的选择:思维起点是指开始时的思维指向、思维对象或思维角度,推断题中的思维起点应是最具特征的某个条件(包括文字叙述或某个变化过程);思维过程的展开:解题者在确定思维起点的基础上,利用题目所给信息,结合已有的化学知识和解题经验,不断地缩小问题状态与目标状态的距离;思维过程的检验:将上述思维过程的结果代入题中,检查一下是否符合题中条件;金属在无色气体中燃烧生成非金属单质这一特殊反应现象,及时与Mg在二氧化碳中燃烧建立联系,展开思维的空间,寻找目标答案。
2.X、Y、Z、W 是常见的几种元素,其相关信息如表:元素相关信息X原子核外有 3 个电子层,最外层比次外层少 1 个电子Y食盐中添加少量 Y 的一种化合物预防 Y 元素缺乏Z Z 与钾的一种合金可用于快中子反应堆作热交换剂W W 的一种核素质量数为 24,中子数为 12(1)元素 X 在海水中含量非常高,海水中含 X 元素的主要化合物是_____。
高考化学镁及其化合物(大题培优)及答案(1)

高考化学镁及其化合物 ( 大题培优 ) 及答案 (1)一、镁及其化合物1.A 、 B 、 C 、 D 、 E 、 X 都是短周期元素构成的常有无机物依据上框图关系 ,达成以下问题 :(1) A 可作漂白剂, X 是含有某种阳离子(此阳离子拥有净水作用)的溶液,且 M(A)=M(D) ,则 A 与 H 2O 反响的化学方程式为 ___________, C 转变成 D 的离子方程式为___________(2) A 的某种合金可作原子反响堆的导热剂,X 是非极性分子的化合物,则A 与 H 2O 反响的离子方程式为 ________________ ,C 转变成 D 的化学方程式为 ______________ (3) A 是单质, X 是 Na 2CO 3 溶液, E 可用消毒剂,则 A 与 H 2O 反响的离子方程式为 _______________,(4) A 是单质, X 是单质(它的同素异形体是原子晶体),则E 与 SiO 2 反响的化学方程式为________________( 5) A 是化合物, X 是 O 2, C 转变成 D 还需要催化剂, E 拥有两性,则 A 与 H 2 O 反响的化学方程式为 _____________( 6) A 是化合物( Mr(A)=100 ), X 是 O 2,B 转变成 C 还需要催化剂, E 是中强碱,则 A 与 H 2O 反响的化学方程式为 ___________【答案】 2Na 22222 -3+ 2 3 2O + 2H O =4NaOH + O ↑3AlO + Al + 6H O = 4Al(OH) ↓ 2Na + 2H O =+-22322322+-22Na + 2OH +H ↑Na CO + CO + H O = 2NaHCOCl + H O =H +Cl + HCl SiO +4HF=SiF ↑ + 2H OAl S + 6H O = 2Al(OH) + 3H S ↑ Mg N + 6H O = 3Mg(OH)2+2NH ↑22 32323223【分析】 【剖析】A 和水反响生成两种物质,B 和 X 反响生成C , C 再与 X 反响生成D ,可推测可能是连续两次氧化,或许与量有关的反响。
高考化学镁及其化合物(大题培优)及详细答案

(2)另取mg试样A,加入2mol·L-1的NaOH溶液,当加到100mL时,气体不再生成,该过程中只有铝和氢氧化钠溶液反应,则②中发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
③往溶液B中加入2mol/L NaOH,至沉淀不再发生变化。
根据以上过程回答下列问题:
(1)溶液B中是否含有H+_____________(填“是”或“否”);
(2)写出②中发生反应的离子方程式____________________________________;
(3)下列能表示过程③产生的沉淀质量W与加入NaOH溶液体积V的关系是_____;
【答案】2.80.25mol· L-10.15 mol2:1
【解析】试题分析:本题考查混合物的计算,涉及Mg、Fe与酸的反应,Cl2与H2、NaOH的反应。
(1)根据反应的化学方程式:Mg+2HCl=MgCl2+H2↑、Fe+2HCl=FeCl2+H2↑可列式:n(Mg)+n(Fe)= ,24g/moln(Mg)+56g/moln(Fe)=4.0g,解得n(Mg)=0.05mol,n(Fe)=0.05mol;则铁的质量m(Fe)=0.05mol 56g/mol=2.8g;根据Mg守恒,n(Mg2+)=n(Mg)=0.05mol,c(Mg2+)= =0.25mol/L。
5.(1)有镁和铁的混合物共4.0克,与200毫升盐酸恰好完全反应,在标准状况下共收集到2.24L气体。假设反应后溶液体积不变,则铁的质量为_____g;反应后溶液中Mg2+的物质的量浓度为_______。
高考化学培优专题复习镁及其化合物练习题及答案解析

高考化学培优专题复习镁及其化合物练习题及答案解析一、镁及其化合物1.下图中A-J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。
请填写以下空白:(1)A的化学式_____________B的电子式_______________。
(2)写出下列反应的化学方程式:D+G→ H_____________________________。
B+镁→ E + F______________________________。
(3)写出A + NaOH →D的离子方程式_________________________________。
【答案】(1) NH4HCO3(2) 4NH3+5O24NO + 6H2O CO2+ 2Mg ="==" 2MgO+C(3) NH4++ HCO3-+2OH-= NH3+CO32-+2H2O【解析】【分析】已知A与碱反应生成气体化合物,则A含有铵根离子;A加热分解生成等物质的量的2种气体和1种液体,液体与过氧化钠反应则为水,可确定A为碳酸氢铵,D为氨气,C为水,B为二氧化碳;二氧化碳与镁反应生成氧化镁和碳;【详解】(1)分析可知,A为碳酸氢铵,化学式为:NH4HCO3;B为二氧化碳,其电子式为:;(2)D与G分别为氨气、氧气,在一定条件下反应生成一氧化氮和水,方程式为:4NH3+5O24NO+6H2O;镁与二氧化碳反应生成氧化镁和碳,方程式为:CO2+2Mg 点燃2MgO+C;(3)碳酸氢钠与NaOH反应生成氨气、水和碳酸钠,其反应的离子方程式为:NH4+ + HCO3-+2OH-= NH3 +CO32-+2H2O;2.短周期元素形成的物质A、B、C、D、E,它们的转化关系如下图所示,物质A与物质B 之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
请回答下列问题:(1)若C是离子化合物,D是一种强碱,写出C的电子式:_____________(2)若E是有臭鸡蛋气味,D是既能溶于强酸,又能溶于强碱的化合物。
高考化学培优 易错 难题(含解析)之镁及其化合物及详细答案

高考化学培优易错难题(含解析)之镁及其化合物及详细答案一、镁及其化合物1.下图中A-J分别代表相关反应的一种物质。
已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
请填写以下空白:(1)A的化学式为______________,B的电子式为_________________。
(2)写出下列反应②的化学方程式:___________________。
(3)写出反应③的离子方程式:_________________。
(4)写出J与F反应的化学方程式:______________。
(5)在反应④中,当生成标准状况下2.24L G时,转移电子的物质的量为_______mol。
【答案】 NH4HCO3 4NH3+5O24NO+6H2O NH4++HCO3-+2OH-NH3↑+CO32-+2H2O C+HNO3(浓) CO2↑+4NO2↑+2H2O 0.2【解析】A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,C能和过氧化钠反应,则C为水或二氧化碳,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,C为水,水和过氧化钠反应生成NaOH和O2,D能在催化剂条件下反应生成H,则D是NH3,G是O2,H是NO,I是NO2,J是HNO3,镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3,(1)根据上面的分析可知,A为NH4HCO3,B为CO2,其电子式为;(2)反应②为在催化剂、加热条件下,氨气被氧化生成一氧化氮和水,反应方程式为:4NH3+5O24NO+6H2O;(3)在加热条件下,碳酸氢铵和氢氧化钠反应的离子方程式为:NH4++HCO3-+2OH-NH3↑+CO32-+2H2O;(4)在加热条件下,碳和浓硝酸发生氧化还原反应生成二氧化碳、二氧化氮和水,反应方程式为:C+4HNO3(浓)CO2↑+4NO2↑+2H2O;(5)水和过氧化钠反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,当生成标况下2.24L 氧气时转移电子的物质的量=2.2422.4/molLL=0.2mol。
高考化学培优(含解析)之镁及其化合物及详细答案

高考化学培优(含解析)之镁及其化合物及详细答案一、镁及其化合物1.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。
从硼镁泥中提取MgSO4·7H2O的流程如下:根据题意回答下列问题:(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________。
(5)已知MgSO4、CaSO4的溶解度如下表:温度(℃)40506070MgSO430.933.435.636.9CaSO40.2100.2070.2010.193“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________、_________。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________。
【答案】烧杯、100mL的容量瓶、胶头滴管 SiO2 Mn2++ ClO-+ H2O → MnO2↓ + 2H++ Cl-2Fe2++ ClO-+ 2H+→ 2Fe3++ Cl-+ H2O 取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。
蒸发浓缩趁热过滤80%【解析】【详解】(1)配制溶液时还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管,(2)由于pH=5-6溶液呈酸性,所以滤渣中还有二氧化硅。
高考化学镁及其化合物(大题培优)及答案解析
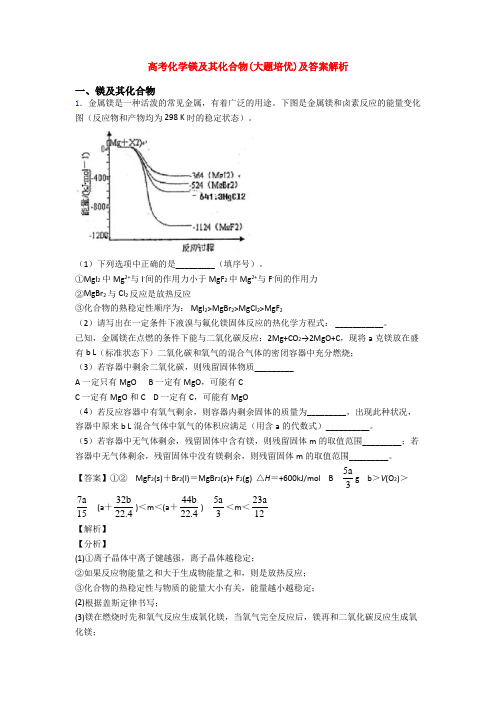
高考化学镁及其化合物(大题培优)及答案解析一、镁及其化合物1.金属镁是一种活泼的常见金属,有着广泛的用途。
下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态)。
(1)下列选项中正确的是_________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力②MgBr2与Cl2反应是放热反应③化合物的熟稳定性顺序为: MgI2>MgBr2>MgCl2>MgF2(2)请写出在一定条件下液溴与氟化镁固体反应的热化学方程式: ___________。
已知,金属镁在点燃的条件下能与二氧化碳反应:2Mg+CO2→2MgO+C,现将a克镁放在盛有b L(标准状态下)二氧化碳和氧气的混合气体的密闭容器中充分燃烧;(3)若容器中剩余二氧化碳,则残留固体物质_________A 一定只有MgOB 一定有MgO,可能有CC 一定有MgO和CD 一定有C,可能有MgO(4)若反应容器中有氧气剩余,则容器内剩余固体的质量为_________,出现此种状况,容器中原来b L混合气体中氧气的体积应满足(用含a的代数式)__________。
(5)若容器中无气体剩余,残留固体中含有镁,则残留固体m的取值范围_________;若容器中无气体剩余,残留固体中没有镁剩余,则残留固体m的取值范围_________。
【答案】①② MgF2(s)+Br2(l)=MgBr2(s)+ F2(g) △H=+600kJ/mol B 5a3g b>V(O2)>7a 15 (a+32b22.4)<m<(a+44b22.4)5a3<m<23a12【解析】【分析】(1)①离子晶体中离子键越强,离子晶体越稳定;②如果反应物能量之和大于生成物能量之和,则是放热反应;③化合物的热稳定性与物质的能量大小有关,能量越小越稳定;(2)根据盖斯定律书写;(3)镁在燃烧时先和氧气反应生成氧化镁,当氧气完全反应后,镁再和二氧化碳反应生成氧化镁;(4)若氧气有剩余,则镁只和氧气反应生成氧化镁,根据原子守恒计算;采用极限的方法计算;(5)若容器中无气体剩余,残留固体中含有镁,假设气体全部为氧气或二氧化碳,然后采用极限的方法解答;若容器中无气体剩余,残留固体中没有镁剩余,说明二者完全反应。
高考化学二轮 镁及其化合物 专项培优附答案

高考化学二轮镁及其化合物专项培优附答案一、镁及其化合物1.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。
从硼镁泥中提取MgSO4·7H2O的流程如下:根据题意回答下列问题:(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________。
(5)已知MgSO4、CaSO4的溶解度如下表:温度(℃)40506070MgSO430.933.435.636.9CaSO40.2100.2070.2010.193“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________、_________。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________。
【答案】烧杯、100mL的容量瓶、胶头滴管 SiO2 Mn2++ ClO-+ H2O → MnO2↓ + 2H++ Cl-2Fe2++ ClO-+ 2H+→ 2Fe3++ Cl-+ H2O 取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。
蒸发浓缩趁热过滤80%【解析】【详解】(1)配制溶液时还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管,(2)由于pH=5-6溶液呈酸性,所以滤渣中还有二氧化硅。
高考化学 镁及其化合物 培优练习(含答案)附答案解析

高考化学镁及其化合物培优练习(含答案)附答案解析一、镁及其化合物1.镁铝合金在交通、航空、电子等行业有着广泛的应用。
某化学兴趣小组试对镁铝合金废料进行回收利用,实验中可将铝转化为硫酸铝晶体,并对硫酸铝晶体进行热重分析。
镁铝合金废料转化为硫酸铝晶体实验流程如下:试回答下列问题:(1)在镁铝合金中加入NaOH溶液,写出反应的化学反应方程式,固体B的化学式。
(2)操作Ⅱ包含的实验步骤有:蒸发浓缩、、、洗涤、干燥。
(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是。
(4)若初始时称取的镁铝合金废料的质量为9.00 g,得到固体A的质量为4.95 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%,合金废料中不含溶于碱的杂质)。
计算得硫酸铝晶体的化学式为。
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见下图,已知:。
根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式,第三阶段反应化学方程式。
【答案】(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2)Al(OH)3(3)冷却结晶(4)过滤减少晶体的溶解(5)洗去晶体表面杂质(6)有利于晶体的干燥(7)Al2(SO4)3·18H2O(8)Al2(SO4)3·3H2O (9)Al2(SO4)3Al2O3+3SO3↑【解析】【分析】向镁铝合金中加入足量氢氧化钠溶液,发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,镁不反应,固体A为Mg,采用过滤的方法进行分离,向滤液中通入二氧化碳,发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,再通过过量进行分离,固体B为氢氧化铝,氢氧化铝与硫酸反应得到硫酸铝溶液,再经过蒸发浓缩、冷却结晶、洗涤、干燥得到硫酸铝晶体(1)Al和氢氧化钠溶液生成可溶性的偏铝酸钠,镁不反应;(2)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作;(3)用乙醇洗涤,可以减少晶体的溶解,有利于晶体的干燥;(4)Al的质量为9g-4.95g=4.05g,设硫酸铝晶体化学式为:Al2(SO4)3·nH2O,根据Al元素守恒计算硫酸铝晶体的物质的量,再计算硫酸铝晶体的相对分子质量,进而计算n的值,确定化学式;(5)根据(4)中计算可知,晶体中结晶水的质量分数,低温加热,首先失去结晶水,高温下,最终硫酸铝分解,根据失重%计算判断各阶段分解产物,再书写化学方程式;【详解】(1)在镁铝合金中加入NaOH溶液,Al可以与强碱溶液发生反应,而Mg不能反应,该反应的化学反应方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑;所以固体A是Mg;向滤液中通入过量的CO2气体,由于酸性H2CO3>Al(OH)3,会发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;所以固体B是Al(OH)3;(2)用硫酸溶解该固体,发生反应:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;得到的溶液C是Al2(SO4)3溶液;由于其溶解度随温度的升高而增大,所以从溶液中获得晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,来洗去表面的杂质离子,选用无水乙醇的原因是减少晶体的溶解;洗去晶体表面杂质;有利于晶体的干燥;(4)若初始时称取的镁铝合金废料的质量为9.00 g,得到固体A的质量为4.95 g,金属发生反应,而镁不反应,减少的质量为金属铝的质量,则m(Al)= 9.00g—4.95 g=4.05g,n(Al)=4.05 27/gg mol=0.15mol,硫酸铝晶体的质量为49.95 g,硫酸铝晶体中含有SO42-的物质的量为n(SO42-)=32n(Al3+)=32×0.15mol=0.225mol, Al2(SO4)3的质量是m(Al2(SO4)3)= (0.15mol2)×342g/mol=25.65g,则含有的结晶水的物质的量是n(H2O)=49.95g25.65g18g/mol)(=1.35mol,则n(Al2(SO4)3):n(H2O)= (0.15mol2):1.35mol=1: 18,所以该结晶水合物的化学式是:Al2(SO4)3·18H2O。
备战高考化学 镁及其化合物 培优练习(含答案)含答案

备战高考化学镁及其化合物培优练习(含答案)含答案一、镁及其化合物1.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。
若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:表1 生成氢氧化物沉淀的pH物质开始沉淀沉淀完全Fe(OH)3 2.7 3.7Fe(OH)27.69.6﹡Mn(OH)28.39.8Mg(OH)29.611.1﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去表2 原料价格表物质价格/(元·吨-1)漂液(含25.2%NaClO)450双氧水(含30%H2O2)2400烧碱(含98%NaOH)2100纯碱(含99.5%Na2CO3)600(1)在步骤②中加入的试剂X,最佳的选择是____________,其作用是_________________;(2)在步骤③中加入的试剂应是_______________________;之所以要控制pH=9.8,其目的是___________________________________________________________。
(3)在步骤④中加入的试剂Z应是________________;(4)在步骤⑤中发生反应的化学方程式是_____________________________________________。
【答案】漂液(或NaClO) 将Fe2+氧化为Fe3+烧碱(或NaOH) 使Fe3+、Mn2+沉淀完全,又尽量减少Mg2+的损失纯碱(或Na2CO3) MgCO3+H2O Mg(OH)2↓+CO2↑【解析】【分析】为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO。
【化学】培优镁及其化合物辅导专题训练附答案解析

【化学】培优镁及其化合物辅导专题训练附答案解析一、镁及其化合物1.A、B、C、D 均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):(1)若 A 是一种金属,C 是淡黄色固体,C 的阴阳离子个数比为_______;(2)若 A 为淡黄色固体单质,写出 D 的浓溶液与铜反应的化学方程式_______;(3)若 A 是化合物,C 是红棕色气体,则 A 的化学式为_____;C 转化为 D 的过程中,氧化剂与还原剂的质量比为_____。
(4)若 A 为黑色固体单质,C 是空气中的主要温室气体。
C 还可以转化为 A,写出该反应的化学方程式______。
【答案】1:2 2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O NH3 1:2 CO2+2Mg2MgO+C 【解析】【分析】(1)若A为活泼金属元素的单质,C是淡黄色固体,应为Na2O2,再结合物质构成作答;(2)常温下A为淡黄色固体单质,即说明A是S,则B是SO2,C是SO3,D是硫酸;(3)若C是红棕色气体,应为NO2,则D为HNO3,B为NO,A为NH3;(4)若A为黑色固体单质,C是空气中的主要温室气体,则为CO2,C 还可以转化为 A,则推知A为C,B为CO,D为H2CO3,据此分析作答。
【详解】根据上述分析可知,(1)C为Na2O2,因1 mol Na2O2中含2 mol Na+和1 mol 过氧根离子,则其阴阳离子个数比为1:2,故答案为1:2;(2)D是硫酸,D的浓溶液与铜反应的化学方程式为:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O,故答案为2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O;(3)C为NO2,D为HNO3,C转化为D的方程式为3NO2+H2O=2HNO3+NO,由方程式可知氧化剂与还原剂均为NO2,其质量比等于对应的NO2物质的量之比,为1:2,故答案为NH3;1:2;(4)A为C,C为CO2,C 可以与镁粉反应转化为 A,其化学方程式为:CO2+2Mg2MgO+C,故答案为CO2+2Mg2MgO+C。
培优镁及其化合物辅导专题训练及详细答案

培优镁及其化合物辅导专题训练及详细答案一、镁及其化合物1.以硼镁泥(主要成分为MgSiO3、Fe2O3及少量A l2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:己知:①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:pH值Mg(OH)2Mn(OH)2MnO(OH)2Fe(OH)2Al(OH)3Fe(OH)3开始沉淀时9.37.17.87.6 3.7 2.3沉淀完全时10.810.89.89.6 4.7 3.7②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为__________。
a.将硼镁泥制成浆料b.降低浸取温度c.用盐酸多次浸取(2)“浸取”时,MgSi O3与盐酸反应的化学方程式为_________________________。
(3)“除铁、铝”时,需调节溶液pH范围为_________________________。
(4)“除Mn2+”时发生反应的离子方程式为_________________________;过滤3所得滤渣中含有MnO(OH)2和__________。
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是________________。
【答案】ac MgSi O3+2HCl+(n-l)H2O=MgCl2+Si O2·n H2O4.7<pH<7.1Mn2++H2O2+2O H-=MnO(OH)2↓+H2O Mg(OH)2氨水挥发加剧,导致溶液中氨水浓度降低。
【解析】(1)此处主要考查反应速率的影响因素,所以要想加快酸溶解速率可以从外因浓度、温度、接触面积等考虑,可以采取升温、把硼镁泥粉碎、搅拌等措施,答案选ac。
(2)根据滤渣1可知:MgSiO3与盐酸反应生成SiO2·nH2O,还有产物MgCl2、H2O方程式为MgSiO3+2HCl+(n-l)H2O=MgCl2+SiO2·nH2O(3)加入双氧水后,Fe2+转化为Fe3+,要使Fe3+、Al3+完全沉淀,pH必须大于或等于4.7,Mn2+不沉淀,pH小于或等于7.1,所以答案为4.7<pH<7.1(4)Mn2+在碱性下被H2O2氧化生成MnO(OH)2,H2O2被还原为H2O,离子方程式为Mn2++H2O2+2OH-=MnO(OH)2↓+H2O 。
2020-2021高考化学 镁及其化合物 培优练习(含答案)附答案解析

2020-2021高考化学镁及其化合物培优练习(含答案)附答案解析一、镁及其化合物1.短周期元素形成的物质A、B、C、D、E,它们的转化关系如下图所示,物质A与物质B 之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
请回答下列问题:(1)若C是离子化合物,D是一种强碱,写出C的电子式:_____________(2)若E是有臭鸡蛋气味,D是既能溶于强酸,又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因: ____________________②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系:_______________________________(3)若C是一种气体,D是一种强酸,且E与A相同,则C与水反应的化学方程式为(请标出电子转移方向和数目): __________________________________________(4)若A是一种单质,该元素的原子最外层电子数等于最内层,气体E能使湿润的红色石蕊试纸变蓝,那么化合物D是_____________。
【答案】 H++H2O+AlO2- Al(OH)3Al3++3OH-c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) Mg(OH)2【解析】【分析】(1)若C是离子化合物,D是一种强碱,可能为NaOH,则C可为Na2O2(或NaH),生成气体为O2或H2;(2)D是既能溶于强酸、又有溶于强碱的化合物,应为Al(OH)3,E的水溶液呈现弱酸性,E 可能与A、B两种物质中的某种相同,结合转化关系分析可知C应为H2S;(3)若C是一种气体,D是一种强酸,C应为NO2,则D为HNO3,E为NO,结合物质的性质解答该题;(4)若A是一种单质,该元素的原子最外层电子数等于最内层,气体E能使湿润的红色石蕊试纸变蓝,则气体E为NH3,A为Mg,B为氮气,生成的C为Mg2N3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
③能量越小的物质越稳定,所以化合物的热稳定性顺序为 MgI2<MgBr2<MgCl2<MgF2,故 错误;
故选①②;
(2)镁和氟气反应的热化学反应方程式为:Mg(s)+F2(g)=MgF2(s) △H=−1124kJ/mol① Mg(s)+Br2(l)=MgBr2(s) △H=−524kJ/mol② 将方程式②−①得 MgF2(s)+Br2(l)=MgBr2(s)+ F2(g) △H=(−524kJ/mol)−( −1124kJ/mol)= +600kJ/mol,故答案为:MgF2(s)+Br2(l)=MgBr2(s)+ F2(g) △H=+600kJ/mol; (3)镁先和氧气反应生成氧化镁,当氧气完全反应后,镁再和二氧化碳反应生成氧化镁,若
已知:
。
根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式 ,第三阶段反 应化学方程式 。
【答案】(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2)Al(OH)3(3)冷却结晶 (4)过滤减少 晶体的溶解(5)洗去晶体表面杂质(6)有利于晶体的干燥(7)Al2(SO4)3·18H2O(8)
(1)下列选项中正确的是_________(填序号)。
①MgI2 中 Mg2+与 I-间的作用力小于 MgF2 中 Mg2+与 F-间的作用力
②MgBr2 与 Cl2 反应是放热反应 ③化合物的熟稳定性顺序为: MgI2>MgBr2>MgCl2>MgF2 (2)请写出在一定条件下液溴与氟化镁固体反应的热化学方程式: ___________。
已知,金属镁在点燃的条件下能与二氧化碳反应:2Mg+CO2→2MgO+C,现将 a 克镁放在盛 有 b L(标准状态下)二氧化碳和氧气的混合气体的密闭容器中充分燃烧;
(3)若容器中剩余二氧化碳,则残留固体物质_________
A 一定只有 MgO B 一定有 MgO,可能有 C
C 一定有 MgO 和 C D 一定有 C,可能有 MgO
高考化学 镁及其化合物 培优练习(含答案)及答案解析
一、镁及其化合物
1.镁铝合金在交通、航空、电子等行业有着广泛的应用。某化学兴趣小组试对镁铝合金废 料进行回收利用,实验中可将铝转化为硫酸铝晶体,并对硫酸铝晶体进行热重分析。镁铝 合金废料转化为硫酸铝晶体实验流程如下:
试回答下列问题: (1)在镁铝合金中加入 NaOH 溶液,写出反应的化学反应方程式 ,固体 B 的化学 式。 (2)操作Ⅱ包含的实验步骤有:蒸发浓缩、 、 、洗涤、干燥。 (3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是 。 (4)若初始时称取的镁铝合金废料的质量为 9.00 g,得到固体 A 的质量为 4.95 g,硫酸铝 晶体的质量为 49.95 g(假设每一步的转化率均为 100%,合金废料中不含溶于碱的杂 质)。计算得硫酸铝晶体的化学式为 。 (5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K687K,1043K 以上不再失重,其热分解的 TG 曲线见下图,
>V(O2)> 7a ,故答案为: 5a g;b>V(O2)> 7a ;
15
3
15
(5)若容器中无气体剩余,残留固体中含有镁,说明镁不足量,假设气体全部是氧气,氧气
完全反应时固体质量增加的质量= b mol×32g/mol= 32b g,则固体质量为(a+
22.4
22.4
32b )g; 22.4
假设气体全部是二氧化碳,根据 2Mg+CO2→2MgO+C 知,固体增加的质量为二氧化碳的
容器中剩余二氧化碳,二氧化碳可能参加反应也可能不参加反应,所以残留固体物质一定
含有氧化镁,可能含有碳,故选 B;
(4)镁的物质的量=
ag 24g/mol
=
a 24
mol,若氧气有剩余,则镁只和氧气反应生成氧化镁,
根据原子守恒得 n(Mg)=n(MgO),所以氧化镁的质量= a mol×40g/mol= 5a g;
×342g/mol=25.65g,则含有的结晶水的物质的量是 n(H2O)=
18g / mol
=1.35mol,
则 n(Al2(SO4)3):n(H2O)= ( 0.15mol ):1.35mol=1: 18,所以该结晶水合物的化学式是: 2
Al2(SO4)3·18H2O。 (5)在第一个阶段,减少的水的质量是:m(H2O)= 40.54%×49.95g=20.25g,失去的结晶水
子个数守恒可知,合金中镁的质量为
11.6 g 58g /mol
×24g/mol=4.8g,铝的质量为
7.8 g 78g /mol
×27g/mol=2.7g,则铝的物质的量分数为
(4)若反应容器中有氧气剩余,则容器内剩余固体的质量为_________,出现此种状况,
容器中原来 b L 混合气体中氧气的体积应满足(用含 a 的代数式)______体中含有镁,则残留固体 m 的取值范围_________;若
容器中无气体剩余,残留固体中没有镁剩余,则残留固体 m 的取值范围_________。
【答案】①② MgF2(s)+Br2(l)=MgBr2(s)+ F2(g) △H=+600kJ/mol B
5a
g
b>V(O2)>
3
7a (a+ 32b )<m<(a+ 44b ) 5a <m< 23a
15
22.4
22.4 3
12
【解析】
【分析】
(1)①离子晶体中离子键越强,离子晶体越稳定;
②如果反应物能量之和大于生成物能量之和,则是放热反应;
Al2(SO4)3·3H2O (9)Al2(SO4)3 Al2O3+3SO3↑
【解析】 【分析】 向镁铝合金中加入足量氢氧化钠溶液,发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,镁不 反应,固体 A 为 Mg,采用过滤的方法进行分离,向滤液中通入二氧化碳,发生反应: NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,再通过过量进行分离,固体 B 为氢氧化铝,氢氧化 铝与硫酸反应得到硫酸铝溶液,再经过蒸发浓缩、冷却结晶、洗涤、干燥得到硫酸铝晶体 (1)Al 和氢氧化钠溶液生成可溶性的偏铝酸钠,镁不反应; (2)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作; (3)用乙醇洗涤,可以减少晶体的溶解,有利于晶体的干燥; (4)Al 的质量为 9g-4.95g=4.05g,设硫酸铝晶体化学式为:Al2(SO4)3·nH2O,根据 Al 元 素守恒计算硫酸铝晶体的物质的量,再计算硫酸铝晶体的相对分子质量,进而计算 n 的 值,确定化学式; (5)根据(4)中计算可知,晶体中结晶水的质量分数,低温加热,首先失去结晶水,高 温下,最终硫酸铝分解,根据失重%计算判断各阶段分解产物,再书写化学方程式; 【详解】 (1)在镁铝合金中加入 NaOH 溶液,Al 可以与强碱溶液发生反应,而 Mg 不能反应,该反 应的化学反应方程式是 2Al+2NaOH+2H2O=2NaAlO2+3H2↑;所以固体 A 是 Mg;向滤液中通 入过量的 CO2 气体,由于酸性 H2CO3>Al(OH)3,会发生反应:NaAlO2+CO2+2H2O= Al(OH)3↓+NaHCO3;所以固体 B 是 Al(OH)3; (2)用硫酸溶解该固体,发生反应:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;得到的溶液 C 是 Al2(SO4)3 溶液;由于其溶解度随温度的升高而增大,所以从溶液中获得晶体的方法是蒸发 浓缩、冷却结晶、过滤 、洗涤、干燥; (3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,来洗去表面的杂质离子,选用无水乙醇的原 因是减少晶体的溶解;洗去晶体表面杂质;有利于晶体的干燥; (4)若初始时称取的镁铝合金废料的质量为 9.00 g,得到固体 A 的质量为 4.95 g,金属发 生反应,而镁不反应,减少的质量为金属铝的质量,则 m(Al)= 9.00g—4.95 g=4.05g,n(Al)=
③化合物的热稳定性与物质的能量大小有关,能量越小越稳定;
(2)根据盖斯定律书写;
(3)镁在燃烧时先和氧气反应生成氧化镁,当氧气完全反应后,镁再和二氧化碳反应生成氧
化镁;
(4)若氧气有剩余,则镁只和氧气反应生成氧化镁,根据原子守恒计算;采用极限的方法计
算;
(5)若容器中无气体剩余,残留固体中含有镁,假设气体全部为氧气或二氧化碳,然后采用
质量,所以固体增加的质量= b mol×44g/mol= 44b g,所以固体质量为(a+ 44b )g,
22.4
22.4
22.4
则容器内固体质量为(a+ 32b )<m<(a+ 44b );
22.4
22.4
假设镁和氧气恰好反应,固体的质量为氧化镁的质量= 5a g; 3
假设镁和二氧化碳恰好反应,固体的质量为镁和二氧化碳的质量=a+
极限的方法解答;若容器中无气体剩余,残留固体中没有镁剩余,说明二者完全反应。
【详解】
(1)①相同类型的离子晶体中,离子键越强,则离子间作用力越强,物质含有的能量越低, 所以 MgI2 中 Mg2+与 I−间的作用力小于 MgF2 中 Mg2+与 F−间的作用力,故正确; ②根据图象知,反应物的能量大于生成物能量,所以 Mg 与 F2 的反应是放热反应,故正 确;
4.05g 27g / mol =0.15mol,硫酸铝晶体的质量为 49.95 g,硫酸铝晶体中含有 SO42-的物质的量为
n(SO42-)= 3 n(Al3+)= 3 ×0.15mol=0.225mol, Al2(SO4)3 的质量是 m(Al2(SO4)3)= ( 0.15mol )
