第六章 晶体结构与晶体材料
晶体结构与材料力学性质关联分析

晶体结构与材料力学性质关联分析晶体结构是材料科学中的重要概念,是指物质中原子或分子的有序排列形式。
晶体结构的不同,对材料的力学性质有着直接的影响。
本文将从晶体结构的原理和材料力学性质的相关性等方面进行探讨。
首先,晶体结构的原理是由一定的几何规则和对称性来决定。
常见的晶体结构包括立方晶体、正交晶体、单斜晶体、正斜晶体等等。
在晶体结构中,晶胞是最基本的结构单位,所有的晶体结构都是由晶胞堆积而成。
晶胞内部的原子或分子的排列方式呈现一定的规律性,这种规律性主要体现在晶胞的对称性上。
不同的晶体结构对材料的性质具有不同的影响。
其次,晶体结构对材料的力学性质有着直接的影响。
晶体的力学性质主要包括弹性性质、塑性性质和断裂性质等。
弹性性质是指材料在受力作用下能够恢复原状的能力。
晶体结构的对称性可以影响晶体的弹性性质,比如立方晶体具有各向同性的弹性性质,而正交晶体由于具有不同的晶轴长度,其弹性性质则表现出各向异性。
塑性性质是指材料在受力作用下发生永久形变的能力。
晶格结构中的晶胞和晶胞之间的排列方式直接影响了晶体材料的塑性性质,比如晶胞的堆积方式决定了晶体的滑移系以及滑移面的取向等。
断裂性质是指材料在受力作用下发生破裂的能力。
晶体结构的切向力和剪切力对材料的断裂性质有着重要的影响,晶体结构中存在的位错等缺陷会对断裂行为起到关键的作用。
此外,晶体结构的有序排列还可以影响材料的热膨胀性质和导热性质等。
晶体结构中的原子排列方式决定了晶体对温度的响应。
不同晶体结构的原子排列方式会导致不同的热膨胀系数,即在不同温度下晶体材料的尺寸变化程度不同。
此外,晶体结构中的原子之间的距离和键强度也会影响材料的导热性能,即不同晶体结构的导热性能也会存在差异。
最后,晶体结构与材料力学性质关联的研究对材料科学和工程应用有着重要意义。
通过深入了解晶体结构和材料力学性质之间的关联,在材料设计和合成方面可以更加精准地控制材料的性能。
例如,在晶体材料的工程应用中,可以通过调控晶体结构来实现材料的功能化设计。
金属的晶体结构与结晶PPT课件
3.2 纯金属的结晶
(2)变质处理
变质处理是在浇注前向液态金属中加入一些细 小的难熔的物质(变质剂),在液相中起附加 晶核的作用,使形核率增加,晶粒显著细化。
(3)振动处理
金属结晶时,利用机械振动、超声波振动,电 磁振动等方法,既可使正在生长的枝晶熔断成 碎晶而细化,又可使破碎的枝晶尖端起晶核作 用,以增大形核率。
第27页/共31页
Fe3C的晶体结构
3.5 合金的结晶
➢共晶转变 从一定化学成分的液体合金中同时结晶出两种
不同固相的机械混合物,则该转变过程称为共 晶转变。 ➢共析转变 在固态下由一种单相固溶体同时析出两种不同 固相的机械混合物,则该转变过程称为共析转 变。
第28页/共31页
3.6 金属铸锭的组织结构
内位错线的总长度表示。位 错密度愈大,塑性变形抗力 愈大。因此,目前通过塑性 变形,提高位错密度,是强 化金属的有效途径之一。
第8页/共31页
3.1 金属的结构
(3)面缺陷
面缺陷即晶界和亚晶界。
➢晶界:晶粒之间原子无规 则排列的过渡层,又称大 角度晶界。
➢亚晶界:晶粒内部亚组织 之间的边界,一系列刃型 位错所形成的小角度晶界。
晶界和亚晶界处表现出有较高的强度和硬度。 晶粒越细小晶界和亚晶界越多,它对塑性变形的阻碍作用就越大, 金属的强度、硬度越高。
第9页/共31页
3.2 纯金属的结晶
结晶:金属由液态转变为固态晶体的现象叫做结晶。
一、纯金属的冷却曲线和冷却现象
1、冷却曲线
以极缓慢速度冷却
第10页/共31页
实际冷却条件下的冷却
二、柱状晶粒区(垂直于铸锭表面)
金属材料—晶体结构(无损检测课件)

第1节 晶体结构
金属与合金的晶体结构
晶体的概念 固态物质可以分为两类:晶体和非晶体。 晶体 原子呈有规则的、按一定的几何形状重复排列。如金刚
石、石墨及一切固态的金属和合金。晶体具有各向异性。 非晶体 原子呈无规则的堆积在一起。如玻璃、沥青、松香等。
非晶体具有各向同性 在一定条件下晶体和非晶体可以互相转化。
第1节 晶体结构
金属常见的晶体结构
(1)体心立方晶格 体心立方晶格的晶胞是一个立方 体,在立方体的中心有一个原子,在立边夹角α=β=γ=90°。属于体心立方 晶格的金属有α-Fe、Cr、W、Mo等。
(2)面心立方晶格 面心立方晶格的晶胞也是一个立方 体,在立方体的每一个面的中心和立方体的八个角 上,均分别有一个与其他相邻晶胞所共有的原子。 其晶格常数a=b=c,棱边夹角α=β=γ=90°。属 于这类晶格的金属有γ-Fe、Al、Cu、Ni等。
(3)晶格常数 在三维空间中,晶胞的几何特征即大小和形 状常以晶胞的棱边长度a、b、c及棱边夹角α、β、γ来描述, 其中晶胞的棱边长度a、b、c一般称为晶格常数。
第1节 晶体结构
2.晶体结构的基本知识
(1)晶格 假定晶体中的物质质点都是固定的刚球, 由这些刚球堆垛而成晶体,如图所示,即原子堆垛 模型。
为了研究方便,假设通过这些质点的中心画出许多空间直线 形成空间格架,这种假想的格架在晶体学上就称为晶格。晶格 中的每个点叫做晶格结点。
(2)晶胞 从晶格中选取一个能够完全反映晶格 特征的最小的几何单元来分析晶体中原子排列的规 律,这个最小的几何单元称为晶胞。
(3)密排六方晶格 密排六方晶格 密排六方晶格的晶胞是
一个六方柱体,它是由六个呈长方形的侧面和两个呈六边形 的底面所组成。在上下底面的十二个结点处各有一个原子, 在两个六方底面的中间还有三个原子,其晶格常数a=b≠c, 棱边夹角α=β=90°,γ=120°。属于密排六方晶格的金属有 Mg、Zn、Cd、Be等。
《晶体结构与性质》课件

总结词
密排六方结构是一种晶体结构,其特点是原子或分子的排列具有高度的六方对称性,且每个原子或分子的周围都有相同数量的最近邻。
详细描述
密排六方结构是一种晶体结构,其原子或分子在晶格中以密排六方的形式排列。这种结构的六方对称性使得原子或分子的排列非常紧密。由于每个原子或分子周围都有相同数量的最近邻,这种结构也具有高度的稳定性。密排六方结构在金属材料中较为常见,如镁、锌、镉等。
总结词
金属材料在晶体结构与性质方面具有广泛的应用,其性能受到晶体结构的影响。
详细描述
金属材料的物理和化学性质,如导电性、导热性、耐腐蚀性等,都与其晶体结构密切相关。通过了解金属材料的晶体结构,可以预测其在不同环境下的性能表现,从而优化材料的选择和应用。
陶瓷材料的晶体结构对其硬度、耐磨性和耐高温性能具有重要影响。
分子晶体结构是一种由分子通过范德华力结合形成的晶体结构。
总结词
分子晶体结构是一种由分子通过范德华力结合形成的晶体结构。范德华力是一种较弱的作用力,因此分子晶体通常具有较低的熔点和硬度。常见的分子晶体有冰、干冰等。分子晶体在材料科学和工程中也有一定的应用,如某些塑料和橡胶材料。
详细描述
晶体结构与材料性能的应用
总结词
硬度是衡量晶体抵抗被划痕或刻入的能力的物理量。硬度通常与晶体中原子的排列方式和相互间的作用力有关。例如,金刚石是自然界中硬度最高的物质,这归功于其独特的碳原子排列方式。
详细描述
VS
晶体的光学性质主要取决于其内部结构和对称性。
详细描述
当光照射到晶体上时,会发生折射、反射、双折射等光学现象。这些现象的产生与晶体内原子或分子的振动和排列方式有关。例如,某些晶体具有特殊的颜色,这是由于它们对不同波长的光有不同的折射率。
晶体生长第六章 界面的微观结构
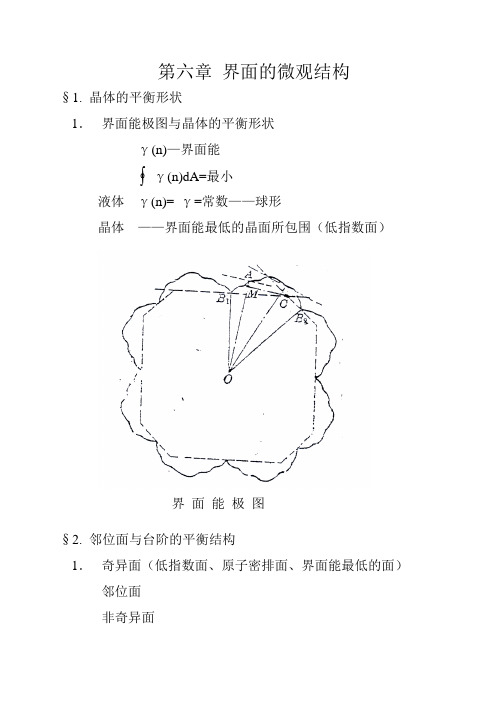
第六章 界面的微观结构§1. 晶体的平衡形状1. 界面能极图与晶体的平衡形状γ(n)—界面能γ(n)dA=最小液体 γ(n)= γ=常数——球形晶体 ——界面能最低的晶面所包围(低指数面)§2. 邻位面与台阶的平衡结构1. 奇异面(低指数面、原子密排面、界面能最低的面)邻位面非奇异面界 面 能 极 图2. 邻位面台阶化邻位面→台阶(总界面能最低)§2. 台阶热力学性质1. 台阶——奇异面的一条连续曲线,线之间则有一个原子的高度差。
台阶是起止于晶体边缘或形成闭合曲线,不会终止在晶面内。
hk yZ tg -=∂∂=θ2. 台阶棱边能:单位长度台阶具有的自由能(产生单位长度台阶所作之功)台阶有线张力(棱边能大小),使台阶缩短。
3. 台阶棱边能的各项异性——台阶扭折化h tg k /θ=4. 台阶的平衡结构台阶上的扭折取决于台阶取向,当θ=0(台阶和密排方向一致),k →0,这只在0k 时成立。
热涨落可在台阶上产生扭折。
扭折有正负号。
扭折产生与台阶吸附空位或原子有关。
α+=α- α++α-+α0=1α+:产生正扭折机率台 阶 的 扭 折 化α-:产生负扭折机率α0:不产生扭折的机率细微平衡原理(The principle of detailed balancing )求扭折形成能 a: 2Φ1 2扭折b: 4Φ1 4扭折 一个扭折形成能为Φ1 c: 0 0 )/exp(//100kT Φ-==∴-+αααα台阶任意位置产生扭折的总机率(正和负)为: )/exp(210kT Φ-=+=-+αααα台阶有n 原子,a 为原子间距,台阶长na,台阶上的扭折数为:n (α++α-)扭折平均距离: +-+-+=+=+=ααααα2)(0a a n na X由于α++α-+α0=α0+2α+=1 即: )(1αααα+=++ }2){exp(210+Φ=∴kT a X X 0>>a , )exp(210kT a X Φ≈∴T →0k 时,X 0→∞ 扭折密度为零在有限温度下,台阶上总是存在扭折的(θ=0) 600K X0≈4~5a§3. 界面相变熵和界面的平衡结构1.光滑界面与粗糙界面晶体原子→振动平均频率固定熔体原子→振动平均频率是变化的X=N A/N N A晶体原子1-X 熔体X≈50% 1-X≈50% 粗糙界面X≈0% 或 1-X≈100% 光滑界面考察界面自由能的表达式,求出自由能最低时的X。
晶体结构与材料导电性质的关联研究

晶体结构与材料导电性质的关联研究导电性质是材料科学中一个重要的研究方向,通过研究材料的导电性质,可以揭示材料的内在性质以及可能的应用价值。
在导电性质的研究中,晶体结构起着至关重要的作用。
晶体结构是材料内部原子的排列方式,不同的晶体结构会导致材料具有不同的电导率。
本文将探讨晶体结构与材料导电性质的关联。
首先,我们需要了解晶体的基本结构。
晶体是一种具有周期性排列的固体材料,其内部原子或分子呈现高度有序的排列方式。
晶体结构可以由晶胞和晶格来描述。
晶胞是晶体的基本单位,它是由若干个原胞组成的。
原胞则是晶胞中最小的可重复结构,通常是一个或多个原子及其周围的电子。
晶格则是指晶体中所有晶胞的集合。
晶格的对称性决定了晶体的宏观性质,包括导电性质。
晶体结构对材料的导电性质有着直接的影响。
在晶格中,原子或分子通过离子键、共价键或金属键相连,形成电子的导电路径。
晶格的对称性决定了这些电子路径的有效性和连通性,进而影响材料的导电性质。
例如,金属材料常常具有良好的导电性能,这是由于金属晶格中的自由电子能够自由流动。
而对于离子晶体,由于离子间存在强烈的静电作用力,电子难以在离子晶格中自由传导,因此离子晶体一般具有较低的导电性能。
此外,晶体结构中存在的缺陷也对导电性质产生影响。
晶格缺陷是指晶格中的位置发生了改变,如原子空位、杂质原子等。
这些缺陷可以导致电子的局域化和散射,从而改变材料的导电性能。
例如,掺杂某些杂质原子可以改变半导体材料的导电性质,从使其从绝缘体变为导体。
这是因为杂质原子引入了额外的能级,改变了电子在晶格中的能带结构。
除了晶格结构和缺陷对导电性质的影响外,温度也是一个重要的因素。
温度对晶格结构的稳定性产生影响,进而影响材料的导电性质。
随着温度的升高,晶格结构会发生变化,原子的振动幅度会增大。
这些变化会影响到电子的运动,从而改变材料的导电性质。
一些材料在较低温度下可能表现出绝缘体特性,而在高温下则变为导体。
综上所述,晶体结构与材料导电性质之间存在密切的关联。
材料科学中的晶体结构与性质

材料科学中的晶体结构与性质材料科学是研究固体材料的构成、结构、性质和制备方法的一个领域。
在材料科学中,晶体结构是一个非常重要的概念。
晶体结构指的是固体材料中,原子、分子、离子等微观粒子按照一定规律排列形成的空间结构。
晶体结构的性质与材料的物理、化学性质密切相关。
以下将介绍晶体结构的基本知识、晶体中常见的结构类型以及晶体结构与性质的关系。
一、晶体结构的基本知识晶体结构是固体材料中的原子、分子、离子等微观粒子按照一定的空间规律排列而成的结构。
晶体结构具有周期性,即在整个结构中重复出现某一单元的结构,这个单元称为晶胞。
晶胞是晶体结构的基本单位,在晶体内不断重复,最终形成整个晶体。
晶体中的晶胞是唯一的。
晶体结构的周期性和唯一性赋予了晶体一些特殊的性质,如晶体具有明显的各向同性、划分明确的晶面和晶向、有固定的比重和熔点等。
二、晶体中常见的结构类型根据晶体中原子或分子排列方式的不同,晶体可分为离子晶体、共价晶体、分子晶体和金属晶体等。
下面分别介绍这几种晶体的结构特点:1、离子晶体离子晶体的晶胞由阳离子和阴离子构成。
常见的离子晶体有氯化钠结构、立方密堆积结构和六方最密堆积结构。
氯化钠结构中,钠离子和氯离子按照1:1的比例排列在构成立方体的点上。
立方密堆积结构中,阳离子和阴离子在每层密堆积,相邻层的离子排列顺序相反。
六方最密堆积结构中,阴离子构成一个六角形密堆积的层,阳离子沿着六边形的间隙排列,分别在两个六角形层之间和一层之上。
2、共价晶体共价晶体主要由非金属元素构成,它们共用电子在晶体中形成化学键。
共价晶体常见的结构有钻石结构和石墨结构。
钻石结构中,每个碳原子与四个相邻的碳原子形成正四面体结构。
石墨结构中,每个碳原子与三个相邻的碳原子在同一平面形成六边形的环,多层六边形环堆叠而成。
3、分子晶体分子晶体是由分子构成的晶体,分子之间是通过分子间的Van der Waals力或氢键相互作用而结合在一起的。
分子晶体通常呈透明或半透明的颗粒状或柱状晶体。
晶体结构与材料的物理性质

晶体结构与材料的物理性质晶体是固体材料中具有高度有序的排列和周期性结构的形式,对于材料的物理性质具有重要影响。
本文将从晶体结构与物理性质的相互关系、晶体的基本结构以及晶体的几个重要物理性质等方面展开讨论。
一、晶体结构与物理性质的相互关系晶体结构对于材料的物理性质具有决定性影响。
1. 晶粒结构晶体中存在许多晶粒,每个晶粒都具有独特的晶体结构。
晶粒的大小和形状会对材料的物理性质产生影响。
晶粒越大,材料的力学性能和导电性能往往更好,因为晶粒内的原子排列更有序。
2. 晶格缺陷晶体中的晶格缺陷包括点缺陷、线缺陷和面缺陷等。
这些缺陷形成后,会改变晶体的结构,从而影响材料的物理性质。
例如,点缺陷如空位和杂质原子会导致晶格的畸变,进而影响材料的导电性和光学性能。
3. 晶体的结晶度晶体的结晶度是指晶体内部有序程度的度量。
结晶度越高,晶体结构越完整,材料的物理性质也会更加稳定和一致。
反之,低结晶度可能会导致材料的力学性能和导电性能的不均匀性。
二、晶体的基本结构晶体的基本结构是由原子或离子以一定的方式排列而成。
1. 金属晶体结构金属晶体结构通常由金属原子以密堆积的方式组成。
常见的金属晶体结构有面心立方(FCC)结构和体心立方(BCC)结构。
这些结构具有高导电性和热导性,同时也具有较高的塑性和延展性。
2. 离子晶体结构离子晶体结构由正离子和负离子以离子键相互结合形成。
例如,氯化钠(NaCl)是一种典型的离子晶体,其中钠离子和氯离子以离子键相互结合。
离子晶体结构具有较高的熔点和硬度,并且具有良好的电绝缘性。
3. 共价晶体结构共价晶体结构由共价键连接的原子组成。
例如,硅是一种典型的共价晶体。
共价晶体具有较高的熔点和硬度,同时也具有一定的电导性。
三、晶体的物理性质晶体的物理性质包括力学性质、光学性质、电学性质等。
1. 力学性质晶体的力学性质包括硬度、弹性模量和塑性等。
晶体的硬度取决于晶体内原子或离子之间的结合力,而弹性模量则反映了晶体对外力的响应能力。
晶体材料制备原理与技术:第6章 相变与结晶成核

均匀成核
一次成核
成核
非均匀成核
二次成核
特点:(以区别于不稳分解)
★需要克服一定的位垒; ★需要达到一定的临界尺寸;
★生长过程中新相的化学组成始终不变。
§3 结晶相变的基本条件
ⅰ) 热力学条件
等温等压条件下,物质系统总是自发地从自由能较 高的状态向自由能较低的状态转变。
G H TS
可逆过程:
dS d CP dT
*相变动力学
研究相变的发生和发展、相变速度和停止 过程以及影响它们的因素。
在母相中产生新相的晶胚,在一定温度下, 晶胚以一定速率长大,一直到受阻或自由能 条件变为不利。由于新相形成晶胚时体自由 能减少,而表面自由能增加,矛盾统一的结 果是新相的晶胚必须具有或超过一定临界尺 寸才是稳定的。临界晶核继续长大才能导致 体系的自由能下降。
单元系统相变过程图
例:
过冷状态-亚稳态
有一位英国结晶学家,把过冷却的水杨酸苯酯液 体放置了18年之久而未结晶。非常遗憾的是,当他 要把这一珍品出示给听课的学生时,刚把它拿到讲 台上,仅仅一点轻微振动,便全部结成了晶体。虽 然大家有点失望,但却明白了一个道理:过冷态是 一种亚稳态。
处于过冷态的任何熔体,哪怕引入一点微小的晶 粒、灰尘或发生振动,就会失去平衡,向稳定态转 化。
TC
T
临界晶核半径、结构起伏尺寸与 过冷度的关系
结构起伏的
尺寸 ra 也与过
冷度有关,它 随过冷度的增 大而增大。TC 为形成临界晶 核所必须的最 小过冷度,称 为临界过冷度。
对均匀成核可作如下描述:
ⅰ) 过冷是必须的,但要使结晶过程得以进 行,还必须超过某一临界值 ;
ⅱ) 界面能是在过冷熔体中形成临界晶核
金属材料的晶体结构与结晶

1.1.1 合金的晶体结构
合金是指由两种或两种以上的金属元素或由金属元素与非金属元素 组成的具有金属特性的物质。
组成合金的最基本的、独立的单元称为组元。由两个组元组成的合 金称为二元合金,由三个组元组成的合金称为三元合金,由三个以上组 元组成的合金称为多元合金。
合金中结构相同、成分相同和性能一致,并以界面相互隔开的组成 部分称为相。只有一种相组成的合金为单相合金,由两种或两种以上相 组成的合金为多相合金。用金相观察方法,在金属及合金内部看到的相 的形态、数量、大小和分布及相间结合状态称为显微组织。
非晶体
晶体
金属材料的晶体结构与结晶
1.晶体结构的基本知识
图2-1 晶体结构示意图
金属材料的晶体结构与结晶
1.常见的金属晶格类型 常见的金属晶格类型包括体心立方晶格、面心立方晶格和密排六方
晶格三大类。 1)体心立方晶格 body—centered cubic lattice 特点:b 较好。如:<912℃ Fe, Cr, Mo, V等。 含有2个原子体积组成。
图2-7 刃型位错示意图
金属材料的晶体结构与结晶
(3)面缺陷。面缺陷是指在晶体中呈面状分布(在两个方向上尺寸很大,在第 三个方向上尺寸很小)的缺陷。常见的面缺陷是晶界和亚晶界。
晶界是位向不同的晶粒间的过渡区,其宽度为5~10个原子间距。晶界区域的晶 粒的位向通过晶界的协调逐步过渡到相邻晶粒的位向,如图2-8(a)所示。亚晶界 是由位向相差很小的亚晶粒组成的,如图2-8(b)所示。晶界和亚晶界的原子排列 都不规则,会产生晶格畸变。因此,晶界和亚晶界均可提高金属的强度,改善塑性 和韧性。
图2-10 液态金属的结晶过程示意图
金属材料的晶体结构与结晶
第六章 化学键和晶体结构
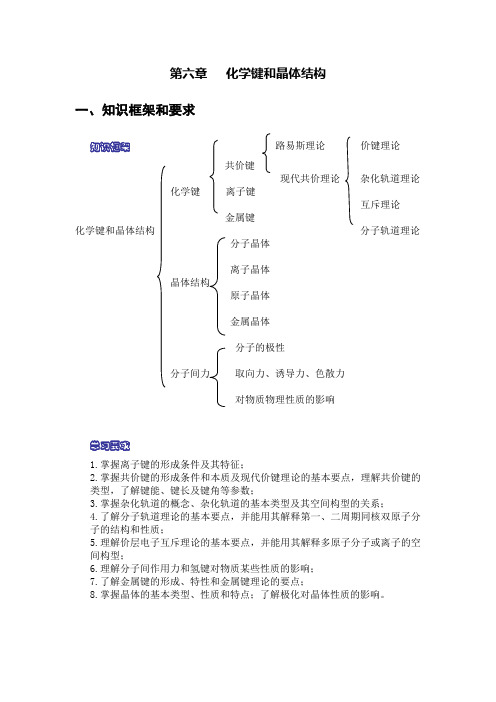
第六章化学键和晶体结构一、知识框架和要求知识框架路易斯理论价键理论共价键现代共价理论杂化轨道理论化学键离子键互斥理论金属键化学键和晶体结构分子轨道理论分子晶体离子晶体晶体结构原子晶体金属晶体分子的极性分子间力取向力、诱导力、色散力对物质物理性质的影响学习要求1.掌握离子键的形成条件及其特征;2.掌握共价键的形成条件和本质及现代价键理论的基本要点,理解共价键的类型,了解键能、键长及键角等参数;3.掌握杂化轨道的概念、杂化轨道的基本类型及其空间构型的关系;4.了解分子轨道理论的基本要点,并能用其解释第一、二周期同核双原子分子的结构和性质;5.理解价层电子互斥理论的基本要点,并能用其解释多原子分子或离子的空间构型;6.理解分子间作用力和氢键对物质某些性质的影响;7.了解金属键的形成、特性和金属键理论的要点;8.掌握晶体的基本类型、性质和特点;了解极化对晶体性质的影响。
二、重点及难点解析1. 离子键、共价键和金属键的比较 化学键类型 离子键 共价键 金属键概念 阴、阳离子间通过静电作用所形成的化学键 原子间通过共用电子对所形成的化学键 金属阳离子与自由电子通过相互作用而形成的化学键 成键微粒阴阳离子 原子 金属阳离子和自由电子 成键性质静电作用 共用电子对 电性作用 形成条件活泼金属与活泼的非金属元素 非金属与非金属元素 金属内部 实例 NaCl 、MgO HCl 、H 2SO 4 Fe 、Mg小问答1:下列关于化学键的说法,正确的是( )A. 构成单质分子的粒子一定含共价键。
B. 由非金属元素组成的化合物不一定是共价化合物。
C. 非极性键只存在于双原子单质分子里。
D. 不同元素组成的多原子分子里的化学键一定是极性键。
解析:列举法。
A 错,因稀有气体构成的单原子分子中不含共价键。
B 对,例如、 等铵盐是非金属元素组成的离子化合物。
C 错,例如在、等物质中键是非极性键。
D 错,例如中键,中键是非极性键。
金属材料的晶体结构与晶粒取向

金属材料的晶体结构与晶粒取向金属材料是我们生活中常见的材料之一,它们广泛应用于建筑、制造业、航空航天等领域。
而金属材料的性能与其晶体结构以及晶粒取向密切相关,本文将探讨金属材料的晶体结构以及晶粒取向对材料性能的影响。
一、晶体结构晶体结构是指金属材料中原子或离子的排列方式。
在固态材料中,大部分金属都呈现结晶状态,即原子或离子按照一定规律在空间中排列形成晶体。
常见的金属晶体结构有面心立方结构、体心立方结构和六方最密堆积结构。
1. 面心立方结构面心立方结构是最简单而常见的金属晶体结构之一。
它的原子或离子在每个顶点和每个面中心都有一个,总共构成了四分之一的原子或离子。
典型的面心立方结构材料有铝、铜等。
2. 体心立方结构体心立方结构是另一种常见的金属晶体结构。
它的原子或离子在每个顶点和一个立方体的中心都有一个,总共构成了八分之一的原子或离子。
典型的体心立方结构材料有铁、钨等。
3. 六方最密堆积结构六方最密堆积结构是一种特殊的晶体结构,其原子或离子在垂直于堆积方向的六个面上形成堆积序列。
典型的六方最密堆积结构材料有钛、锌等。
二、晶粒取向晶粒是金属材料中具有相同晶体结构的晶体区域。
晶粒取向指的是晶粒的排列方向和取向规律。
晶粒取向对金属材料的性能有重要影响,包括力学性能、导电性能等。
晶粒取向受到多种因素的影响,其中最主要的是金属材料的制备方法以及热处理过程。
金属材料的制备方法包括熔融法、凝固法等,不同制备方法会导致晶粒取向的差异。
而热处理过程则可以通过控制温度和冷却速率等参数来调控晶粒取向。
在晶粒取向中,晶粒的方向性分布对材料的性能有直接影响。
例如,在金属材料中,晶粒的取向可以影响材料的塑性变形行为。
当晶粒取向一致时,材料的塑性变形性能明显提高,而当晶粒取向不一致时,材料的力学性能可能会下降。
此外,晶粒的大小也会影响晶粒取向对材料性能的影响。
较小的晶粒可以提高材料的强度和硬度,但可能会降低其韧性和塑性。
因此,在金属材料的制备和处理过程中,需要根据具体应用需求控制晶粒的大小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章晶体结构与晶体材料教学目的:掌握晶体的概念及晶体结构的特点;掌握晶体的宏观对称性;熟悉晶体的基本性质;了解晶体缺陷的重要性。
教学重点:晶体材料:石英晶体与压电材料、钛酸钡晶体与非线性光学材料、BGO晶体材料。
教学难点:晶体的对称性与晶系。
第一节晶体的结构特点一、晶体晶体是由原子或分子按照一定的周期性规律在空间重复排列而成的固体物质。
二、晶体结构的特点1. 晶体结构的特点以NaCl晶体为例讨论晶体结构的特点。
NaCl是食盐的主要成分,市售粗盐经过重结晶可得到纯净、漂亮的NaCl晶体。
NaCl晶体呈立方体外形,肉眼可以看到平滑的晶面,尖锐的顶角和笔直的棱边。
NaCl晶体整齐的外形反映了晶体的内部结构规整性。
用X射线衍射法测定的NaCl的晶体结构,如图6-1所示。
2. 晶胞晶胞晶胞是晶体的一个基本结构单位,它的形状是一个平行六面体。
图6-1给出了NaCl晶体的一个晶胞,无数的这种晶胞在空间规则地重复排列就形成NaCl晶体。
要确定晶体的结构,首先要知道晶胞的大小和形状,其次要知道晶胞中原子的种类、数目和原子的坐标位置。
晶胞的大小和形状由晶胞参数规定。
若把晶胞放在坐标系中,如图6-2所示,它的三条棱边a,b,c和三条棱边两两之间的夹角α,β,γ合称为晶胞参数。
如NaCl晶体的晶胞参数为:a=b=c=562.8 pm,α=β=γ=90°,这种晶胞称为立方晶胞。
NaCl晶体中Na+与Cl-以离子键结合,所以NaCl晶体称为离子晶体。
在NaCl晶体中,一个Na+周围配有6个Cl-(配位数为6)。
这6个配位Cl-形成一个八面体,Na+处于八面体的空隙中。
同样地,以一个Cl-为中心,周围也配有6个Na+,Cl-也处于Na+的八面体空隙中。
由此可见,NaCl只是个化学式,整块NaCl 晶体是个巨大的分子,把NaCl看作一个分子(或分子式)是不确切的。
3. 结构基元结构基元是指晶体中作周期性规律重复排列的那一部分内容。
它是晶体中重复排列的基本单位,必须满足化学组成相同、空间结构相同、排列取向相同和周围环境相同的条件。
晶胞中含一个结构基元的称为素晶胞,含2个和2个以上结构基元的称复晶胞。
图6-1的NaCl晶胞中含4个Na—Cl结构基元,是面心立方型式的复晶胞。
图6-3给出了CsCl晶体和金属钨晶体的晶胞结构。
CsCl晶胞中只含1个结构基元(Cs—Cl),所以是素晶胞,它是立方晶胞,故称为简单立方。
金属钨立方晶胞中有2个钨原子,一个钨原子为一个结构基元,所以是复晶胞,称为体心立方。
立方晶胞共有三种形式:简单立方、体心立方和面心立方。
第二节晶体的基本性质一、晶体的基本性质晶体的基本性质由晶体的周期性结构决定的。
晶体具有均匀性和各向异性。
二、均匀性均匀性如晶体的化学组成、密度等性质在晶体中各部分都是相同的,这是由于晶体周期性结构中的周期很小,宏观上分辨不出的缘故。
三、各向异性晶体中沿不同方向,原子或分子排列的情况不同,因此在不同方向上呈现不同的性质,这称为各向异性。
四、晶体的熔点、晶体的对称性、晶体能使X射线产生衍射晶体具有确定的熔点如果把晶体加热,随着温度的升高,晶体中原子之间的化学键会发生断裂,晶体的周期性规则排列遭到破坏,晶态向液态转化,转化时的温度就是晶体的熔点。
晶体具有对称性对称性是晶体的重要性质之一,晶体的外形和内部结构都具有特有的对称性,下面将做具体讨论。
不论是天然晶体或人工培养的晶体,都呈现多面体外形。
晶体能使X射线产生衍射当入射光的波长与光栅隙缝大小相当时,能产生光的衍射现象。
X射线的波长与晶体结构的周期大小相近,所以晶体是个理想的光栅,它能使X射线产生衍射。
利用这种性质人们建立了测定晶体结构的重要实验方法。
非晶态物质没有周期性结构,不能使X射线产生衍射,只有散射效应。
第三节晶体的对称性与晶系一、晶体的宏观对称性晶体宏观对称性有旋转轴(也称对称轴)、对称面(也称镜面)和对称中心。
1.旋转轴旋转轴是对称元素,绕旋转轴可做旋转操作。
n次旋转体对应面中心联线方向有4次旋转轴,绕此轴每旋转90°后,晶体形状不变;立方体对角线联线方向有3次旋转轴,绕此轴每旋转120°后,晶体形状不变;立方体对应棱边中心联线方向有2次旋转轴,绕此轴每旋转180°,晶体形状不变。
图6-4示出这3种旋转轴。
可以证明在晶体宏观外形中存在的旋转轴有1,2,3,4和6次旋转轴5种,不存在5次轴和大于6次的旋转轴。
2.对称面对称面是对称元素,对称面也称镜面,常用m表示。
凭借对称面可以做反映操作,如同物体与镜子中的像是反映关系。
人的双手手心相对,平行放置,左右手就互为镜象。
许多晶体中存在对称面,NaCl晶体有9个对称面。
3. 对称中心对称中心也是对称元素,常用i表示。
通过对称中心可以做倒反操作。
例如人的双手手心相对,逆平行放置,此时左右手构成倒反关系。
图6-1 所示的NaCl 晶胞中,在体心位置存在对称中心。
因此晶胞中任意一个原子与对称中心相连,在反方向等距离处必存在同样的原子。
晶体有无对称中心对晶体的性质有较大的影响。
凭借上述三种对称元素所做的对称操作都是简单操作,如果连续做两个简单操作就成为复合操作。
旋转倒反操作是复合操作,与它对应的综上所述,在晶体外形独立存在的宏观对称元素有8种:1,2,3,称类型,称为32种晶体学点群。
二、7个晶系自然界存在的晶体和人工培养的晶体有千万种,但按照晶体宏观对称性可将它们分为7类,称为7个晶系。
在众多的对称元素中,把对称性最高的叫做特征对称元素。
晶系就是根据晶体的特征对称元素来划分的。
凡晶体中有4个3次轴的归为立方晶系,立方晶系的对称性最高。
其次是六方晶系,晶体中有一个6次轴是六方晶系的特征对称元素。
第四节晶体材料一、石英晶体与压电材料1.压电效应把晶体切成薄片,薄片受压后在两个面上分别产生正电荷和负电荷,这就是晶体的压电效应。
只有非中心对称晶体可能有压电效应,因此利用压电效应可以帮助我们判断晶体的对称性。
图6-5示出石英晶体的形状,并标出了石英晶体的对称元素。
它有1个3次轴,有3个2次轴垂直3次轴,没有对称中心,所以石英是非中心对称晶体,是很好的压电材料。
石英晶体具有压电效应,把石英晶体切成薄片,石英片可以取代钟表中的摆和游丝。
二、钛酸钡晶体与非线性光学材料非线性光学效应在传统的线性光学范围内,一束光通过晶体后,光的频率不会改变。
然而当光通过某种晶体后产生频率为入射光两倍的光,则将这种现象称为非线性光学效应。
产生非线性光学效应的晶体叫非线性光学晶体。
这种晶体必须是非中心对称晶体。
钛酸钡晶体钛酸钡的化学式为BaTiO3,高温时它的晶体是立方晶系,图6-6示出BaTiO3立方晶体的一个晶胞。
晶胞中只有一个分子,Ba原子位于体心位置,Ti原子处于顶角,O原子处于棱边。
从图中可看到,立方晶胞的顶角有TiO6八面体基团。
立方BaTiO3晶体有对称中心,因此没有非线性光学性能。
当温度降低时,TiO6八面体基团发生畸变,基团中的Ti沿4次轴相对O原子移动12 pm,Ba也在同方向移动6pm,O原子也偏离了正八面体。
此时晶体转变为四方晶系,没有对称中心,四方BaTiO3是非线性光学晶体,它能对高强度的激光光源进行调频、调相等技术处理。
四方BaTiO3还是优良的压电、铁电、电光等重要功能晶体材料。
三、BGO晶体材料BGO是化合物锗酸铋Bi4Ge3O12的简称。
BGO晶体无色透明,在光和X射线辐照下,BGO在室温下有很强的发光性质,是性能优异的新一代闪烁晶体材料,可用于探测X射线、γ射线、正电子和带电粒子等,在高能物理、核物理、核医学、核工业和石油勘探等方面有广泛的应用。
图6-7BGO晶体属立方晶系,晶胞中有4个Bi4Ge3O12分子。
Bi+3周围有6个GeO4四面体,图6-7示出BGO的晶体结构。
作为闪烁晶体材料,对BGO晶体的纯度要求极高。
如果起始原料中包含高于千万分之几的杂质,如Fe,Pb,Cr,Mn等,BGO晶体在光和X射线辐照下就会变成棕色,形成辐照损伤,它的探测性能就明显下降。
因此,生长BGO晶体需要用高纯(99.999%)的Bi2O3和GeO2作原料,并且要严格地按化学计量比(Bi2O3∶GeO2=2∶3)配料,还要长时间保持稳定的温度。
上海硅酸盐研究所曾培养出长25cm,质量为5kg的BGO大晶体。
第五节晶体缺陷1.晶体缺陷理想晶体是指晶体中的原子、分子完全按照严格的周期性重复排列得到的晶体,晶体中所有的晶胞都是等同的。
而在实际晶体中或多或少总会存在空位、位错、杂质原子等缺陷,这些因素促使实际晶体偏离理想的周期性重复排列,人们称之为晶体缺陷。
2.ZnS晶体与蓝色荧光粉蓝色荧光粉的主要原料是硫化锌(ZnS)晶体,它是白色的。
如果往ZnS晶体中掺入大约0.0001%的氯化银(AgCl)时,Ag+和Cl-分别占据ZnS晶体中Zn2+和S2-的位置,造成晶体缺陷,破坏了ZnS晶体周期性结构,使得杂质原子周围的电子能级与Zn2+和S2-周围的不同。
这种掺杂的ZnS晶体,在阴极射线激发下,放出波长为450nm的荧光,可做彩色电视荧光屏中的蓝色荧光粉。
3.单晶硅、锗和信息材料高纯的单晶硅、单晶锗都是很好的半导体材料,但如果掺杂后得到的掺杂半导体,其性能受掺杂的种类和数量控制,应用更为广泛。
(1)P型半导体单晶硅是金刚石型结构,每个Si原子的配位数为4,形成4个Si—Si单键,所以每个Si原子的外层有8个电子。
如果往单晶硅中掺杂质Ga(镓),由于Ga原子价层只有3个价电子,当它取代了硅原子的位置后,Ga原子外层只有7个电子,其中有一个Ga—Si键只有一个电子,即产生了一个空穴,如图6-8(a)所示。
相邻的Si原子价层上电子可移动到空穴,而又留下一个空穴,这相当于空穴在移动。
这种由空穴迁移导电的称为P型半导体。
(2)N型半导体若在单晶硅中掺杂质As(砷),由于As原子外层有5个价电子,当它取代硅原子位置后,成键的As原子外层就有9个价电子,见图6-8(b),多出的一个电子可以激发到导带而导电。
这类由电子移动导电的称为N型半导体。
(3)P-N结单晶硅和单晶锗都可通过掺杂形成P型和N型半导体。
若将单晶硅的一端掺Ga,而另一端掺As,则掺Ga部分形成P型半导体,掺As部分形成N型半导体。
N型和P型半导体的结合处称为P-N结,它具有一种特殊的功能,使电流只能单向导通。
所以P-N结就是一个整流器,它可将交流电转变为直流电,使电流从P-N结的P区流向N区。
利用P-N结可以做成晶体管,P-N-P或N-P-N晶体管都可以将光信号转变为电信号输出,并且还能把光电流放大。
把许许多多的晶体管集成在硅芯片上,做成集成电路,它是现代计算机技术、通信技术、遥控技术、自动化技术的基础。
