物理化学实验报告 表面吸附
物化实验报告 溶液中的吸附作用和表面张力的测定

最大气泡压力法测量溶液中的吸附作用和表面张力摘要:本实验采用最大气泡法测量液体的表面张力。
通过测量不同浓度下正丙醇的表面张力,计算吸附量,求出正丙醇分子的横截面积。
并探讨了表面张力的性质、表面吸附,加深对表面自由能的理解和表面活性剂的了解。
关键词:最大气泡法 表面张力 吸附 横截面积0. 引言在日常生活中, 我们对见到的一些现象可能已经习以为常,比如, 下过雨后, 我们可以见到树叶、草上的小水珠都接近於球形;不小心打碎了体温计后, 里面的水银掉到地上, 小水银滴也呈球形.其实这些现象都与表面张力有关.液体与气体相接触时, 会形成一个表面层, 在这个表面层内存在着的相互吸引力就是表面张力, 它能使液面自动收缩.表面张力是由液体分子间很大的内聚力引起的.处於液体表面层中的分子比液体内部稀疏, 所以它们受到指向液体内部的力的作用, 使得液体表面层犹如张紧的橡皮膜, 有收缩趋势, 从而使液体尽可能地缩小它的表面面积.我们知道, 球形是一定体积下具有最小的表面积的几何形体.因此, 在表面张力的作用下, 液滴总是力图保持球形, 这就是我们常见的树叶上的水滴按近球形的原因.表面张力与我们生活息息相关。
1、实验部分1.1实验原理:物体表面的分子和内部分子所处的境况不同,因而能量也不同,如图11-1,表面层的分子受到向内的拉力,所以液体表面都有自动缩小的趋势。
如要把一个分子由内部迁移到表面,就需要对抗拉力而作功,故表面分子的能量比内部分子大。
增加体系的表面,即增加了体系的总能量。
体系产生新的表面(∆A )所需耗费功(W )的量,其大小应与∆A 成正比。
-W =σ∆A (12-1) 如果∆A =1m 2,则-W =σ,即在等温下形成1m 2新的表面所需的可逆功。
故σ称为单位表面的表面能,其单位为N ·m -1。
这样就把σ看作为作用在界面上每单位长度边缘上的力,通常称为表面张力。
它表示表面自动缩小的趋势的大小。
物理化学实验溶液的表面吸附实验数据、结论和实验报告

实验名称:溶液的表面吸附
实验目的:
用最大气泡压力法测同浓度的醇溶液的表面张力σ,作出σ-c曲线,并计算吸附量;作吸附量Γ对浓度c的曲线,找出最大吸附量Γ∞;掌握最大气泡压力法测定表面张力的原理和技术
实验原理:
当液体中加入溶质时,体表面张力发生变化,随着溶液的浓度变化不同,表面张力发生的变化也不相同。
附加压力与表面张力成正比,与气泡曲率半径成反比,此本实验采用最大气泡压力法测定不同浓度乙醇溶液的表面张力
操作步骤:
数据处理:
<第一部分>
由K=
σ
水
∆p水
,求出仪器常数K=-1.3254,记录室温25℃
根据上图可知该温度下最大吸附量Γ∞为60.5×10−11mol∙cm−2 <第二部分>
由K=
σ
水
∆p水
,求出仪器常数K=-1.3304,记录室温35℃
根据上图可知该温度下最大吸附量Γ∞为55.7×10−11mol∙cm−2
分析与讨论:
1.实验时,确保粗细两毛细管插入液面下的位置一致,且橡胶塞密封完好
2.鼓泡速率不能太快也不能太慢,适宜的速率为5-6秒产生一个气泡。
物理化学-表面张力及表面吸附量的测定-175
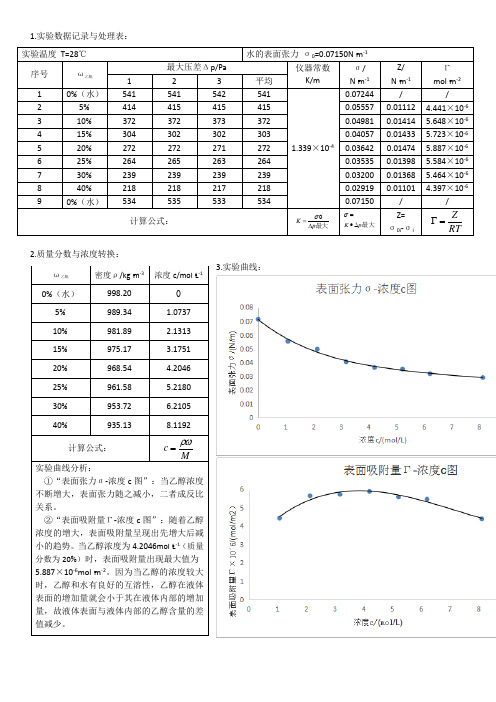
1.实验数据记录与处理表:2.质量分数与浓度转换:3.实验曲线:实验温度 T=28℃ 水的表面张力 σ0=0.07150N ▪m -1序号 ω乙醇 最大压差Δp/Pa仪器常数K/mσ/ N ▪m -1 Z/ N ▪m -1 Γmol ▪m -2 1 2 3 平均 1 0%(水) 541 541 542 541 1.339×10-40.07244 //2 5% 414 415 415 415 0.05557 0.01112 4.441×10-63 10% 372 372 373 372 0.04981 0.01414 5.648×10-6 4 15% 304 302 302 303 0.040570.01433 5.723×10-6 5 20% 272 272 271 272 0.03642 0.014745.887×10-66 25% 264 265 263 264 0.03535 0.01398 5.584×10-67 30% 239 239 239 239 0.03200 0.01368 5.464×10-6 8 40% 218 218 217 218 0.02919 0.01101 4.397×10-6 90%(水)5345355335340.07150/ /计算公式:最大p K ∆=σ最大p K ∆•=σZ= σ0i -σiRTZ=Γ ω乙醇 密度ρ/kg ▪m -3浓度c/mol ▪L -10%(水) 998.20 05% 989.34 1.0737 10% 981.89 2.1313 15% 975.17 3.1751 20% 968.54 4.2046 25% 961.58 5.2180 30% 953.72 6.2105 40%935.138.1192计算公式:Mc ρω=实验曲线分析:①“表面张力σ-浓度c 图”:当乙醇浓度不断增大,表面张力随之减小,二者成反比关系。
分子吸附现象实验报告(3篇)

第1篇一、实验目的1. 了解分子吸附现象的基本原理和实验方法。
2. 掌握利用吸附平衡常数和吸附等温线研究吸附过程的方法。
3. 分析影响分子吸附的因素,如温度、压力、吸附剂性质等。
4. 熟悉吸附实验仪器的操作。
二、实验原理分子吸附是指吸附质分子在固体表面上的吸附。
根据吸附机理,分子吸附可分为物理吸附和化学吸附两种。
物理吸附主要发生在低温和低压下,吸附剂与吸附质之间主要通过范德华力相互作用;化学吸附则发生在高温和高压下,吸附剂与吸附质之间形成化学键。
本实验采用静态吸附法,通过测定吸附平衡时吸附质在吸附剂上的吸附量,研究分子吸附现象。
实验过程中,控制温度、压力等条件,观察吸附等温线的形状,分析吸附过程。
三、实验仪器与试剂1. 实验仪器:吸附仪、吸附柱、吸附剂、吸附质、分析天平、温度计、压力计、计时器等。
2. 实验试剂:活性炭、苯、甲苯、正己烷等。
四、实验步骤1. 准备吸附剂和吸附质:将活性炭用溶剂洗涤、干燥,并称取一定量。
将苯、甲苯、正己烷等吸附质配制成一定浓度的溶液。
2. 吸附实验:将吸附剂装入吸附柱,将吸附质溶液注入吸附柱。
控制温度、压力等条件,观察吸附过程,记录吸附时间。
3. 吸附平衡:当吸附剂达到吸附平衡时,记录吸附时间,测定吸附剂的质量。
4. 计算吸附量:根据吸附剂质量的变化,计算吸附量。
5. 分析吸附等温线:绘制吸附等温线,分析吸附过程。
五、实验结果与讨论1. 实验结果:根据实验数据,绘制吸附等温线,分析吸附过程。
2. 讨论:(1)吸附等温线的形状:本实验中,吸附等温线呈现典型的Langmuir吸附等温线形状,说明吸附过程符合Langmuir吸附模型。
(2)吸附量:随着吸附质浓度的增加,吸附量也随之增加。
当吸附质浓度达到一定值时,吸附量趋于饱和,说明吸附剂具有一定的吸附容量。
(3)温度、压力对吸附的影响:实验结果表明,温度和压力对吸附过程有显著影响。
随着温度的升高,吸附量减小;随着压力的增大,吸附量增大。
固液界面上的吸附实验报告

固液界面上的吸附实验报告固液界面上的吸附实验报告引言固液界面上的吸附现象是物理化学领域中的一个重要研究方向。
通过吸附实验,我们可以了解物质在固液界面上的吸附行为及其影响因素,从而为解决环境污染、材料制备等问题提供理论依据和实验指导。
本报告将介绍我们进行的一系列固液界面吸附实验及其结果。
实验一:吸附剂的选择与影响因素在第一组实验中,我们选择了不同类型的吸附剂,包括活性炭、硅胶和分子筛,并研究了不同因素对吸附效果的影响。
首先,我们对比了不同吸附剂在吸附有机染料溶液中的效果。
结果显示,活性炭对染料的吸附效果最好,其次是硅胶,而分子筛的吸附效果较差。
这可能是由于活性炭具有较大的比表面积和孔隙结构,有利于染料分子的吸附。
同时,我们还发现吸附剂的颗粒大小和形状对吸附效果也有一定影响,颗粒较小的吸附剂表现出更好的吸附性能。
其次,我们研究了溶液初始浓度、pH值和温度对吸附效果的影响。
实验结果表明,随着溶液初始浓度的增加,吸附剂的吸附量也随之增加,但吸附速率却逐渐减慢。
pH值对吸附效果有显著影响,一般情况下,pH值越低,吸附效果越好。
温度的变化对吸附效果的影响较小,但在一定范围内,温度升高可以提高吸附速率。
实验二:吸附动力学与等温吸附模型在第二组实验中,我们研究了吸附动力学和等温吸附模型。
首先,我们进行了吸附动力学实验,通过测定吸附剂对染料的吸附量随时间的变化,得到了吸附速率常数。
结果显示,吸附速率常数随着初始浓度的增加而增大,但随着温度的升高而减小。
这与实验一的结果一致,说明吸附速率受到溶液浓度和温度的影响。
其次,我们使用了Freundlich和Langmuir等温吸附模型来描述吸附过程。
实验数据拟合结果显示,Freundlich模型适用于活性炭和硅胶的吸附过程,而Langmuir模型适用于分子筛的吸附过程。
这说明吸附剂的吸附机制可能有所不同,需要根据具体情况选择适合的模型。
实验三:吸附剂的再生与循环利用在第三组实验中,我们研究了吸附剂的再生与循环利用问题。
溶液表面吸附的测定

溶液表面吸附的测定一、实验目的1、采用最大泡压法测定不同浓度的乙醇水溶液的表面张力2、根据吉布斯吸附公式计算溶液表面的吸附量和乙醇分子的横截面积二、实验原理1、表面自由能 从热力学观点看,液体表面缩小是一个自发过程,这是使体系总的自由能减小的过程。
如欲使液体产生新的表面△A ,则需要对其作功。
功的大小应与△A 成正比:A W ∆=σ-式中σ为液体的表面自由能,亦称表面张力。
它表示了液体表面自动缩小趋势的大小,其量值与液体的成分、溶质的浓度、温度及表面气氛等因素有关。
2、溶液的表面吸附 纯物质表面层的组成与内部的组成相同,因此纯液体降低表面自由能的唯一途径是尽可能缩小其表面积。
对于溶液,由于溶质能使溶剂表面张力发生变化,因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原则,溶质能降低溶剂的表面张力时,表面层溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,表面层中的浓度比内部的浓度低。
这种表面浓度与溶液内部浓度不同的现象叫做溶液的表面吸附。
显然,在指定的温度和压力下,溶质的吸附量与溶液的表面张力及溶液的浓度有关,从热力学方法可知它们之间的关系遵守吉布斯(Gibbs)吸附方程:Tdc dσRTc-Γ⎪⎪⎭⎫ ⎝⎛= 式中:Γ为表面吸附量(单位:mol·m -2);T 为热力学温度(单位:K);c 为稀溶液浓度(单位:mol·dm -3);R 为气体常数。
T dc dσ⎪⎪⎭⎫ ⎝⎛<0,则Γ>0,称为正吸附;Tdc dσ⎪⎪⎭⎫⎝⎛>0,则Γ<0,称为负吸附。
以表面张力对浓度作图,即得到c -σ曲线,在c -σ曲线上任选一点作切线,如图12.1所示,即可得该点所对应浓度c i 的斜率:()T i c d /d σ,图12.1 表面张力与浓度的关系其中: ()T i i c c MN d /d σ-= 则: RT MN /=Γ,根据此式可求得不同浓度下各个溶液的Γ值。
物理化学实验报告-溶液表面张力的测定及等温吸附(2)

p最大 = p大气 − p系统 = ∆p
毛细管内气体压力必须高于大试管内液面上压力的附加压力以克服气泡的表面张力,此附加压力∆p与 表面张力γ成正比,与气泡的曲率半径R成反比,其关系式为:
2γ ∆p = R
如果毛细管半径很小,则形成的气泡基本上是球形的。随着气泡的形成曲率半径逐渐变小,直到形成
装
半球形。这时曲率半径R与毛细管内半径r相等,曲率半径达到最小值。
数字式微压差测量仪当表面张力仪的活塞使水缓慢下滴而减小系统压力这样毛细管内液面上受到一个比试管中液面上大的压力当此压力差在毛细管尖端产生的作用力稍大于毛细管管口液体的表面张力时气泡就从毛细管口逸出这一最大压力差可由数字式微压差测量仪测出
1.精密恒温水槽;2.带有毛细管的表面张力仪; 3.滴液漏斗;4.数字式微压差测量仪
答:实验中,气泡的速度对实验数据有很大的影响。速度过快,会使数据变大。因此,保持相同的气泡速
度对于实验的成败有很大的关系。而实验装置中,随着滴液漏斗中水的不断流出,滴液的速度会减慢,装
置的此处有待改进。另外,毛细管的竖直以及毛细管进入液面的深度,对于测定结果都有一定的影响,实
装
验中应该注意。实验的数据处理也是很关键的一步,对测量结果有较大影响。
=
71.97 280.7
=
0.2564
mN
∙
m−1
∙
Pa−1
2. 求出各浓度正丁醇溶液的表面张力。
γ溶液 = K∆p溶液
表 1 正丁醇溶液表面张力的测定数据记录表
c mol ∙ L−1
0
0.02 0.04 0.06 0.09 0.12 0.16 0.2 0.24
∆pm1 Pa ∆pm2 Pa ∆pm3 Pa ∆pm Pa γ mN ∙ m−1
表面吸附

溶液表面吸附的测定院系:化学与分子工程学院 学号:1200061702 姓名;陈博 组内编号:12组5号 实验日期:2014年12月17日星期三P =102.54-102.46 kPa T =18.5-18.2 ℃摘要:本实验使用恒温槽控温,U 型管压力计来测量压力,实验通过测量毛细管尖端产生的气泡的最大压力,来计算正丁醇溶液的表面张力,做出γ-c 图,利用非线性拟合和做切线的方法得到正丁醇溶液的饱和表面吸附量2(6.040.00)mol m μ-∞Γ=±,每个分子在表面占有的面积20.2750.000q nm =±。
本文还对实验中可能在成误差的原因进行分析和讨论,认为引起实验误差的因素主要有拟合误差,气压计零点差,毛细管尖端位置,毛细管是否垂直,毛细现象,温度,压力,其中主要误差来源于毛细管尖端的位置。
【实验目的】1、测定不同浓度的正丁醇水溶液的表面张力,根据吸附公式计算溶液表面的吸附量以及饱和吸附是每个分子所占的表面积。
2、通过最大气泡压力的测定,了解气泡压力与半径以及表面张力的关系。
【实验原理】当溶液中加入某种溶质的时候,液体的表面张力就会升高或降低,对于同一溶质来说,其变化的多少与溶液浓度有关。
1、 液体中加入溶质时,其表面张力会变化,定量的用Gibbs 吸附公式来描写d dcγΓ⨯c =-RT 其中γ是表面张力,其物理意义是在一定温度下,液体表面积增加1m 2所需的功。
当Γ>0时,d dcγ<0,称为正吸附,即增加浓度时,溶液的表面张力下降,表面层的浓度大于溶液内部的浓度,这种物质称为表面活性剂。
2、 以γ对c 作图,得到γ=f (c )的等温曲线,如图1所示:过其上任意一点a 作切线,那么d z dcγ=-,从而有: z RTΓ=图1 表面吸附等温曲线3、Γ与c 的关系服从Langmuir 等温式,即 1Kc Kc ∞Γ=Γ+,由此推出1c c K ∞∞=+ΓΓΓ 因此,作cΓ-c 图后,其斜率的倒数即为∞Γ。
固体吸附物化实验报告

1. 了解固体吸附的基本原理和吸附过程。
2. 掌握吸附实验的基本操作和数据处理方法。
3. 研究不同吸附剂对同一吸附质的吸附性能差异。
4. 分析影响吸附效果的因素。
二、实验原理固体吸附是指吸附质分子在固体表面的吸附现象。
根据吸附质和吸附剂之间的相互作用,吸附可分为物理吸附和化学吸附。
物理吸附是由于分子间范德华力引起的,吸附过程是可逆的;化学吸附是由于吸附质与吸附剂之间形成化学键,吸附过程是不可逆的。
本实验采用活性炭作为吸附剂,以某种有机物为吸附质,研究活性炭对有机物的吸附性能。
实验过程中,通过改变吸附剂用量、吸附时间、吸附温度等因素,探讨其对吸附效果的影响。
三、实验材料与仪器1. 实验材料:(1)活性炭:颗粒状,比表面积大,吸附性能好。
(2)有机物溶液:浓度为1.0×10^-3 mol/L。
(3)pH缓冲溶液:pH值为7.0。
2. 实验仪器:(1)恒温水浴锅(2)分析天平(3)移液管(4)锥形瓶(5)分光光度计(6)磁力搅拌器1. 准备吸附剂:称取一定量的活性炭,用去离子水清洗,于105℃下烘干至恒重。
2. 配制吸附质溶液:将有机物溶解于pH值为7.0的缓冲溶液中,配制成1.0×10^-3 mol/L的溶液。
3. 吸附实验:分别取不同量的活性炭于锥形瓶中,加入一定量的有机物溶液,置于恒温水浴锅中,设定不同的吸附时间,在磁力搅拌下进行吸附实验。
4. 测定吸附量:在吸附实验结束后,取出锥形瓶,用分光光度计测定溶液中有机物的浓度,根据吸附前后浓度的变化计算吸附量。
5. 分析吸附效果:根据吸附量与吸附剂用量、吸附时间、吸附温度等因素的关系,分析吸附效果。
五、实验结果与分析1. 吸附剂用量对吸附效果的影响:实验结果表明,随着吸附剂用量的增加,吸附量也随之增加,但达到一定量后,吸附量增加幅度减小。
这是因为吸附剂表面吸附位点有限,当吸附剂用量过多时,吸附位点趋于饱和。
2. 吸附时间对吸附效果的影响:实验结果表明,随着吸附时间的延长,吸附量逐渐增加,但达到一定时间后,吸附量增加幅度减小。
表面吸附量的测定

实验十二 表面吸附量的测定一、 实验目的1、 用气泡最大压力法测定十六烷基三甲基溴化铵水溶液的表面张力。
从而计算溶液在某一浓度C 时的表面吸附量Γ; 2、 学会使用表面张力试验组合装置; 3、 学会σ对lnC 作图求Γ。
二、 实验原理1、 在指定温度下,纯液体的表面张力是一定的,如果在液体中加入溶质而成溶液时,情况就发生了变化。
我们说溶液的表面张力不仅与温度有关,而且也与溶液的种类,溶液浓度有关。
这是由于溶液中部分溶质分子进入到溶液表面,使表面层的分子组成发生了改变,分子间引力起了变化,因而表面张力也随着改变,根据实验结果证明,加入溶质以后表面张力发生改变的同时还发现溶液表面层的浓度与内部浓度有何差别,有些溶液表面层浓度大于溶液内部浓度,有些恰恰相反,这种现象称为溶液浓度表面吸附作用。
按吉布斯吸附等温式Cd d RTdcd RTC ln 1σσ∙-=∙-=Γ,其中Γ代表溶液浓度为C 时的表面吸附量(mol/cm 2),C 代表平衡时溶液浓度(mol/1),R 为气体常数(8315×107mol ·K ),T 为吸附时的温度。
由上(1)式可看出,在一定温度时,溶液表面吸附量Γ是与平衡时溶液浓度C 和表面活度dcd σ或cd d ln σ成正比关系。
当dcd σ<0时,Γ>0,表示溶液表面张力随浓度增加而降低,则溶液表面发生正吸附。
我们把能产生显著正吸附的物质(即有显著降低溶液表面张力的物质)称为表面活性物质。
本实验用表面活性物质十六烷基三甲基溴化铵配制成一系列不同浓度的水溶液,分别测定这些溶液的表面张力σ,然后以σ对lgC 作图,得一曲线,求曲线上某一点的斜率(d σ/dlgC ),可计算相应于该点浓度时溶液的表面吸附量Γ。
2、 本实验测定各溶液的表面张力采用气泡最大压力法,此法原理的当毛细管与液面相接触时,由毛细管内加压(或在溶液体系内减压)则可以在液面的毛细管出口处形成气泡。
中国科大物化实验9 溶液中的吸附作用和表面张力的测定报告

2、实验试剂: 名称 蒸馏水 正丁醇
参数 分析纯
三、实验步骤
1、毛细管常数的测定 按实验装置图装好仪器,打开恒温水浴,使其温度稳定于 25℃。取一支浸 泡在洗液中的毛细管依次次用自来水、蒸馏水反复清洗若干次,同样把玻璃套管 也清洗干净,加上蒸馏水,插上毛细管,用套管下端的开关调节液面恰好与毛细 管端面相切,使样品在其中恒温 10 分钟。在分液漏斗中加入适量的自来水,注 意切勿使体系漏气。然后调节分液漏斗下的活塞使水慢慢滴下,这时体系压力逐 渐减小,直至气泡由毛细管口冒出,细心调节出泡速度,使之在 5-10 秒钟内出 一个。 注意气泡爆破前数字式微压差测量仪的读数,并用电脑采集数据得到最大 的压差值,求平均值而得 hH 2 O 。根据手册查出 25℃时水的表面张力为=71.97 ×10-3N·m-1,以/h=K 求出所使用的毛细管常数,此值控制在 8cm 左右为宜, 否则毛细管太粗误差较大,毛细管太细,易堵塞,气泡很难逸出。 2、不同浓度的正丁醇溶液表面张力的测定 用 2mL 移液管分别移取 0.40ml、0.80ml、1.20ml、1.60ml、2.00ml、2.40ml、 2.80ml 正丁醇到 100ml 容量瓶中,然后稀释到刻度。重复上述实验步骤,按照 由稀至浓的顺序依次进行测量。求得一系列浓度的正丁醇溶液的h。 本实验的关键在于溶液浓度的准确性和所用毛细管、恒温套管的清洁程度。 因此除事先用热的洗液清洗它们以外, 每改变一次测量溶液必须用待测的溶液反 复洗涤它们, 以保证所测量的溶液表面张力与实际溶液的浓度相一致。并控制好 出泡速度、平稳地重复出现压力差。而不允许气泡一连串地出。洗涤毛细管时切 勿碰破其尖端,影响测量。 温度对该实验的测量影响也比较大,实验中请注意观察恒温水浴的温度, 溶 液加入测量管后恒温 10min 后再进行读数测量。
物理化学实验报告讲义溶液表面张力及吸附分子横截面积的测定

实验33 溶液表面张力及吸附分子横截面积的测定预习要求1. 液体表面张力的概念。
2. 溶质对溶液表面张力的影响的类型。
3. 测定表面张力在恒温槽中进行的原因。
4. 思考本实验中测标准样品的表面张力的目的。
实验目的1. 学习用最大气泡压力法测定溶液的表面张力。
2. 了解吉布斯方程在溶液表面吸附中的实验应用。
3. 了解溶液表面吸附分子的横截面积的测量方法。
实验原理1.表面张力σ与溶液表面的过剩物质的量Γ表面张力,也称为比表面自由能,即单位表面积的表面分子比体相分子多余的能量。
表面张力是液体的重要特性之一,与温度、压力、组成和共存的另一相有关。
纯液体的体相与表面相的组成相同,因此在温度、压力不变时,纯液体降低表面张力的唯一途径是尽量缩小表面积。
而对溶液,溶质的种类和浓度都会影响表面张力。
溶质对溶液表面张力的影响有三种情况:①溶质浓度增加引起溶液表面张力增大;②溶质浓度增加引起溶液表面张力减小;③少量溶质使溶液的表面张力急剧减小,当达到某一临界浓度时,溶液的表面张力几乎不变,见图3-20。
根据能量最低原则,能降低溶液表面张力的物质,其在表面相的浓度必然大于在体相的浓度,否则反之。
这种表面相的浓度与体相浓度不同的现象,叫“吸附”。
在指定的温度和压力下,定量地描述这一规律的方程是Gibbs 等温吸附方程:()c RT c ΓTd d σ-= (3-35) 式中,Γ 为表面过剩物质的量(mol·m -2)。
对某些溶液(如电解质溶液),式中的浓度c 要用活度a 代换。
当(d σ/d c )T >0,Γ<0,称为负吸附(图3-20曲线①);当(d σ/d c )T <0,Γ>0,称为正吸附(曲线②③)。
本实验研究正吸附的情况。
只要获得了溶液表面张力随溶质浓度的变化曲线,就可用微分法得到某一浓度下的(d σ/d c )T,然后依据式(3-35)得到表面过剩物质的量Γ。
2.饱和表面过剩物质的量与吸附分子的横截面积在一定温度下,若溶质在溶液表面是单分子层吸附,则表面过剩物质的量Γ与溶液浓度之间的关系可由Langmuir 等温式表示:Kc1Kc ΓΓ+=∞ (3-36) Γ∞ 为饱和表面过剩物质的量,K 为经验常数,与溶质的性质有关。
物理化学实验报告讲义溶液表面张力及吸附分子横截面积的测定

实验33 溶液表面张力及吸附分子横截面积的测定预习要求1. 液体表面张力的概念。
2. 溶质对溶液表面张力的影响的类型。
3. 测定表面张力在恒温槽中进行的原因。
4. 思考本实验中测标准样品的表面张力的目的。
实验目的1. 学习用最大气泡压力法测定溶液的表面张力。
2. 了解吉布斯方程在溶液表面吸附中的实验应用。
3. 了解溶液表面吸附分子的横截面积的测量方法。
实验原理1.表面张力σ与溶液表面的过剩物质的量Γ表面张力,也称为比表面自由能,即单位表面积的表面分子比体相分子多余的能量。
表面张力是液体的重要特性之一,与温度、压力、组成和共存的另一相有关。
纯液体的体相与表面相的组成相同,因此在温度、压力不变时,纯液体降低表面张力的唯一途径是尽量缩小表面积。
而对溶液,溶质的种类和浓度都会影响表面张力。
溶质对溶液表面张力的影响有三种情况:①溶质浓度增加引起溶液表面张力增大;②溶质浓度增加引起溶液表面张力减小;③少量溶质使溶液的表面张力急剧减小,当达到某一临界浓度时,溶液的表面张力几乎不变,见图3-20。
根据能量最低原则,能降低溶液表面张力的物质,其在表面相的浓度必然大于在体相的浓度,否则反之。
这种表面相的浓度与体相浓度不同的现象,叫“吸附”。
在指定的温度和压力下,定量地描述这一规律的方程是Gibbs 等温吸附方程:()c RT c ΓTd d σ-= (3-35) 式中,Γ 为表面过剩物质的量(mol·m -2)。
对某些溶液(如电解质溶液),式中的浓度c 要用活度a 代换。
当(d σ/d c )T >0,Γ<0,称为负吸附(图3-20曲线①);当(d σ/d c )T <0,Γ>0,称为正吸附(曲线②③)。
本实验研究正吸附的情况。
只要获得了溶液表面张力随溶质浓度的变化曲线,就可用微分法得到某一浓度下的(d σ/d c )T,然后依据式(3-35)得到表面过剩物质的量Γ。
2.饱和表面过剩物质的量与吸附分子的横截面积在一定温度下,若溶质在溶液表面是单分子层吸附,则表面过剩物质的量Γ与溶液浓度之间的关系可由Langmuir 等温式表示:Kc1Kc ΓΓ+=∞ (3-36) Γ∞ 为饱和表面过剩物质的量,K 为经验常数,与溶质的性质有关。
物化实验报告-表面张力的测定

溶液中的吸附作用和表面张力的测定一、实验目的1、 掌握最大气泡法和滴重法测定表面活性物质正丁醇的表面张力,并且利用Gibbs 吸附公式和Langmuir 吸附等温式测定正丁醇分子的横截面积。
2、 训练学生利用毛细管和数字式微压测量仪以及滴重管测定表面张力的方法,并通过曲线及直线拟合处理得到不同数据。
3、 培养学生在实验中严谨的实验作风和态度,并对学生的科研兴趣进行初步的指导。
二、实验原理1. 物体表面分子和内部分子所处的境遇不同,表面层分子受到向内的拉力,所以液体表面都有自动缩小的趋势。
如果把一个分子由内部迁移到表面,就需要对抗拉力而做功。
在温度、压力和组成恒定时,可逆地表面增加dA 所需对体系做的功,叫表面功,可以表示为:W dA δσ'-=式中σ为比例常数。
σ在数值上等于当T 、p 和组成恒定的条件下增加单位表面积所必须对体系做的可逆非膨胀功,也可以说是每增加单位表面积时体系自由能的增加值。
环境对体系作的表面功转变为表面层分子比内部分子多余的自由能。
因此,σ称为表面自由能,其单位是焦耳每平方米(J/m 2)。
若把σ看作为作用在界面上每单位长度边缘上的力,通常称为表面张力。
从另外一方面考虑表面现象,特别是观察气液界面的一些现象,可以觉察到表面上处处存在着一种张力,它力图缩小表面积,此力称为表面张力,其单位是牛顿每米(N/m )。
表面张力是液体的重要特性之一,与所处的温度、压力、浓度以及共存的另一相的组成有关。
纯液体的表面张力通常是指该液体与饱和了其本身蒸气的空气共存的情况而言。
2、 纯液体表面层的组成与内部层相同,因此,液体降低体系表面自由能的唯一途径是尽可能缩小其表面积。
对于溶液则由于溶质会影响表面张力,因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原则,溶质能降低溶剂的表面张力时,表面层中溶质的浓度应比溶液内部来得大。
反之溶质使溶剂的表面张力升高时,它在表面层中的浓度比在内部的浓度来得低,这种表面浓度与溶液内部浓度不同的现象叫“吸附”。
物理化学实验报告-表面吸附

物理化学实验报告溶液表面吸附的测量1.实验目的(1)掌握最大气泡压力法测定溶液表面张力的方法。
(2)根据Gibbs 吸附方程式,计算溶质(乙醇)在单位溶液表面的吸附量Γ,并作Γ−c 图。
2.实验原理在定温下,纯物质液体的表面层与本体(内部)组成相同,根据能量最低原理,为降低体系的表面吉布斯自由能,将尽可能地收缩液体表面。
对溶液则不同,加入溶质后,溶剂表面张力发生变化。
根据能量最低原理,若溶质降低溶剂表面张力,c (表面层)> c (本体);反之,若溶质升高表面张力,c (表面层)<c (本体)。
溶质在溶液表面层与在溶液本体中浓度不同的现象称为溶液的表面吸附,即溶液借助于表面吸附来降低表面吉布斯自由能。
溶液表面吸附溶质的量Γ与表面张力σ、浓度c 有关,其关系符合Gibbs 吸附方程T cRT c )(∂∂-=Γσ式中:Γ吸附量;c 溶液浓度;T 温度;R 气体常数;σ表面张力或表面吉布斯自由能。
T c)(∂∂σ表示在一定温度下,表面张力随浓度的变化率。
如果溶液表面张力随浓度增加而减小,即(∂σ∂c )<0,Γ>0,此时溶液中溶质在表面层中的浓度大于在溶液中的浓度,称为正吸附。
相反,Γ<0,称为负吸附。
在一定温度下,测定不同浓度溶液的表面张力σ,以σ对c 作图,求不同浓度时的T c)(∂∂σ值。
由Gibbs 吸附方程求各浓度下的吸附量Γ。
对于求各点斜率值可以借助计算机软件。
测定液体表面张力的方法较多,如最大气泡压力法,滴体积法,毛细管升高法,环法等,本实验采用最大气泡压力法。
将待测液体装入表面张力仪中,使玻璃毛细管下端与液面相切,若液体能润湿管壁,则液体沿毛细管上升形成凹液面,其液面所受压力P ’为大气压力P 0和附加压力ΔP 。
根据拉普拉斯(Laplace )方程:∆P =2σr式中:r 为弯曲液面曲率半径;σ为液体与气体表面(界面)张力。
因是凹液面,弯曲液面的曲率半径r <0,ΔP <0(指向大气)。
物理化学实验报告-溶液中的吸附作用和表面张力的测定实验报告

实验十二溶液中的吸附作用和表面张力的测定摘要:本实验采用最大气泡压力法测定了液体表面张力,通过对不同浓度下正丙醇溶液的表面张力研究其和浓度之间的关系。
初步探讨了表面张力的性质、表面能的意义以及表面张力和吸附作用的关系。
关键词:吸附作用、表面张力、最大气泡法The measurement of the adsorption effect andsurface tensionAbstract:In this experiment, according to Gibbs formula and Langmuir equal-temperature equation, we apply the biggest bladder pressure method to research the relationship between the amount of absorption and the consistency of a substance in the solution besides the surface tension. The phenomenon show that the consistency of a substance in the surface of the solution is different from that inside is called absorption.Keyword:Surface tension, The biggest bubble pressure method, Absorption effect1. 序言物体表面的分子和内部的分子所处的境况不同,因此能量也不同,表面张力就是内部分子对表面分子的作用力,它是液体的重要属性之一,与所处的温度、压力、液体的组成共存的另一面的组成等因素都有关。
对于溶液,由于溶质会影响表面张力,因此可以调节溶质在表面层的浓度来降低表面自由能。
溶液表面吸附的测定

溶液表面吸附的测定一、实验目的1、采用最大泡压法测定不同浓度的乙醇水溶液的表面张力2、根据吉布斯吸附公式计算溶液表面的吸附量和乙醇分子的横截面积二、实验原理1、表面自由能 从热力学观点看,液体表面缩小是一个自发过程,这是使体系总的自由能减小的过程。
如欲使液体产生新的表面△A ,则需要对其作功。
功的大小应与△A 成正比:A W ∆=σ-式中σ为液体的表面自由能,亦称表面张力。
它表示了液体表面自动缩小趋势的大小,其量值与液体的成分、溶质的浓度、温度及表面气氛等因素有关。
2、溶液的表面吸附 纯物质表面层的组成与内部的组成相同,因此纯液体降低表面自由能的唯一途径是尽可能缩小其表面积。
对于溶液,由于溶质能使溶剂表面张力发生变化,因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原则,溶质能降低溶剂的表面张力时,表面层溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,表面层中的浓度比内部的浓度低。
这种表面浓度与溶液内部浓度不同的现象叫做溶液的表面吸附。
显然,在指定的温度和压力下,溶质的吸附量与溶液的表面张力及溶液的浓度有关,从热力学方法可知它们之间的关系遵守吉布斯(Gibbs)吸附方程:Tdc d σRTc-Γ⎪⎪⎭⎫ ⎝⎛= 式中:Γ为表面吸附量(单位:mol·m -2);T 为热力学温度(单位:K);c 为稀溶液浓度(单位:mol·dm -3);R 为气体常数。
T dc d σ⎪⎪⎭⎫ ⎝⎛<0,则Γ>0,称为正吸附;Tdc d σ⎪⎪⎭⎫⎝⎛>0,则Γ<0,称为负吸附。
以表面张力对浓度作图,即得到c -σ曲线,在c -σ曲线上任选一点作切线,如图12.1所示,即可得该点所对应浓度c i 的斜率:()T i c d /d σ,图12.1 表面张力与浓度的关系其中: ()T i i c c MN d /d σ-= 则: RT MN /=Γ,根据此式可求得不同浓度下各个溶液的Γ值。
表面吸附量的测定

实验十九 表面吸附量的测定预习题1.为什么表面活性物质水溶液的表面张力随溶液浓度的变化而变化?2.用气泡最大压力法测表面张力时,为什么气泡必须均匀缓慢冒出?3.为什么毛细管端要刚好与液面接触?若毛细管端浸入溶液,则使最大压力差变大还使变小?为什么?4.毛细管常数如何测定?5.表面吸附量Γ的物理意义是什么?6.浓度为4.00×10-4 mol·L -1时的溶液表面吸附量如何得到?此表面吸附量的单位是什么?7.分析影响本实验结果的因素有哪些?一.实验目的1.用气泡最大压力法测定十六烷基三甲基溴化铵水溶液的表面张力。
从而计算溶液在某一浓度时表面吸附量Γ。
2.熟悉斜管压力计的使用方法。
二.实验原理1.在指定的温度下,纯液体的表面张力是一定的,一旦在液体中加入溶质成溶液时情况就不同了,溶液的表面张力不仅与温度有关,而且也与溶质的种类,溶液浓度有关。
这是由于溶液中部分分子进入到溶液表面,使表面层的分子组成也发生了改变,分子间引力起了变化,因此表面张力也随着改变,根据实验结果,加入溶质以后在表面张力发生改变的同时还发现溶液表面层的浓度与内部浓度有所差别,有些溶液表面层浓度大于溶液内部浓度,有些恰恰相反,这种现象称为溶液的表面吸附作用。
根据吉布斯吸附等温式12.303lg cd d RTdc RT d cσσΓ=-=- (1) 式中,Γ代表溶液浓度为c 时的表面上溶质的吸附量(mol·m -2),c 代表平衡时溶液浓度(mol·L -1),R 为理想气体常数(8.314 J·mol -1·K -1),T 为吸附时的温度(K )。
从(1)式可看出,在一定温度时,溶液表面吸附量与平衡时溶液浓度c 和表面张力随浓度变化率d dcσ成正比关系。
当0d dcσ<时,Γ > 0表示溶液表面张力随浓度增加而降低,则溶液表面发生正吸附,此时溶液表面层浓度大于溶液内部浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学实验报告
溶液表面吸附的测量
1.实验目的
(1)掌握最大气泡压力法测定溶液表面张力的方法。
(2)根据Gibbs 吸附方程式,计算溶质(乙醇)在单位溶液表面的吸附量Γ,并作Γ−c 图。
2.实验原理
在定温下,纯物质液体的表面层与本体(内部)组成相同,根据能量最低原理,为降低体系的表面吉布斯自由能,将尽可能地收缩液体表面。
对溶液则不同,加入溶质后,溶剂表面张力发生变化。
根据能量最低原理,若溶质降低溶剂表面张力,c (表面层)> c (本体);反之,若溶质升高表面张力,c (表面层)<c (本体)。
溶质在溶液表面层与在溶液本体中浓度不同的现象称为溶液的表面吸附,即溶液借助于表面吸附来降低表面吉布斯自由能。
溶液表面吸附溶质的量Γ与表面张力σ、浓度c 有关,其关系符合Gibbs 吸附方程
T c
RT c )(∂∂-
=Γσ
式中:Γ吸附量;c 溶液浓度;T 温度;R 气体常数;σ表面张力或表面吉布斯自由能。
T c
)(
∂∂σ表示在一定温度下,表面张力随浓度的变化率。
如果溶液表面张力随浓度增加而减小,即(∂σ
∂c )<0,Γ>0,此时溶液中溶质在表面层中的浓度大于在溶液中的浓度,称为正
吸附。
相反,Γ<0,称为负吸附。
在一定温度下,测定不同浓度溶液的表面张力σ,以σ对c 作图,求不同浓度时的T c
)(∂∂σ
值。
由Gibbs 吸附方程求各浓度下的吸附量Γ。
对于求各点斜率值可以借助计算机软件。
测定液体表面张力的方法较多,如最大气泡压力法,滴体积法,毛细管升高法,环法等,本实验采用最大气泡压力法。
将待测液体装入表面张力仪中,使玻璃毛细管下端与液面相切,若液体能润湿管壁,则液体沿毛细管上升形成凹液面,其液面所受压力P ’为大气压力P 0和附加压力ΔP 。
根据拉普拉斯(Laplace )方程:
∆P =
2σr
式中:r 为弯曲液面曲率半径;σ为液体与气体表面(界面)张力。
因是凹液面,弯曲液面的曲率半径r <0,ΔP <0(指向大气)。
当打开漏斗的活塞,让水缓慢滴入下面密封的加压瓶中,毛细管内液面上受到比毛细管外液面上更大的压力,毛细管内液面开始下降。
当此压力差在毛细管上面产生的作用稍大于毛细管口液体的表面张力所能产生的最大作用时,气泡就从毛细管口逸出。
气泡逸出前能承受的最大压力差为ΔPmax ,可以由微压差计测出。
根据拉普拉斯方程,毛细管内凹液面的曲率半径等于毛细管的半径r 时,能承受的压力差最大。
则有
r
P σ
2max =
∆
max 2
P r
∆=
σ
测定毛细管的半径r 和ΔPmax 即可求得液体表面张力σ。
直接测定毛细管半径r 容易带入较大的误差,可用同一支毛细管,在相同条件下分别测出已知表面张力为σ1的参考液体的ΔPmax,1和待测液体的ΔPmax ,由③式得
1
max,1max 22P P r ∆=
∆=
σσ
max 1
max,1
P P ∆∆=
σσ
由上式可求出其它液体的表面张力σ。
3.仪器与试剂
微差压测量仪
恒温槽
表面张力仪
滴管
烧杯
容量瓶
无水乙醇
4.实验步骤
(1)配制溶液:根据实验所要求的不同浓度的溶液称取不同质量的无水乙醇。
(2)按照实验要求连接仪器。
设定恒温槽温度为30摄氏度,通入恒温水。
(3)在表面张力仪中加入适量去离子水,恒温10分钟以上。
通过表面张力仪下端的活塞调节液面高度,使毛细管下端与液面相切。
(4)将毛细管与乳胶管连接断开,将毛细管内外用吹气法处理干净,将毛细管连入整个装置,盖紧活塞。
按下微差压计的置零键,再将乳胶管与毛细管连接好。
(5)缓慢打开漏斗活塞,是水滴慢慢滴下,毛细管此时上方的压力不断增大,之后毛细管口开始出现气泡,待气泡形成稳定后,在微差压测量计读取压力的最大值,读数三次,取平均值。
(6)使用上述方法,将去离子水换成不同浓度的溶液。
在更换溶液时必须洗刷表面张力仪3次,并且将毛细管内外吹干净。
每次更换的溶液都必须保证恒温10分钟以上。
(7)实验完毕,整理仪器。
5.实验数据
水在30℃下表面张力为71.18( mN*m−1)
0123
456
30
354045505560657075c/mol*l
上图为σ−c 曲线图
1
2
3
4
5
6
0.0040
0.0045
0.0050
0.0055
0.0060
Y A x i s T i t l e
X Axis Title
此图为Γ-c 曲线图
6.数据分析
本次试验的误差来源有如下几项
(1)无水乙醇是一种极易挥发的物质,尽管在称量时我们可以先加入一些水以防止乙醇挥发,但是挥发还是在所难免的,所以可能会对溶液浓度造成一定影响。
(2)毛细管与液面相切也会引起误差,因为肉眼并不能准确判断是否相切,而毛细管如果插入稍深,则会影响读数。
(3)在洗涤仪器时所引起的误差,包括洗涤表面张力仪,还有处理毛细管时都可能有少量的之前测量溶液的残留。
7.思考题
(1)实验前为什么一定要确保表面张力仪和毛细管的洁净?
主要是为了保证再加入溶液后不会出现杂质,不会影响溶液本身的浓度,而且毛细管的洁净也是为了使气泡更均匀。
(2)为什么不直接测毛细管的半径,而用标定的方法?
毛细管的半径非常小,直接测量必然会带来很大的误差,而通过其他测量值来算毛细管的半径则可以很好的避免这种误差。
