碳族元素练习题
高三一轮复习碳及碳的化合物
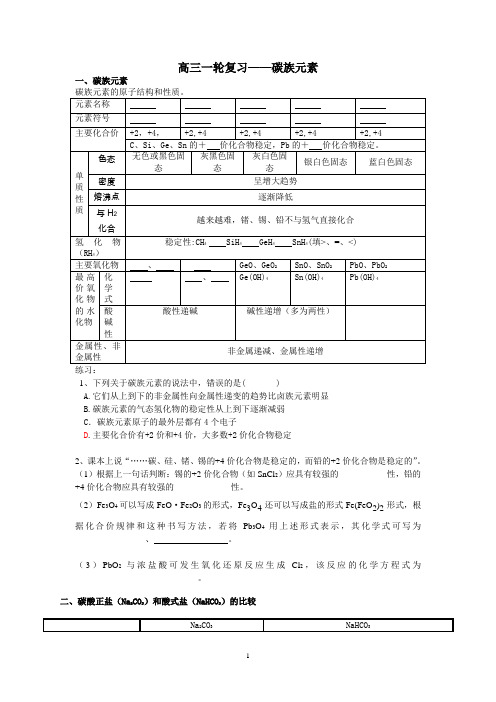
高三一轮复习——碳族元素一、碳族元素1、下列关于碳族元素的说法中,错误的是( )A.它们从上到下的非金属性向金属性递变的趋势比卤族元素明显B.碳族元素的气态氢化物的稳定性从上到下逐渐减弱C .碳族元素原子的最外层都有4个电子D .主要化合价有+2价和+4价,大多数+2价化合物稳定2、课本上说“……碳、硅、锗、锡的+4价化合物是稳定的,而铅的+2价化合物是稳定的”。
(1)根据上一句话判断:锡的+2价化合物(如SnCl 2)应具有较强的___________性,铅的+4价化合物应具有较强的_____________性。
(2)Fe 3O 4可以写成FeO ·Fe 2O 3的形式,Fe 3O 4还可以写成盐的形式Fe(FeO 2)2形式,根据化合价规律和这种书写方法,若将Pb 3O 4用上述形式表示,其化学式可写为______________ 、 。
(3)PbO 2与浓盐酸可发生氧化还原反应生成Cl 2,该反应的化学方程式为____________________________。
二、碳酸正盐(Na 2CO 3)和酸式盐(NaHCO 3)的比较23a、用酚酞做指示剂,达到滴定终点时发生的反应为:b、用甲基橙做指示剂,达到滴定终点时发生的反应为:,典型例题[例1]下列关于碳族元素的说法正确的是()A.单质都是无色晶体B.单质中硅单质熔点最高C.碳族元素形成的化合物种类最多D.在化合物中最稳定的化合价都是+4价[例2]门捷列夫在19世纪中叶,曾根据他所发现的周期律,预言过第四周期第ⅣA族元素X(当时称为类硅)。
下列有关类硅的元素性质,不正确的是()A.XH4不稳定,但有强还原性B.可用焦炭在高温下从XO2中冶炼XC.X单质的熔点比硅高D.X(OH)4的酸性比H2SiO3强[例3]若发现了114号新元素X, 则有关X元素及其化合物的叙述正确的是: ( )(A)X有稳定的气态氢化物(B)X的最高正价氧化物的化学式为XO2(C)X为非金属元素(D)X的低价氧化物是酸性氧化物[例4]下列饱和溶液中,通入过量二氧化碳气体,肯定没有沉淀产生的是()①氢氧化钠②碳酸钠③硅酸钠④次氯酸钙⑤氯化钙A、①⑤B、①②C、④⑤D、③④[例5]某种混合气体,可能含有N2、HCl、CO,常温下,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都有没有变化,再将其通过足量的过氧化钠固体,气体体积减小,最后混合气体通过红热的铜丝网,经充分反应后气体体积又减少,但仍有剩余气体,以下对混合气体组成的判断正确的是()A、一定没有氮气,至少有一氧化碳和氯化氢中的一种B、一定有氮气,一氧化碳和氯化氢C、一定有氮气,一氧化碳和氯化氢至少有其中的一种D、一定有氮气和氯化氢,没有一氧化碳【真题演练】1.(2002上海15)将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是()A B C D2、(2003全国理综8)某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。
碳族元素

(二)碳的氧化物(CO2和CO)
1、CO2(1)物性:无色无味,密度比空气 大的气体,能溶于水,固体CO2称“干冰” (2)化学性质:a、具有酸性氧化物的通性 b、弱氧化性:CO2+C=2CO 点燃 CO2+2Mg==2MgO+C (3)制取:工业上煅烧石灰石 : 高温 CaCO3==CaO+CO2 实验室:CaCO3+2HCl=CaCl2+CO2+H2O 固体+液体-气(不加热)可启普发生器及 简易装置
练习:某无色溶液可能由Na2CO3 、MgCl2 、 NaHCO3 、BaCl2 中的一种或几种混合而成.往 溶液中加入烧碱溶液出现白色沉淀 ,加入稀 H2SO4 也出现白色沉淀,并放出气体,据此分 析,下述组合判断中正确的是 ( B ) ① 肯 定 有 BaCl2 ② 肯 定 有 MgCl2 ③ 肯 定 有 NaHCO3 ④肯定有Na2CO3 或NaHCO3 ⑤肯定 无MgCl2 A、① ② ⑤ B、① ③ C、② ④ D、① ③ ⑤
从左到右酸性减弱、碱性增强
CH4 SiH4
-
-
-
从左到右稳定性减弱
3、单质的物理性质(见P148)
思考1:根据元素周期律的知识,Pb的金属性比Sn强, 而在金属活动性顺序表中,Sn的活动性却比Pb强,这 是否矛盾?
不矛盾。在金属活动性顺序表中,是指金属单质在水溶液中失 去电子的能力;而元素周期表中指元素原子失电子能力强弱。
碳族元素性质递变规律
元素符号 原子半径的变化 金属性、非金属 性变化 最高正价 最高价氧化物化 学式 对应水化物化学 式及酸碱性强弱 氢化物化学式及 稳定性
C
Si
Ge
Sn
Pb
从左到右逐渐增加
中山大学无机化学第13章碳族元素习题及答案

第13章 碳族元素一、选择题13-1 硅甲烷与甲烷的性质对比中,下列说法正确的是: ( ) (A) 硅甲烷与碱溶液作用放出氢气,甲烷则不然 (B) 硅甲烷的沸点比甲烷高(C) 在空气中,硅甲烷的着火温度比甲烷低(D) 硅甲烷不与氯气反应,而甲烷可与氯气发生反应 答案: D13-2 在下列有关稳定性的叙述中正确的是: ( ) (A) (B) (C) (D)答案: C13-3 天然硅酸盐是岩石的基本成份,它的基本结构单元是: ( ) (A) 分子 (B) 正四面体 (C) 平面三角形(D)共用顶点的两个正四面体答案: B13-4 分子筛用来筛选混在一起的大小不同的分子,它是沸石型不溶性的: ( ) (A) 碱土金属硅酸盐 (B) 碱土金属铝酸盐 (C) 碱土金属碳酸盐 (D) 铝硅酸盐 答案: D13-5 下列理论能解释碳酸盐热稳定性变化规律的是: ( ) (A) 分子轨道理论 (B) 价键理论 (C) 离子极化理论 (D) 晶体场理论 答案: C13-6 将氯化亚锡和二氯化铅进行对比,下列说法不正确的是: ( ) (A)比更易溶于水233323H CO >CaCO >Ca(HCO )>CaSiO 323323Ca(HCO )>CaCO >CaSiO >H CO 333223CaSiO >CaCO >Ca(HCO )>H CO 333223CaCO >CaSiO >Ca(HCO )>H CO 2SiO 4SiO 2-2SiO 6-7SiO 2SnCl 2PbCl(B)比更易水解(C) 氯化汞可将氧化,但不能将氧化(D)及都是常用的还原剂答案:A13-7 下列说明不正确的是: ( ) (A) 酸性依次增强 (B) 碱性依次增强(C) 均显两性 (D)只显碱性,只显酸性答案: D二、计算题和问答题 13-8 如何除去:(1)氮气中的一氧化碳或一氧化碳中的氢气; (2)一氧化碳中的二氧化碳; (3)二氧化碳中的二氧化硫。
高中化学竞赛辅导无机元素练习题

(1)确定A的结构简式。写出生成A的化学反应方程式。
(2)在室温或高于室温的条件下,A能定量地分解,产生B和C。已知B的阳离子的价电子总数比C的价电子总数少4。试确定B的结构简式,写出B中阴、阳离子各中心原子的杂化形态。
3为什么NF3常温不水解,而NCl3常温可以水解?写出水解产物。
九、回答下列关于磷的问题:
高中化学竞赛练习(无机化学主族元素)
第一章卤素
一、于酸性溶液中混合等物质的量的KBrO3和KI,生成哪些氧化还原产物,它们的物质量的比是多少?
(2)用漂白粉漂白物料时,常采用以下步骤:将物料浸入漂白粉溶液,然后暴露在空气中;将物料浸在稀盐酸中;将物料浸在大苏打溶液中,最后取出放在空气中干燥;试说明每一步处理的作用,并写出有关的反应方程式。
(2)石硫合剂在空气中与H2O及CO2作用又生成具有杀虫作用的S,写出分步的反应方程式。
四.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。
1.氯化亚砜分子的几何构型是;中心原子采取杂方式,
是(等性、不等性)杂化。
2.写出亚硫酸钙和五氯化磷共热,制备氯化亚砜反应的化学方程式
3.氯化亚砜在有机化学中用作氯化剂,写出乙醇和氯化亚砜反应的化学方程式
1.写出N2O4在登月飞船的液体推进系统中所发生主要反应的方程式;
2.说明N2O4分子中N原子的杂化方式和成键情况;
3.画出偏二甲肼的构型。
4.写出我国长征系列火箭二元推进剂反应的化学方程式。
5.偏二甲肼可用二甲胺被亚硝酸氧化、再用锌还原来制备,写出各步反应方程式。
2008年 高三化学第一轮复习: 高化学第一轮复习 课题39 第七章 碳族元素

高三化学第一轮复习:高: 课题39 第七章碳族元素第二讲硅及其化合物一、复习目标:1.掌握硅和二氧化硅的性质。
2、了解新型无机非金属材料。
二.知识回顾(一)硅及其化合物1.硅〈1〉硅的存在在自然界中,硅全部以____态存在,是构成矿物和岩石的主要成分。
在地壳中,硅的含量在所有元素中居第__位,仅次于氧。
〈2〉、硅的物理性质单质硅有晶体硅和无定形硅两种。
晶体硅是___色、有___光泽、脆而硬的固体,是良好的___材料。
〈3〉硅的化学性质(1)常温下硅的化学性质稳定,但能和氟、HF、强碱(NaOH)发生反应。
①硅和氟气反应生成四氟化硅气体,化学方程式为:。
②硅和氢氟酸反应生成四氟化硅,放出学方程式为:。
③硅与NaOH溶液作用生成硅酸钠,反应的化学方程式为:(2)在加热条件下,硅能和某些非金属单质发生反应。
①硅与氧气在加热时反应生成二氧化硅程式为。
②硅和C12在加热条件下反应生成四氯化硅的化学方程式为:〈4〉硅的制取:自然界中没有游离态的硅,常见的化合态的硅有和等。
工业上,用焦炭在电炉中还原二氧化硅得到含有少量杂质的粗硅。
反应的化学方程式:。
在该反应中,氧化剂是,还原剂。
2、二氧化硅(1)物理性质:二氧化硅广泛存在于自然界中,沙子、石英的主要成分就是二氧化硅,SiO2不溶于水,熔点、硬度。
水晶、石英是二氧化硅晶体。
(2)二氧化硅出化学性质①酸性氧化物的性质:Si02是酸性氧化物,是的酸酑,于水。
常温下Si02与NaOH溶液反应得到硅酸钠(Na2SiO3),反应的化学方程式为:高温下Si02能和碱性氧化物(如CaO)反应生成硅酸盐,反应的化学方程式为②常温下,SiO2能与氢氟酸(HF)反应,此反应常用于刻蚀玻璃,反应的化学方程式为:。
③二氧化硅的弱氧化性:Si02高温下与C作用可制取粗硅,反应的化学方程式为:_(3)二氧化硅的用途 :①Si02是制造光导纤维的主要。
②Si02常被用来制造石英表中的压电材料(3)Si02用于制造各种例3、硅酸(1)硅酸(H2Si03)硅酸不溶于水,其酸性比碳酸的酸性___。
第九讲 碳族元素复习学案、教案、习题

第九讲碳族元素复习主讲人车琳高考考点1、掌握碳族元素在周期表中的位置及其性质的关系2、了解碳、硅的单质及某些氧化物、氢化物、碳酸盐、硅酸盐的性质3、了解金刚石、石墨、晶体硅、二氧化硅的结构和性质。
4、了解碳的氧化物对大气的污染及其防治,初步了解粉尘对环境及人类健康的影响。
本讲序列【阅读议点】一、概述碳族元素包括、、、、,位于第于它们位于和之间,故容易形成化合物,不易形成化合物。
常见化合物有 +4和+2,其中:+4价较稳定的元素是 , +2价较稳定的元素是。
二、碳1、同素异形体⑴金刚石:色体形晶体,构型 ,键角,硬度,导电。
⑵石墨:色不透明状固体, 金属光泽,滑腻,结构,导电。
⑶无定形碳:包括炭黑、木炭、活性炭、焦炭。
⑷C60:“足球烯”2、化性⑴稳定性:⑵可燃性: C+O2─⑶还原性: CuO+ C —C+ H2O(气) ─C+ FeO—C+ S —C+ SiO2 —C+ HNO3(浓)—C+ CO2 ─⑷既作氧化剂,又作还原剂: C+ CaO ──C+ SiO2──三、一氧化碳1、物性:___色___味气体,___溶于水,比空气___,___毒,是因为。
2、化性:⑴可燃性:CO+ O2─ (蓝色火焰)⑵还原性: CO+ CuO ─CO+ H2O(气) ─3、实验室制法四、二氧化碳1、物性: 色 味的 体, 毒,比空气 ,扩散慢, 溶于水(1:1) 其固体俗称 ,易 。
2、化性:(指出各反应在实际生产中的应用) ⑴不能燃烧,不支持燃烧,不支持呼吸。
⑵酸性氧化物:CO 2+H 2O H 2CO 3 H ++HCO 3-CO 2+ Na 2O ─ CO 2+ CaO ── CO 2 + NaOH ─ 用于_________ CO 2 + Ca(OH)2 ─ 用于_________CO 2 + Na 2CO 3+ H 2O ─ CO 2 + CaCO 3 + H 2O ─ CO 2 + NH 3 + H 2O ─ CO 2 + NH 3 + NaCl+ H 2O ─ ⑶实验室制法原理:装置: 收集: 干燥: 检验: 吸收:五、碳酸及其盐1、碳酸(H 2CO 3):___挥发,___分解,二元弱酸(HAc>H 2CO 3>C 6H 5OH) 指出:①碳酸盐除K + .Na + .NH 4+盐外,一般不溶于水,碳酸氢盐均可溶 ; ②Al 2(CO 3)3、Al(HCO 3)3等一般不存在。
初中化学元素周期表练习题及答案

初中化学元素周期表练习题及答案1. 以下不属于主族元素的是:a) 碳b) 铜c) 锌d) 铝答案: b) 铜2. 下列元素中,原子序数最小的是:a) 氧b) 氢c) 氮d) 锂答案: b) 氢3. 元素周期表中,横行被称为:a) 周期b) 纵行c) 族d) 分组答案: a) 周期4. 下列元素中,能形成正离子的是:a) 氯b) 溴c) 氧d) 氖答案: a) 氯5. 元素周期表中第一周期有几个元素?a) 4b) 6c) 8d) 2答案: d) 26. 下列元素中,化学性质相似的是:a) 镁、铝、硅b) 碳、氧、氮c) 钾、钙、铷d) 锌、铁、铜答案: b) 碳、氧、氮7. 具有类似电子结构的元素在元素周期表中位于同一:a) 周期b) 族c) 分组d) 列答案: a) 周期8. 具有相同周期的元素,其原子核中的电子层数:a) 相等b) 不相等c) 无法确定d) 取决于元素种类答案: a) 相等9. 在元素周期表中,第一周期元素是:a) 碱金属b) 碱土金属c) 非金属d) 惰性气体答案: a) 碱金属10. 具有不完全填满外层电子层的元素,其化学性质更倾向于成为:a) 阴离子b) 阳离子c) 氧化剂d) 物质答案: b) 阳离子总结:元素周期表是化学中重要的工具,帮助我们理解和组织化学元素。
通过掌握元素周期表的基本知识,我们可以更好地理解元素的性质和周期规律。
希望以上练习题能够帮助您巩固对元素周期表的了解。
元素符号练习题初三

元素符号练习题初三化学是一门研究物质的科学,其中元素符号是化学语言中的基本单位。
了解元素符号是初中化学学习的基础,帮助学生更好地理解元素周期表和化学反应。
在这篇文章中,我们将提供一些元素符号练习题,以帮助初三学生巩固对元素符号的掌握。
练习题一:选择题1. 下列元素符号中,不是属于金属元素的是:A. FeB. CuC. SiD. Al2. 氧元素的符号是:A. OB. OnC. OxD. N3. 符号Hg代表的是:A. 铁B. 氧C. 水银D. 氮4. 下列元素符号中,是指代同一元素的是:A. Na,NB. C,CaC. S,SnD. O,H5. 氮元素所属的族别是:A. 碱金属B. 卤素C. 碱土金属D. 稀有气体练习题二:填空题1. 氧元素的符号是__2. 铁元素的符号是__3. 碳元素的符号是__4. 氢元素的符号是__5. 钠元素的符号是__解答:练习题一:选择题1. C. Si2. A. O3. C. 水银4. D. O,H5. D. 稀有气体练习题二:填空题1. 氧元素的符号是 O2. 铁元素的符号是 Fe3. 碳元素的符号是 C4. 氢元素的符号是 H5. 钠元素的符号是 Na通过以上练习题,希望能够帮助初三学生更好地掌握元素符号。
掌握元素符号,有助于我们更好地理解化学概念、学习元素周期表以及进行化学方程式的书写与解题。
化学是一门实践和理论相结合的学科,通过不断地练习和学习,我们可以更好地探索和理解物质的性质及其变化过程。
碳族元素——硅及其重要的化合物

碳族元素——硅及其重要的化合物【考纲要求】了解硅及其化合物的主要性质和重要应用【复习目标】了解硅及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响。
【复习重点】硅及其化合物的性质、用途【课堂热身】1、下列各项叙述的解释原因相同的是()①NaOH溶液不能用带玻璃塞的试剂瓶保存;②Na2SiO3溶液要密封保存;③酸式滴定管不能装NaOH溶液;④氢氟酸不能盛放在玻璃瓶中。
A.①② B.①③ C.①④ D.②③2、常温下不能与单质硅反应的是( )A.O2 B. F2 C. HF溶液 D. NaOH溶液3、除去SiO2中混有的石灰石和生石灰,下列试剂中最适宜的是() A.盐酸 B.NaOH溶液 C.水玻璃 D.浓硫酸【考点梳理】1、硅的单质(1)硅元素的含量与存在在地壳里,硅的含量在所有元素中居第位,仅次于,全部以态形式存在,是构成矿物和岩石的主要元素。
(2)硅晶体的结构与主要物理性质晶体,具有 体的空间网状结构; 色,有金属光泽;硬度 ,熔沸点 ,但都低于金刚石,是良好的半导体材料。
(3)硅的化学性质(4)高纯硅的制法2、二氧化硅(1)晶体结构与物理性质晶体结构:晶体二氧化硅是硅原子和氧原子以键形成的晶体,因此二氧化硅硬度,熔点,导电,溶于水。
(2)二氧化硅的化学性质3、硅酸及硅酸盐4、硅酸盐工业(1)水泥原料:。
生产设备:。
主要成分:。
(2)玻璃原料:。
生产设备:。
反应原理:。
主要成分:。
(3)陶瓷主要原料:。
5、无机非金属材料(1)分类:①传统无机非金属材料:水泥、玻璃、陶瓷等硅酸盐材料。
②新型无机非金属材料:半导体材料、超硬耐高温材料、发光材料等。
(2)新型无机非金属材料的特性①耐高温、强度高;②具有电学特性;③具有光学特性;④具有生物功能。
(3)重要的新型无机非金属材料:①高温结构陶瓷(有氧化铝陶瓷:又称人造刚玉,具有熔点很高、硬度高的优点。
可用于作坩埚、高温炉管、球磨机、高压钠灯的灯管等。
碳族元素复习

二、硅及化合物 1、硅(Si)
在自然界中,没游离态的硅, 以化合态存在, 在地壳中含量 居第二位。
Si
晶体硅的晶体结构与金刚石相似,正四面 体向周围空间延伸形成空间网状的结构。 但由于硅原子半径比碳原子半径大,所以, 其熔沸点要比金刚石低,硬度要比金刚石 小。
Si化学 性质
常温下,硅的化学性质不活泼, 除氢氟酸、氟气、强碱外 与F2
所选装置
操作方法
将CO2的试管的 橡皮塞打开 通过分液漏斗向 CO2气体的集气瓶 a中加入NaOH溶液 向a瓶中通入 CO2气体 将滴管中NaOH溶 液挤入烧瓶中
B
C D E
实验现象 水槽中NaOH 溶液上升到 试管中
b瓶中的NaOH 溶液不能排 入烧杯中 b中无气泡 冒出 产生喷泉 现象
某无色混合气体中可能含有H2、CO、CO2、HCl、NH3 及水蒸气中的两种或多种,当混合气体依次通过: (1)澄清石灰水(无浑浊现象);(2)氢氧化钡 (有浑浊现象);(3)浓硫酸(无现象);(4) 灼热氧化铜(变红色);(5)无水硫酸铜(变蓝 色)。试分析该混合气体中肯定有___________, 肯定没有______________,可能有______________。
高温
高温
Si+C == SiC
硅的制备
+C
SiO2 高温 粗硅
+Cl2
高温
SiCl4
精馏+H2 高温
Si
1、 SiO2+2C ==
高温
高温
2CO+Si
(含杂质的粗硅) SiHCl3+H2
2、 Si+2Cl2 == SiCl4 或
高温 Si+3HCl(气)==
大学生化学元素周期表复习题及答案

大学生化学元素周期表复习题及答案一、复习题1. 元素周期表是什么?它的历史背景是什么?2. 描述元素周期表的结构和布局。
3. 什么是周期?什么是周期表中的主周期和副周期?4. 以下元素属于同一周期的是:氢(H)、锂(Li)、鈹(B)、碳(C)、氮(N)、氧(O)、氟(F)、氦(He)。
请写出它们所属的主周期和副周期。
5. 以下元素属于同一族的是:氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)、钍(Th)、钫(Fm)。
请写出它们所属的族。
6. 根据元素周期表来判断,铍(Be)和锌(Zn)谁的原子半径更大?为什么?7. 氮(N)的电子构型是1s²2s²2p³。
请判断氮(N)是金属、非金属还是半金属。
8. 中子数、原子序数和电子数分别代表什么?9. 请写出以下元素的化学符号和它们的原子序数:铁、铜、镁、锰、钠、磷、铝。
10. 拼写出以下元素名称的正确拼写:铝、镍、钨、铒、亚铜、碘、氘。
二、答案1. 元素周期表是元素根据原子序数、原子构型和化学性质等规律排列而成的表格。
它的历史背景可追溯到19世纪初,由德国化学家门德莱夫根据元素的性质和周期性规律提出了最早的元素周期表。
2. 元素周期表的结构由水平周期和竖直族组成。
水平周期代表元素的周期数,竖直族代表元素的性质和化学反应规律。
元素周期表通常由一系列方格组成,每个方格代表一个元素,按照原子序数从左上角到右下角依次排列。
3. 周期是指原子核周围电子排布的规律性重复出现。
主周期是指1至7周期,副周期是指1至4副周期。
主周期和副周期之间的区别在于主周期内元素的化学性质和电子结构更为相似,而副周期内元素的性质相对较为离散。
4. 主周期和副周期的划分依据原子序数,根据元素周期表可以得出:氢(H)、锂(Li)、鈹(B)、碳(C)、氮(N)、氧(O)、氟(F)、氦(He)属于第1周期。
5. 氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)、钍(Th)、钫(Fm)属于第16族。
武汉大学、吉林大学《无机化学》(第3版)笔记和课后习题(含考研真题)详解-碳族元素(圣才出品)

十万种考研考证电子书、题库视频学习平台
第 15 章 碳族元素
15.1 复习笔记
碳族元素包括碳、硅、锗、锡和铅 5 种元素,价电子层结构为 ns2np2。其碳和硅是非 金属元素,其余三种是金属元素。
一、碳族元素通性
1.惰性电子对效应:C、Si +4 氧化态稳定,Pb 是+2 氧化态稳定。
2.碳族元素的单质 (1)碳的同素异形体 ①金刚石属立方晶系,是典型的原子晶体,其中 C 以 sp3 杂化轨道与其它原子相连,形 成了牢固的 C-C 键。金刚石晶体透明、折光、耐腐蚀且不导电,室温下,金刚石对所有的化 学试剂都显惰性。其硬度是所有物质中最大的,可达 10000 kg/mm2,俗称钻石,除用作 装饰品外,还用于制造钻探用的钻头和磨削工具。 ②石墨很软,呈灰黑色,密度较金刚石小,熔点比金刚石略低,具有层向的良好导电导 热性,容易沿层方向滑动裂开,常用来制作电极、润滑剂、铅笔等。 (2)硅、锗、锡、铅单质
③锡有三种同素异形体:
灰锡(α) ⎯286⎯K→白锡(β) ⎯434⎯K→脆锡(γ)
性质活泼, Sn + 2HCl(热、浓) = SnCl2 + H2↑
3Sn + 8HNO3(冷、稀) = 3Sn(NO3)2 + 2NO↑+ 4H2O Sn + 4HNO3(浓) = H2SnO3(SnO2·H2O)↓+ 4NO2↑+ H2O
2 / 23
圣才电子书 十万种考研考证电子书、题库视频学习平台
①单质硅的晶体结构类似于金刚石,熔点 1683 K,呈灰黑色,有金属外貌,性硬脆; 低温下稳定,不与水、空气和酸作用,但与强氧化剂和强碱溶液作用。
②锗是灰白色的脆性金属,结构为金刚石型,原子晶体,比 Si 活泼,能溶于氧化性酸 得到 Ge(Ⅳ),难溶于 NaOH,不与空气中的 O2、H2O、非氧化性酸作用。高纯锗也是较 好的半导体材料。
碳族元素知识要点复习题.doc

碳族元素知识要点复习题碳族元素递变性、特性,未知元素性质推导例1:下了关于碳族元素的递变规律不正确的是A自上而下元素的金属性逐渐增强B从上到下气态氢化物的稳定性依次增强C从上到下元素单质颜色逐渐变浅D从上到下元素单质的熔沸点逐渐升高例2:对于碳族元素下列说法不正确的是A自然界中有游离态的碳,没有游离态的硅B从上到下气态氢化物的稳定性依次减弱C除铅外,碳族元素均以+4价化合物较为稳定D只能形成共价化合物,不能形成离子化合物例3:对于碳族元素下列说法不正确的是A碳族元素的金属性比同周期氧族元素的金属性强B碳族元索的单质通常状况下都能导电C自然界中存在碳族元素中某元素的气态氢化物D碳族元素在自然界中都可以游离态存在例4:关于硅的化学性质的叙述中,正确的是A常温时不和任何酸反应B常温时硅与卤素单质均不反应C单质硅比金刚石熔点低D单质硅比碳的非金属性强例5:如果发现114号新元素X,则下列可能具有的性质合理的是A X是非金属元素B X有稳定的纽化物C X的+2价化合物比+4价化合物稳定D X02具有强氧化性例6:下列关于元素的叙述中,能够说明X一定位于IV A族的是A最高正价与最低负价绝对值相等B最高价氧化物的水化物为弱酸C单质晶体是-•种半导体材料D原子最外层有4个电子氧化物性质例1:关于碳和硅的氧化物叙述中,不正确的是A氧化物不一定能跟氢氧化钠反应B氧化物都能溶于水生成相应的酸C最高价氧化物都是相应酸的酸酊D氧化物在常温下不一定是气体例2:关于SiO?和CO?叙述中,不正确的是A都不能和酸反应B都能和碱反应C Si02由原子构成,CO?由分了构成D 都是酸性氧化物同素异形体例1:下列关于C60的叙述不正确的是A是一种新的化合物B与石墨、金刚石都是碳的同素异形体C其中只含有共价键D在空气中燃烧不一定生成C02 例2:能证明金刚石和石墨是同素异形体的正确解释是A两者在一定条件下可以相互转化B两者几乎有相同的熔点C在氧气中充分燃烧都只生成CO? D两者的晶体结构相同例3:根据反应:石墨二金刚石-1.894kJ, nJ'以得出的结论是A石墨比金刚石稳定B金刚石转化为石墨,能量升高C反应为物理变化D此反应为氧化还原反应原子半径、还原性、氧化性、稳定性比较例1:下列各组顺序的排列不正确的是A 原子半径:CVSiVGcVSnB 热稳定性:CHQSiHAGcH.QSnHiC 酸性强弱:H2CO3<H2SiO3<H.PO1 <H;:SO3D 还原性:CHiVSiHjVGeH’VSnHd物质用途例1:下列有关物质的用途错误的是A SiO?制光纤B Si和Gc制半导体C钢化玻璃制汽车窗玻璃D氮化硅陶瓷做导热剂E水玻璃作粘合剂例2:下列有关物质的用途错误的是A高温结构陶瓷可以制作耐酸设备B氧化铝陶瓷不可用于制作耐酸设备C氮化硅陶瓷可以制作轴承D光导纤维可以用于传像、照明Si、Si。
碳族练习题

碳族元素练习题1.下列说法正确的是()答案:DA. SiO2是酸性氧化物,它溶于水,不溶于酸B. SiO2是制造玻璃的主要原料之一,它在常温下不与NaOH溶液反应C. 电脑芯片的主要成分是SiO2D. CO2通入水玻璃中可以得硅酸答案:B2.硅及其化合物在材料领域中应用广泛。
下列叙述中不正确...的是()A、硅单质可用来制造太阳能电池B、硅单质是制造玻璃的主要原料C、石英(SiO2)可用来制作工艺品D、二氧化硅是制造光导纤维的材料3.下列说法正确的是( )答案:DA.Na2O2、Na2O均能吸收CO2并放出氧气B.Mg、Al、Fe均能在冷的浓硝酸中钝化C.SO2和Cl2的漂白原理相同D.SiO2既能与NaOH又能与Na2CO3反应生成Na2SiO34.甲试管中盛有0.5mol/L Na2CO3溶液10mL,慢慢往试管中加入1mol/L的盐酸7.0mL;乙试管中盛有1mol/L 的盐酸7.0mL,慢慢往试管中滴加0.5mol/L Na2CO3溶液10mL,那么甲、乙两试管中产生的CO2物质的量大小关系为答案:CA.甲=乙B.甲>乙C.甲<乙D.无法确定5.烧杯中盛有液态物质A,加入少量固体物质B,B不溶解。
当通入气体C时发现B逐渐溶解直至完全溶解。
则A、B、C依次为答案:BA.H2O、BaSO4、O2B.FeCl2溶液、Fe粉、Cl2C.H2O、CaCO3、SO3气体D.H2O、SiO2、HCl气体6.铅的冶炼大致过程如下①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O22PbO+2SO2;③制粗铅:PbO+C Pb+CO;PbO+CO Pb+CO2。
下列说法正确的是答案:DA.浮选法富集方铅矿的过程属于化学变化B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbOC.整个冶炼过程中,制取1molPb共转移2mol电子D.将1molPbS冶炼成Pb理论上至少需要6g碳7.日本东京电力公司4月6日宣布,在注入俗称“水玻璃”的硅酸钠溶液等各种阻水材料后,6日凌晨确认已阻答案:B止污水从福岛核电站继续流出。
碳族元素

碳族元素1.碳族元素(1)碳族元素的特征在元素周期表中,碳族元素处在从活泼金属(IA)向活泼非金属(ⅦA)过渡的中间位置,其最外层电子数为4,既不容易失去电子,又不容易得到电子,所以碳族元素的成键特点是易形成共价键,难形成离子键。
这一特点以碳、硅最为典型,碳族元素从非金属性向金属性递变最为明显,是元素周期律和物质结构理论的典型体现。
碳族元素形成的非金属单质为原子晶体,在同周期中硬度最大(石墨例外),熔沸点最高(如金刚石、晶体硅)。
硅在地壳中含量仅次于氧,晶体硅是一种良好的半导体材料。
(2)碳族元素的化合价碳族元素的主要化合价有+2、+4,其中铅+2价稳定,其余元素+4价稳定。
价态的稳定与否,能很好地帮助我们判断物质的氧化性、还原性及稳定性。
如铅的+2价稳定,则铅的+4价的化合物不稳定。
易在氧化还原反应中生成稳定价态的+2价化合物而表现出强的氧化性;又如CO中的碳为+2价,而其+4价更稳定,则CO不如CO2稳定而有较强的还原性。
(3)碳族元素的性质及递变规律在元素周期表中,碳族元素位于活泼金属向活泼非金属过渡的中间位置,其最外层电子数为4,在性质相似的同时,从上到下电子层数增多,原子半径增大,原子核对最外层电子的吸引能力减弱,失电子的能力增强,从上到下由非金属递变为金属的变化非常典型,即由C→Pb,元素的非金属性逐渐减弱、金属性逐渐增强。
其中碳、硅是非金属,锗是半导体材料,锡、铅是金属。
碳族元素,随着原子序数逐渐增大,非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱,最高价氧化物对应水化物的酸性逐渐减弱。
气态氢化物的稳定性:CH4>SiH4>GeH4最高价氧化物对应水化物的酸性:H2CO3>H2SiO3>H4GeO4(4)碳族元素在自然界里的存在在自然界里,碳的存在形式有游离态和化合态两种;硅在地壳上主要以硅酸盐矿石的形式存在;锗是不常见的金属;锡和铅两种金属都以化合态的形式存在。
(5)单质的性质:碳族元素的单质在室温下都是固体、颜色各不相同。
高三新高考化学大一轮专题练习:碳族元素及其化合物

高三新高考化学大一轮专题练习:碳族元素及其化合物一、单选题1.(2023春·陕西西安·高一西安市第八十五中学校考阶段练习)在实验室中,下列试剂的保存方法正确的是①浓硝酸保存在棕色广口瓶内①Na保存在CCl4中(Na与CCl4不反应、不互溶,且CCl4的密度大于Na)①HF溶液保存在塑料瓶中①AgNO3固体保存在棕色试剂瓶内①白磷保存在冷水中A.①①①B.①①①C.①①①①D.①①①2.(2022秋·陕西西安·高二统考期末)无论是传统的或是新型的无机非金属材料,硅元素都占有非常重要的地位。
由于硅在太阳能发电中的重要作用,有些科学家称硅是“二十一世纪的能源”。
下列关于硅说法正确的是A.自然界中硅单质的含量居各元素的第二位B.高纯度的硅是制半导体的重要材料C.水泥、玻璃、陶瓷、光导纤维都是传统的硅酸盐工业产品D.石英砂属于天然的硅酸盐产品3.(2023春·陕西宝鸡·高一统考期中)下列关于硅及其化合物的说法,错误的是A.二氧化硅是半导体材料,硬度大,可用于制造光导纤维B.利用焦炭制备粗硅的化学方程式为:SiO2+2C 高温Si+2CO↑C.不能用带玻璃瓶塞的试剂瓶盛放NaOH溶液D.硅胶多孔,吸附水分能力强,常用作实验室和袋装食品的干燥剂4.(2023春·陕西宝鸡·高一统考期中)化学与生产、生活、科技息息相关,下列叙述错误的是A.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成B.华为首款5G手机搭载了“麒麟980”手机芯片的主要成分是二氧化硅C.小苏打是面包发酵粉的主要成分之一D.水玻璃可用作制备木材防火剂的原料5.(2023春·辽宁沈阳·高一校联考期中)材料化学在航空航天中应用广泛,近期我国在航天领域取得了举世瞩目的成就,下列说法正确的是A.“神舟十五号”载人飞船使用了高性能耐烧蚀树脂,其主要成分是硅酸盐A.A B.B C.C D.D8.(2023春·陕西西安·高一长安一中校考期中)2022年,我国具有独立知识产权的“龙芯”20岁了。
高考考点完全解读 练习 答案 21、碳族元素.碳及其化合物

21、碳族元素.碳及其化合物1.复习重点1.碳族元素原子结构的特点、碳族元素化合价为正四价和正二价;2.碳族元素的性质及其递变规律;3.碳和硅的性质、用途。
2.难点聚焦3 硅及其化合物的特性高温也能发生。
1. Si的还原性大于C,但C却能在高温下还原出Si:↑2++COSiO2CSi210. Na2SiO3的水溶液称水玻璃,但它与玻璃的成分大不相同,硅酸钠水溶液(即水玻璃)俗称泡花碱,但它却是2盐的溶液,并不是碱溶液。
2. 非金属单质跟碱液作用一般无2H 放出,但Si 却放出H 2:↑+=++232222H SiO Na O H NaOH Si ↑+↑=+2424H S i F HF Si3. 非金属单质一般不跟非氧化性酸作用,但Si 能与HF 作用:4. 非金属单质一般为非导体,但Si 为半导体。
5. SiO 2是的酸酐,但它不溶于水,不能直接将它与水作用制备H 2SiO 3。
6. 非金属氧化物的熔沸点一般较低,但SiO 2的却很高。
7. 酸性氧化物一般不与酸作用,但SiO 2能跟HF 作用:↑+↑=+24224H SiF HF SiO8. 无机酸一般易溶于水, 却难溶于水。
9. 因H 2CO 3的酸性大于H 2SiO 3,所以在Na 2SiO 3溶液中通入CO 2能发生下列反应:32322232CO Na SiO H O H CO SiO Na +↓=++, 但在高温下↑++232232CO SiO Na SiO CO Na 高温4 硅与碱溶液的反应特点硅与强碱溶液反应的实质是什么?究竟哪种物质是氧化剂?根据化学方程式:↑+=++232222H SiO Na O H NaOH Si进行分析,似乎NaOH 和O H 2都是氧化剂,其实不然。
上述反应实际分两步进行↑+∆+244224H SiO H O H Si ①O H SiO Na NaOH SiO H 2324432+=+ ②其中反应①为氧化还原反应,反应②为非氧化还原反应。
无机化学教学资料——碳族和硼族元素练习

碳族和硼族元素练习一、选择题( 共17题34分)1. (7643)与Na2CO3溶液作用全部都生成碱式盐沉淀的一组离子是……………………()(A) Mg2+,Al3+,Co2+,Zn2+ (B) Fe3+,Co2+,Ni2+,Cu2+(C) Mg2+,Mn2+,Ba2+,Zn2+ (D) Mg2+,Mn2+,Co2+,Ni2+2. (7462)下列说法不正确的是……………………………………………………………()(A) SiCl4在与潮湿的空气接触时会冒“白烟”(B) NF3因会水解,不能与水接触(C) SF6在水中是稳定的(D) PCl5不完全水解生成POCl33. (3718) 铅蓄电池在充电时,阳极反应是……………………………………………()(A) PbSO4 + H2O = PbO2 + 4H+ + SO-24+ 2e-(B) Pb + SO-24= PbSO4 + 2e-(C) PbSO4 + 2e-= Pb + SO-24(D) PbO2 + 4H+ + SO-24+ 2e-= PbSO4 + 2H2O4. (0545) 已知在一定温度下SnO2(s) + 2H2(g)Sn(s) + 2H2O(g) K c= 21.0CO(g) + H2O(g)CO2(g) + H2(g) K c= 0.0340因此下列反应SnO2(s) + 2CO(g)Sn(s) + 2CO2(g) 的K c值………………………()(A) 21.0 (B) 0.714 (C) 0.0243 (D) 21.15. (7476)分离SnS和PbS,应加的试剂为…………………………………………………()(A) 氨水(B) 硫化钠(C) 硫酸钠(D) 多硫化铵6. (7475)鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)7. (7466)下列分子中,C与O之间键长最短的是…………………………………………()(A) CO (B) Ni(CO)4(C) CO2(D) CH3COOH8. (7363)将过量SiF4通入NaOH溶液中,主要产物是……………………………………()(A) H4SiO4,NaF (B) Na2SiO3,NaF (C) Na2SiO3,Na2SiF6(D) SiO2,HF9. (4370)下列说法不正确的是…………………………………………………………()(A)HCO3-可通过氢键形成双聚离子(B) NaHCO3的热稳定性不如NaCO3高(C) BeCO3在热水中就可发生分解(D) 所有碱金属碳酸盐都是易溶于水的10. (4308) CO32-的几何构型是………………………………………………………()(A) 平面三角形(B) 三角锥形(C) T形(D) 直线形11. (1460) 下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………()(A) SnS (B) SnS2(C) PbS (D) Bi2S312. (1456) 试判断Ge、Sn、Pb 分别与浓HNO3作用时,正确的说法是………………()(A) 三元素都被氧化成+2价(B) 三元素都被氧化成+4价(C) Ge和Sn被氧化成+4价,但Pb却被氧化成+2价(D) Ge被氧化成+4价,但Sn和Pb只却被氧化成+2价13. (1451) IV A族元素从Ge到Pb;下列性质随原子序数的增大而增加的是…………()(A) +2氧化态的稳定性(B) 二氧化物的酸性(C) 单质的熔点(D) 氢化物的稳定性14. (7354)从分子轨道理论出发,可以认为在B2分子中存在的化学键是………………()(A) 三中心二电子键(B) 一个σ键(C) 二个单电子π键(D) 一个σ键和一个π键15. (4403) BF 3通入过量的Na 2CO 3溶液,得到的产物是……………………………( ) (A) HF 和H 3BO 3 (B) HBF 4和B(OH)3 (C) NaBF 4和NaB(OH)4 (D) HF 和B 4O 3 16. (4333) 下列含氧酸中属于三元酸的是…………………………………………… ( ) (A) H 3BO 3 (B) H 3PO 2 (C) H 3PO 3 (D) H 3AsO 4 17. (1478) 铝在空气中燃烧时,生成……………………………………………………( ) (A) 单一化合物Al 2O 3 (B) Al 2O 3和Al 2N 3 (C) 单一化合物Al 2N 3 (D) Al 2O 3和AlN二、填空题 ( 共18题 36分 )18. (1509)将适量的SnCl 2溶液加入HgCl 2溶液中,有____________产生,其化学反应方程式为:__________________________________________________________。
碳族元素练习题

碳族元素一、选择题(每题只有一个选项符合题意)一、选择题(每题只有一个选项符合题意) 1.下列叙述正确的是.下列叙述正确的是 A 、自然界中存在大量的单质硅、自然界中存在大量的单质硅B 、石英、水晶、硅石的主要成份都是二氧化硅、石英、水晶、硅石的主要成份都是二氧化硅C 、二氧化硅的化学性质活泼、溶于水形成难溶的硅酸、二氧化硅的化学性质活泼、溶于水形成难溶的硅酸D 、自然界的二氧化硅都存在在水晶矿中、自然界的二氧化硅都存在在水晶矿中 2.下列物质能直接用作半导体材料的是.下列物质能直接用作半导体材料的是 A 、金刚石、金刚石B 、石墨、石墨C 、晶体硅、晶体硅D 、水晶、水晶3.下列物质中不与水反应的是.下列物质中不与水反应的是 A 、SiO 2B 、CO 2C 、SO 2D 、CaO4.在通风良好,燃烧正旺的煤炉中,下列反应最不容易发生的是.在通风良好,燃烧正旺的煤炉中,下列反应最不容易发生的是5.下列不属于新型无机非金属材料的是.下列不属于新型无机非金属材料的是 A 、Al 2O 3陶瓷陶瓷B 、光导纤维、光导纤维C 、氮化硅陶瓷、氮化硅陶瓷D 、玻璃纤维、玻璃纤维6.石灰石是许多工业的原料之一,但制取下列物质时不需要石灰石为原料的是.石灰石是许多工业的原料之一,但制取下列物质时不需要石灰石为原料的是 A 、制硅酸、制硅酸B 、制水泥、制水泥C 、制玻璃、制玻璃D 、制生石灰、制生石灰7.除去CO 2中混有的少量CO 的方法是的方法是 A 、通过盛有饱和NaHCO 3溶液的洗气瓶溶液的洗气瓶 B 、通过灼热的铜网、通过灼热的铜网 C 、点燃使CO 转化为CO 2D 、通过盛有赤热CuO 粉末的硬质玻管粉末的硬质玻管 8.下列物质中碳元素的质量分数最大的是.下列物质中碳元素的质量分数最大的是A 、CS 2B 、C 2H 2 C 、CH 4D 、CO9.7g 碳和14g 氧气在一定条件下生成21g 碳的氧化物,则生成的CO 和CO 2的物质的量之比为 A 、1:1B 、2:1C 、2:3D 、3:21010.下列物质符合化学式.下列物质符合化学式Al 2O 3·2H 2O 的是的是A 、混合物、混合物B 、两种氧化物的水化物、两种氧化物的水化物C 、硅酸盐、硅酸盐D 、铝酸盐、铝酸盐1111.钙沸石.钙沸石.钙沸石[CaAl [CaAl 2Si 3O 10·3H 2O]O]中中SiO 2的质量分数为的质量分数为 A 、20% B 、46.5% C 、15.3% D 、23.3% 1212.下列叙述中的非金属元素,其气态氢化物最稳定的是.下列叙述中的非金属元素,其气态氢化物最稳定的是.下列叙述中的非金属元素,其气态氢化物最稳定的是 A 、构成矿物和岩石的主要元素、构成矿物和岩石的主要元素B 、空气中含量最多的元素、空气中含量最多的元素C 、单质在常温下的呈液态的元素、单质在常温下的呈液态的元素D 、地壳中含量最多的元素、地壳中含量最多的元素1313.用于制造隐形飞机的某种物质,具有吸收微波的功能,其.用于制造隐形飞机的某种物质,具有吸收微波的功能,其主要成份的分子结构如下图所示,它属于主要成份的分子结构如下图所示,它属于 A 、 新型无机非金属材料新型无机非金属材料 B 、无机化合物、无机化合物 C 、有机物、有机物D 、有机高分子化合物、有机高分子化合物1414.①~④为石灰水保存鲜蛋的原理分析,其中正确的是.①~④为石灰水保存鲜蛋的原理分析,其中正确的是.①~④为石灰水保存鲜蛋的原理分析,其中正确的是①石灰水是碱性物质,能渗入蛋内中和酸性物质,①石灰水是碱性物质,能渗入蛋内中和酸性物质,防止腐败;防止腐败;防止腐败;②石灰水是电解质,②石灰水是电解质,②石灰水是电解质,能防止蛋能防止蛋的腐败;③石灰水呈碱性,具杀菌能力;④石灰水能与鲜蛋呼出的CO 2生成CaCO 3薄膜,起保护作用。
碳族综合练习

碳族综合练习1、下列离子方程式正确的是A.向石灰石中加稀硫酸 CaCO3+2H+=Ca2++H2O+CO2B.向澄清石灰水中通入过量二氧化碳Ca(OH)2+2CO2=Ca2++2HCO3-C.氯化氢通过饱和小苏打溶液 HCO3-+H+=H2O+CO2D.向碳酸氢钙溶液中加入足量烧碱溶液 Ca2++3-+OH- =CaCO3+H2O2、不另加任何试剂就可以将:①Na2SiO3;②Na2SO2;③CaCl2;④KCl;⑤Ba(NO3)2五种溶液鉴别出来,其鉴别检出的顺序是A.③④⑤①②B.③①⑤②④C.①③④②⑤D.③②①④⑤3、下列几种物质不能长期暴露在空气中的是A. 水晶B. 水玻璃C. 氢硫酸D. 石英4、下列离子方程式不正确的是A.石英与烧碱反应:SiO2 + 2OH- === SiO32- + H2OB.往烧碱溶液中通入少量CO2:CO2+ OH- === HCO3-C.往水玻璃中加入盐酸:2H+ + SiO32- === H2SiO3↓D.向小苏打溶液中加入过量石灰水:2HCO3-+Ca2++2OH- = CaCO3↓+2H2O+CO32-5、在0℃,101.3KPa状况下,由一氧化碳和氧气组成的混合气体体积为2L,点燃后使之完全反应。
将生成的气体全部通入过量的澄清石灰水中得到白色沉淀,干燥后称量为5g。
由此推断原混合气体中①CO可能为1.12L ②O2一定为0.56L ③O2可能为0.88L ④CO一定为1.20LA.①②B.①③C.②④D.③④6、只用一种试剂就能将Na2SiO3、Na2CO3、MgCl2、Ba(HCO3)2四种无色溶液区别开来,这种试剂是A.氢氧化钠溶液B.澄清石灰水C.2 mol / L盐酸D. 2 mol / L硫酸7、下列各组离子能在水溶液中大量共存的是A.Ca2+、SO42-、H+、HCO3- B.H+、NO3-、Cl-、SiO32-C.K+、HCO3-、Na+、OH- D. K+、Na+、CO32-、SiO32-8、由10g含有杂质的CaCO3和足量盐酸反应,产生了0.1molCO2,推断杂质的组成可能是A.KHCO3和MgCO3B.K2CO3和Na2CO3C.MgCO3和Na2CO3D.Na2CO3和NaHCO39、下列①~⑧中物质间的反应不能产生气体的是①石灰石和盐酸②冷浓硫酸中投入铝片③石英与苏打混和加强热④石墨与高温水蒸气⑤过氧化钠与水⑥氟与水⑦钠与硫酸铜溶液⑧碳酸氢钠与氢氧化钠A.①和⑤B.④和⑦C.③和⑦D.②和⑧10、将过量CO2通入NaOH和Ca(OH)2的混合稀溶液中,生成沉淀的质量(m)和通入CO2(V)关系图,正确的是11、现有五种失去标签的溶液,它们分别是氢氧化钾、碳酸钠、氯化钡、硅酸钠和硫酸氢钠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳族元素一、选择题(每题只有一个选项符合题意)1. 下列叙述正确的是A、自然界中存在大量的单质硅8石英、水晶、硅石的主要成份都是二氧化硅G二氧化硅的化学性质活泼、溶于水形成难溶的硅酸以自然界的二氧化硅都存在在水晶矿中2. 下列物质能直接用作半导体材料的是A、金刚石B石墨C、晶体硅以水晶3. 下列物质中不与水反应的是A SiO2 B、CQ G SO D> CaO4. 在通风良好,燃烧正旺的煤炉中,下列反应最不容易发生的是A. C+C3兰上C032C。
十Og 三至2CO2U C6+C^^2C。
D, 2C+0i 2C。
5. 下列不属于新型无机非金属材料的是A Al 2Q3陶瓷B光导纤维G氮化硅陶瓷DK玻璃纤维6. 石灰石是许多工业的原料之一,但制取下列物质时不需要石灰石为原料的是A、制硅酸B制水泥G制玻璃D、制生石灰7. 除去CO中混有的少量CO的方法是A、通过盛有饱和NaHC潞液的洗气瓶8通过灼热的铜网G点燃使CO转化为CQ以通过盛有赤热CuO粉末的硬质玻管8. 下列物质中碳元素的质量分数最大的是A CS B、C2H2G CH D. CO9.7g碳和14g氧气在一矢M条件下生成21g碳的氧化物,则生成的CO和CO的物质的量之比为A1:1B、2:1G 2:3D> 3:2 10.下列物质符合化学式Al 2C3 - 2RO的是11. 钙沸石[CaAl 2Si 3O0 - 3H 2O ]中SiO 2的质量分数为 A 20%B 、46.5% G 15.3%D> 23.3%12. 下列叙述中的非金属元素,其气态氢化物最稳定的是 A 、构成矿物和岩石的主要元素 B 、空气中含量最多的元素 G 单质在常温下的呈液态的元素以地壳中含量最多的元素13. 用于制造隐形飞机的某种物质,具有吸收微波的功能,其 主要成份的分子结构如下图所示,它属于 A 新型无机非金属材料 8无机化合物 G 有机物以有机高分子化合物14. ①〜④为石灰水保存鲜蛋的原理分析,其中正确的是 ①石灰水是碱性物质,能渗入蛋内中和酸性物质,防止腐败;②石灰水是电解质, 能防止蛋的腐败;③石灰水呈碱性,具杀菌能力;④石灰水能与鲜蛋呼出的 CO 生成CaCO 薄膜,起保护作用。
A 、①② B 、①②③C 、③④ 以①②③④15.铅的氧化物较多,其中 Pb 3Q 是铅的最高价氧化物和最低价氧化物形成的复杂氧化物, 在Pb 3O 4中,其最高价氧化物和最低价氧化物的物质的量之比为 A 1:1B 、1:2 G 2:1Dk 无法确定二、选择题(每题有 1 — 2个选项符合题意)16. 为使作为历史资料签署的重要文件能长期保存而字迹清晰,则签署文件时要用 A 、蓝黑墨水 B 碳素墨水G 蓝墨水以墨汁17. 某元素A 的气态氢化物受热分解后,能生成Ha 和一种固体物质,已知相同条件下分解2倍,又知分解前后气体式量比为 16:1,则可知A 的相对原子量为A 、混合物B 两种氧化物的水化物 G 硅酸盐 以铝酸盐后气体的体积为分解前气体体积的 A 12B 、15 G 28Dk 3218.下列各组物质的溶液中分别通入CO,看不到明显现象的是A N&SiO 3 和饱和 N&COB 、CaCl 2和 NaOHC Ba(NC3) 2和CaCl2 Dk NaAlQ 和Ca(ClO) 219. 当空气与CO按5:1体积混合与足量灼热炭完全反应时,则反应后气体中CO与总体积之比为A、1:1B、1:2 G 2:3 D> 2:720. 某白色固体钠盐95g足量盐酸反应,其阴离子全部参加反应,放出无色、无气味的气体22.4L (标准状况),此气体能使澄清的石灰水变浑浊,以下判断正确的是A白色固体为纯净物8白色固体为混合物G白色固体中两物质的质量比为42:53以白色固体中两物质的物质的量之比为2:121. 某无色气体可能含有CO、CO H2O蒸气,吒中的一种或几种,依次进行如下处理(每一处处理均反应完全):①通过碱石灰,气体体积变小;②通过赤热的氧化铜时,固体变为红色;③通过无水CuS敬末时,粉末变成蓝色;④通过澄清石灰水时,石灰水变浑浊,由此可以确定混合气体中A一定含有H2O蒸气、CO、可能含有Ha、CO8一定含有H2O蒸气、CO可能含有H2、COG一定含有CO CO,可有含有H、HO蒸气一定含有R、CO可能含有H b O蒸气、CQ22. 将m gCaCO和n gKHCO分别加入100mL 0.5mol/L的盐酸中,若反应后两溶液的质量相等,贝U m和n的关系是A m=n=2.5B m=n<2.5 G m>n>2.5 以m<n<2.523. 在相同条件下,将Si、Al分别投入到质量相等且过量的NaOH§液中,反应完全后二种溶液的质量相等,则投入的Si、Al的质量关系是A m si) >m(Al)B m Al) >n(ii) G m si) =n(Al) 以无法确定提示Si、Al 与NaOH溶液反应2Al+2NaOH+2HO=2NaAlO+3H b f ;Si+2NaOH+HO=NaSiO+2H2 f二、填空题(共21分)24 (4分)石棉的化学式为CaMgSi O,蛇纹石的化学式为HkMgSi 2。
,贝U x=―,y=,若用氧化物的形式表示以上两种物质的组成,则可写成:25 (6分)A B两元素的原子最外层电子数相同,但相差一个电子层,且两单质在常温下所处的状态相同,A、C两元素位于同一周期,并能形成化合物AG, AG内共有22质子,试求: (1) A B C的元素名称A; B; C(2)A、B的最高价氧化物的水化物的化学式为(按酸性由强到弱顺序排列)(3)A、B C的氢化物的化学式为(按稳定性由强到弱顺序排列)(4)B的氧化物与A的单质反应的化学方程式为: 26(5分)A B、G以E五种物质均含有同一种元素,它们能发生如下图所示的变化。
MaOH溶液CaC以溶液加垫过童盐酸写出五种物质的化学式:AH"(6分)己知结构为……中'…的物质可写成+ cw+的形式,又知原HH H0H OH 0H 硅酸可相互反应成多硅鼠HP-jiPH : 0H OH OH ?HHO-Si-O-SiPH .HO-i-O-Si-O-Si-OH--OH 0H OH 0H原硅酸二硅酸三硅酸(1)写出n个原硅酸形成的多硅酸的结构式(2)此多硅酸分子中含有个Si 一。
键。
四、实验题(共14分)28(6分)错是IVA族元素,它的单质晶体是一种良好的半导体材料, 广泛应用于电子工业, 错是可以从烟道灰提取,其过程如下:29 (8分)(1)若CO中混有CQ除去的方法是(2)若CQ中混有HCl,要得到纯净的CQ,其方法是(3)在没有现成CQ气体发生器的情况下,请你运用下图中的部份仪器,装配成一个简H2SQ,浓硝酸、水、块状纯碱、大理石(块状),比较合理的方案,应选用的药品是。
五、计算题(共11分)30 (5分)某二价金属的碳酸盐和碳酸氢盐的混合物跟足量盐酸反应,消耗H+和产生CQ的物质的量之比为6:5,计算该混合物中碳酸盐和碳酸氢盐的物质的量之比为多少?31 (6分)在两个分别充满N和Q的密闭窗口中各锻烧11.6g某二价金属的碳酸盐,反应结束后恢复到原状态,发现两容器的压强均增大,充N2与充Q容器中无压强的变化比为4:3 ,充Q容器中固体残留物只有一种,质量为8g,求二价金属的相对原子质量及其碳酸盐的化学式。
参考答案24、12; 9; CaO・ 3MgO 4SiO2, 3MgO・ 2SiO2 - 2HzO25、(1)碳;硅;氧;(2) H b CO>H2SiO3;(3) HbO>C昨SiH4(4)S I O3+2C Si+SCO t26、SiO2;CaSi。
;N&SiO3; Si; HSiO4(H2SiO3 )OH「IHO—Si-0一H-np - n27、(1)*口(2)4n28、<T> GeO2-*-4HCl=GeC14-F2H2O© GeCUH-3H2O=H2GeO3-l-4HCrr△ Ge O2+H2 O® GeO24-2H2- △一Ge4-2H2 O29、(1)将气体通过灼烧的CuO粉末后,收集气体;(2)将气体通过饱和NaHC宓液后, 再通过浓HbSO干燥,然后收集气体;(3) acde (4)块状大理石,浓HNO和水。
30、MCO32HCl MCl2H2O CO2 x2x xM (HCO3)22HCl MCl22H2O2CO 2y2y2y据题意有:2y): (x2y) 6:5解得:x : y 1: 2即碳酸盐与碳酸氢盐的物质的量之比为2:131、解:T、V一定时(恒温、恒容)压强(P)的变化等于物质的量(n)的变化。
设金属为M则有.............. ①充氧容器变化量小,说明Q有消耗(Nk没有消耗),若生成的CO为4mol,则耗Q为1mol (因为变化比为4: 3)而容器中只可能是M^ 02反应耗3Q从①反应式中看出:n(Mo)=n(co2)=4(mol)故有:4M0+2=M406 得2MO3设反应中生成M0的物质的量为x,有:4MO 十。
2 2M2O34E 2E 得M=3b11.6 2M+而2归十48二价金属的相对原子质量为56 (Fe)碳酸盐的化学式为:FeCOImol Itnol11.6 21^ + 6011.677+60mol。
