金属晶体金属键堆积方式(市级公开课1)PPT课件
合集下载
《金属晶体》ppt课件人教版化学选修

2、金属晶体的原子在三维空间堆积模型
堆积 模型
采纳这种堆积的典 型代表
空间 配位数 利用 率
晶胞
简单
立方
Po (钋)
52% 6
钾型
(bcp) K、Na、Fe 68% 8
镁型
(hcp) Mg、Zn、Ti 74% 12
铜型
(ccp) Cu, Ag, Au 74% 12
《 金 属 晶 体 》ppt课 件人教 版化学 选修
第三层的另一种排列方式,是将球对准第一层的 2, 4,6 位,不同于 AB 两层的位置,这是 C 层。
《 金 属 晶 体 》ppt课 件人教 版化学 选修
12
6
3
54
12
6
3
54
《 金 属 晶 体 》ppt课 件人教 版化学 选修
④面心立方最密堆积:铜型
A
12
C
6
3
B
54
A
第四层再排 A,于是形成 ABC
A
A6,上下层各 3 ),空间利用率为74%
《 金 属 晶 体 》ppt课 件人教 版化学 选修
《 金 属 晶 体 》ppt课 件人教 版化学 选修 《 金 属 晶 体 》ppt课 件人教 版化学 选修
《 金 属 晶 体 》ppt课 件人教 版化学 选修
《 金 属 晶 体 》ppt课 件人教 版化学 选修
石墨晶体
《 金 属 晶 体 》ppt课 件人教 版化学 选修
《 金 属 晶 体 》ppt课 件人教 版化学 选修
思考:
(1)在石墨晶体中,C采取 sp2
杂化方式,每个C与 3 个C成键,
形成
正三角形结构。最小
碳环由
个6 碳原子组成,它们
堆积 模型
采纳这种堆积的典 型代表
空间 配位数 利用 率
晶胞
简单
立方
Po (钋)
52% 6
钾型
(bcp) K、Na、Fe 68% 8
镁型
(hcp) Mg、Zn、Ti 74% 12
铜型
(ccp) Cu, Ag, Au 74% 12
《 金 属 晶 体 》ppt课 件人教 版化学 选修
第三层的另一种排列方式,是将球对准第一层的 2, 4,6 位,不同于 AB 两层的位置,这是 C 层。
《 金 属 晶 体 》ppt课 件人教 版化学 选修
12
6
3
54
12
6
3
54
《 金 属 晶 体 》ppt课 件人教 版化学 选修
④面心立方最密堆积:铜型
A
12
C
6
3
B
54
A
第四层再排 A,于是形成 ABC
A
A6,上下层各 3 ),空间利用率为74%
《 金 属 晶 体 》ppt课 件人教 版化学 选修
《 金 属 晶 体 》ppt课 件人教 版化学 选修 《 金 属 晶 体 》ppt课 件人教 版化学 选修
《 金 属 晶 体 》ppt课 件人教 版化学 选修
《 金 属 晶 体 》ppt课 件人教 版化学 选修
石墨晶体
《 金 属 晶 体 》ppt课 件人教 版化学 选修
《 金 属 晶 体 》ppt课 件人教 版化学 选修
思考:
(1)在石墨晶体中,C采取 sp2
杂化方式,每个C与 3 个C成键,
形成
正三角形结构。最小
碳环由
个6 碳原子组成,它们
金属晶体金属键堆积方式
修高
3
) 第 三 章
二 化 学 ( 选
第三节
金属晶体
Ti
金属样品 Ti
1、金属共同的物理性质
容易导电、导热、有延展性、有金属光泽等。
金属为什么具有这些共同性质呢? 2、金属的结构
㈠、金属键
(1)定义: 金属离子和自由电子之间的相互作用。 (2)成键微粒: 金属阳离子和自由电子 (3)键的存在: 金属单质和合金中 (4)方向性: 无方向性 (5)键的本质: 电子气理论
【总结】非金属单质是原子晶体还是分子晶体的 判断方法
(1)依据组成晶体的粒子和粒子间的作用判断: 原子晶体的粒子是原子,质点间的作用是共价键; 分子晶体的粒子是分子,质点间的作用是范德华力。
(2)记忆常见的、典型的原子晶体。 (3)依据晶体的熔点判断:原子晶体熔、沸点高, 常在1000℃以上;分子晶体熔、沸点低,常在数百 度以下至很低的温度。 (4)依据导电性判断:分子晶体为非导体,但部 分分子晶体溶于水后能导电;原子晶体多数为非导 体,但晶体硅、晶体锗是半导体。 (5)依据硬度和机械性能判断:原子晶体硬度大, 分子晶体硬度小且较脆。
③ 六方堆积 ——六方晶胞
④面心立方堆积 ——面心立方晶胞
配位数 = 12 空间利用率 = 74.05% 配位数 = 12 空间利用率 = 74.05%
知识拓展-石墨
一种结晶形碳,有天然出产的矿物。铁 黑色至深钢灰色。质软具滑腻感,可沾污手 指成灰黑色。有金属光泽。六方晶系,成叶 片状、鳞片状和致密块状。密度2.25g/cm3, 化学性质不活泼。具有耐腐蚀性,在空气或 氧气中强热可以燃烧生成二氧化碳。石墨可 用作润滑剂,并用于制造坩锅、电极、铅笔 芯等。
4.金属晶体熔点变化规律
选修三专题3《金属键金属晶体》ppt课件

原子半径的减小使得金属原子间的距离缩短,相互作用 力增强,金属键强度增大。 原子半径的变化对金属键强度的影响程度因金属种类而 异。
电负性对金属键稳定性影响
01
电负性越大,金属原子间的电子云重叠程度越小, 金属键越稳定。
02
电负性的增加使得金属原子对外层电子的束缚力增 强,有利于形成稳定的金属键。
03
无方向性
金属键没有固定的方向,金属原子可以在空间任意排列。
无饱和性
金属原子可以不断吸收自由电子,形成更多的金属键。
强度与金属半径和电荷有关
金属半径越小,电荷越高,金属键越强。
金属晶体结构类型
简单立方结构
01
每个金属原子都与相邻的6个金属原子形成金属键,空间利用率
较低。
体心立方结构
02
晶胞中心有一个金属原子,8个顶角各有一个金属原子,空间利
能带理论的基本思想
将金属中的自由电子视为在周期性势场中运动的粒子,通过求解薛 定谔方程得到电子的能级分布。
能带的形成
由于金属原子实的周期性排列,电子的波函数相互交叠,形成连续 的能带。
能带理论对金属性质的解释
金属的导电性源于价带中的电子在外电场作用下可以定向移动形成 电流。
实验方法及结果分析
实验方法
04
常见金属晶体结构解析
Chapter
简单立方结构
01
结构特点
每个晶胞只含有一个原子,原子位 于晶胞的体心。
配位数
6。
03
02
原子堆积方式
简单立方堆积。
典型金属
钋(Po)。
04
面心立方结构
结构特点
每个晶胞含有4个原子, 原子位于晶胞的8个顶点 和6个面心。
电负性对金属键稳定性影响
01
电负性越大,金属原子间的电子云重叠程度越小, 金属键越稳定。
02
电负性的增加使得金属原子对外层电子的束缚力增 强,有利于形成稳定的金属键。
03
无方向性
金属键没有固定的方向,金属原子可以在空间任意排列。
无饱和性
金属原子可以不断吸收自由电子,形成更多的金属键。
强度与金属半径和电荷有关
金属半径越小,电荷越高,金属键越强。
金属晶体结构类型
简单立方结构
01
每个金属原子都与相邻的6个金属原子形成金属键,空间利用率
较低。
体心立方结构
02
晶胞中心有一个金属原子,8个顶角各有一个金属原子,空间利
能带理论的基本思想
将金属中的自由电子视为在周期性势场中运动的粒子,通过求解薛 定谔方程得到电子的能级分布。
能带的形成
由于金属原子实的周期性排列,电子的波函数相互交叠,形成连续 的能带。
能带理论对金属性质的解释
金属的导电性源于价带中的电子在外电场作用下可以定向移动形成 电流。
实验方法及结果分析
实验方法
04
常见金属晶体结构解析
Chapter
简单立方结构
01
结构特点
每个晶胞只含有一个原子,原子位 于晶胞的体心。
配位数
6。
03
02
原子堆积方式
简单立方堆积。
典型金属
钋(Po)。
04
面心立方结构
结构特点
每个晶胞含有4个原子, 原子位于晶胞的8个顶点 和6个面心。
金属晶体金属键堆积方式(市级公开课1)

电子显微镜原理
利用电子束在磁场中的偏转和聚焦,形成高分辨率的显微图像。
金属晶体的电子显微观察特点
金属晶体在电子显微镜下呈现出清晰的晶格结构和原子排列,可以观察到晶界、位错、孪 晶等微观缺陷。
电子显微技术在金属晶体研究中的应用实例
利用电子显微镜可以观察金属晶体的微观形貌、晶体缺陷和相变过程等,为揭示金属材料 的强化机制和性能优化提供直观证据。
的金属光泽。
影响金属键强度的因素
金属原子的电负性
电负性较小的金属原子更容易失去外层电子,形成稳定的金属离子和自由电子。因此,电 负性较小的金属元素通常具有更强的金属键。
金属原子的半径
金属原子的半径越小,其核对外层电子的束缚力越强,使得外层电子越不容易摆脱原子核 的束缚成为自由电子。因此,金属原子的半径越小,其金属键强度通常越弱。
移动,从而形成电流。同时,自由电子的运动也能传递热量,使金属具
有良好的导热性。
02
延展性和可塑性
金属键没有方向性和饱和性,当金属受到外力作用时,金属离子和自由
电子之间的相互作用可以发生调整,使得金属可以发生形变而不易断裂。
这种性质使得金属具有良好的延展性和可塑性。
03
金属光泽
金属键中的自由电子可以吸收并重新发射可见光,这使得金属具有特有
线缺陷:位错现象分析
位错概念
晶体中局部区域原子排列不规则造成 的线状缺陷,是金属晶体中最常见的 缺陷之一。
位错类型
位错对金属性能的影响
位错可以显著提高金属的强度和硬度, 同时降低金属的塑性和韧性。
包括刃型位错和螺型位错,分别对应 原子滑移面和滑移方向的不同。
面缺陷:晶界作用探讨
1 2
晶界概念
相邻晶粒间的界面,是晶体结构中的一种面缺陷。
利用电子束在磁场中的偏转和聚焦,形成高分辨率的显微图像。
金属晶体的电子显微观察特点
金属晶体在电子显微镜下呈现出清晰的晶格结构和原子排列,可以观察到晶界、位错、孪 晶等微观缺陷。
电子显微技术在金属晶体研究中的应用实例
利用电子显微镜可以观察金属晶体的微观形貌、晶体缺陷和相变过程等,为揭示金属材料 的强化机制和性能优化提供直观证据。
的金属光泽。
影响金属键强度的因素
金属原子的电负性
电负性较小的金属原子更容易失去外层电子,形成稳定的金属离子和自由电子。因此,电 负性较小的金属元素通常具有更强的金属键。
金属原子的半径
金属原子的半径越小,其核对外层电子的束缚力越强,使得外层电子越不容易摆脱原子核 的束缚成为自由电子。因此,金属原子的半径越小,其金属键强度通常越弱。
移动,从而形成电流。同时,自由电子的运动也能传递热量,使金属具
有良好的导热性。
02
延展性和可塑性
金属键没有方向性和饱和性,当金属受到外力作用时,金属离子和自由
电子之间的相互作用可以发生调整,使得金属可以发生形变而不易断裂。
这种性质使得金属具有良好的延展性和可塑性。
03
金属光泽
金属键中的自由电子可以吸收并重新发射可见光,这使得金属具有特有
线缺陷:位错现象分析
位错概念
晶体中局部区域原子排列不规则造成 的线状缺陷,是金属晶体中最常见的 缺陷之一。
位错类型
位错对金属性能的影响
位错可以显著提高金属的强度和硬度, 同时降低金属的塑性和韧性。
包括刃型位错和螺型位错,分别对应 原子滑移面和滑移方向的不同。
面缺陷:晶界作用探讨
1 2
晶界概念
相邻晶粒间的界面,是晶体结构中的一种面缺陷。
金属晶体金属堆积方式40页PPT

金属晶体金属堆积方式
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的,义无 反顾。 40、对时间的价值没有没有深切认识 的人, 决不会 坚韧勤 勉。
46、我们若已接受最坏的,就再没有什么损失。——卡耐基 47、书到用时方恨少、事非经过不知难。——陆游 48、书籍把我们引入最美好的社会,使我们认识各个时代的伟大智者。——史美尔斯 49、熟读唐诗三百首,不会作诗也会吟。——孙洙 50、谁和我一样用功,谁就会和我一样成功。——莫扎特
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的,义无 反顾。 40、对时间的价值没有没有深切认识 的人, 决不会 坚韧勤 勉。
46、我们若已接受最坏的,就再没有什么损失。——卡耐基 47、书到用时方恨少、事非经过不知难。——陆游 48、书籍把我们引入最美好的社会,使我们认识各个时代的伟大智者。——史美尔斯 49、熟读唐诗三百首,不会作诗也会吟。——孙洙 50、谁和我一样用功,谁就会和我一样成功。——莫扎特
金属晶体优秀课件

解:晶胞边长为a,原子半径为r. 由勾股定理: a 2 + a 2 = (4r)2
a = 2.83 r 每个面心立方晶胞含原子数目: 8 1/8 + 6 ½ = 4
= (4 4/3 r 3) / a 3
= (4 4/3 r 3) / (2.83 r ) 3 100 % = 74 %
堆积模 型
6
3
54
,
AB
关键是第三层,对第一、二层来说,第三 层可以有两种最紧密的堆积方式。
第一种是将球对准第一层的 下图是此种六方
球。
紧密堆积的前视图
A
12
6
3
B
54
A
B
于是每两层形成一个周期,即
A
AB AB 堆积方式,形成六方紧
密堆积。
配位数 12 。 ( 同层 6,上下层各 3 ),空间利用率为74%
简单立方堆积
每个晶胞含原子数:1 配位数: 6
②体心立方堆积—钾型(碱金属,Fe) 每个晶胞含原子数:2 配位数: 8
体 心 立 方 堆 积
(2)最密堆积
镁型
铜型
第二层 对第一层来讲最紧密的堆积方 式是将球对准1,3,5 位。 ( 或对准 2, 4,6 位,其情形是一样的 )
12
6
3
54
12
①、六方最密堆积 镁型
第三层的另一种排列 方式,是将球对准第一层 的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
12
6
3
54
12
6
3
54
12
6
3
54
第四层再排 A,于是形
A
成 ABC ABC 三层一个周
a = 2.83 r 每个面心立方晶胞含原子数目: 8 1/8 + 6 ½ = 4
= (4 4/3 r 3) / a 3
= (4 4/3 r 3) / (2.83 r ) 3 100 % = 74 %
堆积模 型
6
3
54
,
AB
关键是第三层,对第一、二层来说,第三 层可以有两种最紧密的堆积方式。
第一种是将球对准第一层的 下图是此种六方
球。
紧密堆积的前视图
A
12
6
3
B
54
A
B
于是每两层形成一个周期,即
A
AB AB 堆积方式,形成六方紧
密堆积。
配位数 12 。 ( 同层 6,上下层各 3 ),空间利用率为74%
简单立方堆积
每个晶胞含原子数:1 配位数: 6
②体心立方堆积—钾型(碱金属,Fe) 每个晶胞含原子数:2 配位数: 8
体 心 立 方 堆 积
(2)最密堆积
镁型
铜型
第二层 对第一层来讲最紧密的堆积方 式是将球对准1,3,5 位。 ( 或对准 2, 4,6 位,其情形是一样的 )
12
6
3
54
12
①、六方最密堆积 镁型
第三层的另一种排列 方式,是将球对准第一层 的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
12
6
3
54
12
6
3
54
12
6
3
54
第四层再排 A,于是形
A
成 ABC ABC 三层一个周
高二化学物质结构 金属晶体的堆积方式(共31张PPT)

简单立方堆积
②体心立方堆积—钾型(碱金属)
体 心 立 方 堆 积
配位数:8
镁型
铜型
第二层 对第一层来讲最紧密的堆积方
式是将球对准1,3,5 位。 (
4,6 位,其情形是一样的 )
1 6 5 4 2 3 6 5 4
或对准 2,
1
2
3
A
关键是第三层,对第一、二层来说,第三层 可以有两种最紧密的堆积方式。
,Leabharlann B第一种是将球对准第一层的球。
下图是此种六方 紧密堆积的前视图
1 6 5
2
3 4
A
B
A
于是每两层形成一个周期, 即 AB AB 堆积方式,形成六 方紧密堆积。 配位数 12 。 ( 同层 6,上下层各 3 ),空间利用率为74%
B A
3、镁型
第三层的另一种排列 方式,是将球对准第一层 1 6 5 4
金属晶体的原子在二维平面堆积模型 金属晶体中的原子可看成直径相等的 小球。将等径圆球在一平面上排列,有两 种排布方式,按(b)图方式排列,圆球 周围剩余空隙最小,称为密置层;按(a) 图方式排列,剩余的空隙较大,称为非密 置层。
(a)非密置层
(b)密置层
金属晶体的原子在三维空间堆积模型 ①简单立方堆积(Po)
C
B A
镁型
铜型
金属晶体的两种最密堆积方式
堆积模 型
简单立 方 钾型 (bcp) 镁型 (hcp) 铜型 (ccp)
采纳这种堆积的 空间利用率 典型代表 52% Po (钋)
K、Na、Fe Mg、Zn、Ti Cu, Ag, Au 68% 74% 74%
配位数
6 8 12 12
晶胞
金属晶体的原子堆积模型ppt课件

A
21 此种立方紧密堆积的前视图
C B A
面心立方
晶胞含金属原子数: 4
2019
金属晶体的堆积方式──铜型 22
2019
-
23
总 结
堆积模 型 采纳这种堆积的典 空间利 用率 型代表 配位数 晶胞
简单 立方 钾型 镁型 铜型
Po Na K Fe Mg Zn Ti Cu Ag Au
52% 68% 74% 74%
知识回顾:两种晶体类型与性质的比较
晶体类型
概念 作用力 构成微粒 物 理 性 质 实例
2019
原子晶体
相邻原子之间以共价 键相结合而成具有空 间网状结构的晶体
分子晶体
金属晶体
分子间以范德 通过金属键形成的 华力相结合而 晶体 成的晶体
共价键 原子 很高 很大 部分为半导体)
金刚石、二氧化硅、 晶体硅、碳化硅
2019
-
28
4、最近发现一种由钛原子和碳原子构成的气 态团簇分子,如下图所示,顶角和面心的原子 是钛原子,棱的中心和体心的原子是碳原子, 它的化学式是 。
解析:由于本题团簇分子指的 是一个分子的具体结构,并不 是晶体中的最小的一个重复单 位,不能采用均摊法分析,所 以只需数出该结构内两种原子 的数目就可以了。答案为: Ti14
为什么碱金属单质的熔沸点从上到下逐渐降 低,而卤素单质的熔沸点从上到下却升高?
返回
2019 6
二、 金属晶体的原子堆积模型
2019
-
7
三、金属晶体的原子堆积模型
1、几个概念
紧密堆积:微粒之间的作用力使微粒间尽可 能的相互接近,使它们占有最小的空间 配位数:在晶体中与每个微粒紧密相邻的微 粒个数 空间利用率:晶体的空间被微粒占满的体积 百分数,用它来表示紧密堆积的程度
金属键金属晶体ppt课件.ppt

熔点/℃
Na 3s1 186 108.4 97.5
Mg 3s2 160 146.4 650
Al 3s23p1 143.1 326.4
660
Cr 3d54s1 124.9 397.5 1900
金属的熔点、硬度与金属键的强弱有关,金属键的强弱 又可以用原子化热来衡量。
原子化热是指1mol金属固体完全气化成相互远离的 气态原子时吸收的能量。
⑷金属晶体结构具有金属光泽和颜色
• 由于自由电子可吸收所有频率的光,然 后很快释放出各种频率的光,因此绝大 多数金属具有银白色或钢灰色光泽。而 某些金属(如铜、金、铯、铅等)由于 较易吸收某些频率的光而呈现较为特殊 的颜色。
• 当金属成粉末状时,金属晶体的晶面取
向杂乱、晶格排列不规则,吸收可见光
后辐射不出去,所以成黑色。
a
ρ= m = 4 M/NA V 2 2 d3
解此类题的关键! 37
已知铜晶胞是面心立方晶胞,该晶胞的边长为 3.6210-10m,每一个铜原子的质量为1.0551025kg ,试回答下列问题:
(1)一个晶胞中“实际”拥有的铜原子数是多少?
(2)该晶胞的体积是多大?
(3)利用以上结果计算金属铜的密度。
2. 晶胞中微粒数个晶胞共享,处于体心的 金属原子全部属于该晶胞。 微粒数为:8×1/8 + 1 = 2 (2)面心立方:
在立方体顶点的微粒为8个晶胞共有,在面心的为2 个晶胞共有。 微粒数为:8×1/8 + 6×1/2 = 4 (3)六方棱柱:
在六方体顶点的微粒为6个晶胞共有,在面心的为2 个棱柱共有,在体内的微粒全属于该棱柱。 微粒数为:12×1/6 + 2×1/2 + 3 = 6
(1)欲计算一个晶胞的体积,除假定金原子是钢 性小球外,还应假定 各面对角线上。的三个球两两相切
Na 3s1 186 108.4 97.5
Mg 3s2 160 146.4 650
Al 3s23p1 143.1 326.4
660
Cr 3d54s1 124.9 397.5 1900
金属的熔点、硬度与金属键的强弱有关,金属键的强弱 又可以用原子化热来衡量。
原子化热是指1mol金属固体完全气化成相互远离的 气态原子时吸收的能量。
⑷金属晶体结构具有金属光泽和颜色
• 由于自由电子可吸收所有频率的光,然 后很快释放出各种频率的光,因此绝大 多数金属具有银白色或钢灰色光泽。而 某些金属(如铜、金、铯、铅等)由于 较易吸收某些频率的光而呈现较为特殊 的颜色。
• 当金属成粉末状时,金属晶体的晶面取
向杂乱、晶格排列不规则,吸收可见光
后辐射不出去,所以成黑色。
a
ρ= m = 4 M/NA V 2 2 d3
解此类题的关键! 37
已知铜晶胞是面心立方晶胞,该晶胞的边长为 3.6210-10m,每一个铜原子的质量为1.0551025kg ,试回答下列问题:
(1)一个晶胞中“实际”拥有的铜原子数是多少?
(2)该晶胞的体积是多大?
(3)利用以上结果计算金属铜的密度。
2. 晶胞中微粒数个晶胞共享,处于体心的 金属原子全部属于该晶胞。 微粒数为:8×1/8 + 1 = 2 (2)面心立方:
在立方体顶点的微粒为8个晶胞共有,在面心的为2 个晶胞共有。 微粒数为:8×1/8 + 6×1/2 = 4 (3)六方棱柱:
在六方体顶点的微粒为6个晶胞共有,在面心的为2 个棱柱共有,在体内的微粒全属于该棱柱。 微粒数为:12×1/6 + 2×1/2 + 3 = 6
(1)欲计算一个晶胞的体积,除假定金原子是钢 性小球外,还应假定 各面对角线上。的三个球两两相切
金属键金属晶体课件-2024鲜版

晶体结构测定
相变研究
利用X射线衍射技术,可以研究金属 晶体在不同温度、压力条件下的相变 行为,深入了解金属键与晶体结构之 间的关系。
通过X射线衍射实验,可以测定金属 晶体的晶格常数、原子间距等结构参 数,进而揭示金属键的本质。
2024/3/28
23
电子显微镜在微观形貌观察中作用
1 2
高分辨率成像 电子显微镜利用电子束代替光束进行成像,具有 更高的分辨率,能够观察到金属晶体的微观形貌 和缺陷结构。
2024/3/28
关系总结
金属键是决定金属晶体结构和性质的关键因素。金属键的强度、 稳定性和特性直接影响金属晶体的结构稳定性、物理性质、化 学性质和力学性能。
意义
深入了解金属键与金属晶体的关系有助于理解金属的宏观性质 和行为,为材料科学、冶金工程等领域提供理论支持和实践指 导。此外,这种关系的研究还有助于开发新的金属材料和优化 现有材料的性能。
2024/3/28
20
新型金属功能材料发展趋势
2024/3/28
超导材料 超导材料是指在低温下电阻为零的材料,具有极高的导电 性能。超导材料在电力输送、磁悬浮列车等领域有潜在应 用前景。
形状记忆合金 形状记忆合金是一种具有形状记忆效应的金属材料,能够 在加热后恢复其原始形状。形状记忆合金在医疗器械、航 空航天等领域有广泛应用。
金属键金属晶体课件
2024/3/28
1
contents
目录
2024/3/28
• 金属键基本概念与特性 • 金属晶体结构与性质 • 金属键与金属晶体关系探讨 • 常见金属晶体材料介绍与应用 • 实验方法与技术手段在金属键、金属晶
体研究中应用 • 总结回顾与拓展延伸
2
第三节金属晶体结构ppt课件

=4
则:
16
V球 =
πr3 3
C B
B
C CC C A
A BBB B C
立方F
8个顶角
n1
=
8×
1 8
=1
6个面心
n2
=
6×
1 2
=3
⑵立方面心晶胞的体积
V晶 = a3
c
C B
B
C CC C A
b a A BBB B C
立方F
每层采取最紧 密堆积
a
A
B
a
D
C
(100)晶面
∵⊿ABC是直角三角形。根据勾股定律得有:
……
第4层 A 第2层 C 第2层 B 第1层 A
A1型最紧密堆积
2.A1型堆积的晶胞类型
根据晶胞划分的规则,我们可从金属的 A1 型最紧密堆积中抽取出立方 面心晶胞。
第4层 A 第2层 C 第2层 B 第1层 A
抽取出
A1型最紧密堆积
BCCC A
B
CC
A BB B堆积 C C堆积
B 堆积和 C 堆积——(111)晶面 c
b a
3.立方面心晶胞的正八面体空隙
立方面心晶胞
立方面心晶胞内 的正八面体空隙
3个晶胞共有的正八面 体空隙
即,立方面心晶胞有两种八
面体空隙。
3个晶胞共用 顶点
⑴6各面心“点”构成的晶
晶胞1、3的 面心
胞内八面体空隙。 ⑵3个晶胞共同拥有的八面
体空隙(共用1条棱边) 。
二、A3型最紧密堆积及其晶胞
The A3 type is most close to pile up and its crystal lattice
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
的“电子气”,被所有原子所共用,从而把所有 的金属原子维系在一起。
(6)键的强弱:阳离子半径;所带电荷
阳离子所带电荷多、半径小----金属键
强,熔沸点高
.
10
㈡、金属晶体: 概念:金属阳离子和自由电子通过金属键作 用形成的晶体
组成粒子:金属阳离子和自由电子 作用力:金属离子和自由电子之间的较强作
用—— 金属键(电子气理论)
.
17
4.金属晶体熔点变化规律
⑴金属晶体熔点变化较大
与金属晶体紧密堆积方式、金属阳离子与自由电子之间 的金属键的强弱有密切关系.
⑵一般情况下,金属晶体熔点由金属键强弱决定:
金属阳离子半径越小,所带电荷越多,自由电子越多,
金属键越强,熔点就相应越高,硬度也越大。
如:K ﹤Na ﹤Mg ﹤Al Li﹥Na ﹥K ﹥ Rb ﹥Cs
熔点最低的金属:汞(常温时成液态)
熔点很高的金属:钨(3410℃)
铁的熔点:1535 ℃
.
18
资
金属之最
料
熔点最低的金属是-------- 汞
熔点最高的金属是-------- 钨
密度最小的金属是-------- 锂
密度最大的金属是-------- 锇
硬度最小的金属是-------- 铯
硬度最大的金属是-------- 铬
2.金属能导电的原因是( B)
A.金属晶体中金属阳离子与自由电子间的 相互作用较弱
B.金属晶体中的自由电子在外加电场作用 下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作 用下可发生定向移动
石晶体,在一个小正四面体中平均含有
1+4×1/4 =2个碳原子;
③在金刚石中最小的环是六元环,1个环中平
均含有6×1/12=1/2个C原子,含C-C键数为
6×1/6=1;
④金刚石的晶胞中含有C原子为8个,内含4个
小正四面体,含有C-C键数为16。
.
3
二氧化硅晶体结构示意图
Si
O
180º
109º28´
金属容易导热,是由于自由电子运动时与金 属离子碰撞把能量从温度高的部分传到温度低 的部分,从而使整块金属达到相同的温度。
.
14
⑶、金属晶体结构与金属延展性的关系
【讨论3】金属为什么具有较好的延展性?
原子晶体受外力作用时,原子间的位移必 然导致共价键的断裂,因而难以锻压成型, 无延展性。而金属晶体中由于金属离子与自 由电子间的相互作用没有方向性,各原子层 之间发生相对滑动以后,仍可保持这种相互 作用,因而即使在外力作用下,发生形变也 不易断裂。
导Байду номын сангаас物质
离子晶体
金属晶体
导电时的状态 溶液或熔融液
固态或液态
导电粒子 阴离子和阳离子
自由电子
升温时 导电能力
增强
减弱
.
13
⑵、金属晶体结构与金属导热性的关系 【讨论2】金属为什么易导热?
自由电子在运动时经常与金属离子碰撞,引 起两者能量的交换。当金属某部分受热时,那 个区域里的自由电子能量增加,运动速度加快, 通过碰撞,把能量传给金属离子。
.
5
【总结】非金属单质是原子晶体还是分子晶体的
判断方法
(1)依据组成晶体的粒子和粒子间的作用判断:
原子晶体的粒子是原子,质点间的作用是共价键;
分子晶体的粒子是分子,质点间的作用是范德华力。
(2)记忆常见的、典型的原子晶体。
(3)依据晶体的熔点判断:原子晶体熔、沸点高,
常在1000℃以上;分子晶体熔、沸点低,常在数百
延性最好的金属是-------- 铂
展性最好的金属是-------- 金
最活泼的金属是---------- 铯
最稳定的金属是---------- 金
.
19
练习
1.金属晶体的形成是因为晶体中存在( A.金属离子间的相互作用
C)
B.金属原子间的相互作用
C.金属离子与自由电子间的相互作用
D.金属原子与自由电子间的相互作用
共价键
.
4
①二氧化硅中Si原子均以sp3杂化,分别 与4个O原子成键,每个O原子与2个Si原子 成键;
②晶体中的最小环为十二元环,其中有6 个Si原子和6个O原子,含有12个Si-O键; 每个Si原子被12个十二元环共有,每个O原 子被6个十二元环共有,每个Si-O键被6个 十二元环共有;每个十二元环所拥有的Si 原子数为6×1/12=1/2,拥有的O原子数为 6×1/6=1,拥有的Si-O键数为12×1/6=2, 则Si原子数与O原子数之比为1:2。
容易导电、导热、有延展性、有金属光泽等。
金属为什么具有这些共同性质呢? 2、金属的结构
.
9
㈠、金属键
(1)定义: 金属离子和自由电子之间的相互作用。
(2)成键微粒: 金属阳离子和自由电子
(3)键的存在: 金属单质和合金中
(4)方向性: 无方向性
(5)键的本质: 电子气理论
金属原子脱落下来的价电子形成遍布整晶体
.
11
3、金属晶体的结构与金属性质的内在联系
⑴、金属晶体结构与金属导电性的关系
【讨论1】 金属为什么易导电?
在金属晶体中,存在着许多自由电子,这些自由 电子的运动是没有一定方向的,但在外加电场的条件 下自由电子就会发生定向运动,因而形成电流,所以 金属容易导电。
.
12
比较离子体导电与金属晶体导电的区别:
.
15
金属的延展性
外力
自由电子
金属离子
.
16
⑷、金属晶体结构具有金属光泽和颜 色
• 由于自由电子可吸收所有频率的光,然后 很快释放出各种频率的光,因此绝大多数 金属具有银白色或钢灰色光泽。而某些金 属(如铜、金、铯、铅等)由于较易吸收 某些频率的光而呈现较为特殊的颜色。
• 当金属成粉末状时,金属晶体的晶面取向 杂乱、晶格排列不规则,吸收可见光后辐 射不出去,所以成黑色。
干冰的晶体结构图
分子的密堆积
(与CO2分子距离最近的 CO2分子共有12个 )
.
1
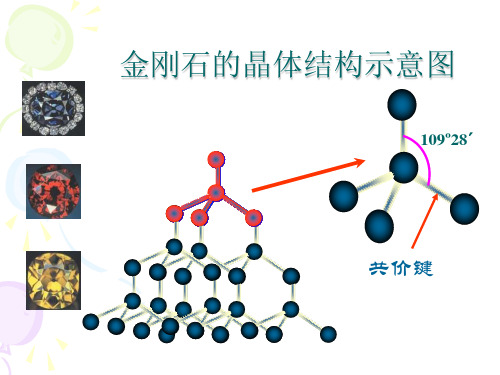
金刚石的晶体结构示意图
109º28´
共价键
.
2
①金刚石中每个C原子以sp3杂化,分别与4个
相邻的C 原子形成4个σ键,故键角为
109°28′,每个C原子的配位数为4;
②每个C原子均可与相邻的4个C构成实心的正
四面体,向空间无限延伸得到立体网状的金刚
度以下至很低的温度。
(4)依据导电性判断:分子晶体为非导体,但部
分分子晶体溶于水后能导电;原子晶体多数为非导
体,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断:原子晶体硬度大,
分子晶体硬度小且较脆。
.
6
修高 3二 )化 第学 三( 章选
第三节
金属晶体
Ti
.
7
金属样品
Ti
.
8
1、金属共同的物理性质
(6)键的强弱:阳离子半径;所带电荷
阳离子所带电荷多、半径小----金属键
强,熔沸点高
.
10
㈡、金属晶体: 概念:金属阳离子和自由电子通过金属键作 用形成的晶体
组成粒子:金属阳离子和自由电子 作用力:金属离子和自由电子之间的较强作
用—— 金属键(电子气理论)
.
17
4.金属晶体熔点变化规律
⑴金属晶体熔点变化较大
与金属晶体紧密堆积方式、金属阳离子与自由电子之间 的金属键的强弱有密切关系.
⑵一般情况下,金属晶体熔点由金属键强弱决定:
金属阳离子半径越小,所带电荷越多,自由电子越多,
金属键越强,熔点就相应越高,硬度也越大。
如:K ﹤Na ﹤Mg ﹤Al Li﹥Na ﹥K ﹥ Rb ﹥Cs
熔点最低的金属:汞(常温时成液态)
熔点很高的金属:钨(3410℃)
铁的熔点:1535 ℃
.
18
资
金属之最
料
熔点最低的金属是-------- 汞
熔点最高的金属是-------- 钨
密度最小的金属是-------- 锂
密度最大的金属是-------- 锇
硬度最小的金属是-------- 铯
硬度最大的金属是-------- 铬
2.金属能导电的原因是( B)
A.金属晶体中金属阳离子与自由电子间的 相互作用较弱
B.金属晶体中的自由电子在外加电场作用 下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作 用下可发生定向移动
石晶体,在一个小正四面体中平均含有
1+4×1/4 =2个碳原子;
③在金刚石中最小的环是六元环,1个环中平
均含有6×1/12=1/2个C原子,含C-C键数为
6×1/6=1;
④金刚石的晶胞中含有C原子为8个,内含4个
小正四面体,含有C-C键数为16。
.
3
二氧化硅晶体结构示意图
Si
O
180º
109º28´
金属容易导热,是由于自由电子运动时与金 属离子碰撞把能量从温度高的部分传到温度低 的部分,从而使整块金属达到相同的温度。
.
14
⑶、金属晶体结构与金属延展性的关系
【讨论3】金属为什么具有较好的延展性?
原子晶体受外力作用时,原子间的位移必 然导致共价键的断裂,因而难以锻压成型, 无延展性。而金属晶体中由于金属离子与自 由电子间的相互作用没有方向性,各原子层 之间发生相对滑动以后,仍可保持这种相互 作用,因而即使在外力作用下,发生形变也 不易断裂。
导Байду номын сангаас物质
离子晶体
金属晶体
导电时的状态 溶液或熔融液
固态或液态
导电粒子 阴离子和阳离子
自由电子
升温时 导电能力
增强
减弱
.
13
⑵、金属晶体结构与金属导热性的关系 【讨论2】金属为什么易导热?
自由电子在运动时经常与金属离子碰撞,引 起两者能量的交换。当金属某部分受热时,那 个区域里的自由电子能量增加,运动速度加快, 通过碰撞,把能量传给金属离子。
.
5
【总结】非金属单质是原子晶体还是分子晶体的
判断方法
(1)依据组成晶体的粒子和粒子间的作用判断:
原子晶体的粒子是原子,质点间的作用是共价键;
分子晶体的粒子是分子,质点间的作用是范德华力。
(2)记忆常见的、典型的原子晶体。
(3)依据晶体的熔点判断:原子晶体熔、沸点高,
常在1000℃以上;分子晶体熔、沸点低,常在数百
延性最好的金属是-------- 铂
展性最好的金属是-------- 金
最活泼的金属是---------- 铯
最稳定的金属是---------- 金
.
19
练习
1.金属晶体的形成是因为晶体中存在( A.金属离子间的相互作用
C)
B.金属原子间的相互作用
C.金属离子与自由电子间的相互作用
D.金属原子与自由电子间的相互作用
共价键
.
4
①二氧化硅中Si原子均以sp3杂化,分别 与4个O原子成键,每个O原子与2个Si原子 成键;
②晶体中的最小环为十二元环,其中有6 个Si原子和6个O原子,含有12个Si-O键; 每个Si原子被12个十二元环共有,每个O原 子被6个十二元环共有,每个Si-O键被6个 十二元环共有;每个十二元环所拥有的Si 原子数为6×1/12=1/2,拥有的O原子数为 6×1/6=1,拥有的Si-O键数为12×1/6=2, 则Si原子数与O原子数之比为1:2。
容易导电、导热、有延展性、有金属光泽等。
金属为什么具有这些共同性质呢? 2、金属的结构
.
9
㈠、金属键
(1)定义: 金属离子和自由电子之间的相互作用。
(2)成键微粒: 金属阳离子和自由电子
(3)键的存在: 金属单质和合金中
(4)方向性: 无方向性
(5)键的本质: 电子气理论
金属原子脱落下来的价电子形成遍布整晶体
.
11
3、金属晶体的结构与金属性质的内在联系
⑴、金属晶体结构与金属导电性的关系
【讨论1】 金属为什么易导电?
在金属晶体中,存在着许多自由电子,这些自由 电子的运动是没有一定方向的,但在外加电场的条件 下自由电子就会发生定向运动,因而形成电流,所以 金属容易导电。
.
12
比较离子体导电与金属晶体导电的区别:
.
15
金属的延展性
外力
自由电子
金属离子
.
16
⑷、金属晶体结构具有金属光泽和颜 色
• 由于自由电子可吸收所有频率的光,然后 很快释放出各种频率的光,因此绝大多数 金属具有银白色或钢灰色光泽。而某些金 属(如铜、金、铯、铅等)由于较易吸收 某些频率的光而呈现较为特殊的颜色。
• 当金属成粉末状时,金属晶体的晶面取向 杂乱、晶格排列不规则,吸收可见光后辐 射不出去,所以成黑色。
干冰的晶体结构图
分子的密堆积
(与CO2分子距离最近的 CO2分子共有12个 )
.
1
金刚石的晶体结构示意图
109º28´
共价键
.
2
①金刚石中每个C原子以sp3杂化,分别与4个
相邻的C 原子形成4个σ键,故键角为
109°28′,每个C原子的配位数为4;
②每个C原子均可与相邻的4个C构成实心的正
四面体,向空间无限延伸得到立体网状的金刚
度以下至很低的温度。
(4)依据导电性判断:分子晶体为非导体,但部
分分子晶体溶于水后能导电;原子晶体多数为非导
体,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断:原子晶体硬度大,
分子晶体硬度小且较脆。
.
6
修高 3二 )化 第学 三( 章选
第三节
金属晶体
Ti
.
7
金属样品
Ti
.
8
1、金属共同的物理性质
