无机分析化学第7章 习题解答
分析化学第六版第7章 氧化还原滴定法及答案

第七章氧化还原滴定法一、判断题(对的打√, 错的打×)1、条件电位的大小反映了氧化还原电对实际氧化还原能力。
()2、以滴定反应时自身颜色变化为指示剂的物质称为自身指示剂。
()3、氧化还原滴定中,影响电势突跃范围大小的主要因素是电对的电位差,而与溶液的浓度几乎无关。
()4、重铬酸钾是比高锰酸钾更强的一种氧化剂,它可以在盐酸介质中滴定。
()5、KMnO4标准溶液和K2Cr2O7标准溶液都可直接配制。
()6、溶液酸度越高,KMnO4氧化能力越强,与Na2C2O4反应越完全,所以用Na2C2O4标定KMnO4时,溶液酸度越高越好。
二、选择题1.以K2Cr2O7法测定铁矿石中铁含量时,用0.02 mol·L-1K2Cr2O7滴定。
设试样含铁以Fe2O3(M Fe2O3=159.7)表示约为50%,则试样称取量约为A 0.lgB 0.2gC 1gD 0.5g2.对称性氧化还原滴定反应,n1=1 n2=2 时,对反应平衡常数的要求是( ) A、K'≥106 B、K'≥6 C、K'≥ 8 D、K'≥1093.KMnO4法测定H2O2,为加速反应,可( )A、加热B、增大浓度C、加Mn2+D、开始多加KMnO44.已知在1mol/LH2SO4溶液中,Eº′(MnO4- / Mn2+ )=1.45V,Eº′(Fe3+/Fe2+)=0.68V在此条件下用KMnO4标准溶液滴定Fe2+,其滴定突跃的范围为( )A、0.86~1.26VB、0.86~1.41VC、0.68~1. 41VD、0.68~1.41V5、在pH=1.0的酸性溶液中,MnO4- / Mn2+ -电对的条件电位是( )(已知E ΘMnO4- / Mn2+ -=1.51V)A、1.42VB、1.51VC、1.32VD、0.059V6.下列基准物质中,既可标定NaOH,又可标定KMnO4溶液的是( )A、邻苯二甲酸氢钾B、Na2C2O4C、H2C2O4·2H2OD、Na2B4O7·10H2O 7.Na2C2O4标定KMnO4,温度控制75~85 ℃温度,过高则( )A、生成MnO2B、H2C2O2分解C、反应太快D、终点不明显8.用Na2C2O4标定KMnO4时,滴入第一滴KMnO4,颜色消褪后反应加快,原因是( ) A、溶液酸度增大B、反应放热C、产生的Mn2+起催化作用D、诱导效应9.K2Cr2O7法在酸性条件下滴定,其酸为( )A、只能用HNO3B、只能用HClC、只能用H2SO4D、HCl、H2SO4均可10.在H3PO4存在下的HCl 溶液中,用0.02mol·L-1 K2Cr2O7滴定0.1mol·L-1Fe2+,化学计量点电位为0.86V, 最合适的指示剂为( )A、次甲基蓝(Eθ'=0.36V)B、二苯胺(Eθ'= 0.76V)C、二苯胺磺酸钠(Eθ'=0.85V)D、邻二氮菲亚铁( Eθ'=1.06V)11.间接碘量法中,加入淀粉指示剂的适宜时间是()A、滴定开始时B、滴定接近终点时C、标准溶液滴定至50%时D、任何时候都可以12.用KMnO4滴定Fe2+时,Cl-的氧化被加快,这种现象称为( )A、催化反应B、自动催化反应C、氧化反应D、诱导反应13.间接碘量法中误差的主要来源有( )A、I-容易挥发B、I-容易生成I3-C、I-容易氧化D、I2容易挥发14.重铬酸钾法中加入H2SO4–H3PO4的作用有( )A.提供必要的酸度B、掩蔽Fe3+ C、提高E Fe3+/Fe2+D、降低E Fe3+/Fe2+ 15.碘量法中最主要的反应I2 + 2S2O32- = 2I- + S4O62-,应在什么条件下进行?( ) A、碱性B、强酸性C、中性弱酸性D、加热16.标定Na2S2O3溶液时,为促进KI与K2Cr2O7反应可采用的措施有( )A、增大K2Cr2O7的浓度B、增大KI的浓度C、保持溶液适当酸度D、采用棕色碘量瓶17.用Na2C2O4基准物标定KMnO4溶液,应掌握的条件有( )A、盐酸酸性B、温度在75~85℃C、需加入Mn2+催化剂D、滴定速度开始要快E、终点时,粉红色应保持30秒内不褪色18.氧化还原滴定前预处理的作用是( )A、使被测物转化成氧化态B、使被测物转化成还原态C、使被测物转化成有利于测定状态D、使干扰物沉淀除去E、使有机物氧化除去19.为下列物质含量的测定选择适当的标准溶液①CuSO4 ( ) ②Na2C2O4 ( ) ③FeSO4 ( ) ④Na2S2O3 ( )A、K2Cr2O7标准溶液B、KMnO4标准溶液C、Na2S2O3标准溶液D、I2标准溶液20.用C(NaOH)和C(1/5KMnO4)相等的两溶液分别滴定相同质量的KHC2O4H2C2O42H2O,滴定至终点时消耗的两种溶液的体积关系是( )A、V(NaOH)=V(KMnO4)B、4V(NaOH)= 3V(KMnO4)C、5V(NaOH)=V(KMnO4)D、3V(NaOH)= 4V(KMnO4)21.已知在1mol·L-1H2SO4溶液中Eθ(MnO4-/Mn2+)= 1.45V,Eθ (Fe3+/Fe2+)= 0.68V,在此条件下用KMnO4标准溶液滴定Fe2+,其计量点的电势值为( )A、0.38VB、0.89VC、1.32VD、1.49V22.在0.5mol·L-1H2SO4中,用KMnO4滴定相同浓度的下列溶液,突跃范围最大的是( )A、H2O2 (Eθ=0.68V)B、Fe2+ (Eθ=0.77V)C、H2C2O4 (Eθ= -0.49V)D、Sn2+ (Eθ=0.15V) 23.下面关于K2Cr2O7的叙述不正确的是( )A、是基准物质B、其标准溶液可用直接法配制C、是自身指示剂D、标准溶液很稳定,可长期保存三、填空题1、KMnO4法不能用HCl调节酸度的原因是_______ _____________________。
分析化学课后习题答案第七章

第七章重量分析法和沉淀滴定法思考题1.沉淀形式和称量形式有何区别?试举例说明之。
答:在重量分析法中,沉淀是经过烘干或灼烧后再称量的。
沉淀形式是被测物与沉淀剂反应生成的沉淀物质,称量形式是沉淀经过烘干或灼烧后能够进行称量的物质。
有些情况下,由于在烘干或灼烧过程中可能发生化学变化,使沉淀转化为另一物质。
故沉淀形式和称量形式可以相同,也可以不相同。
例如:BaSO4,其沉淀形式和称量形式相同,而在测定Mg2+时,沉淀形式是MgNH4PO4·6H2O,灼烧后所得的称量形式却是Mg2P2O7。
2.为了使沉淀定量完全,必须加人过量沉淀剂,为什么又不能过量太多?答:在重量分析法中,为使沉淀完全,常加入过量的沉淀剂,这样可以利用共同离子效应来降低沉淀的溶解度。
沉淀剂过量的程度,应根据沉淀剂的性质来确定。
若沉淀剂不易挥发,应过量20%~50%;若沉淀剂易挥发,则可过量多些,甚至过量100%。
但沉淀剂不能过量太多,否则可能发生盐效应、配位效应等,反而使沉淀的溶解度增大。
3.影响沉淀溶解度的因素有哪些?它们是怎样发生影响的?在分析工作中,对于复杂的情况,应如何考虑主要影响因素?答:影响沉淀溶解度的因素有:共同离子效应,盐效应,酸效应,配位效应,温度,溶剂,沉淀颗粒大小和结构等。
共同离子效应能够降低沉淀的溶解度;盐效应通过改变溶液的离子强度使沉淀的溶解度增加;酸效应是由于溶液中H+浓度的大小对弱酸、多元酸或难溶酸离解平衡的影响来影响沉淀的溶解度。
若沉淀是强酸盐,如BaSO4,AgCl等,其溶解度受酸度影响不大,若沉淀是弱酸或多元酸盐[如CaC2O4、Ca3(PO4)2]或难溶酸(如硅酸、钨酸)以及与有机沉淀剂形成的沉淀,则酸效应就很显着。
除沉淀是难溶酸外,其他沉淀的溶解度往往随着溶液酸度的增加而增加;配位效应是配位剂与生成沉淀的离子形成配合物,是沉淀的溶解度增大的现象。
因为溶解是一吸热过程,所以绝大多数沉淀的溶解度岁温度的升高而增大。
分析化学第7章课后知识题目解析

第七章氧化还原滴定1.条件电位和标准电位有什么不同?影响电位的外界因素有哪些?答:标准电极电位E′是指在一定温度条件下(通常为25℃)半反应中各物质都处于标准状态,即离子、分子的浓度(严格讲应该是活度)都是1mol/l(或其比值为1)(如反应中有气体物质,则其分压等于1.013×105Pa,固体物质的活度为1)时相对于标准氢电极的电极电位。
电对的条件电极电位(E0f)是当半反应中氧化型和还原型的浓度都为1或浓度比为,并且溶液中其它组分的浓度都已确知时,该电对相对于标准氢电极电位(且校正了各种外界因素影响后的实际电极电位,它在条件不变时为一常数)。
由上可知,显然条件电位是考虑了外界的各种影响,进行了校正。
而标准电极电位则没有校正外界的各种外界的各种因素。
影响条件电位的外界因素有以下3个方面;(1)配位效应;(2)沉淀效应;(3)酸浓度。
2.是否平衡常数大的氧化还原反应就能应用于氧化还原中?为什么?答:一般讲,两电对的标准电位大于0.4V(K>106),这样的氧化还原反应,可以用于滴定分析。
实际上,当外界条件(例如介质浓度变化、酸度等)改变时,电对的标准电位是要改变的,因此,只要能创造一个适当的外界条件,使两电对的电极电位超过0.4V ,那么这样的氧化还原反应也能应用于滴定分析。
但是并不是平衡常数大的氧化还原反应都能应用于氧化还原滴定中。
因为有的反应K虽然很大,但反应速度太慢,亦不符合滴定分析的要求。
3.影响氧化还原反应速率的主要因素有哪些?答:影响氧化还原反应速度的主要因素有以下几个方面:1)反应物的浓度;2)温度;3)催化反应和诱导反应。
4.常用氧化还原滴定法有哪几类?这些方法的基本反应是什么?答:1)高锰酸钾法.2MnO4+5H2O2+6H+==2Mn2++5O2↑+8H2O.MnO2+H2C2O4+2H+==Mn2++2CO2+2H2O2) 重铬酸甲法. Cr2O72-+14H++Fe2+===2Cr3++Fe3++7H2OCH3OH+Cr2O72-+8H+===CO2↑+2Cr3++6H2O3)碘量法3I2+6HO-===IO3-+3H2O,2S2O32-+I2===2I-+2H2OCr2O72-+6I-+14H+===3I2+3Cr3++7H2O5.应用于氧化还原滴定法的反应具备什么条件?答:应用于氧化还原滴定法的反应,必须具备以下几个主要条件:(1)反应平衡常数必须大于106,即△E>0.4V。
《分析化学》第7章》基于沉淀反应的分析法及答案

1、(摩尔法的操作注意点) 摩尔法测Cl-时,使用的铬酸钾指示剂越多,终点颜色变化越明显,故铬酸钾用量应多些。
(×)2、(摩尔法的操作注意点) 摩尔法既适用于测Cl-,也适用于测Br-和I-。
(×)3、(吸附指示剂的原理) 法扬司法中指示剂在吸附前后颜色不同从而起指示作用。
(√)4、(法扬司法的注意点) 法扬司法中滴定生成的不溶物应尽可能为不聚沉的胶体,可加入糊精,防止凝聚。
(√)5、(法扬司法的注意点) 法扬司法中滴定生成的胶体应对指示剂吸附能力应略大于对被测离子的吸附能力。
(×)6、(佛尔哈德法的注意点) 佛尔哈德法在滴定时需剧烈振荡,以释放出被吸附的Ag+。
(√)7、(佛尔哈德法的注意点) 佛尔哈德法使用硫酸铁铵作指示剂,可在pH中性或碱性条件下滴定。
(×)8、(重量分析法注意点) 重量分析法一般不适用于低含量组分分析。
(√)9、(沉淀形式与称量形式的概念) 沉淀重量分析法中沉淀形式与称量形式的化学组成可以相同也可以不同。
(√)9、(影响沉淀完全的因素) 用Cl-沉淀Ag+时,可利用Cl-的同离子效应使Ag+沉淀彻底,所以Cl-浓度越高越好。
(×)10、(如何形成晶形沉淀) 沉淀重量分析法中,待测离子形成沉淀的溶度积越小越好。
(×)11、(如何形成晶形沉淀) 高价金属离子形成氢氧化物沉淀,如Fe(OH)3,易于形成晶形沉淀。
(×)12、(如何形成晶形沉淀) 为防止沉淀溶解,沉淀重量分析法操作中不应包含加热过程。
(×)13、(如何形成晶形沉淀) 沉淀重量分析法中应尽可能加快沉淀,以减少分析时间。
(×)14、AgCl在0.1mol/L的NaCl溶液中或在0.1mol/L的NaNO3溶液的溶解度均比在纯水中小。
(×)15、佛尔哈德返滴定法测氯离子时,先加入准确过量的AgNO3,再用NH4SCN标准溶液返滴过量的Ag+,若未加硝基苯保护生成的AgCl沉淀,测定出的氯离子会偏高。
分析化学作业5(第七章)参考答案

7-1 解释下列现象:(简明扼要即可,必要时可配合公式)(1)将氯水慢慢加入到含有Br -和I -的酸性溶液中,以CCl 4萃取后,CCl 4层变为紫色。
答:查附录9可得以下数据V 545.0V 05.1V36.1V 45.1I /I Br /Br Cl/ClCl /HClO 332=ϕ=ϕ=ϕ=ϕθθθθ------ 可知氯水中的Cl 2及HClO 可将酸性溶液中的I -和Br -氧化为I 2和Br 2,I 2和Br 2更易溶于CCl 4,故可被CCl 4萃取,使CCl 4层呈紫色(I 2的紫色比Br 2的棕红色明显)。
(2)V 159.0V 534.0Cu /Cu I/I22=ϕ>=ϕθθ++-,但是Cu 2+却能将I -氧化为I 2。
答:12sp Cu /Cu CuI /Cu 101.11lg 059.0159.0)CuI (K 1lg059.022-θθ⨯+=+ϕ=ϕ+++ V 534.0V 865.0I /I 3=ϕ>=θ--(具体计算过程不必列出,只回答原因即可) 即Cu +可与I -生成溶解度很小的CuI 沉淀(pK sp =11.96)而大大降低了溶液中Cu +的浓度,从而使得Cu 2+/Cu +的电极电位显著增高,以致可将I -氧化为I 2。
(3)Fe 2+的存在加速KMnO 4氧化Cl -的反应。
答:Mn VII 氧化Cl -的反应很慢,通常可认为难以发生。
但体系中若有Fe 2+共存,则Mn VII 氧化Fe 2+的过程中可形成一系列Mn 的中间产物:Mn VI 、Mn V 、Mn IV 、Mn III ,它们均可较快的氧化Cl -,因此可诱导Cl -被Mn VII 氧化的速率加速。
(4)以KMnO 4滴定-222O C 时,滴入KMnO 4的红色消失速度由慢到快。
答:KMnO 4 与 C 2O 42-的反应速度很慢,但反应产物Mn II 可催化该反应。
开始反应时,由于没有或仅含极少量的Mn II ,故反应速度很慢,KMnO 4的红色消失得很慢;但随着反应进行,Mn II 不断产生,使得反应越来越快,KMnO 4红色消失速度亦逐渐加快。
无机及分析化学第七章选择题及答案

20. 重量分析中的沉淀形式应当符合(D)A. 溶解度小B. 沉淀纯净含杂质少C. 相对分子量尽量大D. A、B和C17. Ca3(PO4)2的溶解度为a/2 mol·L-1,其Ksp为 ( D)(A). 36a5 (B) 4 a5/ 9 (C) 9a5 /4 (D) 27a5 /87.已知在一定的温度下,CdCO3的Ksp=×10-12,Cd(OH)2的Ksp=×10-14,那么它们在水中的溶解度:( B )>Cd(OH)2 <Cd(OH)2= Cd(OH)2D.不能确定13. AgNO3处理[Fe(H2O)5Cl]Br溶液,产生沉淀主要是 ( A )A. AgBrB. AgClC. AgBr和AgClD. Fe(OH)3存在下,AgCl的溶解度比纯水中大,原因是(C)(A)同离子效应(B)酸效应(C)盐效应(D)配位效应9. 在沉淀反应中,加入易溶电解质会使沉淀的溶解度增加,该现象是( B)A. 同离子效应B. 盐效应C. 酸效应D. 配位效应5. 某物质的化学式是AB3,其溶解度S和容度积常数KspΘ的关系式是(C)A. Ksp Θ=2S2 B. KspΘ=2S3 C. KspΘ=27S4 D. KspΘ=4S29、已知在一定的温度下,CdCO3的Ksp=×10-12,Cd(OH)2的Ksp=×10-14,那么它们在水中的溶解度:B(1)CdCO3>Cd(OH)2(2)CdCO3<Cd(OH)2(3)CdCO3= Cd(OH)2(4)不能确定16、Ag2S的溶度积Ksp的表示式为:D(1)Ksp =c(Ag+)c(s2-) (2)Ksp= c(Ag+)c(s2-) 2(3)Ksp = 2c(Ag+)c(s2-) (4)Ksp= c(Ag+) 2c(s2-)11. 过量AgCl溶解在下列各物质中,问哪种溶液中Ag+浓度最小(D)A. 100 cm3水B. 1000 cm3水C. 1000 cm3 mol·dm-3KNO3溶液 D. 100 cm3 mol·dm-3KCl溶液20.关于晶型沉沉淀的条件,下列说法错误的是: ( D)(A)沉淀反应应当在适当稀的溶液中进行;(B)沉淀作用应当在热溶液中进行;(C)沉淀完毕后进行陈化使沉淀晶体完整、纯净;(D)当沉淀剂是挥发性物质时,沉淀剂用量应为其理论用量的200%为宜。
兰叶青无机及分析化学课后习题答案(所有章节)

第二章 习题解答2-10解:(1)×;(2)×;(3)√;(4)×;(5)×;(6)×;(7)×;(8)×;(9);(10)×;(11)×2-11解:(1)敞开体系;(2)孤立体系;(3)敞开体系;2-12解:(1) Q =100kJ W=-500 kJ △U = Q + W=-400 kJ(2)Q =-100kJ W=500 kJ △U = Q + W=400 k2-13解:因为此过程为可逆相变过程,所以Q p =△H= ·mol -1W=-p 外△V ≈-n R T =-×=- kJ ·mol -1 △U = Q + W= +(-)= kJ ·mol -12-14解:(1)r m B f m Bf m 2f m f m f m 231B)3CO g Fe,s 3CO,g Fe O ,s 3393.51203(110.52)(822.2)26.77kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯---=-⋅∑((,)+2()()()()+ΘΘΘΘΘΘ(2)r m B f m Bf m 2f m 2f m f m 21B)CO g H ,g CO,g H O,g 393.510(110.52)(241.82)41.17kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=-----=-⋅∑((,)+()()()()+ΘΘΘΘΘΘ(3)r m B f m Bf m 2f m f m 2f m 31B)6H O l NO,g 5O ,g 4NH ,g 6285.834(90.25)504(46.11)1169.54kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯-⨯-=-⋅∑((,)+4()()()()+ΘΘΘΘΘΘ2-15解:乙醇的Θm f H ∆反应r m H ∆Θ为:(4) 2C (s ,石墨)+3H 2(g )+1/2O 2(g )= C 2H 5OH (l ),所以:反应(4)=反应(2)×2+反应(3)×3-反应(1)r m r m r m r m -1(4)2(2)3(3)(1)2(393.5)3(571.6)(1366.7)1135.1kJ mol H H H H ∆=∆+∆-∆=⨯-+⨯---=-⋅ΘΘΘΘ对反应2C (s ,石墨)+ 2H 2(g )+ H 2O (l )= C 2H 5OH (l )r m f m f m 2f m 2f m 1()(H O,l)2(H ,g)2(C,s)1135.1(285.83)2020849.27kJ mol H H H H H -∆=∆-∆-∆-∆=----⨯-⨯=-⋅乙醇ΘΘΘΘΘ虽然,该反应的r m H ∆Θ<0(能量下降有利),但不能由r m H ∆Θ单一确定反应的方向,实际反应中还须考虑其他因素,如:混乱度、反应速率等。
第七章习题答案

第七章1.计算氢原子核外电子从第三能级跃迁到第二能级时产生的谱线H α的波长与频率。
解: ν = R H ⎪⎭⎫ ⎝⎛-222111n n= 3.289 ⨯ 1015⎪⎪⎭⎫⎝⎛-223121s -1= 4.57⨯1014s -1νλc= =11418s 1057.4s m 10998.2--⨯⋅⨯= 656⨯10-9m= 656nm2.计算基态氢原子的电离能为多少? 解: I = ∆E = h ν= 6.626⨯10-34 J ⋅s ⨯3.289⨯1015s -1(1/12 -1/∞)=2.179⨯10-18J3.下列各组量子数哪些是不合理的?为什么?n l m(1) 2 1 0(2) 2 2 -1(3) 2 3 +2解:(1)合理;(2) l 取值不合理,应小于n ;(3) l 、m 取值不合理,l 应小于n ,m 取值为0, ±1, ±2,⋯ ± l ;4.用合理的量子数表示:(1)3d 能级; (2)4s 1电子解:(1)3d 能级: n =3,l =2;(2)4s 1电子:n =4,l =0,m = 0;5.分别写出下列元素基态原子的电子分布式,并分别指出各元素在周期表中的位置。
9F 10Ne 25Mn 29Cu 24Cr 55Cs 71Lu解:9F 1s 22s 22p 5 第二周期VIIA 族 10Ne [He]2s 22p 6 第二周期VIIIA 族25Mn [Ar]3d 54s 2 第四周期VIIB 族 29Cu [Ar]3d 104s 1 第四周期I B 族24Cr [Ar]3d 54s 1 第四周期VI B 族 55Cs [Xe]6s 1 第六周期I A 族71Lu [Xe]4f 145d 16s 2 第六周期IIIB 族6.以(1)为例,完成下列(2)~(4)题。
(1)Na (Z = 11) [Ne]3s 1 ; (3 ) (Z =24) [ ? ] 3d 54s 1;(2) 1s 22s 22p 63s 23p 3 ; (4 ) Kr (Z = ) [ ? ] 3d 104s 24p 6;解:(1) Na (Z = 11) [Ne]3s 1 ; (3 ) Cr (Z =24) [Ar ] 3d 54s 1;(2) P(Z=15) 1s 22s 22p 63s 23p 3 ; (4 ) Kr (Z = 36 ) [Ar] 3d 104s 24p 6;7.写出下列离子的最外层电子分布式:S 2-K + Pb 2+ Ag + Mn 2+ Co 2+ 解:8.试完成下表。
无机化学第四版第七章思考题与习题答案

无机化学第四版第七章思考题与习题答案第七章固体的结构与性质思考题1.常用的硫粉是硫的微晶,熔点为112.8℃,溶于CS2,CCl4等溶剂中,试判断它属于哪一类晶体?分子晶体2.已知下列两类晶体的熔点:(1) 物质NaF NaCl NaBr NaI熔点/℃993 801 747 661(2) 物质SiF4SiCl4SiBr4 SiI4熔点/℃ -90.2 -70 5.4 120.5为什么钠的卤化物的熔点比相应硅的卤化物的熔点高? 而且熔点递变趋势相反? 因为钠的卤化物为离子晶体,硅的卤化物为分子晶体,所以钠的卤化物的熔点比相应硅的卤化物的熔点高,离子晶体的熔点主要取决于晶格能,NaF、NaCl、NaBr、NaI随着阴离子半径的逐渐增大,晶格能减小,所以熔点降低。
分子晶体的熔点主要取决于分子间力,随着SiF4、SiCl4、SiBr4、SiI4相对分子质量的增大,分子间力逐渐增大,所以熔点逐渐升高。
3. 当气态离子Ca2+,Sr2+,F-分别形成CaF2,SrF2晶体时,何者放出的能量多?为什么?形成CaF2晶体时放出的能量多。
因为离子半径r(Ca2+)<r(Sr2+),形成的晶体CaF2的核间距离较小,相对较稳定的缘故。
4. 解释下列问题:(1)NaF的熔点高于NaCl;因为r(F-)<r(Cl-),而电荷数相同,因此,晶格能:NaF>NaCl。
所以NaF的熔点高于NaCl。
(2)BeO的熔点高于LiF;由于BeO中离子的电荷数是LiF 中离子电荷数的2倍。
晶格能:BeO>LiF。
所以BeO的熔点高于LiF。
(3)SiO2的熔点高于CO2;SiO2为原子晶体,而CO2为分子晶体。
所以SiO2的熔点高于CO2。
(4)冰的熔点高于干冰(固态CO2);它们都属于分子晶体,但是冰分子中具有氢键。
所以冰的熔点高于干冰。
(5)石墨软而导电,而金刚石坚硬且不导电。
石墨具有层状结构,每个碳原子采用SP2杂化,层与层之间作用力较弱,同层碳原子之间存在大π键,大π键中的电子可以沿着层面运动。
无机及分析化学第7章 习题解答

第七章 水溶液中的解离平衡 习题解答1.写出下列物质的共轭酸。
S 2-、SO 42-、H 2PO 4-、HSO 4-、NH 3、NH 2OH 、55C H N 。
1.依次为:HS -、HSO 4-、H 3PO 4、H 2SO 4、NH 4+、NH 2OH ⋅H +、55C H N ⋅H +。
2.写出下列物质的共轭碱。
H 2S 、HSO 4-、H 2PO 4-、H 2SO 4、NH 3、NH 2OH 、3+26[Al(H O)]。
2.依次为:HS -、SO 42-、HPO 42-、HSO 4-、NH 2-、NH 2O -、2+25[Al(OH)(H O)]。
3.根据酸碱质子理论,按由强到弱的顺序排列下列各碱。
NO 2-、SO 42-、HCOO -、HSO 4-、Ac -、CO 32-、S 2-、ClO 4-。
3.下列碱由强到弱的顺序:S 2-> CO 32-> Ac-> HCOO-> NO 2-> SO 42-> HSO 4-> ClO 4-1414.151010-- 1410.251010-- 144.741010-- 143.741010-- 143.371010-- 141.991010--4.pH =7.00的水溶液一定是中性水溶液吗?请说明原因。
4.不一定。
K w 随温度的改变而改变,在常温下它的值为10-14,此时的中性溶液pH 为7.005.常温下水的离子积w K θ=1.0×10-14,是否意味着水的解离平衡常数K θ=1.0×10-14?5.不。
w K θ=[H +][OH -],而K θ=[H +][OH -]/c (H 2O);c (H 2O)=11000/18.0255.5mol L 1-=⋅ 6.判断下列过程溶液pH 的变化(假设溶液体积不变),说明原因。
(1)将NaNO 2加入到HNO 2溶液中; (2)将NaNO 3加入到HNO 3溶液中; (3)将NH 4Cl 加入到氨水中; (4)将NaCl 加入到HAc 溶液中;6. (1)pH 变大。
分析化学课后习题答案第七章

第七章重量分析法和沉淀滴定法思考题1.沉淀形式和称量形式有何区别?试举例说明之。
答:在重量分析法中,沉淀是经过烘干或灼烧后再称量的。
沉淀形式是被测物与沉淀剂反应生成的沉淀物质,称量形式是沉淀经过烘干或灼烧后能够进行称量的物质。
有些情况下,由于在烘干或灼烧过程中可能发生化学变化,使沉淀转化为另一物质。
故沉淀形式和称量形式可以相同,也可以不相同。
例如:BaSO4,2+其沉淀形式和称量形式相同,而在测定Mg时,沉淀形式是MgNH4PO4·6H2O,灼烧后所得的称量形式却是Mg2P2O7。
2.为了使沉淀定量完全,必须加人过量沉淀剂,为什么又不能过量太多?答:在重量分析法中,为使沉淀完全,常加入过量的沉淀剂,这样可以利用共同离子效应来降低沉淀的溶解度。
沉淀剂过量的程度,应根据沉淀剂的性质来确定。
若沉淀剂不易挥发,应过量20%~50%;若沉淀剂易挥发,则可过量多些,甚至过量100%。
但沉淀剂不能过量太多,否则可能发生盐效应、配位效应等,反而使沉淀的溶解度增大。
3.影响沉淀溶解度的因素有哪些?它们是怎样发生影响的?在分析工作中,对于复杂的情况,应如何考虑主要影响因素?答:影响沉淀溶解度的因素有:共同离子效应,盐效应,酸效应,配位效应,温度,溶剂,沉淀颗粒大小和结构等。
共同离子效应能够降低沉淀的溶解度;盐效应通过改变溶液的离子强度使沉淀的溶解度增+加;酸效应是由于溶液中H浓度的大小对弱酸、多元酸或难溶酸离解平衡的影响来影响沉淀的溶解度。
若沉淀是强酸盐,如BaSO4,AgCl等,其溶解度受酸度影响不大,若沉淀是弱酸或多元酸盐[如CaC2O4、Ca3(PO4)2]或难溶酸(如硅酸、钨酸)以及与有机沉淀剂形成的沉淀,则酸效应就很显著。
除沉淀是难溶酸外,其他沉淀的溶解度往往随着溶液酸度的增加而增加;配位效应是配位剂与生成沉淀的离子形成配合物,是沉淀的溶解度增大的现象。
因为溶解是一吸热过程,所以绝大多数沉淀的溶解度岁温度的升高而增大。
兰叶青 无机及分析化学课后答案 第七章

第 习题答案7—1解:设BaSO 4在水中的溶解度为S 1(mol ·L -1);在0.10mol•L -1Na 2SO 4溶液中的溶解度为S 2(mol ·L -1).由 )()()(aq S O aq Ba s BaSO 2424-++= 222222sp 441010BaSO Ba SO c S .S K c /c c /c S /c ΘΘΘΘΘ+-⋅+⎡⎤⎡⎤===⎣⎦⎣⎦()()()()()(纯水中) (Na 2SO 4中)已知 10sp 4BaSO 10710K .Θ-=⨯()解得 S 1=1.03×10-5mol•L -1由同离子效应知,S 2<S 1=1.03×10-5mol•L -1 所以 0.10+ S 2≈0.10 解得S 2=1.1×10-9mol•L -1 7—2解:(1)7213sp AgBr 88107710K ..Θ--=⨯=⨯()()(2)5313sp 44Mg NH PO 63102510K ..Θ--=⨯=⨯(())()(3)55213sp 32Pb IO 3110101210K ..Θ---=⨯⨯⨯⨯=⨯(())(2 3.1)7—3 解:两液混合后,13132L m o l 1001L mol 1001001001002Pb ----+⋅⨯=⋅+⨯⨯=.....c)()( 11L mol 0200L mol 1001001000400I ---⋅=⋅+⨯=.....c )()(22PbI s Pb aq 2I aq +-+ƒ()()() 根据溶度积规则,计算离子积Q :22327Q P b I 101000204010c /c c /c ...ΘΘ+---⎡⎤⎡⎤==⨯⨯=⨯⎣⎦⎣⎦()() 查表得 9sp 2PbI 84910K .Θ-=⨯() 即 )(2sp PbI Q ΘK 〉应有PbI 2沉淀产生. 7—4解:查表39sp 3Fe OH 26410K .Θ-=⨯(()) 17sp 2Fe OH 48710K .Θ-=⨯(())Fe (OH )3沉淀完全时, c (Fe 3+)≤1.0×10-5mol·L -1,此时OH c /c Θ-==()解得 c (OH -)=6.4×10-12 mol·L -1pH=14-pOH=2.81,即pH 至少为2.81。
无机及分析化学第七章答案 (2)

第七章 要求作业答案7-1 判断题 解:(1)不正确。
有些化合物不存在外界,如[PtCl 2(NH 3)2]、[CoCl 3(NH 3)3]等。
(2)不正确。
少数高氧化数的非金属元素离子也可作为形成体,如[BF 4]-、[SiF 6]2-中的B 3+、Si 4+等;另外,有些中性原子也可作形成体,如[Ni(CO)4]中的Ni 原子。
(3)不正确。
在多齿配体的螯合物中,配位体数目就不等于配位数,如[Cu(en)2]2+中。
(4)不正确。
配离子电荷应是形成体和配位体电荷的代数和。
如[Fe(CN)6]3-。
(5)正确。
7-2 填空题 解:(1)五氟·一水合铁(Ⅲ)酸铵;Fe 3+; F -,H 2O ; F ,O ; 6; sp 3d 2; 外轨(2)Co 3+;Cl -,NH 3; Cl ,N ; 6;1s 22s 22p 63s 23p 63d 6 or [Ar]3d 6;四;Ⅷ;d ;d 2sp 3;八面体;内轨型;氯化一氯·五氨合钴(III)(3)乙二胺四乙酸;1:1 (4)pH <12.47-3 选择题解 (1)D (2)B (3)A (4)B7-4 计算题1.解:(1)())L (mol 0.041000.1040Ag 1•=×=+c , ()()13L mol 1.21006.020NH -⋅=⨯=c 设平衡时[Ag(NH 3)2]+ 解离产生的Ag +的浓度为x mol·L -1。
Ag + + 2 NH 3 = [Ag(NH 3)2]+c 0/ mol·L -1 0.04 1.2 0c / mol·L -1 x 1.2-2×0.04+2x ≈ 1.12 0.04-x ≈0.04()722323107.10.1/12.1)0.1/(0.1/04.0]/)([/)(/])([⨯=•=•=++x c NH c c Ag c c NH Ag c K f θθθθ解得 c (Ag +) = x = 1.88 ×10-9 (mol·L -1)c (NH 3) ≈ 1.12 (mol·L -1)c [Ag(NH 3)2+] ≈ 0.04 (mol·L -1)(2) 在混合稀释后的溶液中加入0.010mol KCl 固体,即c (Cl -) = 0.01010000.100100⨯= (mol·L -1) ∵Q = c (Ag +)/1.0×c (Cl -)/1.0 = (1.88×10-9/1.0)×(0.10/1.0 )= 1.88×10-10 ∴Q >[]AgCl θsp K = 1.77×10-10,所以能产生AgCl 沉淀。
高教第五版分析化学课后习题及思考题答案第7章

高教第五版分析化学课后习题及思考题答案第7章第七章习题7.1 下列情况,有无沉淀生成?(1)0.001mol·L-1Ca(NO3)2溶液与0.01mol·L-1NH4HF2溶液以等体积相混合;(2)0.01mol·L-1MgCl2溶液与0.1mol·L-1NH3-1mol·L-1NH4Cl溶液等体积相混合。
解:(1)已知:K sp(CaF2)=3.4×10-11两溶液等体积混合后:[Ca2+]=5.0×10-4mol·L-1, [F-]=5.0×10-3mol·L-1,[Ca2+][F-]2=5.0×10-4×(5.0×10-3)2=2.5×10-8>K sp(CaF2)=3.4×10-11∴有沉淀生成。
(2)已知:K b(NH3)=1.8×10-5 K sp (Mg(OH)2)=1.8×10-11[Mg2+]=5.0×10-3mol·L-1, [NH3]=0.05mol·L-1, [NH4]=0.5mol·L-1,[OH-]=K b(NH3)×[NH3]=1.8×10-5×0.05=1.8×10-6mol·L-1 [NH4+] 0.5[Mg2+][OH-]2=5.0×10-3×(1.8×10-6)2=1.6×10-14<K sp∵Q <K sp∴无沉淀生成。
7.2 求氟化钙的溶解度:(1)在纯水中(忽略水解);(2)在0.01 mol·L-1CaCl2溶液中;(3)在0.01mol·L-1HCl溶液中。
解:(1)已知:K sp (CaF2)=3.4×10-11,K a(HF)=3.5×10-4[Ca2+][F-]2= s·(2s)2 = 4s3∴s = 2.0×10-4 mol·L-1(2)考虑同离子效应:[Ca2+][F-]2=0.01×(2s)2=3.4×10-11 s =2.9×10-5 mol·L-1(3)考虑酸效应:δF-= Ka(HF)=3.5×10-4=3.5×10-2 Ka+[H+] 3.5×10-4+0.01αF-=1=28.6 3.5×10-2[Ca2+][F-]2=[Ca2+][F-]2·α2=K sp·α2s =1.9×10-3 mol·L-17.3 计算PH=5.0,草酸总浓度为0.05 mol·L-1时,草酸钙的溶解度.如果溶液的体积为300mL,将溶解多少克CaC2O4?解: 已知:K a1(H2C2O4)=5.9×10-2,K a2=6.4×10-5 , K sp(CaC2O4)=1.8×10-9M(CaC2O4)=128.1α (H)=1 δ同理得:α=1.16[Ca2+][C2O42-]总= Ksp(CaC2O4) ·αC2O42-s×0.05=1.8×10-9×1.16 s = 4.2×10-8 mol·L-1溶解损失:m(CaC2O4)=4.2×10-8×0.3×128.1=1.6×10-6(g)= 1.6×10-3(mg)7.4 25℃时,铬酸银的溶解度为每升0.0279g,计算铬酸银的溶度积.解: 已知:M(Ag2CrO4)=331.73设:铬酸银(Ag2CrO4)的溶解度为S.s = 0.0279=8.41 ×10-5mol·L-1 331.73K sp =[Ag+]2[CrO42-]=( 2×8.41×10-5)2×8.41×10-5=2.38×10-127.5 为了使0.2032g (NH4)2SO4中的SO42-沉淀完全,需要每升含63g BaCl2·2H2O的溶液多少亳升?解:已知M((NH4)2SO4)=132.14, M(BaCl2·2H2O)2SO4)=244.3考虑问题的思路是,沉淀剂过量20%~50% 。
(完整版)无机及分析化学课后习题第七章答案

一、选择题在给出的4个选项中,请选出1个正确答案。
1. 下列物质中,酸的强度最大的是( D )A. HAc 4.75HAc)p θa=(K B. HCN 219HCN)p θa .(K = C. NH 4+4.75O)H NH p 23θb =⋅(K D. HCOOH 25.10HCOONa)(p θb =K 2. 某混合碱用盐酸滴定至酚酞变色,消耗V 1ml ,继续以甲基橙为指示剂消耗V 2ml ,已知V 1>V 2 ,其组成是( C )A. Na 2CO 3B. Na 2CO 3与NaHCO 3C. NaOH 与Na 2CO 3D. NaOH3. 用Na 2CO 3 为基准物质标定HCl 溶液时,下列情况对HCl 溶液的浓度不产生影响的是( A )A. 用去离子水溶解锥形瓶中的Na 2CO 3时,多加了5.0mL 去离子水B. 烘干Na 2CO 3时,温度控制300℃以上C. 滴定管未用HCl 溶液润洗D. 滴定速度太快,附着在滴定管壁上的HCl 溶液来不及流下来就读取滴定体积4. 蒸馏法测定铵盐中N 含量时,能用作吸收液的是( B )A. 硼砂B. HClC. HAcD. NH 4Cl5. 下列溶液能用HCl 或NaOH 标准溶液直接滴定的是(浓度均为0.1mol·L -1) ( D )A. NaAcB. NH 4ClC. HCND. HCOOH(K θa (HAc) = 1.79×10-5 ;K θb (NH 3) = 1.8×10-5 ;K θa (HCN) = 4.99×10-10 ; K θa (HCOOH) =1.7×10-4)6. 用返滴定法测定氨水含量,应选用的指示剂是( D )A. 酚酞B. 甲基橙C. 钙红D. 甲基红7. 用c (NaOH)=0.1000 mol·L -1的NaOH 溶液滴定相同浓度的弱酸(K a1 =8.6 ×10-2K a2 =6.3×10-7 K a3 =4.0×10-13)( B )A.有两个滴定终点,第一终点用酚酞、第二终点用甲基红指示B.有两个滴定终点,第一终点用甲基红、第二终点用酚酞指示C.只有一个终点,用酚酞指示D.只有一个终点,用甲基红指示8. 酸碱滴定中,选择酸碱指示剂可以不考虑的因素是( C )A. pH 突跃范围B. 指示剂的变色范围C. 指示剂的摩尔质量D. 要求的误差范围9. H3PO4的pKθa1, pKθa2 pKθa3分别为2.12、7.20、12.36,当pH=8.0时,H3PO4溶液体系中浓度最大的组分是( A )A. HPO42-B. H2PO4- C . H3PO4 D. PO43-二、填空题1. 下列离子HCO3―,H2O,S2-,NH4+只能作碱的是S2-,只能作酸的是NH4+,即可作酸又能作碱的是HCO3―,H2O 。
无机及分析化学 第七章氧化还原反应课后习题答案
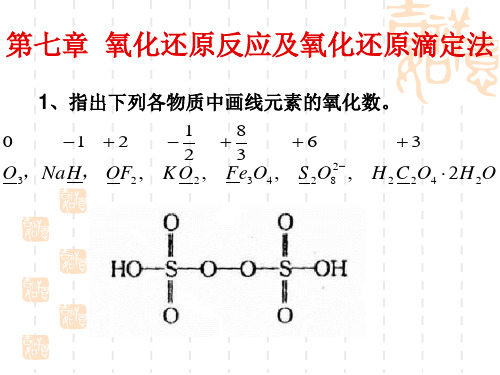
7、求下列情况下在298.15K时有关电对的电极电势。 (忽略加入固体对溶液体积变化)
nCu 2 cNa S O VNa S O 0.1000 25.13 10 3 2.513 10 3 mol
2 7 2 7
1.967 10 4 mol
解:2Cr2 O72 28H 12e 3O2 12 H 12e nO2 nCr O2
2 7
4Cr 3 14 H 2O
6 H 2O nCr O2 1.967 104
2 7
3 2
1
COD(O2, mg L )
2
0.0592 E H / H lg(1.34 103 ) 2 2 2 0.17V
9、计算在H2SO4介质中,H+浓度分别为1mol.L-1和 0.1mol.L-1的溶液中,VO2+/VO2+电对的条件电极电势 (忽略离子强度的影响)。
解:查表得VO2 2 H e VO 2 H 2 O 2 E A (VO2 / VO 2 ) E ( VO / VO ) 0.0592 lg A 2 2 E ( VO / VO ) 1.000V A 2
2
0.0592 36 0.34 lg 6.3 10 2 0.70V
(3)100kPa氢气通入0.10 mol.L-1 HCI溶液中, E H / H2 ?
0.0592 (cH / c ) E H / H2 E H / H lg 2 n (p H2 /p )
分析化学第五版第七章答案

第七章重量分析法和沉淀滴定法思考题1.沉淀形式和称量形式有何区别?试举例说明之。
答:在重量分析法中,沉淀是经过烘干或灼烧后再称量的。
沉淀形式是被测物与沉淀剂反应生成的沉淀物质,称量形式是沉淀经过烘干或灼烧后能够进行称量的物质。
有些情况下,由于在烘干或灼烧过程中可能发生化学变化,使沉淀转化为另一物质。
故沉淀形式和称量形式可以相同,也可以不相同。
例如:BaSO4,其沉淀形式和称量形式相同,而在测定Mg2+时,沉淀形式是MgNH4PO4·6H2O,灼烧后所得的称量形式却是Mg2P2O7。
2.为了使沉淀定量完全,必须加人过量沉淀剂,为什么又不能过量太多?答:在重量分析法中,为使沉淀完全,常加入过量的沉淀剂,这样可以利用共同离子效应来降低沉淀的溶解度。
沉淀剂过量的程度,应根据沉淀剂的性质来确定。
若沉淀剂不易挥发,应过量20%~50%;若沉淀剂易挥发,则可过量多些,甚至过量100%。
但沉淀剂不能过量太多,否则可能发生盐效应、配位效应等,反而使沉淀的溶解度增大。
3.影响沉淀溶解度的因素有哪些?它们是怎样发生影响的?在分析工作中,对于复杂的情况,应如何考虑主要影响因素?答:影响沉淀溶解度的因素有:共同离子效应,盐效应,酸效应,配位效应,温度,溶剂,沉淀颗粒大小和结构等。
共同离子效应能够降低沉淀的溶解度;盐效应通过改变溶液的离子强度使沉淀的溶解度增加;酸效应是由于溶液中H+浓度的大小对弱酸、多元酸或难溶酸离解平衡的影响来影响沉淀的溶解度。
若沉淀是强酸盐,如BaSO4,AgCl等,其溶解度受酸度影响不大,若沉淀是弱酸或多元酸盐[如CaC2O4、Ca3(PO4)2]或难溶酸(如硅酸、钨酸)以及与有机沉淀剂形成的沉淀,则酸效应就很显著。
除沉淀是难溶酸外,其他沉淀的溶解度往往随着溶液酸度的增加而增加;配位效应是配位剂与生成沉淀的离子形成配合物,是沉淀的溶解度增大的现象。
因为溶解是一吸热过程,所以绝大多数沉淀的溶解度岁温度的升高而增大。
分析化学第六版第7章氧化还原滴定法及答案

分析化学第六版第7章氧化还原滴定法及答案第七章氧化还原滴定法一、判断题(对的打√, 错的打×)1、条件电位的大小反映了氧化还原电对实际氧化还原能力。
()2、以滴定反应时自身颜色变化为指示剂的物质称为自身指示剂。
()3、氧化还原滴定中,影响电势突跃范围大小的主要因素是电对的电位差,而与溶液的浓度几乎无关。
()4、重铬酸钾是比高锰酸钾更强的一种氧化剂,它可以在盐酸介质中滴定。
()5、KMnO4标准溶液和K2Cr2O7标准溶液都可直接配制。
()6、溶液酸度越高,KMnO4氧化能力越强,与Na2C2O4反应越完全,所以用Na2C2O4标定KMnO4时,溶液酸度越高越好。
二、选择题1.以K2Cr2O7法测定铁矿石中铁含量时,用0.02 mol·L-1K2Cr2O7滴定。
设试样含铁以Fe2O3(M Fe2O3=159.7)表示约为50%,则试样称取量约为A 0.lgB 0.2gC 1gD 0.5g2.对称性氧化还原滴定反应,n1=1 n2=2 时,对反应平衡常数的要求是( ) A、K'≥106 B、K'≥6 C、K'≥ 8 D、K'≥109 3.KMnO4法测定H2O2,为加速反应,可( )A、加热B、增大浓度C、加Mn2+D、开始多加KMnO44.已知在1mol/LH2SO4溶液中,Eo′(MnO4- / Mn2+ )=1.45V,Eo′(Fe3+/Fe2+)=0.68V在此条件下用KMnO4标准溶液滴定Fe2+,其滴定突跃的范围为( )A、0.86~1.26VB、0.86~1.41VC、0.68~1. 41VD、0.68~1.41V5、在pH=1.0的酸性溶液中,MnO4- / Mn2+ -电对的条件电位是( )(已知E ΘMnO4- / Mn2+ -=1.51V)A、1.42VB、1.51VC、1.32VD、0.059V6.下列基准物质中,既可标定NaOH,又可标定KMnO4溶液的是( )A、邻苯二甲酸氢钾B、Na2C2O4C、H2C2O4·2H2OD、Na2B4O7·10H2O 7.Na2C2O4标定KMnO4,温度控制75~85 ℃温度,过高则( )A、生成MnO2B、H2C2O2分解C、反应太快D、终点不明显8.用Na2C2O4标定KMnO4时,滴入第一滴KMnO4,颜色消褪后反应加快,原因是( ) A、溶液酸度增大B、反应放热C、产生的Mn2+起催化作用D、诱导效应9.K2Cr2O7法在酸性条件下滴定,其酸为( )A、只能用HNO3B、只能用HClC、只能用H2SO4D、HCl、H2SO4均可10.在H3PO4存在下的HCl 溶液中,用0.02mol·L-1 K2Cr2O7滴定0.1mol·L-1Fe2+,化学计量点电位为0.86V, 最合适的指示剂为( )A、次甲基蓝(Eθ'=0.36V)B、二苯胺(Eθ'= 0.76V)C、二苯胺磺酸钠(Eθ'=0.85V)D、邻二氮菲亚铁( Eθ'=1.06V)11.间接碘量法中,加入淀粉指示剂的适宜时间是()A、滴定开始时B、滴定接近终点时C、标准溶液滴定至50%时D、任何时候都可以12.用KMnO4滴定Fe2+时,Cl-的氧化被加快,这种现象称为( )A、催化反应B、自动催化反应C、氧化反应D、诱导反应13.间接碘量法中误差的主要来源有( )A、I-容易挥发B、I-容易生成I3-C、I-容易氧化D、I2容易挥发14.重铬酸钾法中加入H2SO4–H3PO4的作用有( )A.提供必要的酸度B、掩蔽Fe3+ C、提高E Fe3+/Fe2+D、降低E Fe3+/Fe2+ 15.碘量法中最主要的反应I2 + 2S2O32- = 2I- + S4O62-,应在什么条件下进行?( ) A、碱性B、强酸性C、中性弱酸性D、加热16.标定Na2S2O3溶液时,为促进KI与K2Cr2O7反应可采用的措施有( )A、增大K2Cr2O7的浓度B、增大KI的浓度C、保持溶液适当酸度D、采用棕色碘量瓶17.用Na2C2O4基准物标定KMnO4溶液,应掌握的条件有( )A、盐酸酸性B、温度在75~85℃C、需加入Mn2+催化剂D、滴定速度开始要快E、终点时,粉红色应保持30秒内不褪色18.氧化还原滴定前预处理的作用是( )A、使被测物转化成氧化态B、使被测物转化成还原态C、使被测物转化成有利于测定状态D、使干扰物沉淀除去E、使有机物氧化除去19.为下列物质含量的测定选择适当的标准溶液①CuSO4 ( ) ②Na2C2O4 ( ) ③FeSO4 ( ) ④Na2S2O3 ( )A、K2Cr2O7标准溶液B、KMnO4标准溶液C、Na2S2O3标准溶液D、I2标准溶液20.用C(NaOH)和C(1/5KMnO4)相等的两溶液分别滴定相同质量的KHC2O4H2C2O42H2O,滴定至终点时消耗的两种溶液的体积关系是( )A、V(NaOH)=V(KMnO4)B、4V(NaOH)= 3V(KMnO4)C、5V(NaOH)=V(KMnO4)D、3V(NaOH)= 4V(KMnO4)21.已知在1mol·L-1H2SO4溶液中Eθ(MnO4-/Mn2+)= 1.45V,Eθ (Fe3+/Fe2+)= 0.68V,在此条件下用KMnO4标准溶液滴定Fe2+,其计量点的电势值为( )A、0.38VB、0.89VC、1.32VD、1.49V22.在0.5mol·L-1H2SO4中,用KMnO4滴定相同浓度的下列溶液,突跃范围最大的是( )A、H2O2 (Eθ=0.68V)B、Fe2+ (Eθ=0.77V)C、H2C2O4 (Eθ= -0.49V)D、Sn2+ (Eθ=0.15V) 23.下面关于K2Cr2O7的叙述不正确的是( )A、是基准物质B、其标准溶液可用直接法配制C、是自身指示剂D、标准溶液很稳定,可长期保存三、填空题1、KMnO4法不能用HCl调节酸度的原因是_______ _____________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章 水溶液中的解离平衡 习题解答1.写出下列物质的共轭酸。
S 2-、SO 42-、H 2PO 4-、HSO 4-、NH 3、NH 2OH 、55C H N 。
1.依次为:HS -、HSO 4-、H 3PO 4、H 2SO 4、NH 4+、NH 2OH ⋅H +、55C H N ⋅H +。
2.写出下列物质的共轭碱。
H 2S 、HSO 4-、H 2PO 4-、H 2SO 4、NH 3、NH 2OH 、3+26[Al(H O)]。
Q56 2.依次为:HS -、SO 42-、HPO 42-、HSO 4-、NH 2-、NH 2O -、2+25[Al(OH)(H O)]。
3.根据酸碱质子理论,按由强到弱的顺序排列下列各碱。
NO 2-、SO 42-、HCOO -、HSO 4-、Ac -、CO 32-、S 2-、ClO 4-。
3.下列碱由强到弱的顺序: S 2- > CO 32- > Ac -> HCOO - > NO 2- > SO 42-> HSO 4- > ClO 4-1414.151010-- 1410.251010-- 144.741010-- 143.741010-- 143.371010-- 141.991010-- 4.pH =7.00的水溶液一定是中性水溶液吗?请说明原因。
4.不一定。
K w 随温度的改变而改变,在常温下它的值为10-14,此时的中性溶液pH 为7.00 5.常温下水的离子积wK θ=1.0×10-14,是否意味着水的解离平衡常数K θ=1.0×10-14?5.不。
wK θ=[H +][OH -],而K θ=[H +][OH -]/c (H 2O);c (H 2O)=11000/18.0255.5mol L 1-=⋅ 6.判断下列过程溶液pH 的变化(假设溶液体积不变),说明原因。
(1)将NaNO 2加入到HNO 2溶液中; (2)将NaNO 3加入到HNO 3溶液中; (3)将NH 4Cl 加入到氨水中; (4)将NaCl 加入到HAc 溶液中;6. (1)pH 变大。
同离子效应使HNO 2的解离度减小。
(2)pH 稍变大。
加入的盐使得氢离子活度变小。
(3)pH 变小。
同离子效应,使氨水的解离度减小。
(4)pH 稍变小。
盐效应。
7.写出下列溶液的质子条件式:(1)32NH H O ⋅ (2) NaHCO 3 (3) Na 2CO 3 (4) NH 4HCO 3 (5) NH 4H 2PO 47.(1)32NH H O ⋅ 选择2H O 和32NH H O ⋅为参考水准:得质子产物 参考水准 失质子产物++32++43H +H H O H OOH +HNH NH +--←−−−−−−→←−−−PBE : 4[H ][NH ][OH ]++-+=(2) 3NaHCO 选择2H O 和3HCO -为参考水准:得质子产物 参考水准 失质子产物+++-32++2333-H +H H O H OOH +H -H H CO HCO CO --←−−−−−−→←−−−−−−→PBE : +-2233[H ]+[H CO ]=[OH ]+[CO ]- (3)23Na CO 选择2H O 和23CO -为参考水准:得质子产物 参考水准 失质子产物+++-32+233+2233-H +H H O H OOH +H HCO CO +2H H CO CO ---←−−−−−−→←−−−←−−−−PBE : +323[H ]+[HCO ]+2[H CO ]=[OH ]--(4) 43NH HCO 选择2H O 、+4NH 、3HCO -为参考水准:得质子产物 参考水准 失质子产物+++3243+22333H +H H O H OOH H NH NH +H H H CO HCO CO -+++---←−−−−−−→-−−−→-←−−−−−−→PBE : +22333[H ]+[H CO ]=[OH ]+[NH ]+[CO ]--(5) 424NH H PO 选择2H O 、24H PO -、+4NH 为参考水准:得质子产物 参考水准 失质子产物+++-32++-2-34244+3-4++43-H +H H O H OOH +H -H H PO H PO HPO -2H PO -H NH NH ←−−−−−−→←−−−−−−→−−−−→−−−→PBE : +-2-3-34443[H ]+[H PO ]=[OH ]+[HPO ]+2[PO ]+[NH ] 8.已知0.010mol·L -1H 2SO 4溶液的pH =1.84,求HSO 4-的解离常数2a K θ。
8. H 2SO 4的第一级完全解离,由第一步解离出的氢离子浓度为0.010mol ⋅L -1pH =1.84时,该溶液的[H +]=0.0145 mol ⋅L -1 故由HSO 4-H ++SO 4-解离出的氢离子为0.0045 mol·L-12224a24[H ][SO ]0.0045 1.2100.0100.0045[HSO ]K θ+---===⨯-9.已知0.10mol·L -1HCN 溶液的解离度0.0063%,求溶液的pH 和HCN 的解离常数。
9.[H +]=0.0063%×0.10=6.3×10-6(mol·L -1) pH=5.20226210a6[H ][H ](6.310) 4.010[HCN]0.10[H ]0.10 6.310K θ++--+-⨯====⨯--⨯ 10.已知0.10 mol·L -1 H 3BO 3溶液的pH =5.11,试求的解离常数aK θ。
10.假设acK θ>10wK θ a/c K θ>105 则 由[H +]=a cK θ 得 5.11210a(10) 6.03100.1K θ--==⨯结果证明假设成立,故aK θ=6.03×10-1011.在291K 、101kPa 时,硫化氢在水中的溶解度是2.61体积/1体积水。
已知291K 时,氢硫酸的解离常数为1a K θ=1.3×10-7,2a K θ=7.1×10-15。
(1)求饱和H 2S 水溶液的物质的量浓度;(2)求饱和H 2S 水溶液中H +、HS -、S 2-的浓度和pH ; (3)当用盐酸将饱和H 2S 水溶液的pH 调至2.00时,溶液中HS -和S 2-的浓度又为多少?11.(1)2.61LH 2S 的物质的量为 3310110 2.61100.109mol 8.314291pV n RT -⨯⨯⨯===⨯ 则有10.109mol/1L 0.11mol L c -==⋅(2)设[H +]=x mol·L -1 [HS -]= x mol·L -1 [H 2S]= 0.11mol·L -127a12[H ][HS ] 1.310[H S]0.11x K θ+--===⨯ 得 x =1.2×10-4mol·L -1 即[H +]=[HS -]= 1.2×10-4mol·L -1 pH=3.927152151a1a22242[H S] 1.3107.1100.11[S ]7.110mol L [H ](1.210)K K θθ-----+-⨯⨯⨯⨯===⨯⋅⨯ (3)7a10.010[HS ]1.3100.11Kθ--⨯=⨯=得[HS -]=1.4×10-6 mol·L -1同理可得7152181a1a22222[H S] 1.3107.1100.11[S ] 1.010mol L [H ](10)K K θθ-----+-⨯⨯⨯⨯===⨯⋅12.将10gP 2O 5溶于热水生成磷酸,再将溶液稀释至1.00L ,求溶液中各组分的浓度。
已知298K 时,H 3PO 4的解离常数为1a K θ=7.6×10-3,2a K θ=6.3×10-8,3a K θ=4.4×10-13。
12.()1342101H PO 0.14mol L 141.951.00c -⨯=⨯=⋅ 磷酸二级、三级解离相对一级可以忽略不计由于a1cK θ>10wK θ a1/c K θ<105 故有方程 [H +]2+K a1 [H +]-cK a1=0解得 [H +]=[H 2PO 4-]=0.029 mol·L -1 pH=1.54[H 3PO 4]=0.14-0.029=0.11 mol·L -1[HPO 42-]=3881a1a23422[H PO ]7.610 6.3100.11 6.310mol L [H ]0.029K K θθ----+⨯⨯⨯⨯==⨯⋅ [PO 43-]=3813181a1a2a33433[H PO ]7.610 6.310 4.4100.111.010mol L [H ]0.029K K K θθθ-----+⨯⨯⨯⨯⨯⨯===⨯⋅13.欲用H 2C 2O 4和NaOH 配制pH =4.19的缓冲溶液,问需0.100mol·L -1H 2C 2O 4溶液0.100 mol·L -1NaOH 溶液的体积比。
已知298K 时,H 2C 2O 4的解离常数为a1K θ=5.9×10-2,a2K θ=6.4×10-5。
13.pH=p a2K θ 即有[C 2O 42-]=[ HC 2O 4-] 由于二溶液浓度相等,故有224(H C O )12(NaOH)10.53V V ==+14.1.0 L0.20 mol·L -1盐酸和1.0 L0.40 mol·L -1的醋酸钠溶液混合,试计算 (1)溶液的pH ;(2)向混合溶液中加入10 mL 0.50 mol·L -1的NaOH 溶液后的pH ; (3)向混合溶液中加入10 mL 0.50 mol·L -1的HCl 溶液后的pH ;(4)混合溶液稀释1倍后溶液的pH 。
14.(1)[HAc]=10.20 1.0/2.00.10mol L -⨯=⋅ [Ac-]=1(0.400.20) 1.0/2.00.10mol L --⨯=⋅则a-[HAc]pH p lg 4.74[Ac ]K =-= (2)加入NaOH 后[HAc]=1(0.10 2.00.010.50)0.097mol L 2.01-⨯-⨯=⋅,[Ac-]=10.10 2.00.010.500.102mol L 2.01-⨯-⨯=⋅ pH=4.74-lg(0.097/0.102)=4.76(3)加入HCl 后[HAc]=1(0.10 2.00.010.50)0.102mol L 2.01-⨯+⨯=⋅,10.10 2.00.010.50[Ac ]0.097mol L 2.01--⨯+⨯==⋅pH=4.74+lg(0.097/0.102)=4.72(4)缓冲溶液适当倍数的稀释对其pH 无影响,pH=4.74 15.计算298K 时,下列溶液的pH 。
