Neon 细胞电转仪中文说明书(MPK5000)
3100溶氧仪中文操作手册

3.1 概述............................................................................................................................................ 15 3.2 拆箱............................................................................................................................................ 15 3.3 您接收到的物品.......................................................................................................................... 15 3.4 安装开始检查单.......................................................................................................................... 16 3.5 重新连接电池 ............................................................................................................................. 17 3.6 仪器开关和连接器 ...................................................................................................................... 18 3.7 仪器接口..................................................................................................................................... 20
Neon电转染操作步骤

Protocol for Neon transfection system (100 μl Tips) 电穿孔技术的原理电穿孔技术是利用脉冲电场改变细胞膜的状态和通透性,达到将DNA导入细胞以及促使细胞发生融合的目的。
该技术目前一方面应用于细菌、真菌、植物、昆虫和哺乳动物细胞的基因转移,另一方面应用于细胞融合,制备杂交细胞和动物克隆等影响电穿孔效率的因素电场强度:电压太低时,细胞膜的改变不足以允许DNA分子通过,而电压过高时又会造成细胞的不可逆损害。
对于大多数哺乳动物细胞而言,250~2500V/cm的电压可获得有效转染[2,3]。
电脉冲形状和长度:电脉冲形状主要有指数衰减式和方波两种,一般需20~100毫秒。
缓冲液:通常使用甘露醇和蔗糖等非离子缓冲液,但有报道认为HEPES缓冲液的转染效率更高,血清也可以提高转染效率[4]。
其它诸如转染温度、DNA浓度和构象等均会对转染效果产生影响。
1.Cultivate the required number of cells (5×105-2×106 adhere cell per each 100ul Neon Tip),the cells should be 70-90% confluent on the day of experiment. 实验前培养足够量的细胞(对于100ul的tip,每个tip需要5×105-2×106 贴壁细胞,可以根据实际情况调整),并使其在实验当天达到70%-90%的汇合度。
2.Pre-warm an aliquot of culture medium containing serum, DPBS and so on.预热实验所需的culture medium,DPBS等。
3.Prepare 6-well plate by filling the wells with 2.0 ml of culture medium containing serum andsupplements without antibiotics and pre-incubate plate in a humidified 37℃/5% CO2 incubator. 准备6孔板,在每孔中加入2.0 mL 不含抗生素的正常培养基,放到倒培养箱中预热。
API5000仪器维护简明手册详解

Note: It is essential to dissolve the Ammonium Acetate and water first. 1. Dissolve 154 milligrams of Ammonium Acetate in 300 ml of water. 2. Dissolve 699 ml of Acetonitrile + 1.0 ml of Formic Acid. 3. Mix above two together to make final API-4000 HPLC Buffer 70/30.
6.更换机械泵油
7.清洗机械泵滤网 8.仪器除尘 9.PPG质量校正 10.更换空气过滤网 11.更换PEEK管 12.更换喷雾针 13.清洗interface ,Q0, orifice内部 14.更换或清理机械泵废气回油装置
操作步骤 Gas1/2 0.7MPa, Curtain/CAD, Exhaust gas 0.35-0.4MPa 50:50 甲醇水 为流动相 200ul/min 冲洗10-20分钟 50:50 甲醇水 无尘纸 擦拭 50:50甲醇水 无尘纸 擦拭,再用甲醇擦拭,用氮气吹干。 在最高和最低标线之间(两个箭头之间)的80% 停机,冷却,放空旧油后用100ML-200ML新油冲洗,后加油至正常位 置. 需使用8mm内六角工具。(不同型号厂家的油不可混用) 拆下机械泵进气口滤网,清洗吹干,装上。 停机,打开前后盖,用氮气吹扫电路板,风扇(不要碰触电路电线) 参考装机调试手册Q1,Q3,POS,NEG测试步骤 松开滤网前固定栅板,更换新的滤网 长度确定, 使用专用切管器环形切断,切平 安装时喷针与两通接触后用工具拧紧,防止死体积 50:50 甲醇水 清洗专用大, 小棉签 无尘纸 擦拭,氮气吹干 需在工程师指导下完成, 需专用内六角工具
norma4K5K使用手册

Tecan Infinite M1000多功能微平板检测仪说明书

The Infinite M1000 has an optional state-of-the art injector module that allows the use of up to two injectors for dispensing reagents, to replace a manual pipetting step or trigger fast kinetic reactions in fluorescence, luminescence and absorbance modes. The injectors have variable volume and speed settings and can be used in combination with the ratio mode to allow fast switching of wavelengths for a wide range of applications. The instrument can be easily combined with a stacker module for batch processing of up to 50 microplates. Tecan has introduced special on-board control functions for the Infinite M1000 that allow, for example, pre-programmed measurement workflows to be initiated at the touch of a button on the instrument itself, avoiding the need to go back to your PC in between workflows. Apart from multi-channel absorbance measurements, the fully loaded platform offers you a wide range of detection modes such as fluorescence intensity top and bottom measurements, time resolved fluorescence (TRF), fluorescence Tecan is launching the Infinite M1000, its new flagship microplate reader, at LabAutomation 2008, booth 305, 27-30 January in Palm Springs, USA. The high-end detection system offers top-of-the-range quality and performance with robust and innovative new technology.The Infinite M1000 joins the Infinite 200 and Infinite 500 series of detection systems, and is the successor to Tecan’s high performance Safire 2™ microplate reader. The new platform gives excellent flexibility through its next-generation premium quad4 monochromators™, but it also provides the uncompromising sensitivity and speed typically associated with filter-based systems.The instrument’s special combination of flexibility, sensitivity and speed is ideal for bridging the drug discovery gap between research, assay development and screening in the biopharmaceutical industry, as well as for advanced research laboratories with multiple users and ever-changing applications. The platform’s modular concept allows upgrades to new detection modes at any time if further applications are required.at LabAutomation 2008The Infinite® M1000 brings flexibility, sensitivity and speed in one high-end, multimode reader, bridging the gap between research, assay development and screening.The Infinite M1000 shown with optional injector box Tecan Journal 1/2008resonance energy transfer (FRET) and fluorescence polarization (FP). Furthermore, the Infinite M1000 has been especially optimized for TR-FRET based assays as well as glow luminescence, fast luminescence and dual color luminescence assays.The Infinite M1000 supports a broad spectrum of applications including the latest biomolecular assays for primary and secondary screening; receptor-ligand binding studies and other molecular interaction assays; kinase assays; protease Infinite M1000 – features at a glancel High-end multimode microplatereaderl Equipped with premium quad4 monochromatorsl Provides a wide range of detection modes and plate formatsl Optimized for luminescence and TR-FRET-based assaysl Modular and upgradeablel Offers injector, stacker and barcode optionsl Includes special on-board control functions for plate in/out and starting measurementsl Controlled by easy to use, workflow-oriented i-Control™ softwarelCompatible with Magellan™ software for comprehensive data evaluation and processing For availability of products in your country for the identified application areas, please contact your local Tecan sales organization. For further reference, please refer to Product names and configurations as well as technical details are subject to change and the current product offerings may differ from those outlined in the text.assays; G protein-coupled receptor assays; cell-based assays; DNA/RNA quantification; and applications based on UV fluorometry.If you would like to learn more about our new flagship microplate reader, see /highend or please visit us at the Tecan booth during LabAutomation 2008 – we look forward to seeing you!A stacker module can be used for batch processing Image of the quad4 monochromatorsTecan Journal 1/2008。
经皮血氧监护仪的使用说明书++

目录目录 (1)责任声明 (5)前言 (7)第一章产品概述 (8)1.1 监护仪概述 (9)1.2 显示界面介绍 (11)1.3 按键功能与基本操作 (13)1.4 监护仪外部接口 (15)1.5 内置充电电池 (16)第二章监护仪的安装 (17)2.1 开箱并检查 (17)2.2 电器连接 (17)2.3 通电开机 (17)2.4 传感器的连接 (18)2.5 记录仪的检查 (18)第三章系统菜单 (19)3.1 病人信息管理 (19)3.2 缺省配置 (20)3.3 回顾功能 (21)3.3.1 NIBP回顾 (21)3.3.2 报警事件回顾 (22)3.3.3 趋势图回顾 (22)3.3.4 趋势表回顾 (24)3.4 监护仪信息 (25)3.5 监护仪设置 (26)3.5.1 工作界面选择 (26)3.5.2 报警限显示 (26)3.5.3 报警记录时间 (27)3.5.4 报警暂停时间 (27)3.5.5 参数报警形式 (27)3.5.6 报警音量 (27)3.5.7 系统时间设置 (27)3.5.8 记录输出设置 (28)3.5.9 事件设置 (28)3.6 监护仪维护 (28)3.7 演示功能 (29)第四章病人安全 (30)第五章维护和清洁 (32)5.1 维护检查 (32)5.2 一般清洁 (32)5.3 清洁剂的使用 (32)第六章报警 (34)6.1 报警概述 (34)6.2 报警属性 (34)6.2.1 报警类型 (34)6.2.1.1 生理报警分类 (34)6.2.1.2 报警级别 (34)6.2.1.3 可清除声光 (35)6.2.1.4 可完全清除 (35)6.3 报警提示形式 (35)6.3.1 声光特性 (35)6.3.2 文字特性 (35)6.3.3 其他 (36)6.4 报警状态 (36)6.4.1 概述 (36)6.4.2 报警静音状态 (36)6.4.3 报警声音关闭状态 (36)6.4.4 报警暂停状态 (36)6.4.5 状态切换 (36)6.5 报警方式 (37)6.5.1 概述 (37)6.5.2 适用范围 (37)6.5.3 栓锁后的报警提示 (37)6.5.4 栓锁方式的清除 (37)6.6 报警设置 (38)6.6.1 声音开关设置 (38)6.6.2 自动报警关闭 (38)6.6.3 开机时导联脱落 (39)6.7 参数报警 (39)6.8 当报警发生时应采取的措施 (39)第七章记录仪(选配) (40)7.1 记录仪的一般资料 (40)7.2 记录仪的类型 (40)7.3 记录输出 (40)7.4 记录仪操作及状态信息 (41)第八章心电和呼吸(ECG/RESP) (42)8.1 心电监护说明 (42)8.1.1 心电监护定义 (42)8.1.2 心电监护的注意事项 (42)8.2 心电监护操作方法 (43)8.2.1 准备 (43)8.2.2 安装心电导联 (44)8.3 心电图菜单 (47)8.4 心电报警信息与提示信 (49)8.5 呼吸测量 (51)8.6 RESP报警信息与提示信息 (52)8.7 维护与清洁 (53)第九章血氧饱和度(SPO2) (54)9.1 血氧饱和度监护说明 (54)9.2 血氧饱和度监护操作方法 (56)9.3 血氧饱和度监护测量限制 (57)9.4 血氧饱和度菜单 (59)9.5 血氧饱和度报警信息 (63)9.6 维护与清洁 (61)第十章体温(TEMP) (62)10.1 体温监护说明 (62)10.2 体温菜单 (62)10.3 体温报警信息与提示信息 (63)10.4 维护与清洁 (64)第十一章无创血压(NIBP) (65)11.1 无创血压监护说明 (65)11.2 无创血压监护操作方法 (65)11.2.1 NIBP测量 (65)11.2.2 NIBP参数设置与调整 (68)11.3 无创血压菜单 (69)11.4 NIBP报警信息与提示信息 (72)11.5 维护与清洁 (75)附录I附件规格 (76)I.1 ECG附件 (76)I.2 SPO2附件 (76)I.3 TEMP附件 (76)I.4 NIBP附件 (77)附录II产品规格 (78)II.1监护仪类型 (78)II.2 监护仪规格 (78)II.2.1 监护仪尺寸和重量 (78)II.2.2 工作环境 (78)II.2.3 显示信息 (78)II.2.4 电池 (78)II.2.5 记录仪 (78)II.2.6 回顾 (79)II.3ECG规格 (79)II.3.1 导联配置 (79)II.3.2 增益 (79)II.3.3 心率 (79)II.3.4 灵敏度 (79)II.3.5 输入阻抗 (79)II.3.6 带宽 (79)II.3.7 共模抑制比 (79)II.3.8 电极极化电压范围 (79)II.3.9 起搏脉冲检测 (79)II.3.10 起搏脉冲抑制 (79)II.3.11 基线恢复时间 (79)II.3.12 信号范围 (79)II.3.13 校准信号 (80)II.4 呼吸规格 (80)II.4.1 测量方式 (80)II.4.2 呼吸阻抗检测范围 (80)II.4.3 基阻抗范围 (80)II.4.4 带宽 (80)II.4.5 呼吸率 (80)II.4.6 窒息报警 (80)II.5 SPO2规格 (80)II.5.1 血氧饱和度 (80)II.5.2 脉率 (80)II.6 TEMP规格 (80)II.6.1 适用温度传感器 (80)II.6.2 通道数 (80)II.6.3 测量 (80)II.7 NIBP规格 (80)II.7.1 测量方式 (80)II.7.2 工作模式 (80)II.7.3 自动测量模式的测量间隔时间 (80)II.7.4 连续测量模式的测量时间 (81)II.7.5 脉率范围 (81)II.7.6 测量范围和精度 (81)II.6.7 过压保护 (81)责任声明本公司对于本手册的错误、安装错误、操作错误不作任何形式的担保,对于偶发或必然损坏不承担任何法律责任。
细胞电转仪操作流程

细胞电转仪操作流程
1. 细胞准备:
收集并洗涤细胞,调整细胞浓度至推荐范围,通常在10^6-10^7 cells/mL之间。
如果需要,对细胞进行特定处理,如饥饿或预热等。
2. 核酸准备:
根据实验要求准备好适量的DNA或RNA溶液,计算出每个样品所需的体积和浓度。
3. 混合细胞与核酸:
将细胞悬液与核酸溶液轻轻混匀,按照设备手册建议的比例加入到电转杯中。
4. 设置参数:
打开细胞电转仪,根据细胞类型、细胞数量以及所用仪器的操作手册设置合适的电压、脉冲长度、脉冲次数及脉冲间隔等参数。
5. 装载电转杯:
将含有细胞和核酸混合物的电转杯放入电极板之间,并确保电极接触良好。
6. 执行电击:
启动电转程序,按照预设的条件进行电转化。
7. 恢复培养:
电转完成后,迅速将电转杯中的细胞转移至预冷的含血清或其他营养成分的缓冲液中,以终止电穿孔效应,降低细胞毒性。
8. 孵育与检测:
继续将细胞在适宜温度下孵育一段时间,以便核酸整合入细胞内并表达。
在合适的时间点可以通过荧光显微镜观察、PCR扩增、Western Blot检测、流式细胞术分析等方式验证转染效率。
9. 后续处理:
根据实验目的,可以进一步进行细胞培养、基因表达功能研究、药物筛选等下游实验。
转录因子KLF6对大鼠趋化因子CCL5基因启动子活性的影响及其可能的结合部位

转录因子KLF6对大鼠趋化因子CCL5基因启动子活性的影响及其可能的结合部位刘玉;虞天一;张婧;何风霞;卢燕来;周梦雅;王璐璐;赵聃;邱文【摘要】目的:构建大鼠趋化因子CCL5基因启动子(全长和截短)荧光素酶报告质粒,检测大鼠肾小球系膜细胞(glomerular mesangial cell,GMC)中过表达Kruppel 样转录因子6(Kruppel-like factor 6,KLF6)对CCL5基因启动子活性的影响.同时,筛选KLF6与CCL5基因启动子区的结合位点.方法:采用PCR技术,将扩增出的大鼠CCL5基因启动子全长序列(-1744nt ~-14nt)插入荧光素酶报告基因载体pGL3-basic中,获得CCL5基因启动子全长荧光素酶报告质粒(pGL3-CCL5-FL).然后,将pGL3-CCL5-FL与大鼠野生型KLF6表达质粒(pIRES2/KLF6)共转染GMC,测定其荧光素酶活性.另用生物信息学软件预测CCL5基因启动子上KLF6潜在的结合位点,并据此构建出4个CCL5基因启动子截短的荧光素酶报告质粒(即pGL3-CCL5-1~4).将上述CCL5基因启动子全长和各截短的荧光素酶报告质粒分别与KLF6过表达质粒共转染GMC,再行荧光素酶活性的测定,初筛KLF6可能的结合部位.结果:菌液PCR以及核酸测序结果证实,上述所有启动子荧光素酶报告质粒均构建成功.pGL3-CCL5-FL和pIRES2/KLF6共转染GMC结果显示,CCL5基因启动子的活性显著增强.pGL3-CCL5-FL、pGL3-CCL5-1~4分别与pIRES2/KLF6共转染GMC后发现,pGL3-CCL5-4的启动活性显著降低.提示KLF6可能结合在CCL5基因启动子的-343nt ~-191nt区域.结论:本实验成功构建了大鼠CCL5基因启动子全长及截短荧光素酶报告质粒,并初步筛查出KLF6在CCL5基因启动子上可能的结合部位在-343nt ~-191nt区域.【期刊名称】《江苏大学学报(医学版)》【年(卷),期】2015(025)006【总页数】5页(P461-465)【关键词】Kruppel样转录因子6;CCL5;肾小球系膜细胞;荧光素酶报告质粒;启动子活性【作者】刘玉;虞天一;张婧;何风霞;卢燕来;周梦雅;王璐璐;赵聃;邱文【作者单位】南京医科大学免疫学系,江苏南京210029;南京医科大学免疫学系,江苏南京210029;南京医科大学免疫学系,江苏南京210029;南京医科大学免疫学系,江苏南京210029;南京医科大学免疫学系,江苏南京210029;南京医科大学免疫学系,江苏南京210029;南京医科大学免疫学系,江苏南京210029;南京医科大学免疫学系,江苏南京210029;南京医科大学免疫学系,江苏南京210029【正文语种】中文【中图分类】R393大鼠Thy-1肾炎(Thy-1 nephritis)是人类系膜增生性肾小球肾炎(mesangina1 pro1iferative g1omeru1onephritis,MsPGN)的动物模型[1],其病理变化与人类MsPGN的病变十分相似。
电转仪

美国Invitrogen公司推出的Neon电转仪,可高效地将核酸导入所有测试过的哺乳动物细胞类型中,包括难转染的细胞、原代细胞和干细胞等,具有相当出色的转染效率和极低的死亡率。
系统组成:小型的台式电穿孔仪、电子移液器吸头架、专利的电子移液器吸头和配套试剂。
特点:∙高效率——在多种细胞类型中获得90%以上的转染效率,包括原代细胞和干细胞等难转染的细胞∙灵活性——每次可轻松转染2 x 104~ 6 x 106个细胞∙简单、易用——所有细胞类型通用一个试剂盒,操作只需三步∙开放性——开放的系统,可自由优化转染参数,适应不同实验需求∙新颖的移液器吸头(电击反应室)∙∙与传统的电转杯不同,Neon;转染系统采用独特的移液器吸头给细胞传导电场。
Neon吸头的构造,延长了2个电极之间的距离,并减少了每个电极的面积。
使得细胞承受的电场更加均匀,pH值的变化更小,金属离子形成的更少,同时避免了更多热量的产生。
此外,样品不需要加入或移出电转杯,也不需要加盖和开盖,转染过程完全发生在Neon吸头中这一新技术更好地维持了细胞的生理条件,提高转染效率,保证细胞更高的存活率。
部分细胞类型的转染效率和存活率Amaxa Nucleofector 细胞核转染系统原理Amaxa®Nucleofector®技术是 Lonza(原Amaxa)公司的专利创新技术,它综合应用传统的电穿孔技术及细胞特异性细胞核转染液,通过调整优化的电转参数(内存转染程序),直接把外源基因导入原代细胞及细胞系的细胞浆和细胞核中。
外源基因直接导入核内Normal human dermal fibroblasts –neonatal were nucleofected with 2.5 μg TMR-labeled plasmid DNA encoding eGFP. Fixation of cells was performed after 2 hours with 3.5 % PFA. TMR label is shown in (A), GFP fluorescence in (B), DAPI nuclear staining in (C) and a merge of all three fluorescent labels in (D).最广泛细胞类型的高效转染130余种原代细胞成功转染维持细胞生理功能Human H9 ES cells preserve pluripotency post Nucleofection. H9 cells were transfected by Nucleofection with the pmaxGFP Vector. (Left) Cells analyzed after 24 hours show expression of GFP (green) as well as of the pluri potency markers SSEA4 (red) and Oct4 (purple). The blue signals refer to nuclear staining by DAPI. (Right) The percentage of double- positive cells (GFP/SSEA) was analyzed by flow cytometry. (Data kindly provided by Jennifer Moore, Rutgers University, Piscataway, USA.)相关Kit。
Nanodrop 2000中文操作守则

Nanodrop 2000/2000C 分光光度计V1.0 用户守则基因有限公司仪器应用技术支持亲爱的用户,您好!非常感谢您选购我公司代理的仪器。
我们将竭诚为您提供优质的售后服务及免费的专业应用培训。
为了更好地进行仪器的应用培训,我们根据您所选购的仪器特点,将需要您配合准备的工作敬告如下:1.应用培训内容:仪器操作培训和软件应用培训。
仪器操作培训包括:仪器的操作、维护和仪器使用注意事项。
软件应用培训包括:用户本次所购买的同仪器配套的所有软件的软件应用培训。
2.培训时间:仪器正式安装调试后,本公司2周内派出专业技术人员进行应用培训。
3.应用培训中所需准备的试剂、耗材和仪器均需由用户提供,并在系统培训开始前准备好。
我公司将指派专业技术人员免费进行应用培训。
4.用户签收售后服务工作报告后,基因公司正式的系统培训内容即完成。
您以后在使用的过程中有任何疑问都可以向我们咨询,我们非常乐意为您们解决应用上遇到的问题。
5.在仪器的使用过程中,无论遇到您认为多么微小或繁琐的问题,请您及时和我们联系,一个及时的通知能节约您的时间,也能帮助我们更好的了解仪器和软件。
6.联系我们时请您提供:仪器型号、软件名称,版本、错误代码、实验目的、操作系统(98/2k/xp/NT)、维修历史等相关资料。
本守则提的信息仅供参考,本守则包含的所有信息应该是正确和完整的。
如果对本守则中的描述有疑问,请参考厂家的英文操作说明。
如果由于您的不正当使用而对仪器造成损坏或者导致仪器的性能损伤,本公司将不会对此负责。
1.仪器介绍仪器描述Thermo Scientific NanoDrop 2000/2000C分光光度计可以检测0.5-2ul的样本,而且检测有非常高的准确性和重复性。
ND2000C分光光度计不仅提供了NanoDrop样品保留专利技术的便利性,还可以使用传统的比色皿来进行样本检测。
样本保留系统应用了表面张力来把样本保留在两根检测光纤中间,这使得仪器可以检测较高浓度的样本而不用稀释。
мериアム流量表技术PIT5000水平测试仪说明书

PIT5000 • Durable composite case with built-in wheels and collapsible handle,
water resistant, hinged lid with latches (and a lock hole), with a pneumatic lift arm to prevent accidental closure • Simplied control panel with Power, Computer, and Measure connection areas and industrial keyboard º Power area: two 12 V dc sockets (one locking), voltage input meter, and power switch º Computer area: two dedicated USB ports to connect a memory stick and/or mouse º Measure area: one male Ralston Quick-Test pressure connection, two M12 RTD connections, one M12 stroke counter connection • Zippered documentation pouch to hold important paperwork • Ruggedized computer with large color screen and industrial keyboard with touchpad • NIST-traceable Meriam pressure and temperature measurement technology • Meriam patented system provides reliable, automated data collection and storage, including test reports. Additionally, the software provides real-time graphs of pressure and temperature.
behringer EUROPOWER PMP1000 PMP3000 PMP5000 说明书

使用说明书版本1.0 2006年11月E U R O P O W E R P M P 1000/P M P 3000/P M P 5000EUROPOWER PMP1000/PMP3000/PMP50002重要的安全说明注 意:机内无用户可用备件!为了防止触电,切勿自行 拆开机盖!必要时需由专业人士维修!警告:为防止发生火灾或触电危险, 本机切勿受雨淋 或受潮!该符号警告用户---禁止推移在最顶端装放有机器而又无保护措施的可移动机架, 谨防最顶端的机器跌落给您带来不必要的人身伤害。
为保护您的利益, 请使用由该制造厂商所生产或推荐的可移动机架、三角架、脚架,固定架、控制台等配件。
电源开关的使用说明详细的安全说明● 请详细阅读本使用说明书为了您的安全和能更快地熟练使用这台机器, 使用前请先 详细阅读并理解本书中所有的安全与使用说明。
● 请妥善保管好本使用说明书为了您以后能更加方便地使用和保养这台机器, 请妥善保 管好本使用说明书以供必要时查阅。
● 请遵守所有的警告与注意事项为了您能更加安全地使用这台机器, 请遵守在设备上和说 明书中所有的警告与注意事项。
● 请查阅并按照制造厂商的方法来安装本机器, 请安装它在易通风散热的地方。
请勿阻塞机器上所有的通风散热孔。
不要用诸如报纸、桌布、窗帘等之类的物品覆盖着本机器; 不要将本机器放置在棉被或绒毛很长的地毯上。
● 禁止在靠近水或潮湿的地方使用本机器,如浴缸、厕所、洗衣桶、厨房的洗菜池、潮湿的地下室、游泳池旁; 禁止将水或其它液体之类的东西滴入或倒入机内;避免在 周围充满易燃易爆气体如汽油站或粉尘等场所使用。
● 不要在靠近热源的地方使用本机器,如加热器、暖气 机、电热炉、大功率放大器等各种易发热设备。
● 请勿将易发生危险的物品放置在机器上。
例如装有液体如化妆品、花瓶之类的物品;裸露的火焰源如点燃的蜡 烛之类的物品;易燃易爆如酒精、天那水之类的医疗及化学用 品等等。
bio电转仪使用手册

Bio电转仪——让你了解身体电信号的神奇仪器
我们的身体每时每刻都在发出电信号,这些信号通过神经系统传递,控制我们的肌肉运动、心跳、呼吸等生理功能。
而Bio电转仪则是一种能够测量这些电信号的仪器。
Bio电转仪的使用方法非常简单,只需要将电极贴在身体上,就能够测量出身体发出的电信号。
这些电信号可以反映出身体内部的生理状态,比如心跳、呼吸、肌肉运动等。
通过对这些信号的分析,我们可以了解身体的健康状况,及时发现潜在的健康问题。
Bio电转仪的应用范围非常广泛,比如在医疗领域,可以用于诊断心脏病、神经系统疾病等;在运动领域,可以用于监测运动员的身体状态,提高训练效果;在科学研究领域,可以用于研究人体生理学、神经科学等方面的问题。
除了以上应用领域,Bio电转仪还有一些非常有趣的应用。
比如,有些艺术家将Bio 电转仪的测量结果作为音乐的创作素材,创造出了一些非常独特的音乐作品。
还有一些科技公司将Bio电转仪与虚拟现实技术结合起来,开发了一些可以通过身体动作控制虚拟世界的游戏。
Bio电转仪的使用虽然非常简单,但是在使用过程中还是需要注意一些事项。
使用前需要将身体部位清洗干净,以保证电极能够贴紧皮肤;需要注意电极的位置,不同的位置对应不同的测量结果;需要注意仪器的使用方法,避免误操作导致测量结果不准确。
Bio电转仪是一种非常神奇的仪器,它能够让我们了解身体内部的电信号,帮助我们更好地了解身体的健康状况。
无论是在医疗、运动、科学研究还是艺术、科技领域,Bio 电转仪都有着广泛的应用前景。
让我们一起来探索这个神奇的世界吧!。
南偌电气 测试仪 使用说明书

仪器在不使用的情况下,请及时关闭电源!如果长期不使用仪器,请定期进行充、放电,电池应至少每月充、放电一次。
严禁亏电使用,亏电将严重缩短电池寿命,甚至使电池报废,当仪器欠电时,应马上关闭电源,进行充电。
避免因电池放电时间过长而导致电池失效。
充电灯:充电器上的充电灯在充电过程中亮红色;充电完成后亮绿色。
用户不得私自拆卸仪器并更换电池,仪器或电池故障时请返厂处理。
目录1 简介 (1)2 包装内容 (1)3 功能特点 (1)4 技术指标 (1)5 对电池充电 (2)6 产品外观 (2)7 操作使用说明 (3)8 注意事项 (6)1 简介本测试仪是一款创新型产品,克服了传统变比电桥测试的缺点,屏幕采用了大屏幕高分辨率液晶显示屏,供电采用锂电供电,方便现场使用。
产品主要应用于变压器的变比组别测试,PT、CT的变比极性测试,测试速度快、准确度高。
2 包装内容收到货运包装箱后,打开包装箱并检查是否有损坏。
如果货运包装箱已损坏,或衬垫材料有压痕,请通知货运公司和离您最近的销售处。
请检查您是否在测试仪包装中收到下列物品:√1台测试仪√1套测试线(红、黑各一组)√1个充电器(8.4V)√1份印刷版用户手册√1份合格证及出厂测试报告3 功能特点◆锂电池供电或者220V交流供电自适应,一次充电,可连续进行100台以上变压器变比组别测试,测试过程简单、方便。
◆具有盲测功能,即在不知道高低压联结方式时进行变比、组别测试。
◆在常规变压器、Z型变压器、PT试品测试的基础上增加了CT变比极性测试功能,应用领域更广。
◆量程宽、精度高,变比测量范围可达10000,且最高值10000时测试精度保证0.3%。
◆具有反接保护、输出短路保护等完善的保护功能。
◆ 5.6寸超大工业级高亮度彩色液晶屏,在强阳光下显示依然清晰可见。
◆配备热敏打印机,便于数据打印。
◆具有本机存储和优盘存储,方便数据保存。
4 技术指标5 对电池充电在首次使用本仪器之前或长时间存放之后或电池电量低时,请使用其随附的充电器对电池至少充电3小时,并且充电时可继续使用本测试仪。
Z-5000系列偏振塞曼原子吸收光谱仪使用说明书(中文)

Z-5000系列偏振塞曼原子吸收光谱仪使用说明书(中文)仪器说明书Z-5000系列偏振塞曼原子吸收光谱仪-------------------------------------(操作手册:石墨炉法)日立公司前言我会感谢你们购买了日立Z-5000系列偏振塞曼原子吸收光谱仪。
Z-5000系列偏振塞曼原子吸收光谱仪是用于元素分析的仪器这本说明书适用于具有一定化学基础知识使用。
用此仪器进行分析测定时,要求操作人场,因为仪器要求点燃火焰,原子化器需要高温加热,请牢记误操作仪器、化学试剂和样品,将不仅导致错误的分析数据操作说明由三部手册组成( Z-5000系列偏振塞曼原子吸收光谱仪维修手册。
( Z-5000系列偏振塞曼原子吸收光谱仪,火焰法分析部分手册。
( Z-5000系列偏振塞曼原子吸收光谱仪,石墨炉分析法操作手册。
安全注意事项在维修手册中介绍,所以使用仪器前一定要阅读维修手册。
石墨炉分析法操作手册介绍了使用Z-5000系列偏振塞曼原子吸收光谱仪如何进行石墨炉法分析,在用此仪器前,必须阅读这本手册。
火焰分析法的维修参见相应的操作手,而且也对个人安全构成伤害。
目录1前期工作 ................................................... 1-11.1检查仪器.................................................... 1-11.2 准备工作 ................................................... 1-21.2.1安装空心阴极灯............................................. 1-21.2.2打开气源................................................... 1-41.2.3打开排气管道的电源......................................... 1-51.2.3.1选择石墨管............................................... 1-51.2.3.2安装石墨管............................................... 1-61.2.4打开排气管道电源........................................... 1-91.3 Z-5000系列偏振塞曼原子吸收光谱仪............................ 1-10 2正确打开电源顺序............................................. 2-12.1打开光谱仪主机电源........................................... 2-12.2打开计算机电源............................................... 2-13开始操作软件................................................. 3-13.1启动原子吸收光谱仪的应用栏 .................................. 3-13.2启动原子吸收光谱仪的应用状态 ................................ 3-1 3.2.1在启动栏目下与仪器选择连通................................. 3-1 3.2.2在启动栏目下与仪器非选择连通............................... 3-3 3.3原子吸收光谱仪窗口的基本操作................................. 3-3 3.3.1单击和双击键............................................... 3-33.3.2窗口内容的名称和功能....................................... 3-33.3.3对话窗口的关闭............................................. 3-63.3.4输入数值和字母............................................. 3-73.3.5命名文件................................................... 3-83.3.6询求帮助................................................... 3-114.测量条件的设定.............................................. 4-14.1使用自动开始测量条件........................................ 4-1 4.2从文件库提取测量条件........................................ 4-1 4.3测量条件总缆................................................ 4-24.3.1显示方法设制窗口........................................... 4-3 4.3.2设置分析模式............................................... 4-34.3.3设置分析元素............................................... 4-34.3.4仪器设置................................................... 4-5(i)4.3.5设置分析条件............................................... 4-84.3.6设置工作曲线表............................................. 4-12 4.3.7设置样品表................................................. 4-174.3.8设置自动取样器............................................. 4-19 4.3.9 QC设置.................................................... 4-304.3.10设置报告格式.............................................. 4-43 4.3.11输入[分析名称]和[命令] .................................... 4-45 4.4测量条件的储存.............................................. 4-464.5测量条件的确认.............................................. 4-475.自动取样方式测量............................................ 5-15.1准备测量.................................................... 5-15.2准备自动取样器.............................................. 5-25.2.1提供清洗溶液............................................... 5-25.2.1.1配制清洗溶液............................................. 5-25.2.1.2运行清洗溶液............................................. 5-25.2.2调整喷嘴................................................... 5-35.2.3设置样品和试剂、容器....................................... 5-6 5.3运行冷却水.................................................. 5-95.4清洗石墨管.................................................. 5-105.5校正GA光学温度控制......................................... 5-10 5.6开始测量.................................................... 5-115.6.1开始测量................................................... 5-125.6.2检查工作曲线............................................... 5-12 5.6.3中断测量................................................... 5-135.6.4 停止测量................................................... 5-13 5.7阶段测量和连续测量......................................... 5-14 5.7.1连续测量不同的元素......................................... 5-14 5.7.2同一条件下连续测量......................................... 5-14 5.7.3使用工作曲线连续测量....................................... 5-16 5.7.4终止测量................................................... 5-175.7.5停止冷却水................................................. 5-186 手动方式测量................................................ 6-16.1准备测量.................................................... 6-16.2通冷却水.................................................... 6-26.3清洗石墨管.................................................. 6-26.4校正GA光学温度控制......................................... 6-3 6.5开始测量.................................................... 6-46.5.1进行自动调零............................................... 6-56.5.2测量标准样................................................. 6-66.5.3检查工作曲线............................................... 6-6 (ii)6.5.4测量未知样品............................................... 6-76.5.5中断测量................................................... 6-86.5.6停止测量................................................... 6-86.6终止或连续测量.............................................. 6-96.6.1改变分析元素连续测量....................................... 6-9 6.6.2同样条件下连续测量......................................... 6-9 6.6.3用工作曲线连续测量......................................... 6-11 6.6.4终止测量................................................... 6-126.6.5停止冷却水................................................. 6-13 7.处理测量结果............................................... 7-17.1测量结果显示................................................. 7-17.1.1单个元素显示............................................... 7-37.1.2详细数据表................................................. 7-37.1.3浓度表显示................................................. 7-47.1.4浓度校正表显示............................................. 7-57.1.5工作曲线显示............................................... 7-67.1.6光谱图形显示............................................... 7-77.2测量结果重新计算............................................ 7-107.2.1删除样品结果............................................... 7-107.2.2恢复样品结果............................................... 7-107.2.3样品结果互换............................................... 7-117.2.4改变测量方式............................................... 7-127.2.5 测定样品空白............................................... 7-127.2.6校正浓度................................................... 7-137.2.7样品重命名................................................. 7-147.2.8改变样品测量单位........................................... 7-147.2.9改变小数点后位数........................................... 7-157.2.10改变工作曲线.............................................. 7-157.2.11确定基线.................................................. 7-177.3储存测量结果................................................ 7-177.4打开测量结果文件............................................ 7-187.5打印测量结果................................................ 7-207.6其他应用测量结果使用........................................ 7-217.6.1交换数据................................................... 7-217.6.2使用文件交换数据........................................... 7-227.7原子吸收光谱非数据处理的启动 ................................ 7-23 8各种测量方法................................................. 8-18.1吸收模式.................................................... 8-38.2工作曲线模式................................................ 8-6(iii)8.3标准加入法(炉内加入法) .................................... 8-108.4标准加入法(炉外加入法) .................................... 8-14 8.5简单标准加入法(炉内加入法) ................................ 8-19 8.6简单标准加入法(炉外加入法) ................................ 8-24 8.7等份标准溶液测量............................................ 8-298.8修改法测量.................................................. 8-338.9回归法测量.................................................. 8-388.10浓度测量................................................... 8-448.11稀释法测量................................................. 8-488.12热注样测量................................................. 8-529QC测量..................................................... 9-19.1检查工作曲线................................................. 9-19.1.1执行....................................................... 9-19.1.2打印报告................................................... 9-19.2检查样品.................................................... 9-29.2.1执行....................................................... 9-29.2.2打印报告................................................... 9-29.3检查QC样品................................................. 9-39.3.1执行....................................................... 9-39.3.2打印报告................................................... 9-39.4检查STD .................................................... 9-49.4.1执行....................................................... 9-49.4.2打印报告................................................... 9-49.5检查回收率.................................................. 9-59.5.1执行....................................................... 9-59.5.2打印报告................................................... 9-510结束软件 ................................................... 10-110.1关闭原子吸收光谱应用程序 ................................... 10-1 10.2退出Windows ............................................... 10-111结束工作 ................................................... 11-111.1关闭仪器电源............................................... 11-111.2最终步骤................................................... 11-112监视器窗口.................................................. 12-112.1[测量]菜单 ................................................. 12-212.1.1[开始测量]和[取消测量] ..................................... 12-2 12.1.2[自动零点]命令............................................. 12-212.1.3[回归法]命令............................................... 12-2(iv)12.1.4[准备开始]和[下一个元素]命令............................... 12-2 12.1.5[结束程序]和[重新设置程序]命令............................. 12-2 12.1.6[停止]命令................................................. 12-312.2[仪器监测]菜单.............................................. 12-312.2.1[条件设置…]命令........................................... 12-312.2.2[最高温度…]命令........................................... 12-312.2.3[关闭灯源]命令............................................. 12-412.2.4[检验自动取样器]命令....................................... 12-4 12.2.5[转到波长…]命令........................................... 12-712.2.6[波长校正…]命令........................................... 12-712.2.7[PMT电压…]命令........................................... 12-8 12.2.8[背景校正…]命令........................................... 12-812.2.9[检查火焰气体]命令......................................... 12-9 12.2.10[光源温度校正]命令........................................ 12-9 12.2.11[图形]命令................................................ 12-912.2.12[设置光源位置]命令........................................ 12-10 12.3[监视器]菜单 ............................................... 12-1112.3.1[监视器条件…]命令......................................... 12-11 12.4[应用]菜单 ................................................. 12-1212.4.1[仪器启动…]命令........................................... 12-12 12.4.2[分析信息…]命令........................................... 12-13 12.4.3[仪器数据库…]命令......................................... 12-15 12.4.4[错误数据栏…]命令......................................... 12-1613消除故障................................................... 13-1 14错误信息 ................................................... 14-115偏振赛曼方法原理............................................ 15-1(v)1.前期工作在开始操作原子吸收光谱仪时,要严格履行以下程序。
仪器使用说明书

动态试管检测仪
使用说明书
英国莱伯金耐特有限公司
目
录
Байду номын сангаас
1. 前 言............................................................................................................................................. 1 2. 概述................................................................................................................................................. 2
2.1 安全信息............................................................................................................................... 2 2.2 仪器的主要功能和特点 ....................................................................................................... 2 2.2.1............................................................................................................................................... 2 2.2.2............................................................................................................................................... 2 2.2.3 温度精确度....................................................................................................................... 2 2.2.4 光学精确度....................................................................................................................... 3 2.2.5 时间精确度....................................................................................................................... 3 2.2.6 检测精确度....................................................................................................................... 3 2.2.7 系统日常验证................................................................................................................... 3 2.3 仪器的使用环境................................................................................................................... 3 2.4 仪器的安装........................................................................................................................... 4 2.4.1 仪器的组成........................................................................................................................ 4 2.4.2 仪器对配套设备和用具的要求 ....................................................................................... 4 2.4.3 仪器的安放....................................................................................................................... 4 2.4.4 仪器的安装....................................................................................................................... 5 2.4.5 仪器温度校准................................................................................................................... 6
多转电动驱动器同步集,精密潜入式潜入器(标准,5K欧姆,其他值请联系)说明书
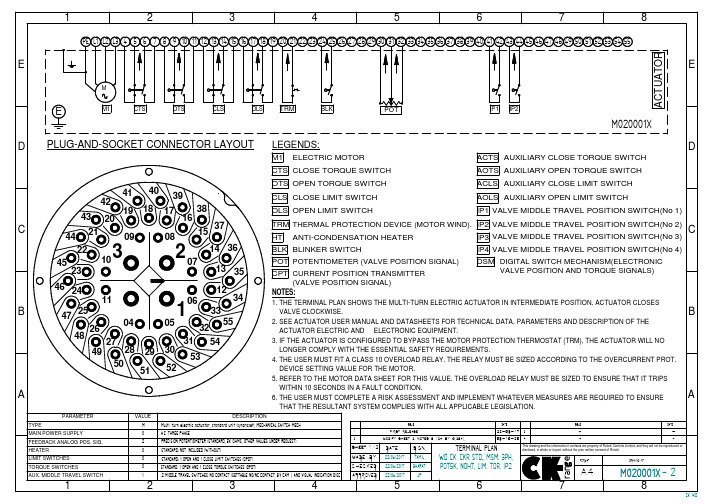
OVERTORQUE IN OPEN DIRECTION
ELECTRIC ACTUATOR
30 31 32
D
POT x Ohms
250VAC/5A 24VDC 0,25A max
(SEE NOTES BELOW)
IP1
IP2
0
C
ELECTRIC ACTUATOR
42
44
IP1
IP2
41
43
B
OPEN/CLOSE by limit switching
5
6
7
8
CK-WD
1
2
3
4
5
6
7
8
S1
POWER U
V
W
E
N
PE
F1 F2 F3
V (250 VAC max allowable voltage) 0
F4
CONTROL
POTENTIOMETER
E
FEEDBACK SIGNAL
(SEE NOTES BELOW)
D C B
KM1
L1 L2 L3
ELECTRIC ACTUATOR (centork supply)
49
28 29 30 53
50 51 52
LONGER COMPLY WITH THE ESSENTIAL SAFETY REQUIREMENTS. 4. THE USER MUST FIT A CLASS 10 OVERLOAD RELAY. THE RELAY MUST BE SIZED ACCORDING TO THE OVERCURRENT PROT.
IP4 VALVE MIDDLE TRAVEL POSITION SWITCH(No 4)
Omega HHF5000数字旋转风速计说明书

The OMEGA ®HHF5000 digital anemometer enables fast, reliable and accurate readings of air velocity using a high-quality rotating vane sensor with either a 25 mm (1") or 70 mm (2.75") diameter.HHF5000 may be used with either of theOMEGA ®rotating vane sensors. The connected sensor is displayed automatically when the instrument is switched on.The HHF5000 is designed for use in heating and ventilating, air conditioning and process industry applications, as well as maintenance and commissioning requirements, particularly exhaust and fume ventilation assessments.ߜDisplay in Metres/Second or Feet/Minute ߜAutomatic ProbeIdentification and Linearisation ߜ2 or 16 SecondMeasurement Period ߜMax and Min ReadingsStored in MemoryDIGITAL ROTATING VANE ANEMOMETERSPECIFICATIONSRange:25 mm (1") Probe:0.3 to 35 m/s (59 to 6891 ft/min)70 mm (2.75") Probe: 0.3 to 40 m/s (59 to 7875 ft/min)Accuracy (System):25 mm (1") Probe:±0.5% FS plus ±0.75% of rdg70 mm (2.75") Probe:±0.25% FS plus ±0.75% rdgDisplay:4-digit liquid crystal, 10 mm (0.4") H characters Resolution: 0.1 m/s (1 ft min)Operating Temperature:Instrument:0 to 50°C (32 to 122°F)Probe: -30 to 80°C (-22 to 176°F)Power Source: 2 x 1.5 V “AA” batteries (included)Battery Life:250 hours approx; low-battery warning after 225 hours Dimensions:181 x 77 x 21.5 mm (7 x 3 x 0.8") indicatorWeight:190 g (0.5 lb) approx with battery (indicator alone)HHF5000 SeriesStarts at£560with Vane ProbeOrdering Example: HHF5001,handheld anemometer kit with 25 mm (1") rotating vane sensor, extension rods and molded carrying case, £560.HHF5003, £765, includes hard carrying case with 70 mm (2.75") and 25 mm (1") sensing probes,anemometer, extensionrods and connecting cable.HHF5001 70 mm (2.75")sensing probe, carrying case, extension rods and connecting cable, £560.CC-1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一,简单的3步骤程序。
1.将收集到的细胞和待转染的分子(例如DNA,RNA,siRNA)的混合物加入到提取物中。
2.将带专用枪头的移液器插入带有电极杯的移液器座中; 在设备上选择程序,然后按开始。
3.拔下移液器,将转染的细胞转移到含有适当培养基的培养容器中。
注:1.为了避免污染,强烈建议只使用电极杯10次。
建议在切换到不同质粒DNA / siRNA或细胞类型时更换电极杯和缓冲液2.为了确保重复性和排除转染条件的变化,建议不要使用枪头超过2次二,软件操作程序1.按下电源开关(位于设备背面,第vii页)打开Neon®设备。
本机检查确保Neon®移液器站已连接到设备,然后显示启动屏幕。
2.按Voltage启动数字键盘输入电压值。
按所需的电压值,然后按Done保存该值。
注意:如果任何输入值超出限制,则会显示错误信息,并自动设置最小的限制值。
3.按Width激活数字键盘输入宽度值。
按所需的宽度值,然后按Done保存该值。
4.按Pulses激活数字键盘以输入脉冲值。
按所需的脉冲值,然后按Done保存该值。
5.如果要保存这些电穿孔参数,请按主屏幕上的“Save”将程序保存在数据库中。
6.按所需的程序号码编辑程序。
选定的程序会突出显示。
7.显示“Edit”屏幕后,按键盘按钮输入用户名。
光标自动移动到下一个字段协议,并突出显示为红色。
继续输入Voltage,Width 和Pulses信息。
8。
按Enter键将信息保存在数据库中。
9.继续准备细胞和DNA,并设置用于电穿孔的移液器座三,细胞与DNA混合物准备注意事项:1.将纯化的DNA重悬于1-5μg/μL浓度的去离子水或TE缓冲液(10mM TrisHCl,1mM EDTA,pH8.0)中。
浓度可能因细胞类型而异。
2.DNA量不应超过使用总体积的10%。
3.通过测量A 260/280比例来检查纯化的DNA制剂的纯度。
电穿孔的比例应至少为1.8。
4.该装置已经用4-7kb质粒进行常规测试,质粒高达约20kb不应该是问题。
使用大于20 kb的质粒很可能降低转染效率。
5.不要用乙醇沉淀DNA以浓缩DNA。
通过乙醇沉淀的浓缩DNA 显示差的转染效率和由于盐污染导致的细胞活力。
6.不含Ca2 +和Mg2 +的D-PBS或磷酸盐缓冲盐水(PBS)(第40页)流程:1.用3 mL电解缓冲液(使用缓冲液E,10μLNeon®Tip和Buffer E2,100μLNeon®Tip)填充电转杯。
(确保管子侧的电极完全浸入缓冲液中。
)2. 将电极杯插入移液器座,直到听到咔嗒声。
确保Neon®管的侧面电极与Neon®移液器站的侧球柱塞良好连接(见下图左侧正确位置)3.在电穿孔前一天,将细胞转移到具有新鲜生长培养基的培养瓶中,使得细胞在实验当天为70-90%汇合。
4.对于大多数优化协议,每10μLNeon®Tip可提供5×104-2×105个细胞。
(5×105-2×106个细胞每100μLNeon®Tip适用于大多数优化的方案。
)5.将含有血清,PBS(不含Ca2 +和Mg2 +)和胰蛋白酶/ EDTA溶液的培养基的等分试样预温至37℃。
从培养瓶中吸出培养基,并使用PBS(不含Ca2 +和Mg2 +)冲洗细胞。
使用胰蛋白酶/ EDTA 或TrypLE Express(目录号12563)对细胞进行胰蛋白酶消化。
取一等份的胰蛋白酶化细胞悬浮液并计数细胞以确定细胞密度。
将细胞转移到1.5mL微量离心管或15mL锥形管中,并在室温下以100-400×g离心细胞5分钟。
通过在室温下以100-400×g离心5分钟,用PBS(不含Ca2 +和Mg2 +)清洗细胞。
吸出PBS并以1.0×10 7个细胞/ mL的最终密度将细胞沉淀重悬于Resuspension Buffer R中。
轻轻移液细胞以获得单细胞悬浮液。
避免在室温下储存细胞悬浮液超过15-30分钟,从而降低细胞存活力和转染效率。
可以调整重悬细胞密度以适应电穿孔方案(第18页)或优化方案(第24-29页)的推荐细胞数。
6.通过用含有血清和补充剂的0.5mL培养基将孔插入24孔板,不用抗生素,并在潮湿的37℃/ 5%CO 2培养箱中预培养板。
如果您使用其他培养板,请参见第18页电镀介质卷建议。
7.对于每个电穿孔样品,下面列出了每孔的质粒DNA或siRNA的推荐量,细胞数量和电镀培养基的体积。
使用再悬浮缓冲液T作为初级悬浮液8.使用3 mL电解缓冲液(使用缓冲液E,10μLNeon®Tip和缓冲液E2,100μLNeon®Tip)装入Neon®移液管9.根据您的单元格类型在设备上设置所需的脉冲条件10.将适量的质粒DNA / siRNA转移到无菌的1.5mL微量离心管中。
11.将细胞加入到含有质粒DNA / siRNA的管中,轻轻混合。
请参见上表,了解细胞浓度,DNA和电镀量。
12.要将Neon®Tip插入Neon®移液器,请将移液器上的按钮按到第二个停止位置以打开夹具13.将Neon®移液器的顶部插入Neon®Tip,直到夹具完全拿起活塞的安装杆(见下图)14.轻轻释放按钮,继续向移液器施加向下的压力,确保尖端密封在移液管上,没有间隙。
注意:确保Neon®移液器和尖端紧密连接,无间隙(见左图),无故障移液和正确的电气连接15.将Neon®移液器上的按钮按到第一站,并将Neon®Tip浸入细胞DNA / siRNA混合物中。
缓慢释放移液器上的按钮,将细胞DNA / siRNA混合物吸入Neon®Tip。
在移液过程中避免气泡,因为气泡在电穿孔期间导致电弧,导致转染降低或失败。
如果您注意到尖端中有气泡,请丢弃样品,并小心地将新鲜样品再次吸入尖端,无任何气泡。
16.将带有样品的Neon®移液器垂直插入放置在Neon®移液器站中的Neon®Tube,直至听到咔嗒声。
确保移液器突起插入吸液管的槽中。
17.确保Neon®移液器的金属头与Neon®移液器支架内的球形活塞和Neon®Tube(见左图所示的正确位置)紧密连接。
18.在传送电脉冲之前,Neon®设备会自动检查Neon®Tube和Neon®Pipette是否正确插入。
19.在电穿孔期间监测Neon®Tip,以查看是否有由于尖端存在气泡引起的电弧(火花)。
电弧导致转染效率低,细胞活力低。
20.交付电脉冲后,触摸屏上将显示“Complete”以指示电穿孔完成。
21.从Neon®移液器站慢慢移除Neon®移液器,并立即从Neon®Tip中将样品从移液器上按下第一个停留点,放入含有预热培养基的准备培养基中。
22.我们强烈建议将电穿孔细胞加载到没有抗生素的生长培养基中,这可以大大降低转染后细胞的活力。
23.要放弃Neon®Tip,请按第二个按钮的按钮进入适当的生物危险废物容器。
24.对剩余的样品重复步骤7-16。
使用两次后,请务必更换Neon®Tips,并在10次使用后更换Neon®Tubes。
每个新的质粒DNA样品使用新的Neon®Tip和Neon®Tube25.轻轻摇动板,以确保细胞的均匀分布。
在37℃下在加湿的CO2培养箱中孵育该板。
注意1.如果您没有使用Neon®设备,将后面的电源开关转到OFF位置。
2.避免在Neon®移液器台内溢出任何液体,以防止移液器台上的球塞上产生锈迹。
3.如果您不小心将任何液体(如缓冲液,水,咖啡)溅入Neon®移液器站内,请将主机从主设备上断开,并用干燥的实验室纸擦拭。
倒置并允许车站在室温下完全干燥24小时。
优化流程1.确保您按照第16-17页所述制备细胞,使用DNA或siRNA,并制备含有0.5 mL含有血清和无抗生素的培养基的24孔板,以转移电穿孔细胞。
准备足够的细胞和质粒DNA / siRNA进行至少30次转染。
2.对于使用24孔格式的10μLNeon®Tip的每个电穿孔样品,请参见下表。
对于以24孔格式使用100μLNeon®Tip,请将下表中列出的数值适当调整10倍。
3.使用3 mL电解缓冲液(将缓冲液E用于10μLNeon®Tip和缓冲液E2,100μLNeon®Tip)置于含有细胞DNA / siRNA混合物的Neon®移液站中,如第15页所述。
4.按优化和加载优化协议开始电穿孔使用下列参数。
5.电穿孔后,立即取出Neon®移液器,将样品从10μLNeon®Tip 中转移到预热的0.5 mL培养基中。
6.对于100μLNeon®Tip,将稀释样品在900μL培养基中稀释10倍,并将100μL样品转移至0.4 mL预热培养基中。
7.对剩余的样品重复步骤3-5。
8.轻轻摇动板,以确保细胞的均匀分布。
在37℃下在加湿的CO2培养箱中孵育该板。
