药物合成反应—第三章 烃化反应
药物合成反应-3烃化反应

第二章 烃化反应
(Hydrocarbylation Reaction,Alkylation)
一、概念
《药物合成反应》
用烃基取代有机物分子中的氢原子,包括某些 官能团或碳架上的氢原子,均称为烃化反应。
引入的烃基包括: 饱和的、不饱和的烃基 脂肪的、芳香的烃基 含有各种取代基的烃基 举例 NaOH
O CH2OCOC17H33
O
O
/KOH /H2 O
CH2OCOC17H33 O(CH2CH2O)p H
HO OH
OH (75.5%)
H(OCH2CH2)mO (13 )
(m、n、p均约为20)
O(CH2CH2O)nH
四、烯烃为烃化剂
《药物合成反应》
醇可与烯烃双键进行加成反应生成醚, 也可理解为烯对醇的O-烃化。但对烯烃双 键旁没有吸电子基团存在时,反应不易进 行。只有当双键的α-位有羰基、氰基、酯 基、羧基等存在时,才较易发生烃化反应。 例如醇在碱存在下对丙烯腈的加成反应。
HOOC NH
HX
CuSO4/NaOH,pH5~6
F3C NH2
HOOC Cl
Cu/无水K2CO3 HCl
F3C
HOOC NH
pH4
二、酯类为烃化剂
《药物合成反应》
1.硫酸酯为烃化剂
OH COOCH3 S O NH O
(CH3)2SO4/NaOH 25 ,10h
OH COOCH3 S O N CH3 O
ห้องสมุดไป่ตู้
七、溶剂对烃化位置有较大影响:
《药物合成反应》
酚类在DMSO、DMF、醚类、醇类中烃化时,主要 得酚醚(O-烃化产物),而在水、酚或三氟乙醇中 烃化时,则主要得到C-烃化产物。
药合试题库及答案
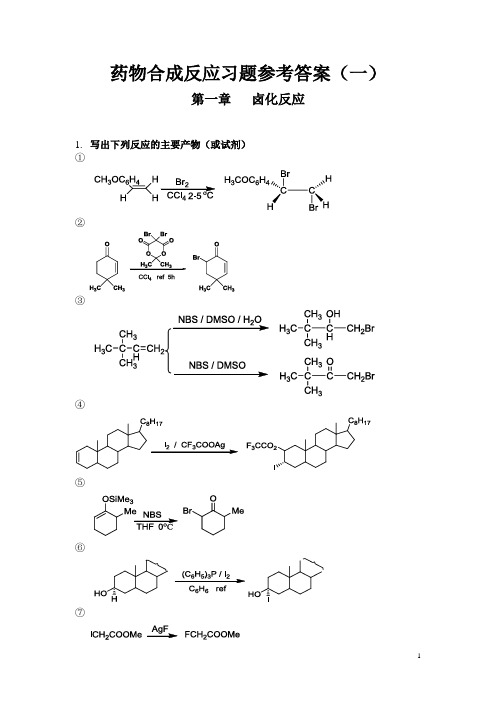
药物合成反应习题参考答案(一)第一章卤化反应1.写出下列反应的主要产物(或试剂)①②③④⑤⑥⑦⑧⑨⑩2.写出下列反应的可能产物①②③④3.写出下列反应的主要试剂及条件①②③④第二章烃化反应1. 完成下列反应①③④⑤⑥⑦⑧OH3C LDA / CH3OCH2CH2OCH3-40~0 o C, 酮过量O-Li⊕ H3C2.完成下列反应过程①②③④第三章 酰化反应1.完成下列反应①OCH 3OCH 3H 3CO +CH 3COClAlCl 3OCH 3OCH 3H 3COCOCH 3②C O 2NH OH C NHCOCHCl 2HCH 2OH +CH 3(CH 2)16COClC 6H 6C O 2N H OH C NHCOCHCl 2HCH 2OCO(CH 2)16CH 3Py③ClCH 2CONH+N SOCOOH CH 2S H 2N N NNNCH 3DCC THFN SOCOOHCH 2S N N NNCH 3SCO 2H NOCH 3ClCH 2CONHS CONH NOCH 3④CH 3CH 3(CH 2)5COClAlCl 3ClCH 2CH 2Cl, 0 o CCH 3CH 3O⑤OCH 3H 3CO H 3COH 3CO OCH 3H 3CO H 3COH 3COCHODMF/POCl 3⑥+C 6H 5N CHOPOCl 390-95 oCCHOCH 3CH 3CO C H 2C O OC 2H 5+HO140 oC 4~5hrCH 3CO C H 2C O O2.完成下列合成路线①OH OC 2H 5DMFPOCl 3OC 2H 5COClNaOH/C 2H 5BrOC 2H 5CHOOC 2H 5CONH SOH 2NCH 3CH 3CO 2NaSOCH 3CH 3CO 2Na② 以苯和丁二酸酐为起始原料合成四氢萘O OOOOH O AlCl 3Zn-Hg HCl (gas)OHO OPPAHCl (gas)Zn-Hg第四章 缩合反应1. 改错(只能改动一处)①Ph 3PCHCH 3+CHOHCH 3H HCH 3HXCH 3CH 2CH 2CCH 3O+CH 3COOC 2H 5C 3H 7H 3CCCHCOOC 2H 5XCH 3CH 2CH 2COCH 2COCH 3C 2H 5ONa③CHO+ClCH 2CO 2C 2H 5Zn +C 6H 6(C 2H 5)2OH CCHCOOC 2H 5BrCH 2CO 2C 2H 5x2. 完成下列反应式①O+NO 2CHO OH /H 2OCH 3OCH 3O 2N②OOCHCH 3H 3CHC Ph 3P=CHCH 3> 2mol③O+CH 2O (excess)Ca(OH)2H 2OOCH 2OH CH 2OHHOH 2C HOH 2C④C 6H 5CHOC H CCOOH C 2H 5C 3H 7CO 2K(C 3H 7CO)2O⑤OClCH 2CO 2CH 3CH 3ONaH 2OOH-H+OCO 2CH 3OCO 2CHO+C 6H 5CH 2CNC 6H 5H C CNC OC 2H 5O(CO 2C 2H 5)2C 2H 5ONaor C 2H 5OCO 2C 2H 5⑦(C 6H 5)3P C H 2C HCH 2OCH 2CH 2CHO CH 3C 6H 6BrNaNH 2Ph 3P=CH-CH=CH 2O CH 2CH 2CH=CH-CH=CH 2CH 3⑧H 3COOCH 3CO 2CH 3BrCH 2CO 2CH 3ZnC 6H 6(C 2H 5)2O,ref.CH 3CO 2H H 2O+H 3COCHCO 2CH 3CH 3CO 2CH 33. 完成下列合成过程 ①CCOOC 2H 5C 2H 5COOC 2H 5CH 3CH 3CH 2BrCH 2CNCH 2CO 2C 2H 5CH(CO 2C 2H 5)2C 2H 5Br/C 2H 5ONaC(CO 2C 2H 5)2C 2H 5C 2H 5ONaOC 2H 5OOC 2H 5NBSKCN1. H +/H 2O2. C 2H 5OH H 2SO 4CH 3CH 3H 2C CH 3C HCHOCH 3CH 3CH 3CHOCH 3CH 2CH(CH 3)CHOCH 3CH 3CH 3CHO H 2, Pd/CCH 3CH 2CHO NaOHCrO 2Cl 24. 填写下列各部分产物(1)H 3CCHOCH 3H 3CCHOH 3C CH 2OH H 3CCH H 3C CH 2OH OHCO 2H AB O H 3C H 3C OHOC NH 2CH 2CH 2CO 2CH 2PhCH 3H 3C CH 2OHCHCONHCH 2CH 2CO 2CH 2PhOH DH 3OCH 3H 3C CH 2OHCHCONHCH 2CH 2CO 2H OH E+ PhCH 2OHHCHO OH(2)OCOCH 3(C 2H 5)2N CH 2CH 2COCH 3CH 3CH 3ONa CH 3OH C 6H 6KOH CH 3OH/H 2O, ref.H 3O +O COCH 3COCH 3OCOCH 3Zn/BrCH 2CO 2EtH 3O +HBr KCNSOCl 2AlCl 3OHCEtO 2CCH=CHOHO 2COHLAHCN(4)N HMeCO 2EtMeHCOOH, HClor DMF/POCl 3CH 2(CO 2H)2PiperidineN HMeCO 2EtMeOHCN HMe CO 2EtMeHO 2C-HC=HC第五章 重排反应1.完成下列反应式 (1)OHOHdilute H 2SO 4O(2)CONH 2H OH HO H H OH HOH CH 2OHNaOCl / H 2OCHO HO H H OH H OH CH 2OH(3)NC 2H 5CH 3CH 2OCH 3C 6H 5Li Et 2ON C 2H 5CH 2CH 3OCH 3N ClC 6H 5Libenzene, heatN(5)N CH 2N(CH 3)3CH 3NaNH 2 / NH 3N CH 3CH 3CH 2N (CH 3)2(6)CH 3CH 3OH OH H +- H 2OCH 3OCH 3(7)OCH 3CONH 2NaOCl, NaOHOCH 3OCH 3NH 2OCH 3(8)NC EtOOC180 o CNC EtOOC(9)OOCH 3CH 3CH 3PhNEt 2reflux 2hOHOCH 3(10)CH 3NaNO 2 / H +HOCH 2NH 2CH 3OHOCH 3C(OEt)3142-147o C, 8daysCO 2C 2H 5(12)1. HCl-HOAc-Ac 2O2. H 3O +MeCO 2MeMeC CHMe 2MeN HOMeCO 2MeMeCHMe 2NH 22.完成下列合成过程 (1)OCHOO COOH OHOCNOOOONaOH H 3O(2)OCH 2OH +CH 3OC 2H 5OCH 3CHO OOCH 3OCH 3CHO ClaisenCopeOCH 3CHOH 2, Pd-C(3)CH 3C 2H 5OCH 3OCH 3+H 3CO 2COHCH 3ClaisenRearrangement2,4-O 2NC 6H 5OHTol OC 2H 5CO 2CH 3CH 3CO 2CH 3C 2H 5OCH 3CO2CH3C2H5OHCH3CH3C2H5OCH3OCH3CO2CH3C2H5CH3C2H5OHNaBH4MeOHNaBH4MeOHCO2CH3CH3C2H5OC2H5CO2CH3C2H5CH3C2H5OClaisen第六章氧化反应1.完成下列反应式①CH3NO2CrO3/Ac2OH2SO4CHONO2②CH3COOHNa2Cr2O7, H2O③CH3CH3CH3COClAlCl3CH 3COOHCH3CH3CH3COCH3 1. Br2,NaOH2. H+④HO OHMnO2CHCl3,25°CRHO OR⑤OAcOKMnO4BaOHKIO4//H2O/K2CO3/35°COOAcOOH⑥CH3NO2 OCH3CrO2Cl2CS225°CCHONO2OCH3⑦HO CH2OH(C5H5N)2CrO3CH2Cl225°CHO CHO ⑧0.5 M SeO2C2H5OH, ref.OH⑨H3CO HOOHH3PO4RTDMSO-DCCH3COOO⑩C OCH 3C OCH 3ORO ROH 2O 2, NaOH⑾H 3C H 3CH HHHClCOOOH(C 2H 5)2O 25°C H 3CH 3CHHHHO⑿HCOCH 3C 6H 5COOOHCHCl 325°CHOCOCH 32. 试以化学式表示实现下列变化的各步反应①CHOAg 2O1.SOCl 22.NH 3RCO 3Haq NaOHC 2H 5CHO C 2H 5COOH C 2H 5CONH 2C 2H 5CONH 2O②HO(CH 2)6CH 3H 3CSO 2ClOHC(CH 2)5CH 3H 3CSO 2O(CH 2)6CH 3DMSO③OH1.H 2SO 42.KMnO 4CHOCHO CHOOH OHPb(OAc)4aqNaOH④OH Bu-tO Bu-tOOBu-t1. CrO 3-H 2SO 4-H 2O2.SeO 21. KOH2. HCl,第七章 还原反应1、完成下列反应 ①H 3CCHO0.25M NaBH 4H 3CCH 2OH②NO 2NH 2NH 2H 2O Pd-C /C 2H 5OHNH 2③OOH0.25M NaBH 4④CO(CH 2)2CH 2Br OCH 3OCH 3Zn-Hg.HClCH 2(CH 2)2CH 2BrOCH 3OCH 3⑤H3CCH 3CH 3H B 2H 6THF,25°CNaOHH 2OH 3CCH 3CH 3H2BHH 3CCH 3HOH CH 3H⑥OCH 3CH 3COClOCH 3CH 3CHOPd-BaSO 4/H 2⑦2PhCH 2C HCH 2+Pd/C2PhCH 2CH 2CH 3⑧OH 2 / (Ph 3P)3RhClO⑨OOPhH 2 / Pd-CAcOH , HClO 4HOOPh⑩N H 3COCNC HCH 2Al(OCH(CH 3)2)3(CH 3)2CHOHONH 3COCHN C HCH 2HO2. 改错①COOHCOOEtLAHCH 2OHCOOEtCH 2OHCH 2OH②CH 3C O COOEtZn-Hg HClCH 3CH 2COOEtCH 3CCHOOEtOH③C CH 3O C H 3C H C H 3C CH 3CH 3C CH 3OHC H 3C H C H 3C CH 3CH 3H C CH 3H C H 3C H C H 3C CH 3CH 3OH LAH3. 完成下列合成题①试由环己醇,氯乙酸,乙醇合成C 10OOH-H 2O1. O 32. Pd/C, H 2ZnCl 2/ HCl Cl(CH 2)6ClClCH 2COOHNaCNOH -C 2H 5OHCH 2(COOC 2H 5)2CH 2(COOC 2H 5)2+Cl(CH 2)6Cl C 2H 5ONa(COOC 2H 5)2CH(CH 2)6CH(COOC 2H 5)21. NaOH, H 2O 2. EtOH, H +C 2H 5OOC(CH 2)8COOC 2H 5Na, NH 3PhCH 3(CH 2)2OHO(CH 2)2O②试由O OCH 3合成O。
药物合成反应习题集.

《药物合成技术》习题集适用于制药技术类专业第一章 概论一、本课程的学习内容和任务是什么?学好本课程对从事药物及其中间体合成工作有何意义?二、药物合成反应有哪些特点?应如何学习和掌握? 三、什么是化学、区域选择性?举例说明。
四、什么是导向基?具体包括哪些类型?举例说明。
五、药物合成反应有哪些分类方法?所用试剂有哪些分类方法?举例说明。
六、查资料写一篇500字左右的短文,报道药物合成领域的新技术及发展动态?第二章 卤化技术(Halogenation Reaction )一、简答下列问题1.何为卤化反应?按反应类型分类,卤化反应可分为哪几种?并举例说明。
2.在药物合成中,为什么常用卤化物作为药物合成的中间体?3.在较高温度或自由基引发剂存在下,于非极性溶剂中,B r 2和NBS 都可用于烯丙位和苄位的溴取代,试比较它们各自的优缺点。
4.比较X 2、HX 、HOX 对双键离子型加成的机理、产物有何异同,为什么?5.解释卤化氢与烯烃加成反应中,产生马氏规则的原因(用反应机理)。
为什么Lewis 酸能够催化该反应?6.解释溴化氢与烯烃加成反应中,产生过氧化效应的原因?7.在羟基卤置换反应中,卤化剂(HX 、SOCl 2、PCl 3、PCl 5)各有何特点,它们的使用范围如何?二、完成下列反应C CH 3CH 3CHCH 3Ca(OCl)2/AcOH/H 2O1.Ph 2CHCH 2CH 2OH32.CH 3SO 2ClCl /AIBN3.OH4CH 3CH 35.2OC O CH 3OHI 2/CaOAcOK Me 2CO?6.三、为下列反应选择合适的试剂和条件,并说明原因。
(CH 3)2C CHCH 3CHCH 2Br(CH 3)2C 1.CH 3CH CH COOHCH 3CH CH COCl 2.HOCH 2(CH 2)4CH 2OH(CH 2)4CH 2I CH 2I 3.CH 3OCH 2CH 2CO 2HCH 2CHCOBrBrCH 3O 4.CH 3CH CH CO 2CH 3CH 2CH CH CO 2CH 3Br 5.O2CH 2OH CH 2CH 2OHOCH 2CH 2CH 2CH 2ClCl 6.CH 2OH3CH2Cl37.8.BrCH 2(CH 2)9COOH CH 3CH(CH 2)8COOHBrCH 2CH(CH 2)8COOHCH 32CH 2C(COOC 2H 5)NHCOCH 3CH 2Br2CH 2C(COOC 2H 5)39.CH 2NO 2CH 2N(CH 2CH 2OH)2C(COOC 2H 5)3(抗肿瘤药消卡芥)CH 2NO 2CH 2N(CH 2CH 2Cl)2CHCOOH 2CH 2NO 2CH 2N(CH 2CH 2Cl)2C(COOC 2H 5)310.CH 3(CH 2)5OCH 3C 2H 5CH 3(CH 2)5OCH 2BrC 2H 5CH3(CH 2)5OOHC 2H 5CH 3(CH 2)4CH 2OHCH 3(CH 2)4CH 2Cl CH 3(CH 2)4CH 2Cl (构型反转)(构型保持)11.OC 2H 5OC 2H 5Br12.四、分析讨论1.试预测下列各烯烃溴化(Br 2/CCl 4)的活性顺序。
《药物合成反应》-闻韧主编第三章酰化反应-知识点总结

#2.11打卡# 完成学习目标第三章酰化反应Acylation Reaction1 定义:有机物分子中O、N、C原子上导入酰基的反应.2 分类:根据接受酰基原子的不同可分为:氧酰化、氮酰化、碳酰化3 用途:药物本身有酰基活性化合物的必要官能团结构修饰和前体药物羟基、胺基等基团的保护。
酰化机理:加成-消除机理加成阶段反应是否易于进行决定于羰基的活性:若L的电子效应是吸电子的,不仅有利于亲核试剂的进攻,而且使中间体稳定;若是给电子的作用相反。
根据上述的反应机理可以看出,作为被酰化物质来讲,无疑其亲核性越强越容易被酰化。
具有不同结构的被酰化物的亲核能力一般规律为;RCH2->R—NH->R—O->R—NH2>R—OH。
在消除阶段反应是否易于进行主要取决于L的离去倾向:L-碱性越强,越不容易离去,Cl- 是很弱的碱,-OCOR的碱性较强些,OH-、OR-是相当强的碱,NH2-是更强的碱。
RCOCl>(RCO)2O>RCOOH 、RCOOR′ >RCONH2>RCONR2′R: R为吸电子基团利于进行反应;R为给电子基团不利于反应R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行酸碱催化碱催化作用是可以使较弱的亲核试剂H-Nu转化成亲核性较强的亲核试剂Nu-,从而加速反应。
酸催化的作用是它可以使羰基质子化,转化成羰基碳上带有更大正电性、更容易受亲核试剂进攻的基团,从而加速反应进行。
氧原子的酰化反应是一类形成羧酸酯的反应,是羧酸和醇的酯化反应,是羧酸衍生物的醇解反应醇的结构对酰化反应的影响伯醇(苄醇、烯丙醇除外)>仲醇>叔醇1) 羧酸为酰化剂:提高收率:(1)增加反应物浓度(2)不断蒸出反应产物之一(3)共沸除水、添加脱水剂或分子筛除水。
(无水CuSO4,无水Al2(SO4)3,(CF3CO)2O,DCC。
)加快反应速率:(1)提高温度(2)催化剂(降低活化能)催化剂(1)质子酸催化法: 无机酸:浓硫酸,氯化氢气体,有机酸:苯磺酸,对甲苯磺酸等。
酰化反应

RCO2- H+
R'OH
17
DCC 和有机碱(DMAP,4-吡咯烷基吡啶:PPY)合 用可用于增强反应的活性,可使反应在室温下进行。
18
应用实例
(酰化能力弱,因为可形成分子内氢键)
19
(5)偶氮二羧酸酯活化醇(重点)
合成大环内酯类化合物,使得反应条件温和,收率高。
29
(2)羧酸吡啶酯法
(羧酸/Et3N) 活性羧酸酯
n = 5 89% n = 11 69%
30
(3)羧酸三硝基苯酯法
活性羧酸酯
31
应用
32
活性羧酸酯应用的本质
本质:将羧酸中难以离去的羟基转化为易离去的基团
33
3. 酸酐作为酰化剂
酸酐是与羧酸和酯相比,是一类活性更强的酰化剂,
12
(1)质子酸催化法
无机酸:浓硫酸,氯化氢气体
有机酸:苯磺酸,对甲苯磺酸等
一些内酯的合成常用有机酸如苯磺酸、对甲苯磺酸作催化剂
13
(2)Lewis酸催化法
常用的Lewis酸:AlCl3, SnCl4, FeCl3, BF3等。 Lewis酸适用于高级不饱和脂肪酸、杂环酸的酯化, 可避免双键的分解或重排。
6
(2)间接酰化法:将酰基的等价体与有机化合物相结
合,结构中潜在的被隐蔽的酰基经过处理可以恢复成 酰基。 一些酰基核酰化:
8
3. 被酰化物和酰化剂
被酰化物的反应活性取决于被酰化原子的亲核能力; 一般被酰化物: R2CH-> RCH2 - > RO - > RNH2 > ROH 酰化剂的酰化能力取决于离去基团的离去能力与具体的 反应条件; 酰化剂: RCO-X > (RCO)2O > RCOOR', RCOOH > RCONHR'
药物合成反应(全)

H 快
B C H CH OH 慢
CH X-X
CH2 OH
X2 快
C X
C O
三、醛酮α位的卤代反应
四溴环己二烯酮(α,β不饱和酮的α卤代剂,不发生
双键加成反应)
O Br Br
+
O
O Br
+
OH Br Br
Br
Br
Br
Br
(选 择 性 溴 化 试 剂 )
三、醛酮α位的卤代反应
1 通过烯醇酯的卤化反应
心肌梗死等症。 本品化学名为1,4-二氢-2,6-二甲基-4-2-硝基苯基)-吡 啶-3,5-二羧酸二乙酯 化学结构式为:
CH3 CH2 OOC H3 C N H COOCH2 CH3 CH3 NO2
合成路线如下
NO2 CHO KNO3 H2SO4 NO2 CHO CH3 COCH2 COOCH2 CH3 NH4 OH H3 C N H CH3 CH3 CH2 OOC COOCH2 CH3
5.6 molSO2Cl2/Et2O 0.7 molSO2Cl2/Et2O
一、醇的卤素置换反应
3 与卤代磷反应
R-OH + PX3 X R O P X HX R-X + O H P X X
4 与NCS反应
H3C HOH2CH2C H CH2OH
NCS CH3SCH3
H3C HOH2CH2C
H CH2Cl
化学药物的合成方法分类?
全合成:由结构简单的原料经过一系列单元反应制备化学药 物的方法;在药物发展上发挥了重要作用。 半合成:对已经具有一定基本结构的产物经过化学修饰或结 构改造得到疗效更高、毒副作用更小的新药。
水杨酰苯胺(Salicylanilide)的合成
药物合成反应第三章酰化反应

•③催化剂 •i提高羧酸反应活性
•(a)质子酸催化法: 浓硫酸,氯化氢气体,磺酸等
O H+ OH RCOH RCOH
H
OH RCOH
H
C H 2C O O H T sO H /PhH
O H
△,
O
H
O
H
•(b)Lewis酸催化法: (AlCl3, SnCl4,FeCl3,等)
A lC l3
O
A lC l3
O
+C
CH 3
CH 3
+O
C
CH 3
CH 3
CH 3
CH 3
CH 3
CH 3
属于SN1机理
CH3OH
CH 3
OH
C-
O
+
CH3 CH 3
-H+
CH 3
O
C- O C H 3 CH 3
CH 3
CH 3
78%
仅有少量空阻大的羧酸按此反应机理进行
(3)影响因素
① 醇结构影响
•醇的结构对酰化反应的影响 •立体影响因素:伯醇>仲醇>叔醇、烯丙醇 •叔碳正离子倾向与水反应而逆转
• (4)应用特点 • 单一酸酐应用有限,一般使用混合酸酐
• i 羧酸-三氟乙酸混合酸酐(适用于立体位组 较大的羧酸的酯化,临时制备)
OO
( C F 3 C O ) 2 O + R C O O H F 3 CCOCR+ C F 3 C O O H
羧 酸 - 三 氟 乙 酸 混 合 酸 酐 的 制 备
故逆向反应比正向反应易进行。所以3oROH的酯化 反应产率很低。
该反应机理也 从同位素方法 中得到了证明
药物合成反应(全) PPT

H2N
COOCH2CH2N(C2H5)2 . HCl
二氢吡啶钙离子拮抗剂的合成
➢ 具有很强的扩血管作用,适用于冠脉痉挛、高血压、 心肌梗死等症。
➢ 本品化学名为1,4-二氢-2,6-二甲基-4-2-硝基苯基)-吡
啶-3,5-二羧酸二乙酯
NO2
➢ 化学结构式为:
CH 3CH 2OOC
COOCH 2CH 3
药物合成反应(全) PPT
药物合成反应教学内容
绪论 第1章 卤化反应 第2章 烃化反应 第3章 缩合反应 第4章 氧化反应 第5章 还原反应 第6章 重排反应 第7章 官能团保护反应 第8章 药物合成反应路线设计
Chapter 1 概论
水杨酰苯胺(Salicylanilide)的合成
➢ 水杨酸类解热镇痛药 ➢ 用于发热、头痛、神经痛、关节痛及活动性风湿症 ➢ 作用较阿司匹林强,副作用小 ➢ 化学名为邻羟基苯甲酰苯胺 ➢ 化学结构式为:
巴比妥(Barbital)的合成
➢ 巴比妥为长时间作用的催眠药。 ➢ 主要用于神经过度兴奋、狂躁或忧虑引起的失眠。 ➢ 学名为5,5-二乙基巴比妥酸,化学结构式为:
O
C2H 5 C2H 5
O
NH O
NH
合成路线如下
H2C
COOC2H5
COOC2H5+C2H5Br
C2H5ONa
C2H5 C2H5
C
CONH
OH
合成路线如下:
OH
OH
COOH
+
PCl3
OH COO
OH COO
NH2
+
CONH OH
苯妥英钠(PHenytoin Sodium)的合成
药物合成反应知识点总结

药物合成反应知识点总结
药物合成反应是化学制药领域中的重要知识点,以下是一些可能有用的药物合成反应知识点总结:
1. 卤化反应:卤化反应是药物合成中常用的反应之一,主要用于将药物分子中的醇或酮羟基转化为卤代烃。
卤代烃的优点是具有广泛的药物合成应用,可以用于制备多种药物分子。
2. 烃化反应:烃化反应是将药物分子中的羟基或酮基转化为烃基的反应。
烃化反应可以用于制备多种药物分子,例如甾体激素、抗癌药物等。
3. 缩合反应:缩合反应是药物合成中常用的反应之一,主要用于将两个或多个分子缩合成为一个分子。
缩合反应可以用于制备多种药物分子,例如甾体激素、抗生素等。
4. 氧化反应:氧化反应是药物合成中常用的反应之一,主要用于将药物分子中的不饱和键氧化为饱和键。
氧化反应可以用于制备多种药物分子,例如杀虫剂、抗生素等。
5. 还原反应:还原反应是药物合成中常用的反应之一,主要用于将药物分子中的氧化剂还原为还原剂。
还原反应可以用于制备多种药物分子,例如维生素、甾体激素等。
6. 重排反应:重排反应是药物合成中常用的反应之一,主要用于将药物分子中的官能团进行重排。
重排反应可以用于制备多种药物分子,例如甾体激素、抗癌药物等。
7. 官能团保护反应:官能团保护反应是药物合成中常用的反应
之一,主要用于保护药物分子中的某些官能团,避免在合成过程中受到破坏。
官能团保护反应可以用于制备多种药物分子,例如甾体激素、抗生素等。
药物合成反应是化学制药领域中的重要知识点,掌握这些反应可以有助于更好地理解和设计药物合成路线。
烃化反应
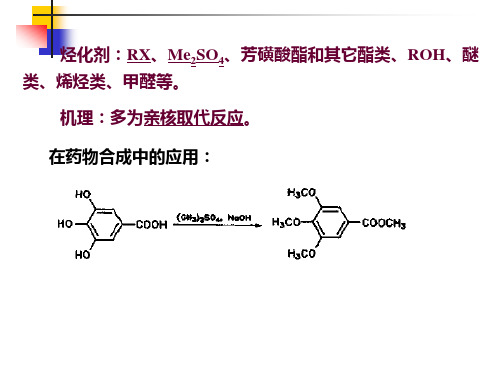
CH3 CH3
NaOH Ph CH OH
+
Br CH2 CH2 N
CH3 CH3
抗组胺药苯海拉明
CH3 C R` Cl
Ph
HO H3C C R
O
B:
-
CH3 C Cl R`
H3C C R
O C
H3C C R
CH3 R`
如何制备? 烯烃+次卤酸
CH3I/NaH/THF
50℃、1h
H3C
OH
H3C
OCH3
-
+
R1 CH2X
SN1
SN2
RO
+
R1 C H H
X
R OCH2 R1
R X R
+
R
+
X-
+
R1 OH
R1
O R
+
H
R1 O R
3. 影响因素:
烃化剂的结构: SN2机理的立体效应影响较大。特别是
卤代烃的立体位阻。 SN1机理的碳正离子的稳定性起决定作用。
H X R C C R3 R1 R2 XH R C C R3 R1 R 2 B +
CH3 CH3 H3C C O C CH3 CH3 CH3
Cl
由于Cl与苯环共轭,不活泼,不易反应,若苯环
邻对位有吸电子基,能增强Cl的活性。
Cl EtOH/NaOH NO2
NO2 EtO
醇的结构:
Ph NaH
Ph CH O CH2 CH2N Ph CH3 CH3
CH Br Ph
+ HO
CH2CH2 N
HOR
C H3 OR
- + H2C N N
化学制药工艺学——第3章

共九十二页
(一)简单 反应 (jiǎndān)
1 单分子反应(fǎnyìng)
➢在基元反应中,若只有一分子参与反应,则称为 单分子反应。
➢一级反应:反应速率与反应物浓度成正比。
-dC/dt= kC
➢包括热分解反应、异构化反应、分子内重排、酮 式与烯醇式互变等
13 共九十二页
(一)简单 反应 (jiǎndān)
二氯甲烷 3.4 41
乙酸乙酯 4.30 77
氯仿
4.4 61
丙酮
5.4 57
二甲基甲酰胺 6.4 153
甲醇
6.6 65
乙二醇
6.9 197
二甲亚砜 7.2 189
水
10.2 100
30
共九十二页
2 溶剂 的分类 (róngjì)
31
共九十二页
质子 性溶剂 (zhìzǐ)
➢质子(zhìzǐ)性溶剂含有易取代氢原子,可与含负离 子的反应物发生氢键结合,发生溶剂化作用; 也可与正离子进行配位结合;或与中性分子 中的氧原子或氮原子形成氢键,或由于偶极 矩的相互作用而产生溶剂化作用。
➢ 一般将介电常数(ε)在15以上的溶剂称为极性溶剂, 介电常数(ε)在15以下的溶剂称为非极性溶剂。
➢ 非质子非极性溶剂又称惰性溶剂(芳烃、脂肪烃)
33
共九十二页
非质子极性溶剂(róngjì)
➢ 醚类(乙醚、四氢呋喃、二氧六环等) ➢ 卤代烃类(氯甲烷、二氯甲烷、氯仿、四氯化碳
等) ➢ 酮类(丙酮、甲乙酮等) ➢ 含氮化合物(如硝基甲烷、硝基苯、吡啶、乙腈、
➢反应过程的外因(反应条件)
反应条件,也就是各种化学反应的一些共同点: 配料(pèi liào)比、反应物的浓度与纯度、加料次 序、反应时间、反应温度与压力、溶剂、催化 剂、pH值、设备条件、反应终点控制、产物分 离与精制、产物质量监控等。
药物合成习题及答案3

O O
药物合成反应
第三章 酰化反应习题参考答案
作为酰化剂的活性酐中间体在完成酰化后形成五元环状内酯(分子内能低,比较稳定) 是一种促使该酰化完成的“驱动力” 。 7.完成以下反应——选择性酰化酚羟基: 参考答案:
OH
RCOCl/NaOH/dioxane/ Bu4N HSO4
r.t., 30min
OH
药物合成反应
第三章 酰化反应习题参考答案
第三章
一、简述题
酰化反应习题参考答案
1.何谓酰化反应?常用的酰化剂是哪种类型化合物? 参考答案:在有机分子中的碳、氧、氮、硫等原子上引入酰基的反应称为酰化反应。常用的 酰化剂包括羧酸、羧酸酯、酸酐、酰氯、酰胺、烯酮等。 2. 一般 Claisen 酯缩合反应选用与羧酸酯的烷氧基相同的醇钠作为缩合催化剂, 为什么?但 对于只有一个 α-H 的羧酸酯的 Claisen 反应, 往往须选用比醇钠强的多的碱, 如 NaOH、 PhCNa 等,才能完成反应,请予解释。 参考答案: 选择与羧酸酯的烷氧基相同的醇钠主要是避免由于酯交换反应而得混合物; 对于 α位只有一个氢的酯,酯缩合反应产物β酮酸酯的α位无活性氢,不能烯醇化,从而对缩合 反应平衡的移动不利,醇钠的碱性不足以转化酯羰基烯醇化所以很难完成这类酯的 Claisen 反应。Claisen 反应机理请参阅 p157。 3.什么叫 Vesley 酯化法?Vesley 法的主要优点是什么? 参考答案:Vesley 等采用强酸型离子交换树脂加硫酸钙催化酯化反应,可加快反应速度、提 高收率。 4.简述试剂 DCC 的结构特点及主要用途。 参考答案:DCC 的全称是 dicyclohexylcarbodiimide, 结构式如下:
(95%)
5.完成以下反应: 参考答案:
药物合成反应(全) ppt

转化成其它官能团。
?
-
32
1 制备药物中间体
皮质激素----醋酸可的松
-
33
2 制备生理活性的含卤素的有机药物
-
34
卤化反应的类型
➢ 加成反应 X2, HX, HOX
➢ 取代反应 烷烃; -H 取代; 芳香环上取代
➢ 化学结构式为:
HO C H
H C NHCOCHCl2 CH2OH
1R,2R (-)
H C OH
Cl2CHCOHN
CH CH2OH
1S,2S (+)
仅1R,2R(-)型有- 抗菌活性, 临床使用 16
合成路线如下
O2N
Br2 , C6H5Cl COCH3
O2N
COCH2Br (CH2)6N4 , C6H5Cl O2N
HCl , H2O
H NH2.HCl
H NH2
15% NaOH
拆分
O2N
C C CH2OH
O2N
C C CH2OH
OH H
OH H
H NHCOCH3
H NHCOCHCl2
O2N
C
CHCl2COOCH3 , CH3OH C CH2OH
O2N
C C CH2OH
OH H
-
OH H
17
氟哌酸(Norfloxacin)的合成
H ClH 3 C
P h
C3 -H CCh -P
CC +
H
P h
CC
H
Cl H 3 C
Cl
Ph
H3C H2C C CCll
药物合成反应-烃化反应

C H 3 O N a + C lC H 2 C O O M eC H 6 3 O 4 H ℃ /p H = 8C H 3 O C H 2 C O O M e
● 反应机理:SN1
◆单分子亲核反应,第一步RX生成R+,X-,反应较慢 ◆ 第二步生成的烃基碳正离子很快与亲核试剂R ′ OH结合生成产物 ◆ 提高RX的量浓度来促进反应速率
◆环氧乙烷与醇反应,引入羟乙基,又称羟乙基化反应;
◆环氧乙烷属小环化合物,其三元环的张力很大,可发生开环 反应; ◆非常活泼的烷化剂,容易和活泼氢(氨基,酰胺基,醇酚羟 基,羧基)发生反应引入羟乙基; ◆反应一般用酸或碱催化 ◆ 条件温和,速率快
● 反应机理 酸催化
◆酸催化属部分单分子亲核取代反应 SN1
◆苯海拉明:组胺作用: 可与组织中释放出来的组胺竞争 效应细胞上的H1受体,从而制止过敏发作;镇咳作用: 可直接作用于延髓的咳嗽中枢,抑制咳嗽反射。 ◆由于醇羟基氢原子的活性不同,进行烃化反应时所需 的条件也不同。前一反应醇的活性低,要先制成醇钠; ◆ 二苯甲醇中,由于苯基的吸电子效应,羟基中氢原子 的活性增大,在反应中加入氢氧化钠作除酸剂即可。
质子溶剂有利于两中间产物通过质子交换平衡产物转换或酮过量或采用较弱的碱镇静催眠药格鲁米特中间体抗心律失常药维拉帕米中间体应用特点腈烃化衍生物的制备苯乙腈因为苯环和氰基存在增强了ch酸性使碳负离子稳定在药物合成中应用广泛酯烃化衍生物的制备自学醛酮与仲胺缩合脱水转变成烯胺后其位碳原子具有强亲核性易于与卤代烃酰卤或其它亲电性烯烃发生反应烯胺的双键与氮原子共轭烯胺酸化后可在碳原子上质子化得到亚胺鎓离子与卤代烷进行亲核反应常用的烃化剂有碘甲烷卤化苄等甲基环己酮与四氢吡咯生成的烯胺混合物中a产物占优势因为位阻有利于a的生成如果双键在甲基一侧那么甲基会和连着氮的烃基上h产生非键排斥
药物合成反应知识复习资料收集

药物合成反应知识点复习题资料第一章绪论1、药物合成反应主要研究对象:化学合成药物2、药物合成反应中反应类型有哪几种?①按有机分子的结构变换方式分:新基团的导入反应;取代基的转化反应;有机分子的骨架。
②按反应机制分:极性反应(a.亲核试剂、b.亲电试剂);自由基反应;协同反应3、化学品的安全使用说明书——MSDS4、原子经济性反应:“原子经济性”是指在化学品合成过程中,合成方法和工艺被设计成能把反应过程中使用的所有原料尽可能多的转化到最终产物中。
5、三废:废气、废水、废渣第二章硝化反应定理1、混酸硝化试剂的特点有哪些?①硝化能力强;②氧化性较纯硝酸小;③对设备的腐蚀性小○+2、硝化试剂的活泼中间离子为:硝酰正离子NO23、桑德迈尔反应定义及应用定义:在氯化亚铜或溴化铜的存在下,重氮基被氮或溴置换的反应;重氮基被氰基置换:将重氮盐与氰化亚铜的配合物在水介质中作用,可以使重氮基被氰基置换,该反应也称Sandmeyer反应。
应用:CuX+Ar-N2X Ar-X+N2 (X:Cl,Br,-CN)4、常用的重氮化试剂一般是由盐酸、硫酸、过氯酸和氟硼酸等无机酸与亚硝酸钠作用产生。
5、硝化反应定义:指向有机分子结构中引入硝基(—NO2)的反应过程,广义的硝化反应包括生产(C—NO2、N—NO2和O—NO2)反应。
6、重氮化反应定义:含有伯氨基的有机化合物在无机酸的存在下与亚硝酸钠作用生成重氮盐的反应。
7、硝化剂:单一硝酸、硝酸和各种质子酸、有机酸、酸酐及各种Lewis酸的混合物。
8、生成硝基烷烃的难易顺序:卤代烃中卤素被取代的顺序:9、DMF:DMSO:10、常用的重氮化试剂有哪些?NaNO2+HCl/H2SO4第三章卤化反应原理1、Ph上取代基对卤化反应的影响①催化剂的影响;②芳环结构的影响;③反应温度的影响; ④卤化剂的影响; ⑤反应溶剂影响2、醇与HCl 发生卤置换反应活性顺序醇羟基的活性顺序:叔(苄基、烯丙基)醇>仲醇>伯醇 氢卤酸的活性顺序:HI >HBr >HCL 3、NBS 的应用(N —溴代丁二酸亚胺)①N —卤代酰胺与不饱和烃的卤取代反应机制:RCH 2CH=CH 2+NBS RCHBrCH=CH 2本反应属自由基型反应,可在光照下引发自由基②N —卤代酰胺与不饱和烃的加成反应:在质子酸(醋酸、溴氢酸、高氯酸)的 催化下,N —卤代酰胺与烯烃加成易制备错误!未找到引用源。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
N
① NaNH2,甲苯 ② Cl(CH2)2N(CH3)2•HCl (19)
CH2N
N
(80%)
CH2CH2N(CH3)2
二 、氮原子上的烃化反应
2.酯类为烃化剂 (1)硫酸酯为烃化剂 氨基氮原子的亲和活性大,容易与硫酸二酯反应,生成
氮烃化产物。
CH3
NH2 + (CH3)2SO4
NaOH,H2O 40
Cl
CuSO4/NaOH,pH=5~6 △
HOOC NH
(17)
F3C
HOOC NH
(18)
二 、氮原子上的烃化反应
(3)叔胺的制备
制备叔胺的常用的方法是卤代烃与仲胺反应。由于叔胺 分子中不含有活泼氢,所以其制备较伯胺、仲胺简单,产物 也较单一。如抗组胺药物曲吡那敏中间体(21)的合成。
CH2NH
一、氧原子上的烃化
(二)酚的O-烃化
1.烃化剂
(1)卤代烃为烃化剂 酚的酸性比醇强,在碱性条件下与卤代烃反应,可生成芳基醚 ,收率高。常用的碱有氢氧化钠(钾)、碳酸钠(钾)。反应可以在 水中进行,也可以在醇、丙酮、苯、甲苯、DMSO等溶剂中进行。
O Na Cl(CH2)3N(CH3)2/Xyl N N
二 、氮原子上的烃化反应
③Dele′pine反应
反应式
N
RX
N
HCl/EtOH
N N
N
N N
N
R X
RNH2
优点 缺点
原料价廉易得
课堂互动 应用至少三种方法合成,
应用范围不如Gabriel合成广泛 要求使用的卤代烃有较高的活性
CH2NH2
并比较各种方法的优缺点。
二 、氮原子上的烃化反应
一、氧原子上的烃化
(2)醇的影响
醇的活性一般较弱,需要在反应中加入碱以生成亲核试剂 进反应的进行。 醇的结构不同,其反应条件及操作方法也不相同
RO ,促
① 活性小的醇,必须先与金属钠或氢氧化钠作用生成醇钠,再进行烃化 ;
② 活性大的醇,可不生成醇钠,而是在反应中加入氢氧化钠等碱作为去 酸剂,即可反应。
一、氧原子上的烃化
(1)硫酸酯
常用的硫酸酯类烃化剂有硫酸二甲酯(Me2SO4)和硫 酸二乙酯(Et2SO4) 。
硫酸二甲酯由于其良好的反应活性,在医药、农药、精 细化学品等的合成中,作为甲基化试剂而得到广泛的应 用。例如抗高血压药美托洛尔中间体的合成。
CH2CH2OH CH2CH2OCH3
(91%) (3)
+ (CH3)2SO4
NaOH
一、氧原子上的烃化
(2)芳磺酸酯 芳磺酸酯由芳磺酰氯与相应的醇在低温下反应制得。 芳磺酸酯中应用最多的是对甲苯磺酸酯(TsOR), 常用于引入分子量较大的烃基。 某些难以烃化的羟基(如螯合酚的烃化),可用芳磺 酸酯进行烃化。例如鲨肝醇的合成。
Me2SO4/NaOH
HO
COOH
75
80 ,1h
(86%)
MeO
(9)
COOH
(CH3)2SO4 NaOH
+ CH3OSO3Na H3CO OCH3
(10)
HO
OH
OH
OCH3
一、氧原子上的烃化
(3)环氧乙烷类烃化剂
环氧氯丙烷在碱性条件下与酚羟基反应,环氧环开裂 ,然后在过量碱存在下,β-氯代醇脱去氯化氢生成新 的环氧乙烷环状化合物。例如治疗前列腺疾病的药物 萘哌地尔中间体(11)的合成。
CH2OH CHOH CH2OH
Me2CO/HCl
CH2OH CHO CH2O C CH3 CH3
CH2OC18H37
C18H37OTs/KOH/Tol >100 ,3h
CH2OC18H37
EtOH/HCl ,2h
CHO CH2O
C
CH3 CH3
CHOH CH2OH
(4)
一、氧原子上的烃化
3.环氧乙烷为烃化剂
加剂等分别制备伯、仲、叔胺。
二 、氮原子上的烃化反应
(1)伯胺的制备 ①NH3与卤代烃反应 由于 NH3 的三个氢原子都可以被烃基所取代,生成伯、 仲、叔胺及季胺盐的混合物,所以采用大大过量的 NH3 与卤代烃反应,可抑制生成的伯胺的进一步烃化,而主要 得伯胺。如:
CH3
CHCOOH Br
NH3(70mol)
CHNHCH3 +
(78%)
CH
N CH3
CH
(少量)
二 、氮原子上的烃化反应 乌尔曼反应
由于卤代芳烃活性低,又有位阻,不易与芳伯胺反应。 但加入铜盐作为催化剂,与无水碳酸钾共热,可生成二芳胺 及其同系物,此反应称为乌尔曼反应。
Cl HOOC NH2 + Cl
F3C NH2 HOOC + Cl
Cu/无水K2CO3 △ HCl pH=4
、
R X + OR
此反应为亲核取代反应,即 RO 对卤代烃中与卤素相 连的碳原子作亲核取代。
一、氧原子上的烃化
(1)卤代烃的影响 卤代烃的活性与其结构及卤原子有较大的关系。 ①当烃基相同时不同卤代烃的活性次序为:
RF<RCl<RBr<RI;应用较多的是RCl和RBr。
②当卤原子相同时,随烃基分子量的增大,卤代烃的 活性逐渐降低。
Ph
NaOH/ 二甲苯
Ph
CH
OCH2CH2NMe2
OH + ClCH2CH2NMe2 HCl
由于醇羟基氢原子的活性不同,进行烃化反应时所需的条件也不同。前一 反应醇的活性低,需先制成醇钠;后一反应采用二苯甲醇为原料,由于苯基的 吸电子效应,羟基中氢原子的活性增大,在反应中加入氢氧化钠作去酸剂即可 顺利反应。显然,后一反应优于前一反应,因此,苯海拉明的合成采用后一种 方法。
CH3
CHCOOH NH2
(70%)
二 、氮原子上的烃化反应
② Gabriel合成 反应式
O NH O O
NH2NH2
KOH/EtOH
O N K O NH NH O
RX/DMF
O N R O
+ RNH2
特点
HCl/H2O
CO2H CO2H + RNH2
酸性水解一般需要剧烈条件 用水合肼水解效果好 卤代烃范围广
R (H)R' C O + NH3 R (H)R' C OH NH2
成仲醇类化合物,如抗高血压药萘哌地尔(24)的合成。
OCH3
OCH3
O CH2 CH CH2 N OH
(24)
O CH2 CH O
CH2
HN
N
N
二 、氮原子上的烃化反应
4.其他烃化剂
(1)还原烃化 醛或酮在还原剂存在下,与氨、伯胺、仲胺反应,在氮原 子上引入烃基的反应称为还原烃化反应。 常用烃化剂有催化氢化、金属钠和乙醇、锌粉、金属负氢 化物、以及甲酸等。其中以催化氢化和甲酸还原应用最多 。
环氧乙烷属小环化合物,容易开环,在酸或碱的作用下, 能和分子中含有活泼氢的化合物(如醇、酚、胺、活性亚 甲基、芳环等)反应得到烃化产物,在被烃化的原子上引 入羟乙基,所以这类反应又称为羟乙基化反应。 在酸或碱的催化下,环氧乙烷很容易开环,在醇的氧原子 上引入羟乙基,反应条件温和,速度快。酸催化时属于 S N 1 反应,碱催化时属于 SN 2 反应。
OH + ClCH2 CH O CH2
NaOH
O
CH2CHCH2Cl OH
NaOH
OCH2
CH O
CH2
(11)
一、氧原子上的烃化
2.位阻及螯合对烃化的影响 螯合酚
H O O C OH
MeI/NaOH
OH
O C O Me
螯合酚的烃化
H O O
TsOMe/MeOH 180 ,20min
O
OCH3
转化成
,亲核性增强,加速反应。
② 质子溶剂会降低
能够增强
RO
RO
的亲核性,而极性非质子性溶剂
的亲核性。因此,反应中常采用极性非质
子性溶剂如DMSO、DMF、苯、甲苯等;
一、氧原子上的烃化
2.酯类为烃化剂
硫酸酯(ROSO2OR)和芳磺酸酯(ArSO2OR) 也 是常用烃化剂,其反应机理与卤代烃的烃化反应相同。 由于芳磺酸酯基和硫酸酯基比卤原子易离去,所以,其 活性比卤代烃大,是一类强烃化剂。因此,使用芳磺酸 酯和硫酸酯时,其反应条件较卤代烃温和。
二 、氮原子上的烃化反应
1.卤代烃为烃化剂 2.酯类为烃化剂 3. 环氧乙烷类烃化剂 4.其他烃化剂
与氨、胺反应可以在氮原子上引入烃基,得到伯、 仲、叔胺,但由于氨及胺分子中含有多个活泼氢,易得混
合物。可通过选择烃化剂种类、原料配比、反应溶剂、添
125 128 ,7h (6)
ClCH2COOH,NaOH 回流7h,pH8~9
O(CH2)3N(CH3)2 N N
(57%)
CH2C6H5
CH2C6H5
Cl
OH
Cl
(7)
OCH2COOH
(74.7%)
一、氧原子上的烃化
(2)酯类为烃化剂
硫酸二酯对酚羟基很易烃化,在氢氧化钠水溶液中室温即能顺利进行 反应。如消炎镇痛药萘普生中间体(9)、抗精神病药曲美托嗪中间 体(10)的合成。
NMe
(68%) (c)
分析:黄嘌呤(a)分子中有三个可被烃化的氮原子,其中 N5和N7的碱性强,在
近中性条件下可被烃化;N1 上的氢有一定的酸性,中性条件下不易被烃化
,只能在碱性条件下被烃化。因此,在不同的pH条件下,可得到两种不同的 产物,分别为咖啡因(b)和可可碱(c)。
