金属的腐蚀与防护ppt课件
合集下载
金属的腐蚀与防护完整版PPT课件

数据分析与结果讨论
对实验数据进行处理和分析,提取金属内部或表面的缺陷信息,评 估金属的腐蚀程度和剩余寿命。
06 金属防护工程实践案例 分享
石油化工行业金属设备防护案例
案例一
某石化公司炼油厂塔器设备腐蚀防护。采用高分子复合涂层技术进 行防护,有效延长了设备使用寿命。
案例二
某油田输油管道腐蚀防护。采用阴极保护技术,结合涂层保护,降 低了管道的腐蚀速率。
阴极保护法
01
将被保护金属与外加直流电源的负极相连,使其成为阴极而防
止金属腐蚀的方法。
阳极保护法
02
将被保护金属与外加直流电源的正极相连,使其处于阳极电位
下成为钝态或致钝而防止金属腐蚀的方法。
牺牲阳极保护法
03
在被保护金属上连接电位更负的金属或合金作为阳极,使其在
腐蚀介质中优先溶解,从而保护被连接金属的方法。
金属的腐蚀与防护完 整版PPT课件
目录
CONTENTS
• 金属腐蚀概述 • 金属腐蚀类型及特点 • 金属防护方法及原理 • 不同环境下金属腐蚀与防护策略 • 金属腐蚀实验方法与检测技术 • 金属防护工程实践案例分享
01 金属腐蚀概述
腐蚀定义与分类
腐蚀定义
金属与周围环境发生化学或电化学 反应,导致金属性能劣化的现象。
案例三
某变电站高压开关柜金 属外壳腐蚀防护。采用 阴极保护技术,结合涂 层保护,降低了金属外 壳的腐蚀速率。
交通运输领域金属部件防护案例
案例一
某地铁列车车体腐蚀防护。采用 不锈钢车体材料,结合电化学保 护技术,提高了车体的耐蚀性。
案例二
某汽车制造厂车身钢板腐蚀防护。 采用镀锌钢板材料,结合涂层保 护技术,延长了车身的使用寿命。
对实验数据进行处理和分析,提取金属内部或表面的缺陷信息,评 估金属的腐蚀程度和剩余寿命。
06 金属防护工程实践案例 分享
石油化工行业金属设备防护案例
案例一
某石化公司炼油厂塔器设备腐蚀防护。采用高分子复合涂层技术进 行防护,有效延长了设备使用寿命。
案例二
某油田输油管道腐蚀防护。采用阴极保护技术,结合涂层保护,降 低了管道的腐蚀速率。
阴极保护法
01
将被保护金属与外加直流电源的负极相连,使其成为阴极而防
止金属腐蚀的方法。
阳极保护法
02
将被保护金属与外加直流电源的正极相连,使其处于阳极电位
下成为钝态或致钝而防止金属腐蚀的方法。
牺牲阳极保护法
03
在被保护金属上连接电位更负的金属或合金作为阳极,使其在
腐蚀介质中优先溶解,从而保护被连接金属的方法。
金属的腐蚀与防护完 整版PPT课件
目录
CONTENTS
• 金属腐蚀概述 • 金属腐蚀类型及特点 • 金属防护方法及原理 • 不同环境下金属腐蚀与防护策略 • 金属腐蚀实验方法与检测技术 • 金属防护工程实践案例分享
01 金属腐蚀概述
腐蚀定义与分类
腐蚀定义
金属与周围环境发生化学或电化学 反应,导致金属性能劣化的现象。
案例三
某变电站高压开关柜金 属外壳腐蚀防护。采用 阴极保护技术,结合涂 层保护,降低了金属外 壳的腐蚀速率。
交通运输领域金属部件防护案例
案例一
某地铁列车车体腐蚀防护。采用 不锈钢车体材料,结合电化学保 护技术,提高了车体的耐蚀性。
案例二
某汽车制造厂车身钢板腐蚀防护。 采用镀锌钢板材料,结合涂层保 护技术,延长了车身的使用寿命。
金属腐蚀与防护高温氧化课件.ppt

• C可以还原Fe的氧化物但不能还原Al的氧化物 • “选择性氧化” ——合金表面氧化物的组成
合金氧化膜主要由图下方合金元素的氧化物所组成
第12页,共100页。
第13页,共100页。
∆G0-T 图
1. 各直线:相变
熔化、沸腾、升华和晶型转变
在相变温度处,特别是沸点 处,直线发生明显的转折
——体系在相变时熵发生了变化
5.1.2 氧化物固相的稳定性
• ∆G0
判断金属氧化物的高温化学稳定性
根据氧化物的熔点、挥发性来估计其固相的高温稳定性 低熔点易挥发氧化物的产生往往是造成灾难性高温腐蚀的
重要原因之一
1. 氧化物的熔点
估计氧化物的高温稳定性
金属表面生成液态氧化物
失去氧化物保护性
如:硼、钨、钼、钒等的氧化物
合金氧化时更易产生液态氧化物
• 蒸气压随温度升高而增大,即氧化物固相的稳定性随温度升 高而下降
• 高温腐蚀中形成的挥发性物质
加速腐蚀过程
• 挥发性氧化物影响碳、硅、钼、钨和铬等的高温氧化动力学
第28页,共100页。
氧化物的挥发性
• 挥发性物质的热力学平衡图
• 例:Cr-O体系,1250K ,高温氧化 只生成Cr2O3一种致密氧化物 Cr(气)、CrO(气)、CrO2(气)和 CrO3(气)4种挥发物质 凝聚相-气相平衡有 2种类型
第30页,共100页。
氧化物的挥发性
• Cr-O体系的固有性质:
– pO2较低时,Cr(气)的蒸气压最大 – pO2较高时,CrO3(气)的蒸气压最大
• 影响铬及含铬合金的氧化
– 在Cr2O3膜与基体之间将产生很大的Cr(气)的蒸气压,使Cr2O3膜 与基体分离;
合金氧化膜主要由图下方合金元素的氧化物所组成
第12页,共100页。
第13页,共100页。
∆G0-T 图
1. 各直线:相变
熔化、沸腾、升华和晶型转变
在相变温度处,特别是沸点 处,直线发生明显的转折
——体系在相变时熵发生了变化
5.1.2 氧化物固相的稳定性
• ∆G0
判断金属氧化物的高温化学稳定性
根据氧化物的熔点、挥发性来估计其固相的高温稳定性 低熔点易挥发氧化物的产生往往是造成灾难性高温腐蚀的
重要原因之一
1. 氧化物的熔点
估计氧化物的高温稳定性
金属表面生成液态氧化物
失去氧化物保护性
如:硼、钨、钼、钒等的氧化物
合金氧化时更易产生液态氧化物
• 蒸气压随温度升高而增大,即氧化物固相的稳定性随温度升 高而下降
• 高温腐蚀中形成的挥发性物质
加速腐蚀过程
• 挥发性氧化物影响碳、硅、钼、钨和铬等的高温氧化动力学
第28页,共100页。
氧化物的挥发性
• 挥发性物质的热力学平衡图
• 例:Cr-O体系,1250K ,高温氧化 只生成Cr2O3一种致密氧化物 Cr(气)、CrO(气)、CrO2(气)和 CrO3(气)4种挥发物质 凝聚相-气相平衡有 2种类型
第30页,共100页。
氧化物的挥发性
• Cr-O体系的固有性质:
– pO2较低时,Cr(气)的蒸气压最大 – pO2较高时,CrO3(气)的蒸气压最大
• 影响铬及含铬合金的氧化
– 在Cr2O3膜与基体之间将产生很大的Cr(气)的蒸气压,使Cr2O3膜 与基体分离;
人教版高中化学选修1 3.2 金属的腐蚀和防护 课件(21张PPT) (共21张PPT)

【小试牛刀】
下图是铁钉在某溶液中被腐蚀的实验(开始时试管中液面和试管外 液面等高)。[来源:学科网ZXXK]
(1)甲、乙两图溶液中呈酸性的是___乙_____(填“甲”或“乙”)。 (2)甲图电极反应式是:正极___2_H__2_O__+_O__2_+__4_e_- _=__4__O_H__-___ 负极____F_e_-__2__e-_=__F_e_2_+___________
接触部分有 部份有较 有较多铁锈,
铁锈
多铁锈
下半部分有气 泡
结论
【科学探究】不同条件下铁钉的腐蚀
实验
一周后 铁钉生 锈程度
结论
煮沸冷
却蒸馏
蒸馏水
NaCl溶液
醋酸溶液
①
②水
③
④
⑤
铁钉表面 铁钉表面 铁钉与水面 铁钉上半
无锈蚀 无锈蚀 接触部分有 部份有较
铁锈
多铁锈
铁钉与空气、水同时接触才会发生锈蚀,与NaCl溶液、
【小组讨论】
2、结合原电池理论,分析实验⑤的腐蚀现象
正负极材料? 正负极反应物? 电解质溶液?
析氢腐蚀(水膜酸性较强)
钢铁的析氢腐蚀和吸氧腐蚀比较
析氢腐蚀
条 件
水膜呈_较__强__酸__性
吸氧腐蚀 水膜呈中__性__或__酸__性__很__弱__
电 负极Fe
极 正极C
反 应
总反应:
Fe-2e-=Fe2+
(3)乙图中发生反应的离子方程式是
____F_e_+__2_H__+_=__F_e_2_+_+_H__2↑______。
被口水冲垮的大桥
【小组讨论】
高中化学新人教版化学选择性必修1金属的腐蚀与防护 课件(44张)

解析:酸性环境中,钢铁形成原电池发生析氢腐蚀,铁作负极,发生氧化反应,
电极反应式为 Fe-2e-===Fe2+,A 正确;钢铁表面水膜的酸性较弱或呈中性时, 发生吸氧腐蚀,正极为氧气得电子发生还原反应,电极反应式为 O2+4e-+ 2H2O===4OH-,B 正确;外加电流法是利用电解池原理让被保护的金属连接电源 的负极作为阴极,惰性电极作为辅助阳极,若被保护的金属作阳极将会发生氧化
关键能力培养
探究与创新能力
《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴 趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为 Cu2(OH)2CO3,俗称铜绿,可溶于酸。请写出铜绿 与盐酸反应的化学方程式。
提示:Cu2(OH)2CO3+4HCl===2CuCl2+3H2O+CO2↑。
反应而被腐蚀,C 错误;锅炉内壁镶嵌镁块,形成原电池,镁作负极被氧化,钢
铁作正极被保护,D 正确。
答案:C
2.如图是金属牺牲阳极法的实验装置,下列有关说法正确的是
()
A.该装置为电解池 B.本实验牺牲了金属 Fe 来保护金属 Zn C.若加入 K3[Fe(CN)6]溶液后,Fe 电极附近不会产生特征的蓝色沉淀 D.远洋货轮上镶嵌的金属 Zn 长时间没有什么变化,不需要更换
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有 Cu2(OH)2CO3 和 Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
Cu2(OH)2CO3 和 Cu2(OH)3Cl 分别属于无害锈和有害锈,请解释原因。 提示:结合图可知,Cu2(OH)2CO3 为致密结构,可以阻止潮湿空气进入内部 进一步腐蚀铜,属于无害锈。Cu2(OH)3Cl 为疏松结构,潮湿空气可以进入空隙内 将内部的铜进一步腐蚀,属于有害锈。
金属的腐蚀与防护完整版课件

指津:A 项中黄铜(铜锌合金)若发生电化学 腐蚀,被腐蚀的金属应是金属性较强的锌 而不是铜。B 项中生铁中含较多的碳,比铁 芯(几乎是纯铁)在电解质作用下更容易形 成原电池,也更容易生锈。C 项在接触电解 质溶液时,铁作原电池的负极,易被腐蚀生 成铁锈。D 项这是化学腐蚀,与电化学腐蚀 无关。
2.将经过酸洗除锈的铁钉,用饱和食盐水
3.金属腐蚀的快慢规律
(1)在同一电解质溶液中,金属腐蚀由快到慢 的顺序为:电解原理引起的腐蚀>原电池原理 引起的腐蚀>化学腐蚀>应用原电池原理有保 护措施的腐蚀>应用电解池原理有保护措施的 腐蚀。 (2)同一种金属在不同介质中腐蚀由快到慢的 顺序为:强电解质溶液中的腐蚀>弱电解质溶 液中的腐蚀>非电解质溶液中的腐蚀。
实例
化学腐蚀 金属或合金直接与具有腐蚀性的 化学物质接触发生氧化还原反应 而消耗的过程 金属直接将电子转移给有氧化性 的物质 无电流产生(电子不定向移动) 金属单质 金属与 Cl2、O2 等物质直接反应
2.电化学腐蚀
发生 条件
电极 反应
钢铁表面吸附了一层水膜,且溶有 CO2、O2 等 气体 负极:2Fe-4e- 2Fe2+
解题导引:
解析:a 为中性环境,发生吸氧腐蚀,氧气被消 耗,气体压强减小;b 中酸性较强,发生析氢腐 蚀,有氢气放出,气体压强增大,所以红墨水柱 两边的液面变为左高右低,故 B 项错。 答案:B。
【活学活用】
1.以下现象与电化学腐蚀无关的是 (D) A.黄铜(铜锌合金)制作的铜锣不易产生 铜绿 B.生铁比软铁芯(几乎是纯铁)容易生锈 C.铁质器件附有铜质配件,在接触处易生 铁锈 D.银质奖牌久置后表面变暗
③镀锌铁发生电化学腐蚀时是锌被腐蚀, 而铁一定不会被腐蚀 ④金属发生电化学腐蚀时是较活泼金属 作负极先被腐蚀 A.①④ B.③④ C.②③ D.①② 指津:金属的电化学腐蚀也可以在中性或 碱性环境下进行;镀锌铁中锌若被腐蚀 完,Fe 也可继续被空气、水所腐蚀(即铁的 吸氧腐蚀)。
金属腐蚀与防护ppt课件
阳极 (Fe) :Fe(s)
Fe2+ (aq) + 2e-
阴极(杂质): 1/2 O2 + H2O + 2e-
2OH- (aq)
总反应: Fe(s) + 1/2O2 (g) + H2O
Fe(OH)2 (s)
2Fe(OH)2 (s) H2O+O2 Fe(OH)3 (s)
条 件: 弱酸性、中性或碱性介质
原理,将工件加工成型的一种技术。
电解液的要求:
有良好的导电性 不使阳极产生钝化 有利于阳极溶解
电流
—
直流电源 电压
+
阴极(模件) 阳极(工件)
泵
电解液
电解加工示意图
2. 金属的防腐
1、正确选材 2、覆盖保护层
要 求:
a. 膜层致密,完整无孔,不透介质; b. 与基体金属结合强度高,附着力强; c. 高硬度,耐磨; d. 均匀分布。
① 金属保护层
镀层 > 基体
例如: 铜上镀银、金,铁上镀锡,主要起 隔离和装饰作用。
镀层 < 基体
例如:铁上镀锌,主要起防腐作用。
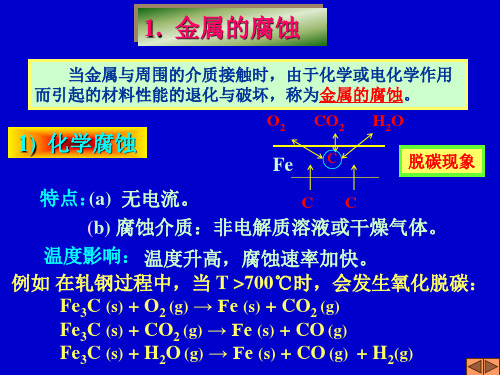
1. 金属的腐蚀
当金属与周围的介质接触时,由于化学或电化学作用 而引起的材料性能的退化与破坏,称为金属的腐蚀。
1) 化学腐蚀
O2 CO2
Fe C
H2O 脱碳现象
特点:(a) 无电流。
CC
(b) 腐蚀介质:非电解质溶液或干燥气体。
温度影响: 温度升高,腐蚀速率加快。
例如 在轧钢过程中,当 T >700℃时,会发生氧化脱碳:
难溶性碳酸钙覆盖于阴极表面,使电极的极化电势降低,阻滞 阴极反应继续进行,从而减缓金属的腐蚀速率。
金属的腐蚀与防护ppt课件

牺牲阳极保护法 外加电流的阴极保护法
21
总反应: Fe + 2H+ =Fe2+ + H2↑
★析氢腐蚀和吸氧腐蚀都属于电化学腐蚀
9
条件
化学腐蚀
金属与干燥气体或非电 解质液体直接接触
电化学腐蚀
不纯金属或合金与电解 质溶液接触
现象 无电流产生
有微弱电流产生
本质 金属被氧化
较活泼金属被氧化
影响 与接触物质的氧化性及 与电解质溶液的酸碱性
因素 温度有关
化学 · 选修4《化学反应原理》
1.3 金属的腐蚀与防护
1
钢 铁 生 锈
2
铜 器 生 锈
3
金属腐蚀 • 我国是世界上钢铁产量最多的国家,每年被腐蚀的铁占到我国钢铁
年产量的十分之一,因为金属腐蚀而造成的损失占到国内生产总值 的2%~4%;约合人民币3000亿元 。 • 根据各国调查结果,一般说来,金属腐蚀所造成的经济损失大致为 该国国民生产总值的4%左右。 • 另据统计,金属腐蚀的年损失远远超过水灾、火灾、风灾和地震(平 均值)损失的总和,在这里还不包括由于腐蚀导致的停工、减产和爆 炸等造成的间接损失。
4
一、金属的电化学腐蚀 1、 金属腐蚀 指金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。
➢金属腐蚀的本质 M – ne- → Mn+ (氧化反应)
化学腐蚀 ➢金属腐蚀的类型
电化学腐蚀
5
2、化学腐蚀 金属与其他物质直接接触反生氧化还原反应而引起的腐蚀
燃气灶的中心部位易生锈
食品罐头 放在南极80多年却很少生锈
及金属活性有关
联系 两者往往同时发生,电化学腐蚀更普遍
10
1、用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装 置及得到的图象如下,以下结论错误的是( C ) pH=2时,压强逐渐增
21
总反应: Fe + 2H+ =Fe2+ + H2↑
★析氢腐蚀和吸氧腐蚀都属于电化学腐蚀
9
条件
化学腐蚀
金属与干燥气体或非电 解质液体直接接触
电化学腐蚀
不纯金属或合金与电解 质溶液接触
现象 无电流产生
有微弱电流产生
本质 金属被氧化
较活泼金属被氧化
影响 与接触物质的氧化性及 与电解质溶液的酸碱性
因素 温度有关
化学 · 选修4《化学反应原理》
1.3 金属的腐蚀与防护
1
钢 铁 生 锈
2
铜 器 生 锈
3
金属腐蚀 • 我国是世界上钢铁产量最多的国家,每年被腐蚀的铁占到我国钢铁
年产量的十分之一,因为金属腐蚀而造成的损失占到国内生产总值 的2%~4%;约合人民币3000亿元 。 • 根据各国调查结果,一般说来,金属腐蚀所造成的经济损失大致为 该国国民生产总值的4%左右。 • 另据统计,金属腐蚀的年损失远远超过水灾、火灾、风灾和地震(平 均值)损失的总和,在这里还不包括由于腐蚀导致的停工、减产和爆 炸等造成的间接损失。
4
一、金属的电化学腐蚀 1、 金属腐蚀 指金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。
➢金属腐蚀的本质 M – ne- → Mn+ (氧化反应)
化学腐蚀 ➢金属腐蚀的类型
电化学腐蚀
5
2、化学腐蚀 金属与其他物质直接接触反生氧化还原反应而引起的腐蚀
燃气灶的中心部位易生锈
食品罐头 放在南极80多年却很少生锈
及金属活性有关
联系 两者往往同时发生,电化学腐蚀更普遍
10
1、用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装 置及得到的图象如下,以下结论错误的是( C ) pH=2时,压强逐渐增
金属的腐蚀与防护ppt课件

(2)在金属表面覆盖保护层 ①非金属保护层:如喷油漆、涂油脂。 ②金属保护层:如铁制品上镀铜、锌等。
铁制品镀锌,破损 后,仍能保护;
铁制品镀锡 ,破损 后,失去保护。
为什么?
(3)电化学防护法 ①牺牲阳极法
原理:原电池原理 要求:活泼性强的金属作负极,被保护金属作正极。
②外加电流法
原理:电解池原理 要求:被保护的金属与外接电源负极相连作阴极。
√C.可能产生Fe2O3·nH2O
D.腐蚀的总反应式一定是2Fe+O2+2H2O===2Fe(OH)2
12345
内容小结 04
课堂回顾
课后练习
1.金属腐蚀的电化学原理可用如图模拟。 (1)请写出有关电极反应式。 ①铁棒上电极反应式:_2_F_e_-__4_e_-_=__=_=_2_F_e_2_+_。 ②(2)碳该棒图上所电表极示反的应是式__吸:__氧_O-___2_(+填__2“_H_2析_O_氢_+_”_4_e或_-_=_“_=吸_=_4氧_O_H_”_)。腐蚀。 (3)若将O2撤走,并将NaCl溶液改为稀硫酸溶液,则此图可表示__析__氢__(填“析 氢”或“吸氧”)腐蚀原理;若用牺牲阳极的阴极保护法来保护铁棒不被腐蚀溶 解,则可将碳棒改为_锌__(_或__其__他__比__F_e_活__泼__的__金__属__)_棒。
2.科学态度与社会责任:认识金属腐蚀产生的危害和影响,培养防止金属腐蚀 的意识,熟知金属腐蚀常用的防护方法。
内容索引
NEIRONGSUOYIN
一、金属的腐蚀 二、金属的防护方法 三、练习 四、总结
金属的腐蚀 01
1.金属的腐蚀
(1)概念:金属发生 氧化还原反应 而引起损耗的现象。 实质:金属原子 失去电子 变为阳离子发生氧化反应
铁制品镀锌,破损 后,仍能保护;
铁制品镀锡 ,破损 后,失去保护。
为什么?
(3)电化学防护法 ①牺牲阳极法
原理:原电池原理 要求:活泼性强的金属作负极,被保护金属作正极。
②外加电流法
原理:电解池原理 要求:被保护的金属与外接电源负极相连作阴极。
√C.可能产生Fe2O3·nH2O
D.腐蚀的总反应式一定是2Fe+O2+2H2O===2Fe(OH)2
12345
内容小结 04
课堂回顾
课后练习
1.金属腐蚀的电化学原理可用如图模拟。 (1)请写出有关电极反应式。 ①铁棒上电极反应式:_2_F_e_-__4_e_-_=__=_=_2_F_e_2_+_。 ②(2)碳该棒图上所电表极示反的应是式__吸:__氧_O-___2_(+填__2“_H_2析_O_氢_+_”_4_e或_-_=_“_=吸_=_4氧_O_H_”_)。腐蚀。 (3)若将O2撤走,并将NaCl溶液改为稀硫酸溶液,则此图可表示__析__氢__(填“析 氢”或“吸氧”)腐蚀原理;若用牺牲阳极的阴极保护法来保护铁棒不被腐蚀溶 解,则可将碳棒改为_锌__(_或__其__他__比__F_e_活__泼__的__金__属__)_棒。
2.科学态度与社会责任:认识金属腐蚀产生的危害和影响,培养防止金属腐蚀 的意识,熟知金属腐蚀常用的防护方法。
内容索引
NEIRONGSUOYIN
一、金属的腐蚀 二、金属的防护方法 三、练习 四、总结
金属的腐蚀 01
1.金属的腐蚀
(1)概念:金属发生 氧化还原反应 而引起损耗的现象。 实质:金属原子 失去电子 变为阳离子发生氧化反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
失e 氧化反应
金属阳离子
M – ne- ==== Mn+ 3.分类 化学腐蚀 析氢腐蚀
电化学腐蚀
吸氧腐蚀
4.化学腐蚀与电化学腐蚀 化学腐蚀 金属跟化学物质 条件 现象 本质 联系 接触反应 无电流产生 金属被氧化 电化学腐蚀 不纯金属或合金
跟电解质溶液接触 有微弱电流产生 较活泼金属被氧化
两者往往同时发生,电化学腐蚀更普遍
2.下列有关金属腐蚀的说法中正确的是 ( ①金属的腐蚀全部是氧化还原反应
C )
②金属的腐蚀可分为化学腐蚀和电化学腐蚀,只有电化
学腐蚀才是氧化还原反应 ③因二氧化碳普遍存在,所以钢铁的电化学腐蚀以析氢 腐 蚀为主 ④无论是析氢腐蚀还是吸氧腐蚀,总是金属被氧化 A.①③ B.②③ C.①④ D.①③④
下列各情况中铁片腐蚀由快到慢的顺序是
(5) (2) (1) (3) (4) 。 ____________________
1.金属腐蚀的本质 金属原子 2.分类 化学腐蚀
M – ne- ====Mn+
失e -
氧化反应
金属阳离子
析氢腐蚀
电化学腐蚀 吸氧腐蚀
3.钢铁的析氢腐蚀和吸氧腐蚀比较
析氢腐蚀 条件 水膜呈酸性 吸氧腐蚀
如图:将被保护金属作电解池的阴极,在外加直流电的
作用下使阴极得到保护。 此法主要用于防止土壤、海水
及水中金属设备的腐蚀。
在同一电解质溶液中,金属腐蚀的快慢规律如下: 电解原理引起的腐蚀>原电池原理引起的腐蚀 >化学腐蚀>有防腐措施的腐蚀 防腐措施由好到坏的顺序如下: 外接电源的阴极保护法>牺牲阳极的阴极保护法 >有一般防腐条件的腐蚀>无防腐条件的腐蚀
(1)改变金属的内部组织结构:
如将Cr、Ni等金属加入钢里制成合金钢
(2)金属表面覆盖保护层
(3)电化学保护法
牺牲阳极的阴极保护法
外加电源的阴极保护法
1.以下现象与电化学腐蚀无关的是( D ) A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈 D.银质奖牌久置后表面变暗
。
二、钢铁腐蚀的防护:
1.改变金属的内部组织结构: 如将Cr、Ni等金属加入钢里制成合金钢。 2.金属表面覆盖保护层 例如:在金属表面涂油漆或油脂,搪瓷。
3.电化学保护法
(1)牺牲阳极的阴极保护法
用活泼的金属(如Zn、Al)与被保护金属连接构成原电 池,被保护金属作正极而得到保护。
–
–
(2)外加电源的阴极保护法
5.钢铁的析氢腐蚀和吸氧腐蚀比较
析氢腐蚀 条件 吸氧腐蚀 水膜呈中性或酸性很弱
水膜呈酸性
负极Fe
Fe-2e-====Fe2+
2Fe-4e-====2Fe2+
电极 反应 正极C
总反 应: 2H++2e-====H2↑ Fe+2H+====Fe2++H2↑
O2+2H2O+4e-====4OH2Fe+2H2O+O2====2Fe(OH)2
水膜呈中性或酸性很弱
负极
电极 反应 ( 铁) 正极 ( 碳) 总反 应: Fe-2e-====Fe2+
2Fe-4e-====2Fe2+
2H++2e-====H2↑
O2+2H2O+4e-====4OH-
Fe+2H+====Fe2++H2↑
2Fe+2H2O+O2====2Fe(OH)2
4.钢铁腐蚀的防护
钢铁在潮湿环境里长期放置容易生锈。请解释下列与铁生 锈现象有关的因素。 1.相对于在内河行驶的轮船来说,海轮更容易被腐蚀。 2.用于连接铜板的铁螺丝容易生锈。 3.当化工厂排出酸性废气时,工厂附近的铁制品更容易生锈。
1.相对于在内河行驶的轮船来说,海轮更容易被腐蚀。 海水含有更多盐类,在电解质溶液中电化学腐蚀更易 进行。 2.用于连接铜板的铁螺丝容易生锈。
通常两种腐蚀同时存在,但后者更普遍。
如图, 水槽中试管内有一枚铁钉,放置数天后观察: (1)若液面上升,则溶液呈 中性或碱 性,发生_____ 吸氧
腐蚀,电极反应式为:负极: Fe–2e-====Fe2+ ,
正极: O2+2H2O+4e-====4OH- ; (2)若液面下降,则溶液呈 酸 性,发生 析氢 腐蚀,电极反应式为: 负极: Fe–2e-====Fe2+ ++2e-====H ↑ 2H 2 正极: ,
由于铁与铜及潮湿的空气构成了原电池,铁作负极,
因而更易被腐蚀而生锈。 3.当化工厂排出酸性废气时,工厂附近的铁制品更容易生锈。 铁制品在酸性条件下比在中性条件下更容易被腐蚀。
1.铁锈的成分是什么?是怎样形成的? 2.将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,再放
入如图所示的具支试管中。几分钟后,导管中的水柱上升
第3课时
金属的腐蚀与防护
1.理解金属发生电化学腐蚀的原因; 2.了解金属腐蚀的危害; 3.了解防止金属腐蚀的常用措施。
我国作为世界上钢铁产量最多的国家,每年被腐蚀的 铁占到我国钢铁年产量的十分之一,因金属腐蚀而造成的
损失占到 国内生产总值的2 %~4 %;约合人民币3 000
亿 元。
金属腐蚀的危害和防腐的意义 据统计,金属腐蚀的年损失远远超过水灾、火灾、风 灾和地震损失的总和。 腐蚀不仅造成经济损失,也常造成灾难性事故,如飞
了,你知道为什么吗?
钢铁通常为含碳的铁合金,在一定环境中会构成原电池, 铁作负极,碳作正极。从而加快了钢铁的腐蚀。
水膜的酸碱性,
决定了钢铁的 电化学腐蚀的不同。 钢铁表面的微小原电池示意图
写出钢铁腐蚀的正极反应式。
钢铁的析氢腐蚀
钢铁的吸氧腐蚀
–
–
–
– –
–
酸性水膜 2H++2e-====H2↑
碱性或中性水膜 O2+2H2O+4e-====4OH-
机因零部件破裂而坠毁;桥梁因钢梁产生裂缝而塌陷;油
管因穿孔或裂缝而漏油,引起着火爆炸;化工厂中储酸槽 穿孔泄漏,造成重大环境污染等。
面对这样惊人的数据和金属腐蚀 危害的事实,思考:铁为什么会被腐蚀?应该怎样防腐呢?
一、金属腐蚀
1.定义 金属表面与周围的物质发生化学反应或因电化学作用而遭到 破坏。
2.本质 金属原子
3.钢铁在潮湿空气中发生电化学腐蚀时,正极发生的主 要反应是( B )
A.Fe - 2eˉ ==== Fe2+
B.2H2O + O2 + 4eˉ==== 4OHˉ C.4OHˉ - 4eˉ==== 2H2O +O2↑ D.2H+ + 2eˉ==== H2↑
金属阳离子
M – ne- ==== Mn+ 3.分类 化学腐蚀 析氢腐蚀
电化学腐蚀
吸氧腐蚀
4.化学腐蚀与电化学腐蚀 化学腐蚀 金属跟化学物质 条件 现象 本质 联系 接触反应 无电流产生 金属被氧化 电化学腐蚀 不纯金属或合金
跟电解质溶液接触 有微弱电流产生 较活泼金属被氧化
两者往往同时发生,电化学腐蚀更普遍
2.下列有关金属腐蚀的说法中正确的是 ( ①金属的腐蚀全部是氧化还原反应
C )
②金属的腐蚀可分为化学腐蚀和电化学腐蚀,只有电化
学腐蚀才是氧化还原反应 ③因二氧化碳普遍存在,所以钢铁的电化学腐蚀以析氢 腐 蚀为主 ④无论是析氢腐蚀还是吸氧腐蚀,总是金属被氧化 A.①③ B.②③ C.①④ D.①③④
下列各情况中铁片腐蚀由快到慢的顺序是
(5) (2) (1) (3) (4) 。 ____________________
1.金属腐蚀的本质 金属原子 2.分类 化学腐蚀
M – ne- ====Mn+
失e -
氧化反应
金属阳离子
析氢腐蚀
电化学腐蚀 吸氧腐蚀
3.钢铁的析氢腐蚀和吸氧腐蚀比较
析氢腐蚀 条件 水膜呈酸性 吸氧腐蚀
如图:将被保护金属作电解池的阴极,在外加直流电的
作用下使阴极得到保护。 此法主要用于防止土壤、海水
及水中金属设备的腐蚀。
在同一电解质溶液中,金属腐蚀的快慢规律如下: 电解原理引起的腐蚀>原电池原理引起的腐蚀 >化学腐蚀>有防腐措施的腐蚀 防腐措施由好到坏的顺序如下: 外接电源的阴极保护法>牺牲阳极的阴极保护法 >有一般防腐条件的腐蚀>无防腐条件的腐蚀
(1)改变金属的内部组织结构:
如将Cr、Ni等金属加入钢里制成合金钢
(2)金属表面覆盖保护层
(3)电化学保护法
牺牲阳极的阴极保护法
外加电源的阴极保护法
1.以下现象与电化学腐蚀无关的是( D ) A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈 D.银质奖牌久置后表面变暗
。
二、钢铁腐蚀的防护:
1.改变金属的内部组织结构: 如将Cr、Ni等金属加入钢里制成合金钢。 2.金属表面覆盖保护层 例如:在金属表面涂油漆或油脂,搪瓷。
3.电化学保护法
(1)牺牲阳极的阴极保护法
用活泼的金属(如Zn、Al)与被保护金属连接构成原电 池,被保护金属作正极而得到保护。
–
–
(2)外加电源的阴极保护法
5.钢铁的析氢腐蚀和吸氧腐蚀比较
析氢腐蚀 条件 吸氧腐蚀 水膜呈中性或酸性很弱
水膜呈酸性
负极Fe
Fe-2e-====Fe2+
2Fe-4e-====2Fe2+
电极 反应 正极C
总反 应: 2H++2e-====H2↑ Fe+2H+====Fe2++H2↑
O2+2H2O+4e-====4OH2Fe+2H2O+O2====2Fe(OH)2
水膜呈中性或酸性很弱
负极
电极 反应 ( 铁) 正极 ( 碳) 总反 应: Fe-2e-====Fe2+
2Fe-4e-====2Fe2+
2H++2e-====H2↑
O2+2H2O+4e-====4OH-
Fe+2H+====Fe2++H2↑
2Fe+2H2O+O2====2Fe(OH)2
4.钢铁腐蚀的防护
钢铁在潮湿环境里长期放置容易生锈。请解释下列与铁生 锈现象有关的因素。 1.相对于在内河行驶的轮船来说,海轮更容易被腐蚀。 2.用于连接铜板的铁螺丝容易生锈。 3.当化工厂排出酸性废气时,工厂附近的铁制品更容易生锈。
1.相对于在内河行驶的轮船来说,海轮更容易被腐蚀。 海水含有更多盐类,在电解质溶液中电化学腐蚀更易 进行。 2.用于连接铜板的铁螺丝容易生锈。
通常两种腐蚀同时存在,但后者更普遍。
如图, 水槽中试管内有一枚铁钉,放置数天后观察: (1)若液面上升,则溶液呈 中性或碱 性,发生_____ 吸氧
腐蚀,电极反应式为:负极: Fe–2e-====Fe2+ ,
正极: O2+2H2O+4e-====4OH- ; (2)若液面下降,则溶液呈 酸 性,发生 析氢 腐蚀,电极反应式为: 负极: Fe–2e-====Fe2+ ++2e-====H ↑ 2H 2 正极: ,
由于铁与铜及潮湿的空气构成了原电池,铁作负极,
因而更易被腐蚀而生锈。 3.当化工厂排出酸性废气时,工厂附近的铁制品更容易生锈。 铁制品在酸性条件下比在中性条件下更容易被腐蚀。
1.铁锈的成分是什么?是怎样形成的? 2.将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,再放
入如图所示的具支试管中。几分钟后,导管中的水柱上升
第3课时
金属的腐蚀与防护
1.理解金属发生电化学腐蚀的原因; 2.了解金属腐蚀的危害; 3.了解防止金属腐蚀的常用措施。
我国作为世界上钢铁产量最多的国家,每年被腐蚀的 铁占到我国钢铁年产量的十分之一,因金属腐蚀而造成的
损失占到 国内生产总值的2 %~4 %;约合人民币3 000
亿 元。
金属腐蚀的危害和防腐的意义 据统计,金属腐蚀的年损失远远超过水灾、火灾、风 灾和地震损失的总和。 腐蚀不仅造成经济损失,也常造成灾难性事故,如飞
了,你知道为什么吗?
钢铁通常为含碳的铁合金,在一定环境中会构成原电池, 铁作负极,碳作正极。从而加快了钢铁的腐蚀。
水膜的酸碱性,
决定了钢铁的 电化学腐蚀的不同。 钢铁表面的微小原电池示意图
写出钢铁腐蚀的正极反应式。
钢铁的析氢腐蚀
钢铁的吸氧腐蚀
–
–
–
– –
–
酸性水膜 2H++2e-====H2↑
碱性或中性水膜 O2+2H2O+4e-====4OH-
机因零部件破裂而坠毁;桥梁因钢梁产生裂缝而塌陷;油
管因穿孔或裂缝而漏油,引起着火爆炸;化工厂中储酸槽 穿孔泄漏,造成重大环境污染等。
面对这样惊人的数据和金属腐蚀 危害的事实,思考:铁为什么会被腐蚀?应该怎样防腐呢?
一、金属腐蚀
1.定义 金属表面与周围的物质发生化学反应或因电化学作用而遭到 破坏。
2.本质 金属原子
3.钢铁在潮湿空气中发生电化学腐蚀时,正极发生的主 要反应是( B )
A.Fe - 2eˉ ==== Fe2+
B.2H2O + O2 + 4eˉ==== 4OHˉ C.4OHˉ - 4eˉ==== 2H2O +O2↑ D.2H+ + 2eˉ==== H2↑
