Claisen(克莱森)缩合反应资料
Claisen(克莱森)缩合反应资料
CH2
COOC2H5
①C2H5ONa
COCOOC2H5
+ (COOC2H5)2
CH2
COOC2H5
②H2O
CH
COOC2H5
CH2
COOC2H5
COCOOH
NaOH
H+
CH
Δ
COOH
CH2
COOH
CH2COCOOH CH2COOH
2.3 甲酸酯与其它酯的反应
与甲酸酯发生酯缩合反应后,即在α碳原子上引入一 个甲酰基。
O O
C2H5ONa
O O
CH3C CHCOC2H5
H
H+
CH3C CCHOC2H5 Na
关键因素:
酯的缩合物与碱生成盐是缩合反应完成的关键 一步。
为使反应顺利进行,两个羰基之间的碳上必须 有活泼氢。因此原料酯上的α碳上至少需要两个 氢。一个用于被碱夺取,另一个用于生成盐。
假如原料酯的α碳上只有一个活泼氢,则缩合反 应必须在更强碱的作用下才能完成。如:异丁 酸乙酯在乙醇钠作用下,不能发生酯缩合反应, 但在三苯甲基钠的作用下就可进行缩合。
CH3CHCOOC2H5 COCOOC2H5
注:
草酸酯的缩合产物有一个α-羰基酸酯的集团,加热即失
去一分子一氧化碳,变成取代的丙二酸酯。苯基取代的
丙二酸酯,不能用溴苯进行芳基化取代,但可用此法制
得:
C6H5CH2COOC2H5
+ (COOC2H5)2
①C2H5ONa ②H+
C6H5CHCOOC2H5
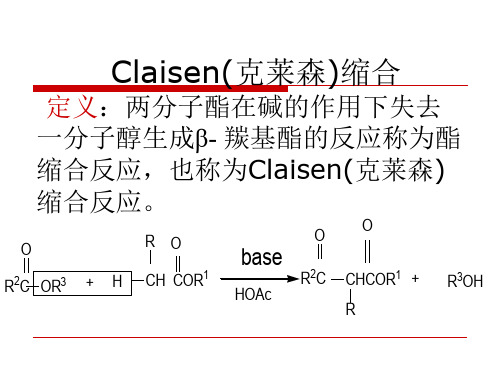
Claisen(克莱森)缩合
定义:两分子酯在碱的作用下失去
一分子醇生成β- 羰基酯的反应称为酯
claisen缩合反应

claisen缩合反应一、Claisen缩合反应的概念和原理Claisen缩合反应是一种重要的有机化学反应,其基本原理是通过两个酯或一个酯和一个醛/酮之间的羰基加成,形成β-羰基酯。
这种反应常用于有机合成中,可以制备出许多重要的有机化合物。
二、Claisen缩合反应的分类1. Claisen酯缩合反应:两个不同的酯在碱性条件下发生缩合反应,生成β-羰基酯。
2. Claisen内酯缩合反应:一种环状的β-羰基酮在碱性条件下发生内部环化,生成环状的β-内酯。
3. Dieckmann环化反应:两个相同的β-羰基酸酯在碱性条件下发生内部环化,生成环状的β-内酯。
三、Claisen缩合反应机理1. 首先,在碱性条件下,一个羰基亲核试剂(如乙氧根离子)攻击一个羧基碳上的电子不稳定位点,形成一个临时的α-羟基负离子中间体。
2. 然后,在第二个羰基试剂的作用下,这个中间体的负电荷被转移到第二个羰基碳上,形成一个新的负离子中间体。
3. 最后,经过质子化和消除水分子,生成β-羰基酯产物。
四、Claisen缩合反应的影响因素1. 碱催化剂:碱催化剂可以促进反应进行,并且影响反应速率和产物选择性。
2. 温度:温度对反应速率和产物选择性都有影响。
通常,较高温度可以加快反应速率,但也可能导致产生不良产物。
3. 反应物浓度:较高浓度的反应物可以加快反应速率,但也可能导致不良产物的生成。
4. 反应时间:反应时间也会影响反应速率和产物选择性。
通常,较长的反应时间可以增加产量和纯度。
五、Claisen缩合反应在有机合成中的应用1. 制备β-羰基酸酯:Claisen缩合反应是制备β-羰基酸酯的重要方法。
这些化合物在医药、香料和杀虫剂等领域都有广泛的用途。
2. 制备环状化合物:Claisen内酯缩合反应和Dieckmann环化反应是制备环状化合物的常用方法。
这些化合物在药物、农药和天然产物的合成中具有重要作用。
3. 制备α,β-不饱和羰基化合物:通过Claisen缩合反应可以制备出α,β-不饱和羰基化合物,这些化合物在有机光电子学、涂料和高分子材料等领域具有广泛的用途。
克莱森缩合反应

克莱森缩合反应克莱森缩合反应(ClaisenCondensation)是一种经典的有机合成反应(OrganicSynthesis),它是第一个把两个亚烷烃(Alkyne)反应,得到α,β-双键醛(α,β-Diketones)的反应。
这种反应被德国化学家Emil Hermann Fischer发现,并由他命名为克莱森缩合反应(Claisen Condensation)。
克莱森缩合反应是一种多步反应,它包含有催化剂和有机物的反应。
首先,其中一个亚烷烃被活性催化剂(Active Catalyst)如碱性金属离子如铵(Ammonium ion)、钾(Potassium)、钠(Sodium)、锂(Lithium)或碱金属氢氧化物(Alkali Metal Hydroxide)等水解,从而产生羟基腈(Hydroxycyanide),分子中的双键醛(alkene)离子(enolate ion)和碱(base)。
接下来,另一个亚烷烃(alkyne)被双键醛离子(enolate ion)活化,反应方程式如下:R-C≡C-H + RC(=O)OH R-C(=O)H + RC(=O)-C-H产物是α,β-双键醛(α,β-Diketone),可以通过进一步水解得到甲醛(aldehyde)或酮(ketone)。
克莱森缩合反应的应用也很广泛,它可以用于芳香醛的合成,也可以用于酮和醇的合成。
它还被用于合成特殊的有机分子,如吡嗪(pyridine)、吡咯(pyrrole)、氢磺化醚(thiol ether)和吡啶(pyridine)等。
克莱森缩合反应也可以用来合成药物,它可以用来合成百苯多拉丁(Bisoprolol)、等离子体低分子量肝素(Plasmolow Molecular Weight Heparin)、环苯胺(Cycloamine)、环氧乙醇(Cyclooxyethanol)和其他药物。
此外,克莱森缩合反应也可以用于分子间化学,它可以用来合成一些重要的分子,如:1、维生素A(Vitamin A):这种维生素是一种脂溶性维生素,它可以使眼部正常发育,可以帮助皮肤正常发育,还有维持视力、健康血管和免疫功能等。
克莱森缩合 草酸二甲酯

克莱森缩合草酸二甲酯
克莱森缩合是一种有机合成反应,常用于合成酮和醛化合物。
草酸二甲酯是该反应中常用的底物之一。
克莱森缩合反应是一种通过酮或醛与碱反应生成烯醇盐的反应。
草酸二甲酯,化学式为(CH3OOC)2O,是一种无色液体,可作为该反应的醇性底物之一。
它在碱的作用下,通过消除甲醇分子,生成烯醇盐中间体。
这种反应的机理比较复杂,但总的来说,草酸二甲酯首先与碱形成酯盐,然后发生脱羰基反应,生成烯醇盐。
烯醇盐可以发生负离子迁移,生成烯醇化合物。
最后,烯醇化合物可以通过水解反应生成醛或酮。
克莱森缩合反应是有机合成中重要的反应之一,它可以用于合成多种有机化合物,尤其是含有活性羰基的化合物。
草酸二甲酯作为该反应的底物之一,具有较高的反应活性和广泛的适用性。
在实际应用中,草酸二甲酯可以通过多种途径合成,如甲醇和草酸的酯化反应。
此外,草酸二甲酯还可以作为某些催化剂的配体,用于催化其他有机反应。
克莱森缩合是一种重要的有机合成反应,草酸二甲酯作为该反应的底物之一,在有机合成中具有广泛的应用前景。
通过这种反应,可以合成多种有机化合物,为有机化学领域的研究和应用提供了重要
的手段。
克莱森缩合反应及其应用

克莱森缩合反应
是指两分子酯或者一分子酯与一分子羰基化合物,在强碱催化下缩合,失去一分 子醇生成一分子β-酮酸酯或者β-二酮的反应。 参与反应的两个酯分子不必相同,但其中一个必须在酰基的α-碳上连有至少一个 氢原子。简单的说,该反应是一个酯分子的酰基对另一酯分子的酰基α-碳原子进 行的酰化反应。
Definition
定义
实际上这个反应不限于酯类与酯类的缩合,酯与含活泼亚甲基的化合物 都可以发生这样的缩合反应。通式表示为:
一般酮和腈的酸性要比酯强,它们在碱作用下α-碳优先变成碳负离子
Mechanism
核心步骤:亲核取代反应。
反应机理
1. 一分子羧酸酯或酮在强碱的进攻下失去酰基的一个α-氢原子,这是一个E2消 除反应,并得到碳负离子
Mechanism
酸性强弱的判断
反应机理
大多数有机酸是指质子酸碱定义中的酸,酸性的强弱主要是给出H 能力的大小, 给出H+能力的大小判断可由其共轭碱的稳定性来判断。 共轭碱的稳定性愈大,据“稳定性原理”,则愈容易给出H+,酸性就大。由于 共轭碱的结构为负离子,因此,只需判断负离子的稳定性,就可判断酸的强 弱。负离子的稳定性可用电子效应来判断。
Direct Carbon-Carbon Bond Formation via Chemoselective Soft Enolization of Thioesters: A Remarkably Simple and Versatile Crossed-Claisen Reaction Applied to the Synthesis of LY294002 G. Zhou, D. Lim, D. M. Coltart, Org. Lett., 2008, 10, 3809-3812.
克莱森缩合反应

实验装置图
实验操作:
于100 mL圆底烧瓶中放 入金属钠2.0 g以及10 mL的二甲苯。 放入磁力搅拌子,置于带搅 拌的电热帽中,再装上球形冷凝回流管以及装有无水氯化钙的干 燥管。 加热,直到金属钠熔融为钠珠,停止加热,打开搅拌开关, 将搅拌子转动速度调到快速位置,熔融的金 属钠被打制成为小液 珠,随着烧瓶慢慢冷却,金属钠液珠冷却形成颗粒细小的钠砂。 停止搅拌,钠砂沉降,倾出二甲苯。 向圆底烧瓶中加入25 mL 乙酸乙酯,加热回流,保持微沸,反应缓慢地进行,直至钠砂完 全消失后继续 反应20 min。 为使反应进行得更为顺利,可以启动 搅拌子。此时得到棕红色的溶液或黄色沉淀。 停止加热,并冷至 室温后,缓慢滴加50 %醋酸,使呈弱酸行。 加入食盐饱和,分 液。
原理:
含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。 如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
制备乙酰乙酸乙酯 实验仪器:
电热帽,磁力搅拌器,100 mL圆底烧瓶,球形冷 凝回流管,干燥管,磁子。
实验试剂:
金属钠,乙酸乙酯,二甲苯,50 %醋酸,5 %碳 酸氢钠,无水硫酸镁。
改进之处:
通过磁力搅拌器在搅拌促进的钠砂制备中,搅拌器的转速和磁子搅拌中 产生的力矩对钠砂的粒度和 均匀性有很大的影响 对比常规震摇方法。通过对乙酰乙酸乙酯合成实验的钠砂制备方法的改进,针对 性地解决常规震摇 制备钠砂中存在的问题。改进的操 作方法,不仅可以顺利地制取钠砂,同时有助于安全便捷地完成 实验,无疑能有效提高该实验课的教学效果。
水相用20 mL乙酸乙酯萃取一次,合并有机相。并用20 mL 5 %碳酸氢钠洗涤两次,用无水硫酸钠干燥有 机相,
克莱森缩合 甲醇甲醇钠

克莱森缩合甲醇甲醇钠克莱森缩合克莱森缩合是一种有机化学反应,常用于合成芳香醛和芳香酮。
该反应以一种芳香化合物和一种碱性化合物(如胺)为原料,在碱性催化下进行缩合反应。
反应机理克莱森缩合的反应机理比较复杂,涉及多个步骤。
以下是一个简单的机理图示:1. 碱性条件下,硫酸钠使甲醛失去一个质子生成甲氧根离子。
2. 芳香环上的羰基吸引甲氧根离子,发生亲核加成。
3. 加成产物失去一个质子生成α-羟基芳香醛中间体。
4. 中间体经过去质子化形成最终产物。
反应条件克莱森缩合通常需要在碱性条件下进行。
常用的碱包括氢氧化钠、碳酸钠、三乙胺等。
此外,还需要使用适当的溶剂来促进反应。
常用的溶剂包括乙二醇、二甘醇、丁二醇等。
应用范围克莱森缩合广泛应用于有机合成领域。
它可以用于合成各种芳香醛和芳香酮,如苯甲醛、苯乙酮、对羟基苯甲醛等。
此外,克莱森缩合还可用于制备一些天然产物和药物分子。
甲醇甲醇是一种无色、有毒的液体,具有轻微的甜味和刺激性气味。
它是一种重要的化学品,在工业生产中广泛应用。
制备方法1. 从天然气中提取:通过天然气水蒸气重整反应得到合成气,再经过低温催化反应得到甲醇。
2. 从木材中提取:通过炭化木材得到木炭,再经过加热分解得到木质液体,最后通过蒸馏得到甲醇。
3. 合成法:将碳一氧化物和氢在高压下催化反应生成甲醇。
应用领域1. 化工行业:作为溶剂、原料、反应介质等。
2. 能源行业:作为汽油替代品、航空燃料等。
3. 医药行业:作为药物成分、消毒剂等。
4. 食品行业:作为食品添加剂、香精等。
甲醇钠甲醇钠是一种无色晶体,易溶于水和乙醇,具有碱性。
它可以用于有机合成领域中的一些反应,如克莱森缩合反应。
制备方法1. 直接反应法:将甲醇和金属钠在惰性气体保护下反应得到甲醇钠。
2. 溶液法:将金属钠加入甲醇溶液中反应得到甲醇钠。
应用领域1. 有机合成领域:作为碱催化剂参与克莱森缩合反应等。
2. 化学分析领域:作为分析试剂进行滴定等实验。
克莱森缩合反应机理

克莱森缩合反应机理
克莱森缩合反应是指含有α-活泼氢的酯类在醇钠、三苯甲基钠等碱性试剂的作用下,发生缩合反应形成β-酮酸酯类化合物。
以下是其反应机理:
1.一分子羧酸酯在强碱的进攻下失去酰基的一个α-氢原子,这是一个E2消除反应,并得到碳负离子A。
2.A对另一分子羧酸酯的羰基进行亲核进攻,得到中间体B,B 随后脱去醇负离子而得到产物β-羰基羧酸酯。
3.产物的α-氢与两个羰基邻近,因而有较强的酸性,会与反应物中的强碱反应而以共轭碱的形式存在。
只要α碳上有氢原子的酯,在乙醇钠或其他碱性催化剂存在下,都能进行克莱森(酯)缩合反应。
反应可在不同的酯之间进行,称为交叉酯缩合;也可将本反应用于二元羧酸酯的分子内环化反应,这时反应又称为迪克曼反应(Dieckmann reaction)。
克莱森酯缩合法制备乙酰乙酸乙酯
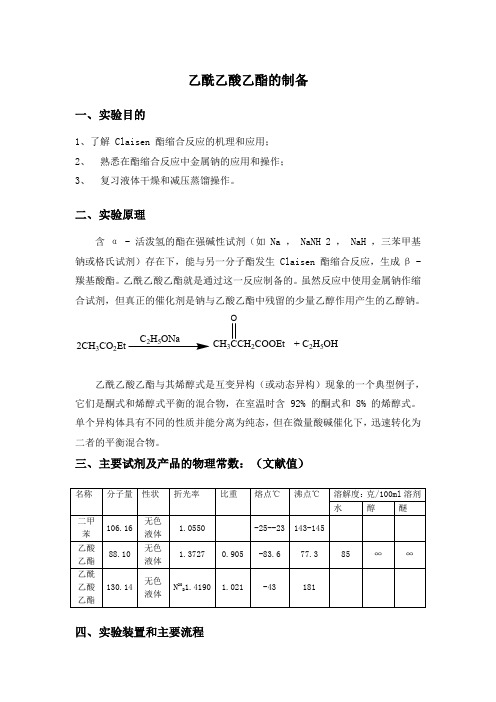
乙酰乙酸乙酯的制备一、 实验目的1、了解 Claisen 酯缩合反应的机理和应用;2、 熟悉在酯缩合反应中金属钠的应用和操作;3、 复习液体干燥和减压蒸馏操作。
二、 实验原理含α - 活泼氢的酯在强碱性试剂(如 Na , NaNH 2 , NaH ,三苯甲基钠或格氏试剂)存在下,能与另一分子酯发生 Claisen 酯缩合反应,生成β - 羰基酸酯。
乙酰乙酸乙酯就是通过这一反应制备的。
虽然反应中使用金属钠作缩合试剂,但真正的催化剂是钠与乙酸乙酯中残留的少量乙醇作用产生的乙醇钠。
2CH 3CO 2EtCH 32COOEt O+ C 2H 5OH乙酰乙酸乙酯与其烯醇式是互变异构(或动态异构)现象的一个典型例子,它们是酮式和烯醇式平衡的混合物,在室温时含 92% 的酮式和 8% 的烯醇式。
单个异构体具有不同的性质并能分离为纯态,但在微量酸碱催化下,迅速转化为二者的平衡混合物。
三、 主要试剂及产品的物理常数:(文献值)四、 实验装置和主要流程五、 实验步骤1、熔钠:在干燥的50mL 圆底烧瓶中加入0.9g 金属钠和5mL 二甲苯,装上冷凝管,加热使钠熔融。
拆去冷凝管,用磨口玻塞塞紧圆底烧瓶,用力振摇得细粒状钠珠。
回收二甲苯。
2、加酯回流:迅速放入10ml 乙酸乙酯,反应开始。
若慢可温热。
回流约2h 至钠直至所有金属钠全部作用完为止,得橘红色溶液,有时析出黄白色沉淀(均为烯醇盐)。
3、酸 化 :加50%醋酸,至反应液呈弱酸性(固体溶完)。
4、分 液:反应液转入分液漏斗,加等体积饱和氯化钠溶液,振摇,静置。
5、干 燥 :分出乙酰乙酸乙酯层,用无水硫酸钠干燥。
(2)6、蒸馏和减压蒸馏。
先在沸水浴上蒸去未作用的乙酸乙酯,然后将剩余液移入25mL圆底烧瓶中,用减压蒸馏装置进行减压蒸馏。
减压蒸馏时须缓慢加热,待残留的低沸点物质蒸出后,再升高温度,收集乙酰乙酸乙酯。
产量约1.5g。
乙酰乙酸乙酯沸点与压力的关系如下表:压力760 80 60 40 30 20 18 14 12 10 5 1.0 0.1 /mmHg*沸点181 100 97 92 88 82 78 74 71 67.3 54 28.5 5 /℃* 1mmHg= 1 Torr = 133.322Pa乙酰乙酸乙酯的沸点为180.4℃,折光率 =1.4199。
克莱森酯缩合反应机理

克莱森酯缩合反应机理克莱森酯缩合反应是一种重要的有机合成反应,被广泛应用于生物化学、有机合成和药物合成等领域。
这种反应的基本原理是以β-酰基联合物(如乙酰乙酸和苯酚)为底物,经过酸催化下的水解和缩合反应,生成新的酰化产物。
本文将从反应机理以及主要反应步骤两个方面详细介绍克莱森酯缩合反应。
一、反应机理克莱森酯缩合反应的机理较复杂,主要可分为三个步骤:酸催化水解、质子转移和羰基加成。
(1)酸催化水解首先,β-酰基联合物在酸的作用下发生水解反应,生成相应的酸和醇。
例如:乙酰乙酸与苯酚可以在硫酸的作用下水解成苯基丙酮和水。
(2)质子转移随着底物的水解,产生的苯基丙酮分子中的一个羰基带有正电荷,另一个羰基则带有负电荷。
为达到中性,α碳上的氢离子会向带负电荷的羰基迁移,形成稳定的偶电子共轭结构。
质子转移反应是本反应中最重要的步骤。
(3)羰基加成最后,由于酮与酯基序列相连,可能发生Ⅰ型加成,形成的β-酰羰基联合物是反应产物的主要组成部分。
二、主要反应步骤1、准备反应底物首先需要准备出乙酰乙酸和苯酚这两种反应底物。
其中,乙酰乙酸是一种有机酸,常为无色无臭的液体,可以通过将醋酸称为之后脱水得到。
苯酚则是一种无色透明的液体,可通过苯的氢氧化反应制得。
2、加入催化剂将乙酰乙酸和苯酚按照一定的比例混合,加入适量的硫酸作为催化剂,用磁力搅拌器搅拌至混合均匀。
3、反应将混合物放置在用于加热的反应器中,加热至适宜的温度继续搅拌,持续反应1-2小时。
反应结束后,用硫酸中和反应产物酸,然后用冰水洗涤,干燥后得到产物。
综上所述,克莱森酯缩合反应具有较高的化学反应性和广泛的应用前景,是有机合成和化学生物学领域不可或缺的重要反应之一。
克莱森Claisen酯缩合反应实例注意

三、命名
1、俗名:
CHOOH 蚁酸
HOOCCOOH草酸
CH3COOH醋酸
HOOC C H C COOH 富马酸 H
HOOCCH 琥珀酸 2CH2COOH
HOOC C H 马来酸 C H COOH
2、IUPAC法
a.含羧基的最长碳链。 b.编号。从羧基C原子开始编号。(用阿拉伯数字或希腊字母)
4 3 2 1 CH3CHCHCH2COOH 5
C O Cl
HCOOH CH3COOH CH3CH2COOH PKa 3.76 4.76 4.78
Me3CCOOH 4.86
Me2CHCOOH 5.03
Cl 3CCOOH 〉Cl2CHCOOH 〉ClCH CH3COOH 2COOH 〉 PKa 0.64 1.30 2.86 4.76
+I效应使羧酸酸性减弱,-I效应使羧酸酸性增强。
Me COOH COOH Me
9个碳羧酸(奇数)
8个碳羧酸(偶数)
3.溶解性:短链羧酸能溶于水,随着烃基的增大溶解度( 水中)减小。 4.气味:甲、乙、丙酸有较强的刺鼻气味,水溶液有酸味。 4-9碳原子酸有难闻的酸臭味。 高级脂肪酸无气味,挥发性很低。
5.比重:一元羧酸:甲酸、乙酸比重大于1; 其它羧酸的比重小于1。 二元羧酸、芳香羧酸的比重大于1。 6. 状态: 十个碳原子以下的饱和一元酸是液体。 高级脂肪酸是蜡状固体。 二元脂肪酸和芳香酸都是结晶固体。
[目的要求]:
1、掌握羧酸的命名。 2、了解羧酸的物理性质和光谱性质; 3、掌握羧酸的结构和化学性质; 4、掌握羧酸的制备,了解羧酸的来源; 5、掌握二元羧酸和取代酸的化学性质; 6、了解一些重要的一元羧酸、二元羧酸和取代酸; 7、理解酸碱理论在有机化学中的应用; 8、掌握羧酸衍生物的分类和命名; 9、了解羧酸衍生物的光谱性质; 10、掌握羧酸衍生物化学性质的共性与特性; 11、掌握酯的水解历程,了解其氨解、醇解历程; 12、了解一些重要的碳酸衍生物的用途;
克莱森缩合反应

克莱森缩合反应是指含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯的反应称为Claisen缩合。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯(又名β-丁酮酸酯)。
两分子乙酸乙酯在乙醇钠的作用下,发生缩合反应,脱去一分子乙醇,生成乙酰乙酸乙酯(又名β-丁酮酸酯)。
CH3COOC2H5+CH3COOC2H5——(乙醇钠)——CH3COCH2COOC2H5+C2H5OH
凡是α碳上有氢原子的酯,在乙醇钠或其他碱性催化剂存在下,都能进行克莱森(酯)缩合反应。
虽然乙酸乙酯的酸性很弱,难以在碱的作用下生成稳定的乙酸乙酯负离子CH2COOC2H5,但产物β酮酯的酸性较强,能形成较稳定的负碳离子,有利于整个反应的平衡向右移动。
一旦有少量乙酸乙酯负离子形成,反应便可不断地进行下去,直至完全。
一般酯类化合物的α氢原子的酸性均很弱,克莱森缩合反应必须用较强的碱催化。
常用的碱有醇钠、氨基钠、氢化钠(钾)等。
原则上,碱性愈强愈有利于缩合反应的进行。
有些酯,由于缩合后的产物不含活泼氢,不能依靠生成稳定的负碳离子而使平衡向生成物的方向移动,因此需要很强的碱(例如用三苯甲基钠)才能使反应进行下去:
克莱森缩合反应除进行酯的自身缩合外,还可与含有活泼α氢原子的其他酯、酮、腈等在碱催化下发生缩合反应,生成相应的β酮酯、β-二酮或β酮腈等。
克莱森酯缩合反应——乙酰乙酸乙酯的合成

四氢铝锂和硼氢化钠作为重要氢负离子的还原剂类化合物,在合成反应中起着举足轻重的作用。
氢负离子的还原羰基化合物实质上就是亲核加成反应,四氢铝锂和硼氢化钠对羰基的还原反应原理是一样的,它们都不能还原碳碳双键;导航:\β-二羰基化合物\克莱森酯缩合反应13.4 克莱森酯缩合反应——乙酰乙酸乙酯的合成乙酸乙酯在乙醇钠存在下,起分子间的缩合反应,酸化后得到乙酰乙酸乙酯:其他有两个α-氢的羧酸酯也可以在乙醇钠存在下缩合,酸化后得到β-酮酸酯。
这是制备β-酮酸酯的重要方法,称为克莱森缩合(Claisen condensation)。
乙酸乙酯分子中的α-氢有微弱酸性,其pKa为15,在醇钠作用下,能生成烯醇盐,烯醇盐进攻另一分子乙酸乙酯中的羰基,生成乙酰乙酸乙酯。
乙酸乙酯的酸性强度与乙醇接近。
因此,用乙醇钠作碱性试剂时,只有很小一部分乙酸乙酯变成烯醇盐,即在第一步反应中,平衡偏向左边。
由烯醇盐的缩合反应生成的乙酰乙酸乙酯的量也很少。
乙酰乙酸乙酯分子中,活性亚甲基上的氢具有较强的酸性(pKa=11),乙醇钠能使它差不多完全变成烯醇盐,即下面的平衡中,平衡位置偏向右边:因此,虽然在上面的平衡反应中只生成少量的乙酰乙酸乙酯,但生成后,差不多完全变成烯醇盐,这样就使平衡向右移动,使缩合反应能够继续进行,直到乙酸乙酯差不多全部缩合为止。
这就是说:乙酰乙酸乙酯较强的酸性推动了缩合反应的进行。
生成的乙酰乙酸乙酯烯醇盐用乙酸酸化,即释出乙酰乙酸乙酯:只有一个α-氢的酯,在乙醇钠存在下,虽然也可以生成烯醇盐,烯醇盐也能与另一分子酯缩合,但得到的β-酮酸酯没有α-氢,不能变成盐,缺乏使平衡向右移动的推动力,缩合也不能继续进行。
如果采用一个很强的碱,使酯生成烯醇盐这一步的平衡位置偏向右边,仍可以得到酮酸酯,例如:位阻很大的格利雅试剂不能与羰基加成,但可以夺取活性氢,也可以用来使羧酸酯变成烯醇盐:两种酯的混合物起克莱森缩合反应,可以得到四种β-酮酸酯的混合物:因此,没有合成价值。
克莱森酯缩合机理与反应机制

Claisen 酯缩合反应
含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如
2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见Dieckmann缩合反应。
反应机理
乙酸乙酯的α-氢酸性很弱(pK a-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pK a~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯
是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管
反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
常用的碱性缩合剂除乙醇钠外,还有叔丁醇钾、叔丁醇钠、氢化钾、氢化钠、三苯甲基钠、二
异丙氨基锂(LDA)和Grignard试剂等。
反应实例
如果酯的α-碳上只有一个氢原子,由于酸性太弱,用乙醇钠难于形成负离子,需要用较强的碱才能把酯变为负离子。
如异丁酸乙酯在三苯甲基钠作用下,可以进行缩合,而在乙醇钠作用下则不能发生反应:
两种不同的酯也能发生酯缩合,理论上可得到四种不同的产物,称为混合酯缩合,在制备上没有太大意义。
如果其中一个酯分子中既无α-氢原子,而且烷氧羰基又比较活泼时,则仅生成一种缩合产物。
如苯甲酸酯、甲酸酯、草酸酯、碳酸酯等。
与其它含α-氢原子的酯反应时,都只生成一种缩合产物。
实际上这个反应不限于酯类自身的缩合,酯与含活泼亚甲基的化合物都可以发生这样的缩合反应,这个反应可以用下列通式表示:。
克莱森缩合机理

克莱森缩合反应是一种重要的有机化学反应,也称为克莱森缩合、克莱森酯化反应或克莱森缩合酯化反应。
它是一种缩合反应,可以将两个分子通过酯化反应形成一个更大的分子。
克莱森缩合反应的机理如下:
1. 首先,反应物中的一个醇和一个酸在适当的条件下(如加热、酸性催化剂等)发生酯化反应,生成一个酯和水。
2. 然后,这个酯与另一个醇发生克莱森缩合反应,生成一个更大的酯和一个小分子醇。
3. 这个小分子醇可以再次参与反应,与另一个酸发生酯化反应,生成一个更大的分子。
4. 这个过程可以重复进行,形成一个连续的酯化反应链。
克莱森缩合反应的机理可以用以下反应式来表示:
醇1 + 酸1 →酯1 + 水
酯1 + 醇2 →更大的酯+ 小分子醇
小分子醇+ 酸2 →酯2 + 水
酯2 + 醇3 →更大的酯+ 小分子醇
这个反应可以一直重复下去,形成一个连续的酯化反应链。
克莱森缩合反应的机理可以用分子轨道理论来解释。
在酯化反应中,醇中的羟基和酸中的羰基形成了一个共价键。
在克莱森缩合反应中,这个共价键被打破,形成了一个新的酯键。
这个过程中,分子中的电子云发生了变化,导致了反应的发生。
总的来说,克莱森缩合反应是一种重要的有机化学反应,可以将两个分子通过酯化反应形成一个更大的分子。
它的机理可以用酯化反应和分子轨道理论来解释。
克莱森缩合反应

Claisen Condensation
——克莱森缩合反应
Contents
1. 定义 2. 反应机理 3. 反应类型 4. 应用 5. 近期文献报道
Definition
定义
定义 是指含活泼H的两分子酯或者一分子酯与一分 子羰基化合物,在强碱催化下缩合,失去一分 子醇生成一分子β-酮酸酯或者1,3-二酮的反应 。 反应条件
Mechanism
反应机理
核心步骤:亲核取代反应。 1.一分子羧酸酯或酮在强碱的进攻下失去酰基的一个α-氢
原子,得到碳负离子。
α-H
烯醇负离子
碳负离子
Mechanism
反应机理
α-H酸性判断
α-H的酸性强弱取决于解离后得到的碳负离子的稳定性:
碳负离子越稳定,α-氢的酸性越强。 1)吸电子效应的影响:
总的吸电子能力越强,α-氢的酸性越强。 2)电子离域的影响:
碳负离子的离域范围越大,α-氢的酸性越强。 3)羰基化合物α-H活性顺序
Mechanism 理
反应机
2.碳负离子对另一分子羧酸酯的羰基进行亲核进攻,得到中 间体,随后脱去醇负离子而得到产物β-羰基羧酸酯。
克莱森缩合——精选推荐

克莱森缩合碱催化下酯缩合得到β-酮酯的反应。
反应机理反应实例反-克莱森缩合反应分⼦内的克莱森缩合⼜被称为迪克曼缩合。
参考⽂献1 Claisen, R. L.; Lowman, O. Ber. 1887, 20, 651. Rainer Ludwig Claisen (1851-1930), born in Cologne, Germany, probably had the best pedigree in the history of organic chemistry. He apprenticed under Kekulé, Wöhler, von Baeyer, and Fischer before embarking on his own independent research. Rainer Ludwig Claisen (1851-1930)⽣于德国科隆,他在有机化学史上可谓师出名门。
在他独⽴进⾏研究之前曾经师从凯库勒,维勒,von Baeyer和Fischer 。
2 Hauser, C. R.; Hudson, B. E. Org. React. 1942, 1, 266-302. (Review).3 Schäfer, J. P.; Bloomfield, J. J. Org. React. 1967, 15, 1-203. (Review).4 Yoshizawa, K.; Toyota, S.; Toda, F. Tetrahedron Lett. 2001, 42, 7983-7985.5 Heath, R. J.; Rock, C. O. Nat. Prod. Rep. 2002, 19, 581-596. (Review).6 Honda, Y.; Katayama, S.; Kojima, M.; Suzuki, T.; Izawa, K. Org. Lett. 2002, 4,447-449.7 Mogilaiah, K.; Reddy, N. V. Synth. Commun. 2003, 33, 73-78.8 Linderberg, M. T.; Moge, M.; Sivadasan, S. Org. Process Res. Dev. 2004, 8, 838-845.9 Kawata, A.; Takata, K.; Kuninobu, Y.; Takai, K. Angew. Chem. Int. Ed. 2007, 46,7793-7795.10 Iida, K.; Ohtaka, K.; Komatsu, T.; Makino, T.; Kajiwara, M. J. Labelled Compd. Radiopharm. 2008, 51, 167-169.11 Song, Y. Y.; He, H. G.; Li, Y.; Deng, Y. Tetrahedron Lett. 2013, 54, 2658-2660.编译⾃:J.J. Li, Name Reactions: A Collection of Detailed Mechanisms and Synthetic Applications, Claisen condensation,page 136-137.。
克莱森酯缩合实验方法

克莱森酯缩合实验方法克莱森酯缩合反应是一种重要的有机合成反应,该反应是通过两个醇分子的脱水缩合来合成酯类化合物的过程。
本文将详细介绍克莱森酯缩合实验的方法,包括实验原理、实验步骤、影响因素、实验结果和实验应用等方面。
一、实验原理克莱森酯缩合反应通常在浓硫酸催化下进行,浓硫酸起到催化剂和脱水剂的作用。
反应首先由一个醇分子中的羟基与另一个醇分子中的氢原子形成氢键,然后失去一分子水,最后形成酯类化合物。
该反应的化学方程式如下:2CH3CH2OH+CH3CH2OH→CH3CH2OCH2CH3+H2O二、实验步骤1.准备试剂和设备:克莱森酯缩合反应需要用到醇类化合物、浓硫酸以及必要的玻璃仪器和搅拌装置等。
2.安装仪器:将所需的玻璃仪器和搅拌装置按照正确的方法连接起来,并确保仪器干净无污染。
3.加入醇类化合物:将所需的醇类化合物按照一定的比例加入到反应器中。
4.加入浓硫酸:将浓硫酸按照一定的比例加入到反应器中,并搅拌均匀。
5.加热和搅拌:将反应器加热到一定的温度并持续搅拌,以使反应充分进行。
6.收集产物:待反应结束后,通过蒸馏等方法收集生成的酯类化合物。
7.分析产物:对生成的酯类化合物进行化学分析,如核磁共振氢谱、红外光谱等。
三、影响因素1.反应温度:反应温度是影响克莱森酯缩合反应速率的重要因素。
一般来说,反应温度越高,反应速率越快,但过高的温度可能导致副反应的发生。
2.时间:反应时间也会影响克莱森酯缩合反应的产物和产率。
反应时间过短可能导致反应不完全,过长则可能导致副反应增加。
3.pH值:在克莱森酯缩合反应中,pH值是一个关键因素。
过低的pH值可能导致醇分子发生碳化,过高的pH值则可能导致水解反应。
4.试剂浓度:醇类化合物和浓硫酸的浓度都会影响克莱森酯缩合反应的结果。
过高或过低的浓度都可能导致反应速率和产物的变化。
四、实验结果实验结束后,我们可以收集到生成的酯类化合物,通过对产物的化学分析,可以得出以下实验结果:1.产物的收集和纯化:通过蒸馏等方法收集生成的酯类化合物,并采用适当的纯化方法得到纯度较高的产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
为什么这个反应进行的如此完全呢?
其原因是最后产物乙酰乙酸乙酯是一个比 较强的酸,在碱作用下可以形成很稳定的 负离子,使平衡朝产物方向移动。体系中 乙酸乙酯负离子浓度虽低,但一旦形成就 不断反应,结果使反应完成。
NaH C6H5COOCH3 + CH3CH2COOC2H5 H CH3 C6H5COCCOOC2H5 CH3 C6H5COCCOOC2H5 H
2.2 草酸酯与其它酯的反应
草酸酯由于一个酯基的诱导作用,增加了另一个羰 基的亲电作用,所以比较容易和其它的酯发生缩合 作用#43; CH3CH2COC2H5 ①C2H5ONa ②H+ CH3CHCOOC2H5 COCOOC2H5
2.混合酯缩合
若用两个不同的并都含有α活泼氢的酯进行 酯缩合作用,理论上就可得到四种不同的产 物,在制备上,没有很多的价值。 因此一般进行这种混合酯缩合时,只用一个 含有活泼氢的酯和一个不含活泼氢的酯进行 缩合。 经常用的不含活泼氢的酯有苯甲酸酯、甲酸 酯、草酸酯、碳酸酯等。
2.1苯甲酸酯与其它酯的反应 注:芳香酸酯的酯羰基一般不够活泼, 缩合时需要用较强的碱,有足够浓度的 碳负离子,才能保证反应进行。
O O
C2H5ONa
O
O
CH3C CHCOC2H5 H
H+
CH3C CCHOC2H5 Na
关键因素:
酯的缩合物与碱生成盐是缩合反应完成的关键 一步。 为使反应顺利进行,两个羰基之间的碳上必须 有活泼氢。因此原料酯上的α碳上至少需要两个 氢。一个用于被碱夺取,另一个用于生成盐。 假如原料酯的α碳上只有一个活泼氢,则缩合反 应必须在更强碱的作用下才能完成。如:异丁 酸乙酯在乙醇钠作用下,不能发生酯缩合反应, 但在三苯甲基钠的作用下就可进行缩合。
注:
Claisen(克莱森)缩合反应是可逆的,因此 生成的β-二羰基化合物在催化量的碱与一分 子醇作用下,可发生Claisen(克莱森)酯缩 合反应的逆反应,分解为两分子酯。 小结:
Claisen(克莱森)缩合反应,在合成上很重要,其逆合成在合 成上也是很有用的。
Claisen(克莱森)缩合
定义:两分子酯在碱的作用下失去 一分子醇生成β- 羰基酯的反应称为酯 缩合反应,也称为Claisen(克莱森) 缩合反应。
O R C OR
2 3
R O + H CH COR1
O
O CHCOR1 + R R3OH
base
HOAc
R2C
反应机理如下:
反应机理为:
首先,酯在碱的作用下失去活泼氢,生成烯 醇负离子,烯醇负离子对另一分子的酯发生 亲和加成,再消去烷氧负离子,生成β-酮酯。
溶剂的影响:
假如溶剂的酸性比原化合物强得多,就不能 产生很多的碳负离子,因为溶剂的质子被碱 性很强的碳负离子夺去了。
一般使用的强碱和相应的溶剂有以下几种 搭配:
1.三级丁醇钾,经常使用三级丁醇、二甲亚 砜、四氢呋喃为溶剂; 2.氨基钠,溶剂为液氨、醚、苯、甲苯、 1,2-二甲氧乙烷等; 3.氢化钠及氢化钾,溶剂为苯、醚、二甲基 甲酰胺等; 4.三苯甲基钠,溶剂为苯、醚、液氨等; 注:三苯甲烷的pKa值大约为31.5,而三级 丁醇的pKa是18,因此三苯甲基钠要比三级 丁醇钠的碱性强得多。此外还有LDA等。
2-氧代戊二酸( α-羰基戊二酸)的合成:
CH2
COOC2H5
+ (COOC2H5)2 CH2
COOC2H5
①C2H5ONa ②H2O CH
COCOOC2H5
COOC2H5
CH2 COCOOH NaOH H+ CH
COOH
COOC2H5
Δ
CH2COCOOH CH2COOH
CH2
COOH
2.3 甲酸酯与其它酯的反应
与甲酸酯发生酯缩合反应后,即在α碳原子上引入一 个甲酰基。 如用苯乙酸乙酯和甲酸乙酯进行缩合,得到α-甲酰 苯乙酸乙酯:
C6H5CH2COOC2H5 + HCOOC2H5 CH3ONa C6H5CHCOOC2H5 + C2H5OH CHO 70%
注:
α-甲酰化合物是非常活泼的,产率往往很低, 并且容易聚合。 例如:乙酸乙酯和甲酸乙酯缩合的产物,会马 上再发生羟醛缩合作用,得到均苯三甲酸三 乙酯。
C2H5OC δ+
COC2H5
注:
草酸酯的缩合产物有一个α-羰基酸酯的集团,加热即失 去一分子一氧化碳,变成取代的丙二酸酯。苯基取代的 丙二酸酯,不能用溴苯进行芳基化取代,但可用此法制 得: C6H5CHCOOC2H5 ①C H ONa
C6H5CH2COOC2 H5 + (COOC2H5)2
2 5
②H+ 175℃
CO
COOC2H5
C6H5 CHCOOC2H5
COOC2 H5
80%~85%
注:
用长链的脂肪酸酯和草酸酯反应,一般产率 很低,但如能将产出来的乙醇不断蒸出,可 以得到产率较高的产物。 草酸酯缩合产物,经过处理可以得到α-羰基 酸。利用这个反应,可以合成生物化学上重 要的2-氧代戊二酸。
反应条件:
1.至少有一个酯含有活泼氢 2.碱性条件下反应 3.使用的溶剂必须符合一定的条件。
1.相同酯之间的缩合
例如:乙酸乙酯的缩合产物“三乙” 乙酸乙酯的α氢的酸性是很弱的(pKa约为24.5), 而乙醇钠是一个较弱的碱(乙醇, pKa 约为15.9) 在这样条件下,乙酸乙酯形成的负离子在平衡体系 中很少的。 反应如下
