四种晶体类型的比较完整版
晶体的四种基本类型和特点

晶体的四种基本类型和特点晶体是由于原子、分子或离子排列有序而形成的固态物质。
根据晶体的结构特点,晶体可以分为四种基本类型:离子晶体、共价晶体、金属晶体和分子晶体。
1. 离子晶体离子晶体由正离子和负离子通过离子键结合而成。
正负离子之间的电荷吸引力使得离子晶体具有高熔点和脆性。
离子晶体的晶格结构稳定,形成高度有序的排列。
常见的离子晶体有氯化钠(NaCl)、氧化镁(MgO)等。
离子晶体在溶液中能够导电,但在固态下通常是绝缘体。
2. 共价晶体共价晶体由共价键连接的原子或分子组成。
共价键是由原子间的电子共享形成的,因此共价晶体具有很高的熔点和硬度。
共价晶体的晶格结构复杂多样,具有很高的化学稳定性。
典型的共价晶体包括金刚石(C)和硅(Si)。
共价晶体通常是绝缘体或半导体,由于共价键的稳定性,其导电性较弱。
3. 金属晶体金属晶体由金属原子通过金属键结合而成。
金属键是由金属原子间的电子云形成的,因此金属晶体具有良好的导电性和热传导性。
金属晶体的晶格结构常为紧密堆积或面心立方等紧密排列。
金属晶体的熔点通常较低,而且具有良好的延展性和韧性。
典型的金属晶体有铁(Fe)、铜(Cu)等。
4. 分子晶体分子晶体由分子通过弱相互作用力(如范德华力)结合而成。
分子晶体的晶格结构不规则,分子间的距离和角度较大。
由于分子间的相互作用力较弱,分子晶体通常具有较低的熔点和软硬度。
典型的分子晶体有水(H2O)、冰、石英(SiO2)等。
分子晶体在固态下通常是绝缘体,但某些分子晶体在溶液中能够导电。
总结起来,离子晶体由正负离子通过离子键结合,具有高熔点和脆性;共价晶体由共价键连接,具有高熔点和硬度;金属晶体由金属原子通过金属键结合,具有良好的导电性和热传导性;分子晶体由分子通过弱相互作用力结合,具有较低的熔点和软硬度。
这四种基本类型的晶体在结构、性质和应用上都有明显的差异。
研究晶体的类型和特点对于理解物质的性质和应用具有重要意义。
21、四种晶体比较表
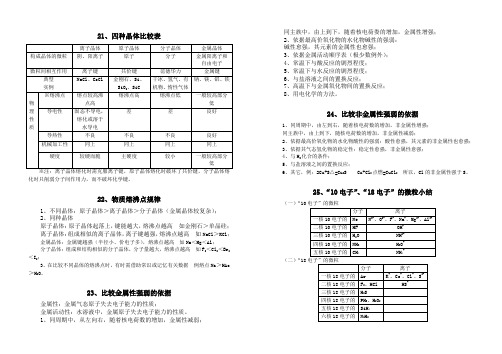
21、四种晶体比较表※注:离子晶体熔化时需克服离子键,原子晶体熔化时破坏了共价键,分子晶体熔化时只削弱分子间作用力,而不破坏化学键。
22、物质熔沸点规律1、不同晶体:原子晶体>离子晶体>分子晶体(金属晶体较复杂);2、同种晶体原子晶体:原子晶体起落上,键能越大,熔沸点越高如金刚石>单晶硅;离子晶体:组成相似的离子晶体,离子键越强,熔沸点越高如NaCl>KCl;金属晶体:金属键越强(半径小、价电子多),熔沸点越高如Na<Mg<Al;分子晶体:组成和结构相似的分子晶体,分子量越大,熔沸点越高如F2<Cl2<Br2<I2;3、在比较不同晶体的熔沸点时,有时需借助常识或记忆有关数据例熔点Na>HAc >H2O。
23、比较金属性强弱的依据金属性:金属气态原子失去电子能力的性质;金属活动性:水溶液中,金属原子失去电子能力的性质。
1、同周期中,从左向右,随着核电荷数的增加,金属性减弱;同主族中,由上到下,随着核电荷娄的增加,金属性增强;2、依据最高价氧化物的水化物碱性的强弱:碱性愈强,其元素的金属性也愈强;3、依据金属活动顺序表(极少数例外);4、常温下与酸反应的剧烈程度;5、常温下与水反应的剧烈程度;6、与盐溶液之间的置换反应;7、高温下与金属氧化物间的置换反应;8、用电化学的方法。
24、比较非金属性强弱的依据1、同周期中,由左到右,随着核电荷数的增加,非金属性增强;同主族中,由上到下,随核电荷数的增加,非金属性减弱;2、依据最高价氧化物的水化物酸性的强弱:酸性愈强,其元素的非金属性也愈强;3、依据其气态氢化物的稳定性:稳定性愈强,非金属性愈强;4、与H2化合的条件;5、与盐溶液之间的置换反应;6、其它,例:2Cu+S△=Cu2S Cu+Cl2点燃=CuCl2所以,Cl的非金属性强于S。
25、“10电子”、“18电子”的微粒小结(一)“10(二)“18。
四种晶体类型的比较之欧阳地创编

四种晶体类型的比较物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下:1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。
例如:NaBr (固)>Br2>HBr(气)。
2、不同类型晶体的比较规律一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。
这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。
原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。
例如:金刚石>食盐>干冰3、同种类型晶体的比较规律A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。
如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C<C—Si< Si—Si,所以熔沸点高低为:金刚石>碳化硅>晶体硅。
B、离子晶体:熔、沸点的高低,取决于离子键的强弱。
一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高,反之越低。
例如:MgO>CaO,NaF>NaCl>NaBr>NaI。
KF>KCl>KBr >KI,CaO>KCl。
C、金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。
如:Na<Mg<Al,Li>Na>K。
合金的熔沸点一般说比它各组份纯金属的熔沸点低。
如铝硅合金<纯铝(或纯硅)。
D、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。
分子晶体分子间作用力越大物质的熔沸点越高,反之越低。
(具有氢键的分子晶体,熔沸点反常地高)如:H2O>H2Te>H2Se>H2S,C2H5OH>CH3—O—CH3。
《四大晶体的比较》课件

05
非晶体
非晶体的定义
非晶体是指原子或分子的排列不呈长程有序性的固体材料。
非晶体没有固定的熔点,其物理性质和化学性质与晶体不同。
非晶体的性质
01 非晶体具有各向同性,即不同方向的物理性质相 同。
02 非晶体通常具有较高的硬度和耐磨性,但韧性较 差。
03 非晶体的导热性、导电性和光学性能与晶体不同 ,具体性质取决于具体的非晶体材料。
四大晶体的比较
目录
• 晶体简介 • 单晶体 • 多晶体 • 玻璃晶体 • 非晶体 • 比较总结
01
晶体简介
晶体的定义
晶体是由原子、分子或离子按照一定 的规律排列而成的固体,具有长程有 序的内部结构。
晶体内部原子、分子或离子的排列方 式称为晶体结构,其决定了晶体的物 理和化学性质。
晶体的分类
金属晶体
03
多晶体
多晶体的定义
定义
多晶体是由许多单晶体杂乱无章地组合在一起形成的晶体。
与单晶体的区别
单晶体具有规则的几何形状和内部结构,而多晶体则没有规则的 形状和内部结构。
形成方式
多晶体通常是通过冷却或结晶过程形成的,而单晶体则是在特定 条件下通过生长形成的。
多晶体的性质
01
物理性质
多晶体的物理性质,如硬度、热 导率、热膨胀系数等,通常介于 单晶体和玻璃之间。
玻璃晶体的性质
玻璃晶体的硬度较高,耐磨、耐腐蚀,化学稳定 性较好。
玻璃晶体通常是无色透明的,也有一些因含有杂 质而呈现不同颜色。
玻璃晶体的熔点较高,不易燃烧,热膨胀系数较 小。
玻璃晶体的应用
01
玻璃晶体在建筑行业中广泛应用,如窗户、玻璃幕 墙等。
02
玻璃晶体也用于制造光学仪器、眼镜等。
四种常见晶体

主讲 汪毅
一、四种晶体类型对比
晶体类型 离子晶体 晶体粒子 阴、阳离子
粒子间作 离子键 用力
原子晶体 分子晶体 金属晶体
原子
分子
金属阳离子、自 由电子
共价键 分子间作 金属键 用力
熔沸点 硬度
较高 较硬
很高 很硬
较低
一般较高,少部
一般较软 分低 ,一般较硬 少部分软
溶解性
易溶于水,难 难溶解 相似相溶 难溶 溶于有机溶剂
存在共价键 B.分子中含两个氢原子的酸一定是二元酸 C.含有金属离子的晶体一定是离子晶体 D.元素的非金属型越强,其单质的活泼性一定
越强
晶体熔沸点高低的判断方法 1、不同晶体类型的熔沸点比较
一般:原子晶体>离子晶体>分子晶体(有例外)
金刚石熔点3350℃ 碳化硅熔点2600℃ 氧化镁熔点2852℃ 二氧化硅熔点1723℃ 氧化铝熔点2050℃ 氯化铝熔点190℃
氯化钠熔点801℃ 氯化镁熔点714℃
离子晶体的晶格能的大小
不能简单用
离子间的库仑力
衡量
晶体熔沸点高低的判断方法
2、同种晶体类型物质的熔沸点比较
组成和结构相似
①离子晶体:再次强调组成和结构相似 阴、阳离子电荷数越大,半径越小
②原子晶体: 原子半径越小→键长越短→键能越大
熔沸点越高 熔沸点越高
③分子晶体: 分子的极性、氢键的因素和支链的多少等
组成,键角是 60o ,共含有 30 个 B—B键。
四、典型的离子晶体举例
<一>NaCl
1、照本宣科可不行喽
有一种由钛原子和碳原 子构成的气态团簇分子, 如右图所示,顶角和面 心的原子是钛原子,棱 的中心和体心的原子是 碳原子,它的化学式是 _T_i1_4_C_1_3 。
3.5四类典型晶体的比较 课件高中化学人教版(2019)选择性必修2

微专题5
四类典型晶体的比较
化学
讲解内容
1.四类典型晶体的比较
类型
离子
项目
晶体
阴、阳
构成晶体的粒子
离子
共价晶体
分子晶体
金属晶体
原子
分子
金属阳离子和自由电
子
离子键
共价键
分子间作用力
(范德华力、氢键)
金属键
离子电
确定作用力强弱
荷数、
的一般判断方法
半径
键长(原
子半径)
组成结构相似时,比
离子半径、价电子数
沸点:SnH4>GeH4>SiH4>CH4。
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、
沸点越高。如熔、沸点:CO>N2,CH3OH>CH3CH3。
④金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
如熔、沸点:Na<Mg<Al。
化学
[典型例题]按要求完成以下题目:
(1)(2021·湖南卷)基态硅原子最外层的电子排布图为
晶体硅和碳化硅熔点较高的是
,
(填化学式)。
2
2
解析:(1)硅元素的原子序数为 14,最外层电子排布式为 3s 3p ,则最外层电子排布
图为
;共价晶体的熔点取决于共价键的强弱,晶体硅和碳化硅都是共价
晶体,碳原子的原子半径小于硅原子,键长:Si—C<Si—Si,键能:Si—C>Si—Si,则
不良
不良
不良
优良
差
差
差
优良
化学
2.晶体熔、沸点高低的比较方法
晶体的类型与性质知识总结

晶体的类型与性质知识规律总结晶体类型离子晶体分子晶体原子晶体金属晶体定义离子间通过离子键相结合而成的晶体分子间以分子间作用力相结合的晶体相邻原子间以共价键相结合而形成的空间网状结构的晶体金属阳离子和自由电子之间的较强作用形成的单质晶体构成粒子阴、阳离子分子原子金属离子、自由电子粒子间作用力离子间肯定有离子键,可能有原子间的共价键分子间:分子间作用力。
可能有分子内共价键(稀有气体例外)共价键金属离子和自由电子之间较强的相互作用代表物NaCl,NaOH,MgSO4干冰,I2,P4,H2O 金刚石,SiC,晶体硅,SiO2镁、铁、金、钠熔、沸点熔点、沸点较高熔点、沸点低熔点、沸点高熔点、沸点差异较大(金属晶体熔沸点一般较高,少部分低)导热性不良不良不良良好导电性固态不导电,熔化或溶于水导电固态和液态不导电,溶于水可能导电不导电。
有的能导电,如晶体硅,但金刚石不导电。
晶体、熔化时都导电硬度硬度较大硬度很小硬度很大硬度差异较大溶解性多数易溶于水等极性溶剂相似相溶难溶解难溶于水(钠、钙等与水反应)决定熔点、沸点高主要因素离子键强弱分子间作用力大小共价键强弱金属键强弱二、几种典型的晶体结构①、NaCl晶体1)在NaCl晶体的每个晶胞中,Na+占据的位置有 2 种。
顶点8个,面心6个2)Cl-占据的位置有 2 种。
棱上12个,体心1个3)在NaCl晶体中,每个Na+周围与之等距离且最近的Na+有 12个;每个Cl-周围与之等距离且最近的Cl-有 12 个。
4)在NaCl晶体中每个Na+同时吸引着6个Cl-,每个Cl-同时也吸引着 6个Na+,向空间延伸,形成NaCl晶体。
5)每个晶胞平均占有 4 个Na+和 4 个Cl-。
1molNaCl能构成这样的晶胞个。
6) Na+与其等距紧邻的6个Cl-围成的空间构型为_____正八面体_________②、CsCl晶体1)每个Cs+同时吸引着8 个Cl-,每个Cl-同时吸引着8 个Cs+;2)在CsCl晶体中,每个Cs+周围与它等距离且最近的Cs+有6个,每个Cl-周围与它等距离且最近的Cl-有 6 个;3)一个CsCl晶胞有 1 个Cs+和 1 个Cl-组成;4)在CsCl晶体中,Cs+与Cl-的个数比为1:1 。
晶体的类型与性质知识总结
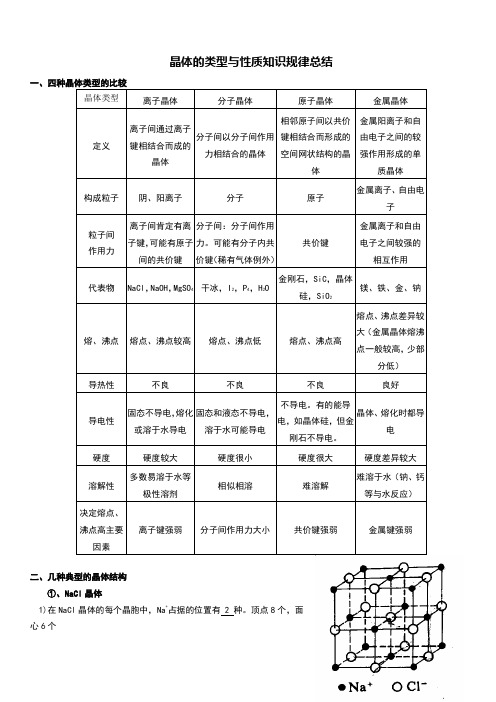
晶体的类型与性质知识规律总结晶体类型离子晶体分子晶体原子晶体金属晶体定义离子间通过离子键相结合而成的晶体分子间以分子间作用力相结合的晶体相邻原子间以共价键相结合而形成的空间网状结构的晶体金属阳离子和自由电子之间的较强作用形成的单质晶体构成粒子阴、阳离子分子原子金属离子、自由电子粒子间作用力离子间肯定有离子键,可能有原子间的共价键分子间:分子间作用力。
可能有分子内共价键(稀有气体例外)共价键金属离子和自由电子之间较强的相互作用代表物NaCl,NaOH,MgSO4干冰,I2,P4,H2O 金刚石,SiC,晶体硅,SiO2镁、铁、金、钠熔、沸点熔点、沸点较高熔点、沸点低熔点、沸点高熔点、沸点差异较大(金属晶体熔沸点一般较高,少部分低)导热性不良不良不良良好导电性固态不导电,熔化或溶于水导电固态和液态不导电,溶于水可能导电不导电。
有的能导电,如晶体硅,但金刚石不导电。
晶体、熔化时都导电硬度硬度较大硬度很小硬度很大硬度差异较大溶解性多数易溶于水等极性溶剂相似相溶难溶解难溶于水(钠、钙等与水反应)决定熔点、沸点高主要因素离子键强弱分子间作用力大小共价键强弱金属键强弱二、几种典型的晶体结构①、NaCl晶体1)在NaCl晶体的每个晶胞中,Na+占据的位置有 2 种。
顶点8个,面心6个2)Cl-占据的位置有 2 种。
棱上12个,体心1个3)在NaCl晶体中,每个Na+周围与之等距离且最近的Na+有 12 个;每个Cl-周围与之等距离且最近的Cl-有12 个。
4)在NaCl晶体中每个Na+同时吸引着6个Cl-,每个Cl-同时也吸引着 6个Na+,向空间延伸,形成NaCl晶体。
5)每个晶胞平均占有 4 个Na+和 4 个Cl-。
1molNaCl能构成这样的晶胞个。
6) Na+与其等距紧邻的6个Cl-围成的空间构型为_____正八面体_________②、CsCl晶体1)每个Cs+同时吸引着 8 个Cl-,每个Cl-同时吸引着 8 个Cs+;2)在CsCl晶体中,每个Cs+周围与它等距离且最近的Cs+有6个,每个Cl-周围与它等距离且最近的Cl-有 6 个;3)一个CsCl晶胞有 1 个Cs+和 1 个Cl-组成;4)在CsCl晶体中,Cs+与Cl-的个数比为 1:1 。
四种晶体类型的比较之欧阳语创编
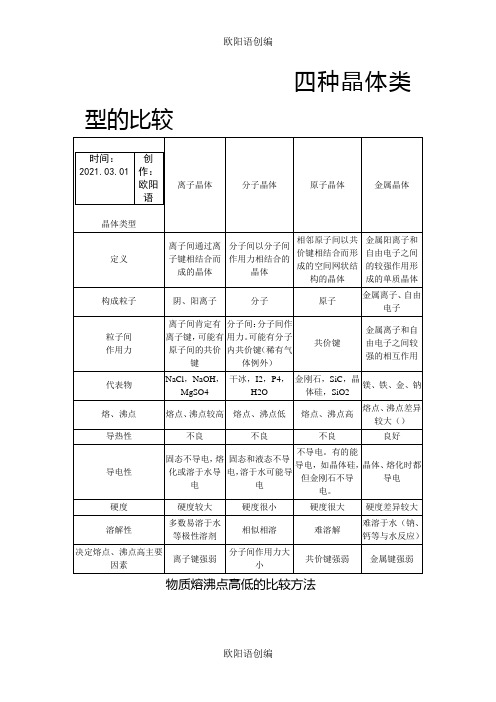
四种晶体类型的比较物质熔沸点高低的比较方法物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下:1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。
例如:NaBr(固)>Br2>HBr (气)。
2、不同类型晶体的比较规律一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。
这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。
原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。
例如:金刚石>食盐>干冰3、同种类型晶体的比较规律A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。
如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C<C—Si< Si—Si,所以熔沸点高低为:金刚石>碳化硅>晶体硅。
B、离子晶体:熔、沸点的高低,取决于离子键的强弱。
一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高,反之越低。
例如:MgO>CaO,NaF>NaCl>NaBr>NaI。
KF>KCl >KBr>KI,CaO>KCl。
C、金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。
如:Na<Mg<Al,Li>Na>K。
合金的熔沸点一般说比它各组份纯金属的熔沸点低。
如铝硅合金<纯铝(或纯硅)。
D、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。
分子晶体分子间作用力越大物质的熔沸点越高,反之越低。
四种晶体比较
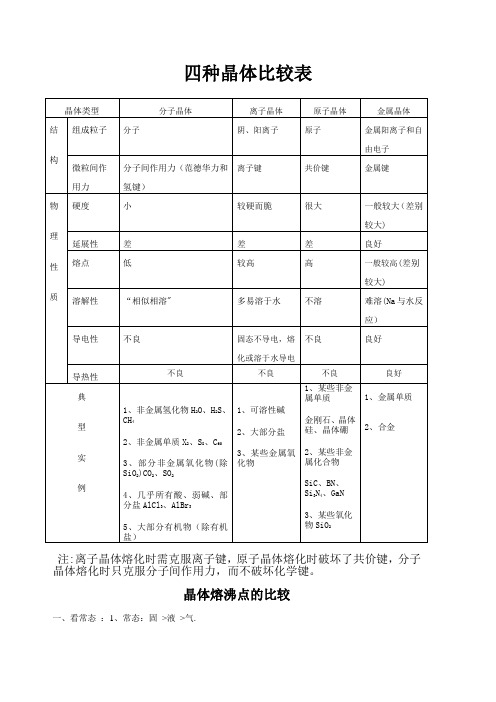
四种晶体比较表注:离子晶体熔化时需克服离子键,原子晶体熔化时破坏了共价键,分子晶体熔化时只克服分子间作用力,而不破坏化学键。
晶体熔沸点的比较一、看常态:1、常态:固>液>气.2、一般情况下,原子晶体〉离子晶体(金属晶体)〉分子晶体。
3、原子晶体:共价键(取决于原子半径).4、离子晶体:离子键(取决于离子半径和离子电荷)5、金属晶体:金属键(取决于金属原子半径和价电子数)6、分子晶体:①结构相似,分子量越大, 熔沸点越高。
②分子量相等,正>异〉新。
③氢键反常二、看类型三、分类比较18.请完成下列各题:(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有种。
(2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为。
在GaN晶体中,每个Ga 原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为。
在四大晶体类型中,GaN属于晶体.(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是(填化学式)。
19.生物质能是一种洁净、可再生的能源。
生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。
写出基态Zn原子的核外电子排布式。
(2)根据等电子原理,写出CO分子结构式。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子中碳原子轨道的杂化类型为。
②甲醛分子的空间构型是;1mol甲醛分子中σ键的数目为。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为.。
晶体的四种基本类型和特点

晶体的四种基本类型和特点
晶体是一种有序的固体结构,其分为四种基本类型:离子晶体、共价晶体、分子晶体和金属晶体。
每种晶体类型都有其独特的结构和特点。
离子晶体是由正负离子通过电子静电力相互吸引而形成的晶体。
其具有高熔点、高硬度和脆性等特点。
常见的离子晶体包括氯化钠、硫酸钠等。
共价晶体是由共价键相互连接而形成的晶体。
其具有高熔点、高硬度和脆性等特点。
常见的共价晶体包括金刚石、石英等。
分子晶体是由分子通过范德华力相互吸引而形成的晶体。
其具有较低的熔点、硬度和脆性较小等特点。
常见的分子晶体包括葡萄糖、萘等。
金属晶体是由金属离子通过金属键相互连接而形成的晶体。
其具有高导电性、高热传导性和良好的延展性等特点。
常见的金属晶体包括铜、银等。
总之,不同类型的晶体具有不同的结构和特点,这些特点也决定了它们在实际应用中的不同用途和作用。
- 1 -。
四大晶体的比较

①铯离子和氯离子的位置: Cs+:体心 Cl-:顶点;或反之。 ②每个晶胞含Cs+、Cl-个数: 1 ③与Cs+等距离且最近的Cs+、ClCs+:6个;Cl-:8个(配位数)
(3)CaF2型晶胞
①一个CaF2晶胞中 4个Ca2+和8个F¯
②Ca2+的配位数: 8 F-的配位数: 4
(4)ZnS型晶胞
(2)较小的硬度 分子间作用力较弱
(3)一般是绝缘体,熔融态也不导电。(有些在水溶液中可以导电)
知识2、分子的堆积 1、干冰的晶体结构
(与CO2分子距离最近的CO2分子共有12个 )
碘晶体结构
氧(O2)的晶体结构
碳60的晶胞
2、冰的晶体结构
氢键具有方向性
冰中1个水分子周围有4个水分子
冰的结构
3、分子晶体结构特征: (1) 密堆积 只范德华力,无氢键。晶体每分子周围一般12个紧邻分子
均位于顶角,并交错排列
①Na+和Cl-的位置: 钠离子:体心 棱中点
氯离子:面心 顶点,或反之。
②每个晶胞含钠离子、氯离子的个数:
Na+:
Cl-:
③与Na+等距离且最近的Na+ 有: 12个
④ NaCl的晶体结构配位数
与Na+等距离且最近的Cl¯ 有:6个
---Cl--- Na+
CsCl晶体 ---Cs+ ---Cl-
, (2) 非密堆积如:C60、干冰 、I2、O2。
有分子间氢键——氢键具有方向性,使晶体中的空间利率不高,留 有相当大的空隙。这种晶体不具有分子密堆积特征。 如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)
四类晶体的结构和性质的比较
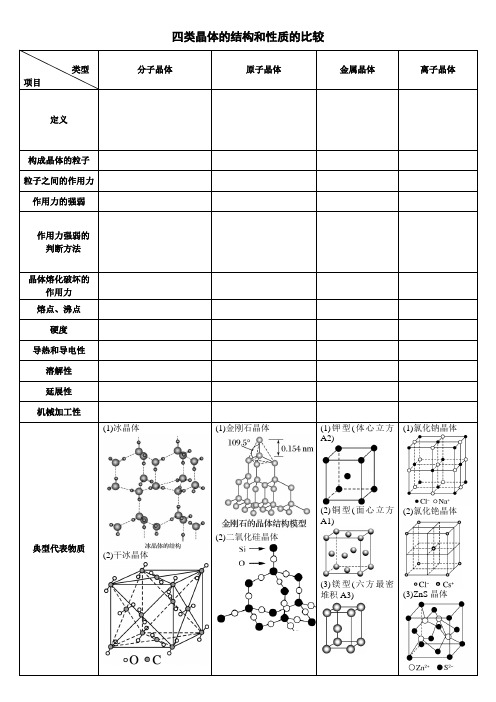
四类晶体的结构和性质的比较
类型
项目
分子晶体原子晶体金属晶体离子晶体定义
构成晶体的粒子
粒子之间的作用力
作用力的强弱
作用力强弱的
判断方法
晶体熔化破坏的
作用力
熔点、沸点
硬度
导热和导电性
溶解性
延展性
机械加工性
典型代表物质(1)冰晶体
(2)干冰晶体
(1)金刚石晶体
(2)二氧化硅晶体
(1)钾型(体心立方
A2)
(2)铜型(面心立方
A1)
(3)镁型(六方最密
堆积A3)
(1)氯化钠晶体
(2)氯化铯晶体
(3)ZnS晶体
(1)金刚石晶体:
①金刚石晶体属于 晶体,其熔点 ,硬度 。
②金刚石晶体中每个碳原子与 个碳原子以 结合,形成 结构, 与碳原子最近的碳原子有 个。
③金刚石晶体中C -C 之间的键角均为 。
④最小碳环由 个碳组成,这些碳原子 同一平面内,最小的环内处于同一平面的碳原子最多有 个。
⑤每个碳原子参与 条C -C 键的形成,碳原子与C -C 键之比为 。
⑥
(2)二氧化硅晶体:
①每个硅原子与4个氧原子以共价键结合,形成正四面体结构。
②每个正四面体占有1个Si ,4个“
2
1
氧”,n (Si):n (O)=1:2。
③最小环上有12个原子,即:6个氧原子和6个硅原子。
四种晶体类型的比较完整版

四种晶体类型的⽐较完整版四种晶体类型的⽐较 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】四种晶体类型的⽐较物质熔沸点⾼低的⽐较⽅法物质的熔沸点的⾼低与构成该物质的晶体类型及晶体内部粒⼦间的作⽤⼒有关,其规律如下:1、在相同条件下,不同状态的物质的熔、沸点的⾼低是不同的,⼀般有:固体>>HBr(⽓)。
液体>⽓体。
例如:NaBr(固)>Br22、不同类型晶体的⽐较规律⼀般来说,不同类型晶体的熔沸点的⾼低顺序为:原⼦晶体>离⼦晶体>分⼦晶体,⽽⾦属晶体的熔沸点有⾼有低。
这是由于不同类型晶体的微粒间作⽤不同,其熔、沸点也不相同。
原⼦晶体间靠共价键结合,⼀般熔、沸点最⾼;离⼦晶体阴、阳离⼦间靠离⼦键结合,⼀般熔、沸点较⾼;分⼦晶体分⼦间靠范德华⼒结合,⼀般熔、沸点较低;⾦属晶体中⾦属键的键能有⼤有⼩,因⽽⾦属晶体熔、沸点有⾼(如W)有低(如Hg)。
例如:⾦刚⽯>⾷盐>⼲冰3、同种类型晶体的⽐较规律A、原⼦晶体:熔、沸点的⾼低,取决于共价键的键长和键能,键长越短,键能越⼤共价键越稳定,物质熔沸点越⾼,反之越低。
如:晶体硅、⾦刚⽯和碳化硅三种晶体中,因键长C—C碳化硅>晶体硅。
B、离⼦晶体:熔、沸点的⾼低,取决于离⼦键的强弱。
⼀般来说,离⼦半径越⼩,离⼦所带电荷越多,离⼦键就越强,熔、沸点就越⾼,反之越低。
例如:MgO>CaO,NaF>NaCl>NaBr>NaI。
KF>KCl>KBr>KI,CaO>KCl。
C、⾦属晶体:⾦属晶体中⾦属阳离⼦所带电荷越多,半径越⼩,⾦属阳离⼦与⾃由电⼦静电作⽤越强,⾦属键越强,熔沸点越⾼,反之越低。
如:Na<Mg <Al,Li>Na>K。
合⾦的熔沸点⼀般说⽐它各组份纯⾦属的熔沸点低。
如铝硅合⾦<纯铝(或纯硅)。
D、分⼦晶体:熔、沸点的⾼低,取决于分⼦间作⽤⼒的⼤⼩。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四种晶体类型的比较 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
四种晶体类型的比较
物质熔沸点高低的比较方法
物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下:
1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>
>HBr(气)。
液体>气体。
例如:NaBr(固)>Br
2
2、不同类型晶体的比较规律
一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。
这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。
原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一
般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。
例如:金刚石>食盐>干冰
3、同种类型晶体的比较规律
A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。
如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C<C—Si<?Si—Si,所以熔沸点高低为:金刚石>碳化硅>晶体硅。
B、离子晶体:熔、沸点的高低,取决于离子键的强弱。
一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高,反之越低。
例如:MgO>CaO,NaF>NaCl>NaBr>NaI。
KF>KCl>KBr>KI,CaO>KCl。
C、金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。
如:Na<Mg <Al,Li>Na>K。
合金的熔沸点一般说比它各组份纯金属的熔沸点低。
如铝硅合金<纯铝(或纯硅)。
D、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。
分子晶体分子间作用力越大物质的熔沸点越高,反之越低。
(具有氢键的分子晶体,熔沸点反常地高)
如:H
2O>H
2
Te>H
2
Se>H
2
S,C
2
H
5
OH>CH
3
—O—CH
3。
(1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越
强,物质的熔沸点越高。
如:CH
4<SiH
4
<GeH
4
<SnH
4。
(2)组成和结构不相似的物质(相对分子质量相近),分子极性越大,
其熔沸点就越高。
如熔沸点 CO>N
2,CH
3
OH>CH
3
—CH
3。
(3)在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。
如:C
17H
35
COOH>C
17
H
33
COOH;硬脂酸>油酸
(4)烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增
加,熔沸点升高,如C
2H
6
>CH
4
, C
2
H
5
Cl>CH
3
Cl,CH
3
COOH>
HCOOH。
(5)同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降
低。
如:CH
3(CH
2
)
3
CH
3
(正)>CH
3
CH
2
CH(CH
3
)
2
(异)>(CH
3
)
4
C(新)。
芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低沸点按邻、间、对位降低)
针对性训练
一、选择题
1.下列性质中,可以证明某化合物内一定存在离子键的是()
(A)溶于水(B)有较高的熔点(C)水溶液能导电(D)熔融状态能导电
2.下列物质中,含有极性键的离子化合是()
(A)CaCl
2(B)Na
2
O
2
(C)NaOH (D)K
2
S
3.Cs是IA族元素,F是VIIA族元素,估计Cs和F形成的化合物可能
是( )
(A )离子化合物 (B )化学式为CsF 2 (C )室温为固体 (D )室温为气体
4.某物质的晶体中含A 、B 、C 三种元素,其排列方式如图所示(其中前后两面心上的B 原子未能画出),晶体中A 、B 、C 的中原子个数之比依次为( )
(A )1:3:1 (B )2:3:1 (C )2:2:1 (D )1:3:3
6.在NaCl 晶体中与每个Na +距离等同且最近的几个Cl -所围成的空间几何构型为( )
(A )正四面体 (B )正六面体 (C )正八面体 (D )正十二面体 7.如图是氯化铯晶体的晶胞(晶体中最小的重复单元),已知晶体中2个最近的Cs +离子核间距为a cm ,氯化铯的式量为M ,NA 为阿伏加德罗常数,则氯化铯晶体的密度为( )
(A )38a N m A ⨯g·cm -3 (B )A N Ma 83g·cm -3
(C )3a N M A ⨯g·cm -3 (D )A
N Ma 3g·cm -3。
