2006年化学竞赛夏令营分子结构
2006年全国高中学生化学竞赛理论试题参考答案

K
sp, Mg ( OH) 2 4 w
K K a2
3 a1
K sp, CaC O3 K
- 6 - 12
=
- 7 3 - 11
5. 50 # 10
10 - 4 # ( 0. 100 # 2) 2 # 5. 61 # 10- 11 = 0. 105 mol/ L 4. 96 # 10- 9 # 4. 30 # 10- 7 0. 105 p CO 2 % # 100= 306 kP a 故 CO2 压力 应控 制在 0. 0343 223 kPa % p C O2 % 306 kP a 4- 5. 轻质碳 酸镁的化学式 : 3M gCO3 M g ( OH ) 2 3H 2 O
O H OH
( 5) H 4 P 2 O6 + H 2 O
( 6) 2 P + 4 N aClO + 2 N aO H ( 7) 通过 H 型阳离子交换树脂 图 ( b) : 结构应含 10 个钨氧 八面 体 , 它们的 氧原 子通过 共顶共边排列成 1 ∃ 4 ∃ 9 ∃ 4 ∃ 9 ∃ 4 ∃ 1 的 层状结 构。共有 氧原子 1+ 4+ 9+ 4+ 9+ 4+ 1= 32 个。因 钨氧八 面体不足 12 个 , 图 ( b) 不会是仲钨酸根的 结构 , 而是十 钨酸根 W10 O432 的结构。
1 3 3
第1题
1- 1. A : N a2 WO 4 ; 4F eW O4 ( s) + 8N aOH ( l) + O2 ( g) + 2F e2 O 3 ( s) + 4H 2 O ( g ) 2M nWO 4 ( s) + 4N aOH ( l) + O2 ( g ) ! Na2 W O4 ( aq) + 2H Cl( aq) ( aq) ∀ H 2 W O4 ( s) WO 3 ( s) + H 2 O( g) 2W ( s) + 3CO2 ( g) 1- 2. [ 1] 2WO 3 ( s) + 3C( 石墨 ) 由能变化分别为 : H = S = # 5. 74] J G =
2006年浙江省高中学生化学竞赛试题(A组)(含答案)2006年浙江省高中学生化学竞赛试题(A组)(

2006年浙江省高中学生化学竞赛试题(A组)一.选择题(本题包括10小题,每小题4分,共40分。
每小题只有一个选项符合题意,) 1.我国科学家为一个比头发丝还细的小分子恢复了磁性,由此创造了一项“世界第一”。
实验时将一种名为“钴酞菁”的小分子搬上了“手术台”。
这个“个头”仅为1.3纳米的小分子,其结构和性质与人体内的血红素及植物体内的叶绿素非常相似,在光电子器件、生物技术等方面具有广泛而重要的应用与研究价值。
下列说法正确的是( )A.“钴酞菁”的小分子没有胶体的性质;B.纳米材料可以应用于所有化工领域;c.现在纳米器件都是无所不能的胶体D.此工作实现了利用局域的化学反应来改变和控制分子的物理陛质2.用即热饭盒盛装食物,可以得到热烘烘的饭菜。
原因是即热饭盒的底部装入了混有镁、铁粉末的高密度聚乙烯,进行简单的操作后水和镁就会发生剧烈的化学反应,放出热量便可使食物变热,其中铁可能是()A.一种反应物B.催化剂;C.起导热作用;D.增大镁与水分子的接触机会。
3.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )4.“拟晶”(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质。
A165Cu23Fe l2是二十世纪发现的几百种拟晶之一,具有合金的某些优良物理性能。
有关这种拟晶的说法错误的是( )A.A165Cu23Fe l2的硬度比金属A1、Cu、Fe都大B.A165Cu23Fe l2中三种金属的化合价均可视作零;C.A165Cu23Fe l2不可用作长期浸泡在海水中的材料D.1mol A165Cu23Fe l2溶于过量的硝酸时共失去265 mol电子5.主链为4个碳原子的某烷烃有2种同分异构体。
则与这种烷烃具有相同的碳原子数、主链上也为4个碳原子的单烯烃,共有异构体( )A.3种B.4种c.5种D.2种6.酸碱指示剂(HIn)在水溶液中存在以下电离平衡:HIn(红色)H’+In-(黄色)。
2006年化学竞赛夏令营_分子结构ppt课件

• 结构 — 颗粒物质的几何结构,以及在此结构 下物质所具有的能量。
• 化学在以下两个层次上讨论物质结构 1)原子如何组成各种分子 2)分子如何聚集形成各种形态的物质
;.
3
分子结构
分子的组成 化学键 空间构型 分子间力
;.
4
第一节 分子结构的基础知识
本节主要讨论分子中直接相邻的原子间的强相互作用力,即化学键问题和分子 的空间构型(即几何形状)问题。
;.
17
1931年美国化学家鲍林和斯莱特将其处理H2分子的方法推广应用 于其他分子系统而发展成为价键理论(valence bond theory),简称VB 法或电子配对法。
;.
18
鲍林 Linus Pouling
美国化学家。1901年2月28日出生于一个 药剂师家中。自幼对父亲在药房配药发 生兴趣。在中学时代他就喜欢做化学实 验。由于化学成绩优秀,老师破格让他 做高一级的化学实验并参加老师的研究 工作。1922年毕业于俄勒冈州立大学化 工系,加州理工学院攻读化学。1925年 获博士位,曾到欧洲各国作访问学者。 1927年回到加州大学理工学院,1931 年升任教授。1969年任斯坦福大学化学 教授一职直到退休。1974年任该校荣誉 教授。
;.
14
量子力学从理论上解释了共价键形成原因:
当核外电子自旋平行的两个氢原子靠近时,两核 间电子云密度小,系统能量E 始终高于两个孤立氢 原子的能量之和Ea+Eb,称为推斥态,不能形成H2 分子。
若电子自旋反平行的两个氢原子靠近时,两核间 的电子云密度大,系统的能量E 逐渐降低,并低于 两个孤立氢原子的能量之和,称为吸引态。 当两个氢原子的核间距L = 74 pm时,其能量达到 最低点,Es = 436 kJmol1,两个氢原子之间形 成了稳定的共价键,形成了氢分子。
2006年江苏化学竞赛夏令营课件

H3C
H2C C
H
H3C
H
CH2 H2C
顺式
H3C H2C
CH2
H
反式
全顺:天然橡胶 全 反: 杜仲胶
H2 H2 CC
n
H2 H CC
n
H2 H CC
CH3 n
CH3 H2 CC
COOnCH3
H2 H CC
Cl n
H2 H CC
CN n
等规 间规 无规
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
缩聚反应
具有两个以上活性功能团的低分 子物质通过分子间的缩合反应,形成 高分子化合物的反应
酚醛树脂
OH + HCHO
OH CH2OH
OH
CH2OH +
HCHO
OH H2 C
OH + H2O
OH
3
+ 2 CH2O
OH H2 C
OH H2 C
OH
尼龙6
H2N
(CH2)5C OH O
H2N (CH2)5C OH O
线形高分子
环状高分子
支化高分子
梳形高分子
星形高分子
梯形高分子
网状高分子
体型高分子
应用举例
硬化橡胶( 20-30%硫)
酚醛塑料(Bakelite) PVC
应用
Teflon
聚苯乙烯(Polystyrene)
尼龙66
Ian Thorpe
Australian Matt Walsh surfaces for air during the launch of the Speedo Fastskin FSll swimsuit in Sydney, Australia in March. The suit is claimed to reduce drag by up
2006年全国高中生化学竞赛(省级赛区)试题例析与思考

中的部分试题展开了分析,并且对今后同一级别化学竞赛的辅导提出了几点思考。
关键词:化学竞赛特点思考跟往年的试题相比,2006年的试题在试卷长度、题目类型上基本稳定,在内容覆盖上主要涉及到原子结构、分子结构、晶体结构、配合物知识等理论和常见的元素化合物知识,在知识点上仍然注重基础知识考查,当然涉及的知识水平是高于高中化学,大致与大学底年级课本相当,在能力上强调学生获取信息、加工信息、从化学视角去分析解决实际问题等能力的考查。
但是,今年试题也稳中有变,第一次出现开放性的有机物合成题、突出了化学平衡常数的计算、要求学生具备一定的英语基础,在题意表达上多处出现用英语或代号等。
今年的试题对今后高中生化学竞赛(省级赛区)的辅导有很强的指导意义。
1 例析06年试题的特点1.1 继承了传统题型跟往年的全国高中生化学竞赛(省级赛区)试题一样,今年的试题仍有许多常规题型,体现“思维容量大,应答书写少”的命题意图。
1.1.1 科学谜语题这类题与我们平时的“猜谜”有相似之处,但又有不同。
平时“猜谜”得出的谜底是猜谜人已有的知识,一旦被猜出,感觉就很自信;而科学谜语题的谜底,却是大多数学生未知的知识,所以,即便得出了结果,也会觉得是难以把握。
当然,也不排除有学生已经有了该知识,但绝不是一般的高中学生能够具备的知识,只有学习主动、肯钻研的学生才有可能具备。
由于得出的结论是新的知识,所以对学生创造性思维的要求特别高。
例1(第6 题)潜在储氢材料——化合物A 是第二周期两种氢化物形成的路易斯酸碱对,是乙烷的等电子体,相对分子质量30.87,常温下为白色晶体,稳定而无毒。
刚刚融化的A 缓慢释放氢气,转变为化合物B(乙烯的等电子体)。
B 不稳定,易聚合成聚合物C(聚乙烯的等电子体)。
C 在155℃释放氢气转变为聚乙炔的等电子体,其中聚合度为3的化合物D 是苯的等电子体。
高于500℃时D 释放氢气,转变为化合物E,E 有多种晶型。
(1)写出A、B、C、D、E 的化学式。
高中化学竞赛专题考试—分子结构(含答案)

高中化学竞赛专题考试——分子结构1(路易斯结构式、共振式、VSPER 理论)1.008Zr Nb Mo T cRu Rh Pd Ag Cd In S n S b T e I Hf T a W Re OsIr Pt Au Hg T l Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl S i P Cl S K Ca S c T i V Cr Mn Fe Co Ni Cu Zn G a G e As S e BrRb Cs Fr S r Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt一. 选择题(每题只有一个正确选项,每题2分,共50分)1. 根据鲍林近似能级图,在多电子原子中,基态时,下列电子均处于一定的能级,其中占据能级最高轨道的电子是: ( )A 2,1,1,+1/2B 3,1,1,+1/2C 3,2,1,+1/2D 4,0,0,1/2 2. 下列离子的电子构型可以用[Ar]3d 6表示的是( )A Mn 2+B Fe 3+C Co 3+D Ni 2+3.下列离子半径变小的顺序正确的是( )A F ->Na +>Mg 2+Al 3+B Na +>Mg 2+>Al 3+>F -C Al 3+>Mg 2+>Na +>F -D F ->Al 3+>Mg 2+>Na +4. 下列元素的原子中,第一电离能最大的是 ( )A BeB BC CD N5. 下列物质中,含极性键的非极性分子是()A H2OB HClC SO3D NO26. 下列分子中,没有配位键的是()A COB (BeCl2)2C CH3OBF3D N2H47. NO3—合理的共振式总数为()A 1B 2C 3D 48.下列分子中,键级等于零的是()A.O2 B. F2 C. N2 D. Ne29.原子轨道沿两核连线以“肩并肩”方式进行重叠的是()A. б键B. 氢键C. π键D. 离子键10. 下列物种中,键长最短的是( )A O2B O2+C O2—D O22—11. 下列化合物中,极性最大的是()A CS2B H2OC SO3D SnCl412. 下列物种中,既是路易斯酸,也是路易斯碱的是()ACCl4 B SOCl2 C NH2— D Hg2+13. 估计下列分子中,键角最小的是()()A NH3B PH3C AsH3D SbH314.估计下列分子或离子中,键角最小的是()A NH3B NO3—C NF3D NCl315. 几何形状是平面三角形的离子是()A SO-23 B SnCl-3C CH-3D NO-316. 下列分子或离子为平面四方构型的是()A ICl4—B ClO4—C BrF4+D SF417. 下列分子或离子中,属于三角锥构型的是()A BCl3B H3O+C BrF3D CH+318. 下列化合物中,可能含有卤桥键的是()A SnCl4B BeCl2C CCl4D NCl319. IF5是共价化合物,但液态IF5是电的良导体,原因是IF5二聚后电离,得到各带一个单位正负电荷的阴阳离子,则在该液体中存在的阳离子的几何构型是()A 三角双锥B 四方锥C 平面四方D 变形四面体20 下列哪一个分子的空间构型为折线型()A N3—B I3—C SO32—D CO32—21.下列分子中,偶极矩不为零的是()A BeCl2B BF3C NF3D CH422. 下列分子或离子中,键角最大的是()A XeF2B NCl3C CO-23 D PCl+423 通过测定AB2型分子的偶极距,能够判断:()A分子的空间构型 B 两元素的电负性之差C A—B键的极性D A—B键的键长24. 下列分子中含有两个不同键长的是()A CO2B SO3C SF4D XeF425. 下列分子中,最不容易聚合的是()A N2O5B BeCl2C AlCl3D NO2二、填空题(共50分)26.(10分)指出下列分子中有几个σ键和π键数目。
2006年“南京工业大学·扬子石化杯”杯第20届全国高中学生化学竞赛夏令营暨选拔赛试题参考答案及评分标准

2006年“南京工业大学·扬子石化”杯第20届全国高中学生化学竞赛(江苏省赛区)夏令营选拔赛试题参考答案及评分标准说明:化学方程式反应物或产物错不得分,配平错扣一半分。
第1题(9分)1-1 第三周期第IA 族 (1分) 低 固 能 易 (每空0.5分,共2分) 1-2n Kr Ba n U 1091361425610235923++−→−+n Y I n U 1097391355310235924++−→−+ (各1分,共2分)1-3 ① SO 2+I 2+2H 2O110~120℃2HI+H 2SO 4 (1分)② 2H 2SO 4900℃2SO 2+O 2 +2H 2O (1分)③ 2HI450℃H 2I 2 (1分)SO 2、I 2 (1分,错任一个即0分)第2题(12分)2-1 Ca 10(OH)2(PO 4)6(s)+2F -=Ca 10F 2(PO 4)6(s)+2OH —(1分)K=c 2(OH -)/c 2(F -)=K sp [Ca 10(OH)2(PO 4)6]/K sp [Ca 10F 2(PO 4)6] =3.8×10-37/1.0×10-60=3.8×1023 (2分)此反应的平衡常数很大,说明羟基磷灰石转化为氟磷灰石的倾向很大,即氟磷灰石更稳定(1分)2-2 不可以。
蛋白质口服下去后在胃、肠里经胃蛋白酶和胰蛋白酶水解生成了氨基酸,不可能完整地以蛋白质(酶)的形式去分解脂肪(答出蛋白质水解变成氨基酸即可) (2分)2-3 (1) C1、C3 N 、C2、O (各1分,错1个扣0.5分,共3分) 43II 6 (各1分,共2分) (2)略 (1分)第3题(9分)3-1 6 (1分)B rO NON H 3N H 3N H 3N H 3C rN H 3N H 3O NO N H 3B rN H 3C r++(2分)3-2 d 2sp 3 (1分)3-3 3.9μ0 (2分) 3.9μ0 (1分) 3-4 不能 晶体场分裂能 △0=31850cm-1所对应的光的波长为λ=(1/31850)cm=3140×10-8=314nm ,即所吸收的光为紫外光或不吸收可见光。
化学竞赛 分子结构课件

七、分子轨道理论(MO法) 1932年前后,美国人Mulliken和德国人Hund提出了分子轨道 理论,分子轨道理论和现代价键理论构成了现代共价键理论。 氢分子离子H2+ 是可以存在的。 1、分子轨道理论的要点 (1)分子轨道是由分子中原子的原子轨道线性组合而成,简 称 LCAO。 组合形成的分子轨道数与组合前的原子轨道数相等。
对称性不匹配
·· x _
_
+
+
· _·
+
+
它们重叠的结果是:一半正正重叠部分使系统能量降低, 另一半正负重叠部分使能量升高,两者效果抵消。系统 的总能量没有发生变化,形成非键轨道。
b. 能量近似原则 c. 最大重叠原则
-
+
-
+
-
+
-
ψ是两个对称性匹配的原子轨道同号叠加而成。在两核间电子 概率密度增大,对两核产生强烈的吸引作用,其能量低于原子 轨道,对成键有利。——成键轨道 成键轨道用符号σ,π,δ 表示 ψ* 是两个对称性匹配的原子轨道异号叠加 (或同号相减)而成。 电子在两核间出现概率密度减小,能量升高,对分子的稳定不 利,对原子的键合会起反作用——反键轨道 节面 反键轨道用符号σ*,π*,δ*表示 3、分子轨道中电子的填充顺序也遵从原子轨道填充电子的三 原理 4、分子轨道理论中,用键级的大小来说明两个相邻原子间成 键的强度,BO 键级可为整数,也可为分数,只要键级大于零,就可得到不同 稳定程度的分子。 5、按分子轨道沿键轴在空间分布的特征,可分为σ轨道、π轨 道和δ轨道三种
1 c1 a c2 b
* 1
c1 a c2 b
(2)成键轨道、反键轨道和非键轨道。 分子轨道能量低于组合前原子轨道能量者称为成键轨道(ψ1 ) 原子轨道线性组合成分子轨道后,分子轨道中能量高于组合前 原子轨道能量者称为反键轨 道 (ψ 1 * )。 组合前后能量相等者称为非键轨道。 2、有效组成分子轨道的条件 a.对称性匹配 只有对称性相同的原子轨道才能组成分子轨道。 此条件是指原子轨道ψa和ψb相对于成键原子间的键轴应有相 同的对称性。 原子轨道相互叠加组合成分子轨道时象波的叠加一样,须考虑 位相的正负号;原子轨道重叠的部分必须有相同的符号。 上述三种情况满足对称性匹配要求。 如果原子轨道在组成分子轨道时,一部分是(+,+ )重叠,另一部 分却是 ( +, -)重叠。
2006年全国化学竞赛初赛模拟试卷(05)

2006年全国化学竞赛初赛模拟试卷(05)(时间:3小时满分:100分)第一题(4分)水是生命之源。
水主要是通过渗透的方式送到身体的各个部分,那么给水分子增加点活力不是更好吗?现在出现了各种活力水,比如用电的,磁的等各种方法,来把水分子团打碎,这就是所谓的小分子团水。
据说这样的水渗透压增大了,有利于健康,还可以治病。
运用你的化学知识,判断上面说法的合理性。
第二题(5分)1.试用分子轨道理论来解释He2分子是不稳定的。
2.在光谱分析中检测到He这种惰性气体存在弱键合的二聚物,试解释其原因。
第三题(8分)工业上以废铜为原料经氯化生产氯化亚铜,其反应如下:Cu+Cl2+2Cl-→2CuCl↓;Cu2++Cu+2Na++2Cl-→2Na[CuCl2];Na[CuCl2]→CuCl↓+NaCl 在操作中为了保证质量,必须按一定规范程序进行操作。
请回答下列问题:1.制备中当氯化完成后须经中间步骤(即生成配合物Na[CuCl2]),为什么不用一步法制得CuCl?(Cu2++Cu++2Cl-→2CuCl↓)2.为什么必须外加NaCl且控制接近饱和?3.为什么要在反应体系中加入少量盐酸,它起何作用?4.合成结束后为什么用酒精洗?第四题(8分)除了我们常用的休克尔规则以外还有很多其他的判定芳香性的方法。
值得一提的是70年代汉斯(Hess)和斯切德(Schaad)运用HMO法计算的约50种环状多烯烃的单个π电子的共轭能(REPE)指标,它不仅能判断芳香性的有无,还能判断芳香性的强弱。
REPE的计算方法为:REPE=(Edeloc-Eloc)/N(式中:N为π电子数,Edeloc为环状多烯非定域能,Eloc为环状多烯定域能。
)下面给出11种化合物的结构简式:1.请补充下表,并排列下列11种化合物芳香性的强弱顺序。
第五题(10分)加替沙星是一种含甲氧基的第四代喹诺酮类合成抗菌药物。
下面是文献报道的家替沙星的一种新的合成路线:1.画出A,B,C,D,E的结构简式。
2006年全国高中学生化学竞赛暨(冬令营)理论试题与实验试题及参考答案

2006年全国高中学生化学竞赛决赛理论试题2006年1月7日 上海竞赛时间4.5小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试题和答卷纸装入信封,放在桌面上,听到指令后方可撤离考场。
试卷和答卷装订成册,不得拆散。
所有解答必须写在答卷纸的指定位置的方框内,答在试题纸上一律无效。
用黑色墨水笔或黑色圆珠笔答题。
不得携带任何其他纸张进入考场。
需要额外的答卷纸或草稿纸时可举手向监考老师索取。
在答卷纸页眉自填总页数和页码。
必须在试题首页左边和每页答卷纸左边指定位置填写营号及姓名,否则按废卷论。
允许使用非编程计算器以及直尺等文具。
不得携带铅笔盒、通讯工具入场。
第1题 (9分) 钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。
钨在自然界主要以钨(VI)酸盐的形式存在。
有开采价值的钨矿石是白钨矿和黑钨矿。
白钨矿的主要成分是钨酸钙(CaWO 4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe,Mn)WO 4。
黑钨矿传统冶炼工艺的第一阶段是碱熔法:黑钨矿NaOH, 空气 熔融(1)水浸A )浓盐酸(2)滤液沉淀B焙烧产品C其中A 、B 、C 都是钨的化合物。
1-1. 写出上述流程中A 、B 、C 的化学式,以及步骤⑴、⑵、⑶中发生反应的化学方程式。
1-2. 钨冶炼工艺的第二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。
对钨的纯度要求不高时,可用碳作还原剂。
[1] 写出用碳还原氧化钨制取金属钨的化学方程式。
[2] 用下表所给的298.15K 的数据计算上述反应的标准自由能变化,推出该反应在什么温度条件下能自发进行。
(假设表中数据不随温度变化)物质 Δf H m (kJ ⋅mol −1)S m (J ⋅mol −1⋅K -1)W(s)WO 3(s) C(石墨) CO(g) CO 2(g) H 2(g) H 2O(g) H 2O(l)-842.870 -110.52 -393.51 0 -241.82 -285.31 32.64 75.90 5.74 197.56 213.64 130.57 188.72 69.901-3. 为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,为什么?写出用氢气还原氧化钨的化学方程式。
2006年全国高中学生化学竞赛理论试题参考答案

・62・化学教育2006年第4期2006年全国高中学生化学竞赛理论试题参考答案上海化学化工学会复旦大学化学系第1题l一1.A:Na2W()^;B:H2W04或w03・H20;C:W03(1)4FeW04(s)+8NaoH(1)+02(g)一4Na2W04(1)+2F。
203(s)+4H20(g)2MnW04(s)+4NaoH(1)+02(g)一2Na2W04(1)+2Mn02(s)+2H20(g)(产物写成Mn20。
或Mn304也可)(2)Na2W()a(aq)+2HCl(aq)——H2W04(s)+2NaCl(aq)(3)H2W04(s)一W03(s)+H20(g)1—2.[1]2w0。
(s)+3c(石墨)——2w(s)+3c02(g)[2]反应在298.15K时的标准焓变、标准熵变和标准自由能变化分别为:△H8一乏u△fH未一[2×o+3×(一393.51)一2×(一842.87)一3×o]kJ/mol一505.21l【J/mol△S9一∑uS。
一r2×32。
64+3×213。
64—2×75。
90一3×5.74]J・mol-1・K1—537.18J・m011・K1△G。
一△H。
一丁△S8一[505.21—298.15×537.18/loOo]kJ/mol一345.05kJ/mol298.15K时反应的标准自由能变化是正值,说明此反应不能在该温度下自发进行。
当温度T>[505.21×1000/537.18]K一940.49K时,反应才有可能发生。
1—3.因为钨的熔点很高。
不容易转变为液态。
如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应形成碳化钨(wc,w:C),不容易获得纯的金属钨。
用氢气作还原剂就不存在这些问题。
方程式为:w03(s)+3H2(g)——w(s)+3H20(g)l一4.(a)仲钨酸根[H:w。
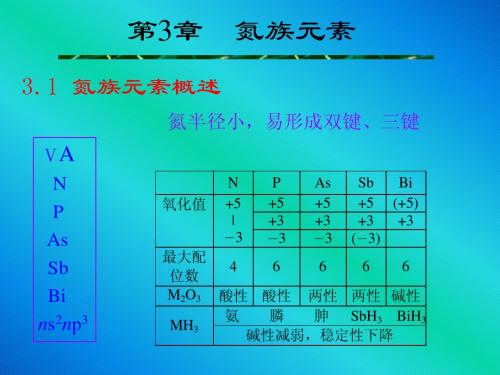
2006年江苏省“南京工业大学杯”化学奥赛夏令营(选拔赛)辅导讲义--无机化学(氮族)
O O O
P
点击方程式,观看动画
O O
P
O O
P
Na5P3O10
(NaPO3)n格氏盐
P
O
O Ca
O
O Ca
O
H3PO4
-H2O
HPO3 (偏)
(HPO3)n
磷酸盐
复杂磷酸盐:可以是直链,支链, 环状,
P-O四面体基本结构单元
Haber F. 获1916年诺贝尔奖
Ag 2NH3 [Ag(NH3 )2 ]
4NH3 3O2 ( 纯) 2N2 6H2 O 4NH3 5O2 (空气 ) Pt 4 NO 6H2 O
2NH3 2Na 570C 2NaNH2 H 2
催化
3.2.2 联氨(肼)、羟胺
正磷酸、焦磷酸和偏磷酸的鉴别方法? PO43– P2O74– PO3–
Ag+
黄↓
白↓
白↓
蛋白
/
/
凝固
PO43– + 3NH3 + 12MoO42– + 24H+ = (NH4)3PO4 ∙12MoO3 ∙6H2O + 6H2O 还可写为(NH4)3[PMo12O40]∙6H2O Mg2+ + NH4+ + PO43– = NH4MgPO4↓ 3Ag+ + PO43– = Ag3PO4↓(黄) 3Ag+ + AsO43– = Ag3AsO4↓(暗红色)
3.6.5 氧化还原反应
OH-
H3AsO3+I2 E H AsO /H AsO
2002~2008年全国高中学生化学竞赛(江苏赛区)夏令营选拔赛试题分类 原子分子、晶体结构

2002~2008年全国高中学生化学竞赛(江苏省赛区)夏令营选拔赛试题分类原子、分子结构(2002年)1.(12分)⑴如果已经发现167号元素A,若已知的原子结构规律不变,167号元素应是第周期、第族元素;可能的最高氧化态为;氢化物的化学式为。
⑵某一放射性物质衰变20%需15天,该物质的半衰期是。
⑶化合物C H3C H C H2O分子中有种化学环境不同的氢原子。
如果用氯取代分子中的氢原子,生成的一氯代物可能有种。
⑷硅与碳为同族元素,呈四价。
然而,与碳化合物相比,硅化合物的数量要少得多。
碳易于形成双键,硅则不易形成双键。
但据美国《科学》杂志2000年报道,已合成了分子中既有Si-Si单键,又有Si=Si双键的化合物X。
X的分子式为Si5H6,红外光谱和核磁共振表明X分子中氢原子的化学环境有2种,则X的结构式是:。
(2002年)2.(13分)⑴磷和氢能组成一系列的氢化物,如PH3,P2H4,P12H16等。
其中最重要的是PH3。
PH3称为膦,它是一种无色剧毒的有类似大蒜臭味的气体。
它可由NaOH和白磷反应来制备,其制备反应的化学方程式为,P2H4的沸点比PH3(填“高”或“低”),原因是。
AsH3又称胂,试写出由As2O3制备胂的反应方程式,胂的汽化热比膦(填“大”或“小”)。
⑵①根据VSEPR理论,SCl3+和ICl4-的空间构型分别是和,S和I 分别以_______和杂化轨道同Cl形成共价键。
② SCl3+和PCl3是等电子体,其S-Cl键键长(填>、=或<)P-Cl键键长,原因是。
(2003年)第2题(共8分)⑴根据杂化轨道理论,下列离子或分子:NH3、NF3、NO2+中氮分别采用、、__________杂化轨道同相应的键合原子成键。
其中NH3的键角(填“大于”或“小于”)NF3的键角的原因是。
⑵最近,德国科学家在医学杂志《柳叶刀》上发表文章,他们研究发现一种名为甘草甜素的物质可以有效抑制非典病毒的增殖,有望用其研制出治疗非典的特效药。
2006全国高中学生化学竞赛(江苏省赛区)选拔赛试题及答案

2006年全国高中学生化学竞赛(江苏省赛区)夏令营选拔赛试题(2005年7月15日 8:30—11:30 共计3小时)● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 所有解答必须写在指定位置,不得用铅笔填写。
● 姓名、准考证号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
● 允许使用非编程计算器以及直尺等文具。
第1题(9分)1-1 元素周期表是20世纪科学技术发展的重要理论依据之一。
假设NH 4+是“元素”NH 4的阳离子,则“元素” NH 4在周期表中的位置应该是 ;“元素” NH 4的单质常温常压下应为(填“高”或“低”)熔点 (填“固”、“液”或“气”)体, (填“能”或“不能”)导电;NH 4的碳酸盐应 (填“易”或“不易”)溶于水。
1-2 放射性元素的发现19世纪末20世纪初物理学发生巨大变革的基础。
最早发现的具有放射性的元素是铀,铀也是核电厂的燃料。
U 23592是自然界存在的易于发生裂变的唯一核素。
U23592吸收一个中子发生核裂变可得到Ba 142和Kr 91,或I 135和Y 97等。
请写出上述核反应方程式:1-3 利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。
下图是国外正在研究中的一种流程(碘—硫法),其中用了过量的碘。
请写出反应①②③的化学方程式并注明条件:反应① 反应② 反应③ 上述流程中循环使用的物质是 。
第2题(12分)2-1 人的牙齿表面有一层釉质,其组成为羟基磷灰石Ca 10(OH)2(PO 4)6(K SP =3.8×10-37)。
为防止龋齿的产生,人们常常使用含氟牙膏,牙膏中的氟化钙可使羟基磷灰石转化为氟磷灰石Ca 10F 2(PO 4)6(K SP =1.0×10-37)。
写出羟基磷灰石与牙膏中的F -反应转化为氟磷灰石的离子方程式,并通过计算其转化反应的平衡常数说明哪种物质更稳定。
2006年中国化学会第20届全国高中学生化学竞赛(省级赛区)试题及答案和评分标准

中国化学会第20届全国高中学生化学竞赛(省级赛区)试题1.008Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te IHf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po AtAc-LrHLi Be B C N O FNa Mg Al Si P ClSK Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se BrRbCsFrSrBaRaYLa Lu-6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]HeNeArKrXeRn相对原子质量Rf Db Sg Bh Hs Mt第1题(4分)2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。
按元素周期系的已知规律,该元素应位于第周期,它未填满电子的能级应是,在该能级上有个电子,而这个能级总共可填充个电子。
(各1分)第2题(5分)下列反应在100o C时能顺利进行:DHMeHHMe EtHMe EtHHHHD Me+Et MeHHHDH MeI II2-1 给出两种产物的系统命名。
(4分)2-2 这两种产物互为下列哪一种异构体?(1分)A旋光异构体B立体异构体C非对映异构体D几何异构体第3题(8分)下面四张图是用计算机制作的在密闭容器里,在不同条件下进行的异构化反应X⇌Y 的X,“Y。
2006全国高中学生化学竞赛试题答案

第一题八5g 6 18第二题2-1 若不把氘视为取代基,则I:(7S,3Z,5Z)-3-甲基-7-氘代-3,5-辛二烯II:(7R,3E,5Z)-3-甲基-7-氘代-3,5-辛二烯(2分)或若把氘视为取代基,则I:(2S,3Z,5Z)-2-氘代-6-甲基-3,5-辛二烯II:(2R,3Z,5E)-2-氘代-6-甲基-3,5-辛二烯(2分)2-2 B(立体异构体)(1分)第三题3-1 X和Y的摩尔百分数(或答:物质的量的分数或物质的量的百分数);时间,分(或答:以分为单位的反应进程)(2分)3-2A(2分)3-3B(2分)3-4 C(2分)第四题不需加。
开始投料时(NH4)2SO4(132g﹒mol-1)过量(MnCO3,115 g﹒mol-1),反应生成的NH3、CO2以及(NH4)2SO4可循环利用。
(2分MnSO4+2NH3+CO2+H2O=(NH4)2SO4+MnCO3↓(2分)MnSO4,MnCO3分解生成高价锰的氧化物而导致锰浸出率下降。
(2分)(NH4)2SO4+MnCO3=MnSO4+2NH3↑+CO2↑+H2O↑(1分)第五题设萃取平衡时,水溶液中c(I2)为x c(I2,CCl4)/c(I2,H2O)=2.60x10-3 mol·L-1/x=85x= 2.60x10-3mol·L-1/85= 3.06×10-5mol·L-1 (2分)水溶液中I2 +I¯=I3¯平衡浓度(mol·L-1):I2:3.06×10-5 ;I¯:0.100-2.22×10-3=0.098 (1分) (1分)I¯3: (4.85- 2.60)×10-3- 3.06×10-5= 2.22×10-3 (1分)K=2.22×10-3 mol·L-1/(0.098 mol·L-1×3.06×10-5 mol·L-1)=7.4×102 L·mol-1(不写单位不扣分)(1分)第六题A H3B:NH3(或BNH6) B H2B=NH2(或BNH4)C—H2B-NH2—nD B3N3H6E BN (5分)A→B 2.016/30.87 = 6.531 %(或0.06531) B→D 2.016/28.85 = 6.988 % (或0.06988)D→E 6.048/26.84 = 22.5 %(或0.225)A→E 6.048/30.87 = 19.59 % (或0.1959) (2分)3 CH4 + 2(HBNH)3 + 6 H 2O = 3 CO 2 + 6 H 3BNH 3(2分)第七题 ON H 2N N NH 2HH 注:C-N-N 角必须不是直线。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NaCl晶体,其化学式仅表示Na离子与Cl离子 的离子数目之比为1∶1,并不是其分子式,整 个NaCl晶体就是一个大分子。
07.01.2021
高中化学竞赛培优教程 第四章
8
问:分子为什么会形成一定的几何结构? 答:是化学键让原子连接成一定的结构。
问:化学键是什么? 答:相邻原子共用成对电子。
问:电子是如何配成对的?
1s 都是正值,叠加后使核间的电子云密度加
大,这叫做原子轨道的重叠,在两个原子之间 出现了一个电子云密度较大的区域。
一方面降低了两核间的正电排斥,另一方面又 增强了两核对电子云密度大的区域的吸引,这 都有利于体系势能的降低,有利于形成稳定的 化学键。
07.01.2021
高中化学竞赛培优教程 第四章
间电子云密度小,系统能量E 始终高于两个孤立氢
原 子 的 能 量 之 和 Ea+Eb , 称 为 推 斥 态 , 不 能 形 成
H2 分子。
若电子自旋反平行的两个氢原子靠近时,两核间
的电子云密度大,系统的能量E 逐渐降低,并低于
两个孤立氢原子的能量之和,称为吸引态。
当两个氢原子的核间距L = 74 pm时,其能量达
指导下继续研究化学,于
1899 年 24 岁 时 获 哲 学 博 士 学
位。
高中化学竞赛培优教程 第四章
11
1、路易斯结构式
确定步骤 1)计算可用价电子的数目。 2)画出结构草图。 3)计算所画结构的电子总数。 4)画出双键或三键。
07.01.2021
高中化学竞赛培优教程 第四章
12
1927年英国物理学家海特勒(W Heitler)和德 国物理学家伦敦(F London)成功地用量子 力学处理H2分子的结构。
化学键——分子中相邻原子间较强烈的
相互结合力。 125-900 kJ/mol 既是电子对核的吸引力,也是核对电子的
吸引力。 电子云偏向对电子吸引力大的原子。
07.01.2021
高中化学竞赛培优教程 第四章
6
一、离子键
离子键(ionic bond)理论是1916年德国 化学家柯塞尔(W.Kossel)提出的,他认 为原子在反应中失去或得到电子以达到 稀有气体的稳定结构,由此形成的正离 子(positive ion)和负离子(negative ion)以静电引力相互吸引在一起。
方向即共价键的方向。
07.01.2021
高中化学竞赛培优教程 第四章
21
饱和性
共价键的饱和性是指每个原子的成键总数或 以单键相连的原子数目是一定的。因为共价键 的本质是原子轨道的重叠和共用电子对的形成, 而每个原子的未成对电子数是一定的,所以形 成共用电子对的数目也就一定。 例如两个H原子的未成对电子配对形成H2分子后, 如有第三个H原子接近该H2分子,则不能形成H3分子。
离子键的本质就是正、负离子间的静电
吸引作用。
07.01.2021
高中化学竞赛培优教程 第四章
7
离子键的要点
由于离子键是正负离子通过静电引力作用
相连接的,从而决定了离子键的特点是没有方 向性和饱和性。正负离子近似看作点电荷,
所以其作用不存在方向问题。没有饱和性是指 在空间条件许可的情况下,每个离子可吸引尽
到
最低点,Es = 436 kJmol1,两个氢原子之间形
07.01成.202了1 稳定的共价键高中,化学形竞赛成培优了教程氢第分四章子。
15
自旋方向相同
自旋方向相反
07.01.2021
高中化学竞赛培优教程 第四章
16
量子力学对氢分子结构的处理阐明了共价键 的本质是电性的。
由于两个氢原子的1s原子轨道互相叠加,两个
17
1931年美国化学家鲍林和斯莱特将 其处理H2分子的方法推广应用于其他分 子系统而发展成为价键理论(valence bond theory),简称VB法或电子配对法。
07.01.2021
高中化学竞赛培优教程 第四章
18
鲍林 Linus Pouling
美国化学家。1901年2月28日出生于 一个药剂师家中。自幼对父亲在药 房配药发生兴趣。在中学时代他就 喜欢做化学实验。由于化学成绩优 秀,老师破格让他做高一级的化学 实验并参加老师的研究工作。1922 年毕业于俄勒冈州立大学化工系, 加州理工学院攻读化学。1925年获 博士位,曾到欧洲各国作访问学者。 1927年回到加州大学理工学院, 1931年升任教授。1969年任斯坦 福大学化学教授一职直到退休。 1974年任该校荣誉教授。
07.01.2021
高中化学竞赛培优教程 第四章
13
氢分子的形成
当具有自旋状态反平行的未成对电子的两个 氢原子相互靠近时,它们之间产生了强烈的 吸引作用,形成了共价键,从而形成了稳定 的氢分子。
07.01.2021
高中化学竞赛培优教程 第四章
14
量子力学从理论上解释了共价键形成原因:
当核外电子自旋平行的两个氢原子靠近时,两核
07.01.2021
高中化学竞赛培优教程 第四章
10
07.01.2021
Lewis
1875年10月25日路易斯出生于
美国麻萨诸塞州的西牛顿市。
他从小聪明过人,在三岁时,
父母就开始在家里让他接受教
育 。 1893 年 进 入 著 名 的 哈 佛
大 学 学 习 , 1896 年 获 理 学 士
学位,以后在T.W.理查兹
07.01.2021
高中化学竞赛培优教程 第四章
19
2、VB法基本要点
*自旋相反的未成对电子相互配对时,因其波函数符号相 同,此时系统的能量最低,可以形成稳定的共价键。
*若A﹑B两原子各有一未成对电子且自旋反平行,则互 相配对构成共价单键,如H—H单键。如果A、B两原 子各有两个或三个未成对电子,则在两个原子间可以 形成共价双键或共价三键。如N≡N分子以三键结合, 因为每个N原子有3个未成对的2p电子。
07.01.2021
高中化学竞赛培优教程 第四章
9
二、 价键理论
离子键理论能很好解释电负性差值较大的离 子型化合物的成键与性质,但无法解释其 他类型的化合物的问题。
美国化学家路易斯(G N Lewis)提出了共价键 (covalent bond)的电子理论:原子间可 共用一对或几对电子,以形成稳定的分子。 这是早期的共价键理论
*若原子A有能量合适的空轨道,原子B有孤电子对,原 子B的孤电子对所占据的原子轨道和原子A的空轨道能 有效地重叠,则原子B的孤电子对可以与原子A共享, 这样形成的共价键称为共价配键,以符号AB表示。
07.01.2021
高中化学竞赛培优教程 第四章
20
共价键的特征
1. 有饱和性——未成对电子决定 2. 有方向性——电子云重叠最大的
