燃烧焓的测定实验报告
燃烧焓的测定

宁波工程学院物理化学实验报告专业班级姓名实验日期同组姓名指导老师实验名称实验一、燃烧焓的测定一、实验目的1、用氧弹量热机测定萘的摩尔燃烧焓。
2、了解热量计中主要部分的作用,掌握氧弹量热计的实验技术。
二、实验原理有机物B的△cHm(B,T)是指在1mol指定相态的B物质在温度T和恒压P下完全燃烧索放出的热量Qp,其值与以B为反应物(Vb=1)的燃烧反应的△rHm相等。
1molB物质在恒容条件下完全燃烧索放出的热量Qv,其值与以B为反应物(Vb=1)的燃烧反应的△rUm相等。
若系统中的气体均视为理想气体:Qp=Qv+△nRT ①△rHm=△rUm+RT∑V b(g) ②本实验采用氧弹量热计测定萘的燃烧热。
测量的原理是将一定量待测萘样品在氧弹中完全燃烧,燃烧时放出的热量使量热计本生及氧弹周围介质(水)的温度升高。
通过测定燃烧前后量热计温度的变化值,就可以求出样品的燃烧热,实验测得的是恒容反应热Qv,通过①和②算出萘的△cHm。
氧弹式量热计中的量热计可看做一个等容绝热系统,△U=0△U =△cU B+△cU(引烧丝)+△U(量热计)m B Qv,B+l Q l+K△T=0通过测已知标准摩尔燃烧焓的苯甲酸来测定K,再通过雷诺温度校正图校正得到△T算出,△cU B 代入②得△cHm(B,T)苯甲酸的反应式:C7H6O2+15/2O2=7CO2+3H2O Vb= -1/2萘的反应式:C10H8+12O2=10CO2+4H2O Vb= -2Q1=-6.699J/mol △cHm(苯甲酸,s,298.15K)=-3226.7KJ/moi三、实验仪器、试剂仪器:氧弹量热计、压片机、万用表、贝克曼温度计、温度计(100℃)、点火丝、容量瓶(1000ml)、氧气钢瓶及减压阀试剂:萘(A.R)、苯甲酸(A.R)四、实验步骤1、热容量K 的测定①截15cm 左右的引燃丝,中间部绕成环状。
②称0.8~1.0g 苯甲酸,压成片状,去掉粉状物,再在天平上准确称量。
燃烧焓的测定实验报告

物理化学实验报告实验名称:______________ 燃烧熔的测定_________学院:化学工程学院__________专业:化学工程与工艺班级: _____________________________姓名: ______ 学号:________________指导教师:____________________________________日期: _____________________________一、实验目的1、用氧弹式量热计测定荼的燃烧焙。
2、明确燃烧焙的定义,了解恒压燃烧热与恒容燃烧热的差别。
3、了解氧弹式量热计中主要部分的作用,掌握氧弹式量热计的实验技术。
4、学会用雷诺作图法校正温度变化值。
二、实验原理1、燃烧焰是热化学中重要的基本数据,在非体积功为零的情况下,物质的燃烧焙常以物质燃烧时的燃烧热来表示,即△ cHnFQp,nu测定物质的燃烧焰实际就是测定物质在等温、等压下的燃烧热。
2、量热法是热力学实验的一个基本方法。
等压燃烧热(Qp)与等容燃烧热(Q)之间的关系为:Qp,m =Qv,m + L v (g)RT3、氧弹式量热计属于一个等容系统,且热力学能变=0o即Ac U B+A C U 9|«tt+AU M计=0 ;可化作:m3Q v.B+lQ3+KAT=0三、实验准备1、主要药品:荼约0. 6g,苯甲酸约0. 8go2、主要仪器:氧弹式量热计、压片机、贝克曼温度计、温度计(100°C)、引燃丝(15cm).量筒(2000ml)、氧气钢瓶及减压阀等。
四.实验装置图> 2.L —;计原埋给构图1一马迖:2—挽拧皓帕“ 3=夕卜左入飞4绝站4眛Af让热内柄: &外仝内7以即讣外哀;8 議汤水$ 4远奔「6水俶沪型£1 ;I ■■数宇UI魁吳沁康卜感应器1四、实验步骤1、热容量K的测定(1)截取15cn)引燃丝,将其中部绕成环状。
(2)称取苯甲酸约0. 8g,压成片状,并放桌上敲击2次,去除没压紧的部分,再次称量。
燃烧焓的测定实验报告

燃烧焓的测定实验报告燃烧焓的测定实验报告引言:燃烧焓是热力学中的一个重要概念,用于描述物质燃烧过程中释放或吸收的热量。
本实验旨在通过测定某种物质的燃烧焓,探究其燃烧特性,并进一步了解燃烧过程中的能量变化。
实验方法:1. 实验器材准备:实验室内,准备好量热器、点火器、天平等实验器材。
2. 实验样品准备:选择某种常见有机物质作为实验样品,如甲醇、乙醇等。
将样品称量并记录质量。
3. 燃烧装置搭建:将量热器放置在三脚架上,将实验样品放在量热器内,使其与空气完全接触。
4. 实验操作:点燃实验样品,观察燃烧过程,并记录燃烧时间。
5. 数据处理:根据实验数据计算得出燃烧焓。
实验结果与讨论:通过实验操作,我们成功测定了某种有机物质的燃烧焓。
在实验过程中,我们观察到实验样品在点燃后燃烧迅速进行,释放出明亮的火焰和大量的热量。
燃烧过程中,我们使用量热器测量了温度的变化,并利用计算公式计算出了燃烧焓。
在实验中,我们注意到燃烧焓的测定受到多种因素的影响。
首先,燃烧过程中需要充分供氧,以保证燃烧反应的进行。
其次,实验样品的质量和燃烧时间对燃烧焓的测定也有一定的影响。
因此,在实验操作中需要注意控制这些因素,以提高实验结果的准确性。
燃烧焓的测定结果可以用于评估物质的燃烧特性。
不同物质的燃烧焓差异较大,这与其分子结构和化学键的强度有关。
通过测定燃烧焓,我们可以了解物质在燃烧过程中的能量变化,进而推断其燃烧产物和反应路径。
实验中,我们还发现了一些有趣的现象。
例如,在实验样品完全燃烧后,我们观察到量热器内的温度明显上升,这说明了燃烧过程中释放的大量热量。
此外,我们还观察到了燃烧过程中产生的一些气体,如二氧化碳和水蒸气。
这些现象都与燃烧反应的特点密切相关。
总结:通过本次实验,我们成功测定了某种有机物质的燃烧焓,并了解了燃烧过程中的能量变化。
燃烧焓的测定对于研究物质的燃烧特性和能量转化具有重要意义。
通过进一步的实验研究,我们可以探索更多物质的燃烧焓,并深入理解燃烧反应的机理和热力学性质。
燃烧焓的测定

实验1:燃烧热(焓)的测定一、实验目的:1、用恒温式热量计测定萘的燃烧焓;2、明确燃烧焓的定义,了解恒压燃烧焓与恒容燃烧焓的差别;3、了解恒温式热量计中主要部分的作用,掌握恒温式热量计的实验技术;4、学会雷诺图解法,校正温度改变值;二、实验基本原理:燃烧焓是指1mol物质在等温、等压下与氧进行完全氧化反应时的焓变。
完全氧化即指如碳被氧化成CO2(气),氢被氧化成H2O(液),硫被氧化成SO2(气)根据热力学第一定律,物质在定体积燃烧时,体系不对外作体积功,则燃烧热等于体系内能的变化,即:(1.1)本实验当中就是利用燃烧产生的热与环境内能改变的原理进行设计,即体系热=环境热(式中QV为恒容燃烧热,ΔU为体系内能的变化值。
)设体系的恒容热容为C V,则若将n mol 被测物质置于充氧的氧弹中使其完全燃烧。
燃烧时放出的热量使体系温度升高ΔT,即可根据下式计算实际放出的热量:(1.2)则恒容摩尔燃烧热QV.m 可用下式计算:(1.3)将实验中测得的恒容燃烧热代入热力学基本关系式,可求得恒压燃烧热 Qp: Qp =ΔH =ΔU +Δ(pV) = Q V + pΔV (1.4)(式中ΔH 为反应的焓变,p 为反应压力,ΔV 为反应前后体积的变化。
)由于凝聚相与气相相比,其体积可忽略不计,则ΔV 可近似为反应前后气体物质的体积变化。
设反应前后气态的摩尔数变化为Δn,并设气体为理想气体,则 pΔV=ΔnRT (1.5)则: Q p = Q V +ΔnRT (1.6)反应热效应的数值与温度有关,燃烧热也如此。
其与温度的关系为:(1.7)(式中ΔCp 为燃烧反应产物与反应物的恒压热容差,是温度的函数。
)通常,温度对热效应影响不大。
在较小的温度范围内,可将反应的热效应看着与温度无关的常数。
从上面的讨论可知,测量物质的燃烧热,关键是准确测量物质燃烧时引起的温度升高值ΔT,然而ΔT 的准确度除了与测量温度计有关外,还与其他许多因素有关,如热传导、蒸发、对流和辐射等引起的热交换,搅拌器搅拌时所产生的机械热。
物理化学实验报告燃烧焓

1.656
1.656
0.031
1.200
1.585
1.646
1.656
1.655
0.033
1.285
1.596
1.649
1.656
1.654
0.037
1.362
1.607
1.649
1.657
1.658
0.040
1.394
1.611
1.652
1.658
1.653
0.044
1.439
1.620
△W=0.0067g M=122g/mol
代入公式 × -1400.8×△W=-K△T
得K=14114.3204J/K
3.计算萘的标准摩尔燃烧热,并与文献值比较。
燃烧丝的质量:0.0108g燃烧丝和萘质量:0.5924g
前期温度每分钟读数
燃烧期温度每15秒读数
后期温度每分钟读数
0.007
0.048
1.481
0.052
1.507
1.770
1.818
1.825
外筒水温:19.64℃
温差档读数:1.081残丝质量:0.0041g
2.用作图法求出苯甲酸燃烧引起量热计温度变化的差值△T1,并根据(3-3)式计算水当量K值。
由雷诺温度校正图知△T=1.825-0.061=1.764℃
(苯甲酸)=-3228120J· m=0.9406g
1.626
1.653
1.658
0.010
0.322
1.507
1.630
1.654
1.658
0.013
0.607
1.527
1.632
实验2 燃烧焓的测定

实验2 燃烧焓的测定【实验目的】1. 掌握数显氧弹式热量计测定燃烧焓的热力学原理; 2. 了解数显氧弹式热量计的构造并掌握其使用方法。
【实验原理】物质标准摩尔燃烧焓燃烧焓是指在温度和标准状态下,由1 mol 指定相态的物质与氧气完全氧化的等压反应热,记为∆c H m (B,T )。
在适当条件下,很多有机物都能在氧气中迅速地完全氧化,因此可利用燃烧法快速准确地测定其燃烧焓。
测定装置:氧弹式热量计,如图2.1(介 绍氧弹式热量计结构,待测物燃烧处,等容绝热系统)。
因在氧弹式热量计中被测物质在定容下燃烧,因此测得的为Q V ,即∆c U m 。
但根据∆c H m (B ,T )=∆c U m (B ,T )+ ∆pV 若视为理想气体(∆PV =∑B νB(g )RT ),并忽略压力对∆c H m (B ,T )影响,则:∆c H m (B ,T )=∆c U m (B ,T )+ ∑B νB(g )RT ( 2.1)∆c U m (B ,T )测定原理:整个热量计可看做一个等容绝热系统,故∆U =0。
∆U 由四部分组成:○1样品在氧气中等容燃烧的∆c U (B);○2引燃丝燃烧的∆c U 。
○3氧弹中微量氮气氧化成硝酸的∆f U (HNO 3) ,即等容生成热力学能;○4热量计(包括氧弹,内桶,搅拌器和温度感应器等)的∆U (热力计)。
因此:∆U=∆c U (B)+ ∆c U (引燃丝)+∆f U (HNO 3)+ ∆U (热量计)=0∆f U (HNO 3)相对于∆c U (B)极小,而且氧弹中的微量氮气可通过反复充氧加以排除,因此∆f U (HNO 3)可忽略不计,上式则变为:∆U=∆c U (B)+ ∆c U (引燃丝)+ ∆U (热量计)=0 更实用的形式:m (B )·Q v (B) + m 2Q 2 + C ∆T = 0(2.2)实验测得能当量C 后,根上式计算Q v (B),进而换算为∆c U m (B,T)(除以M B )。
实验一燃烧热焓的测定

实验一燃烧热(焓)的测定一、实验目的:1、了解氧弹量热法的实验原理,掌握燃烧焓的测量技术。
2、学会雷诺校正图的校正方法,掌握Qp与Qv的关系。
3、分析产生误差的原因二、实验原理:燃烧焓是热化学中重要的基本数据,它是指单位物质的量的物质与氧气完全燃烧生成规定的燃烧产物时的反应焓(变)。
所谓规定的燃烧产物是指C变成CO2(气)、H变成H2O(液)、S变成SO2(气)、N变成N2(气)、Cl变成HCl水溶液等。
例如,甲烷在298K时的标准摩尔燃烧焓为:CH4(g)+2O2(g)→ CO2(g)+2H2O(l)= -890.31kJ·mol-1对于燃烧焓的测定来源于量热实验,所依据的是热力学公式:(推导)是反应在恒压条件下测量的恒压热。
对于燃烧反应,实验要在恒容容器中进行,所测量的是反应的恒容热。
由于和的测量条件不同,需按下式进行换算:(推导)式中为气体产物与气体反应物的物质的量之差,R为摩尔气体常数,T为反应的热力学温度。
本实验是利用量热计来测定萘(C10H8)的燃烧热,所测得的是恒容热。
量热计测量的原理是将一定量的待测物质在氧弹中完全燃烧,燃烧时放出的热量使量热计的温度升高,通过测量燃烧反应前后此温度的变化值,就可以计算出该样品的。
其计算式为:式中m为待测物质的质量,为待测物质的恒容热,为点火丝的恒容热(本实验使用的是镍铬合金丝,其=3240 J·g-1);为点火丝的质量;为样品燃烧前后量热计温度的变化值;C为量热计的热容量,它是指量热计(包括量热计中的水)温度升高单位温度时所吸收的热量。
通常用已知的物质标定量热计热容量C,一般采用高纯度的苯甲酸作为标准物质(其恒容热=26460J·g-1)。
当已知量热计热容量C之后,就可以利用上式通过实验测定其它物质的恒容热。
燃烧过程中量热计温度随时间变化的曲线如下图中的曲线abcd所示。
其中ab段表示实验前期,b点相当于开始燃烧之点;bc段相当于燃烧反应期;cd段则为后期。
物化实验报告4-燃烧焓的测定
一、实验目的1、用氧弹量热计测定萘的摩尔燃烧焓。
2、了解热量计中主要部分的作用,掌握氧弹量热计的实验技术。
二、实验原理燃烧反应系统中的气体可视为理想气体,存在以下关系:Q P = Q V + △nRT ①△rH0m=△rU0m+RT∑V b (g) ②本实验采用氧弹式量热计测萘的燃烧焓,构造如图1所示。
测定的原理是将一定量待测萘样品在氧弹中完全燃烧,燃烧放出的热使量热计本身及氧弹周围介质(水)的温度升高,通过测定燃烧前后量热计温度的变化,就可求出Q V,再通过①、②式可算出△cHm。
整个量热计可看做一个等容系统,其热力学能△U=0。
△U = △cU B + △cU引燃丝+ △U量热计=0如果已知物质的质量、等容燃烧热值及燃烧前后系统温度的变化△T,则上式还可以写为更实用的形式m B Q V,B + LQ l + K△T=0式中m B为样品的质量(g);Q v,B为样品的等容燃烧热值(J*g-1);l为燃烧掉的引燃丝的长度(cm);Q l为引燃丝的燃烧热值(J*cm-1);△T为修正后的内桶中水的真实温差(K)。
m B和L的数据可直接由实验测得,而真实温差T可由对实测温差进行修正获得,可通过作下图来得到。
图2、雷诺温度校正图本实验先用已知标准摩尔燃烧焓的苯甲酸(△cHm(苯甲酸,S,298.15K)=–3226.7KJ/mol)来测定量热计的热容量K,之后再重复实验,测定未知样品萘的摩尔燃烧焓。
其=–6.699J*cm。
中用到引燃丝的燃烧热值Ql四、仪器与试剂仪器:氧弹量热计1台、压片机1台、万用表1只、贝克曼温度计1支、温度计(0℃~100 ℃)1支、点火丝、容量瓶(1000ml)1只、氧气钢瓶、减压阀1只。
试剂:萘(A.R)、苯甲酸(A.R)。
五、实验装置图1、氧弹式量热计原理结构图六、实验步骤1、热容量K的测定(1)准确截取16cm左右的引燃丝,然后用笔芯将引燃丝中部绕成环状。
(2)苯甲酸称取约0.8~1.0g,在压片机上压成片状。
实验一燃烧热焓的测定

实验一燃烧热(焓)的测定一、实验目的:1、了解氧弹量热法的实验原理,掌握燃烧焓的测量技术。
2、学会雷诺校正图的校正方法,掌握Qp与Qv的关系。
3、分析产生误差的原因二、实验原理:燃烧焓是热化学中重要的基本数据,它是指单位物质的量的物质与氧气完全燃烧生成规定的燃烧产物时的反应焓(变)。
所谓规定的燃烧产物是指C变成CO2(气)、H变成H2O(液)、S变成SO2(气)、N变成N2(气)、Cl变成HCl水溶液等。
例如,甲烷在298K时的标准摩尔燃烧焓为:CH4(g)+2O2(g)→ CO2(g)+2H2O(l)= -890.31kJ·mol-1对于燃烧焓的测定来源于量热实验,所依据的是热力学公式:(推导)是反应在恒压条件下测量的恒压热。
对于燃烧反应,实验要在恒容容器中进行,所测量的是反应的恒容热。
由于和的测量条件不同,需按下式进行换算:(推导)式中为气体产物与气体反应物的物质的量之差,R为摩尔气体常数,T为反应的热力学温度。
本实验是利用量热计来测定萘(C10H8)的燃烧热,所测得的是恒容热。
量热计测量的原理是将一定量的待测物质在氧弹中完全燃烧,燃烧时放出的热量使量热计的温度升高,通过测量燃烧反应前后此温度的变化值,就可以计算出该样品的。
其计算式为:式中m为待测物质的质量,为待测物质的恒容热,为点火丝的恒容热(本实验使用的是镍铬合金丝,其=3240 J·g-1);为点火丝的质量;为样品燃烧前后量热计温度的变化值;C为量热计的热容量,它是指量热计(包括量热计中的水)温度升高单位温度时所吸收的热量。
通常用已知的物质标定量热计热容量C,一般采用高纯度的苯甲酸作为标准物质(其恒容热=26460J·g-1)。
当已知量热计热容量C之后,就可以利用上式通过实验测定其它物质的恒容热。
燃烧过程中量热计温度随时间变化的曲线如下图中的曲线abcd所示。
其中ab段表示实验前期,b点相当于开始燃烧之点;bc段相当于燃烧反应期;cd段则为后期。
燃烧焓的测定实验报告

燃烧焓的测定实验报告燃烧焓的测定实验报告引言•燃烧焓是指物质完全燃烧时所释放的热量,是燃烧反应的重要性质之一。
•本实验旨在通过测量燃烧反应的温度变化,并结合相关计算,确定甲烷的燃烧焓。
实验方法1.预先称取一定质量的甲烷气体,并充分混合气体。
2.将混合气体注入燃烧装置燃烧室中,并点燃。
3.同时记录开始时和结束时的温度,并用温度计定期测量燃烧室内的温度。
4.待燃烧完全结束后,关闭火源。
实验结果•初始温度:25°C•终止温度:85°C•燃烧时间:10分钟•初始压强:1 atm•甲烷燃烧产生的水蒸气质量: g•参考焦卡尔定律,计算甲烷气体的燃烧焓。
数据处理根据理想气体状态方程:PV=nRT 1. 计算燃烧时甲烷气体的体积: - 温度转换为开尔文:初始温度25°C = 298K,终止温度85°C= 358K - 气体体积计算:V=nRT/P - 转化为标准状态:$V = V (273/298) (1/1) = V $2.计算甲烷的摩尔数:–初始摩尔数:n1=P1V1/RT1–终止摩尔数:n2=P2V2/RT2–平均摩尔数:n=(n1+n2)/23.计算燃烧焓:–燃烧反应释放的热量:q=mcΔT–燃烧焓:ΔH=q/n结果与讨论根据以上计算,得出以下结果: - 燃烧时甲烷气体的体积:$V = V $ - 初始摩尔数:n1=P1V1/RT1 - 终止摩尔数:n2=P2V2/RT2 -平均摩尔数:n=(n1+n2)/2 - 燃烧反应释放的热量:q=mcΔT -燃烧焓:ΔH=q/n本实验测得甲烷燃烧焓为XXX J/mol。
实验中可能存在一些误差,如测量温度的不准确、燃烧不完全等。
为提高测量的准确性,可采取多次重复实验并取平均值。
结论通过实验测定并计算,本实验得出了甲烷的燃烧焓为XXX J/mol。
这一结果对于进一步研究相关燃烧反应的热力学性质具有重要意义。
通过改进实验方法和减小误差,可以进一步提高实验结果的准确性。
实验二.燃烧焓的测定

实验二燃烧焓的测定一、实验目的:1、使用弹式量热计测定萘的燃烧焓。
2、明确燃烧焓的定义,了解恒压燃烧焓与恒容燃烧焓的差别及相互关系。
2、了解量热计的原理和构造,掌握其使用方法。
3、掌握贝克曼温度计的使用方法。
4、学会用雷诺图解法校正温度变化。
二、预习要求:1、明确燃烧热的定义,了解测定燃烧热的意义。
2、了解氧弹式量热计的原理和使用。
熟悉温差测定仪的使用。
3、明确所测定的温差为什么要进行雷诺图校正。
3、了解氧气钢瓶的使用及注意事项。
三、实验原理:燃烧热的定义是:一摩尔的物质完全燃烧时所放出的热量。
所谓完全燃烧,即组成反应物的各元素,在经过燃烧反应后,必须呈显本元素的最高化合价。
如C经燃烧反应后,变成CO不能认为是完全燃烧。
只有在变成CO2时,方可认为是完全燃烧。
同时还必须指出,反应物和生成物在指定的温度下都属于标准态。
如苯甲酸在298.15K时的燃烧反应过程为:燃烧热可在恒容或恒压情况下测定。
由热力学第一定律,恒容过程的热效应Q v,即ΔU。
恒压过程的热效应Q p,即ΔH。
它们之间的相互关系如下:Q p=Q v + Δn(RT) (2.1)或ΔH= ΔU+ Δn(RT) (2.2)其中Δn为反前后气态物质的物质的量之差。
R为气体常数。
T为反应的绝对温度。
本实验通过测定萘的恒容燃烧热,然后再计算出萘的恒压燃烧ΔH。
在实验中用压力为2.5~3Mpa的氧气作为氧化剂。
用氧弹量热计进行实验时,在量热计与环境没有热交换的情况下,实验时保持水桶中水量一定,可写出如下的热量平蘅式:-Q v×a - q×b+ 5.98c = C卡×△T(2.3)式中:Q v—被测物质的定容热值,J/g;a—被被测物质的质量g;q—引火丝的热值,J/g(铁丝为-6694J/g)b—烧掉了的引火丝质量,g;5.98—硝酸生成热为-59831J/mol,当用0.100mol/lNaOH滴定生成的硝酸时,每毫升相当于-5.98J(由于此项结果对Q V的影响甚微,所以常省去不做);c—滴定生成的硝酸时,耗用0.100mol/lNaOH的毫升数;C卡为量热卡计的热容J/K;△T—与环境无热交换时的真实温差。
燃烧热(焓)的测定

实验二 燃烧热(焓)的测定一、实验目的1.了解XRY -1A 型数显氧弹式热量计的原理、构造和使用方法;2.掌握有关热化学实验的一般知识和技术;3.测定萘的燃烧热。
二、基本原理燃烧热是指一摩尔物质完全燃烧时的热效应。
所谓完全燃烧是指C 变为CO 2(气)、H 变为H 2O(液)、S 变为SO 2(气)、N 变为N 2(气)、C1变为HCl 水溶液。
燃烧热有等容燃烧热Qv 和等压燃烧热Q P 两种。
等容燃烧热是定容条件下测定的燃烧热,由热力学第一定律可知,它等于此过程的内能变化ΔU ,即Qv =ΔU ;而等压燃烧热是定压条件下测定的燃烧热,它等于等压过程的焓变ΔH ,即Q P =ΔH 。
若把参加反应的气体视为理想气体,则上述两种燃烧热存在如下关系:nRT Q Q V P ∆+= (2-1)式中Δn 为产物与反应物中气体物质的量之差;R 为气体常数,T 为反应温度。
若测得某物质的定容燃烧热Qv ,则可求得定压燃烧热Q P 。
定压燃烧热通常用ΔH 表示。
在盛有定量水的容器中。
放入内装有m g 样品和氧气的密闭氧弹,然后使样品完全燃烧,放出的热量传给水及仪器引起温度上升。
若已知水的质量为w kg ,仪器的水当量为W 1(热量计温度每升高1 K 所需的热量相当于W 1 kg 水温度升高1 K 所需的热量)。
若燃烧前、后的温度分别为t 0和t n ,则m g 物质的恒容燃烧热为:Q ˊ= C (w + W 1) ( t n - t 0) (2-2)式中水的热容C = 4.18×103 J ·kg -1·K -1。
因此,摩尔质量为M 的物质的摩尔燃烧热为: Q = M/m ·C (w + W 1) ( t n - t 0) (2-3)水当量W 1的求法是把已知燃烧热的物质(如本实验用苯甲酸)放在热量计中燃烧,测其始、末温度,按式(2-3)求出。
三、仪器和药品XRY -1A 型数显氧弹式热量计、压片机、剪刀、活动搬手、氧气钢瓶及减压阀、电子天平、2 000 ml 量筒、1 000 ml 量筒、1/10温度计。
有机物燃烧焓的测定。实验报告

有机物燃烧焓的测定一.实验目的1.明确燃烧焓的定义,了解恒压热效应与恒容热效应的关系。
2.掌握有关热化学实验的一般知识和技术。
3.用氧弹式量热计测定有机物的燃烧焓。
二.实验原理热化学中定义:在指定温度和压力下,一摩尔物质完全燃烧成指定产物的焓变,称为该物质在此温度下的摩尔燃烧焓,记作ΔC H m 。
通常,C 、H 等元素的燃烧产物分别为CO 2(g)、H 2O(l)等。
由于上述条件下ΔH=Q p ,因此ΔC H m 也就是该物质燃烧反应的等压热效应Q p,m 。
在适当的条件下,许多有机物都能迅速而完全地进行氧化反应,这就为准确测定它们的燃烧焓创造了有利条件。
在实际测量中,燃烧反应常在恒容条件下进行,如在弹式量热计中进行,这样直接测得的是反应的恒容热效应Q V (即燃烧反应的热力学能变ΔC U )。
若将应系统中的气体物质视为理想气体,根据热力学推导可得ΔC H m 和ΔC U m 的关系为:)(g RT U H B Bm c m c ν∑+∆=∆ 或 )(,,g RT Q Q B Bm v m p ν∑== (1)式中,T 为反应温度(K);ΔC H m 为摩尔燃烧焓(J·mol -1);ΔC U m 为摩尔燃烧热力学能变(J·mol -1);v B (g)为燃烧反应方程中各气体物质的化学计量数,规定生产物取正值,反应物取负值。
通过实验测得Q V,m (J·mol -1)值,根据上式就可计算出Q p,m (J·mol -1),即燃烧焓的值ΔC H m 。
本实验是用氧弹式量热计进行萘的燃烧焓的测定。
量热计结构如图1所示,氧弹结构如图2所示。
实验中,设质量为m a (g )的待测物质(恒容燃烧热为Q v,m )和质量为m b (g )的点火丝(恒容燃烧热为q ,J·g -1)在氧弹中燃烧,放出的热可使质量为w m 的水(比热容为c w ,J·K -1·g -1)及量热器本身(热容为C m ,J·K -1)的温度由T 1升高到T 2,则根据能量守恒定律可得到热平衡关系)()]().[(1212,T T K T T w c C m q Mm Q m w m b am -⨯=-⨯+-=⨯+⨯ν (2) 式中,M 为该待测物的摩尔质量;规定系统放热时Q 取负数;K= -( C m +c w · w m ),同一套仪器、当内筒中的水量一定时,K 值恒定,称K 为仪器常数或水当量(J·K -1),常用已知燃烧热值Q v 的苯甲酸来测定。
实验四 燃烧焓的测定
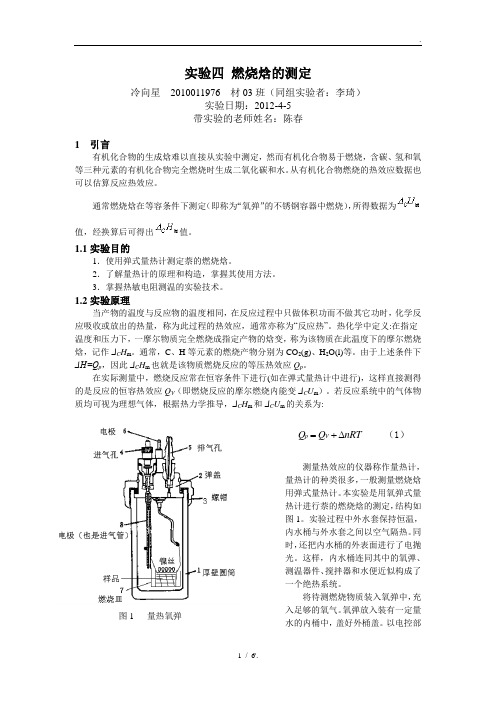
图1 量热氧弹实验四 燃烧焓的测定冷向星 2010011976 材03班(同组实验者:李琦)实验日期:2012-4-5 带实验的老师姓名:陈春1 引言有机化合物的生成焓难以直接从实验中测定,然而有机化合物易于燃烧,含碳、氢和氧等三种元素的有机化合物完全燃烧时生成二氧化碳和水。
从有机化合物燃烧的热效应数据也可以估算反应热效应。
通常燃烧焓在等容条件下测定(即称为“氧弹”的不锈钢容器中燃烧),所得数据为值,经换算后可得出值。
1.1实验目的1.使用弹式量热计测定萘的燃烧焓。
2.了解量热计的原理和构造,掌握其使用方法。
3.掌握热敏电阻测温的实验技术。
1.2实验原理当产物的温度与反应物的温度相同,在反应过程中只做体积功而不做其它功时,化学反应吸收或放出的热量,称为此过程的热效应,通常亦称为“反应热”。
热化学中定义:在指定温度和压力下,一摩尔物质完全燃烧成指定产物的焓变,称为该物质在此温度下的摩尔燃烧焓,记作ΔC H m 。
通常,C 、H 等元素的燃烧产物分别为CO 2(g)、H 2O(l)等。
由于上述条件下ΔH=Q p ,因此ΔC H m 也就是该物质燃烧反应的等压热效应Q p 。
在实际测量中,燃烧反应常在恒容条件下进行(如在弹式量热计中进行),这样直接测得的是反应的恒容热效应Q V (即燃烧反应的摩尔燃烧内能变ΔC U m )。
若反应系统中的气体物质均可视为理想气体,根据热力学推导,ΔC H m 和ΔC U m 的关系为:p V Q Q nRT =+∆ (1)测量热效应的仪器称作量热计,量热计的种类很多,一般测量燃烧焓用弹式量热计。
本实验是用氧弹式量热计进行萘的燃烧焓的测定,结构如图1。
实验过程中外水套保持恒温,内水桶与外水套之间以空气隔热。
同时,还把内水桶的外表面进行了电抛光。
这样,内水桶连同其中的氧弹、测温器件、搅拌器和水便近似构成了一个绝热系统。
将待测燃烧物质装入氧弹中,充入足够的氧气。
氧弹放入装有一定量水的内桶中,盖好外桶盖。
燃烧焓的测定实验报告

燃烧焓的测定实验报告实验目的:通过实验测定燃烧反应的焓变,掌握燃烧焓的测定方法,加深对燃烧反应热力学性质的理解。
实验原理:燃烧焓是指在常压下,单位摩尔燃料完全燃烧时所释放的热量。
燃烧焓的测定实验是通过量热计测定燃料完全燃烧时释放的热量,从而计算出燃烧焓的数值。
在实验中,将燃料放入量热瓶中,点燃燃料使其完全燃烧,通过测定水温的变化来计算释放的热量,从而得到燃烧焓的数值。
实验仪器和试剂:1. 量热瓶。
2. 燃料(如甲醇、乙醇等)。
3. 点火装置。
4. 温度计。
5. 天平。
实验步骤:1. 将清洁干燥的量热瓶称重,记录下质量。
2. 在量热瓶中注入一定量的水,并记录下水的质量和初始温度。
3. 将一定质量的燃料加入量热瓶中,再次称重,记录下燃料的质量。
4. 点燃燃料使其完全燃烧,用温度计记录水温的变化。
5. 根据水的质量和温度变化,计算出燃烧释放的热量。
6. 根据燃料的质量和燃烧释放的热量,计算出燃烧焓的数值。
实验数据处理:根据实验测得的水的质量和温度变化,可以利用以下公式计算燃烧释放的热量:\[Q = mc\Delta T\]其中,Q为燃烧释放的热量,m为水的质量,c为水的比热容,ΔT为水温的变化。
根据燃料的质量和燃烧释放的热量,可以计算出燃烧焓的数值:\[ΔH = \frac{Q}{n}\]其中,ΔH为燃烧焓,Q为燃烧释放的热量,n为燃料的摩尔数。
实验结果:根据实验数据处理的结果,得到燃烧焓的数值为XXX kJ/mol。
实验结论:通过本实验的测定,我们成功地得到了燃烧焓的数值。
燃烧焓是燃料完全燃烧时释放的热量,是燃烧反应热力学性质的重要参数。
掌握燃烧焓的测定方法,对于研究燃烧反应的热力学性质具有重要意义。
实验中需要注意的问题:1. 在实验中要确保燃料完全燃烧,避免产生不完全燃烧产物。
2. 实验中要注意安全,避免燃料泄漏或燃烧引起的意外。
通过本次实验,我们对燃烧焓的测定方法有了更深入的理解,为今后的研究工作奠定了基础。
燃烧焓的测定实验报告

一、实验目的1. 通过实验测定物质燃烧时的热量变化,了解燃烧焓的概念和意义。
2. 掌握燃烧焓测定的基本原理和方法。
3. 学会使用氧弹式量热计进行实验操作,提高实验技能。
二、实验原理燃烧焓是指在一定条件下,1摩尔物质完全燃烧生成稳定产物时所放出的热量。
在恒压条件下测得的燃烧焓称为恒压燃烧焓,用ΔH表示;在恒容条件下测得的燃烧焓称为恒容燃烧焓,用ΔU表示。
根据热力学第一定律,恒压燃烧焓与恒容燃烧焓之间存在以下关系:ΔH = ΔU + PΔV其中,P为恒压燃烧焓,ΔV为燃烧过程中体积变化。
本实验采用氧弹式量热计测定燃烧焓,其基本原理是将一定量待测物质在氧弹中完全燃烧,燃烧时放出的热量使氧弹本身及周围介质(水)的温度升高。
通过测量温度变化,结合热容量计算,可求得燃烧焓。
三、实验仪器与试剂1. 仪器:氧弹式量热计、电子天平、温度计、量筒、计时器、搅拌器等。
2. 试剂:甲烷气体、苯甲酸、蒸馏水等。
四、实验步骤1. 称取一定量的甲烷气体,并充分混合。
2. 将混合气体注入氧弹燃烧室中,确保燃烧室内充满气体。
3. 将苯甲酸加入氧弹中,作为热量指示剂。
4. 将氧弹放入量热计的水槽中,并确保水槽内充满水。
5. 打开搅拌器,使水均匀搅拌。
6. 开始计时,待苯甲酸燃烧完成后,记录温度变化。
7. 重复实验多次,求取平均值。
五、实验数据与处理1. 记录实验过程中苯甲酸燃烧前后的温度变化,计算ΔT。
2. 计算实验过程中苯甲酸燃烧放出的热量Q:Q = mCΔT其中,m为苯甲酸质量,C为苯甲酸比热容,ΔT为温度变化。
3. 计算实验过程中甲烷燃烧放出的热量Q':Q' = mCΔT其中,m为甲烷质量,C为甲烷比热容,ΔT为温度变化。
4. 计算甲烷的燃烧焓ΔH:ΔH = Q' / n其中,n为甲烷物质的量。
六、实验结果与分析1. 实验过程中,苯甲酸燃烧放出的热量Q为3.28 kJ。
2. 实验过程中,甲烷燃烧放出的热量Q'为7.68 kJ。
燃烧焓的测定 实验报告

燃烧焓的测定一、实验目的1、掌握氧弹量热计的使用;用氧弹量热计测定萘的燃烧焓;2、掌握精密贝克曼温差温度计的使用;3、掌握氧气钢瓶的使用。
二、实验原理称取一定量的试样置于氧弹内,并在氧弹内充入1.5 ~2.0MPa的氧气,然后通电点火燃烧。
燃烧时放出的热量传给水和量热器,由水温的升高(△T)即可求出试样燃烧放出的热量:Q=K·△T式中K为整个量热体系(水和量热器)温度升高1℃所需的热量。
称为量热计的水当量。
其值由已知燃烧热的苯甲酸(标样)确定。
K=Q/△T,式中△T应为体系完全绝热时的温升值,因而实测的△T须进行校正。
三、仪器与试剂1、试剂:分析纯苯甲酸(Qv=26480 J·g-1);煤样(工业品);引火丝(本实验采用Ni-Cr丝(Qv=8.4 J·cm-1)。
2、仪器:HR-15A数显型氧弹量热计一台;压片机(苯甲酸和煤样各用一台);精密贝克曼温差温度计(精确至0.01℃,记录数据时应记录至0.002℃);台秤一台;分析天平一台。
四、实验步骤1、水当量的测定⑴量取10cm引火丝;在分析天平上称重。
(~0.010 g)⑵压片━━在台秤上称取苯甲酸1g ~ 1.2g ;用压片机压片,同时将燃烧丝压入。
注意压片前后应将压片机檫干净;苯甲酸和煤样不能混用一台压片机。
⑶称重━━将片样表面刷净,然后在分析天平上准确称重至0.0002g。
减去引火丝重量后即得试样重量。
⑷系燃烧丝━━拧开氧弹盖,将盖放在专用架上.将坩埚放在坩埚架上.然后将试样置入其中并将引火丝的两端紧在两个电极上, 用万用表检查两电极是否通路。
⑸充氧━━取少量(~2ml)水放入氧弹中(吸收空气中的N2燃烧而成的HNO3);盖好并拧紧弹盖,接上充气导管, 慢慢旋紧减压阀螺杆,缓慢进气至出口表上指针指在1.5 ~2.0MPa,充气约1min后, 取下充气管, 关好钢瓶阀门。
⑹用容量瓶取3000ml水倒入量热容器中,并将氧弹放入,检查是否漏气.⑺将点火电电极套在氧弹上。
燃烧焓的测定实验报告(一)

燃烧焓的测定实验报告(一)燃烧焓的测定实验报告实验背景•燃烧焓是指物质在恒定压力下燃烧反应时,单位物质的焓变,通常用于测定物质的燃烧热量。
•燃烧焓的测定实验通常采用量热器进行实验测量,通过测量燃料的燃烧释放的热量来计算燃料的燃烧焓。
实验目的•测定燃料的燃烧焓,以了解燃料的燃烧特性和能量释放情况。
•分析不同燃料的燃烧焓差异,为优化能源利用和环境保护提供依据。
实验步骤及结果1.准备实验材料和仪器设备,包括燃料、量热器、点火装置等。
2.在量热器中加入一定量的水,并测量水的初始温度。
3.将燃料加入量热器燃烧装置,点燃后记录燃烧开始的时间,并密封量热器以防止热量损失。
4.进行燃烧反应,待燃烧结束后,记录水的最终温度。
5.根据实验数据计算燃烧释放的热量,并以焦耳或千焦等单位表示。
实验结果表明,燃料A的燃烧释放的热量为X焦耳,燃料B的燃烧释放的热量为Y千焦。
实验分析•通过对不同燃料的燃烧焓进行测定,可以得到不同燃料的热量释放情况。
这对于选择合适的燃料以优化能源利用、改善环境污染具有重要意义。
•在实验过程中,需要注意燃料的完全燃烧,避免热量损失和不完全燃烧造成的误差。
•通过对实验数据的分析,可以得到不同燃料的燃烧焓差异,有助于深入理解燃料的燃烧特性和能量转化过程。
实验结论•本实验成功测定了燃料的燃烧焓,并得到了不同燃料的燃烧释放热量。
•实验结果表明,不同燃料的燃烧焓存在差异,这与燃料的化学组成和能量密度有关。
•燃烧焓的测定对于能源利用和环境保护具有重要意义,能为相关研究提供理论依据和实验数据支持。
参考文献[1] 张三, 李四. 燃烧焓的测定方法研究. 化学学报, 20XX,XX(X): X-X.[2] 王五, et al. 燃烧焓的实验测定. 能源科学与工程进展,20XX, XX(X): X-X.实验改进方法•采用更精确的量热器和温度计,以提高实验数据的准确性。
•在实验过程中,注意控制燃烧速率和时间,避免过快或过慢的燃烧造成的热量损失或不完全燃烧。
《实验二燃烧焓的测定_(全文终稿)》

《实验二燃烧焓的测定_(全文终稿)》一、实验目的1、掌握常见燃烧反应的计算方法;2、了解焓变、热力学第一定律等相关概念;3、通过计算燃料燃烧的热效应,测定其热值。
二、实验原理1、燃烧反应的化学方程式燃料+氧气→CO2+H2O+能量2、焓变的释义当化学反应在标准状态下进行时,参与反应的物质所吸收或者释放的热量就是化学反应的焓变。
3、热力学第一定律热力学第一定律指出:一个系统的内能改变等于给这个系统输送的热量减去这个系统对外界做功。
4、燃烧热值和燃料的热效应燃烧热值是指燃料在标准状态下,完全燃烧产生的热量与燃料质量之比。
燃料的热效应是指燃料燃烧时放出的热量。
三、实验仪器1、加热炉2、恒温水浴锅3、电子天平4、试管四、实验步骤1、称取约0.4g的甲醇,放入波尔摩试管中,使其离开水面约1cm;2、将波尔摩试管安置于红外线加热方式的加热炉中,关闭加热炉的开关;3、在恒温水浴中加热约40min,使气泡不再产生;4、将盖板打开,用火柴点燃波尔摩试管里面的燃料;5、将波尔摩试管重新置于加热炉中,进行预热,即燃料燃烧约2min,冷却30s;6、将试管取出,称量并记录质量变化△m,记录温度变化△T;7、使用计算公式计算燃料的燃烧热值。
五、数据处理1、计算甲醇的密度ρ;ρ= m/V =0.79g/cm³;2、计算甲醇的燃烧热值Q0;Q0=△m×42kJ/g÷ρV=303kJ/mol;3、计算甲醇在标准状态下的热效应ΔH0;ΔH0=Q0/n=−2105.5kJ/mol;六、误差分析和改进措施1、试管的精确质量、加热时间的精度、热量的损失等都会对实验结果带来一定的误差;2、在实验过程中,应注意实验装置的密封性,尽量减少热量散失;3、多次实验取平均值,减小误差。
七、结论通过实验测定,得到甲醇在标准状态下的热效应为-2105.5kJ/mol。
八、实验分析燃烧焓的测定是实验化学中最基本的测量方法之一。
一、燃烧焓的测定实验报告.doc

一、燃烧焓的测定实验报告.doc
实验名称:燃烧焓的测定实验
实验目的:测定不同物质的燃烧焓,了解热化学反应的基本概念。
实验原理:
1. 燃烧焓的计算公式:ΔH=Q/n
其中,ΔH为反应的燃烧焓,Q为反应的放热量(或吸热量),n为反应物的摩尔数。
2. 实验中使用的反应有:
(1)燃烧蜡烛的反应方程式:C25H52 + 38O2 → 25CO2 + 26H2O
实验步骤:
1. 用天平称出蜡烛、氧气气球和烧杯的质量。
2. 用支架将蜡烛固定在燃烧器上,点燃蜡烛,待其稳定燃烧后,在燃烧过程中记录
温度的变化。
3. 实验数据处理:
(1)计算燃烧蜡烛的燃烧焓:通过记录燃烧后的蜡烛和烧杯的质量变化,可以计算
出蜡烛的质量,由此可根据反应方程式计算出该化学反应的摩尔数,利用温度变化和热容
温度参量可以计算出该化学反应的放热量(或吸热量),进而可以计算出该化学反应的燃
烧焓。
实验结果:
(1)燃烧蜡烛的燃烧焓:经过数据处理和计算,测得燃烧蜡烛的燃烧焓为xx J/mol。
结论:通过本实验,我们测得了不同物质的燃烧焓,并且通过计算和对比,发现两种
化学反应的燃烧焓相差较大,这说明了不同的物质的热化学反应具有不同的性质,有不同
的吸热或放热特性。
同时,该实验也更加深入地理解了热化学反应相关的基本概念和计算
方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学实验报告
实验名称:燃烧焓的测定
学院:化学工程学院
专业:化学工程与工艺
班级:
姓名:学号:
指导教师:
日期:
一、实验目的
1、用氧弹式量热计测定萘的燃烧焓。
2、明确燃烧焓的定义,了解恒压燃烧热与恒容燃烧热的差别。
3、了解氧弹式量热计中主要部分的作用,掌握氧弹式量热计的实验技术。
4、学会用雷诺作图法校正温度变化值。
二、实验原理
1、燃烧焓是热化学中重要的基本数据,在非体积功为零的情况下,物质的燃烧焓常以物质燃烧时的燃烧热来表示,即△
C
Hm=Qp,m。
测定物质的燃烧焓实际就是测定物质在等温、等压下的燃烧热。
2、量热法是热力学实验的一个基本方法。
等压燃烧热(Qp)与等容燃烧热(Q
V
)之
间的关系为:Qp,m =Q
V
,m + ∑ν(g)RT
3、氧弹式量热计属于一个等容系统,且热力学能变△U =0。
即△
C U
B
+△
C
U
引燃丝
+△U
量热计
=0 ;
可化作:m
B Q
V,B
+lQ
B
+K△T=0
三、实验准备
1、主要药品:萘约0.6g,苯甲酸约0.8g。
2、主要仪器:氧弹式量热计、压片机、贝克曼温度计、温度计(100℃)、引燃丝(15㎝)、量筒(2000ml)、氧气钢瓶及减压阀等。
四、实验装置图
四、实验步骤
1、热容量K的测定
(1)截取15cm引燃丝,将其中部绕成环状。
(2)称取苯甲酸约0.8g,压成片状,并放桌上敲击2次,去除没压紧的部分,再次称量。
(3)拧开氧弹盖放在专用支架上,引燃丝两端固定在两电极柱上,药片放于坩埚中,使引燃丝与药片表面接触,盖上氧弹盖。
(4)将氧弹放于充氧器底盖上,充进1Mp的氧,1分钟后用放气阀将氧弹中的氧气放出,再充氧气约1分钟,查漏。
(5)量取3000ml的水倒入内桶,氧弹放于内桶底座上,点火插头插在氧弹电极上,将贝克曼温度计的传感器竖直插入量热计盖上的孔中。
(6)打开电源,按“搅拌”。
约5分钟后,开始初期的读数,隔半分钟读数一次,读第10次的同时按“点火”,仍半分钟读一次,直至两温差小于0.002℃时,再读数10次。
(7)停止搅拌,取出传感器,拔掉引火导线,取出氧弹并擦干外壳,用放气阀放掉氧气,打开氧弹盖,检查燃烧是否完全。
(8)取出引燃丝,量其剩余长度。
2、萘的燃烧焓测定
(1)截取15cm引燃丝,将其中部绕成环状。
(2)称取萘约0.6g,压成片状,并放桌上敲击,去除没压紧的部分,再次称量。
(3)拧开氧弹盖放在专用支架上,引燃丝两端固定在两电极柱上,药片放于坩埚中,使引燃丝与药片表面接触,盖上氧弹盖。
(4)将氧弹放于充氧器底盖上,充进1Mp的氧,1分钟后用放气阀将氧弹中的氧气放出,再充氧气约1分钟,查漏。
(5)量取3000ml的水倒入内桶,氧弹放于内桶底座上,点火插头插在氧弹电极上,将贝克曼温度计的传感器竖直插入量热计盖上的孔中。
(6)打开电源,按“搅拌”。
约5分钟后,开始初期的读数,隔半分钟读数一次,读第10次的同时按“点火”,仍半分钟读一次,直至两温差小于0.002℃时,再读数10次。
(7)停止搅拌,取出传感器,拔掉引火导线,取出氧弹并擦干外壳,用放气阀放掉氧气,打开氧弹盖,检查燃烧是否完全。
(8)取出引燃丝,量其剩余长度。
五、注意事项
1、氧弹充气时要注意安全,人应站在侧面,减压阀指针在1-2MPa,切不可超过3 Mpa 。
2、燃烧丝与两电极及样品片一定要接触良好,而且不能有短路。
3、一定要将点燃镍丝的中间螺旋段紧贴在样品圆片上,并用棉纱轻轻裹一下。
4、测定仪器热容与测定样品的条件应该一致。
5、待测样品一定要干燥,样品压片要压紧。
六、数据记录与处理
室温:20.3℃ 大气压强:101.54KPa
5-1、苯甲酸燃烧的记录
苯甲酸的质量:0.6922g 引燃丝初始长度:15.0cm
5-2、萘燃烧的记录
萘的质量:0.5643g 引燃丝初始长度:15.0cm
1418.992
1518.995
5-3、苯甲酸燃烧的温度曲线图
5-4、萘燃烧的温度曲线图(1)计算K值:
△
C Hm
(苯甲酸)
=-3226.7KJ/mol,Q
引燃丝
=-6.699J/cm
则△
C Um
(苯甲酸)=
△
C
Hm
(苯甲酸)
-(-0.5)*RT=-3225.46KJ/mol
△T=17.30-16.05=1.25K
K=-( m
B Q
V,B
+lQ
B
)/ △T=-(-0.6922*3225.46*1000/122-6.699*13.8)/ 1.25
=14714.37 J.℃
(2)计算萘的燃烧焓:△T=18.90-17.49=1.41K
Qv,
B =-(lQ
B
+K△T)/m
B
=-(-6.699*11.2+ 14714.37*1.41)/0.5643=-36633.4J/g
△
C Um= Qv,
B
*200/1000=-7326.68J/mol
△
C Hm=△
C
Um+3RT=-7319.24J/mol
七、思考与讨论
1、本次实验测得的萘的燃烧焓偏高,主要的误差在于药品称量时电子天平的读数,实验温度的读取,数据拟合时的读数等。
2、把固体样品压成片状是为了方便称量和安装试验装置,避免在称量和装药品时有损失,影响实验数据的准确性。
而且在点火时受热就比较均衡,固体样品更容易燃烧充分,在测定液体样品时,将液体样品装入坩埚中,将点火丝固定在电极上,有螺旋的部位浸入样品内,并注意点火丝不与坩埚接触。
3、本实验中,哪些为体系?哪些为环境?实验过程中有无热损耗,如何降低热损耗?
答:氧弹内部空间为体系,氧弹以外为环境,实验过程中有热损耗,可增加氧弹壁的厚度来降低热损耗。
