20132017高考真题电化学
(浙江选考)2017高考化学 第17题 原电池

第17题:原电池满分:70分1.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。
下列有关氢氧燃料电池的说法不正确的是A. 该装置将化学能转化为电能B. 为了增加灯泡亮度,可以将电极碳棒变得多粗糙多孔C. 电子迁移方向:电极a →灯泡→电极b →电解质溶液→电极aD. 该电池的总反应:2H 2+O 2=2H 2O2.某实验小组依据反应设计如图原电池,探究pH 对AsO 43-氧化性的影响。
测得电压与pH 的关系如图。
下列有关叙述错误的是A .调节pH 可以改变反应的方向B.pH = 0.68时,反应处于平衡状态C .pH = 5时,负极电极反应式为2I --2e - =I 2D .pH >0.68时,氧化性I 2〉AsO 43-3.下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO 34-+2I -+2H +AsO 33-+I 2+H 2O ”设计成的原电池装置,其中C 1、C 2均为碳棒。
甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB 烧杯中逐滴加入适量40% NaOH 溶液。
下列叙述中正确的是A .甲组操作时,电流计(G)指针发生偏转B .甲组操作时,溶液颜色变浅C .乙组操作时,C 2做正极D .乙组操作时,C 1上发生的电极反应为I 2+2e -===2I -4.截止到2013年12月末,中国光伏发电新增装机容量达到10.66GW ,光伏发电累计装机容量达到17.16GW,图为光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。
下列叙述中正确的是A.N型半导体为正极,P型半导体为负极B.制氢装置溶液中电子流向:从B极流向A极C.X2为氧气D.工作时,A极的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O5.热激活电池可用作火箭、导弹的工作电源。
一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl—KCl混合物受热熔融后,电池即可瞬间输出电能。
专题17 电化学原理综合应用—三年高考(2015-2017)化学真题分项版解析(原卷版)
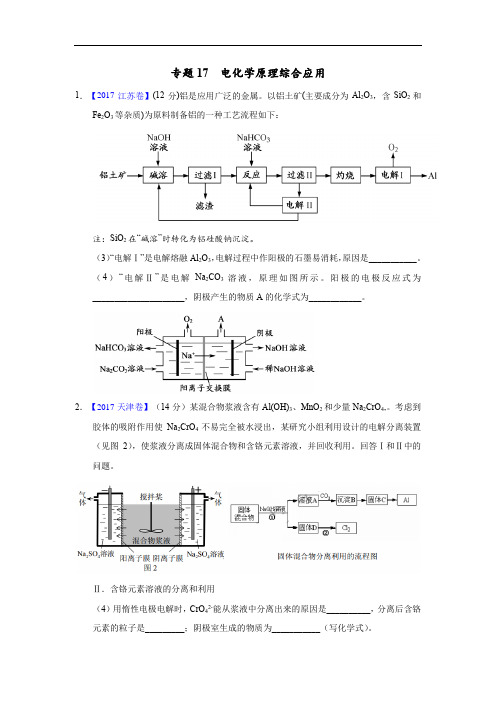
专题17电化学原理综合应用1.【2017江苏卷】(12分)铝是应用广泛的金属。
以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。
阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
2.【2017天津卷】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。
考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
回答Ⅰ和Ⅱ中的问题。
Ⅱ.含铬元素溶液的分离和利用(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
3.【2016新课标1卷】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:回答下列问题:(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
“电解”中阴极反应的主要产物是______。
4.【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:pH=4.5时,NO3—的去除率低。
其原因是________。
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
(word完整版)高考真题电化学

2013-2017高考电化学真题1.【2017 新课标 1 卷】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。
下列有关表述不正确的是()A.通入保护电流使钢管桩表面腐蚀电流接近于零B.通电后外电路电子被强制从高硅铸铁流向钢管桩C.高硅铸铁的作用是作为损耗阳极材料和传递电流D.通入的保护电流应该根据环境条件变化进行调整2.【2017 新课标 2 卷】用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。
下列叙述错误的是A.待加工铝质工件为阳极B.可选用不锈钢网作为阴极C.阴极的电极反应式为: Al3++ 3e-== AlD.硫酸根离子在电解过程中向阳极移动3.【2017 新课标 3 卷】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a 常用掺有石墨烯的 S8材料,电池反应为:16Li+x S8=8Li2S x(2≤x≤8)。
下列说法错误的是()A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4B.电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 gC.石墨烯的作用主要是提高电极 a 的导电性D.电池充电时间越长,电池中 Li2S2的量越多4.【2017海南10】一种电化学制备NH 3的装置如图所示,图中陶瓷在高温时可以传输H+.下列叙述错误的是()A.Pb电极b为阴极B.阴极的反应式为:N2+6H++6e﹣=2NH3C.H+由阳极向阴极迁移D.陶瓷可以隔离N2和H25.【2017 北京11】(16分)某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下:向硝酸酸化的0.05mol•L﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.(1)检验产物①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有.(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是(用离子方程式表示).针对两种观点继续实验:①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:序号取样时间/min 现象ⅰ 3 产生大量白色沉淀;溶液呈红色ⅱ30 产生白色沉淀;较3min时量小;溶液红色较3min时加深ⅲ120 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅(资料:Ag+与SCN﹣生成白色沉淀AgSCN)②对Fe3+产生的原因作出如下假设:假设a:可能是铁粉表面有氧化层,能产生Fe3+;假设b:空气中存在O2,由于(用离子方程式表示),可产生Fe3+;假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;假设d:根据现象,判断溶液中存在Ag+,可产生Fe3+.③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,3 0min后溶液几乎无色.实验Ⅱ:装置如图.其中甲溶液是,操作现象是.(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:.6.【2017江苏16】 (12分)铝是应用广泛的金属。
2013年高考试题汇编:考点09 电化学

2013年高考试题汇编:考点9——电化学试题1.(2013·北京理综·7)下列金属防腐的措施中,属外加电流的阴极保护法的是A.水中的钢闸门连接电源的负极B.金属护拦表面涂漆C.汽水底盘喷涂高分子膜D.地下钢管连接镁块2.(2013·北京理综·9)用石墨电极电解CuCl2溶液(见右图)。
下列分析正确的是A.a端是直流电源的负极B.通电使CuCl2发生电离C.阳极上发生的反应:Cu2++2e-=CuD.通电一段时间后,在阴极附近观察到黄绿色气体3.(2013·新课标卷Ⅱ·11)“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。
下列关于该电池的叙述错误..的是A.电池反应中有NaCl生成B.电池的总反应是金属钠还原三个铝离子C.正极反应为:NiCl2+2e-=Ni+2Cl-D.钠离子通过钠离子导体在两电极间移动4.(2013·天津化学·6)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。
其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l) 电解池:2Al+3H2O Al2O3+3H2电解过程中,以下判断正确的是5.(所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。
该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb。
下列有关说法正确的是A.正极反应式:Ca+2Cl--2e-=CaCl2B.放电过程中,Li+向负极移动C.每转移0.1mol电子,理论上生成20.7gPbD.常温时,在正负极间接上电流表或检流计,指针不偏转6.(2013·新课标卷I·10)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。
2017年高考中的《电化学》考题分析与解题方法

殷列 ㊀ 王春艳
通入保护电流使钢管桩表面腐蚀电流接近于零 A. 通电后外电路电子被强制从高硅铸铁流向钢管桩 B. 高硅铸铁的作用是作为损耗阳极材料和传递电流 C. 通入的保护电流应该根据环境条件变化进行调整 D. 解析 : 本题考查金属的腐蚀和防 护 . 金 属 防 腐 的 电 化 学 方法有牺牲 阳 极 的 阴 极 保 护 法 和 外 加 电 源 的 阴 极 保 护 法 . 本题考察的是外加电流的阴极保护法 , 指的是被保护金属和 电源的负极相连 , 另一 块 能 导 电 的 惰 性 材 料 接 电 源 正 极, 通 电后 , 使金属表面产 生 负 电 荷 的 聚 集 , 因而抑制了金属失电 子而达到保护 目 的 .A. 通 电 后, 使钢管桩表面产生负电荷 的聚 集 , 因 而 抑 制 了 金 属 失 电 子 而 达 到 保 护 目 的, 故A正 确; 在电解池中电子的流向 : 电子从电源负极出发 , 流向阴 B. 极, 再从阳极出发回到电源正极 . 本题 被 保 护 的 钢 管 柱 作 阴 极, 高硅铸铁作阳极 , 故 B 正确 ; 在电 解 池 中, 活性电极直 C. 接失电子发生氧化反应 , 而惰性电极则是 电 解 质 溶 液 中 阴 离 子放电 . 高硅铸铁 为 惰 性 辅 助 阳 极 , 所 以 高 硅 铸 铁 不 损 耗, 故 C 错误 ; 外加电流要抑制金 属 电 化 学 腐 蚀 产 生 的 电 流 , D. 故 D 正确 . 故选 C. ( ) 用电解法可以在铝制品 2. 2 0 1 7 新课标全国卷 Ⅱ ������1 1 表 面 形 成 致 密㊁ 耐 腐 蚀 的 氧 化 膜, 电解质溶液一般为 , ( 混合溶液 下列叙述错误的是 H2S O H C O ㊀㊀ ) 4 2 2 4 待加工铝制工件为阳极 A. 可选用不锈钢网作为阴极 B. 3+ - 阴极的电极反应方程式为 : C. A l +3 e l ������������A 硫酸根离子在电解过程中向阳极移动 D. 解析: 本 题 考 察 电 解 池 的 阴 阳 极 判 断㊁ 电极反应及其离 子移动方向 . 由题 意 知 , 在 铝 制 品 表 面 形 成 氧 化 膜, 则铝作 - 3+ , 为电解池的阳极 , 铝 是 活 性 电 极, 可选用 A l -3 e l ������������A 不锈钢网作为阴极 , 阴 极 为 电 解 质 溶 液 中 的 阳 离 子 放 电, 故 - 在电解池中阴离子移 2 H+ +2 e ������������H2 ʏ . 为了平 衡 电 荷 , 向阳极 , 阳离子移向阴极 . 故选 C.
阿伏加德罗常数

阿伏加德罗常数1.【2017高考全国卷II】阿伏加德罗常数的值为N A。
下列说法正确的是A.1 L 0.1 mol·L-1NH4Cl溶液中,的数量为0.1N AB.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1N AC.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2N AD.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2N A【答案】D【解析】本题考查阿伏加德罗常数的运用。
H2与I2的反应虽为可逆反应,但由于反应前后气体总物质的量不变,因此无论反应程度如何,分子总数均为0.2N A,D项正确。
溶液中含0.1 mol NH4Cl,由于NH4+部分水解,即NH4+的数量少于0.1N A,A项错误;2.4 g Mg为0.1 mol,与H2SO4完全反应转移0.2 mol电子,B项错误;标准状况下,2.24 L N2和O2的混合气体为0.1 mol,其分子数为0.1N A,C项错误。
2.【2017高考全国卷III】N A为阿伏加德罗常数的值。
下列说法正确的是A.0.1 mol的11B中,含有0.6N A个中子B.pH=1的H3PO4溶液中,含有0.1N A个H+C.2.24 L(标准状况)苯在O2中完全燃烧,得到0.6N A个CO2分子D.密闭容器中1 mol PCl3与1 mol Cl2反应制备PCl5(g),增加2N A个P—Cl键【答案】A【解析】本题考查阿伏加德罗常数的应用。
1个11B原子中含有6个中子,0.1 mol 11B中含有0.6N A个中子,A项正确。
H3PO4溶液的体积未知,所以不能计算出所含氢离子个数,B 项错误;标准状况下苯是液体,不能利用标准状况下的气体摩尔体积计算 2.24 L 苯在O2中完全燃烧产生CO2分子的数目,C项错误;PCl3与Cl2生成PCl5的反应是可逆反应,所以1 mol PCl3与1 mol Cl2不可能完全反应,生成的PCl5小于1 mol,故增加的P—Cl键的数目小于2N A,D项错误。
2013年电化学高考真题
答案:CBiblioteka 答案:B答案:C答案:D
答案:B
答案:D
答案:B
金属活动顺序表:Li、 CS、 Rb、 K、 Ra 、Ba 、Sr、 Ca、 Na 、Ac、 La、 Ce、 Pr 、Nd 、Pm、Sm 、Eu 、 Gd 、Tb 、Y 、Mg 、Am、 Dy 、Ho、 Er 、Tm 、 Yb、 Lu 、(H)、 Sc、 Pu 、Th 、Np 、Be、Uv、 Hf 、 Al 、Ti 、Zr 、V 、Mn、 Sm、 Nb、 Zn、 Cr 、Ga 、 Fe 、Cd 、In 、Tl 、Co、Ni、 Mo、 Sn 、Tm 、Pb 、 (H2)、 Cu、 Tc、 Po、 Hg 、Ag、 Rh 、Pd 、Pt 、Au
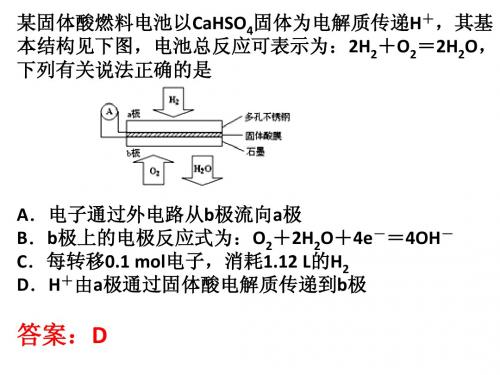
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基 本结构见下图,电池总反应可表示为:2H2+O2=2H2O, 下列有关说法正确的是
A.电子通过外电路从b极流向a极 B.b极上的电极反应式为:O2+2H2O+4e-=4OH- C.每转移0.1 mol电子,消耗1.12 L的H2 D.H+由a极通过固体酸电解质传递到b极
答案:D
右图是一种航天器能量储存系统原理示意图。下列说法 正确的是 A.该系统中只存在3种形式的能量转化 B.装置Y中负极的电极反应式为: 2 +2H2O+4e 4OH O C.装置X能实现燃料电池的燃料和氧化剂再生 D.装置X、Y形成的子系统能实现物质的零排放,并 能实现化学能与电能间的完全转化
金属活动顺序表: 锂、铯、铷、钾、镭、钡、锶、钙、钠、锕、镧、铈、 镨、钕、钷、钐、铕、钆、铽、钇、镁、镅、镝、钬、 铒、铥、镱、镥、钪、钚、钍、镎、铍、铀、铪、铝、 钛、锆、钒、锰、钐、铌、锌、铬、镓、铁、镉、铟、 铊、钴、镍、钼、锡、铥、铅、铜、锝、钋、汞、银、 铑、钯、铂、金
2013高考试题电化学汇编

1、福建 ②电化学法该法制氢过程的示意图如右。
反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 。
反应后的溶液进入电解池,电解总反应的离子方程式为 。
2、新课标1 某锂离子电池正极材料有钴酸锂(LiCoO 2)、导电剂乙炔黑和铝箔等。
充电时,该锂离子电池负极发生的反应为6C+xLi ++xe -==Li x C 6。
(5)充放电过程中,发生LiCoO 2与Li x CoO 2之间的转化,写出放电时电池反应方程式___________________。
3、(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93kW ·h ·kg -1)。
若电解质为酸性,二甲醚直接燃料电池的负极反应为 。
4.新课标11 “ZEBRA ”蓄电池的结构如图所示,电极材料多孔Ni/NiCl 2和金属钠之间由钠离子导体制作的陶瓷管相隔。
下列关于该电池的叙述错误..的是A. 电池反应中有NaCl 生成B. 电池的总反应是金属钠还原三价铝离子C. 正极反应为:NiCl 2 + 2e - = Ni + 2Cl -D. 钠离子通过钠离子导体在两电极间移动5北京.下列金属防腐的措施中,使用外加电流的阴极保护法的是A.水中的钢闸门连接电源的负极B.金属护拦表面涂漆C.汽水底盘喷涂高分子D.地下钢管连接镁块6、北京。
通过NO x 传感器可监测NO x 的含量,其工作原理示意图如下:①Pt 电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO 电极的电极反应式: .7、全国 电解法处理酸性含铬废水(主要含有Cr 2O 72-)时,以铁板作阴、阳极,处理过程中存在反应Cr 2O 72+6Fe 2++14H +2Cr 3++6Fe 3++7H 2O ,最后Cr 3+以Cr(OH)3形式除去,下列说法不正确的是A.阳极反应为Fe -2e -Fe 2+ B.电解过程中溶液pH 不会变化C.过程中有Fe(OH)3沉淀生成 D.电路中每转移12 mol 电子,最多有1 mol Cr 2O 72-被还原8.[13.浙]电解装置如图所示,电解槽内装有KI 淀粉溶液,中间用阴离子交换膜隔开。
2017年高考化学——电化学高考试题

2017年高考化学——电化学高考试题2017年高考化学——电化学高考试题1.微生物电池是一种将化学能转化为电能的装置,其工作原理如图所示。
以下哪种说法是错误的?A.正极反应中有CO2生成B.微生物促进了反应中电子的转移C.质子通过交换膜从负极区移向正极区D.电池总反应为C6H12O6+6O2=6CO2+6H2O2.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。
以下哪种说法是正确的?A.铜电极上发生氧化反应B.电池工作一段时间后,甲池的c(SO42-)减小C.电池工作一段时间后,乙池溶液的总质量增加D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡3.一种熔融碳酸盐燃料电池原理示意如图。
以下哪种说法是正确的?A.反应电解CH4+H2O催化剂3H2+CO,每消耗通电△B.电极A上H2参与的电极反应为:H2+2OH-→2H2O+2e-C.电池工作时,CO32-向电极B移动,1molCH4转移12mol电子D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-4.研究电化学腐蚀及防护的装置如右图所示。
以下哪种说法是错误的?A.d为石墨,铁片腐蚀加快B.d为石墨,石墨上电极反应为:O2+2H2O+4e→4OH- C.d为锌块,铁片不易被腐蚀D.d为锌块,铁片上电极反应为:2H++2e→H2↑5.在固态金属氧化物电解池中,高温电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。
以下哪种说法是不正确的?A.X是电源的负极B.阴极的反应式是:H2O+2e-→H2+O2-,CO2+2e-→CO+O2-C.总反应可表示为:H2O+CO2→H2+CO+O2D.阴、阳两极生成的气体的物质的量之比是1︰16.用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,……(缺少内容,不完整,删除)阳极产生的ClO-可以氧化CN-。
以下说法正确的是()A。
三年高考(2015-2017)化学试题分项版解析专题17 电化学原理综合应用

【三年高考】(2015-2017)化学试题分项版解析1.【2017江苏卷】(12分)铝是应用广泛的金属。
以铝土矿 (主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。
阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
【答案】(3)石墨电极被阳极上产生的O2氧化(4)4CO32-+2H2O−4e−=4HCO3-+O2↑ H22.【2017天津卷】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。
考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
回答Ⅰ和Ⅱ中的问题。
Ⅱ.含铬元素溶液的分离和利用(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
【答案】(4)在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液CrO42-和Cr2O72- NaOH和H23.【2016新课标1卷】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:回答下列问题:(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
“电解”中阴极反应的主要产物是______。
【答案】(3)NaOH溶液;Na2CO3溶液;ClO2−(或NaClO2);【解析】(3)食盐溶液中混有Mg2+和Ca2+,可利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;向NaCl 溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;4.【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
三年高考(2015-2017)化学试题分项版解析专题17 电化学原理综合应用

【三年高考】(2015-2017)化学试题分项版解析1.【2017江苏卷】(12分)铝是应用广泛的金属。
以铝土矿 (主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。
阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
【答案】(3)石墨电极被阳极上产生的O2氧化(4)4CO32-+2H2O−4e−=4HCO3-+O2↑ H22.【2017天津卷】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。
考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
回答Ⅰ和Ⅱ中的问题。
Ⅱ.含铬元素溶液的分离和利用(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
【答案】(4)在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液CrO42-和Cr2O72- NaOH和H23.【2016新课标1卷】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:回答下列问题:(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
“电解”中阴极反应的主要产物是______。
【答案】(3)NaOH溶液;Na2CO3溶液;ClO2−(或NaClO2);【解析】(3)食盐溶液中混有Mg2+和Ca2+,可利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;4.【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
专题八 电化学原理(13年高考真题56张)PPT课件

探 响 : ① 中 性 溶 液 反 应 物 中 若 是 H+得 电 子 或 OH-失 电
究 子 , H+和 OH-均 来 自 于 水 的 电 离 , 但 生 成 物 中 可 能 有 H
+和
OH-; ② 酸 性 溶 液 反 应 物 、 生 成 物 中 均 无 OH-; ③
碱 性 溶 液 反 应 物 、 生 成 物 中 均 无 H+; ④ 水 溶 液 中 不 能
山东卷T15,江 苏卷T20,北京 卷T26,天津卷
T10
新课标全国卷 ⅡT11,海南卷 T6,广东卷T12
山东卷T28,浙 江卷T10,北京 卷T25,海南卷
T3
山东卷T13,广 东卷T7,安徽卷 T11,天津卷T7 ,福建卷T9、
T24,
2013
新课标全国卷 ⅡT11,新课
标全国卷 ⅠT10、28, 四川卷T11, 山东卷T28,
返回目录7
高考真题再现
[高考指南] 分析近几年新课标高考试题,发现电化学原理为 每年的必考内容,一般结合能源与环保问题、以新型 电池为依托,考查电化学的基础知识,题型既有选择 题,也有非选择题,选择题中主要考查原电池以及电 解池的工作原理,如电极判断、电极产物的判断、电 子或离子流向、溶液pH的判断等;而非选择题中主要 考查电极反应式的书写与有关计算等。
出 现 O 2-。
返回目录13
专题八 电化学原理
高
频 2.有关电解池解题的一般思路
考 点 探 究
返回目录14
专题八 电化学原理
高
频
(1)确定阴阳极的方法
考
点
探
究
返回目录15
专题八 电化学原理
高
频
(2)电极反应式的书写步骤及方法
2013-2018高考化学试题分类解析:专题12 电化学基本原理 Word版含解析

姓名,年级:时间:专题12 电化学基本原理2018年化学高考题1. (2018全国Ⅱ理综,12,6分)我国科学家研发了一种室温下“可呼吸"的Na-CO2二次电池。
将NaClO4溶于有机溶剂作为电解液,钠和负载碳钠米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。
下列说法错误的是A.[ZK(#]放电时,ClO4-向负极移动B。
充电时释放CO2,放电时吸收CO2C。
放电时,正极反应为:3CO2+4e-2CO32-+CD.充电时,正极反应为:Na++e—Na1。
D 本题考查化学电源.结合总反应式和题图可知,该电池放电时Na为负极,Ni为正极。
Na-CO2二次电池放电时为原电池,充电时为电解池。
结合总反应进行分析作答.电池放电时,ClO4—向负极移动,A项正确;结合总反应可知放电时需吸收CO,而充电时释放出CO2,B项正确;放2电时,正极CO2得电子被还原生成单质C,即电极反应式为3CO2+4e—===2CO32-+C,C项正确;充电时阳极发生氧化反应,即C被氧化生成CO2,D项错误.2。
(2018全国Ⅲ理综,11,6分)一种可充电锂—空气电池如图所示。
当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。
下列说法正确的是A。
放电时,多孔碳材料电极为负极B.放电时,外电路电子由多孔碳材料电极流向锂电极C。
充电时,电解质溶液中Li+向多孔碳材料区迁移D.充电时,电池总反应为Li2O2-x2Li+ O22. D 本题考查原电池和电解池知识,意在考查考生对电化学知识的运用能力。
根据电池工作原理,多孔碳材料吸附O2,O2在此获得电子,所以多孔碳材料电极为电池的正极,A项错误;放电时电子从负极(锂电极)流出,通过外电路流向正极(多孔碳材料电极),B项错误;Li+带正电荷,充电时,应该向电解池的阴极(锂电极)迁移,C项错误;充电时,电池总反应为Li2O x2-===2Li +(1- 12)O2,D项正确。
专题17 电化学原理综合应用-三年高考(2015-2017)化学试题分项版解析 Word版含解析

1.【2017江苏卷】(12分)铝是应用广泛的金属。
以铝土矿 (主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。
阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
【答案】(3)石墨电极被阳极上产生的O2氧化(4)4CO32-+2H2O−4e−=4HCO3-+O2↑ H22.【2017天津卷】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。
考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
回答Ⅰ和Ⅱ中的问题。
Ⅱ.含铬元素溶液的分离和利用(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
【答案】(4)在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液CrO42-和Cr2O72- NaOH和H23.【2016新课标1卷】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:回答下列问题:(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
“电解”中阴极反应的主要产物是______。
【答案】(3)NaOH溶液;Na2CO3溶液;ClO2−(或NaClO2);【解析】(3)食盐溶液中混有Mg2+和Ca2+,可利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;4.【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
2013年高考电化学试题归类分析

2013年高考电化学试题归类分析王波电化学包括原电池、电解池、金属的腐蚀和防护三部分内容,分析2013年全国各省市高考试题,电化学是考查的热点,考查内容全面,考查形式灵活,现对主要考点进行归纳,并结合典型试题进行分析。
一、考查原电池的原理原电池的工作原理主要涉及装置的能量转化、电极上的氧化还原反应、电路中电子电流方向、电解质溶液中阴阳离子的移动方向等内容。
例1(2013·江苏化学卷·9)Mg-H2O2电池可用于驱动无人驾驶的潜航器。
该电池以海水为电解质溶液,示意图如下。
该电池工作时,下列说法正确的是A.Mg电极是该电池的正极B.H2O2在石墨电极上发生氧化反应C.石墨电极附近溶液的pH增大D.溶液中Cl-向正极移动解析:该电池的两个电极为Mg、石墨,Mg比石墨活泼,Mg电极作负极,A项错误;石墨电极作正极,H2O2在石墨电极上发生还原反应,B项错误;石墨电极上电极反应为:H2O2+2e-=2OH-,电极附近溶液pH增大,C项正确;溶液中Cl-向负极移动,D项错误。
答案:C二、考查原电池的设计原电池的设计思路关键是确定原电池的正、负极材料和电解质溶液。
负极:反应中失去电子的金属单质;正极:选取活泼性比负极弱的金属或石墨;电解质溶液:选取反应中含阳离子的电解质溶液。
例2(2013·广东理综卷·33)能量之间可相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池是将化学能转化为电能,设计两种类型的原电池,探究其能量转化的效率限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线.①完成原电池甲的装置示意图,并作相应的标注。
要求:在同一烧杯中,电极与溶液含有相同的金属元素②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可以观察到负极。
③甲乙两种原电池中可更有效地将化学能转化为电能的是,其原因是。
2013高考试题《氧化还原及电化学》试题汇编

(1)2013·新课标全国卷Ⅰ10.【考查】电化学只是在生活中的应用银质器皿日久表面会逐渐变黑,这是生成了Ag 2S 的缘故。
根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。
下列说法正确的是( )A .处理过程中银器一直保持恒重B .银器为正极,Ag 2S 被还原生成单质银C .该过程中总反应为2Al +3Ag 2S===6Ag +Al 2S 3D .黑色褪去的原因是黑色Ag 2S 转化为白色AgCl10.B [解析] 负极反应为2Al -6e -===2Al 3+;正极反应为3Ag 2S +6e -===6Ag +3S 2-。
溶液中的Al 3+与S 2-进一步发生反应2Al 3++3S 2-+6H 2O===2Al(OH)3↓+3H 2S ↑,故总反应为3Ag 2S +2Al +6H 2O===6Ag +2Al(OH)3↓+3H 2S ↑,C 项错误;由总反应式可知Ag 2S 转化为Ag ,银器质量减轻,A 项错误;黑色褪去说明Ag 2S 转化为Ag ,D 项错误;银器为正极,Ag 2S 被还原为Ag ,B 项正确。
28. 第5问 【考查】电化学方程式的书写及有关计算(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg -1)。
若电解质为酸性,二甲醚直接燃料电池的负极反应为_____________________________________________________,一个二甲醚分子经过电化学氧化,可以产生_____个电子的电量;该电池的理论输出电压为1.20 V ,能量密度E =____________________________(列式计算。
能量密度=电池输出电能燃料质量,1 kW·h =3.6×106 J)。
[答案及解析](5)CH 3OCH 3+3H 2O -12e -===2CO 2+12H +121.20 V ×1000 g46 g ·mol -1×12×96 500 C ·mol -11 kg÷(3.6×106 J ·kW -1·h -1)=8.39 kW·h·kg -1(5)正极反应为O 2+4e -+4H +===2H 2O ;负极反应必有H +生成,由电荷守恒、元素守恒得3H 2O +CH 3OCH 3-12e -===2CO 2+12H +;1个CH 3OCH 3分子失去12e -;假定燃料质量为1 kg ,由能量密度计算方法列式计算即可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2013-2017高考电化学真题1.【2017 新课标 1 卷】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。
下列有关表述不正确的就是( )A.通入保护电流使钢管桩表面腐蚀电流接近于零B.通电后外电路电子被强制从高硅铸铁流向钢管桩C.高硅铸铁的作用就是作为损耗阳极材料与传递电流D.通入的保护电流应该根据环境条件变化进行调整2.【2017 新课标 2 卷】用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。
下列叙述错误的就是A.待加工铝质工件为阳极B.可选用不锈钢网作为阴极C.阴极的电极反应式为: Al3++ 3e- == AlD.硫酸根离子在电解过程中向阳极移动3.【2017 新课标 3 卷】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a 常用掺有石墨烯的 S8材料,电池反应为:16Li+x S8=8Li2S x(2≤x≤8)。
下列说法错误的就是( )A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4B.电池工作时,外电路中流过 0、02 mol 电子,负极材料减重 0、14 gC.石墨烯的作用主要就是提高电极 a 的导电性D.电池充电时间越长,电池中 Li2S2的量越多4.【2017海南10】一种电化学制备NH 3的装置如图所示,图中陶瓷在高温时可以传输H+.下列叙述错误的就是()A.Pb电极b为阴极B.阴极的反应式为:N2+6H++6e﹣=2NH3C.H+由阳极向阴极迁移D.陶瓷可以隔离N2与H25、【2017 北京11】(16分)某小组在验证反应“Fe+2Ag+=Fe2++2A g”的实验中检测到Fe3+,发现与探究过程如下:向硝酸酸化的0、05mol•L﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.(1)检验产物①取少量黑色固体,洗涤后,(填操作与现象),证明黑色固体中含有Ag.②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有.(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理就是(用离子方程式表示).针对两种观点继续实验:①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:序号取样时间/min 现象ⅰ 3 产生大量白色沉淀;溶液呈红色ⅱ30 产生白色沉淀;较3min时量小;溶液红色较3min时加深ⅲ120 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅(资料:Ag+与SCN﹣生成白色沉淀AgSCN)②对Fe3+产生的原因作出如下假设:假设a:可能就是铁粉表面有氧化层,能产生Fe3+;假设b:空气中存在O2,由于(用离子方程式表示),可产生Fe3+;假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;假设d:根据现象,判断溶液中存在Ag+,可产生Fe3+.③下列实验Ⅰ可证实假设a、b、c不就是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,3 0min后溶液几乎无色.实验Ⅱ:装置如图.其中甲溶液就是,操作现象就是.(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:.6、【2017江苏16】 (12分)铝就是应用广泛的金属。
以铝土矿(主要成分为Al2O3,含SiO2与Fe2O3等杂质)为原料制备铝的一种工艺流程如下:注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”就是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因就是________。
(4)“电解Ⅱ”就是电解Na2CO3溶液,原理如图所示。
阳极的电极反应式为_______________,阴极产生的物质A的化学式为______。
(5)铝粉在1000℃时可与N2反应制备AlN。
在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因就是_____________________。
7、【2017天津7】(14分)某混合物浆液含有Al(OH)3、MnO2与少量Na2CrO4.考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物与含铬元素溶液,并回收利用.回答Ⅰ与Ⅱ中的问题.Ⅰ.固体混合物的分离与利用(流程图中的部分分离操作与反应条件未标明)(1)反应①所加试剂NaOH的电子式为.B→C的反应条件为,C→Al的制备方法称为.(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2.由此判断影响该反应有效进行的因素有(填序号). a.温度b.Cl﹣的浓度c.溶液的酸度(3)0、1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体与一种易水解成TiO2•xH2O的液态化合物,放热4、28kJ,该反应的热化学方程式为.Ⅱ含铬元素溶液的分离与利用(4)用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因就是,分离后含铬元素的粒子就是;阴极室生成的物质为(写化学式).2016年1.【2016 新课标 1 卷】三室式电渗析法处理含 Na2SO4废水的原理如图所示,采用惰性电极,ab、cd 均为离子交换膜,在直流电场的作用下,两膜中间的 Na+与SO24-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的就是A.通电后中间隔室的 SO42-离子向正极迁移,正极区溶液 pH 增大B.该法在处理含 Na2SO4废水时可以得到 NaOH 与 H2SO4产品C.负极反应为 2H2O − 4e– = O2+4H+,负极区溶液 pH 降低D.当电路中通过 1mol 电子的电量时,会有 0、5mol 的 O2生成2.【2016 新课标 2 卷】Mg—AgCl 电池就是一种以海水为电解质溶液的水激活电池。
下列叙述错误的就是( )A.负极反应式为 Mg-2e-=Mg2+B.正极反应式为 Ag++e-=AgC.电池放电时 Cl-由正极向负极迁移D.负极会发生副反应 Mg+2H2O=Mg(OH)2+H2↑3.【2016 新课标 3 卷】锌−空气燃料电池可用作电动车动力电源,电池的电解质溶液为 KOH溶液,反应为2Zn+O2+4OH– +2H2O===2Zn(OH)42-。
下列说法正确的就是()A.充电时,电解质溶液中 K+向阳极移动B.充电时,电解质溶液中 c(OH-)逐渐减小C.放电时,负极反应为:Zn+4OH–-2e–===Zn(OH)42-D.放电时,电路中通过 2mol 电子,消耗氧气 22、4L(标准状况)4.【2016 海南卷】某电池以 K2FeO4与 Zn 为电极材料,KOH 溶液为电解溶质溶液。
下列说法正确的就是( )A.Zn 为电池的负极B.正极反应式为 2FeO42−+ 10H++6e−=Fe2O3+5H2OC.该电池放电过程中电解质溶液浓度不变D.电池工作时 OH向负极迁移5.【2016 上海卷】图 1 就是铜锌原电池示意图。
图 2 中,x 轴表示实验时流入正极的电子的物质的量,y 轴表示( )A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO42-)6.【2016 北京卷】用石墨电极完成下列电解实验。
实验一 实验二装置a 、d 处试纸变蓝;b 处变红,局部褪色;c 处现象无明显变化两个石墨电极附近有气泡产生;n 处有气泡产生;……下列对实验现象的解释或推测不合理的就是A.a 、d 处:2H 2O+2e -=H 2↑+2OH -B.b 处:2Cl --2e -=Cl 2↑C.c 处发生了反应:Fe-2e -=Fe 2+ D 、根据实验一的原理,实验二中m 处能析出铜7.【2016 四川卷】某电动汽车配载一种可充放电的锂离子电池。
放电时电池的总反应为: Li 1-x CoO 2+Li x C 6=LiCoO 2+ C 6(x<1)。
下列关于该电池的说法不正确的就是( )A.放电时,Li +在电解质中由负极向正极迁移B.放电时,负极的电极反应式为 Li x C 6-xe -= xLi ++ C 6C.充电时,若转移 1 mol e -,石墨 C 6 电极将增重 7x gD.充电时,阳极的电极反应式为 LiCoO 2-xe -=Li 1-x CoO 2+Li +8.【2016 天津卷】下列叙述正确的就是( )A.使用催化剂能够降低化学反应的反应热(△ H)B.金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关C.原电池中发生的反应达平衡时,该电池仍有电流产生D.在同浓度的盐酸中,ZnS 可溶而 CuS 不溶,说明 CuS 的溶解度比 ZnS 的小2015年1.【2015新课标Ⅰ卷pH 】微生物电池就是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的就是 ( )A.正极反应中有CO 2生成B.微生物促进了反应中电子的转移C.质子通过交换膜从负极区移向正极区D.电池总反应为C 6H 12O 6+6O 2=6CO 2+6H 2O2.【2015浙江pH 】在固态金属氧化物电解池中,高温电解H 2O —CO 2混合气体制备H 2与CO 就是一种新的能源利用方式,基本原理如图所示。
下列说法不正..确.的就是 ( ) A.X 就是电源的负极B.阴极的反应式就是:H 2O +2eˉ=H 2+O 2ˉ CO 2+2eˉ=CO +O 2ˉC.总反应可表示为:H 2O +CO 2====通电H 2+CO +O 2D.阴、阳两极生成的气体的物质的量之比就是1︰13.【2015天津pH 】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子与水分子通过,下列有关叙述正确的就是A.铜电极上发生氧化反应B.电池工作一段时间后,甲池的c(SO 42-)减小C.电池工作一段时间后,乙池溶液的总质量增加D.阴阳离子离子分别通过交换膜向负极与正极移动,保持溶液中电荷平衡4.【2015四川pH 】用右图所示装置除去含CN -、Cl -废水中的CN -时,控制溶液pH 为9~10,阳极产生的ClO -将CN -氧化为两种无污染的气体,下列说法不正确...的就是 ( ) A.用石墨作阳极,铁作阴极B.阳极的电极反应式为:Cl - + 2OH --2e -= ClO - + H 2OC.阴极的电极反应式为:2H 2O + 2e - = H 2↑ + 2OH -D.除去CN -的反应:2CN -+ 5ClO - + 2H + = N 2↑ + 2CO 2↑ + 5Cl -+ H 2O 5.【2015福建pH 】某模拟"人工树叶”电化学实验装置如右图所示,该装置能将H 2O 与CO 2转化为O 2与燃料(C 3H 8O)。
