亚铁离子和铁离子的转化
亚铁离子与铁离子的转化

亚铁离子与铁离子的转化亚铁离子与铁离子的转化及其在生物体中的作用亚铁离子(Fe2+)和铁离子(Fe3+)是铁元素(Fe)的两种氧化态。
在化学反应中,亚铁离子和铁离子可以相互转化,这种转化在生物体内起着重要的作用。
本文将探讨亚铁离子与铁离子的转化过程,以及它们在生物体内的生理功能。
亚铁离子和铁离子在水溶液中的转化是一个氧化还原反应。
当亚铁离子和氧气接触时,氧气将亚铁离子氧化成铁离子,并生成水。
这个反应可以简化为:4Fe2+ + O2 → 4Fe3+ + 2H2O反之,当铁离子和还原剂(如铁离子还原酶)接触时,铁离子会被还原成亚铁离子,同时还原剂被氧化。
这个反应可以简化为:4Fe3+ + 4e- → 4Fe2+这种氧化还原反应是生物体内一些关键生化过程的基础。
亚铁离子和铁离子在生物体内起着许多重要的生理作用,特别是在血液和细胞的代谢过程中。
亚铁离子在体内主要存在于铁蛋白中,这是一种可以储存和运输铁离子的蛋白质。
铁蛋白能够将亚铁离子吸附在其分子结构中,从而有效地避免其被氧气氧化成铁离子。
当亚铁离子需要被释放时,铁蛋白会通过一系列生化反应将其中的亚铁离子氧化为铁离子,从而释放出来。
铁离子是血红蛋白和肌红蛋白中的关键组成部分。
血红蛋白是红细胞中的一种蛋白质,它能够携带氧气到全身各个组织和器官。
血红蛋白中的铁离子可以与氧气结合形成氧合血红蛋白,而在组织中释放氧气。
当血红蛋白中的铁离子被氧气氧化成铁红蛋白时,它会失去对氧气的亲和力,从而将氧气释放出来。
铁离子在细胞的代谢过程中也扮演着重要角色。
细胞需要铁离子来合成DNA,RNA和许多重要的蛋白质。
铁离子还参与细胞中的呼吸链反应,这是一种将食物转化为可使用能量的过程。
此外,铁离子还参与体内的免疫反应,调节细胞的生长和分裂,以及许多其他生物化学过程。
然而,亚铁离子和铁离子过量或缺乏都会对生物体产生不利影响。
当体内铁离子过量时,它们可以与细胞和组织中的其它物质结合,形成自由基,导致细胞膜的氧化损伤和DNA的突变。
亚铁离子 铁离子 相互转化 课件 高一上学期化学人教版(2019)必修第一册

FeCl3溶液
(黄色)
FeCl2
FeCl2溶液
(浅绿色)
滴入KSCN溶液 溶液呈血红色 Fe3++3SCN-=Fe(SCN)3
血红色
无变化
课堂练习
1.将下列四种化合物溶于稀盐酸,滴加硫氰化钾
A 溶液没有颜色变化的是( )
A. FeO
B. Fe2O3
C. FeCl3
D. Fe2(SO4)3
在FeCl2中 加入铁氰化钾
产生蓝色沉淀
课堂练习
2. 要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下
C 实验操作时最佳顺序为( )
①加入适量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液 A.①③ B.③② C.③① D.①②③
生活中的化学
人体缺铁会造成贫血
一个成年人体中含铁3~5 g
二、Fe3+离子的检验
【实验3-3】
滴入KSCN溶液
FeCl3溶液加 入铁粉、 KSCN溶液
溶液由黄色变浅绿
2FeCl3+Fe = 3FeCl2 2Fe3++Fe = 3Fe2+
在上层清液中 加入氯水
变血红色 2FeCl2+Cl2 = 2FeCl3 2Fe2++Cl2=2Fe3++2Cl-
ห้องสมุดไป่ตู้
结论: Fe3+具有 氧化 性,Fe具有 还原 性。
70%集中在血红蛋白中
含铁较多的食品、蔬菜
补铁剂
维生素C与本品同服,有利于本品吸收。 你知道其中的原理吗?
生活中的化学
苹果中富含Fe2+离子
苹果 “生锈了”
关于亚铁离子和三价铁离子

关于亚铁离子和三价铁离子1.Fe 2+和Fe 3+的相互转化Fe 2+有还原性,高锰酸钾、重铬酸钾、过氧化氢等氧化剂能把它氧化成Fe 3+:-4MnO +5Fe 2++8H +Mn 2++5Fe 3++4H 2OCr 2O+6Fe 2++14H +2Cr 3++6Fe 3++7H 2OH 2O 2+2Fe 2++2H +2Fe 3++2H 2O 在酸性溶液中,空气中的氧也能把Fe 2+氧化:4Fe 2++O 2+4H +4Fe 3++2H 2O在碱性溶液中,Fe 2+的还原性更强,它能把-3NO 和-2NO 还原成NH 3,能把Cu 2+还原成金属铜。
Fe 3+具有氧化性,它能把I -氧化成I 2:2Fe 3++2I -2Fe 2++I 2在无线电工业上,常利用FeCl 3溶液来刻蚀铜,制造印刷线路,它们反应的化学方程式是:2Fe 3++Cu 2Fe 2++Cu 2+因此,铜在氯化铁溶液中能作还原剂,而FeCl 3是氧化剂。
Fe 3+在酸性溶液中容易被H 2S 、SnCl 2等还原成Fe 2+:2Fe 3++H 2S =2Fe 2++S↓+2H +2Fe 3++Sn 2+=2Fe 2++Sn 4+Fe 3+还能被金属铁还原:2Fe 3++Fe =3Fe 2+在亚铁盐溶液中加入铁钉可防止Fe 2+被氧化为Fe 3+。
2.Fe2+和Fe3+的颜色Fe2+在水溶液中通常以水合离子[Fe(H2O)6]2+形式存在,呈淡绿色,并存在下列平衡:[Fe(H2O)6]2++H2O[Fe(H2O)5OH]++H3O+这个平衡的P K=,水解的程度很小,溶液近于中性。
Fe3+在酸性溶液中,通常以淡紫色的[Fe(H2O)6]3+形式存在。
三氯化铁以及其他+3价铁盐溶于水后都发生显著的水解,实质是+3价水合铁离子的水解。
只有在pH=0左右时,才有[Fe(H2O)6]3+存在(但由于有阴离子的存在,会生成其他的络离子,影响淡紫色的观察)。
《亚铁离子与铁离子的性质与转化》名师训练

《Fe2与Fe3的性质与转化》名师训练1.有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是2.A.盐酸B.烧碱溶液C.氨水D.KSCN溶液3.下列反应的离子方程式正确的是4.A.硫酸铁溶液与氢氧化钡溶液反应:Fe33OH-FeOH3↓5.B.氯化铁溶液中加入铁粉反应:Fe3Fe-2Fe26.C.用KSCN溶液检验Fe3:Fe33SCN-=FeSCN3↓7.D.FeCl2溶液中通入Cl2:2Fe2Cl2=2Fe32Cl-8.根据下图所示的关系确定A、B、C、D、E、F的化学式:A:______,B:______,C:______,D:______,E:______,F:______。
9.铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。
“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。
该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2的存在,设计并进行了如下实验:(1)试剂1是__________,试剂2是__________。
10.(2)加入新制氯水后溶液中发生的离子反应方程式是__________________________。
11.(3)该同学猜想红色溶液变为无色溶液的原因是溶液中的3价铁被还原为2价铁,你认为该同学的猜想合理吗__________。
若你认为合理,请说明理由_______________________________。
若你认为不合理请提出你的猜想,并设计一个简单的实验加以验证_______________________________________________________ _______。
参考答案:1.B2.D3.FeFe3O4FeSO4Fe2SO43FeOH2FeOH3(1)稀盐酸KSCN溶液(2)2Fe2Cl22Fe32Cl-Fe33SCN-FeSCN3(3)不合理我的猜想是:FeSCN3中的SCN-被过量的氯水氧化而褪色;在褪色后的溶液中加入FeCl3溶液后溶液仍不变红色。
铁转化为亚铁离子的离子方程式

铁转化为亚铁离子的离子方程式哎呀,今天我们来聊聊铁转化为亚铁离子的事儿。
得说说铁,这小家伙可是咱们生活中常见的金属。
无论是铁锅,还是铁钉,它的身影无处不在。
铁的化学性质也挺有意思的,尤其是它转化为亚铁离子的时候。
这一过程可不是简单的事儿,就像人从青涩少年变成成熟男人一样,挺有一番滋味的。
亚铁离子到底是什么呢?简单说,它就是铁的一种离子形式。
铁的化合价有两个,一个是二价的亚铁(Fe²⁺),另一个是三价的铁离子(Fe³⁺)。
想象一下,亚铁离子就像是一位刚刚从青涩时期步入社会的年轻人,虽然成熟了一点,但还有很多潜力可挖。
转化的过程其实挺简单,铁通过氧化反应,丢掉了电子,变成了亚铁离子。
这就好比一位年轻人经历了风风雨雨,学会了放下过去,开始新的生活。
说到这里,肯定有人会问,铁是怎么转化的呢?哈哈,这就涉及到一些化学反应了。
举个简单的例子,铁遇到酸的时候,它就会和酸发生反应,释放出氢气。
就像当你和朋友一起聚会时,聊得开心,慢慢地把自己展现出来。
铁和酸反应的离子方程式就是铁和氢离子的结合,形成了亚铁离子和氢气。
简直就是一场化学界的狂欢派对呀!不过呀,亚铁离子在生活中可不只是呆在实验室里。
它在我们体内也扮演着重要的角色,尤其是在血液中。
咱们的血液中就含有亚铁离子,它可是携氧的重要角色,想想看,如果没有它,咱们的身体可得“缺氧”了,这可就不好了。
所以说,亚铁离子不光是在化学反应中重要,在咱们生活中也是绝对不能少的。
嘿,有些小伙伴可能会说,铁和亚铁离子,听起来都没啥神秘的嘛。
可实际上,这些微小的变化,却能对我们产生巨大的影响。
就像人一样,生活中的每一个小选择,都会影响未来的方向。
其实啊,理解这些反应,能帮助我们更好地认识世界,化学反应的魅力,就在于它们看似简单,但其中却蕴含着无限的可能性。
说到这里,有没有觉得化学有点像恋爱呢?开始的时候,总是青涩,慢慢地了解,才会有变化。
比如铁和氧气相遇,开始是铁,经过一系列反应,最后变成了亚铁离子,简直像一段爱情故事,充满了转折和惊喜。
亚铁 离子和铁离子的转化化学方程式

亚铁离子和铁离子的转化化学方程式
亚铁离子和铁离子的转化可以通过氧化还原反应实现。
例如,亚铁离子可以被氧气等氧化剂氧化成铁离子,反应方程式为:
4Fe2+ + O2 + 4H+ → 4Fe3+ + 2H2O
而铁离子也可以被还原剂还原成亚铁离子,例如铁离子与铁反应生成亚铁离子:2Fe3+ + Fe → 3Fe2+
另外,铁离子也可以与一些还原性酸根离子发生反应,转化为亚铁离子,例如:2Fe3+ + 2S2- → 2Fe2+ + S
2Fe3+ + Sn2+ → 2Fe2+ + Sn4+
需要注意的是,这些反应都需要在特定的条件下进行,并且具体的反应条件和反应产物可能因反应物的种类和浓度等因素而有所不同。
二价铁被氧化成三价铁的离子方程式

二价铁离子转化三价铁离子:Fe2+,用氧化剂氧化变为Fe3+,常用的有
HNO3、H2O2、Cl2
三价铁离子转化二价铁离子:Fe3+,用还原剂还原变为Fe2+,常用的有Fe、Cu、I-
Fe遇到弱氧化剂,比如S、Fe3+、H+变为Fe2+,Fe遇到强氧化剂,比如HNO3、Cl2,变为Fe3+,过量Fe与HNO3反应也能得到Fe2+,
右调明胶甚棉裂目干
这并不是HNO3的关系,开始时,HNO3把Fe氧化为Fe3+,但是过量Fe又把Fe3+还原了。
扩展资料:
Fe2+ 亚铁离子一般呈浅绿色,有较强的还原性,能与许多氧化剂反应,如氯气,氧气等。
因此亚铁离子溶液最好现配现用,储存时向其中加入一些铁粉(铁离子有强氧化性,可以与铁单质反应生成亚铁离子)亚铁离子也有氧化性,但是氧化性比较弱,能与镁、铝、锌等金属发生置换反应。
铁与非氧化性酸反应生成亚铁离子Fe +2HCl == FeCl2 + H2↑
亚铁离子转化成铁单质Fe2+ + Zn == Fe + Zn2+
铁在氯气中燃烧生成铁离子2Fe +3Cl2 === 2FeCl3
铁离子转化为铁单质Fe2O3+3CO=2Fe+3CO2
铁离子转化成亚铁离子2Fe3+ + Fe ===3 Fe2+
亚铁离子转化成铁离子2Fe2+ + Cl2 === 2Fe3+ +2Cl-
铁离子的氧化性是大于铜离子的,而铁单质可以还原铜离子,自然更能还原铁离子了。
还原性从大到小:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、H、Cu、Hg、Ag、Pt、Au。
亚铁离子被氧化成铁离子的方程式

标题:亚铁离子被氧化成铁离子的方程式及其化学反应过程一、引言在化学反应中,氧化-还原反应是一类重要的反应类型,其中电子的转移是关键的。
而亚铁离子被氧化成铁离子的方程式,正是一个典型的氧化-还原反应。
二、亚铁离子与氧化反应1. 亚铁离子(Fe2+)和氧气(O2)之间的氧化反应是一个重要的化学反应过程。
该反应会在水溶液中发生,产生铁离子(Fe3+)和氢氧化物。
2. 反应方程式:2Fe2+ + 1/2O2 + 2H2O -> 2Fe3+ + 2OH-3. 反应过程分析:a. 在反应过程中,亚铁离子失去了电子,氧气被还原成了氢氧化物,而亚铁离子则被氧化成了铁离子。
b. 氧气参与了这个反应过程,并促使了亚铁离子的氧化。
三、化学反应的意义与应用1. 化学反应的意义在工业生产和实验室研究中,亚铁离子被氧化成铁离子的方程式反应是一种重要的氧化-还原反应。
通过研究这种反应过程,我们可以深入了解氧化反应的机理和规律,为相关工业生产提供理论支持。
2. 应用亚铁离子被氧化成铁离子的方程式反应在钢铁生产、电化学工艺等领域有着重要的应用。
了解这种反应的机理,有助于优化生产工艺、提高生产效率。
四、个人观点与总结在化学反应中,亚铁离子被氧化成铁离子的方程式反应是一个重要的氧化-还原反应过程。
通过深入了解这种反应的机理,可以促进工业生产的发展,并提高化学实验室研究的效率。
化学反应的应用也在不断拓展和深化,对于促进科技发展和提高生产效率具有重要意义。
总结:亚铁离子被氧化成铁离子的方程式及其反应过程是化学反应中的重要反应类型,在工业生产和实验室研究中具有重要的应用价值。
通过深入了解这种反应过程,可以促进工业生产和科研技术的发展。
化学反应是化学变化的过程,其中物质之间发生了化学结构的改变。
而在化学反应中,亚铁离子被氧化成铁离子的方程式及其反应过程是一个重要的氧化-还原反应。
这种反应不仅在工业生产中有重要的应用,同时也能在实验室研究中提供理论支持。
21-22版:微专题8 铁离子与亚铁离子的性质与转化(步步高)

例 某同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题: (1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液 中需加入少量铁屑,其目的是_防__止__F_e_2_+_被__氧__化___。 解析 铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防 止氯化亚铁被氧化。
12345
解析 答案
5.下图是某儿童微量元素体检报告单的部分数据:
根据上表的数据,回答下列问题: (1)该儿童_铁__(_或__F_e_) 元素含量偏低。
解析 从检测结果与参考范围看,该儿童Fe元素的含量比参考范围略低。
12345
解析 答案
(2)报告单中“μmol·L-1”是_浓__度__(填“质量”“体积”或“浓度”)的单位。
解析 答案
特别提示
设置实验情景考查Fe2+的还原性、Fe3+的氧化性及其检验方法,是一种常见的 题型。需要注意的是 (1)Fe2+的还原性大于Br-的,但比I-的弱。亚铁盐在溶液中遇到强氧化剂(如氯 气、硝酸、酸性高锰酸钾溶液、溴水、双氧水等)时,一般能被氧化成铁盐。 (2)Fe3+具有较强的氧化性,可跟Fe、Cu及SO2、H2S、HI等还原性物质反应,还 原产物为Fe2+。
C.溶液变红涉及到反应:Cl2+2Fe2+===2Cl-+2Fe3+ D.比较氧化性:Cl2>Fe3+>Fe2+
12345
解析 答案
4.某同学利用铁与水蒸气反应后的固体物质进行了如下实验: 固体稀——盐→酸淡黄色溶液—试—剂→1 淡红色溶液—新—制—氯—水→深红色溶液—一—段—时—间—后→溶液褪色 (1)固体溶于稀盐酸的化学方程式为_F_e_3_O_4_+__8_H_C__l=_=_=__2_F_e_C_l3_+__F_e_C_l_2_+__4_H_2_O__。
亚铁离子和铁离子是同种核算

亚铁离子和铁离子是同种核算
亚铁离子和铁离子都是铁的离子形式,但它们并不是同种核算。
亚铁离子是Fe2+,也称为亚铁酸盐,它是铁的氧化态为+2的离子形式。
铁离子是Fe3+,也称为铁酸盐,它是铁的氧化态为+3的离子形式。
这两种离子在化学性质和化合物形成上有着明显的区别。
首先,亚铁离子和铁离子的化学性质不同。
由于氧化态不同,
它们在化学反应中表现出不同的还原性和氧化性。
亚铁离子通常是
较容易被氧化的,而铁离子则具有较强的氧化性。
其次,由于氧化态的不同,亚铁离子和铁离子在形成化合物时
也会表现出不同的性质。
比如,亚铁离子与一些酸类物质反应会生
成亚铁盐,而铁离子则会形成铁盐。
这些化合物在用途和性质上也
有所不同。
另外,从核算上来看,亚铁离子和铁离子所含的核也是不同的。
亚铁离子是铁的+2氧化态的离子,其核含有26-2=24个中子,而铁
离子是铁的+3氧化态的离子,其核含有26-3=23个中子。
因此,从
核算的角度来看,它们并不是同种核算。
综上所述,虽然亚铁离子和铁离子都是铁的离子形式,但它们在化学性质、化合物形成和核算上都有着明显的区别。
这些差异也决定了它们在化学和物理性质上的不同表现。
亚铁 和 铁离子之间的转化 导学案

②某溶液中加入KSCN溶液,变为红色,则溶液中一定有Fe3+,一定没有Fe2+
4.如何证明溶液中只有Fe2+没有Fe3+?
二、基础感知
1.鉴别Fe2+和Fe3+的方法有: 观察法 SCN—法 碱液法 KMnO4(溴水)法 铜片法。思考:这些方法现象有何不同?
【重点难点】
重点:Fe2+、Fe3+的检验和鉴别方法;铁三角的转化与验和鉴别方法;方程式的书写。
【导学流程】
一、知识链接
1.写出下列物质的颜色
Fe(OH)2Fe2O3Fe(OH)3Fe2+Fe3+
KSCN(硫氰化钾)Fe(SCN)3
2.写出FeCl3与KSCN反应的离子方程式,描述实验现象。
Fe+ Fe3+= Fe2++ MnO4—+ H+=
铁盐和亚铁盐
班级:姓名:小组:
【学习目标】
1.学生通过对课本61页的学习,能用规范的语言描述检验Fe2+、Fe3+的方法。
2.学生通过教师讲评,能归纳出鉴别Fe2+、Fe3+的方法。
3.学生通过教师讲评,能准确说出Fe2+、Fe3+之间相互转化所加的试剂。
4.学生通过教师讲评和氧化还原的思想,能总结出与Fe2+、Fe3+不共存的离子。
2.Fe、Fe2+、Fe3+的转化(提示:强氧化剂有Cl2、Br2、HNO3、浓H2SO4、KMnO4,强还原剂有Al、Zn、CO、H2。弱氧化剂有S、H+、Cu2+、Fe3+,弱还原剂Fe、Cu、I—、S2—、HS—、SO2、SO32—),写出下列化学方程式。
化学课件亚铁和铁离子的性质(更新版)

有关铁的化学方程式

有关铁的化学方程式 铁在氯气中燃烧 2Fe +3Cl2 === 2FeCl3 铁与硫反应 Fe + S ==== FeS 铁与水反应 3Fe + 4H2O ===== Fe3O4 +4H2↑ 铁与非氧化性酸反应 Fe +2HCl === FeCl2 + H2↑ 铁和过量的稀硝酸反应 Fe + 4HNO3(稀) ==== Fe(NO3)3 + NO↑+ 2H2O 过量的铁和稀硝酸反应 3Fe + 8HNO3(稀) === 3Fe(NO3)2 + 2NO↑+ 4H2O 铁与硫酸铜反应 Fe + CuSO4 === FeSO4 + Cu 氧化亚铁与酸反应 FeO +2HCl === FeCl2 + H2O 3FeO + 10HNO3(稀) === 3Fe(NO3)3 + NO↑+ 5H2O 氧化铁与酸反应 Fe2O3 + 6HNO3 === 2Fe(NO3)3 + 3H2O 氯化铁与氢氧化钠反应 FeCl3 + 3NaOH === Fe(OH)3↓ + 3NaCl 氢氧化铁受热反应 2Fe(OH)3 ==== Fe2O3 + 3H2O 硫酸亚铁与氢氧化钠反应 FeSO4 + 2NaOH === Fe(OH)2↓+ Na2SO4 氢氧化亚铁转化成氢氧化铁 4Fe(OH)2 + O2 + 2H2O === 4Fe(OH)3 氢氧化亚铁与酸反应 Fe(OH)2 + 2HCl === FeCl2 + H2O 3Fe(OH)2+ 10HNO3 === 3Fe(NO3)3 + NO↑+ 8H2O 氢氧化铁与酸反应 Fe(OH)3 + 3HNO3 === Fe(NO3)3 + 3H2O 氯化铁与硫氰化钾溶液反应 FeCl3 + 3KSCN === Fe(SCN)3 + 3KCl3 亚铁离子转化成铁单质 Fe2+ + Zn === Fe + Zn2+ 铁转化成亚铁离子 Fe + 2H+ === Fe2+ + H2↑ 铁转化成铁离子 2Fe + 3Cl2 === 2FeCl3 铁离子转化成铁 Fe2O3 + 3CO ==== 2Fe + 3CO2 亚铁离子转化成铁离子 2Fe2+ + Cl2 === 2Fe3+ +2Cl铁离子转化成亚铁离子 2Fe3+ + Fe ===3 Fe2+ 氯化铁溶液中加入碳酸钠 2FeCl3 + 3Na2CO3 + 3H2O === 2Fe(OH)3↓ + 3CO2↑ + 6NaCl 铁在氧气中燃烧 3Fe + 2O2 ===== Fe3O4 铝元素的化学方程式 总结 2Al+6HCl=2AlCl3+3H2 4Al+3O2=2Al2O3 2H2O+2Al+2NaOH=2NaAlO2+3H2 AL2O3+2NaOH=2NaAlO2+2H2O 制取铝的流程: Al2O3+2NaOH = 2NaAlO2+H2O NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3加热 2Al(0H)3=== Al2O3+ 3H2O 通电 2Al2O3 ===4Al+3O2↑ 氢氧化铝和强碱的反应: Al(0H)3+NaOH=NaAlO2+2H2O 氯化铝和氢氧化钠的反应 AlCl3+3NaOH=Al(OH)3↓+3NaCl(氢氧化钠少量) AlCl3+4NaOH= NaAlO2+2H2O(氢氧化钠过量) 氯化铝和氨水的反应: AlCl3+3NH3.H2O ==Al(OH)3↓+3NH4Cl 偏铝酸钠和盐酸的反应: NaAlO2+HCl+H2O=Al(OH)3↓+NaCl(盐酸少量) NaAlO2+4HCl=AlCl3+2H2O +NaCl(盐酸过量) 偏铝酸钠和氯化铝反应:AlCl3+3NaAlO2+6H2O=4Al(OH)3↓高中所学所涉及关于铜的化学方程式,离子方程式,以及含有铜元素的物质 2Cu+O2==2CuO 4Cu+O2==2Cu2O 铜盐的焰色反应2Cu+O2+H2O+CO2=Cu2(OH)2CO3 2Cu+4HCl+O2=2CuCl2+2H2O Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O Cu+Cl2=点燃=CuCl2 Cu+2FeCl3=2FeCl2+CuCl2 >1273K 4CuO==Cu2O+O2↑ ≈353K Cu(OH)2=加热=CuO+H2OCu(OH)2+H2SO4=CuSO4+2H2O Cu2+ + 2OH- =Cu(OH)2↓ (b)硫酸铜的制备 加热 Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O 加热 2Cu+2H2SO4(稀)+O2====2CuSO4+2H2O (c) 硫酸铜的加热 无水硫酸铜加热到 923K 时,分解成 CuO CuSO4==加热==CuO+SO3↑ 或者 2CuSO4==加热==2CuO+2SO2↑+O2↑ (3)硫化铜 Cu2++H2S=CuS+2H+ 加热 3CuS+2NO3-+8H+==3Cu2++2NO+3S+4H2O 2CuS+10CN-==2[Cu(CN-)4]3-+2S2-+(CN)2 高中总结-化学方程式-碱金属-钠 1◆碱金属元素 4Na+O2===2Na2O 2Na2O+ O2 Na2O2 4Na+2O2 2Na2O2 2Na+S===Na2S(爆炸) 2Na+2H2O===2NaOH+H2↑ Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O2↑ (此反应分两步:Na2O2+2H2O===2NaOH+H2O2;2H2O2===2H2O+O2.) Na2O+CO2===Na2CO3 2Na2O2+2CO2===2Na2CO3+O2 Na2CO3+HCl===NaHCO3+NaCl NaHCO3+HCl===NaCl+H2O+CO2↑ Na2CO3+2HCl===2NaCl+ H2O+ CO2↑ 2NaHCO3 Na2CO3+ H2O+ CO2↑ 4Li+ O2 2 Li2O 2K+2H2O===2KOH+H2↑ NaHCO3 + NaOH== Na2CO3 + H2O Na2CO3+ H2O+ CO2 = 2NaHCO3 2NaOH+ CO2 (少量)== Na2CO3 + H2O NaOH+ CO2(多量)== NaHCO3 Na2CO3+ Ca(OH)2=Ca CO3↓+2 NaOH 2NaOH+SO2(少量) ===Na2SO3+H2O NaOH+SO2(足量)===NaHSO3 NaOH+H2S(足量)===NaHS+H2O 2NaOH+H2S(少量)===Na2S+2H2O NaOH+HCl===NaCl+H2O CO2+Ca(OH)2(过量)===CaCO3↓+H2O 2CO2(过 量)+Ca(OH)2===Ca(HCO3)2 Na2O+2HCl===2NaCl+H2O Na2O+SO3===Na2SO4 CaCO3 CaO+CO2↑ MgCO3 MgO+CO2↑ 2Fe(OH)3 Fe 2O3 + 3H2O Mg(OH)2 Mg O+ H2O Cu(OH)2 Cu O+ H2O 2Al(OH)3 Al 2O3 + 3H2O CaCO3+H2O +CO2=Ca(HCO3)2 2NaOH + CuSO4 ==Cu(OH)2↓+ Na2SO4 3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 4、木炭还原氧化铜: 2CuO + C 高温 2Cu + CO2↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu 6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl 7、钠在空气中燃烧:2Na + O2 △ Na2O2 钠与氧气反应:4Na + O2 = 2Na2O 8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑ 9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2 10、钠与水反应:2Na + 2H2O = 2NaOH + H2↑ 11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑ 12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O = Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O 16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O 17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl 18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 20、氢氧化铁加热分解:2Fe(OH)3 △ Fe2O3 + 3H2O↑ 21、 实验室制取氢氧化铝: Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH3)2SO4 22、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O 23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O 24、氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2O 25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2 26、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3 27、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O 硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑ 28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温 CaSiO3 29、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O 30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓ 31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ 32、氯气与金属铁反应:2Fe + 3Cl2 点燃 2FeCl3 33、氯气与金属铜反应:Cu + Cl2 点燃 CuCl2 34、氯气与金属钠反应:2Na + Cl2 点燃 2NaCl 35、氯气与水反应:Cl2 + H2O = HCl + HClO 36、次氯酸光照分解:2HClO 光照 2HCl + O2↑ 37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O 38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O 39、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO3 40、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO41、二氧化硫与水反应:SO2 + H2O ≈ H2SO3 42、氮气与氧气在放电下反应:N2 + O2 放电 2NO 43、一氧化氮与氧气反应:2NO + O2 = 2NO2 44、二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO 45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂 2SO3 46、三氧化硫与水反应:SO3 + H2O = H2SO4 47、浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑ 48、浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2 ↑+ 2SO2↑ + 2H2O 49、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑ 50、稀硝酸与铜反应:3Cu + 8HNO3(稀) △ 3Cu(NO3)2 + 4H2O + 2NO↑ 51、氨水受热分解:NH3•H2O △ NH3↑ + H2O 52、氨气与氯化氢反应:NH3 + HCl = NH4Cl 53、氯化铵受热分解:NH4Cl △ NH3↑ + HCl↑ 54、碳酸氢氨受热分解:NH4HCO3 △ NH3↑ + H2O↑ + CO2↑ 55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NH3↑ + NaNO3 + H2O... 高中化学知识点总结 镁铝和铁化学方程式总结 1、碳酸氢钙溶液受热分解 Ca(HCO3)2 =CaCO3↓+CO2↑+H2o 2、氯化镁和氨水 MgCl2 + 2NH3·H2O = Mg(OH)2+2NH4Cl 3、铝和氢氧化钠溶液 2Al+2NaOH+2H2o=2NaAlO2+3H2↑ 4、铝热反应 4Al+3MnO2=3Mn+2Al2O3(高温) 5、氧化铝和盐酸 Al2O3 + 6HCl = 2AlCl3 + 3H2O 6、氧化铝和氢氧化钠溶液 Al2O3 + 2NaOH = 2NaAlO2 + H2O 7、氢氧化铝受热分解 2Al(OH)3=Al2O3+3H2O 8、氢氧化铝和盐酸 Al(OH)3+3HCl=AlCl3+3H2O 9、氢氧化铝和氢氧化钠溶液 Al(OH)3+NaOH=NaAlO2+2H2O 10、三氯化铝和过量氨水 AlCl3+3NH3+3H2O=Al(OH)3↓+3NH4Cl 11、三氯化铝和过量氢氧化钠 AlCl3+4NaOH=NaAlO2+3NaCl+2H2o 12、铁和水蒸气 3Fe+4H2O=Fe3O4+4H2↑ 13、铁和足量的稀盐酸 Fe + 2HCl = FeCl2 + H2↑ 14、铁和足量的稀硝酸 Fe+4HNO3=Fe(NO3)3+NO↑+2H2o 15、铁(完全过量)和少量的稀硝酸 3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2o 16、氢氧化铁受热分解 2Fe(OH)3=Fe2O3+3H2o碳族元素方程式赞同| SiO2 + 2NaOH == Na2SiO3 + H2O Si + O2 == SiO2(加热) SiO2 + 2C == Si + 2CO(高温) SiO2 + CaO == CaSiO3 (高温) C +2Cl2 == CCl4 (加热) C + Si == SiC (高温) 2H2SO4(浓)+ C == CO2 + 2H2O + 2SO2 加热 C + 4HNO3(浓)== CO2 + 4NO2 + 2H2O SiO2 + 4HF ==SiO2 + 2NaOH == Na2SiO3 + H2O Si + O2 == SiO2↑(加热) SiO2 + 2C == Si + 2CO↑(高温) SiO2 + CaO == CaSiO3 (高温) C +2Cl2 == CCl4 (加热) C + Si == SiC (高温) 2H2SO4(浓)+ C == CO2↑ + 2H2O + 2SO2↑ 加热 C + 4HNO3(浓)== CO2↑ + 4NO2↑ + 2H2O SiO2 + 4HF == SiF4 + H2O 制磨砂玻璃 NaCO3 + SiO2 == Na2SiO3 + CO2↑ CaCO3 + SiO2 == CaSiO3 + CO2↑ 此二者需高温,为制造玻璃的步骤 金刚石、晶体硅:原子晶体 石墨:混合晶体 8 一些别称: 苛性钠 NaOH 纯碱、苏打 Na2CO3 小苏打 NaHCO3 漂白粉 Ca(ClO)2 碱石灰 CaO、NaOH 的混合物 石膏 CaSO4"2H2O 生石膏 2CaSO4"H2O 高岭石 Al2(Si2O5)(OH)4 石英 SiO2氮族化学方程式总结 距离 2011 年高考还有不到 2 个月的时间了, 这个时候文科的同学要有一个清楚的头脑, 总结各科的知识重点并记住。
亚铁离子与三价铁离子的相互转化

4 教学过程设计
创设情境, 引入新课 (3分钟)
图片视频, 引入课题2 (3分钟)
亚铁离子与三价铁离子的相互转化
LOGO
4 教学过程
Fe2+ Fe3+
直达实验室:还原现场
动动手:铁锅中的铁是如何转化成Fe3+?
打破沙锅问到底!哪些试剂可以将Fe2+转化为Fe3+?
直通 高考
例1:工业上回收利用某合金废料(主要含Fe、Cu、Al、Co、Li等,已知Co、Fe都是中等活泼 金属)的工艺流程如下: ①加入H2O2的作用是(用离子方程式表示)
知识层面
2 学情分析
能力层面
心理层面
氧化还原理论 离子方程式书写
实验探究的方法
乐于探究 合作
亚铁离子与三价铁离子的相互转化
3 教学方法
学案 导学法
启发 引导法
教法
实验 探究法
直观 演示法
亚铁离子与三价铁离子的相互转化
3 教学方法
实验 探究法
合作 学习法
讨论 交流法
归纳 总结法
亚铁离子与三价铁离子的相互转化
2
教学目标
了解Fe、Fe2+和 Fe3+的化学性质及 其相互转化的条件 了解Fe2+和Fe3+的 常用检验方法。 体验在理论指导下 进行实验探究的过 程
3
教学重点、难点
知识:铁及其化合 物间的转化。 方法:探究物质性 质的科学方法 学生核心素养的培 养;实验方案的设 计。
亚铁离子与三价铁离子的相互转化
堂开拓思维,启迪智慧的回归课本习题主
人
感谢您的观看
亚铁离子与三价铁离子的相互转化
亚铁离子与三价铁离子的相互转化
高中关于铁的方程式

高中关于铁的方程式1.铁在氯气中燃烧2Fe+3Cl2===2FeCl32.铁与硫反应Fe+S===FeS3.铁与水反应3Fe+4H2O===Fe3O4+4H2↑4.铁与非氧化性酸反应Fe+2HCl==FeCl2+H2↑5.铁和过量的稀硝酸反应Fe+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O6.过量的铁和稀硝酸反应3Fe+8HNO3(稀)==3Fe(NO3)2+2NO↑+4H2O7.铁与硫酸铜反应Fe+CuSO4==FeSO4+Cu8.氧化亚铁与酸反应FeO+2HCl==FeCl2+H2O3FeO+10HNO3(稀)==3Fe(NO3)3+NO↑+5H2O9.氧化铁与酸反应Fe2O3+6HNO3==2Fe(NO3)3+3H2O10.氯化铁与氢氧化钠反应FeCl3+3NaOH==Fe(OH)3↓+3NaCl11.氢氧化铁受热反应2Fe(OH)3===Fe2O3+3H2O12.硫酸亚铁与氢氧化钠反应FeSO4+2NaOH==Fe(OH)2↓+Na2SO413.氢氧化亚铁转化成氢氧化铁4Fe(OH)2+O2+2H2O==4Fe(OH)314.氢氧化亚铁与酸反应Fe(OH)2+3Cl2==2FeCl3+2HCl==FeCl2+2H2O3Fe(OH)2+10HNO3==3Fe(NO3)3+NO↑+8H2O15.氢氧化铁与酸反应Fe(OH)3+3HNO3==Fe(NO3)3+3H2O16.氯化铁与硫氰化钾溶液反应FeCl3+3KSCN==Fe(SCN)3+3KCl17.亚铁离子转化成铁单质Fe2++Zn==Fe+Zn2+18.铁转化成亚铁离子Fe+2H+==Fe2++H2↑19.铁离子转化成铁Fe2O3+3CO===2Fe+3CO220.亚铁离子转化成铁离子2Fe2++Cl2===2Fe3++2Cl-21.铁离子转化成亚铁离子2Fe3++Fe===3 Fe2+ 23.氯化铁与碳酸钠溶2FeCl3+Na2CO3+3H2O==2Fe(OH)3↓+3CO2↑+6NaCl。
2020年高中化学新教材同步必修第一册 第3章 微专题七 铁三角的相互转化及铁离子、亚铁离子的检验

一、“铁三角”——Fe 、Fe 2+、Fe 3+的相互转化1.常见的转化①将H 2S 气体通入FeCl 3溶液中产生淡黄色沉淀: H 2S +2Fe 3+===S ↓+2Fe 2++2H +②将FeCl 3溶液滴入淀粉-KI 溶液,溶液变蓝: 2I -+2Fe 3+===I 2+2Fe 2+③用FeCl 3溶液腐蚀废旧线路板上的铜箔: Cu +2Fe 3+===Cu 2++2Fe 2+④将H 2O 2滴入酸性FeCl 2溶液中: 2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O ⑤将新制氯水滴入FeCl 2溶液中: 2Fe 2++Cl 2===2Fe 3++2Cl -⑥铁粉溶于盐酸中: Fe +2H +===Fe 2++H 2↑ ⑦铁粉在氯气中燃烧: 2Fe +3Cl 2=====点燃2FeCl 3 ⑧硫酸亚铁溶液与锌粉反应: Fe 2++Zn===Zn 2++Fe2.分析除杂问题(括号内物质为杂质)①FeCl 3溶液(FeCl 2):加足量氯水或双氧水或通入足量Cl 2。
②FeCl 2溶液(FeCl 3):加足量铁粉,充分反应后过滤。
③FeSO 4溶液(CuSO 4):加足量铁粉,充分反应后过滤。
3.盐溶液的配制与保存在含Fe 2+的溶液中加入铁粉防止被氧化。
1.下列叙述不正确的是()选项被提纯物质杂质除杂试剂或方法A FeCl3溶液FeCl2通入适量Cl2B FeCl2溶液FeCl3加入过量铁粉并过滤C 铜粉铁粉加入过量盐酸并过滤D Fe(OH)3Fe(OH)2在空气中灼烧答案 D解析FeCl2与Cl2反应生成FeCl3,FeCl3与Fe粉反应生成FeCl2,A、B都正确;Fe(OH)3、Fe(OH)2受热都易分解,D错误。
2.(2018·江西南昌二中高一月考)FeCl3、CuCl2的混合溶液中加入一定量的铁粉,充分反应后固体完全溶解,则下列判断正确的是()A.溶液中一定含Cu2+和Fe2+B.溶液中一定含Cu2+和Fe3+C.溶液中一定含Fe3+和Fe2+D.溶液中一定含Fe3+、Cu2+和Fe2+答案 A解析因氧化性:Fe3+>Cu2+>Fe2+,在FeCl3、CuCl2的混合溶液中加入一定量的铁粉,铁先与铁离子反应生成亚铁离子,最终无固体存在,说明溶液中的铜离子没参加反应,所以溶液中一定存在Cu2+和Fe2+,不一定含有Fe3+。
3.1.3亚铁离子、铁离子的检验与转化 (教学设计) 高一上学期化学人教版(2019)必修第一册
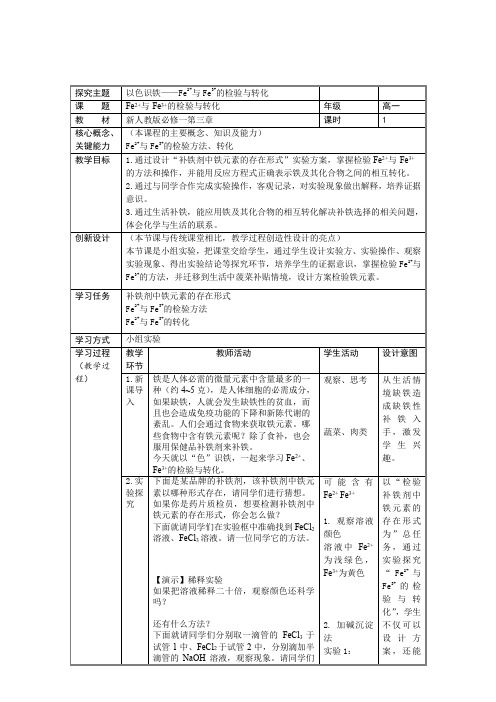
观察、思考
蔬菜、肉类
从生活情境缺铁造成缺铁性补铁入手,激发学生兴趣。
2.实验探究
下面是某品牌的补铁剂,该补铁剂中铁元素以哪种形式存在,请同学们进行猜想。
如果你是药片质检员,想要检测补铁剂中铁元素的存在形式,你会怎么做?
下面就请同学们在实验框中准确找到FeCl2溶液、FeCl3溶液。请一位同学它的方法。
下面请同学们取适量补铁剂粉末溶解,滴加2-3滴硫氰化钾溶液观察。
那么猜想一和猜想三都不正确,如果含有Fe2+该如何设计实验呢?
还有其他方法吗?请同学们结合氧化还原知识设计方案,最好利用今天学到的新的方法硫氰化钾。
Fe2+被氧化成Fe3+需要加什么?
哪些物质可以作氧化剂?
请同学们用刚刚滴加硫氰化钾为变红的试管继续滴加过氧化氢,观察现象。
请同学们分别取FeCl2溶液、FeCl3溶液滴加1滴KSCN溶液,观察现象。
【解释】
这是因为硫氰化钾和Fe3+反应,生成血红色的物质,而不与Fe2+反应。
刚刚稀释过的,滴加一滴硫氰化钾观察
请同学们选出一种检验与鉴别Fe3+最灵敏的方法?
还记得刚开始同学们对补贴剂你中铁元素存在形式的猜想?针对猜想一:含有Fe3+设计实验并进行实验现象预测?
2.通过与同学合作完成实验操作,客观记录,对实验现象做出解释,培养证据意识。
3.通过生活补铁,能应用铁及其化合物的相互转化解决补铁选择的相关问题,体会化学与生活的联系。
创新设计
(本节课与传统课堂相比,教学过程创造性设计的亮点)
本节课是小组实验,把课堂交给学生,通过学生设计实验方、实验操作、观察实验现象、得出实验结论等探究环节,培养学生的证据意识,掌握检验Fe2+与Fe3+的方法,并迁移到生活中菠菜补贴情境,设计方案检验铁元素。
