蛋白不表达常见原因及分析
蛋白不表达原因
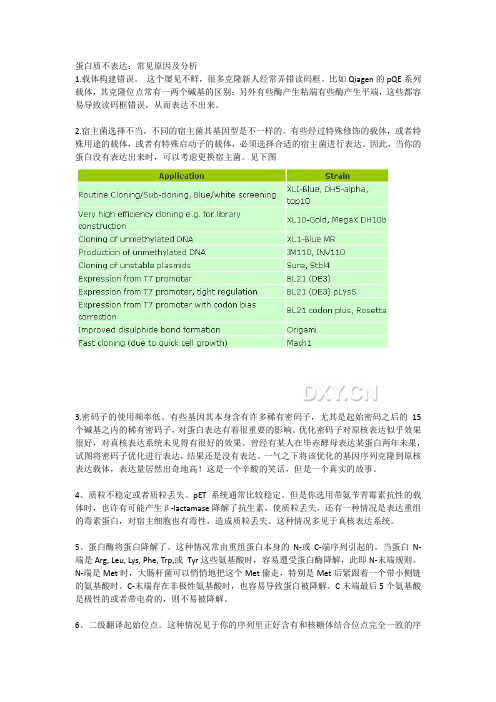
蛋白质不表达:常见原因及分析1.载体构建错误。
这个屡见不鲜,很多克隆新人经常弄错读码框。
比如Qiagen的pQE系列载体,其克隆位点常有一两个碱基的区别;另外有些酶产生粘端有些酶产生平端,这些都容易导致读码框错误,从而表达不出来。
2.宿主菌选择不当。
不同的宿主菌其基因型是不一样的。
有些经过特殊修饰的载体,或者特殊用途的载体,或者有特殊启动子的载体,必须选择合适的宿主菌进行表达。
因此,当你的蛋白没有表达出来时,可以考虑更换宿主菌。
见下图3.密码子的使用频率低。
有些基因其本身含有许多稀有密码子,尤其是起始密码之后的15个碱基之内的稀有密码子,对蛋白表达有着很重要的影响。
优化密码子对原核表达似乎效果很好,对真核表达系统未见得有很好的效果。
曾经有某人在毕赤酵母表达某蛋白两年未果,试图将密码子优化进行表达,结果还是没有表达。
一气之下将该优化的基因序列克隆到原核表达载体,表达量居然出奇地高!这是一个辛酸的笑话,但是一个真实的故事。
4、质粒不稳定或者质粒丢失。
pET系统通常比较稳定。
但是你选用带氨苄青霉素抗性的载体时,也许有可能产生β-lactamase降解了抗生素,使质粒丢失。
还有一种情况是表达重组的毒素蛋白,对宿主细胞也有毒性,造成质粒丢失。
这种情况多见于真核表达系统。
5、蛋白酶将蛋白降解了。
这种情况常由重组蛋白本身的N-或C-端序列引起的。
当蛋白N-端是Arg, Leu, Lys, Phe, Trp,或Tyr这些氨基酸时,容易遭受蛋白酶降解,此即N-末端规则。
N-端是Met时,大肠杆菌可以悄悄地把这个Met偷走,特别是Met后紧跟着一个带小侧链的氨基酸时。
C-末端存在非极性氨基酸时,也容易导致蛋白被降解。
C末端最后5个氨基酸是极性的或者带电荷的,则不易被降解。
6、二级翻译起始位点。
这种情况见于你的序列里正好含有和核糖体结合位点完全一致的序列。
那就怪不得人家了,核糖体会很高兴地找到这个位点,然后开始翻译,致使你的蛋白被截短,在电泳时看不到预期大小的片段。
蛋白不表达常见原因及分析

蛋白不表达常见原因及分析在生物学和医学研究中,蛋白表达是一个至关重要的环节。
然而,经常会遇到蛋白不表达的情况,这给研究工作带来了很大的困扰。
要解决蛋白不表达的问题,首先需要了解导致这一现象的常见原因。
一、基因层面的问题1、基因序列错误基因在转录和翻译过程中,需要遵循严格的碱基互补配对原则。
如果基因序列本身存在错误,比如碱基的缺失、插入或突变,就可能导致 mRNA 无法正确合成,或者合成的 mRNA 无法翻译成有功能的蛋白质。
2、基因调控元件异常基因的表达受到多种调控元件的控制,如启动子、增强子、沉默子等。
如果这些调控元件发生突变或缺失,可能会影响基因的转录起始效率,导致蛋白表达水平降低甚至不表达。
3、基因拷贝数不足在某些情况下,基因的拷贝数过低会导致转录产生的 mRNA 量不足,从而无法合成足够的蛋白质。
二、转录层面的问题1、 RNA 聚合酶活性受影响RNA 聚合酶负责将 DNA 转录为 mRNA,如果其活性受到抑制或者出现功能障碍,就会影响 mRNA 的合成,进而导致蛋白不表达。
2、转录因子异常转录因子能够与基因的调控元件结合,促进或抑制基因的转录。
当转录因子的表达水平、活性或与调控元件的结合能力出现异常时,可能会影响基因的正常转录。
三、翻译层面的问题1、密码子偏好性不同的生物体对某些密码子的使用频率存在差异。
如果在表达系统中使用了不常用的密码子,可能会导致翻译效率低下甚至停滞,从而造成蛋白不表达。
2、 tRNA 丰度不足tRNA 负责携带氨基酸参与蛋白质的合成。
如果某些特定 tRNA 的丰度不足,无法及时供应相应的氨基酸,就会影响蛋白质的翻译进程。
3、核糖体结合位点问题核糖体需要结合在 mRNA 上的特定位点才能启动翻译。
如果核糖体结合位点的序列发生突变或缺失,核糖体无法有效结合,蛋白合成也会受到阻碍。
四、蛋白折叠与修饰问题1、错误折叠即使蛋白质成功合成,若折叠过程出现错误,形成的错误构象可能会被细胞内的质量控制系统识别并降解,导致蛋白无法积累。
蛋白不表达

蛋白不表达引言蛋白质是生物体中最基本的组成部分之一,它们在生物体内发挥着重要的功能。
然而,在某些情况下,蛋白质的表达可能会出现问题,导致一系列的生物学和医学问题。
本文将探讨蛋白质不表达的原因、影响以及可能的解决方法。
为什么蛋白不表达蛋白质的表达受到多种因素的调控,包括基因转录、蛋白翻译、蛋白质修饰等。
蛋白质不表达的原因可以是多方面的。
1. 基因转录问题基因转录是蛋白质表达的第一步,如果基因没有被正确地转录成mRNA,则无法进行后续的蛋白质翻译过程。
基因转录问题可能包括基因突变、转录因子缺失、启动子区域的变异等。
2. 蛋白翻译问题蛋白翻译是将mRNA转化为蛋白质的过程。
如果翻译过程中出现错误,或者翻译过程被抑制,都会导致蛋白质不表达。
蛋白翻译问题可能包括启动子序列的变异、翻译起始子的缺失、翻译因子的不足等。
3. 蛋白修饰问题蛋白修饰是调控蛋白质功能和活性的重要过程。
如果蛋白修饰过程出现问题,也会导致蛋白质不表达。
常见的蛋白修饰问题包括磷酸化、甲基化、乙酰化等修饰方式的缺失或错误。
蛋白不表达的影响蛋白质不表达可能会对生物体的正常功能产生重大影响。
1. 细胞功能受损蛋白质作为细胞内重要的功能分子,参与了细胞的各种生物学过程。
如果某些关键的蛋白质不表达,细胞的正常功能将受到严重的影响,可能导致细胞死亡、代谢紊乱等现象。
2. 器官和组织功能受损蛋白质的功能不仅限于细胞内部,还可以参与组织和器官的正常功能调控。
如果某些关键的蛋白质不表达,可能导致器官和组织的功能受损,进而影响整个生物体的生理活动。
3. 疾病的发生和发展蛋白质的不表达也可能与一些疾病的发生和发展密切相关。
例如,某些肿瘤细胞中特定的肿瘤抑制因子蛋白质不表达,导致异常的细胞增殖和分化,从而促进肿瘤的发展。
解决蛋白不表达的方法针对蛋白质不表达的问题,科学家们提出了一系列的解决方法。
1. 基因治疗基因治疗是利用基因传递手段将正常的基因传递给患者,从而恢复蛋白质的表达。
蛋白诱导不出来的原因

蛋白诱导不出来的原因
蛋白诱导是一种常用的生物实验技术,可用于表达外源蛋白,生
成特定蛋白及其片段,以及研究蛋白质互作等。
然而,在实验中,我
们也经常会遇到蛋白诱导不出来的情况,这可能是由以下原因引起的。
一、表达条件不优
蛋白质的诱导表达通常需要适宜的温度、培养时间、诱导剂浓度
等条件,这些条件可能会因不同蛋白而不同。
如温度过高或过低、培
养时间太短或太长,或者诱导剂的浓度不够,都可能导致蛋白质无法
被充分表达,从而无法诱导出来。
二、质粒或表达宿主株问题
质粒或表达宿主株问题也可能导致蛋白质不容易诱导出来。
比如,质粒本身可能受到污染或损伤,导致表达蛋白的缺陷;表达宿主株则
可能存在蛋白降解酶、异物毒性等问题,导致蛋白质无法得到稳定的
表达。
三、蛋白本身的问题
有时,蛋白本身的物理和化学性质也会影响蛋白诱导表达的效果,比如蛋白质的折叠、稳定性和荷电性等。
这些因素可能导致蛋白质不
易被表达,并可能影响到其生物活性和稳定性。
四、下游操作条件不佳
蛋白质诱导成功后,如不合适的后续操作条件(如提取、纯化、
储存等)也会影响蛋白质的稳定性和生物活性。
此外,若操作时存在
空气接触、低pH、高温等问题,也可能导致蛋白质的结构和功能性质
受到破坏。
综上所述,蛋白质的诱导表达需要严格的实验操作和优化条件,
只有在正确的操作和适宜的条件下,才能成功地诱导出蛋白质。
为此,实验人员需要对每个实验参数进行仔细研究和调整,以充分利用蛋白
质诱导技术的优点。
重组蛋白表达技术的使用中常见问题

重组蛋白表达技术的使用中常见问题蛋白质是生命体内重要的组成部分,它们参与了几乎所有的生物过程。
为了研究和利用蛋白质的功能,科学家们通过重组蛋白表达技术来大量产生目标蛋白。
然而,在使用重组蛋白表达技术的过程中,常常会遇到一些问题。
本文将详细探讨重组蛋白表达技术使用中的一些常见问题,并提供相应的解决方法。
1. 表达水平低在使用重组蛋白表达技术时,常常会遇到表达水平低的问题。
低表达水平可能由多种原因引起,包括启动子的活性不足、转录过程中的阻塞或降解、翻译后期的限制以及蛋白质的不稳定性等。
解决方法:- 优化启动子选择:选择活性较高的启动子,如T7、CMV或SP6启动子。
- 优化培养条件:优化培养基组分、培养温度、表达宿主菌的载体拷贝数等,以提高蛋白表达水平。
- 优化转化方法:尝试使用电转化、化学转化或峰值冲击转化等方法来提高表达宿主菌的转化效率。
- 优化培养时间:延长培养时间,以便提高目标蛋白的表达水平。
2. 目标蛋白形成包含体在表达过程中,目标蛋白常常形成包含体(inclusion body),即蛋白质以不溶性的聚集体形式存在。
解决方法:- 优化培养条件:调整培养温度、培养基成分,提高溶解蛋白的折叠效率。
- 引入辅助蛋白质:结合引入辅助蛋白质的策略,帮助目标蛋白的正确折叠和溶解。
- 进行亲和纯化:通过抗标签或亲和层析等技术,将包含体中包含的目标蛋白从非特异性蛋白质中进行纯化。
3. 目标蛋白磷酸化或糖基化不足重组蛋白质常常需要进行修饰,包括磷酸化和糖基化等。
然而,有时目标蛋白表达后,修饰的程度不足,影响功能和稳定性。
解决方法:- 优化培养条件:调整培养基中相关原料的浓度,如添加合适的磷酸盐或糖类物质,促进修饰的进行。
- 引入修饰相关基因:将相关调控基因引入到表达宿主菌中,提高修饰相关酶的表达水平。
- 转化进化系统:构建具有修饰相关基因的酵母或细菌转化进化系统,通过长时间的适应培养,提高修饰效率。
4. 目标蛋白的折叠和稳定性问题有些目标蛋白在表达和纯化过程中容易失去活性或不稳定。
大量蛋白表达下调的原因

大量蛋白表达下调的原因有多种,包括:
1. 基因表达调控:基因的表达受到多种因素的影响,如转录水平、翻译水平、蛋白质降解等。
这些因素可能因细胞生理状态、环境因素、药物处理等因素而发生变化,导致蛋白表达下调。
2. 基因突变:基因突变可能导致蛋白质结构异常,从而影响其功能和稳定性,导致表达下调。
3. 染色体变异:染色体变异可以改变基因的表达调控序列,如启动子区域的顺式元件、增强子等,从而影响蛋白表达。
4. 信号转导通路异常:信号转导通路异常可以影响细胞对各种刺激的反应性,进而影响蛋白表达。
5. 转录因子失衡:转录因子可以调节基因表达,如果这些因子的平衡发生变化,也可能导致蛋白表达下调。
6. 蛋白降解途径增强:有些蛋白可能通过降解途径被迅速降解,如果这种途径增强,就会导致相应蛋白表达下调。
7. 细胞周期和凋亡:细胞周期和凋亡过程会动态调整细胞内蛋白质的表达。
以上是常见的一些原因,具体情况可能会因个体差异而有所不同。
如遇到特定情况,建议咨询专业医生。
外源蛋白表达失败或不表达的原因和解决方法

外源蛋白表达失败或不表达的原因和解决方法外源蛋白表达的定义和意义外源蛋白表达是指在一个生物体(如细菌、酵母、昆虫、哺乳动物等)中表达另一个生物体(如植物、动物、病毒等)的蛋白质的技术,它是生物技术的重要手段和工具。
外源蛋白表达可以用于研究蛋白质的结构和功能,开发新型的药物和疫苗,生产工业用途的酶和激素等。
外源蛋白表达失败或不表达的原因外源蛋白表达失败或不表达的原因很多,可以分为上游和下游两类。
上游原因上游原因是指与外源基因本身特性或重组蛋白细胞毒性等相关的原因,它们只能通过上游的合理设计来解决。
上游原因包括以下几种:•外源基因与宿主细胞的密码子用法不匹配,导致翻译效率低或错误。
•外源基因含有宿主细胞不能识别或不能正确加工的信号序列,导致转运或定位异常。
•外源基因含有宿主细胞不能识别或不能正确剪切的内含子,导致转录或翻译中断。
•外源基因含有宿主细胞不能识别或不能正确修饰的位点,导致糖基化、磷酸化等后期修饰缺失或异常。
•外源基因含有宿主细胞不能兼容或不能稳定保存的序列,导致重组质粒不稳定或降解。
•重组蛋白对宿主细胞产生毒性或抑制作用,导致细胞生长受阻或死亡。
下游原因下游原因是指与下游的操作不当或失误等相关的原因,它们可以通过下游的规范操作和优化条件来避免。
下游原因包括以下几种:•重组菌甘油管保存时间过长,导致质粒丢失或突变。
•诱导剂加错或用量不当,导致重组蛋白表达水平低或无法诱导。
•表达条件选择不合适,导致重组蛋白表达效率低或形成包涵体。
•蛋白纯化步骤操作不规范,导致重组蛋白损失或污染。
•SDS-PAGE或WB检测操作不当或试剂失效,导致重组蛋白检测失败或假阴性。
外源蛋白表达失败或不表达的解决方法外源蛋白表达失败或不表达的解决方法需要根据具体的原因和情况进行选择和调整。
一般来说,可以从以下几个方面进行优化:•优化外源基因的设计,使其与宿主细胞的密码子用法、信号序列、内含子、修饰位点等相匹配或适应,或者使用人工合成的优化基因。
重组蛋白表达量低的原因

重组蛋白表达量低的原因重组蛋白是一种通过基因工程技术获得的蛋白质,其广泛应用于医药、农业和工业等领域。
然而,有时候在重组蛋白的表达过程中会出现表达量低的情况。
本文将探讨一些可能导致重组蛋白表达量低的原因,并提出相应的解决方法。
重组蛋白表达量低可能与宿主菌的选择有关。
不同的宿主菌具有不同的表达能力和代谢途径,因此选择合适的宿主菌对于提高重组蛋白表达量至关重要。
一些常用的宿主菌包括大肠杆菌(E. coli)、酵母菌(Saccharomyces cerevisiae)和哺乳动物细胞等。
在选择宿主菌时,需要考虑到其表达系统的稳定性、抗蛋白质降解能力以及合成成本等因素。
重组蛋白表达量低还可能与表达载体的设计有关。
表达载体是将目标基因插入宿主菌中进行表达的工具,其设计合理与否直接影响重组蛋白的表达效果。
在设计表达载体时,可以考虑使用强劲的启动子和转录终止子来提高基因的表达水平。
此外,还可以在表达载体中加入调控元件,如增加转录因子结合位点或操纵启动子的序列,以提高转录水平。
此外,还可以选择适当的信号肽序列来促进蛋白质的合成和分泌。
重组蛋白表达量低还可能与培养条件有关。
培养条件的优化可以显著提高重组蛋白的表达量。
首先,合理调节培养基的成分,如氮源、碳源和矿物质等,以满足菌体生长和蛋白质合成的需求。
其次,控制培养的温度、pH值和氧气供应等因素,以提供一个适宜的环境来促进蛋白质的表达。
此外,还可以加入一些诱导物质,如异丙基硫代半乳糖苷(IPTG)和甲醇等,来诱导目标基因的表达。
重组蛋白表达量低还可能与目标基因本身的特性有关。
一些基因可能具有高度的GC含量、结构复杂或毒性较强,这些特性都会影响基因的表达。
在此情况下,可以通过优化基因序列的设计来提高重组蛋白的表达量。
例如,可以通过基因合成或点突变来优化目标基因的序列,以解决结构复杂或毒性较强的问题。
除了上述因素外,重组蛋白表达量低还可能与转录和翻译后修饰等过程有关。
转录和翻译后修饰是蛋白质表达的重要环节,对于保证蛋白质的稳定性和功能性至关重要。
垂体腺瘤组织P16蛋白表达缺失及原因分析

在较高阳性率,其相对端粒酶活性也较相邻正常组织高(P <0.05),这与Mutirangura 等[5]研究结果相似。
这一方面反映了端粒酶是细胞分裂增殖调控的重要因素,另一方面也证实了在癌变形成后期端粒酶活性水平升高。
另有学者在用绝经前的良性子宫内膜和子宫内膜癌组织做端粒酶活性检测时,发现两种组织均有很高的阳性率,而绝经后的子宫内膜组织端粒酶活性表达呈弱阳性,他们认为快速增生的子宫内膜由于有较高的端粒酶活性表达,较有可能发展成癌肿。
而癌旁组织中可有一些非典型性增生,甚至类似原位癌的组织学改变,部分细胞增生活跃,结合本实验,可以认为端粒酶的激活是恶性肿瘤形成的重要分子因素,它在病变由良性转变为恶性过程的后期出现,是癌症多步骤形成过程中的早期事件。
端粒酶可视为恶性肿瘤形成的早期分子指标,也可作为阻断恶性转化形成的靶分子。
本实验中,另有1例腮腺增生性淋巴结炎的端粒酶活性为阳性,但端粒酶相对活性水平较恶性肿瘤低,这可能与淋巴细胞增生活跃有关[6],由于例数少,其原因与机制尚待进一步探讨。
参考文献1 Nelson NJ.Researches debate clinical role of telomerase.J NatlCancer Inst,1996,88(1):10212 张桥,万德森.端粒酶在人类肿瘤发展过程的表达及其利用.癌症,1997,16(6):4613 M ao L,EI Naggar AK,Fan YH,et al.Telomerase activity in head and neck squamous cell carcinoma and adjacent tissues.Cancer Res,1996,56(24):56004 Califano J,Ahrendt SA,Meini nger G,et al.Detection of telom erase activi ty in oral rinse from head and neck squamous cell carcinoma.patients Cancer Res,1996,56(24):57205 Mutirangura A,Supiyaphun P,Trirekapan S,et al.Telomerase activity in oral leukoplakia and head and neck sq uamous cell carcinomas.Patients Cancer Res,1996,56(15):35306 Sumida T,Sogawa K,Hamakawa H,et al.Detection of telom erase acti vity in oral lesions.J Oral Pathol Med,1998,27(3):1117 Hiyama E,Hiyama K,Yokoyama T,et al.Correlating telom erase activity levels wi th human neuroblastoma outcomes.Nature M ed.1995,1:2498 Dahse R,Fiedler W,Ernst G.Telomeres and Telomerase:bio log ical and cli nical importance.Clin Chem,1997,43:7089 Was MH,Li WZ,Duggan BD,et al.T elomerase activity in benign and malignant epi thelial ovarian tumors.J Natl Cancer Inst.1997,89:437(2001 03 20收稿 本文编辑张功员)*博士基金资助课题垂体腺瘤组织P 16蛋白表达缺失及原因分析*魏新亭1)张亚卓2)罗世祺2)1)河南医科大学第一附属医院神经外科郑州450052 2)北京天坛医院神经外科北京100050 男,37岁,博士,主治医师,研究方向:垂体腺瘤的病理机制关键词 垂体腺瘤;p16;纯和性缺失;甲基化中图分类号 R736 4摘要 目的:探讨垂体腺瘤组织中p16的表达及表达缺失的原因。
蛋白表达量低的原因

蛋白表达量低的原因蛋白表达量低是指细胞所表达的蛋白质数量较少,因此会对细胞功能产生严重影响。
蛋白表达量低的原因有多种,本文将分步骤阐述其中的原因。
第一步,起始物质不足。
起始物质是指蛋白质的前体分子,只有充足的起始物质才能保证蛋白质的表达。
在细胞内,起始物质通常来自于mRNA的翻译及其他蛋白质的降解。
然而,当细胞面临负面因素时,这些起始物质的来源可能会减少,从而导致蛋白表达量低。
第二步,转录后修饰过程受到影响。
在蛋白表达过程中,mRNA首先会被翻译成蛋白质。
而在此之前,mRNA需要经过许多后修饰过程,包括剪切、修饰等等。
如果这些后修饰过程受到干扰,那么就会影响蛋白表达量。
例如,在肿瘤细胞中,由于异常表达的蛋白酶会将转录后的mRNA降解,不仅会影响mRNA的稳定性,同时也会影响蛋白表达量。
第三步,翻译后修饰过程受到影响。
翻译后修饰是指在蛋白质合成完成后,对蛋白质进行各种修饰。
这些修饰过程也会影响蛋白表达量。
例如,蛋白质需要适当糖基化才能具有正确的功能,并且稳定在细胞中。
但当翻译后修饰过程出现异常时,糖基化的质量或数量不足,就会导致蛋白表达量低。
第四步,蛋白降解过程失调。
在蛋白质合成后,蛋白质还需要经过降解过程。
在正常情况下,降解过程可以去除蛋白质中的异常部分,并将其分解成氨基酸。
然而,在某些情况下,蛋白降解过程也可能受到影响,导致蛋白质的降解速度变慢。
这就意味着蛋白质会积累在细胞中,这可能会影响蛋白表达量。
在总结中,蛋白表达量低是一个复杂的问题,需要针对许多因素进行分析和研究,包括起始物质不足、转录后修饰过程受到影响、翻译后修饰过程受到影响以及蛋白降解过程失调等因素。
研究这些因素的相关机制将有助于改善细胞蛋白表达量低的情况,从而提高细胞的功能。
蛋白不表达常见原因及分析定稿版

蛋白不表达常见原因及分析HUA system office room 【HUA16H-TTMS2A-HUAS8Q8-HUAH1688】蛋白不表达:常见原因及分析根据自己体会和蛋白版的既往精华帖子,总结了没有发现蛋白质表达的原因,或者蛋白质不表达的原因,欢迎大家拍砖。
1.载体构建错误。
这个屡见不鲜,很多克隆新人经常弄错读码框。
比如Qiagen的pQE系列载体,其克隆位点常有一两个碱基的区别;另外有些酶产生粘端有些酶产生平端,这些都容易导致读码框错误,从而表达不出来。
2.宿主菌选择不当。
不同的宿主菌其基因型是不一样的。
有些经过特殊修饰的载体,或者特殊用途的载体,或者有特殊启动子的载体,必须选择合适的宿主菌进行表达。
因此,当你的蛋白没有表达出来时,可以考虑更换宿主菌。
见下图3.密码子的使用频率低。
有些基因其本身含有许多稀有密码子,尤其是起始密码之后的15个碱基之内的稀有密码子,对蛋白表达有着很重要的影响。
优化密码子对原核表达似乎效果很好,对真核表达系统未见得有很好的效果。
曾经有某人在毕赤酵母表达某蛋白两年未果,试图将密码子优化进行表达,结果还是没有表达。
一气之下将该优化的基因序列克隆到原核表达载体,表达量居然出奇地高!这是一个辛酸的笑话,但是一个真实的故事。
但是有一点我可以有很大把握的说:对于真核表达,密码子优化只能起锦上添花的作用(确认有表达,以此来提高表达量),而不能雪中送炭(没有表达出来,通过密码子优化极有可能不奏效)。
4、质粒不稳定或者质粒丢失。
pET系统通常比较稳定。
但是你选用带氨苄青霉素抗性的载体时,也许有可能产生β-lactamase降解了抗生素,使质粒丢失。
还有一种情况是表达重组的毒素蛋白,对宿主细胞也有毒性,造成质粒丢失。
这种情况多见于真核表达系统。
5、蛋白酶将蛋白降解了。
这种情况常由重组蛋白本身的N-或C-端序列引起的。
当蛋白N-端是Arg, Leu, Lys, Phe, Trp,或 Tyr这些氨基酸时,容易遭受蛋白酶降解,此即N-末端规则。
蛋白质不表达的原因分析

蛋白质不表达:常见原因及分析1.载体构建错误。
这个屡见不鲜,很多克隆新人经常弄错读码框。
比如Qiagen的pQE系列载体,其克隆位点常有一两个碱基的区别;另外有些酶产生粘端有些酶产生平端,这些都容易导致读码框错误,从而表达不出来。
2.宿主菌选择不当。
不同的宿主菌其基因型是不一样的。
有些经过特殊修饰的载体,或者特殊用途的载体,或者有特殊启动子的载体,必须选择合适的宿主菌进行表达。
因此,当你的蛋白没有表达出来时,可以考虑更换宿主菌。
3.密码子的使用频率低。
有些基因其本身含有许多稀有密码子,尤其是起始密码之后的15个碱基之内的稀有密码子,对蛋白表达有着很重要的影响。
优化密码子对原核表达似乎效果很好,对真核表达系统未见得有很好的效果。
曾经有某人在毕赤酵母表达某蛋白两年未果,试图将密码子优化进行表达,结果还是没有表达。
一气之下将该优化的基因序列克隆到原核表达载体,表达量居然出奇地高!这是一个辛酸的笑话,但是一个真实的故事。
4、质粒不稳定或者质粒丢失。
pET系统通常比较稳定。
但是你选用带氨苄青霉素抗性的载体时,也许有可能产生β-lactamase降解了抗生素,使质粒丢失。
还有一种情况是表达重组的毒素蛋白,对宿主细胞也有毒性,造成质粒丢失。
这种情况多见于真核表达系统。
5、蛋白酶将蛋白降解了。
这种情况常由重组蛋白本身的N-或C-端序列引起的。
当蛋白N-端是Arg, Leu, Lys, Phe, Trp,或Tyr这些氨基酸时,容易遭受蛋白酶降解,此即N-末端规则。
N-端是Met时,大肠杆菌可以悄悄地把这个Met偷走,特别是Met后紧跟着一个带小侧链的氨基酸时。
C-末端存在非极性氨基酸时,也容易导致蛋白被降解。
C末端最后5个氨基酸是极性的或者带电荷的,则不易被降解。
6、二级翻译起始位点。
这种情况见于你的序列里正好含有和核糖体结合位点完全一致的序列。
那就怪不得人家了,核糖体会很高兴地找到这个位点,然后开始翻译,致使你的蛋白被截短,在电泳时看不到预期大小的片段。
蛋白不表达常见原因及分析

蛋白不表达常见原因及分析蛋白质是生物体内最基本的结构单位,它们在细胞的生物化学功能中起着至关重要的作用。
然而,在某些情况下,蛋白质的表达可能会受到抑制或受到其他因素的干扰,导致其无法正常表达。
本文将探讨蛋白不表达的常见原因及其分析。
1. 基因突变基因突变是导致蛋白质不表达的主要原因之一。
突变可能引起DNA序列的改变,进而使正常的转录和翻译过程受到影响。
例如,点突变可能会导致氨基酸序列发生变化,从而影响蛋白质的结构和功能。
这种突变可能会导致蛋白质在转录或翻译过程中发生错误,并最终导致其无法正常表达。
2. 转录调控异常蛋白质的表达通常受到转录的调控。
转录调控是指在基因转录过程中通过启动子和调控因子来控制基因表达水平的调节机制。
如果转录调控过程中发生异常,例如调控因子缺失或突变,将导致蛋白质无法正常表达。
此外,DNA甲基化也是一种常见的转录调控机制,它可以通过甲基化基因组区域来静默基因的表达。
3. 翻译后修饰异常翻译后修饰是蛋白质合成后的重要过程,它可以调节蛋白质的结构和功能。
然而,某些异常情况下,翻译后修饰可能无法正确进行,导致蛋白质无法正常表达。
例如,翻译后修饰酶的缺失或突变可能会导致磷酸化、甲基化、乙酰化等修饰无法进行,从而影响蛋白质的功能。
4. 细胞环境影响蛋白质的表达还受到细胞环境的影响。
细胞内环境的改变可能会影响蛋白质的产生和稳定性。
例如,异常的细胞应激反应、病毒感染、细胞内局部代谢物浓度的变化等都可能导致蛋白质无法正常表达。
5. 蛋白质降解异常蛋白质的降解也是影响蛋白质表达的重要因素。
异常的蛋白降解过程可能导致蛋白质无法稳定存在。
例如,异常的泛素化和蛋白酶体功能可能导致蛋白质的过早降解,从而影响其表达。
综上所述,蛋白质不表达的原因多种多样,包括基因突变、转录调控异常、翻译后修饰异常、细胞环境影响以及蛋白质降解异常等。
了解这些原因并分析其影响是研究蛋白质功能和相关疾病的重要基础。
未来的研究应该继续深入探索这些问题,以促进我们对蛋白质表达机制的理解,并开发出新的疾病治疗策略。
大肠杆菌蛋白未表达的原因

大肠杆菌蛋白未表达的原因大肠杆菌是一种常见的细菌,其被广泛应用于生物学研究和工业生产中。
然而,有时候在表达外源蛋白时,大肠杆菌可能会出现未表达的情况。
本文将探讨大肠杆菌蛋白未表达的原因。
大肠杆菌蛋白未表达的原因之一是转录水平的问题。
转录是DNA 信息转化为RNA的过程,而RNA是蛋白质合成的模板。
如果转录过程中出现了错误,如基因缺失、突变或者启动子区域的问题,都可能导致蛋白质未能正常表达。
此外,转录因子的缺失或功能异常也会影响蛋白质的表达。
翻译过程中的问题也是导致大肠杆菌蛋白未表达的原因之一。
翻译是指RNA信息转化为蛋白质的过程。
在翻译过程中,如果发生了错误的蛋白质合成、折叠或者修饰,都可能导致蛋白质未能正常表达。
例如,可能存在缺乏适当的翻译机器或者翻译因子的问题,导致蛋白质合成受阻。
大肠杆菌蛋白未表达的原因还包括转运和定位的问题。
蛋白质需要被正确地转运到细胞的不同位置,才能发挥其功能。
如果转运过程中发生了错误,蛋白质可能会被定位到错误的位置,从而无法正常表达。
大肠杆菌蛋白未表达的原因还包括细胞内环境的问题。
细胞内的环境因子,如温度、pH值、氧气浓度等,都可能影响蛋白质的表达。
如果细胞内环境不适宜,蛋白质合成的速率可能会受到限制,从而导致蛋白质未能正常表达。
此外,细胞内可能存在竞争性的蛋白质合成过程,如果其他蛋白质的合成速率过快,也会影响目标蛋白质的表达。
大肠杆菌蛋白未表达的原因还可能与外源蛋白本身的特性有关。
某些外源蛋白可能具有特殊的结构或功能,与大肠杆菌的细胞机制不兼容。
例如,某些蛋白质可能具有毒性,会对大肠杆菌的生长和生存产生负面影响,从而导致蛋白质未能正常表达。
总结起来,大肠杆菌蛋白未表达的原因可能涉及转录水平、翻译过程、转运和定位、细胞内环境以及外源蛋白本身的特性等多个方面。
了解这些原因有助于我们更好地理解蛋白质表达的机制,并为解决大肠杆菌蛋白未表达的问题提供参考和指导。
希望通过今后的研究和实践,能够更好地克服这些问题,提高大肠杆菌蛋白表达的效率和成功率。
蛋白质纯化常见问题及解决方案

蛋白质纯化常见问题及解决方案蛋白质纯化是生物化学研究中非常重要且常见的实验技术。
纯化蛋白质可以帮助科学家深入理解蛋白质的结构和功能,从而推动相关领域的研究进展。
然而,在进行蛋白质纯化的过程中,科学家们常常会遇到各种问题。
本文将介绍一些常见的问题,并提供解决方案,以帮助研究人员顺利进行蛋白质纯化实验。
常见问题一:蛋白质表达量太低在蛋白质纯化中,蛋白质的表达量是一个非常关键的因素。
然而,有时候我们会发现蛋白质的表达量过低,难以获得足够纯度的样品。
这可能有以下几个原因:1. 载体选择不当:选择适合的表达载体对蛋白质表达量有很大影响。
可以尝试使用高效表达载体,如pET系列载体,来提高蛋白质的表达量。
2. 菌株选择不当:不同菌株对蛋白质表达量有差异。
常用的菌株包括大肠杆菌(E.coli)和酵母菌等。
可以尝试不同菌株进行表达,找到最适合的菌株。
3. 条件优化不足:包括温度、培养基和诱导条件等。
合理优化这些条件有助于提高蛋白质的表达量。
解决方案:针对上述问题,可以尝试优化表达载体、菌株和条件,并进行系统的优化实验。
此外,还可以尝试使用其他表达系统,如哺乳动物细胞和昆虫细胞等。
常见问题二:蛋白质不稳定或易聚集蛋白质在纯化过程中可能会失去稳定性,因而导致降解、聚集或失活。
这种情况可能是由于多种因素造成的,例如温度、pH值、盐浓度和氧气等。
解决方案:对于易聚集和不稳定的蛋白质,可以采取以下一些措施:1. 降低温度:将温度降低到4℃以下,可以减缓蛋白质的降解和聚集速度。
2. 优化缓冲液:选择合适的缓冲液,并进行pH和离子强度的优化。
有时候添加一些辅助物质,如甘油、蔗糖或胰蛋白酶抑制剂,可以提高蛋白质的稳定性。
3. 使用小分子化合物:有时候可以加入一些小分子化合物,如L-辅酶A和聚氧乙烯醇等,来增强蛋白质的稳定性。
常见问题三:蛋白质纯化的污染蛋白质纯化过程中常常会伴随着各种污染物的存在,如其他蛋白质、核酸、有机化合物和盐等。
2016.08.31 毕赤酵母蛋白不表达的原因(排版)

毕赤酵母蛋白不表达的原因很多朋友问这样一个问题:为什么毕赤酵母不表达?他们自己也很纳闷,重组酵母PCR检测也证明目的基因重组了,但是诱导之后就是在表达上清中检测不到目的蛋白,仔细研究操作手册后仍然不知道原因。
本人,根据自己的经验,采用倒推的方法,按实验过程从后向前分析,供大家参考:1、诱导之后表达上清中检测不到目的蛋白:①:检测的方法是否有问题,要考虑是不是蛋白表达量低而没有检测到?如果是蛋白表达低,可以选择浓缩蛋白,具体的方法很多,有TCA、丙酮、浓缩柱等等方法,之前在本版已经发过帖,在此不赘述。
②:如果蛋白浓缩N倍之后仍然检测不到,那基本可以确证蛋白并不在上清中。
那么蛋白到哪里去了,考虑是否没有分泌出来,而是在胞内,那就需要通过裂解酵母来检测胞内蛋白,具体的方法很多,在此也不赘述,曾整理过相关破碎的帖子。
③:如果胞内也没有目的蛋白表达,那么基本可以确定蛋白并没有表达。
2、为什么没有表达呢?倒推回来就是诱导的过程了,诱导体系是什么?甲醇浓度是多少?培养问题是多少,转速是多少?这些都要注意。
甲醇一般是0.5%-1.0%,本人用的是0.5%,也有很多人也用1.0%,曾见过一个帖子,说超过1.5%反而会抑制表达,没有验证过,供大家参考。
培养问题28-30度比较合适,转速250rpm比较合适,诱导体系没有固定的体系,说明书上推荐的是BMGY到OD600 2~6,换到BMMY 中OD600 为1左右。
3、如果诱导的过程也没有问题,那问题就复杂了,特别是重组酵母PCR 检测证明目的基因确实已经发生了重组。
这个时候是最郁闷的了,但是郁闷怎么办,还是要找原因,在此我给的建议是先做RT-PCR证明mRNA水平的情况,也就是说有没有转录。
如果转录了,后续的操作也没有问题(本帖的1、2项),那么只有重新设计实验,比如换酵母株,有文章上说:用GS115表达不出蛋白,换KM71H后,大部分克隆能表达。
4、关于毕赤酵母不表达的。
蛋白质表达与疾病解析蛋白质表达异常与疾病的关系

蛋白质表达与疾病解析蛋白质表达异常与疾病的关系蛋白质表达与疾病解析蛋白质表达异常与疾病的关系蛋白质是细胞内最基本的物质之一,其在细胞中具有非常重要的作用。
细胞内的蛋白质是由遗传信息编码所得,其合成的需要受到基因的调控。
在人体内,蛋白质的异常表达或者突变,往往意味着某种疾病的发生。
在本文中,我们将探讨蛋白质表达与疾病的关系,并且讨论蛋白质表达异常的原因以及如何治疗。
一、蛋白质表达异常与疾病的关系蛋白质表达异常和疾病的关系非常密切。
正常情况下,蛋白质的表达是受到基因调控的,如果出现异常,则会导致蛋白质的合成和功能受到影响,从而引发某些疾病的发生。
举个例子,FXN 基因失调会导致 Frataxin 蛋白质表达减少,从而引发 Friedrich's ataxia 疾病。
另外,蛋白质表达异常和疾病的发生之间有相互的关系,疾病往往也会导致蛋白质表达的异常。
比如,在许多肿瘤细胞中,肿瘤抑制基因失活或者失调会导致卵泡生长素(FSH)或雌激素受体(ER)的异常表达,从而引发肿瘤的发生和发展。
以上都是蛋白质表达异常和疾病的一些基础知识,接下来将会讨论一些蛋白质表达异常的原因。
二、蛋白质表达异常的原因蛋白质表达异常的原因有很多,下面介绍几种常见的原因。
1. 突变蛋白质表达异常的一个主要原因是基因的突变,尤其是那些带有重要遗传信息的基因的突变。
由于突变,DNA序列发生了一些变化,使得编码蛋白质的 mRNA 信息发生了改变,导致蛋白质的合成和功能发生变化。
2. 环境因素环境因素也会影响蛋白质的表达。
举个例子,高温、低温或者酸碱度的变化,都可能影响蛋白质的折叠以及它们的合成,从而引发蛋白质表达异常。
3. 蛋白质的修饰蛋白质的修饰也会导致蛋白质表达异常。
蛋白质的修饰通常是指蛋白质的磷酸化、甲基化、酰化等化学修饰方式,这些化学修饰会影响蛋白质的活性、亲和力或者与其它分子的相互作用等,从而影响其表达。
三、如何治疗蛋白质表达异常引起的疾病针对不同的蛋白质表达异常引起的疾病,治疗方法也各不相同。
原核表达蛋白不表达原因

原核表达蛋白不表达原因
原核表达蛋白不表达原因可能与以下因素有关:
1. 编码序列缺失或不完整
部分原核菌体的基因组存在缺失或未完整编码的基因,因此未能成功
合成蛋白质。
此外,某些原核菌体也可能存在基因突变或缺失,导致
相关蛋白质无法被成功合成。
2. 翻译后修饰不足
蛋白质翻译后需要经过一系列修饰才能成为功能完整的成熟蛋白质。
在一些原核菌体中,可能存在相关修饰酶的缺失或修饰过程受到抑制,导致蛋白质无法成功合成和修饰。
3. 转录和翻译水平低下
某些原核菌体的细胞周期较短,转录和翻译能力较弱。
在这种情况下,它们可能无法在完成生命周期前成功合成足够的蛋白质。
4. 蛋白质抑制作用
有一些蛋白质可以抑制原核菌体的转录和翻译过程,从而阻断蛋白质的合成。
这些蛋白质可能是内源性的,即由细胞自身产生,也可能是外源性的,即来自其他微生物的毒素或环境因素。
5. 环境因素的影响
一些环境因素,例如高温、低温、酸性、碱性和高盐浓度等,可能会对原核菌体中的基因表达产生负面影响,从而导致蛋白质的合成受到限制。
综上,原核表达蛋白不表达的原因可能涉及基因缺失、翻译后修饰不足、转录和翻译水平低下、蛋白质抑制作用以及环境因素的影响等多种因素。
对这些原因的深入研究将有助于提高原核表达系统的表达效率和成功率。
大肠杆菌蛋白未表达的原因

大肠杆菌是一种常见的细菌,常被用于表达蛋白质。
然而,有时候在表达蛋白质的过程中,可能会遇到一些问题导致大肠杆菌中目标蛋白未能成功表达。
以下是一些常见的原因:
1. 毒性效应:某些蛋白质可能对大肠杆菌有毒性,并导致细菌生长受阻或死亡。
这种毒性效应可能是由于蛋白质本身的性质,如聚集、结构不稳定或带有毒性域。
2. 结构不利:目标蛋白质的结构可能在大肠杆菌中很难正确折叠或稳定。
这可能是由于缺乏必要的辅助蛋白质、蛋白质太大或含有复杂的结构域等原因。
3. 转录/翻译问题:在大肠杆菌中,蛋白质的表达受到转录和翻译等多个层面的调控。
如果目标蛋白质的起始密码子或启动子序列存在问题,可能会导致表达受阻。
4. 不稳定的mRNA:在表达过程中,目标蛋白质的mRNA可能容易降解或被细菌的RNase 酶降解,从而影响蛋白质的表达。
5. 细胞环境问题:有时候,大肠杆菌的细胞环境可能对目标蛋白质的表达不利。
例如,蛋白质可能会被细胞内的蛋白酶降解,或者存在竞争性的表达和折叠过程。
针对以上的问题,科研人员通常采取一系列策略来提高目标蛋白质的表达成功率,例如优化表达载体、调节表达条件、使用表达辅助蛋白质等方法。
这些策略有助于克服大肠杆菌蛋白未表达的问题,并最终成功获得目标蛋白质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白不表达:常见原因及分析
根据自己体会和蛋白版的既往精华帖子,总结了没有发现蛋白质表达的原因,或者蛋白质不表达的原因,欢迎大家拍砖。
1.载体构建错误。
这个屡见不鲜,很多克隆新人经常弄错读码框。
比如Qiagen的pQE系列载体,其克隆位点常有一两个碱基的区别;另外有些酶产生粘端有些酶产生平端,这些都容易导致读码框错误,从而表达不出来。
2.宿主菌选择不当。
不同的宿主菌其基因型是不一样的。
有些经过特殊修饰的载体,或者特殊用途的载体,或者有特殊启动子的载体,必须选择合适的宿主菌进行表达。
因此,当你的蛋白没有表达出来时,可以考虑更换宿主菌。
见下图
3.密码子的使用频率低。
有些基因其本身含有许多稀有密码子,尤其是起始密码之后的15个碱基之内的稀有密码子,对蛋白表达有着很重要的影响。
优化密码子对原核表达似乎效果很好,对真核表达系统未见得有很好的效果。
曾经有某人在毕赤酵母表达某蛋白两年未果,试图将密码子优化进行表达,结果还是没有表达。
一气之下将该优化的基因序列克隆到原核表达载体,表达量居然出奇地高!这是一个辛酸的笑话,但是一个真实的故事。
但是有一点我可以有很大把握的说:对于真核表达,密码子优化只能起锦上添花的作用(确认有表达,以此来提高表达量),而不能雪中送炭(没有表达出来,通过密码子优化极有可能不奏效)。
4、质粒不稳定或者质粒丢失。
pET系统通常比较稳定。
但是你选用带氨苄青霉素抗性的载体时,也许有可能产生
β-lactamase降解了抗生素,使质粒丢失。
还有一种情况是表达重组的毒素蛋白,对宿主细胞也有毒性,造成质粒丢失。
这种情况多见于真核表达系统。
5、蛋白酶将蛋白降解了。
这种情况常由重组蛋白本身的N-或C-端序列引起的。
当蛋白N-端是Arg, Leu, Lys, Phe, Trp,或Tyr这些氨基酸时,容易遭受蛋白酶降解,此即N-末端规则。
N-端是Met时,大肠杆菌可以悄悄地把这个Met偷走,特别是Met 后紧跟着一个带小侧链的氨基酸时。
C-末端存在非极性氨基酸时,
也容易导致蛋白被降解。
C末端最后5个氨基酸是极性的或者带电荷的,则不易被降解。
6、二级翻译起始位点。
这种情况见于你的序列里正好含有和核糖体结合位点完全一致的序列。
那就怪不得人家了,核糖体会很高兴地找到这个位点,然后开始翻译,致使你的蛋白被截短,在电泳时看不到预期大小的片段。
7、SD序列。
这个不陌生吧?考研时老师喜欢出名词解释,也难怪人家老是拿这个出题----SD序列和起始密码子序列(80%是AUG,也有GUG的)之间的距离,对蛋白表达的效率也有着非常重要的影响。
SD序列本身的组成对翻译效率也有影响。
有时为了减少包涵体的产生,还特别对SD序列进行修饰呢!
8、mRNA的二级结构。
在克隆之前,你得看看你的序列里是否有和核糖体结合位点和/或翻译起始位点互补的序列。
如然,你最好进行同义密码子替换。
否则由此形成的mRNA二级结构,会让翻译嘎然而止的。
9、意外终止。
这种情况见于PCR扩增序列时,会和你开个不大不小的玩笑。
比如它会将序列中间TAC突变为TAA,让
你的蛋白翻译刹车。
所以在进行表达之前,一定要进行测序,避免这种情况的发生。
10、转录终止子。
转录终止子的存在可以促进蛋白表达;但是缺少时就会造成“通读”,没完没了地读下去。
这在pET系统里不成问题,因为它在靶基因的相反方向有个选择性的标记基因。
如果你的靶基因正好和这个标记基因方向一致,那么你得看看你的靶基因后是否有个转录终止子。
如果没有的话,它们会竞争得天昏地暗,抢着生成mRNA和蛋白质。
11、mRNA的不稳定性。
靶基因的mRNA常聚集于细胞内。
但是大肠菌的mRNA及其不稳定。
如果在mRNA的5'-非翻译区和3‘-rho非依赖性终止子处插入稳定结构序列,可以促进mRNA的稳定性。
尤其是5'末端要是有个不带突出的发夹结构,能让mRNA在胞浆内无生命之虞。
12、检测方法的可行性。
有时候,蛋白的确表达了,只是表达量特别低,或者和杂带靠得特别近,致使你错误地以为蛋白没有表达。
这时候,你可千万别忘记了生物学实验的两大黄金准则:对照和重复。
说到对照,有很多层意思。
最基本的意思是,要设立空载体对照。
在真核系统表达的蛋白,常常量特别低。
因此你不要老是想着WB和SDS-PAGE去检测。
这时候,你必须多看文献,
另辟蹊径,从文献中找找看这个蛋白有米有很特别的性质----比如说如果它具有酶活性,那简直就是便宜你了。
还比如说,某些蛋白具有异样性质,比如说流感病毒的HA,你拿表达的不同梯度稀释的蛋白做个血凝。
如果发生血凝,并且呈现一定的梯度关系,那简直就是板上钉钉的事情了。
总结起来,套用一句很经典的电影台词:能表达出来的蛋白,其原因都是一致的;表达不出来的蛋白,各有各的原因。
我这个小帖子,就是给你一点启示:从哪里找原因。
希望能抛砖引玉,得到更多有价值的建议。
