8 2009第八章酸碱平衡 ppt课件.ppt
合集下载
酸碱平衡 ppt课件

经抢救后病人血压逐渐上升至平稳。 心率仍然130-150次/分 呼吸急促 四肢厥冷 意思淡漠,烦躁。
讨论
此时病人可能存在的酸碱平衡失调类型?
代谢性酸中毒
是指细胞外液H+增加和(或)HCO3- 丢失而引起的以血浆HCO3-减少为 特征的酸碱平衡紊乱。
(一)原因和机制 1.HCO3-直接丢失过多 经胃肠道:严重腹泻,肠道瘘管或肠道引流 经肾: Ⅱ型肾小管酸中毒 大量使用碳酸酐酶(CA )抑制剂
肺的调节作用 效能大 几分钟开始,30分钟达最高峰 不能缓冲固定酸
细胞内液 强于细胞外液 2–4小时后开始,引起血钾改变
肾脏的调节作用 发挥较慢 12–24小时后开始 效率高,作用持久
代谢性 酸中毒
单纯性酸 碱平衡紊乱
代谢性 碱中毒
呼吸性 酸中毒
病例1
男性患者,35岁,车祸致右股血管损伤,垂危入院。 入院时查体:意思丧失,血压不能监测。 诊断:?
细胞内碱中毒,尿液呈碱性
予补液,大量输血等抗休克治疗、应用碳酸氢钠纠正酸 中毒后,病人生命体征逐渐稳定。
HCO3-
:(正常值-测得值)×体重×0.4 注意要点:慢 半量
此时容易出现的酸碱平衡失调类型是?
代谢性碱中毒
代谢性碱中毒
是指细胞外液碱增多或H+丢失而引起的以 血浆HCO3-增多为特征的酸碱平衡紊乱类型。
1.呼吸中枢抑制
4.胸廓病变
2.呼吸道阻塞
5.肺部疾患
3.呼吸肌麻痹
6.CO2吸入过多
(五) 防治的病理生理基础 1.病因学治疗 去除呼吸道梗阻及使用呼吸中枢兴奋剂。 2.发病学治疗 要逐步改善通气功能,避免通气过度。 慎用碱性药物。
四、呼吸性碱中毒
化学 第八章 酸碱平衡精品文档57页

两性物质:既能给出质子,又能接受质子的物质。
如 : F e ( O H ) ( H 2 O ) 5 2 ,H C O 3 ,H 2 O ,H S 等 。
质子论的酸碱反应
(1) 酸碱解离反应是质子在两种酸碱之间 的转移反应。传递的方向与酸碱强度有关。
HF(aq) H+ + F-(aq) H+ + H2O(l) H3O+(aq) HF(aq) + H2O(l) H3O+(aq) + F-(aq) (2) 水是两性物质,它的自身解离反应也是 质子转移反应(自耦电离平衡):
H+
H2O(l)+H2O(l) H3O+(aq) +OH-(aq) 酸(1) 碱(2) 酸(2) 碱(1)
(3) 盐类水解反应也是的质子转移反应。例 如NaAc水解:
H+
Ac-+H2O OH- + HAc
碱(1) 酸(2) 碱(2) 酸(1)
NH4Cl水解:
H+
NH
4
+
H2O
H3O+
pH 定义
pHlg[H]
Kw:水的离子积常数,其值与温度有关 0℃ 1.15310-15 25℃ 1.01210-14 100℃ 5.44510-13
纯水中 [H ][O H ]K w10 7.00
pHlg107.007.00
酸碱平衡计算
• 在溶液中往往发生同时平衡,如醋酸电离:
H A c H A c
Ka
[H ][Ac- ] [HAc]
H2OHO H Kw[H][OH]
• 4 个物质 HAc、Ac-、H+、OH-,2 个方程 • 需建立另外 2 个方程求算各物浓度 • 一般为 “物料平衡” 、“电荷平衡”
如 : F e ( O H ) ( H 2 O ) 5 2 ,H C O 3 ,H 2 O ,H S 等 。
质子论的酸碱反应
(1) 酸碱解离反应是质子在两种酸碱之间 的转移反应。传递的方向与酸碱强度有关。
HF(aq) H+ + F-(aq) H+ + H2O(l) H3O+(aq) HF(aq) + H2O(l) H3O+(aq) + F-(aq) (2) 水是两性物质,它的自身解离反应也是 质子转移反应(自耦电离平衡):
H+
H2O(l)+H2O(l) H3O+(aq) +OH-(aq) 酸(1) 碱(2) 酸(2) 碱(1)
(3) 盐类水解反应也是的质子转移反应。例 如NaAc水解:
H+
Ac-+H2O OH- + HAc
碱(1) 酸(2) 碱(2) 酸(1)
NH4Cl水解:
H+
NH
4
+
H2O
H3O+
pH 定义
pHlg[H]
Kw:水的离子积常数,其值与温度有关 0℃ 1.15310-15 25℃ 1.01210-14 100℃ 5.44510-13
纯水中 [H ][O H ]K w10 7.00
pHlg107.007.00
酸碱平衡计算
• 在溶液中往往发生同时平衡,如醋酸电离:
H A c H A c
Ka
[H ][Ac- ] [HAc]
H2OHO H Kw[H][OH]
• 4 个物质 HAc、Ac-、H+、OH-,2 个方程 • 需建立另外 2 个方程求算各物浓度 • 一般为 “物料平衡” 、“电荷平衡”
酸碱平衡和酸碱平衡紊乱课件.pptx
第26页/共93页
标准碳酸氢盐和实际碳酸氢盐
标准碳酸氢盐 (standard bicarbonate,SB)
正常值:22-27mmol/L(24) 意义: ✓反映代谢性酸碱紊乱
✓呼吸性酸碱紊乱后的肾代偿
标准条件:PaCO2为40mmHg,温度38,血氧饱和度100%。
2024/9/30
第27页/共93页
代酸的分类
AG增高型代酸(血氯正常)
常 除了含氯以外的任何固定酸的血浆浓度增大时的代酸。
见 HCO3-缓冲固定酸H+而消耗,其酸根增高。 原 见于:乳酸,酮症酸,水杨酸中毒。
因
硫酸,磷酸排泄障碍。
AAGG
Na+ HHCCOO33-Cl -
2024/9/30
AG正常型代酸(高血氯)
HCO3 -浓度降低,同时伴有 Cl-浓度
2024/9/30
第18页/共93页
酸碱平衡紊乱
(acid-base disturbance)
概念:病理情况下可引起酸碱超负荷或调 节机制障碍,导致体内酸碱度稳态性破坏, 形成酸中毒或碱中毒,称酸碱平衡紊乱。
2024/9/30
第19页/共93页
酸碱平衡紊乱的类型
酸中毒 pH= 碱中毒
HCO3H2CO3
食物在体内转化或经氧化后生成
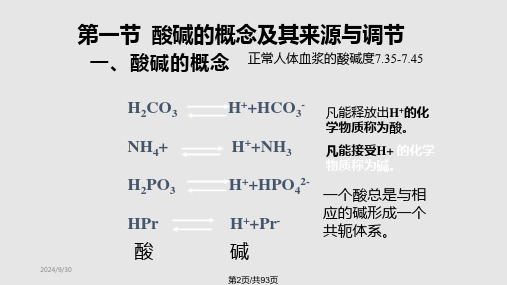
第3页/共93页
H+
H ++HCO3-
CA
H2CO3
CO2 + H2O
CA: 碳酸酐酶,------肾小管上皮细胞;红细胞; 肺泡上皮细胞;胃粘膜上皮细胞
CO2:成人安静状态下每天可产生300-400L, 可释放15mol左右H +。 碳酸:体内酸性物质的主要来源。
成人每日固定酸释放出H+达50—100mmol
标准碳酸氢盐和实际碳酸氢盐
标准碳酸氢盐 (standard bicarbonate,SB)
正常值:22-27mmol/L(24) 意义: ✓反映代谢性酸碱紊乱
✓呼吸性酸碱紊乱后的肾代偿
标准条件:PaCO2为40mmHg,温度38,血氧饱和度100%。
2024/9/30
第27页/共93页
代酸的分类
AG增高型代酸(血氯正常)
常 除了含氯以外的任何固定酸的血浆浓度增大时的代酸。
见 HCO3-缓冲固定酸H+而消耗,其酸根增高。 原 见于:乳酸,酮症酸,水杨酸中毒。
因
硫酸,磷酸排泄障碍。
AAGG
Na+ HHCCOO33-Cl -
2024/9/30
AG正常型代酸(高血氯)
HCO3 -浓度降低,同时伴有 Cl-浓度
2024/9/30
第18页/共93页
酸碱平衡紊乱
(acid-base disturbance)
概念:病理情况下可引起酸碱超负荷或调 节机制障碍,导致体内酸碱度稳态性破坏, 形成酸中毒或碱中毒,称酸碱平衡紊乱。
2024/9/30
第19页/共93页
酸碱平衡紊乱的类型
酸中毒 pH= 碱中毒
HCO3H2CO3
食物在体内转化或经氧化后生成
第3页/共93页
H+
H ++HCO3-
CA
H2CO3
CO2 + H2O
CA: 碳酸酐酶,------肾小管上皮细胞;红细胞; 肺泡上皮细胞;胃粘膜上皮细胞
CO2:成人安静状态下每天可产生300-400L, 可释放15mol左右H +。 碳酸:体内酸性物质的主要来源。
成人每日固定酸释放出H+达50—100mmol
教学课件7酸碱平衡

的抵抗作用。
二、缓冲溶液的组成
1、组成:
共轭碱
缓冲溶液↗抗酸成分(能与强酸作用) 缓冲系统 ↘抗碱成分(能与强碱作用)
共轭酸碱对
2、常见类型: 共轭酸
(1)弱酸及其盐:如:HAc—NaAc、
H2CO3—NaHCO3、H3PO4—NaH2PO4等; (2) 弱碱及其盐:如:NH3—NH4Cl等; (3)多元酸的酸式盐及其对应的次级盐:
2.下列哪种溶液能与0.2 molL-1NaHCO3等体积混合 配成缓冲溶液 ( )
A、0.2 molL-1HAc
B、0.2 molL-1KOH
C、0.1 molL-1H2SO4
D、0.1 molL-1NaOH
三、缓冲溶液的作用原理
HAc-NaAc混合溶液: N a A c
H A c
N a + + A c -
酸及其共轭碱
酸 名称 高氯酸 硫酸 硫酸氢根 水合氢离子
水 铵离子
氨 氢溴酸
化学式
HClO4 H2SO4 HSO4H3O+ H2O NH4+ NH3 HBr
共轭碱
化学式
名称
ClO4HSO4SO42H2O OH-
高氯酸根 硫酸氢根
硫酸根 水
氢氧根
NH3 NH2Br -
氨 氨基离子
溴离子
从表中的共轭酸碱对可以看出:
H2O + NH3 NH4+ +OH酸1 碱2 酸2 碱1
可见在酸的电离过程中,H2O接受质子,是一 个碱,而在NH3的电离过程中,H2O放出质子,又 是一个酸,所以水是两性物质。
H2O + H2O
H3O++OH-
由于H3O+与OH-均为强酸和强碱,所以平衡强
二、缓冲溶液的组成
1、组成:
共轭碱
缓冲溶液↗抗酸成分(能与强酸作用) 缓冲系统 ↘抗碱成分(能与强碱作用)
共轭酸碱对
2、常见类型: 共轭酸
(1)弱酸及其盐:如:HAc—NaAc、
H2CO3—NaHCO3、H3PO4—NaH2PO4等; (2) 弱碱及其盐:如:NH3—NH4Cl等; (3)多元酸的酸式盐及其对应的次级盐:
2.下列哪种溶液能与0.2 molL-1NaHCO3等体积混合 配成缓冲溶液 ( )
A、0.2 molL-1HAc
B、0.2 molL-1KOH
C、0.1 molL-1H2SO4
D、0.1 molL-1NaOH
三、缓冲溶液的作用原理
HAc-NaAc混合溶液: N a A c
H A c
N a + + A c -
酸及其共轭碱
酸 名称 高氯酸 硫酸 硫酸氢根 水合氢离子
水 铵离子
氨 氢溴酸
化学式
HClO4 H2SO4 HSO4H3O+ H2O NH4+ NH3 HBr
共轭碱
化学式
名称
ClO4HSO4SO42H2O OH-
高氯酸根 硫酸氢根
硫酸根 水
氢氧根
NH3 NH2Br -
氨 氨基离子
溴离子
从表中的共轭酸碱对可以看出:
H2O + NH3 NH4+ +OH酸1 碱2 酸2 碱1
可见在酸的电离过程中,H2O接受质子,是一 个碱,而在NH3的电离过程中,H2O放出质子,又 是一个酸,所以水是两性物质。
H2O + H2O
H3O++OH-
由于H3O+与OH-均为强酸和强碱,所以平衡强
酸碱平衡课件ppt.ppt

呼吸加深加快
CO2排出↑
㈢组织细胞的调节作用
K+ Na+
ClH+
H+
HCO3- K+
H+
H+
Na+
K+
Na+
组织细胞
㈣肾脏的调节
肾脏通过排酸(H+或固定酸)以及重吸 收碱(HCO3-)对酸碱平衡进行调节
近曲小管泌H+和对NaHCO3的重吸收 调
节 方
远曲小管泌H+和对NaHCO3的重吸收
式 近曲小管上皮细胞泌NH4+
实际碳酸氢盐(actual bicarbonate, AB)
隔绝空气的血标本在实际状态下测得的HCO3-含量
✓ 受呼吸和代谢两方面的影响
✓AB,SB 同时升高
代谢性碱中毒
✓AB,SB 同时降低
代谢性酸中毒
• AB> SB,CO2潴留
呼吸性酸中毒
• AB< SB,CO2排出过多 呼吸性碱中毒
㈣缓冲碱(buffer base, BB)
H2O
H+ + Buf -
H2CO3 HBuf
缓冲作用即刻发生,HCO3- ↑↑
细胞内外离子交换的缓冲作用
K+ H+
2-4小时起作用,易引起低钾血 症
肺的调节
H+↓ 外周化学感受器
呼吸中枢 抑制
呼吸频率幅度↓
CO2排出↓
pH↓
[HCO3-]↑ [H2CO3]↑
PaCO2 ↑
✓作用迅速,24小时达高峰 ✓代偿作用极限:PaCO2↑至55mmHg
近曲小管和集合管泌H+、重吸收HCO3-
毛细血管 K+
近曲小管上皮细胞 Na+
Na+H++ HCO3- H2CO3
CA
H2O+CO2
肾小管腔 集合管上皮细胞
高二化学课件酸碱平衡

练习
例2:已知H3PO4水溶液的Ka1θ= 7.6×10-3, Ka2θ =
6.3×10-8,计算PO43-的Kb3θ和Kb2θ 。
解: pKb3 = pKw -pKa1 = 14.00-2.12 = 11.88 pKb2 = pKw -pKa2 = 14.00-7.20 = 6.80
返回
二、 酸碱平衡体系中各组分浓度的计算 1.分析浓度与平衡浓度
例 3 计 算 pH=5.0 时 ,HAc 和 Ac-的分布分数
解:
HAc
[H ] 10 0.36 5.0 5.0 K a [ H ] 1.8 10 10
5.0
Ac 1 0.36 0.64
(2)二元酸溶液 如草酸: H2C2O4,
H+
简化:H 2O H OH H+
碱的离解:
中和反应:
OH H H 2O H Ac HAc H+
NH 3 H NH 3 H 2 O
H+
H 2 O H OH NH 4
NH 4
OH
NH H+ OH NH3 H 2O 4
例5 计算pH=5.0时0.1mol· -1 草酸溶液中 L C2O42- 的 浓 度 。 已 知 草 酸 的 Ka1=5.60×10-2 , Ka2=5.42×10-5 。 解:
[A ] K K x x( A ) c( H A) [ H ] K [ H ] K K
2 a1 a2 2 2 2 a1 a1 2 5 5 2 2 5 2 a2
分析浓度(Analytical concentration):一定体积溶液中含
病理生理学-酸碱平衡PPT课件

呼吸调节
通过调节呼吸频率和深度,控制二氧化碳的排出 量,维持酸碱平衡。
饮食调节
合理摄入含碱性或酸性物质的食物,如蔬菜、水 果、肉类等,有助于调节酸碱平衡。
ABCD
肾脏调节
肾脏通过排泄酸性或碱性物质,调节尿液的pH 值,维持酸碱平衡。
药物治疗
在特定情况下,医生会开具适当的药物来调节体 内酸碱平衡。
酸碱平衡与饮食调节
治疗
治疗原则是除去病因, 减少碱性物质的摄入,
补充酸性物质等。
酸碱平衡紊乱的分类
根据病因分类
根据程度分类
分为代谢性酸中毒、呼吸性酸中毒、 代谢性碱中毒和呼吸性碱中毒。
分为轻度、中度和重度酸碱平衡紊乱。
根据pH值变化分类
分为高酸血症、高碱血症、正常酸血 症和正常碱血症。
03 酸碱平衡与疾病的关系
酸碱平衡与心血管疾病
酸碱平衡与肾脏疾病
总结词
酸碱平衡失调可引发肾脏疾病,如肾 结石、肾功能不全等。
详细描述
肾脏是维持酸碱平衡的重要器官,酸 碱平衡失调会导致肾脏负担加重,引 发肾脏疾病。
总结词
酸碱平衡失调可影响肾脏疾病的进展。
详细描述
对于已患有肾脏疾病的个体,酸碱平 衡失调可能加速疾病进展,导致肾功 能恶化。
酸碱平衡与消化系统疾病
酸碱平衡的重要性
酸碱平衡是维持正常生理功能的重要 基础,一旦失衡可能导致一系列生理 功能紊乱,甚至危及生命。
酸碱平衡对于维持骨骼代谢、肌肉收 缩、神经传导等生理过程具有重要作 用,对于预防和治疗某些疾病也具有 重要意义。
酸碱平衡的调节机制
肾脏是调节酸碱平衡的主要器官,通过排泄和重吸收作用调节尿液的pH 值,维持体内酸碱平衡。
《酸碱平衡》PPT课件

再如:当 PaCO2 原发性升高,发生呼吸 性酸碱失衡时,肾脏通过减少对(HCO3- ) 的排出,让 〔HCO3- / PaCO2 〕 的比值维持 在 20/1附近。
如:(HCO3-)代偿性
(PaCO2)原发性
精选ppt
20
20
或是当 PaCO2 原发性减少,发生呼吸 性酸碱失衡时,肾脏通过多排 (HCO3-), 使血 (HCO3-)减少,让〔 HCO3- / PaCO2〕 的比值维持在 20/1附近。
酸碱平衡
(时间:1小时40分钟)
昆医附一院 麻醉科 吴洪翔
精选ppt
1
2
授课目录: 1. 基础知识的复习 2. 调节酸碱平衡的方式 3. 血气报告的实例阅读 4. 酸碱平衡与电解质平衡的关系
精选ppt
2
一、基础知识的复习 1. 酸碱的定义:
酸:能释放 H+ 的物质。
碱:可接受 H+ 的物质。
精选ppt
代酸并呼碱 PH=6.1+log 18/0.03 × 30
=6.1+log 20/1 =6.1+1.3 =7.4
代碱并呼酸 PH=6.1+log 36/0.03 ×60
=6.1+log 20/1 =6.1+1.3 =7.4
精选ppt
8
8
在公式 PH=PK+log ——H—CO—3 -— 中,
a ·PaCO2
精选ppt
17
17
通过代偿,若PH在 7.35-7.45 之间,为 代偿完全的酸碱紊乱,称“血症”。
通过代偿,若PH在 7.35-7.45 以外,为 代偿不完全的酸碱失衡,称“中毒”。
如:代谢性酸中毒时,因(HCO3-)减少。
酸碱平衡失调PPT课件

饮食调整
饮食调整是酸碱平衡失调治疗的基础,通过合理安排饮食,可以改善患 者的酸碱平衡状况。
对于酸性体质的患者,应适当增加碱性食物的摄入,如蔬菜、水果、豆 类等;对于碱性体质的患者,应适当减少碱性食物的摄入,增加酸性食 物的摄入,如肉类、蛋类等。
饮食调整过程中,应注意食物的搭配和烹饪方法,避免因食物搭配不当 或烹饪方法不科学而影响治疗效果。
03
酸碱平衡失调的治疗方法
药物治疗
药物治疗是酸碱平衡失调的重要治疗手段,主要通过口服或静脉注射药物来纠正酸 碱平衡失调。
常用的药物包括碱性药物、酸性药物、电解质补充剂等,具体药物的选择和使用应 根据患者的具体情况而定。
药物治疗过程中,应注意药物的副作用和相互作用,避免因药物使用不当而加重病 情。
血液气体分析
总结词
血液气体分析包括氧分压、二氧化碳分压等指标,用于评估呼吸功能和酸碱平衡 状态。
详细描述
血液气体分析是通过抽取动脉血液样本,测定血液中的氧气和二氧化碳含量,以 及计算相关指标如氧饱和度、呼吸商等,以评估呼吸功能和酸碱平衡状态。对于 判断呼吸衰竭、酸碱失衡等具有重要意义。
其他相关检测指标
04
酸碱平衡失调的预防措施
保持健康的生活方式
01
02
03
规律作息
保持充足的睡眠,避免熬 夜,保证每天有足够的休 息时间。
适量运动
坚持适量的体育锻炼,增 强身体免疫力,促进新陈 代谢。
戒烟限酒
戒烟限酒,避免对身体健 康造成不良影响。
注意饮食结构
均衡营养
保持饮食均衡,摄入足够的蛋白质、脂肪、碳水化合物、维生素 和矿物质。
案例二:急性酸碱平衡失调的抢救
总结词
紧急处理,生命支持
酸碱平衡和沉淀平衡 ppt课件

有机化合物如乙醇CH3CH2OH可看作是(酸)和 OH-碱以配位键结合而成的酸碱配合物C2H5←OH
酸碱电子理论对酸碱的定义,摆脱了体系必须具 有某种离子或元素也不受溶剂的限制,以电子的给出 和接受来说明酸碱的反应,故它更能体现物质的本质 属性,较前面几个酸碱理论更为全面和广泛。但是由 其对酸碱的认识过于笼统,因而不易掌握酸碱的特征。
强碱具有高度接受质子的能力。如OH-、PO43离子等。
酸碱平衡和沉淀平衡
酸及其共轭碱
酸
共轭碱
名称
化学式
化学式
名称
高氯酸 硫酸
硫酸氢根 水合氢离子
水 铵离子
氨 氢溴酸
HClO4
ClO4-
H2SO4
HSO4-
HSO4-
SO42-
H3O+
H2O
H2O
OH-
NH4+
NH3
NH3
NH2-
HBr酸碱平衡和沉淀平衡Br -
酸1 碱2
酸2 碱1
弱酸给出质子的能力很弱,其共轭碱则较强, 因此反应程度很小,为可逆反应(相当于电离理论的 部分电离)。
HAc + H2O H3O++Ac-
酸1 碱2
酸2 碱1 酸碱平衡和沉淀平衡
氨和水的反应,H2O给出质子,由于H2O是弱 酸所以反应程度也很小,是可逆反应(相当于NH3在 水中的电离过程)。
(1)电离作用: 根据酸碱质子理论的观点,电离作用就是水与 分子酸碱的质子传递反应。 在水溶液中,酸电离时放出质子给水,并产生 共轭碱。
酸碱平衡和沉淀平衡
强酸给出质子的能力很强,其共轭碱则较弱, 几乎不能结合质子,因此反应几乎完全进行(相当于 电离理论的全部电离)。
酸碱电子理论对酸碱的定义,摆脱了体系必须具 有某种离子或元素也不受溶剂的限制,以电子的给出 和接受来说明酸碱的反应,故它更能体现物质的本质 属性,较前面几个酸碱理论更为全面和广泛。但是由 其对酸碱的认识过于笼统,因而不易掌握酸碱的特征。
强碱具有高度接受质子的能力。如OH-、PO43离子等。
酸碱平衡和沉淀平衡
酸及其共轭碱
酸
共轭碱
名称
化学式
化学式
名称
高氯酸 硫酸
硫酸氢根 水合氢离子
水 铵离子
氨 氢溴酸
HClO4
ClO4-
H2SO4
HSO4-
HSO4-
SO42-
H3O+
H2O
H2O
OH-
NH4+
NH3
NH3
NH2-
HBr酸碱平衡和沉淀平衡Br -
酸1 碱2
酸2 碱1
弱酸给出质子的能力很弱,其共轭碱则较强, 因此反应程度很小,为可逆反应(相当于电离理论的 部分电离)。
HAc + H2O H3O++Ac-
酸1 碱2
酸2 碱1 酸碱平衡和沉淀平衡
氨和水的反应,H2O给出质子,由于H2O是弱 酸所以反应程度也很小,是可逆反应(相当于NH3在 水中的电离过程)。
(1)电离作用: 根据酸碱质子理论的观点,电离作用就是水与 分子酸碱的质子传递反应。 在水溶液中,酸电离时放出质子给水,并产生 共轭碱。
酸碱平衡和沉淀平衡
强酸给出质子的能力很强,其共轭碱则较弱, 几乎不能结合质子,因此反应几乎完全进行(相当于 电离理论的全部电离)。
第八章 酸碱平衡

7
3). 酸碱共轭关系
酸碱存在着对应的相互依存的关系; 酸碱存在着对应的相互依存的关系 ; 物 质的酸性或碱性要通过给出质子或接受 质子来体现。 质子来体现。
酸
H+ 共轭关系
+ 碱
HAc 共轭酸
H+
+
Ac共轭碱
8
HAc
H+
+ Ac-
HAc的共轭碱是 - ,Ac-的共轭 的共轭碱是Ac 的共轭碱是 酸HAc,HAc和Ac-为一对共轭酸碱, , 和 为一对共轭酸碱, 称为共轭酸碱对。 称为共轭酸碱对。 共轭酸碱对
3
一元酸: 一元酸 HA
H+ + A-
cHA − [ HA] α= ×100% cHA [ A ][ H ] Ka = [ HA]
一定的条件下, 值越大, 在cHA一定的条件下,α值越大,说明弱 酸电离程度越大,说明该酸酸性愈强; 酸电离程度越大,说明该酸酸性愈强;
− +
多元酸: 电离步骤多, 多元酸 电离步骤多,复杂
NH3 (aq) + H2O(l)
c0 0.200 ceq 0.200(1– 0.95%)
NH (aq) + OH (aq)
+ 4 −
0
0
0.200×0.95% 0.200×0.95% × ×
[OH-]=0.200×0.95%=1.9×10-3 (mol.dm-3) × × pH=14-pOH=14-(-lg1.9×10-3)=11.27 ×
B-+H2O HB + OH−
[HB][OH ] Kb = − [B ]
当 [ OH 当 [ OH c K
− a
3). 酸碱共轭关系
酸碱存在着对应的相互依存的关系; 酸碱存在着对应的相互依存的关系 ; 物 质的酸性或碱性要通过给出质子或接受 质子来体现。 质子来体现。
酸
H+ 共轭关系
+ 碱
HAc 共轭酸
H+
+
Ac共轭碱
8
HAc
H+
+ Ac-
HAc的共轭碱是 - ,Ac-的共轭 的共轭碱是Ac 的共轭碱是 酸HAc,HAc和Ac-为一对共轭酸碱, , 和 为一对共轭酸碱, 称为共轭酸碱对。 称为共轭酸碱对。 共轭酸碱对
3
一元酸: 一元酸 HA
H+ + A-
cHA − [ HA] α= ×100% cHA [ A ][ H ] Ka = [ HA]
一定的条件下, 值越大, 在cHA一定的条件下,α值越大,说明弱 酸电离程度越大,说明该酸酸性愈强; 酸电离程度越大,说明该酸酸性愈强;
− +
多元酸: 电离步骤多, 多元酸 电离步骤多,复杂
NH3 (aq) + H2O(l)
c0 0.200 ceq 0.200(1– 0.95%)
NH (aq) + OH (aq)
+ 4 −
0
0
0.200×0.95% 0.200×0.95% × ×
[OH-]=0.200×0.95%=1.9×10-3 (mol.dm-3) × × pH=14-pOH=14-(-lg1.9×10-3)=11.27 ×
B-+H2O HB + OH−
[HB][OH ] Kb = − [B ]
当 [ OH 当 [ OH c K
− a
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H+
H2O(l)+H2O(l) H3O+(aq) +OH-(aq) 酸(1) 碱(2) 酸(2) 碱(1)
(3) 盐类水解反应也是的质子转移反应。例 如NaAc水解:
H+
Ac-+H2O OH- + HAc
碱(1) 酸(2) 碱(2) 酸(1)
NH4Cl水解:
H+
NH
4
+
H2O
H3O+
+
NH3
δ (HA) cHA [HA] [A ] [H ] Ka
δ
(A
)
[A ] cHA
[A ] [HA] [A
]
Ka [H ]
Ka
pH = pKa :δ(HA)=δ(A-)= 0.5,两物种各占一 半 pH < pKa:主要为HA(酸型) pH > pKa:主要为以A-(碱型)
一元弱酸(碱)
二元弱酸
• 选择溶液中大量存在并参与质子传递的物 质作为参照物(零水准)。如:
• 参考水准 质子后的产物 失质子后的产物
• H2O
H3O+
OH-
• HAc
Ac-
• 质子平衡式 [H3O+] = [OH-] + [Ac-]
•
或 [H+] = [OH-] + [Ac-]
质子平衡
• 浓度为c的Na2CO3水溶液: • 参考水准 得质子后的产物 失质子后的产物
• 也可在列出质子平衡式时先进行简化直 接得近似式
• 也可根据物料平衡和电离平衡式计算。
强酸 HA(碱)溶液(Ka > 10)
• 强酸完全电离,H+来自强酸和水的电离 • 质子平衡式, [H+] = [OH-] + [A-]
[A ]=cA ,
[OH
]
Kw [H
]
[H
]
Kw [H
]
cA
• [H+]精确计算 [H ]2 cA[H ] Kw 0
• [H+]近似计算
•
cA 106mol dm3,
[H+ ] cA
cA 108mol dm3,
电荷平衡
• 溶液中正、负离子浓度相等,溶液保持电中性 • 醋酸水溶液:[H+] = [Ac-] + [OH-] • Na2CO3的水溶液: • [Na+] + [H+] = [HCO3-] + 2[CO32-] + [OH-]
质子平衡式
• 酸碱反应中酸失去的质子和碱得到的质子 的物质的量相等(PBE)。
HI HClO4 HCl H2SO4 HNO3
酸越强 其共轭碱越弱 碱越强 其共轭酸越弱
酸性:HClO 4 H2SO4 H3PO4
HAc H2CO3 NH4 H2O
碱性:ClO
4
HSO
4
H 2 P O4
Ac
HCO
3
NH3
OH
pH 定义
pH lg[H ]
Kw:水的离子积常数,其值与温度有关 0℃ 1.15310-15 25℃ 1.01210-14 100℃ 5.44510-13
纯水中 [H ] [OH ] Kw 107.00
pH lg107.00 7.00
酸碱平衡计算
• 在溶液中往往发生同时平衡,如醋酸电离:
HAc H Ac
Ka
[H ][Ac- ] [HAc]
H2O H OH
Kw [H ][OH ]
• 4 个物质 HAc、Ac-、H+、OH-,2 个方程 • 需建立另外 2 个方程求算各物浓度 • 一般为 “物料平衡” 、“电荷平衡”
第八章 酸碱平衡
• 酸碱理论 酸碱电离理论 酸碱质子理论 Lewis酸碱概念 软硬酸碱理论
酸碱质子理论
• 酸:凡是能释放出质子(H+)的任何含 氢原子的分子或离子的物种。
•
(质子的给予体)
• 碱:凡是能与质子(H+)结合的分子或 离子的物种。
•
(质子的接受体)
酸
H+ + 碱
共轭酸碱
酸
H+ + 碱
HAc
HCN
Ka
1.8 105 5.8 1010
溶剂的区分效应:能区分酸或碱的相对强弱。 例如,H2O可以区分HAc,HCN酸性的强弱。
溶剂的拉平效应:将酸或碱的强度拉平的作用。
水不能区分强酸:水能同等程度地将HClO4, HCl,HNO3等强酸的质子全部夺取过来。
冰醋酸(碱性比水弱)为溶剂对水中的强酸 可体现出区分效应。例如在冰醋酸中不完全解离, 酸性强度依次为:
酸(1) 碱(2) 酸(2) 碱(1)
(4) 非水溶液中的酸碱反应,如NH4Cl的生成:
H+
HCl NH 3
NH
4
Cl
酸(1) 碱(2)
酸(2) 碱(1)
液氨中的酸碱中和反应:
H+
NH4Cl NaNH2
2NH3 NaCl
酸和碱的相对强度 酸给出质子的能力和碱接受质子的能力的强弱。
例:HAc的共轭碱是AcAc-的共轭酸是HAc HAc和Ac- 一对共轭酸碱
两性物质:既能给出质子,又能接受质子的物质。
如:Fe(OH)(H2O)5 2 , HCO3, H2O, HS 等。
质子论的酸碱反应
(1) 酸碱解离反应是质子在两种酸碱之间 的转移反应。传递的方向与酸碱强度有关。
HF(aq) H+ + F-(aq) H+ + H2O(l) H3O+(aq) HF(aq) + H2O(l) H3O+(aq) + F-(aq) (2) 水是两性物质,它的自身解离反应也是 质子转移反应(自耦电离平衡):
δ
(HA
)
[HA ] cH2A
[H
]2
Ka,1[H ] Ka,1[H ]
K a,1K a,2
δห้องสมุดไป่ตู้
(A2
)
[A2 ] cH2A
[H
]2
K K a,1 a,2 Ka,1[H ]
K a,1K a,2
δ
(H2A)
[H2A] cH2A
[H
]2
[H ]2 Ka,1[H ]
Ka,1Ka,2
H+浓度的计算
• 首先列出质子平衡式 • 然后代入平衡常数表达式 • 整理后得计算[H+]的精确式 • 再经简化省略一些次要项即可得近似式
物料平衡
• 某组分的分析浓度(在溶液中总浓度)等于 该组分在各物中浓度之和。
• 醋酸的水溶液 [HAc] + [Ac-] = c
• Na2CO3 的水溶液 • CO32- 的物料平衡: • [H2CO3] + [HCO3-] + [CO32 - ] = c • Na+的物料平衡:[Na+] = 2c
• H2O
H3O+
OH-
• CO32-
HCO3-
•
H2CO3
• H2CO3同参考水准相比得2个质子,浓度乘2
• 质子平衡式:
• 2[H2CO3] + [HCO3-] + [H+] = [OH-]
酸度对弱酸(碱)各物种分布的影响
• 一元弱酸(碱) cHA= [HA] + [A-]
[HA] [HA]
[H ]
H2O(l)+H2O(l) H3O+(aq) +OH-(aq) 酸(1) 碱(2) 酸(2) 碱(1)
(3) 盐类水解反应也是的质子转移反应。例 如NaAc水解:
H+
Ac-+H2O OH- + HAc
碱(1) 酸(2) 碱(2) 酸(1)
NH4Cl水解:
H+
NH
4
+
H2O
H3O+
+
NH3
δ (HA) cHA [HA] [A ] [H ] Ka
δ
(A
)
[A ] cHA
[A ] [HA] [A
]
Ka [H ]
Ka
pH = pKa :δ(HA)=δ(A-)= 0.5,两物种各占一 半 pH < pKa:主要为HA(酸型) pH > pKa:主要为以A-(碱型)
一元弱酸(碱)
二元弱酸
• 选择溶液中大量存在并参与质子传递的物 质作为参照物(零水准)。如:
• 参考水准 质子后的产物 失质子后的产物
• H2O
H3O+
OH-
• HAc
Ac-
• 质子平衡式 [H3O+] = [OH-] + [Ac-]
•
或 [H+] = [OH-] + [Ac-]
质子平衡
• 浓度为c的Na2CO3水溶液: • 参考水准 得质子后的产物 失质子后的产物
• 也可在列出质子平衡式时先进行简化直 接得近似式
• 也可根据物料平衡和电离平衡式计算。
强酸 HA(碱)溶液(Ka > 10)
• 强酸完全电离,H+来自强酸和水的电离 • 质子平衡式, [H+] = [OH-] + [A-]
[A ]=cA ,
[OH
]
Kw [H
]
[H
]
Kw [H
]
cA
• [H+]精确计算 [H ]2 cA[H ] Kw 0
• [H+]近似计算
•
cA 106mol dm3,
[H+ ] cA
cA 108mol dm3,
电荷平衡
• 溶液中正、负离子浓度相等,溶液保持电中性 • 醋酸水溶液:[H+] = [Ac-] + [OH-] • Na2CO3的水溶液: • [Na+] + [H+] = [HCO3-] + 2[CO32-] + [OH-]
质子平衡式
• 酸碱反应中酸失去的质子和碱得到的质子 的物质的量相等(PBE)。
HI HClO4 HCl H2SO4 HNO3
酸越强 其共轭碱越弱 碱越强 其共轭酸越弱
酸性:HClO 4 H2SO4 H3PO4
HAc H2CO3 NH4 H2O
碱性:ClO
4
HSO
4
H 2 P O4
Ac
HCO
3
NH3
OH
pH 定义
pH lg[H ]
Kw:水的离子积常数,其值与温度有关 0℃ 1.15310-15 25℃ 1.01210-14 100℃ 5.44510-13
纯水中 [H ] [OH ] Kw 107.00
pH lg107.00 7.00
酸碱平衡计算
• 在溶液中往往发生同时平衡,如醋酸电离:
HAc H Ac
Ka
[H ][Ac- ] [HAc]
H2O H OH
Kw [H ][OH ]
• 4 个物质 HAc、Ac-、H+、OH-,2 个方程 • 需建立另外 2 个方程求算各物浓度 • 一般为 “物料平衡” 、“电荷平衡”
第八章 酸碱平衡
• 酸碱理论 酸碱电离理论 酸碱质子理论 Lewis酸碱概念 软硬酸碱理论
酸碱质子理论
• 酸:凡是能释放出质子(H+)的任何含 氢原子的分子或离子的物种。
•
(质子的给予体)
• 碱:凡是能与质子(H+)结合的分子或 离子的物种。
•
(质子的接受体)
酸
H+ + 碱
共轭酸碱
酸
H+ + 碱
HAc
HCN
Ka
1.8 105 5.8 1010
溶剂的区分效应:能区分酸或碱的相对强弱。 例如,H2O可以区分HAc,HCN酸性的强弱。
溶剂的拉平效应:将酸或碱的强度拉平的作用。
水不能区分强酸:水能同等程度地将HClO4, HCl,HNO3等强酸的质子全部夺取过来。
冰醋酸(碱性比水弱)为溶剂对水中的强酸 可体现出区分效应。例如在冰醋酸中不完全解离, 酸性强度依次为:
酸(1) 碱(2) 酸(2) 碱(1)
(4) 非水溶液中的酸碱反应,如NH4Cl的生成:
H+
HCl NH 3
NH
4
Cl
酸(1) 碱(2)
酸(2) 碱(1)
液氨中的酸碱中和反应:
H+
NH4Cl NaNH2
2NH3 NaCl
酸和碱的相对强度 酸给出质子的能力和碱接受质子的能力的强弱。
例:HAc的共轭碱是AcAc-的共轭酸是HAc HAc和Ac- 一对共轭酸碱
两性物质:既能给出质子,又能接受质子的物质。
如:Fe(OH)(H2O)5 2 , HCO3, H2O, HS 等。
质子论的酸碱反应
(1) 酸碱解离反应是质子在两种酸碱之间 的转移反应。传递的方向与酸碱强度有关。
HF(aq) H+ + F-(aq) H+ + H2O(l) H3O+(aq) HF(aq) + H2O(l) H3O+(aq) + F-(aq) (2) 水是两性物质,它的自身解离反应也是 质子转移反应(自耦电离平衡):
δ
(HA
)
[HA ] cH2A
[H
]2
Ka,1[H ] Ka,1[H ]
K a,1K a,2
δห้องสมุดไป่ตู้
(A2
)
[A2 ] cH2A
[H
]2
K K a,1 a,2 Ka,1[H ]
K a,1K a,2
δ
(H2A)
[H2A] cH2A
[H
]2
[H ]2 Ka,1[H ]
Ka,1Ka,2
H+浓度的计算
• 首先列出质子平衡式 • 然后代入平衡常数表达式 • 整理后得计算[H+]的精确式 • 再经简化省略一些次要项即可得近似式
物料平衡
• 某组分的分析浓度(在溶液中总浓度)等于 该组分在各物中浓度之和。
• 醋酸的水溶液 [HAc] + [Ac-] = c
• Na2CO3 的水溶液 • CO32- 的物料平衡: • [H2CO3] + [HCO3-] + [CO32 - ] = c • Na+的物料平衡:[Na+] = 2c
• H2O
H3O+
OH-
• CO32-
HCO3-
•
H2CO3
• H2CO3同参考水准相比得2个质子,浓度乘2
• 质子平衡式:
• 2[H2CO3] + [HCO3-] + [H+] = [OH-]
酸度对弱酸(碱)各物种分布的影响
• 一元弱酸(碱) cHA= [HA] + [A-]
[HA] [HA]
[H ]
