可疑医疗器械不良事件报告表(模版)
(整理)可疑医疗器械不良事件报告表

填报内容包括四个表:10.医疗器械分类名称:
2.环境影响报告表的内容11.商品名称:
12.注册证号:
13.生产企业名称:
生产企业地址:
(5)为保障评价对象建成或实施后能安全运行,应从评价对象的总图布置、功能分布、工艺流程、设施、设备、装置等方面提出安全技术对策措施;从评价对象的组织机构设置、人员管理、物料管理、应急救援管理等方面提出安全管理对策措施;从保证评价对象安全运行的需要提出其他安全对策措施。对策措施的建议应有针对性、技术可行性和经济合理性,可分为应采纳和宜采纳两种类型。企业联系电话:
省级监测机构意见陈述:
国家监测机构意见陈述:
报告人签名:
可疑医疗器械不良事件报告表
报告日期:年月日
报告来源:□生产企业□经营企业□使用单位单位名称:
联系地址:邮编:联系电话:编码:□□□□□□□□□□□
A.患者资料
1.患者姓名:2.年龄:3.性别:□男□女
4.预期治疗疾病或作用:
B.不良事件情况
5.事件主要表现:
6.事件发生日期:年月日
7.医疗器械实际使用场所:
意愿调查评估法(简称CV法)是指通过调查等方法,让消费者直接表述出他们对环境物品或服务的支付意愿(或接受赔偿意愿),或者对其价值进行判断。在很多情形下,它是唯一可用的方法。如用于评价环境资源的选择价值和存在价值。□威胁生命;
(1)内涵资产定价法□机体功能结构永久损伤;
□需要内、外科治疗避免上述永久损伤;
(一)建设项目环境影响评价的人:□专业人员□非专业人员□患者□其它
16.有效期至:年月日
17.停用日期:年月日
18.植入日期(若植入):年月日
可疑医疗器械不良事件报告表

可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码: 报告来源: 生产企业 经营企业 使用单位 单位名称:联系地址: 邮 编: 联系电话:报告人签名:A .患者资料 1.姓名:2.年龄:3.性别 男 女4.预期治疗疾病或作用:B .不良事件情况5.事件主要表现:6.事件发生日期: 年 月 日7.发现或者知悉时间: 年 月 日 8. 医疗器械实际使用场所:医疗机构 家庭 其它(请注明): 9.事件后果死亡 (时间); 危及生命;机体功能结构永久性损伤;可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其它(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)报告人: 医师 技师 护士 其他 C .医疗器械情况11.产品名称: 12.商品名称: 13.注册证号: 14.生产企业名称:生产企业地址: 企业联系电话: 15.型号规格:产品编号: 产品批号:16. 操作人:专业人员 非专业人员 患者 其它(请注明):17. 有效期至: 年 月 日 18.生产日期: 年 月 日 19. 停用日期: 年 月 日 20. 植入日期(若植入): 年 月 日 21. 事件发生初步原因分析: 22. 事件初步处理情况: 23.事件报告状态: 已通知使用单位 已通知生产企业 已通知经营企业已通知药监部门D. 关联性评价(1)使用医疗器械与已发生/可能发生的伤害事件之间是否具有合理的先后时间顺序是□ 否□(2)已发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型是□ 否□ 不清楚□(3)已发生/可能发生的伤害事件是否可用合并用药和/或械的作用、患者病情或其他非医疗器械因素来解释是□ 否□ 不清楚□评价结论:很可能□可能有关□可能无关□无法确定□E.不良事件评价24.省级监测技术机构评价意见(可另附附页):25.国家监测技术机构评价意见(可另附附页):填写要求:《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。
可疑医疗器械不良事件报告表 (1)

22.停用日期:年月日
23.植入日期(若植入):年月日
24.事件发生原因分析:
25.事件处理情况:
26.事件报告状态:
已通知使用单位已通知生产企业已通知经营企业已通知药监部门
D.关联性评价
27.使用医疗器械与已发生/可能发生的伤害事件之间是否具有合理的先后时间顺序?是否
28.发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型?是否无法确定
29已发生/可能发生的伤害事件是否可以用合并用药和/或械的作用、患者病情或其他非医疗器械因素来解释?
是否无法确定
30关联性评价结果
很有可能可能有关可能无关无法确定
联系地址:邮编:联系电话:编码:
A.患者资料
1.患者姓名:
2.年龄:
3.性别男女
4.预期治疗疾病或作用:
B.不良事件情况
5.事件主要表现:
6.事件发生日期:年月日
7.发现或知悉日期:年月日
8.医疗器械实际使用场所:
医院诊所家庭其它(在陈述中说明)
9.事件后果
死亡;
危பைடு நூலகம்生命;
机体功能结构永久性损伤;
可能导致机体功能结构永久性损伤;
需要内、外科治疗避免上述永久损伤;
其它
10.事件陈述:(填写模板:血常规检测.肾功能.血脂分析.生命体征.血气)
可疑医疗器械不良事件报告表
报告日期:年月日国家食品药品监督管理局监制
报告来源:生产企业经营企业使用单位单位名称:
C.医疗器械情况
11.注册证号:
12.产品名称:
13.商品名称:
14.生产企业名称:
15.生产企业地址:
16.企业联系电话:
可疑医疗器械不良反应报告表范文

可疑医疗器械不良反应报告表范文英文回答:Adverse Event Reporting Form for Suspected Medical Device Adverse Reactions.Name: [Your Name]Date: [Date]Patient Information:Name: [Patient's Name]Age: [Patient's Age]Sex: [Patient's Gender]Medical History: [Brief summary of patient's medical history]Device Information:Device Name: [Name of the medical device]Manufacturer: [Name of the manufacturer]Model/Serial Number: [Model/Serial Number of the device]Date of Implantation/Use: [Date of deviceimplantation/use]Description of the Adverse Event:Please provide a detailed description of the adverse event experienced by the patient, including any signs or symptoms observed.Example: I recently used a blood pressure monitoring device on a patient. The patient experienced severe painand discomfort during the procedure. The device seemed tobe malfunctioning as it was displaying inconsistentreadings. The patient's blood pressure was also abnormally high, which was concerning.Actions Taken:Please describe any actions taken in response to the adverse event, such as discontinuation of device use, medical intervention, or device replacement.Example: As soon as I noticed the patient's discomfort and the device malfunction, I immediately stopped using the device. I informed the patient about the situation and provided them with alternative methods for monitoring their blood pressure. I also reported the incident to thehospital's medical device department for further investigation.Outcome:Please describe the outcome of the adverse event, including any medical interventions or treatments provided to the patient.Example: After discontinuing the use of the blood pressure monitoring device, the patient's pain and discomfort subsided. The patient was closely monitored for any further complications and was eventually switched to a different device for blood pressure monitoring. No further adverse events were reported.Preventive Measures:Please suggest any preventive measures that can be taken to avoid similar adverse events in the future.Example: To prevent similar adverse events in the future, it is important to conduct regular maintenance and calibration checks on medical devices. Additionally, healthcare professionals should receive proper training on device usage and troubleshooting. It is also crucial to establish a robust reporting system for adverse events to ensure prompt investigation and appropriate action.中文回答:可疑医疗器械不良反应报告表。
可疑医疗器械不良事件报告表

可疑医疗器械不良事件报告表可疑医疗器械不良事件报告表 A(患者资料 1(姓名: 2(年龄: 3.性别, 男 ,女 4(预期治疗疾病或作用:B(不良事件情况 5(事件主要表现:(患者的表现和器械的表现)6(事件发生日期(患者或其他人首次返现异常的日期): 年月日7(发现或者知悉时间(我们获知的时间): 年月日 8. 医疗器械实际使用场所: , ?医疗机构 , 家庭 , 其它(请注明):9.事件后果, 死亡 (时间);, 危及生命;, 机体功能结构永久性损伤;, 可能导致机体功能机构永久性损伤(指治疗可能无效或效果较差); , 需要内、外科治疗避免上述永久损伤(指治疗可使功能恢复); , 其它(在事件陈述中说明)。
10.事件陈述:使用时间:使用目的:使用依据:使用情况(使用过程是否正常按说明书操作,说明书是否清楚明白详细,产品有无异常):出现的不良事件情况(尽量详细描述产品使用过程中发生的变化和对患者的损害或对诊断治疗的影响):对受害者影响(对治疗、生理身体功能、生活等有无影响):采取的治疗措施:器械联合使用情况C(医疗器械情况11(产品名称:12(商品名称:13(注册证号:14(生产企业名称:生产企业地址:企业联系电话:15 型号规格:产品编号:产品批号:16. 操作人:,?专业人员 ,非专业人员 ,患者 ,其它(请注明): 17. 有效期至: 年月日18(生产日期: 年月日19. 停用日期(若停用): 年月日 20. 植入日期(若植入): 年月日21. 事件发生初步原因分析(简单判断):22. 事件初步处理情况(任何措施,如更换产品、对患者损害处理、安抚、报告、留样封存):23(事件报告状态:, 已通知使用单位 , 已通知生产企业, 已通知经营企业 , 已通知药监部门D. 不良事件评价24(省级监测技术机构评价意见(可另附附页): 25(国家监测技术机构评价意见(可另附附页): 报告人: 医师, 技师, 护士, 其他,国家食品药品监督管理局制。
医疗器械不良事件报告表

医疗器械不良事件报告表
一、报告单位信息。
1. 报告单位名称:
2. 单位地址:
3. 联系人:
4. 联系电话:
5. 邮政编码:
二、器械基本信息。
1. 器械名称:
2. 型号:
3. 规格:
4. 生产厂家:
5. 出厂日期:
6. 有效期至:
三、不良事件描述。
1. 事件发生时间:
2. 事件发现时间:
3. 不良事件描述:
4. 不良事件对患者造成的影响:
5. 不良事件对医疗过程的影响:
6. 不良事件对医疗器械的影响:
四、不良事件原因分析。
1. 不良事件的直接原因:
2. 不良事件的间接原因:
3. 不良事件的根本原因:
4. 防范措施及改进建议:
五、处理结果。
1. 患者处理情况:
2. 医疗器械处理情况:
3. 相关人员处理情况:
4. 预防措施及改进措施:
六、报告人信息。
1. 姓名:
2. 职务:
3. 联系电话:
4. 电子邮箱:
5. 签名:
七、报告时间。
1. 年月日。
以上是医疗器械不良事件报告表的内容,医疗器械不良事件的及时报告对于医疗安全至关重要,希望各报告单位能够认真填写以上信息,确保医疗器械使用过程中的安全和有效性。
同时,对于不良事件的原因分析和处理结果也需要进行深入的思考和总结,以期减少类似事件的再次发生,保障患者和医护人员的安全。
可疑医疗器械不良事件报告表和例子word正常版

附件1:(一)
国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期:年月日编码:
报告来源: 生产企业 经营企业 使用单位单位名称:
联系地址: 邮编:联系电话:
报告人签名:
例子:
附件1: 国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期:10月25日 编 码:
报告来源: 生产企业 经营企业 √使用单位 单位名称:按实际填写
联系地址: 按实际填写 邮 编: 联系电话:
附件
1:
国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期: 2010 年 10 月 8日 编 码:
报告人签名:
报告来源: 生产企业 经营企业 √使用单位单位名称:联系地址: 邮编:联系电话:
报告人签名:。
可疑医疗器械不良事件报告表完整版

可疑医疗器械不良事件报告表
可疑医疗器械不良事件报告表
报告来源生产企业经营企业使用单位个人报告日期
单位名称编码
联系地址联系电话邮编A.患者资料 C.医疗器械情况
患者姓名医疗器械分类名称
年龄产品名称
性别男女商品名称
联系电话注册证号
预期治疗疾病生产企业名称
预期作用生产企业地址
B.不良事件情况企业联系电话
事件主要表现型号规格
事件发生日期产品编号
发现患者知悉时间产品批号
操作人
专业人员非专业人员
患者其它
医疗器械实际使用场所医院诊所家庭其它
有效期至
事件后果(如选择其它,请在事件陈述中说明)死亡
威胁生命
机体功能结构永久损伤
需要内、外科治疗避免上述永久损伤
其它(在事件陈述中说明)
生产日期
停用日期
植入日期(若植入)
事件发生初步
原因分析
事件陈述事件初步处理情况
事件报告状态
已通知使用单位已通知企业
已通知药监部门
D.不良事件评价
评价结论
评价时间
监测机构意见陈述
评价人
评价单位
报告人类别医师技师
护士患者其他
报告人签名。
医疗器械不良反应报告表

附件1:《可疑医疗器械不良事件报告表》及填写要求可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码:报告来源: 生产企业 经营企业 使用单位 单位名称: 联系地址: 邮 编: 联系电话:报告人签名: 国家食品药品监督管理局制A .患者资料 1.姓名:2.年龄:3.性别 男 女4.预期治疗疾病或作用:B .不良事件情况 5.事件主要表现:6.事件发生日期: 年 月 日 7.发现或者知悉时间: 年 月 日 8. 医疗器械实际使用场所:医疗机构 家庭 其他(请注明):9.事件后果死亡 (时间); 危及生命;机体功能结构永久性损伤;可能导致机体功能结构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其他(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)报告人: 医师 技师 护士 其他C .医疗器械情况 11.产品名称: 12.商品名称: 13.注册证号: 14.生产企业名称:生产企业地址: 企业联系电话: 15.型号规格:产品编号: 产品批号:16. 操作人: 专业人员 非专业人员 患者 其他(请注明): 17. 有效期至: 年 月 日 18.生产日期: 年 月 日 19. 停用日期: 年 月 日 20. 植入日期(若植入): 年 月 日 21. 事件发生初步原因分析: 22. 事件初步处理情况:23.事件报告状态:已通知使用单位 已通知生产企业 已通知经营企业 已通知药监部门 D.关联性评价(1)使用医疗器械与已发生/可能发生的伤害事件之间是否具有合理的先后时间顺序? 是□ 否□(2)已发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型?是□ 否□ 不清楚□(3)已发生/可能发生的伤害事件是否可用合并用药和/或械的作用、患者病情或其他非医疗器械因素来解释? 是□ 否□ 不清楚□评价结论:很可能□可能有关□可能无关□无法确定□ E. 不良事件评价24.省级监测技术机构评价意见(可另附附页): 25.国家监测技术机构评价意见(可另附附页):填写要求《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。
可疑医疗器械不良事件报告表

使用情况
预期治疗疾病或作用
器械使用日期*
使用场所*
医疗பைடு நூலகம்构
使用过程*
加药抽取药品时发现针体弯曲,破损,无刻度。
合并用药/械情况说明
事件初步原因分析与处置
事件原因分析*
产品原因(包括说明书等)
事件原因分析描述
加药抽取药品时发现针体弯曲,破损,无刻度
初步处置情况*
立刻更换注射器,并上报器械科
可疑医疗器械不良事件报告表
医疗器械不良事件报告表
报告基本情况
报告编码系统自动生成
发生地
报告人*
医疗器械情况
产品名称*
注册证编号*
型号
规格
产品批号
产品编号
UDI
生产日期
有效期至
上市许可持有人名称
不良事件情况
事件发生日期*
发现或获知日期*
伤害*
伤害表现
器械故障表现
姓名
出生日期
年龄类型
年月天
年龄
性别
男女
病历号
可疑医疗器械不良事件报告表和例子word正常版

附件1:国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期:年月日编码: 报告来源: 生产企业 经营企业 使用单位单位名称:
联系地址: 邮编:联系电话:
报告人:医师 技师 护士 其他
报告人签名:
例子:
附件1:国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期:2010年10月25日编码: 报告来源: 生产企业 经营企业 √使用单位单位名称:按实际填写
联系地址: 按实际填写邮编:联系电话:
报告人:医师 √技师 护士 其他
报告人签名:
例子2
附件1:国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期: 2010 年 10 月 8日编码: 报告来源: 生产企业 经营企业 √使用单位单位名称:
联系地址:邮编:联系电话:
报告人:医师 技师 护士 √其他
报告人签名:。
可疑医疗器械不良事件报告表
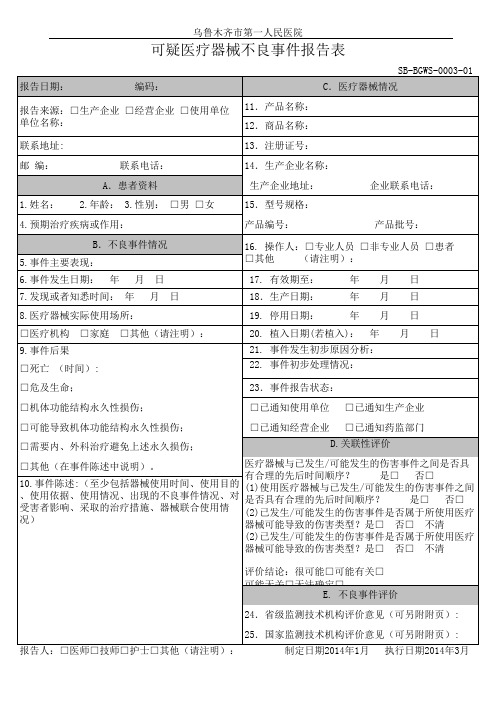
报告来源:□生产企业 □经营企业 □使用单位 单位名称: 联系地址: 邮 编:
4.预期治疗疾病或作用: B.不良事件情况 5.事件主要表现: 6.事件发生日期: 年 月 日 月 日 7.发现或者知悉时间: 年 8.医疗器械实际使用场所: □医疗机构 9.事件后果 □死亡 (时间): □危及பைடு நூலகம்命; □机体功能结构永久性损伤; □可能导致机体功能结构永久性损伤; □需要内、外科治疗避免上述永久损伤; □其他(在事件陈述中说明)。 □家庭 □其他(请注明):
乌鲁木齐市第一人民医院
可疑医疗器械不良事件报告表
SB-BGWS-0003-01 报告日期: 编码: 11.产品名称: 12.商品名称: 13.注册证号: 联系电话: A.患者资料 1.姓名: 2.年龄: 3.性别: □男 □女 14.生产企业名称: 生产企业地址: 15.型号规格: 产品编号: 产品批号: 企业联系电话: C.医疗器械情况
16. 操作人:□专业人员 □非专业人员 □患者 □其他 (请注明): 17. 有效期至: 18.生产日期: 19. 停用日期: 年 年 年 年 月 月 月 月 日 日 日 日
20. 植入日期(若植入): 22. 事件初步处理情况: 23.事件报告状态: □已通知使用单位 □已通知经营企业
21. 事件发生初步原因分析:
□已通知生产企业 □已通知药监部门 D.关联性评价
医疗器械与已发生/可能发生的伤害事件之间是否具 有合理的先后时间顺序? 是□ 否□ 10.事件陈述:(至少包括器械使用时间、使用目的 (1)使用医疗器械与已发生/可能发生的伤害事件之间 、使用依据、使用情况、出现的不良事件情况、对 是否具有合理的先后时间顺序? 是□ 否□ 受害者影响、采取的治疗措施、器械联合使用情 (2)已发生/可能发生的伤害事件是否属于所使用医疗 况) 器械可能导致的伤害类型?是□ 否□ 不清 (2)已发生/可能发生的伤害事件是否属于所使用医疗 器械可能导致的伤害类型?是□ 否□ 不清 评价结论:很可能□可能有关□ 可能无关□无法确定□ E. 不良事件评价 24.省级监测技术机构评价意见(可另附附页): 25.国家监测技术机构评价意见(可另附附页): 报告人:□医师□技师□护士□其他(请注明): 制定日期2014年1月 执行日期2014年3月
可疑医疗器械不良事件报告表

可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码:报告来源: 生产企业 经营企业 使用单位 单位名称:联系地址: 邮 编: 联系电话:报告人签名:国家食品药品监督管理局制报告人: 医师 技师 护士 其他可疑医疗器械不良事件报告的有关说明一、医疗器械不良事件定义:获准上市的、合格的医疗器械在正常使用情况下,发生的或可能发生的任何与医疗器械预期使用效果无关的有害事件。
二、报告范围:需要医疗器械生产企业、经营企业、使用单位提供的可疑医疗器械不良事件报告是死亡和严重伤害报告。
其中,严重伤害指①危及生命;②导致机体功能的永久性伤害或者机体结构的永久性损伤;③必须采取医疗措施才能避免上述永久性伤害或损伤。
“永久性”是对身体结构或功能的不可逆的伤害,不包括小的伤害或损害。
三、报告原则:基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与所使用医疗器械有关,需要按可疑医疗器械不良事件报告。
濒临事件原则:有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者或医务人员死亡或严重伤害,则也需要报告。
可疑即报原则:在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
这些事件可以是与使用医疗器械有关的,也可以是不能除外与医疗器械有关的事件。
四、免除报告规则:1、使用者在应用前能够发现医疗器械有缺陷;2、完全是患者因素导致了不良事件发生;3、事件发生仅仅是因为器械超过有效期限;4、事件发生时,医疗器械预先设计的安全保护措施正常工作,并不会对患者造成伤害。
五、注意事项:1、请务必填写清楚您的联系方式、产品名称和生产企业名称2、进口产品在生产企业联系方式一栏请填写境内代理企业联系方式六、《可疑医疗器械不良事件报告表》填写说明1.患者资料:第1条至第4条为患者一般情况,包括:患者姓名、性别、年龄、预期治疗疾病或作用,资料请填写清楚,有利于资料的分析处理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C.医疗器械情况
*11.产品名称:
12.商品名称:
*13.注册证号:
*14.生产企业名称:
生产企业地址:
企业联系电话:
15.型号规格:
产品编号:
产品批号:
16.操作人:专业人员非专业人员患者其它(请注明):
17.有效期至:年月日
18.生产日期:年月日
19.停用日期:年月日
7.发现或者知悉时间:2013年月日
8.医疗器械实际使用场所:
医疗机构家庭其它(请注明):
*9.事件后果
死亡(时间);
危及生命;
机体功能结构永久性损伤;
可能导致机体功能机构永久性损伤;
需要内、外科治疗避免上述永久损伤;
其它(在事件陈述中说明)。
*10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)
可疑医疗器械不良事件报告表
报告日期:年月日编码:
报告来源:生产企业经营企业使用单位单位名称:
联系地址:邮编:452370联系电话:
A.患者资料
1.姓名:
2.年龄:
出生日期:
3.性别男女
患者联系电话:
4.预期治疗疾病或作用:
B.不良事件情况
*5.事件主要表现
器械故障:
主要伤害:
6.事件发生药和/或械的作用、患者病情或其他非医疗器械因素来解释?
是否无法确定
关联性评价结果
很有可能可能有关可能无关不能确定
*报告人签名:国家食品药品监督管理局制
20.植入日期(若植入):年月日
21.事件发生初步原因分析:
*22.事件初步处理情况:
23.事件报告状态:
已通知使用单位已通知生产企业
已通知经营企业已通知药监部门
D.关联性评价
*24、使用医疗器械与已发生/可能发生的伤害事件之间是否具有合理的先后时间顺序?是否
*25、发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型?是否无法确定
