化学选修三第二章第二节分子的立体构型
人教化学选修3第二章第二节分子的立体构型(共23张PPT)
员、计时员、发言员
• 时间:5分钟 • 约定:“ 蓝矾苦矾,蓝色晶体”停止实
验,倒数五个数,归位并且安静。
实验探究2:CuSO4+NH3·H2O
化学
天蓝色 溶液
蓝色 沉淀
深蓝色 溶液
Cu 2+ +2NH3 . H2O
Cu(OH)2 + 4NH3 . H2O
蓝色沉淀
探究2 除实水验外探究,[是2—否2]有(其取实他验电[2子-1给]所予得硫体酸?铜溶
液1/3实验)根据现象分析溶液成分的变化并说 明你的推断依据,记录现象和写出相关的离子 方程式,找出配位键,配体?
• 任务: • (1)7人小组合作完成实验 • (2)将实验现象记录于小卡上,顺时针
交流,实验报告,实验最快小组把结果写 在大板卡上。
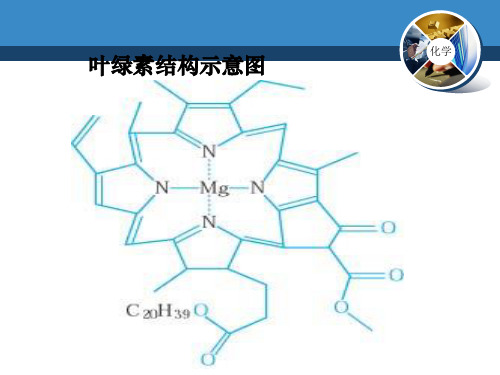
叶绿素结构示意图
化学
高二选修3 物质结构与性质
第二章第二节 分子的立体构型 ——配合物理论简介
化学
授课人:杨远贞
目标 化学
什么是配位键?
配位键属于 哪一类化学键?
探究1 为什么CuSO4 •5H2O晶体是蓝 色而无水CuSO4 是白色?
实验探究[2—1] 向盛有固体样品的试管中,分别加1/3试管
水溶解固体,观察实验现象并填写下表
固体
C白uS色O4
Cu绿Cl色2•2H2O
深Cu褐Br色2
NaCl
白色
K白2S色O4
KBr
白色
溶液
颜色
无色离子:
什么离子
呈天蓝色:
探究1 为什么CuSO4 •5H2O晶体是蓝 色而无水CuSO4 是白色?
• 任务: • (1)7人小组合作完成实验 • (2)将实验现象以表格的形式记录于小
人教版高中化学选修3--2.2分子的立体结构-课件品质课件PPT

用中心原子的价电子对数预测分子的立体结构:
价电子对n VSEPR模型
例
n=2
直线形
CO2、 CS2
n=3
平面三角形 CH2O、BF3
n=4
正四面体形
CH4、 CCl4
n=5
三角双锥形
PCl5
n=6
正八面体形
SCl6
思考并填写下列表格:
中心原
代表物 子价电
子对数
中心原子 孤对电子 对数
VSEPR模型
型,下列说法正确的(C )
• A.若n=2,则分子的立体构型为V形 • B.若n=3,则分子的立体构型为三角锥形 • C.若n=4,则分子的立体构型为正四面体形 • D.以上说法都不正确
课堂练习
• 4.美国著名化学家鲍林(L.Pauling, 1901—1994)教授具有独特的化学想象力: 只要给他物质的分子式,他就能通过“毛
CO2 2 0
直线形
CH2O 3 0
平面三角形
C2H4 3
0
平面三角形
SO42- 4
0
四面体形
H2O 4 2
四面体形
NH3 4 1
平面三角形
中心原子价 中心原子孤 电子对数 对电子对数
2
0
4
0
2
0
4
1
3
1
3
0
中心原子上存在孤对电子的分子: • 先由价层电子对数得互斥模型, • 然后略去孤对电子占有的空间, • 分子的立体结构。
• 分子中的价层电子对(孤对电子和σ键电子)
由于斥力作用而趋向尽可能彼此远离以减小斥力, 分子尽可能采取对称的空间构型,电子对之间的夹 角越大,排斥力越小。
人教版化学选修三第二章第二节分子的立体构型(共87张PPT)

2020/7/27
正八面
体形
SF6
正方形 XeF4
24
价电子对的排斥力
1、如果ABn型分子中有双键或叁键,价电子互斥理论仍适用, 把双键或叁键看成一对电子。
2、价层电子对相互排斥作用的大小取决于电子对之间的夹 角和电子的成键情况,一般规律如下:
1).电子对的夹角越小,排斥力越大 2).由于成键电子对受到两个核的吸引,电子云比较密紧,
数
4
3
2
孤电子对 VSEPR模 分子的立体
数
型及名称 构型及名称
H
0
正四面体
H
C
H
正四面H体
1
四面体
N
H
H
H 三角锥形
2
四面体
O
H H
V形 20
应用反馈
化学式
H2S BF3 NH2-
中心原子
孤对电子 数
σ键电子 对数
VSEPR模型
2
2
四面体
0
3 平面三角形
2
2
四面体
空间构型
V形 平面三角形
V形
课本P39思考与交流
2020/7/27
18
孤电子对数的计算 =½(a-xb)
分子或 中心原 a
x
b
离子 子
H2O
O
6
1
2
SO2
S
6
2
2
NH4+
N
5-1=4
4
1
CO32- C
4+2=6 3
2
中心原子 上的孤电 子对数
2
1
0
0
4.价层电子对互斥模型即VSEPR模型应用
高中化学 第2章第2节 分子的立体构型 新人教版选修3

节
分
子
的
课堂互动讲练
立
体
构
型
知能优化训练
课前自主学案
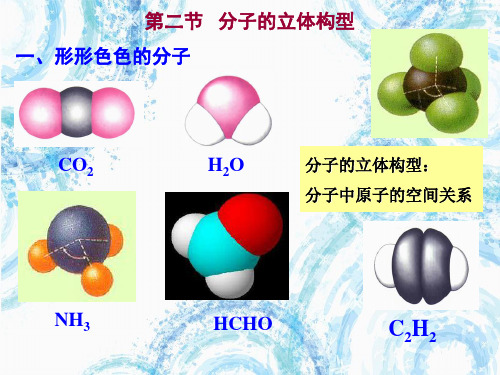
一、形形色色的分子 分子的立体构型:两个以上原子构成的分子中 的原子的空间关系问题。 1.三原子分子的立体构型有直线形和V形两种。 如:
化学 式
电子式
结构式
键角
分子的 立体模
型
立体构 型
CO2
__18_0_°__
直__线__形__ _
H2O
_1_0_5_°__ _
化学 式
电子式
结构式
键角
分子的 立体模
型
立体构 型
Байду номын сангаас
CH4
_1_0_9_°_2_8_′_ _
_正__体_四__形__面___
CCl4
_1_0_9_°__2_8′_ _
_正__体__四__形_面___
思考感悟 1.五原子分子都是正四面体结构吗? 【提示】 不是,如CH3Cl、CH2Cl2、CHCl3等, 虽为四面体结构,但由于碳原子所连的四个原子 不相同,四个原子电子间的排斥力不同,使四个 键的键角不再相等,所以并不是正四面体结构。
杂化类型 sp
sp2
sp3
参于杂化 1个s轨道 1个s轨道 1个s轨道
的原子轨 和
和
和
道及数目 1个p轨道 2个p轨道 3个p轨道
杂化轨道
2
的数目 ______
3 ______
4 ______
2.杂化轨道类型与分子空间构型的关系
杂化类型 sp
sp2
sp3
杂化轨道 间的夹角
180° ______
120° 109°28′ ______ _________
人教化学选修3第二章第二节分子的立体构型(共18张PPT)

▪ 化形成键;如果有一个双键,则有一个键,用去一 个P轨道形成SP2杂化;例如:C2H4
▪ 如果全部是单键,一般来说采取SP3杂化;例如:CH4
3、根据中心原子的VSEPR模型判定
VSEPR模型 直线型
平面三角形 四面体
杂化理论简介
观察几张我们熟悉的 有机分子结构图,你知道 它们是怎么成键的吗??
乙烯
苯
乙炔
请大家看书P39思考:
1、画出碳原子的核外电子排布图;
2、碳原子只有2个未成对电子,如何 与氢原子形成CH4,而不是CH2?
C:2s22p2
2p
2s
为了解释此问题,美国化学家鲍林提出了杂 化轨道理论
杂化轨道理论
4
109。28′
'
正四面体
BF3 BCl3 CH 4 NH3
H2O
SiCl4 PH 3
H 2S
三角形
3
四面体 三角锥 V型
4
判断分子或离子中心原子杂化的方法:
1、依据中心原子的价层电子对
价层电子对数 中心原子杂化类型
实例
2
SP
BeCl2
3
SP2
BF3
4
SP3
CH4
2、看中心原子有没有形成双键或者三键
乙烯中碳以sp2 杂化,C=C中一
个σ和一个π
乙炔中碳以sp杂 化,C=C中一个
σ和两个π
本节要求:
1、了解几种常见的杂化方式; 2、会用不同方法判断分子或者离子中 心原子的杂化方式; 3、会用杂化轨道理论解释某些物质成 键情况;
课后思考:
人教版高中化学选修三第二章第二节分子的立体结构 课件(共19张PPT)

思考
↑↓
↑↓
1s 2s
↑↑
2p
根据碳原子的核外电子排布图,思考为什么碳原子与
氢原子结合形成CH4,而不是CH2 ?
↑↓碳原子的一个2S电子受外界影响跃迁到2P空轨道 上,使碳原子具有四个单电子,因此碳原子与氢原子 结合生成CH4。
思考
如果C原子就以1个2S轨道和3个2P轨道上的单电子,
D.H2O
B ❖ 2.下列分子中的中心原子杂化轨道的类型相同的是( )
❖ A.CO2与SO2
B.CH4与NH3
❖ C.BeCl2与BF3
D.C2H2与C2H4
❖ 3.ClO-、ClO2-、ClO3-、ClO4-中Cl都是以sp3杂化轨道与 O原子成键的,试推测下列微粒的立体结构
直线形
V形 三角锥形 正四面体
强调:杂化前后轨道数目不变。即杂化轨道数=参与杂化的轨道数目 如:1个s,1个p形成2个完全相同的sp杂化轨道,
1个s,2个p形成3个完全相同的sp2杂化轨道, 1个s,3个p形成4个完全相同的sp3杂化轨道, 杂化后轨道伸展方向、形状发生改变。
2说明:
(1)只有能量相近的原子轨道才能杂化。 (2)杂化轨道数目和参与杂化的原子轨道数目相等,杂 化轨道能量相同。
例题
❖ 例:有关乙炔分子中的化学键描述不正确的是( )
❖ A.两个碳原子采用sp杂化方式
B
❖ B.两个碳原子采用sp2杂化方式
❖ C.每个碳原子都有两个未杂化的2p轨道形成π键
❖ D.两个碳原子形成两个π键
返回
C ❖ 1.下列分子中心原子是sp2杂化的是 ( )
❖ A.PBr3
B.CH4
C.BF3
化学选修3第二章第二节分子的立体构型
3个sp2杂化轨 4个sp3杂化轨 道 道
1200 1090 28’
1800
空 间 构 型
实 例
直 线形
平面三角形
四面体形 CH4 , H2O
BeCl2 CO2 C2H2 BF3 , C2H4
杂化轨道只用于形成σ键或者用来容纳孤对电子,剩 余的p轨道可以形成π键
1、氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是 因为( C ) A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化, 而CH4是sp3杂化 B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形 成4个杂化轨道 C.NH3分子中有未成键的孤电子对,它对成键电子的排斥 作用较强 D.氨气分子中氮原子电负性强于甲烷分子中的碳原子 2、用价层电子对互斥理论预测H2S和BF3的立体结构,两个 结论都正确的是( D )
sp2杂化轨道的形成过程
120° z z z z
y x x
y x
y x
y
sp2杂化轨道由1个s轨道和2个p轨道杂化而得到三个sp2杂化轨道。 三个杂化轨道在空间分布是在同一平面上,互成120º 例如:C2H4
C2H4(sp2杂化)
sp杂化轨道的形成过程
z
z
180°
z
z
y x x
y x
y x
y
sp杂化轨道由1个s轨道和1个p轨道杂化而得到两个sp杂化轨道。 两个杂化轨道在空间分布呈直线型,互成180º 例如:C2H2
4、下列分子或离子中,不含有孤对电子的是( D ) A、H2O B、H3O+ C、NH3 D、NH4+
5、以下分子或离子的结构为正四面体,且键角为 109°28′ 的是( B ) ①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42A、①②③ B、①②④ C、①②⑤ D、①④⑤
人教版选修三:第二章第二节《分子的立体构型》课件(人教版选修3)

测分子体结构: 红外光谱仪→吸收峰→分析。
同为三原子分子,CO2 和 H2O 分子的空间结 构却不同,什么原因?
直线形
V形
同为四原子分子,CH2O与 NH3 分子的的空 间结构也不同,什么原因?
平面三角形
三角锥形
二、价层电子对互斥理论(VSEPR) 二、价层电子对互斥理论(VSEPR) 1、VSEPR理论要点:
例:
1 中心原子上的孤电子对数= 2 1 中心原子上的孤电子对数= 2
NH3
(5-3×1)=1
(6-2×1)=2
H 2O BF3
练习
1 中心原子上的孤电子对数= 2
(3-3×1)=0
1 中心原子上的孤电子对数= 2
(a-xb)
(4-4×1)=0 (4-2×2)=0
练习
1 中心原子上的孤电子对数= 2 1 中心原子上的孤电子对数= 2
Eg: CH3+ 孤对电子数=(4-1-3*1)/2=0 CH3孤对电子数=(4+1-3*1)/2=1
1 中心原子上的孤电子对数= 2
x为与中心原子结合的原子数 b为与中心原子结合的原子最多能接受的电子数 (氢为1,其他为“8-价电子数”)
(a-xb)
a为中心原子的价电子数(阴、阳离子还要分别加、减离子的电荷数)
小结:
中心原子
价层电子对互斥模型
中心原子 分子 代表物 结合的原子数 类型 CO2 2 3 4 2 3 AB2 空间构型 直线形
无孤对电子 CH2O CH4 H2O NH3
AB3 平面三角形 AB4 AB2 AB3 正四面体 V形 三角锥形
有孤对电子
问题:按照价键理论,C的价态应为多少?
一个C原子可以和几个氢原子结合形成分子?
人教版高中化学选修3课件 第二章第二节分子的立体结构(共54张PPT)

四、配合物理论简介
(一)配位键和配位化合物
1、配位键
⑴概念:共用电子对由一个原子单方向提供给另一
原子共用所形成的共价键。
⑵表示: A
B
电子对给予体 电子对接受体
⑶条件:其中一个原子必须提供孤对电子。另一原
子必须有能接受孤对电子的空轨道。
举例: NH4 +
H3O+
实验2-1 CuSO4 CuCl2.2H2
共轭大л键
苯分子中6个碳原子连接成环,每个碳原子上再连一个 氢原子,所有原子处在同一个平面上。
苯的结构式里的碳-碳键有单键和双键之分,这种结构满 足了碳的四价,可是事实上苯分子的单键和双键的键长和键能 并没有区别,苯的结构式并不能反映这个事实。苯形成p-p大 键。
大π 键
C6H6
C6H6的大π键(离域键)
• 杂化 轨道:原子轨道组合杂化后形成的 一组新轨道
• 杂化轨道类型:sp、sp2、sp3、sp3d2等 • 杂化结果:重新分配能量和空间方向,组
成数目相等成键能力更强的原子轨道 • 杂化轨道用于容纳σ键和孤对电子
1、sp3 杂
化
思考: 学习价层电子互斥模型知道: NH3和H2O的模型和甲烷
分子一样,也是四面体形的, 它们的中心原子是不是sp3杂化呢?
ABn 立体结构 n=2 直线型 n=3 平面三角形 n=4 正四面体型
范例 C02
CH20 CH4
另一类是中心原子上有孤对电子(未用于形成共价键 的电子对)的分子,如H2O和NH3,中心原子上的孤对电子也 要占据中心原子周围的空间,并参与互相排斥。
例如,H20和NH3的中心原子工分别有2对和l对孤对电 子,跟中心原子周围的σ键加起来都是4,它们相互排斥, 形成四面体,因而H:O分子呈V形,NH3分子呈三角锥形。
高中化学人教版选修3 第2章第2节分子的立体结构 课件(63张)

①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42A、①②③ B、①②④ C、①②⑤ D、①④⑤ 5、用价层电子对互斥模型判断SO3的分子构型 _D__ A、正四面体形 B、V形 C、三角锥形 D、平面三角形
课堂练习
6.下列物质中,分子的立体结构与水分子
杂化轨道
杂化轨道
基本要点:在形成分子时,由于原子的相 互影响,若干不同类型能量相近的原子轨 道混合起来,重新组合成一组新轨道。这 种轨道重新组合的过程叫做杂化,所形成 的新轨道就称为杂化轨道。
杂化前后轨道数目不变。 杂化后轨道伸展方向,形状发生改变。
sp3杂化 CH4的空间构 型为正四面体
C:2s22p2
A.若n=2,则分子的立体构型为V形 B.若n=3,则分子的立体构型为三角锥形 C.若n=4,则分子的立体构型为正四面体形 D.以上说法都不正确
课堂练习
美国著名化学家鲍林(L.Pauling, 1901— 1994)教授具有独特的化学想象力:只要
给他物质的分子式,他就能通过“毛估”
1.价层电子对数目的计算
价层电子对数 = 1/2( a + xb ) a为中心原子的价电子数;x为与中 心原子结合的原子数;b为与中心原 子结合的原子最多能接受的电子数
强调:(1)与中心原子连接的原子
如果是氧或是硫则b为0 (2)阴阳离子的孤电子对计算
价层电子对数目 =δ键电子对+孤电子对数
分子或 中心 a
CH4
5、其它:
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
资料卡片: 形形色色的分子 C60
人教版选修3 化学:2.2 分子的立体构型 课件(共41张PPT)

碳原子杂化之前都要发生电子跃迁
Sp3杂化
三、杂化轨道理论简介
1.概念 同一原子中能量相近的原子轨道,重新组合 形成能量相等新轨道的过程叫做原子轨道杂 化,所形成的新轨道叫做杂化轨道
理论要点
①杂化轨道数等于参加杂化的原子轨道数 ②杂化改变了原子轨道的形状、方向。杂化 轨道形成的键比简单原子轨道形成的键更牢 固。 ③杂化轨道用于形成σ键和容纳孤电子对, 未参与杂化的p轨道,可用于形成 π键
子的电荷数
对于阴离子,a=中心原子的价电子数 + 离 子的电荷数 b:与中心原子结合的原子最多能接受的电子 数,氢为1,其他原子等于“ 8-该原子的价 电子数 ” x:与中心原子结合的原子数
阅读:课本P38表2-4
关于公式的说明
中心原子上的孤电子对数 = ½(a-xb)
a为中心原子的价电子数(最外层电子数), 减去结合其他原子时所提供的电子数(xb), 所剩余的电子即为未参与成键的电子,一半 即为孤对电子数。
一般为2、4、6。 配离子的电荷数= 中心原子电荷数+配体总电荷数。
如[Zn(CN) 4 ]2-的电荷数是:+2+(-1)×4=-2;
3.配合物形成时的性质改变 (1)引起离子颜色的改变,如Fe(SCN)3的形 成; (2)引起离子溶解度的改变,如 AgCl→[Ag(NH3)2]+。
注意:配合物溶于水易电离为内界配离子和 外界离子,而内界配离子不能电离。
实验2-1
CuSO4 CuCl2.2H2O CuBr2 NaCl K2SO4 KBr
固体颜色 白色
绿色
深褐色 白色 白色 白色
溶液颜色天蓝色 天蓝色 天蓝色 无色 无色 无色
化学选修三第二章第二节分子的立体构型

化学选修三第二章第二节分子的立体构型选修三第二章第2节分子的立体构型第2节分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl、NO、O 2、N2等。
2.三原子分子有直线形,如CO2、CS2等;还有“V”形,如H2O、H2S、SO2等。
3.四原子分子有平面三角形,如BF3、BCl3、CH2O等;有三角锥形,如NH3、PH3等;也有正四面体,如P4。
4.五原子分子有正四面体,如CH4、CCl4等,也有不规则四面体,如CH3Cl、CH2Cl2、CHCl3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory)简称VSEPR适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤:(1)确定中心原子A价层电子对数目法1.经验总结中心原子的价层电子对数=1(中心离子价电子数+配2对原子提供电子总数)对于AB m型分子(A为中心原子,B为配位原子),计算方法如下: n =中心原子的价电子数+每个配位原子提供的价电子数×m2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断)N H +4价层电子对数为21[5+(4×1)-1] = 4对 正四面体PO -34价层电子对数为21[5+(0×4)+3] = 4对 正四面体NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP )VP 是价层电子对,BP 是成键电子对(BOND ),LP 是孤对电子对(LONE PAIR )VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP=配位原子数+LP Lp =21(中心原子价电子数—配位原子未成对电子数之和)IF 5 Lp =21[7-(5×1)] = 1 构型由八面体−→−四方锥 NH +4Lp =21[(5-1)-(4×1)] = 0 正四面体PO -34Lp =21[(5+3)-(4×2)] = 0 正四面体SO -24Lp =21[(6+2)-(4×2)] = 0 正四面体NO 2 Lp =21[5-(2×2)] = 21−→− 1 构型由三角形−→−V 形 SO -23Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis 结构式或结构式直接写出,双键、三键都是1对电子P ClClCl ClCl P Cl Cl ClP ClClCl Cl+Cl P Cl ClClCl Cl -Cl Cl ClCl +Cl P Cl Cl Cl Cl Cl -VP: 5 4 4 6 4(2)确定价层电子对的空间构型价层电子对数目2 3 4 5 6价层电子对构型直线形三角形四面体三角双锥八面体(3)分子空间构型确定价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
中学化学选修三人教版 2.2 分子的立体构型(共32张PPT)

思考ห้องสมุดไป่ตู้
根据电荷分布是否均匀,共价键有极 性、非极性之分,以共价键结合的分 子是否也有极性、非极性之分呢?
分子的极性又是根据什么来判定呢?
3.分子的极性
非极性分子: 电荷分布均匀对 称的分子
正电荷重心和负电荷重心相重合的分子
Cl
Cl
Cl
Cl
共用电子对 2个 Cl原子吸引电子的能力相同,共用电 子对不偏向任何一个原子,整个分子的 电荷分布均匀,∴为非极性分子
分子对称性与分子的许多性质如极性、 旋光性及化学性质都有关
2.手性分子
左手和右手不能重叠
左右手互为镜像
手性异构体和手性分子
概念:如果一对分子,它们的组成和原 子的排列方式完全相同,但如同左手和右手 一样互为镜像,在三维空间里不能重叠,这 对分子互称手性异构体。有手性异构体的分 子称为手性分子。 条件:当四个不同的原子或基团连接在碳 原子上时,形成的化合物存在手性异构体。 其中,连接四个不同的原子或基团的碳原子 称为手性碳原子。
道混合起来,重新组合成一组新轨道。这 种轨道重新组合的过程叫做杂化,所形成 的新轨道就称为杂化轨道。
① 有多少个原子轨道发生杂 化就形成多少个杂化轨道。
②杂化轨道的电子云一头大, 一头小,成键时利用大的一头, 可以使电子云重叠程度更大, 形成的化学键更稳定。即杂化 轨道增强了成键能力。
③杂化轨道之间在空间取最大 夹角分布,使相互间的排斥能最 小,故形成的键较稳定。不同类 型的杂化轨道之间夹角不同,成 键后所形成的分子就具有不同的 空间构型。
碳原子的p轨道
杂化轨道理论解释苯分子的结构:
C为SP2杂化 C-C (sp2-sp2 ) ; C-H (sp2-s )
人教版化学选修三第二章第二节《分子的立体构型》全课时课件

回顾 Fe3+是如何检验的?
Fe3++3SCN- = Fe(SCN)3 血红色
(4) 配合物的性质 配合物具有一定的稳定性, 过渡金属配合物远比主族金属配合物稳定
(5) 配合物的应用
a 叶绿素 在生命体中的应用 血红蛋白 酶 含锌的配合物 含锌酶有80多种 维生素B12 钴配合物 在医药中的应用 抗癌药物 配合物与生物固氮 固氮酶 王水溶金 H[AuCl4] 照相技术的定影 在生产生活中的应用 电解氧化铝的助熔剂 Na3[AlF6] 镀银工业
Cu2+与H2O是如何结合的呢?
1、配位键
(1)定义提供孤电子对的原子与接受孤电 子对的原子之间形成的共价键。 注意: 配位键与共价键性质完全相同 (2)配位键的形成条件 一方提供孤电子对(配位体)
一方提供空轨道
常见的配位体 H2O NH3 X- CO CN SCN-
(3)配位键的表示方法
A B
电子对给予体→电子对接受体 H O H
2+ H2O H2O Cu OH2 H2O [Cu(NH3)4]2+的配位键
H 请你写出NH4+ 的表示法?
,
讨论 在NH3·BF3中,何种元素的原子提供孤电子 对,何种元素的原子接受孤电子对?写出 NH3·BF3的结构式 NH3中N原子提供孤电子对 BF3中的B原子提供空轨道接受孤电子对 H F H N B F
价层电子对互斥理论(VSEPR theory)
理论要点(根本依据):对ABn型的分子或离子,中 心原子A上价层电子对之间相互排斥,尽可能趋向彼 此远离。价层电子对包括参与形成σ 键的电子对和中 心原子上未参与成键的孤电子对。
人教版化学选修三第二章 第二节 分子的立体构型 课件 (共28张PPT)

Fe3+
+ nSCN = [Fe(SCN)n ]3-n (n=1-6) 血红色
—
银氨溶液的配制 Ag++ NH3· H2O = AgOH↓+ NH4+
白色沉淀 AgOH+2NH3· H2O = [Ag(NH3)2 ]++ OH +2H2O
—
二氨合银离子 无色
冰晶石 冰晶石(六氟合铝酸钠):Na3[AlF6]
第二章 分子的结构与性质
第二节 分子的立体结构
一、形形色色的分子
1、三原子分子的空间结构
①直线型: CO2、HCN ②V型: H2O、SO2
2、四原子分子的空间结构
①平面三角型: SO3、HCHO ②三角锥型: NH3
3、五原子分子的空间结构
①四面体:CCl4、 CH4 ②其它等
二、价层电子对互斥(VSEPR)理论
激发
C
杂化
C
sp 杂 化
2
2p
基态 激发态
1个s轨道和2个p轨道杂化形成3个sp2杂化轨道
+ +
-
3个sp2杂化轨道可形成3个σ键 剩下的一个未参与杂化 的p轨道用于形成π键 价层电子对数为3的中心原子 采用sp2杂化方式
+
构型 120° 正三角型
③ sp杂化 以C原子为例
2p 2s
2s 2p
激发
3 3 三角型 2
0
三角型
1
V—型
电子对 数目
电子对 的空间 构型
成键 电子 对数
孤电子 对数
电子对的 排列方式
分子的 空间构 型
实 例
4
0
高中化学人教版选修3第二章第二节分子的立体构型课件

2.价层电子对(σ键电子对和未成键的孤对电子
对)
代表 电子式 中心原子结合 σ键电 孤对电 价层电
物
原子数
子对
子对 子对数
: :: :
H :O :H H2O
2
H: N: H
NH3
H
3
H
CH4 H: C : H
4
H
: ::
:
CO2 :O ::C::O :
2
2
2
4
3
1
4
4
0
4
2
0
2
价层电子对数 =δ键个数+中心原子上的孤对电子对个数
A、H2O、B、H3O+、C、NH3、D、NH4+ 3 、下列分子①BCl3、②CCl4、③H2S、④CS2中,其键角由 小到大的顺序为__③_② ① ④
4、以下分子或离子的结构为正四面体,且键角为 109°28′ 的是__C __
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42A、①②③ B、①②④ C、①②⑤ D、①④⑤
平面三角形
三角锥形
二.价层互斥理论(VSEPR) 1.内容
σ键电子对和 孤对电子对
对ABn型的分子或离子,中心原子A价层电子对(包 括成键σ键电子对和未成键的孤对电子对)之间由
一般分子组成可写成ABn型。A称为中心原 于存在排挤力,将使分子的几何构型总是采取电子 对子相;B互称排为挤配最位小体的(可那以种是构原型子,、以分使于彼或此原之于间团斥);n力是最
离子 数
数
型及名称 构型及名称
CH4 4
NH3 3
H2O 2
0正四Leabharlann 体1正四面体2
化学选修三第二章第二节分子的立体构型

化学选修三第二章第二节分子的立体构型2选修三第二章第2节 分子的立体构型 第2节 分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl 、NO 、O 2、N 2 等。
2.三原子分子有直线形,如CO 2、CS 2等;还有“V ”形,如H 2O 、H 2S 、SO 2等。
3.四原子分子有平面三角形,如BF 3、BCl 3、CH 2O 等; 有三角锥形,如NH 3、PH 3等; 也有正四面体,如P 4。
4.五原子分子有正四面体,如CH 4、CCl 4等,也有不规则四面体,如CH 3Cl 、CH 2Cl 2、CHCl 3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory )简称VSEPR 适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤: (1)确定中心原子A 价层电子对数目 法1.经验总结中心原子的价层电子对数=21(中心离子价电子数+配对原子提供电子总数)对于AB m 型分子(A 为中心原子,B 为配位原子),计算方法如下: n =中心原子的价电子数+每个配位原子提供的价电子数×m 2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4 中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断)N H +4 价层电子对数为21[5+(4×1)-1] = 4对 正四面体 PO -34 价层电子对数为21[5+(0×4)+3] = 4对 正四面体 NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形 法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP )VP是价层电子对,BP是成键电子对(BOND ),LP是孤对电子对(LONE PAIR)VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP=配位原子数+LPLp =21(中心原子价电子数—配位原子未成对电子数之和)IF5Lp =21[7-(5×1)] = 1 构型由八面体−→−四方锥NH+4Lp =21[(5-1)-(4×1)] = 0 正四面体PO-34Lp =21[(5+3)-(4×2)] = 0 正四面体SO-24Lp =21[(6+2)-(4×2)] = 0 正四面体NO2Lp =21[5-(2×2)] =21−→− 1 构型由三角形−→−V形SO-23Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis结构式或结构式直接写出,双键、三键都是1对电子PClClClClCl PCl Cl ClPClClClCl+ClPClClClClCl-ClClClCl+ClPClClClClCl-VP: 5 4 4 6 4(2)价层电子对数目23456价层电子对构型直线形三角形四面体三角双锥八面体(3)价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
人教版高中化学选修三第二章第二节 《分子的立体构型》 课件 (共25张PPT)

思考与 交流2
2、请根据H3O+的形成提出
[Cu(H2O)4]2+中 Cu2+与H2O结合方 式的设想,并将你的想法与同学交流。
H2O 提供孤电子对
H+
提供空轨道接
受孤对电子
HOH H
H2O
Cu2+
H2O
2+
H2O Cu OH2
H2O
配合物理论简介
2、配合物
(1) 定义 通常把接受孤电子对的金属离子
H
同其他相同原子形成的
共价键键参数完全相同
•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
无色离子:Na+ Cl- K + SO42 – Br - K + 什么离子 呈天蓝色:[Cu(H2O)4]2+
配合物理论简介
思考与 交流2 Cu2+与H2O是如何结合的呢? 1、在强酸溶液电离的过程中, H2O能与H+结 合形成H3O+,请用电子式表示H与O形成H2O的 过程,比较H2O和H3O+的电子式,讨论H2O与 H+是如何形成H3O+?
•8、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者就都不 能在他的身上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。 2021/11/162021/11/162021/11/162021/11/16
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精品教育-可编辑-选修三第二章第2节 分子的立体构型 第2节 分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl 、NO 、O 2、N 2 等。
2.三原子分子有直线形,如CO 2、CS 2等;还有“V ”形,如H 2O 、H 2S 、SO 2等。
3.四原子分子有平面三角形,如BF 3、BCl 3、CH 2O 等; 有三角锥形,如NH 3、PH 3等; 也有正四面体,如P 4。
4.五原子分子有正四面体,如CH 4、CCl 4等,也有不规则四面体,如CH 3Cl 、CH 2Cl 2、CHCl 3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory )简称VSEPR 适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤: (1)确定中心原子A 价层电子对数目 法1.经验总结中心原子的价层电子对数=21(中心离子价电子数+配对原子提供电子总数) 对于AB m 型分子(A 为中心原子,B 为配位原子),计算方法如下:n =中心原子的价电子数+每个配位原子提供的价电子数×m 2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4 中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断) N H +4 价层电子对数为21[5+(4×1)-1] = 4对 正四面体 PO -34 价层电子对数为21[5+(0×4)+3] = 4对 正四面体 NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形 法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP ) VP 是价层电子对,BP 是成键电子对(BOND ),LP 是孤对电子对(LONE PAIR ) VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP精品教育-可编辑-=配位原子数+LPLp =21(中心原子价电子数—配位原子未成对电子数之和) IF 5 Lp =21[7-(5×1)] = 1构型由八面体−→−四方锥NH +4Lp =21[(5-1)-(4×1)] = 0 正四面体 PO -34Lp =21[(5+3)-(4×2)] = 0 正四面体 SO -24Lp =21[(6+2)-(4×2)] = 0 正四面体 NO 2 Lp =21[5-(2×2)] =21−→− 1 构型由三角形−→−V 形 SO -23 Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis 结构式或结构式直接写出,双键、三键都是1对电子P ClClCl ClClP Cl Cl ClP ClClCl Cl +Cl P Cl ClClClCl-Cl Cl ClCl +Cl P Cl Cl Cl Cl Cl -VP: 5 4 4 6 4(2)价层电子对数目 2 3 4 5 6 价层电子对构型 直线形 三角形 四面体 三角双锥 八面体精品教育-可编辑-(3)分子空间构型确定价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
当中心原子无孤对电子时,两者的构型一致; 电子对数 目 中心原子杂化类型 电子对的空间构型 成键电子对数 孤电子 对 数 电子对的 排列方式 分子的空间构型实 例2 sp 直 线 2 0 直 线 BeCl 2CO 23sp 2三角形3三角形 BF 3SO 3 2 1V —形 SnBr 2 PbCl 2 4sp3四面体4四面体CH 4 CCl 4 3 1三角锥NH 3 PCl 3 2 2V —形H 2O①AD m 型分子的空间构型总是采取A 的价层电子对相互斥力最小的那种几何构型; ②分子构型与价层电子对数有关(包括成键电子对和孤电子对); ③分子中若有重键(双、叁键)均视为一个电子对; ④电子对的斥力顺序:孤电子对-孤电子对>孤电子对-键对>键对-键对由于三键、双键比单键包含的电子数多,所以其斥力大小次序为三键>双键>单键。
叁键与叁键>叁数与双键>双键与双键>双键与单键>单与单键。
4、价层电子对斥力作用对键角影响的定性解释由于键合电子对受到左右两端带正电原子核的吸引,而孤对电子对只受到一端原子核吸引,相比之下,孤对电子对较“胖”,占据较大的空间,而键合电子对较“瘦”,占据较小的空间。
这样就解释了斥力大小的顺序:孤电子对-孤电子对>孤电子对-键电子对>键电子对-键电子对。
如:CH 4、NH 3、H 2O 中的键角∠HAH 分别为109.5°、107.3°、104.5°。
类似地,重键较单键占据较大的空间,故有斥力大小的顺序:t-t>t-d>d-d>d-s>s-s(t-叁键,d-双键,s-单键)又如,SO 2Cl 2分子属AX 4L 0=AY 4,因S=O 键是双键,S-Cl 键是单键,据顺序有:∠OSO>109°28''''∠ClSCl<∠OSCl<109°28''''。
此外,键的极性对键角也有影响。
中心原子电负性较大,成键电子对将偏向中心原子,成键电子对之间斥力增大,键角增大,如:NH 3、PH 3、AsH 3分子中的键角(∠HAH)依次为107°、93.08°、91.8°;配位原子电负性较大,成键电子对将偏离中心原子,成键电子对之间斥力减小,键角减小,如:H 2O 、OF 2分精品教育-可编辑-子中的键角(AOA)依次为104.5°、102°。
据此,可解释下列键角变化:NO 2+、NO 2、NO 2-键角(∠ONO)依次为180°、134.3°、115.4°。
二、价层电子对互斥理论1940年 Sidgwick 提出价层电子对互斥理论, 用以判断分子的几何构型. 分子 ABn 中, A 为中心, B 为配体, B 均与A 有键联关系. 本节讨论的 AB n 型分子中, A 为主族元素的原子. 1. 理论要点AB n 型分子的几何构型取决于中心 A 的价层中电子对的排斥作用. 分子的构型总是采取电子对排斥力平衡的形式.1) 中心价层电子对总数和对数a)中心原子价层电子 总数等于中心 A 的价电子数(s + p)加上配体在成键过程中提供的电子数, 如 CCl 4 4 + 1×4 = 8 b)氧族元素的氧族做中心时: 价电子数为 6, 如 H 2O, H 2S;做配体时:提供电子数为 0, 如在 CO 2中. c)处理离子体系时, 要加减离子价d)总数除以 2 ,得电子对数: 总数为奇数时,对数进 1,例如:总数为 9,对数为 52) 电子对和电子对空间构型的关系 电子对相互排斥,在空间达到平衡取向.3) 分子的几何构型与电子对构型的关系若配体数和电子对数相一致,各电子对均为成键电对,考虑分子构型时,只考虑原子 A ,B 的位置,不考虑电子、对电子等。
以上三种情况中,孤对电子只有一种位置考虑。
孤对电子的位置若有两种或两种以上的位置可供考虑,则要选择斥力易于平衡位置,而斥力大小和两种因素有关: a)角度小,电对距离近,斥力大;b)角度相同时,孤对——孤对的斥力最大。
因为负电集中,孤对-成键斥力次之,而成键电对-成键电对之间斥力最小,因有配体原子核去分散电对的负电性。
于是,要避免的是斥力大的情况在 90°的方向上。
90 °的分布 :孤对-孤对 0 0 1 孤对-成键 6 4 3 成键-成键 0 2 2 乙种稳定,称 “T”字型精品教育-可编辑-则分子构型和电子对构型一致。
配体数不可能大于电子对数. 当配体数少于电子对数时,一部分电子对成为成键电对,另一部分电子成为孤对电子,确定出孤对电子的位置,分子构型才能确定。
电子对数 配体数 孤电对数 电对构型 分子构型例1. 利用价层电子对互斥理论判断下列分子和离子的几何构型(总数、对数、电子对构型和分子构型): AlCl 3 H 2S SO 32- NH 4+ NO 2 IF 3解题思路:根据价层电子对互斥理论, 计算单电子个数, 价层电子对数, 孤对电子对数, 进而判断分子的构型(注意:必须考虑离子的价态!)电子对构型是十分重要的结构因素,要注意!价层电子对数和配体数是否相等也是十分重要的。
2. 影响键角的因素 1) 孤对电子的影响孤对电子的负电集中,可以排斥其余成键电对,使键角变小,NH 3 4对 电对构型四面体,分子构型三角锥。
键角 HNH 为107°,这是由于孤对电子对 N -H 成键电 对的排斥,使109°28′变小, 成为107°。
2) 中心电负性的影响键角依次减小,如何解释?3. 多重键的处理某配体(非VIA 族)与中心之间有双键和三键时,价层电子对数减 1 或 2 。
如乙烯 H 2C=CH 2 以左碳为中心电子总数 4 + x + 2 = 8 , 4对, 减 1,3 对,为三配体,呈平面三角形:不提供共用电子, 是因为O, S 等可通过键, 反馈键或大键, 将提供的电子又重新得回; 另外, 端基氧或硫, 形成的双键, 要求减去一对价电子, 也得到同样结果.非端基氧或硫, 要将O或S的价电子计入其中, 如在H2CO3中, C为中心, 价电子为4(C) + 2X1(O) = 6, 价电对= 3, 电子对构型和分子构型一致, 为三面体:3) 配体电负性的影响中心相同,配体电负性大时,电对距离中心远,键角可以小些,故有:-可编辑-精品教育【练习】1.用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )A.直线形;三角锥形B.V形;三角锥形C.直线形;平面三角形D.V形;平面三角形2.下列分子中的中心原子杂化轨道的类型相同的是( )A.CO2与SO2B.CH4与NH3 C.BeCl2与BF3D.C2H4与C2H23.(1)某校化学课外活动小组的同学对AB3型分子或离子的空间构型提出了两种看法,你认为是哪两种?若两个A—B键均是极性键且极性相同,它们分子的极性是怎样的?举例说明。
