原子核式结构模型(一)
原子结构的模型(PPT课件(初中科学)26张)

金金属箔
[1]大多数粒子不改变本来的运动方向,原因是:
原子内有较大的间隙。
。
[2]有小部分改变本来的运动路径,原因是: α粒子受到了同种电荷互相排挤作用而改变了运动方向。。
[3]极少数被弹射了回来,原因是: α粒子撞击到了带正电荷、质量大、体积很小的核。 。
自从卢瑟福用α粒子轰击了金属箔后,使人 们对原子内部的结构有了更深入的了解,从而对 原子内部结构的认识更接近了它的本质。
2.汤姆生的原子结构模型
汤姆生模型 (西瓜模型)
探究:卢瑟福的α粒子散射实验
1911年,英国科学家卢瑟福 用带正电的α粒子轰击金属箔, α粒子源 实验发现多数α粒子穿过金属箔 后仍保持本来的运动方向,但有 少量的α粒子产生了较大的偏转。
金金属箔
探究:卢瑟福的α粒子散射实验
1911年,英国科学家卢瑟福 用带正电的α粒子轰击金属箔, α粒子源 实验发现多数α粒子穿过金属箔 后仍保持本来的运动方向,但有 少量的α粒子产生了较大的偏转。 问题思考:
在化学变化中可分的微粒是( B ) A.原子 B.分子 C.电子 D.原子核
6.下列叙述正确的是……………( B ) A.原子核都是由质子和中子构成的 B.原子和分子都是构成物质的一种粒子,它 们都是在不停地运动的 C.原子既可以构成分子,也可以构成物质 D.物质在产生物理变化时,分子产生了变化, 在产生化学变化时,原子产生了变化
原 子
原子核 (+)
质子:一个质子带一个单位的正电荷 中子: 中子不带电
电子: 一个电子带一个单位的负电荷
( —)
原子核所带的电荷数简称为核电荷数。
说一说:以氧原子为例解说原子的结构
电子:8个,带8个单位负电荷
原子核式结构模型

创新微课
原子核式结构模型
五、卢瑟福核式结构模型
创新微课
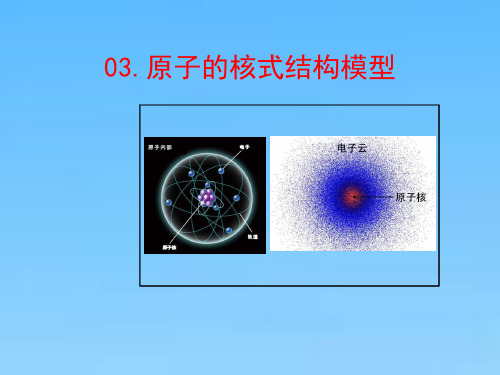
在原子的中心有一个很小的核,叫做原子核。原子的全 部正电荷和几乎全部质量都集中在原子核里,带负电的 电子在核外空1间绕着核旋转。
原子核式结构模型
根据卢瑟福的原子核式结构模型,原子内部是十 分“空旷”的,举一个简微课
原子核
原子核式结构模型
创新微课
六、原子核的电荷和大小
根据卢瑟福的原子核式结构模型和 α 粒子散射实验数据,可以推算 出各种元素原子核的电荷数,还可以估计出原子核的大小。 (1)原子半径的数量1 级为 10 ─ 10 m、原子核半径的数量级为 10 ─14 m, 原子核的体积只占原子体积的万亿分之一。 (2)原子核所带正电荷数与核外电子数以及该元素在周期表内的原子 序数相等。 (3)电子绕核旋转所需向心力就是核对它的库仑力。
创新微课 现在开始
原子核式结构模型
原子核式结构模型
创新微课
一、汤姆孙的原子模型
在汤姆孙的原子模型中,原子是一个球体,正电荷均匀分布在 整个球体内,电子镶嵌其中。
1
电子
英国物理学家 汤姆孙
汤姆孙原子模型 (枣糕模型)
原子核式结构模型
二、α粒子散射实验
1909~1911年,英国物理学家卢瑟福和他的 助手们进行了 α 粒子散射实验。
同学,下节再见
1
创新微课
原子核式结构模型
1
创新微课
原子核式结构模型
【高中物理】高中物理-第十八章-2原子的核式结构模型教案-新人教版选修3-5

原子的核式结构模型(一)知识与技能1.了解原子结构模型建立的历史过程及各种模型建立的依据。
2.知道α粒子散射实验的实验方法和实验现象,及原子核式结构模型的主要内容。
(二)过程与方法1.通过对α粒子散射实验结果的讨论与交流,培养学生对现象的分析中归纳中得出结论的逻辑推理能力。
2.通过核式结构模型的建立,体会建立模型研究物理问题的方法,理解物理模型的演化及其在物理学发展过程中的作用。
3.了解研究微观现象。
(三)情感、态度与价值观1.通过对原子模型演变的历史的学习,感受科学家们细致、敏锐的科学态度和不畏权威、尊重事实、尊重科学的科学精神。
2.通过对原子结构的认识的不断深入,使学生认识到人类对微观世界的认识是不断扩大和加深的,领悟和感受科学研究方法的正确使用对科学发展的重要意义。
★教学重点1.引导学生小组自主思考讨论在于对α粒子散射实验的结果分析从而否定葡萄干布丁模型,得出原子的核式结构;2.在教学中渗透和让学生体会物理学研究方法,渗透三个物理学方法:模型方法,黑箱方法和微观粒子的碰撞方法;★教学难点引导学生小组自主思考讨论在于对ɑ粒子散射实验的结果分析从而否定葡萄干布丁模型,得出原子的核式结构★教学方法教师启发、引导,学生讨论、交流。
★教学用具:投影片,多媒体辅助教学设备★课时安排1 课时★教学过程(一)引入新课讲述:汤姆生发现电子,根据原子呈电中性,提出了原子的葡萄干布丁模型。
学生活动:师生共同得出汤姆生的原子葡萄干布丁模型。
点评:用动画展示原子葡萄干布丁模型。
(二)进行新课1.α粒子散射实验原理、装置(1)α粒子散射实验原理:汤姆生提出的葡萄干布丁原子模型是否对呢?原子的结构非常紧密,用一般的方法是无法探测它的内部结构的,要认识原子的结构,需要用高速粒子对它进行轰击。
而α粒子具有足够的能量,可以接近原子中心。
它还可以使荧光屏物质发光。
如果α粒子与其他粒子发生相互作用,改变了运动方向,荧光屏就能够显示出它的方向变化。
原子核式结构模型

原子核式结构模型
1 什么是原子核式结构模型
原子核式结构模型是指以原子核为中心,以其结构核素为外围组成的一种模型,是现代物理学提出的一种量子力学模型。
根据这种模型,原子核由质子和中子构成,其外围有质子、中子和费米子存在,使原子核具有特殊的结构。
2 原子核式结构模型的特点
1、核子的发明:今年是发现原子核的百年纪念,由爱因斯坦和玻尔在1905年提出核子模型,只有由正质子、负质子和中子组成。
2、结构特性:原子核由核子和核质子共同构成,核子质量极小,要比中子大2000倍以上,构成原子核的核质子的构成数量为其质量的比例,有的原子核还带有中性的费米子。
3、区别:原子核式结构模型与物理学里的分子模型完全不同,分子模型是以分子的中心的分子键为中心的,原子核式结构模型是以原子核的结构核素构成一个完整的模型。
3 原子核式结构模型的应用
原子核模型对物理学、化学、核物理学等多领域有重大影响,它可以解释原子中核子的形成、核素的变异等现象,为大规模原子核研究奠定了坚实的理论基础。
此外,它还可以用来解释原子构型的形成
以及其价态间的相互作用等,广泛应用于原子核反应和量子表现、原子与微粒子的测定等。
原子的核式结构模型25张PPT

动画:α粒子散射
课堂小结
实验中发现极少数α粒子发生了大角度偏转,甚至反 弹回来,表明这些ɑ粒子在原子中某个地方受到了质量、 电量均比它本身大得多的物体的作用,可见:
1.原子中的正电荷、质量应都集中在一个中心上。 绝大多数α粒子不偏移→原子内部绝大部分是“空” 的。 2.少数α粒子发生较大偏转→原子内部有“核”存在。 3.极少数α粒子被弹回 表明:作用力很大;质量很大;电量集中。
教材习题解答
1、答:反射源:α粒子 金箔:被α粒子轰出的物质。 带有荧光屏的放大镜。整个装置置于真空中α
粒子打在银光屏上有微弱的光,由于放大镜能够 围绕金箔在一个圆周内运动,因此可以通过它观 察到穿过金箔后偏转角度不同的α粒子。
观察到的现象是:绝大多数α粒子穿过金箔后基 本上沿着原来方向前进,少数α粒子发生了大角 度偏转,偏转超过了90度,极少数像是被弹了回 来去。
原子
原 子核
电子
中子
质子
核外电子数
+ = 质量数A
中子数
质子数Z
原子序数 核电核数
高考链接
1、根据卢瑟福的原子核式结构模型,下列说 法正确的是( D)
A.原子中的正电荷均匀分布在整个原子范围 内
B.原子中的质量均匀分布在整个原子范围内 C.原子中的正电荷和质量都均匀分布在整个原 子范围内 D.原子中的正电荷和几乎全部质量都集中在很 小的区域范围内
本节导航 一、 α粒子散射实验 二、原子核的电荷与尺度
一、α粒子散射实验
原子正负电荷分布的研究 汤姆生的原子模型
被a粒子散射实验否定 卢瑟福提出新的假设(核式结构模型)
数学推理 与实验事实的对照
卢瑟福(Lusefu), 在他66年的生涯中,他阐 述了放射性衰变的理论, 鉴定出α粒子(氦核24He)、 β粒子(电子流-10e)和γ 射线(光子),发现了原 子核,第一次用人工的方 法将一种元素转变为另一 种元素。直接培养了11名 诺贝尔奖获得者。
原子核式结构模型卢瑟福

原子核式结构模型卢瑟福原子核式结构模型卢瑟福引言原子核式结构模型是科学家卢瑟福在1911年提出的,它为人们理解原子的内部结构提供了重要的线索。
本文将从实验原理、实验过程、实验结果和结论等方面详细介绍卢瑟福的原子核式结构模型。
一、实验原理1.1 原子核和电子在学习卢瑟福原子核式结构模型之前,我们需要先了解什么是原子核和电子。
原子核是由质子和中子组成的,质量大约为电子质量的2000倍,而电子则是带有负电荷的基本粒子。
1.2 α粒子α粒子是一种带有正电荷的粒子,由两个质子和两个中性粒子组成。
它具有高速运动能力,并能穿透物体。
1.3 散射现象散射现象指入射粒子与目标物质发生碰撞后改变方向或速度的现象。
散射角度越大,则入射粒子与目标物质之间相互作用越小。
二、实验过程2.1 实验装置卢瑟福使用了一台放射性源、一块金箔和一个探测器的实验装置。
放射性源发出α粒子,经过金箔后被探测器接收。
2.2 实验步骤卢瑟福将α粒子从放射源中释放出来,让它们穿过金箔,并在探测器上进行检测。
他还记录了散射角度和散射粒子数目等数据。
2.3 实验结果卢瑟福的实验结果表明,大多数α粒子穿过金箔而不受到任何影响。
然而,一小部分α粒子发生了强烈的偏转或反弹。
三、实验结果分析3.1 结果解释卢瑟福根据实验结果推断,原子核在原子中的体积非常小,只占整个原子体积的很小一部分。
这是因为大多数α粒子能够穿透金箔并被探测器接收。
3.2 原子核式结构模型基于他的实验结果,卢瑟福提出了原子核式结构模型。
该模型认为原子由一个带正电荷的核和围绕核运动的带负电荷的电子组成。
原子核的大小非常小,但它却包含了原子中大部分的质量。
四、结论卢瑟福的原子核式结构模型为人们理解原子内部结构提供了重要线索。
它揭示了核和电子之间相互作用的基本规律,对后来的原子理论研究产生了深远影响。
原子的核式结构模型课件

二、电子的发现
1.汤姆孙的探究
(1)让阴极射线分别通过电场和磁场,根据偏转情况,证明它是B(A.
带正电 B.带负电)的粒子流并求出了它的比荷。
(2)换用不同材料的阴极做实验,所得比荷的数值都相同。证明这
种粒子是构成各种物质的共有成分。
(3)进一步研究新现象,不论是由于正离子的轰击,紫外光的照射,
金属受热还是放射性物质的自发辐射,都能发射同样的带电粒子—
核库仑斥力的作用,所以选项D错误,C正确。
答案:C
—电子。由此可见,电子是原子的组成部分,是比原子更基本的物
质单元。
2.密立根“油滴实验”
(1)精确测定电子电荷。
(2)电荷是量子化的。
3.电子的有关常量
→电性:负电
→电量: = 1.602 × 10-19 C,与氢离子
组成
阴极射线
电子 带电量相同
成分
→质量:e = 9.1 × 10-31 kg
四、α粒子散射实验
1.α粒子
α粒子是从放射性物质中发射出来的快速运动的粒子,含有两个
单位的正电荷,质量为氢原子质量的4倍。
2.实验方法
用α粒子源发射的α粒子束轰击金箔,用带有荧光屏的放大镜,在
水平面内不同方向对散射的α粒子进行观察,根据散射到各方向的α
粒子所占的比例,可以推知原子中正、负电荷的分布情况。
很小,但几乎占有全部质量,电子在正电体的外面运动。
2.原子核的电荷与尺度
原子结构
问题探究
1.1808年,英国化学家道尔顿根据化学实验的结果,发表了“原子
论”,说明物体是由原子组成的,同时他又断定:原子就像一个实心球,
是不能分割的,他的这种观点现在看来正确吗?
原子核式结构模型

12
一、对物质构成和微观构造旳认识过程
4、1923年,卢瑟福 粒子散射试验
试验成果分析: (1)绝大多数α粒子穿过金箔后,与原来 旳运动方向偏离不多(平均2º-3º)。 (2)少数α粒子发生了大角度旳偏转。 (3)极少数α粒子产生超出90º旳大角 度偏转,个别α粒子甚至被弹回。 讨论2:α粒子大角度偏转是不是撞到了
例2:试估算氢原子核旳密度(氢原子核半径为R=1.210-15m)。
例3:请根据卢瑟福旳原子核式构造思索 粒子在穿过原子核时旳轨
迹有何特点,并画出其轨迹示意图。
四、作业
练习册:P22-P23
4、1923年,卢瑟福 粒子散射试验
试验成果分析: (1)绝大多数α粒子穿过金箔后,与原来 旳运动方向偏离不多(平均2º-3º)。 (2)少数α粒子发生了大角度旳偏转。 (3)极少数α粒子产生超出90º旳大角 度偏转,个别α粒子甚至被弹回。
讨论1:按照汤姆逊旳葡萄干蛋糕原子模 型,会不会出现试验成果(2)和(3)?
培养12位诺奖得主旳“核子科学之父”
1923年,卢瑟福取得该年度旳诺贝尔化学奖 1923年,卢瑟福旳助手索迪获诺贝尔化学奖; 1923年,卢瑟福旳学生阿斯顿获诺贝尔化学奖; 1923年,卢瑟福旳学生玻尔获诺贝尔物理奖; 1927年,卢瑟福旳助手威尔逊获诺贝尔物理奖; 1935年,卢瑟福旳学生查德威克获诺贝尔物理奖 1948年,卢瑟福旳助手布莱克特获诺贝尔物理奖 1951年,卢瑟福旳学生科克拉夫特和瓦耳顿,共同取 得诺贝尔物理奖; 1978年,卢瑟福旳学生卡皮茨获诺贝尔物理奖。
14
一、对物质构成和微观构造旳认识过程
4、1923年,卢瑟福 粒子散射试验
1923年,卢瑟福旳原子核式构造模型(假说): (1)原子旳中心有一种很小旳核,叫做原子核 (2)原子旳全部正电荷和几乎全部质量都集中
原子核式结构模型

原子核式结构模型原子核式结构模型是一种描述原子内部结构的模型,它将原子的中心部分称为原子核,核外电子以云状分布在原子核周围。
该模型由英国的物理学家Rutherford于1911年提出,他通过一系列的金箔散射实验得出了这一结构模型。
在Rutherford的实验中,他使用了一个金箔和一个细小的放射性源,将放射性源发射出的α粒子射向金箔。
他观察到,射向金箔的大部分α粒子直接穿过金箔而没有发生任何偏转,但也有少数α粒子发生了较大角度的散射。
这个实验结果对于当时普遍认为原子是一个均匀分布的物质,或是由电子与正电荷均匀分布的"杏仁布丁模型"提出了挑战。
根据实验结果,Rutherford提出了原子核式结构模型:1.大部分的α粒子直接穿过金箔而没有发生偏转,说明原子内有一个非常小而且带有正电荷的核心,这个核心所占据的体积与整个原子相比非常小。
2.少数的α粒子发生了较大角度的散射,说明原子核带有正电荷,并且具有较高的密度。
3.原子核中带有正电荷,质量相对较大的粒子,这些粒子被称为质子。
4.原子核中可能还存在中性的、质量相对较大的粒子,这些粒子被称为中子。
这个假设后来得到了实验证实。
5.核外电子以一种云状的分布环绕在原子核周围,构成了原子的外部结构。
然而,原子核式结构模型仍然存在着一些问题和局限性。
例如,它无法解释电子如何在原子核附近运动,以及原子中质子和电子如何保持静止的平衡。
因此,在20世纪初,科学家们开始发展量子力学的理论来更加全面地描述原子内部结构。
总的来说,原子核式结构模型是一个革命性的模型,它的提出对原子结构的认识产生了重大影响。
虽然它的一个重要局限是无法解释质子和电子之间的平衡,但它为后来量子力学的发展奠定了基础,为我们更好地理解原子内部结构提供了关键性的启示。
原子的核式结构模型1

原子的核式结构模型1原子的核式结构模型1根据核式结构模型,原子的质子数和中子数决定了原子的化学性质,而电子的排布则决定了原子的物理性质。
质子的数量决定了原子的原子序数,而中子的数量则决定了原子的质量数。
在原子的电子排布中,波尔提出了一系列规则,即波尔规则。
根据这些规则,电子会按照能级递增的顺序填充在原子的不同轨道上。
每个轨道可以容纳一定数量的电子,且不同轨道的容纳能力不同。
电子填充轨道时,优先填充能级较低的轨道。
波尔模型还提出了著名的玻尔半径,即电子距离原子核的平均距离。
根据波尔半径,可以推算出原子的尺寸大小。
然而,虽然波尔的核式结构模型在描述轻原子和简单分子时具有一定的成功,但随着科学的发展,它的局限性也逐渐显现出来。
随着原子核和电子结构的进一步研究,人们发现原子结构更加复杂,无法完全用波尔模型来描述。
首先,波尔模型无法解释原子核和电子之间的相互作用。
实际上,根据量子力学的理论,电子并不是轨道运动,而是在一定范围内存在特定的概率云。
这种概率云描述了电子在空间中的可能位置,但无法确定其确切轨道。
其次,波尔模型无法解释原子核内部的复杂结构。
现在我们知道原子核由质子和中子组成,这些粒子之间相互作用的力也更加复杂。
传统的核式结构模型无法提供关于原子核内部结构的详细信息。
此外,波尔模型也无法解释光谱线的细微结构。
根据实验观测,原子的光谱线具有复杂的细微结构。
波尔模型只能解释一些特定的能级跃迁过程,而无法解释其他更加复杂的现象。
然而,尽管波尔模型有其局限性,它对于理解原子结构的发展仍然具有重要意义。
波尔模型在其提出的时代是一项重大的突破,为后续的研究提供了基础。
尽管现代的量子力学理论更能完整地描述原子结构,但波尔模型仍然是教学中的基本概念之一,有助于学生理解原子结构的基本原理。
原子的核式结构模型

描述微观粒子运动的基本方程, 用于求解原子中电子的波函数和
能量。
原子轨道
由量子力学计算得出的电子在原子 中的概率分布区域,决定了元素的 化学性质。
自旋和磁矩
电子自旋和轨道运动产生的磁矩是 原子磁性的来源。
多电子原子中电子排布规律研究进展
泡利原理
确定每个电子状态的独特性,保证电子排布的稳 定性。
原子中心有一个带正电的原子核,电子绕核旋转。该模型预测了α粒子散射实 验的结果,即大多数α粒子穿过原子时不受影响,少数α粒子受到大角度偏转, 极少数α粒子被反弹回来。
实验结果与预测一致
α粒子散射实验结果与卢瑟福的核式结构模型预测相符,从而验证了该模型的正 确性。同时,其他相关实验结果也支持了核式结构模型的理论预测。
局限性
玻尔理论虽然成功地解释了氢原子光谱和类氢离子光谱,但对于复杂原子(多电 子原子)的光谱现象却无法解释。此外,玻尔理论也无法解释原子的化学性质和 化学键的形成。
03
原子核式结构模型具体内容
原子核组成与性质
原子核位于原子的中心,由质子和中 子组成。
原子核的半径约为原子半径的万分之 一,但质量却占原子总质量的99.9% 以上。
04
电子云密度越大,表明 电子在该区域出现的概 率越高。
能量层级
原子中的电子按照能量高低分 布在不同的能级上,每个能级 对应一定的电子云形状和取向
。
当电子从一个能级跃迁到另一 个能级时,会吸收或释放能量 ,表现为光的吸收或发射。
电子跃迁遵循一定的选择定则 ,如偶极跃迁选择定则、自旋
原子核的发现
卢瑟福根据α粒子散射实验现象提出了原子核式结构模型。在 原子的中心有一个很小的核,叫原子核,原子的全部正电荷 和几乎全部质量都集中在原子核里,带负电的电子在核外空 间里绕着核旋转。
原子的核式结构模型(高中物理教学课件)完整版
二.原子的核式结构模型
1.枣糕模型:J.J.汤姆孙本人于1898 年提出了一种 模型。他认为,原子是一个球体,正电荷弥漫性 地均匀分布在整个球体内,电子镶嵌其中。有人 形象地把他的这个模型称为“西瓜模型”或“枣 糕模型”。
中发射出来的快速运动的粒子,质量为氢原子质量的4倍、 电子质量的7300倍。统计散射到各个方向的α粒子所占的 比例,可以推知原子中电荷的分布情况。除了金箔,当 时的实验还用了其他重金属箔,例如铂箔。现在我们知 道α粒子就是氦原子核。
二.原子的核式结构模型
3.实验现象: ①绝大多数α粒子穿过金箔后基本上仍沿原来的 方向前进 ②少数粒子(约占1/8000)发生了大角度偏转 ③极少数偏转的角度甚至大于90度,甚至反弹
mv
B
qB
联立求得比荷:q m
E B2R
一.电子的发现
4.电子的发现:1897年,J.J.汤姆孙发现电子
1897年,J.J.汤姆孙根据阴极射线在电场和磁场中的偏转情况断 定,它的本质是带负电的粒子流,并求出了这种粒子的比荷。
他进一步发现,用不同材料的阴极做实验,所得比荷的数值都 是相同的。这说明不同物质都能发射这种带电粒子,它是构成各 种物质的共有成分。
03.原子的核式结构模型
这种从阴极发射出来的射线称为 阴极射线。
对这种射线本质的认识有两种观 点:一种观点认为,它是一种电 磁辐射;另一种观点认为,它是 带电微粒。
一.电子的发现
1.电子的发现:英国物理学家J. J. 汤姆孙认为阴 极射线是带电粒子流。为了证实这一点,从1890 年起他和他的助手进行了一系列实验研究。于 1897年,发现电子。
原子的核式结构模型(24张ppt)

汤姆生的原子模型
十九世纪末,汤姆生发现了电子,并知道电 子是原子的组成部分.由于电子是带负电的, 而原子又是中性的,因此推断出原子中还有带 正电的物质.那么这两种物质是怎样构成原子 的呢?
了汤 枣姆 糕生 模提 型出
汤姆生
汤姆生的原子模型
在汤姆生的原子 模型中,原子是一个 球体;正电核均匀分 布在整个球内,而电 子都象枣核那样镶嵌 在原子里面.
质子
中子 质子数
核子
电荷数
四.原子核的电荷与尺度
原子核的电荷和大小 根据卢瑟福的原子核式模型和α粒子散射 的实验数据,可以推算出各种元素原子核 的电荷数,还可以估计出原子核的大小。 (1)原子的半径约为10-10m、原子核半径 约是10-15m,原子核的体积只占原子的体积 的万亿分之一。 (2)原子核所带正电荷数与核外电子数以 及该元素在周期表内的原子序数相等。 (3)电子绕核旋转所需向心力就是核对它 的库仑力。
2.2 原子的核式结构模型
1897年,汤姆孙对阴极 射线研究,发现了电子, 说明原子是可再分,原 子是中性,可推断出原 子中还有带正电的物 质.那么这两种物质是 怎样构成原子的呢?
汤姆孙
19世纪末到20世纪的三十年代,对于电子、光 谱的深入研究以及放射性现象、中子、质子的 发现,引起物理观念的重大变革,创立了新的 理论,导致人们对原子和原子核认识的升华.
第一条现象说明,原子中绝大部分是空的 第二、三现象可看出,α 粒子受到较大的库仑力作用 第四条现象可看出,α粒子在原子中碰到了比他质量大的多 的东西
粒子散射实验
对α 粒子的运动方向不会发生明显影响;由于正 电荷均匀分布,α 粒子所受库仑力也很小,故α 粒子偏转角度不会很大.
原子的核式结构
原子的核式结构模型 课件

二、α粒子散射实验
卢
瑟
福
著名的 粒子散射实验装置
真空 放射源
ห้องสมุดไป่ตู้金箔
可转动的带 有荧光屏的 放大镜
二、α粒子散射实验
著名的 粒子散射实验装置
真空 放射源
金箔
可转动的带 有荧光屏的 放大镜
作用:
统计散射到各个方向的α粒子所占的比例, 可以推知原子中正负电荷的分布情况
二、α粒子散射实验
思考和讨论:
根据汤姆孙原子模型,α 粒 子可能的前进方向?
根据卢瑟福的原子结构模型,原子内 部是十分“空旷”的,举一个简单的例子:
10-10m 原子
体育场
原子核 10-15m
卢瑟福本人是一位伟大的物理学家,这是无需置疑的。但他同时 更是一位伟大的物理导师。
尼尔斯·玻尔:1922年诺贝尔物理奖得主,量子论的奠基人和象 征。在曼彻斯特跟随过卢瑟福。
保罗·狄拉克:量子论的创始人之一,1933年诺贝尔物理奖得主。 狄拉克获奖的时候才31岁,他对卢瑟福说他不想领这个奖,因为 他讨厌在公众中的名声。卢瑟福劝道,如果不领奖的话,那么这 个名声可就更响了。
汤姆生的原子模型
枣糕模型
汤姆生的原子模型: 原子是一个球体;正 电荷弥漫性地均匀分 布在整个球内,而电 子都象枣子那样镶嵌 在原子里面.
正电荷
这个模型不
久就被实验事
电子
实否定了
一、勒纳德电子束实验:
使电子束射到金属膜上
现象: 较高速度的电子束很容易穿透原子
推断: 原子不是一个实心球体
矛盾: 与汤姆孙的原子模型(实心)不符
原子中带正电部分的体积很小,但几 乎占有全部的质量——原子核,电子 在原子核的外面运动。
