人教版高中化学选修四31弱电解质电离教学课件(共44张)
合集下载
高中化学 人教版选修4 课件:第三章 第一节 第2课时 弱电解质的电离(36张PPT)

栏 目 链 接
五、设计实验验证时注意等物质的量浓度和等pH的两种 酸的性质差异。
实验设计思路:以证明某酸(HA) 是弱酸为例
栏 目 链 接
尝试
应用 2.常温下,下列有关酸HA的叙述中,不能说明HA是弱 酸的是( ) ②测0.01 mol/L
栏 目 链 接
①取0.1 mol/L HA溶液,其溶液pH为2 NaA溶液,其溶液pH大于7 泡发光很暗 HA酸加水量多
第三章
水溶液中的离子平衡第一节
第一节 弱电解质的电离
第2课时 弱电解质的电离
栏 目 链 接
1.掌握弱电解质的电离平衡。
2.了解影响电离平衡的因素。
3.了解电离常数的意义。
栏 目 链 接
栏 目 链 接
要点一
1.概念
弱电解质的电离平衡
在一定条件(如温度、浓度一定)下,弱电解质在溶液中 电离成离子 __________的速率和 离子结合成分子 __________ 的速率相等,电离过程 就达到了平衡状态。 2.电离平衡的建立过程(用vt图象描述)
栏 目 链 接
多元弱酸各步电离常数大小的比较为K1≫K2≫K3,因此
多元弱酸的酸性主要由第一步电离所决定 (八字诀:分步进 行,一步定性)。
栏 目 链 接
四、一元强酸与一元弱酸的比较
♨ 特别提示:判断一种酸是强酸还是弱酸时,实质是 看它在水溶液中的电离程度,完全电离即为强酸,不完全电 离即为弱酸。
mol/L的NaA溶液,其溶液的pH大于7,说明NaA是强碱弱
酸盐,所以能说明HA是弱酸,故不选;③用HA溶液做导电 性实验,灯泡发光很暗,只能说明溶液中氢离子浓度较小,
栏 目 不能说明该酸的电离程度,所以不能说明该酸是弱酸,故选; 链 ④等体积pH=4的盐酸和HA稀释到pH=5,HA加水量多, 接
五、设计实验验证时注意等物质的量浓度和等pH的两种 酸的性质差异。
实验设计思路:以证明某酸(HA) 是弱酸为例
栏 目 链 接
尝试
应用 2.常温下,下列有关酸HA的叙述中,不能说明HA是弱 酸的是( ) ②测0.01 mol/L
栏 目 链 接
①取0.1 mol/L HA溶液,其溶液pH为2 NaA溶液,其溶液pH大于7 泡发光很暗 HA酸加水量多
第三章
水溶液中的离子平衡第一节
第一节 弱电解质的电离
第2课时 弱电解质的电离
栏 目 链 接
1.掌握弱电解质的电离平衡。
2.了解影响电离平衡的因素。
3.了解电离常数的意义。
栏 目 链 接
栏 目 链 接
要点一
1.概念
弱电解质的电离平衡
在一定条件(如温度、浓度一定)下,弱电解质在溶液中 电离成离子 __________的速率和 离子结合成分子 __________ 的速率相等,电离过程 就达到了平衡状态。 2.电离平衡的建立过程(用vt图象描述)
栏 目 链 接
多元弱酸各步电离常数大小的比较为K1≫K2≫K3,因此
多元弱酸的酸性主要由第一步电离所决定 (八字诀:分步进 行,一步定性)。
栏 目 链 接
四、一元强酸与一元弱酸的比较
♨ 特别提示:判断一种酸是强酸还是弱酸时,实质是 看它在水溶液中的电离程度,完全电离即为强酸,不完全电 离即为弱酸。
mol/L的NaA溶液,其溶液的pH大于7,说明NaA是强碱弱
酸盐,所以能说明HA是弱酸,故不选;③用HA溶液做导电 性实验,灯泡发光很暗,只能说明溶液中氢离子浓度较小,
栏 目 不能说明该酸的电离程度,所以不能说明该酸是弱酸,故选; 链 ④等体积pH=4的盐酸和HA稀释到pH=5,HA加水量多, 接
人教版化学选修四3.1 弱电解质的电离 课件 (共32张)

Ⅳ、多元弱酸是分步电离的,一级电离常数程度最大,一 般有K1 >> K2 >> K3。
2021/10/10
30
(3)、电离常数的意义:判断弱酸、弱碱的相对强弱。 典型例题:
2021/10/10
31
电离平衡的移动:
实例(稀溶液) CH3COOH CH3COO- +H+ ;△>0
改变条件
平衡移 动方向
n(H+) c(H+) c(CH3COO-)
c(CH3COOH)
电离度 (α)
导电 能力
Ka
加水稀释
向右 增大 减小 减小
减小
增大 减弱 不变
加入少量冰醋酸 向右 增大 增大
增大
增大
减小 增强 不变
加HCl(g)
向左 增大 增大
减小
增大
减小 增强 不变
加NaOH(s)
加入
( CH3COONa)
加入镁粉
(2)、表达式:
C
C
C
C
C
2021/10/10
C
29
Ⅰ、弱电解质的电离常数表达式中的c(A 十)、 c(B-) 和 c(AB) 均为达到电离平衡后各粒子在溶液中的浓度值。
Ⅱ、当温度一定时,其电离常数是定值。
Ⅲ、电离常数的大小反映强弱电解质的电离程度。K值越 大,弱电解质越易电离,其对应的弱酸(弱碱)越强。
(2)外因:溶液的浓度、温度等。
① 温度:由于弱电解质的电离是吸热的,因此升高温度,电离平 衡将向电离方向移动,弱电解质的电离程度将增大。
②浓度:增大电解质分子的浓度或减少相应离子的浓度,都会使弱 电解质分子向电离为离子的方向移动。加水稀释弱电解质 溶液,电离平衡向右移动,电离程度增大。
人教版化学选修4第三章第一节---弱电解质的电离精选课件

D 达到电离平衡状态的是
()
A.醋酸的浓度达到1 mol·L-1
B.H+的浓度达到0.5 mol·L-1
C.醋酸分子的浓度、醋酸根离子的浓度、
H+的浓度均为0.5 mol·L-1
D.醋酸分子电离成离子的速率和离子重新 结合成醋酸分子的速率相等
• 2.在醋酸溶液中,CH3COOH的电离达
到平衡的标志是
度增大
越稀越电离
同离子效应:加入和弱电解质具有相同离子的强电解质,
使弱电解质电离程度减小。
离子反应: 在弱电解质溶液中加入能与弱电解质电离产生的某种离子 反应的物质时,可以使电离平衡向电离方向移动
达标检测 HA
H++A— △H > 0
移动方向 c(H+)
c(A— )
升高温度
降低温度
加入HA 加入H2O 加NaOH
思考与讨论:
(1)开始时,V电离 和 V结合怎样变化? (2)当V电离 = V结合时,可逆过程达到一种 什么样的状态。
(3)关于上述电离平衡,什么条件的改变 会使平衡向电离的方向移动?
v
1、弱电解质的电离平衡 弱电解质的电
离平衡模型
v(电离成离子)
电离平衡状态
v(结合成分子)
t
在一定条件下,当弱电解质分子电离成离子的 速率和离子重新结合生成分子的速率相等时, 电离过程就达到了平衡状态,叫电离平衡。
实例探究:影响电离平衡因素?
在醋酸溶液中,存在如下电离平衡:
CH3COOH
H+ + CH3COO—
加入固体NaOH,电离平衡向___正___反应方向
移动,c(H+)_____减__小_____
加入固体CH3COONa,电离平衡向___逆___反 应方向移动,c(H+)___减__小_______
高中化学选修4人教版3.1弱电解质电离(新课标3)课件优质课件PPT

HC2- < H2C- < HA < HB- < H3C < H2B 对应的酸 (1) H2B (2) C3- HB-(3)B C (4)H3C+3OH- =C3- +3H2O
2HA(过量)+C3- = H2C- + 2A-
我们很容易遭遇逆境,也很容易被一次次的失败打垮。但是人生不容许我们停留在失败的瞬间,如果不前进,不会自我激励的话,就注定只能被这个世界抛弃。自我激 组成部分,主要表现在对于在压力或者困境中,个体自我安慰、自我积极暗示、自我调节的能力,在个体克服困难、顶住压力、勇对挑战等情况下,都发挥着关键性的 有弹性,经常表现出反败为胜、后来居上、东山再起的倾向,而缺乏这种能力的人,在逆境中的表现就大打折扣,表现为过分依赖外界的鼓励和支持。一个小男孩在自 ,对自己大喊:“我是世界上最棒的棒球手!”然后扔出棒球,挥动……但是没有击中。接着,他又对自己喊:“我是世界上最棒的棒球手!”扔出棒球,挥动依旧没 棒和球,然后用更大的力气对自己喊:“我是世界上最棒的棒球手!”可是接下来的结果,并未如愿。男孩子似乎有些气馁,可是转念一想:我抛球这么刁,一定是个 己喊:“我是世界上最棒的挥球手!”其实,大多数情况下,很多人做不到这看似荒谬的自我鼓励,可是,这故事却深深反映了这个男孩子自我鼓励下的执著,而这执
HPO42-
H+ + PO43-
K3
c(H)c(PO43) c(HP42O )
多元弱酸各步电离常数大小比较:K1>>K2>>K3, 因此多元弱酸的酸性主要由第一步电离决定的
(记住:分步进行,一步定性)。 3、电离常数的影响因素 (1)电离常数只受温度影响,由于电离是吸热 的,因此升高温度,电离常数 增大 。
2HA(过量)+C3- = H2C- + 2A-
我们很容易遭遇逆境,也很容易被一次次的失败打垮。但是人生不容许我们停留在失败的瞬间,如果不前进,不会自我激励的话,就注定只能被这个世界抛弃。自我激 组成部分,主要表现在对于在压力或者困境中,个体自我安慰、自我积极暗示、自我调节的能力,在个体克服困难、顶住压力、勇对挑战等情况下,都发挥着关键性的 有弹性,经常表现出反败为胜、后来居上、东山再起的倾向,而缺乏这种能力的人,在逆境中的表现就大打折扣,表现为过分依赖外界的鼓励和支持。一个小男孩在自 ,对自己大喊:“我是世界上最棒的棒球手!”然后扔出棒球,挥动……但是没有击中。接着,他又对自己喊:“我是世界上最棒的棒球手!”扔出棒球,挥动依旧没 棒和球,然后用更大的力气对自己喊:“我是世界上最棒的棒球手!”可是接下来的结果,并未如愿。男孩子似乎有些气馁,可是转念一想:我抛球这么刁,一定是个 己喊:“我是世界上最棒的挥球手!”其实,大多数情况下,很多人做不到这看似荒谬的自我鼓励,可是,这故事却深深反映了这个男孩子自我鼓励下的执著,而这执
HPO42-
H+ + PO43-
K3
c(H)c(PO43) c(HP42O )
多元弱酸各步电离常数大小比较:K1>>K2>>K3, 因此多元弱酸的酸性主要由第一步电离决定的
(记住:分步进行,一步定性)。 3、电离常数的影响因素 (1)电离常数只受温度影响,由于电离是吸热 的,因此升高温度,电离常数 增大 。
人教版高中化学选修四3.1-1弱电解质的电离(共33张PPT)
③吸热过程
2、弱电解质的电离平衡的建立 V
电离速率
V(电离)=V(结合)
在一定条件下,当弱电解质分 子电离成离子的速率和离子重 新结合成分子的速率相等时, 分子离子浓度都不再变化,电 离过程就达到了平衡。
分子化速率
t1
t
3.电离平衡定义:
电离平衡状态是指在一定条件下(如温度、浓度等)的弱电解质的 溶液中,弱电解质分子等动电离成离子的速率和离子重新结合成 分子的速等,溶液中各分子、离子的定浓度保持不变的状态。
弱电解质电离特点 ①部分(极少数)电离
H+ + A B+ + OH② 可逆 存在电离平衡 ③吸热过程
2)、结合图3-3填写下表
0 不变
0
不变
最大 不变
最大
最大
0
V
电离速率达到电离平Fra bibliotek时V(电离)=V(结合)
结合速率
t
t
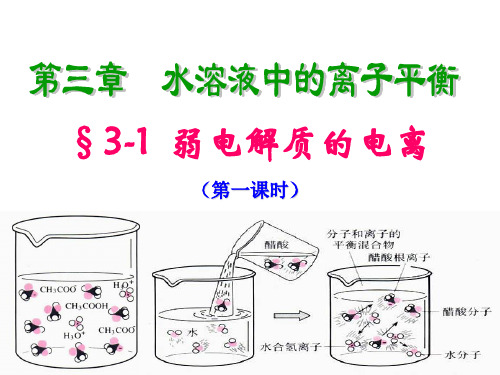
三、弱电解质的电离 1、弱电解质在水溶液中电离的特点 CH3COOH CH3COO- + H+ 弱电解质电离特点 ①部分(极少数)电离 ② 可逆 存在电离平衡
讨论完成表格:CH COOH 3
CH3COO- + H+ △H>0
改变条件
弱电解 质电离 吸热 效应
平衡移 C(H+) C(Ac---) 动方向
C(HAc 电离 ) 常数
加热
正向 左向 右向 左向 右向 右向
增大 增大 减小
增大 减小 增大 增大
减小 增大 减小 增大 增大 减小
增大 不变 不变 不变 不变 不变
弱电解质CH3COOH在水中 部分电离,既有溶质离子。 也有溶质分子存在
高中化学 人教版选修4 课件:第三章 第一节 第1课时 强弱电解质(36张PPT)

栏 目 链 接
5.强、弱电解质在熔融态的导电性: 离子型的强电解质由离子构成,在熔融态时产生自由移 动的离子,可以导电;而共价型的强电解质以及弱电解质 由分子构成,熔融态时仍以分子形式存在,所以不导电。
栏 目 链 接
尝试
应用
1 .下列物质的水溶液能导电,但属于非电解质的是
( ) A.CH3COOH C.NH4HCO3 B.Cl2 D.SO2
栏 目 链 接
尝试
应用 解析:选项中的四种物质的水溶液都能导电,但原因有 所不同。CH3COOH和NH4HCO3均为电解质,水溶液理应 能导电;Cl2和SO2水溶液能导电,是因为它们与水反应的生
成物均为电解质,故溶液也导电(Cl2+H2O
SO2+H2O 为非电解质。 答案:D
HCl+HClO,
H2SO3)。电解质和非电解质都属于化合物,
栏 目 链 接
♨ 特别提示: 1. 强、弱电解质的范围: , 强电解质:强 酸、强碱、绝大多数盐,弱电解质:弱酸、弱碱、水。 2. 强、弱电解质与溶解性的关系: , 电解质的强弱取决 于电解质在水溶液中是否完全电离,与溶解度的大小无关。 一些难溶的电解质,但溶解的部分能全部电离,则仍属强电 解质;如:BaSO4、BaCO3等。
栏 目 链 接
Cl2是单质,它既不是电解质又不是非电解质,因此只有SO2
要点二
强弱电解质电离方程式的书写
电离:电解质在水溶液或熔融状态下离解成自由移动离 子的过程。电离不需要通电,且一般为吸热的。电离方程式 的书写如下: 1.强电解质 完全 电离,符号用“________” ,如 HCl_________________________________________________ === H++Cl- _______________________; CH3COONH4____________________________________ ===CH3COO-+NH ____________________________________; Ba(OH)2_________________________________________ ===Ba2++2OH- _______________________________。
5.强、弱电解质在熔融态的导电性: 离子型的强电解质由离子构成,在熔融态时产生自由移 动的离子,可以导电;而共价型的强电解质以及弱电解质 由分子构成,熔融态时仍以分子形式存在,所以不导电。
栏 目 链 接
尝试
应用
1 .下列物质的水溶液能导电,但属于非电解质的是
( ) A.CH3COOH C.NH4HCO3 B.Cl2 D.SO2
栏 目 链 接
尝试
应用 解析:选项中的四种物质的水溶液都能导电,但原因有 所不同。CH3COOH和NH4HCO3均为电解质,水溶液理应 能导电;Cl2和SO2水溶液能导电,是因为它们与水反应的生
成物均为电解质,故溶液也导电(Cl2+H2O
SO2+H2O 为非电解质。 答案:D
HCl+HClO,
H2SO3)。电解质和非电解质都属于化合物,
栏 目 链 接
♨ 特别提示: 1. 强、弱电解质的范围: , 强电解质:强 酸、强碱、绝大多数盐,弱电解质:弱酸、弱碱、水。 2. 强、弱电解质与溶解性的关系: , 电解质的强弱取决 于电解质在水溶液中是否完全电离,与溶解度的大小无关。 一些难溶的电解质,但溶解的部分能全部电离,则仍属强电 解质;如:BaSO4、BaCO3等。
栏 目 链 接
Cl2是单质,它既不是电解质又不是非电解质,因此只有SO2
要点二
强弱电解质电离方程式的书写
电离:电解质在水溶液或熔融状态下离解成自由移动离 子的过程。电离不需要通电,且一般为吸热的。电离方程式 的书写如下: 1.强电解质 完全 电离,符号用“________” ,如 HCl_________________________________________________ === H++Cl- _______________________; CH3COONH4____________________________________ ===CH3COO-+NH ____________________________________; Ba(OH)2_________________________________________ ===Ba2++2OH- _______________________________。
高中化学人教版选修四 3-1 弱电解质的电离 课件(48张)

强碱: KOH、NaOH 、Ba(OH)2、Ca(OH)2 大多数盐类:NaCl、NaSO4、NaNO3、BaSO4、AgCl、CaCO3 活泼金属氧化物: K2O、Na2O 、CaO
二、强电解质、弱电解质
2、弱电解质 (1)定义:在水溶液里和熔融状态下 只有部分分子电离成离子的电解质。 (2)种类:
【想一想】
酸、碱、盐都是电解质,
在水中都能电离出离子。
不同电解质的电离程度是否有区别?
你能举出生活中的例子证实你的想法吗?
实验探究1: 等体积、等浓度的盐酸、醋酸
溶液与等量的镁条反应
请注意观察、记录实验现象。
实验现象记录:
与镁条反应的现象
1 mol/L CH3COOH 1 mol/L HCl 对实验现象 的解释
H++HPO42- (难)
HPO42-
H++PO43-
(更难)
第一步: H2S 第二步: HS-
H++HS- H++S2-
②多元弱碱电离: 分步电离,按一步电离书写
Fe(OH)3 Fe(OH)2
Cu(OH)2
Fe3++3OHFe3++2OHCu2++2OH-
(3)酸式盐的电离
NaHSO4 Na H SO4
Na2SO4 = 2Na++ SO42-
(2)弱电解质:部分电离,用 “ ” -
CH3COOH
HClO
CH3COO +H+
H++ClO-
NH3· H2O
H2O
NH4++OH-
H++OH-
① 多元弱酸电离: 分步电离,以第一步电离为主,一级比一级难电离。
高中化学3.1.2弱电解质的电离课件新人教选修4.ppt

5.几个注意的问题: ⑴稀释弱电解质溶液(温度不变),电离程度电离方向,平衡向增大或减小移动, 自由离子数目 增大 ;离子浓度 增多 ,溶液导电能力增强或减弱 。电离平 衡常数 不变(填变或不变)
A、对于冰醋酸和磷酸:加水溶解并不断稀释的过程中,电离程度电离方向平衡向 移动自由离子浓度先 大后 小;
• a、盐酸 b、硫酸 c、醋酸,同时加入足 量的锌,则开始反应时速率_a_=_b_=_c_,反应完全 后生成H2的质量_a=__b_<_c____。(用<、=、> 表示)
①加碱②加碳酸钠③加镁或锌
2、有两瓶pH=2的酸溶液,一瓶是强酸,一瓶 是弱酸.现只有石蕊试液、酚酞试液、pH试纸 和蒸馏水,而没有其它试剂.简述如何用最简 便的实验方法来判别哪瓶是强酸:
各取等体积酸液,用蒸馏水稀释相同倍数,然 后用PH试纸分别测其PH值,PH值变化大的那瓶 是强酸.
• 3.有H+浓度相同、体积相等的三种酸:
H3PO4 ⇌ H++H2PO4-
H2PO4 ⇌ H++HPO42HPO4 ⇌ H++PO43-
电离平衡常数K K=1.76×10-5
K1=4.31×10-7
K2=5.61×10-11 K1=9.1×10-8 K2=1.1×10-12 K1=7.5×10-3
K2=6.23×10-8 K3=2.2×10-13
B、稀醋酸和稀磷酸的稀释:电离程度增大,而离子浓度始终是减小的。
⑴“0”点导电能力为0的理由是:
存在醋酸分子,无离子。 ⑵a、b、c三点对应溶液的[H+]值由大到小的顺序是
a﹥c﹥ b
冰醋酸中只
⑶a、b、c三点中电离程度最大的是相等值均增大,可采取的措 施有:
人教版高中化学选修4第三章第一节弱电解质的电离市公开课教学课件共36张PPT[可修改版ppt]
![人教版高中化学选修4第三章第一节弱电解质的电离市公开课教学课件共36张PPT[可修改版ppt]](https://img.taocdn.com/s3/m/2354ca9faef8941ea76e05bd.png)
如:弱酸 HF、H2SO3、HClO、CH3COOH等
弱碱 NH3·H2O Fe(OH)3等
H2O
思考与交流
难溶:BaSO4 Fe(OH)3
强电解质 弱电解质
易溶:HCl CH3COOH
电解质的强弱与其溶解性有何关系? 无关
怎样区分强弱电解质?
溶于水的部分是否完全电离
实验再探
实验3-1:体积相同,浓度相同的盐酸和醋酸 分别与等量镁条反应,并测量溶液的pH值
(2)二元及多元弱酸的电离分步完成,并以第
一步电离为主。
H2CO3
H+ + HCO3-
HCO3-
2.过程与方法: 从化学平衡移动的角度理解电离平衡和移动的结果,
体会重要的学习方法(类比迁移)。 3.情感、态度价值观:
通过本节课的学习,意识到整个自然界实际就是各类物 种相互依存、各种变化相互制约的复杂的平衡体系
知识回顾
①NaCl溶液 ②NaOH
③蔗糖
④Cu
⑤CH3COOH ⑥乙醇
电解质:在水溶液中或熔融状态下能导电的化合物
②⑤
(如:酸、碱、盐、水)
非电解质:在水溶液和熔融状态下都不导电的化合物
③⑥
(如:多数有机物、某些非金属氧化物)
混合物
物质
纯净物
既不是电解质也 不是非电解质
单质
化合物 非电解质 电解质
实验探究
实验3-1:体积相同,浓度相同的盐酸和醋酸分别 与等量镁条反应,并测量溶液的pH值比较其大小
注意 :1.测过的pH试纸要留存在点滴板上
2.观察反应快慢,尤其反应一段时间后速率的变化
项目
与足量镁条反应速率比较 比较溶液的pH大小
1mol/L 1mol/L HCl CH3COOH
弱碱 NH3·H2O Fe(OH)3等
H2O
思考与交流
难溶:BaSO4 Fe(OH)3
强电解质 弱电解质
易溶:HCl CH3COOH
电解质的强弱与其溶解性有何关系? 无关
怎样区分强弱电解质?
溶于水的部分是否完全电离
实验再探
实验3-1:体积相同,浓度相同的盐酸和醋酸 分别与等量镁条反应,并测量溶液的pH值
(2)二元及多元弱酸的电离分步完成,并以第
一步电离为主。
H2CO3
H+ + HCO3-
HCO3-
2.过程与方法: 从化学平衡移动的角度理解电离平衡和移动的结果,
体会重要的学习方法(类比迁移)。 3.情感、态度价值观:
通过本节课的学习,意识到整个自然界实际就是各类物 种相互依存、各种变化相互制约的复杂的平衡体系
知识回顾
①NaCl溶液 ②NaOH
③蔗糖
④Cu
⑤CH3COOH ⑥乙醇
电解质:在水溶液中或熔融状态下能导电的化合物
②⑤
(如:酸、碱、盐、水)
非电解质:在水溶液和熔融状态下都不导电的化合物
③⑥
(如:多数有机物、某些非金属氧化物)
混合物
物质
纯净物
既不是电解质也 不是非电解质
单质
化合物 非电解质 电解质
实验探究
实验3-1:体积相同,浓度相同的盐酸和醋酸分别 与等量镁条反应,并测量溶液的pH值比较其大小
注意 :1.测过的pH试纸要留存在点滴板上
2.观察反应快慢,尤其反应一段时间后速率的变化
项目
与足量镁条反应速率比较 比较溶液的pH大小
1mol/L 1mol/L HCl CH3COOH
人教版化学选修四弱电解质的电离

人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
弱电解质的电离平衡
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
H++A-,平衡时
c ( H+) .c( A-)
Ka=
c(HA)
对于一元弱碱:MOH
M++OH-,平衡时
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
c ( M+).c( OH- )
Kb=
c(MOH)
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
减少 增大 增大 减少
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
二、弱电解质电离程度的表示:
1、电离平衡常数K:
(1)、K表达式: 对于一元弱酸:HA
( BC )
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
【练习】利用右图装做下面的实验:在烧杯里盛半杯乙溶
液,然后用滴定管向容器里滴入甲溶液。随着甲的滴入,
弱电解质的电离平衡
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
H++A-,平衡时
c ( H+) .c( A-)
Ka=
c(HA)
对于一元弱碱:MOH
M++OH-,平衡时
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
c ( M+).c( OH- )
Kb=
c(MOH)
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
减少 增大 增大 减少
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
二、弱电解质电离程度的表示:
1、电离平衡常数K:
(1)、K表达式: 对于一元弱酸:HA
( BC )
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
【练习】利用右图装做下面的实验:在烧杯里盛半杯乙溶
液,然后用滴定管向容器里滴入甲溶液。随着甲的滴入,
弱电解质的电离课件人教版高中化学选修4

实验探究
[实验3-2] 课本P42 你能否推测CH3COOH、H3BO3、H2CO3三种弱酸的 相对强弱,及其与电离常数大小的关系?
实验结论: 酸性强弱:CH3COOH﹥H2CO3﹥H3BO3 电离常数:醋酸>碳酸>硼酸
➢试根据课本P43表3-1中“一些弱酸和弱碱的电离平衡
常数”比较它们的相对强弱。 •K 值 越 大 , 电 离 程 度 越
减?小
增大 增大 增大
减?小
减小 增大 增大 减小
练习:金版P40 例1、即时演练、P41 课堂3、
影响电离平衡的因素
内因
电解质的性质 通常电解质越弱电离程度越小
已电离的弱电解质的浓度
已电离的弱电解质分子数
弱电解质的初始浓度 100% 弱电解质分子总数 100%
外因 ①温度:温度升高,平衡向(右)移动,电离程度( 增大 )
2.特征
逆:弱电解质的电离是可逆过程 等:V电离 = V结合≠0 动:电离平衡是一种动态平衡 定:条件不变,溶液中各分子、离子的浓
度不变 变: 条件改变时,电离平衡发生移动。
课本P41思考与交流:
根据化学平衡理论,分析一元弱酸(HA) 一元弱碱 (BOH)的电离平衡过程,并完成问题:
1.写出电离方程式 2.填表
对于一元弱酸 HA
c ( H+) .c( A-) K=
c(HA)
对于一元弱碱 BOH
H++AB++OH-
c ( B+).c( OH- ) K=
c(BOH)
电离平衡常数大小是由物质的本性决定的。
K值只随_温__度__变化。 K值越大,电离程度 __越__大__,相应酸 (或碱)的酸(或碱)性__越__强___ 。
《弱电解质的电离》人教版高二化学选修4PPT课件(第1课时)

试分析两溶液中各有哪些粒子?
盐酸
醋酸
1. 强弱电解质的概念
强电解质:在水溶液里全部电离成离子的电 解质。如:强酸、强碱和大多数盐类。
弱电解质:在水溶液里只有一部分分子电离 成离子的电解质。如 :弱酸、弱碱等。
1. 强弱电解质的概念
常见的强电解质:
强电解质、弱电解质与其溶解性无关。 如:某些难溶或微溶于水的盐,由于 其溶解度很小,但是其溶于水的部分, 却是完全电离的,所以它们仍然属于 强电解质,例如:CaCO3、BaSO4等。
二、弱电解质的电离平衡
V
V电离
V结合
0
V电离= V结合
电离平衡状态
t1
t2
弱电解质电离的V-t图像 t
二、弱电解质的电离平衡Fra bibliotek特点逆 弱电解质的电离是一个可逆过程 等 V电离= V结合= 0
动 电离平衡是一种动态平衡 定 条件不变,溶液中各分子、离子 的浓度不变,溶液 里既有离子又有分子
变 条件改变时,电离平衡发生移动
(2)HCl、H2SO4是由什么键构成的什么化合物? (3)在水溶液里电解质以什么形式存在?
离子化合物 (如强碱和大部分盐类)
某些具有极性键的共价化合物
}强电解质
电离方程式可表示为:
NaCl == Na+ + Cl-
试写出Na2SO4、NaOH、H2SO4、KHSO4、 Ba(OH)2在水溶液里的电离方程式.
注意:
1.单质/混合物 既不是电解质也不是非电解质。
2.CO2、NH3等溶于水得到的水溶液能导电,但它们不是电解质,因为导电 的物质不是其本身。 3.难溶的盐(BaSO4等)虽然水溶液不能导电,但是在融化时能导电,也是电 解质。
【人教版】化学选修四弱电解质的电离精品教学课件-PPT

注意:弱酸的电离为可逆反应需注意可逆符号! 强酸的电离是完全的,不需要写可逆符号!
探究作业
思考:哪些外界条件的改变可以使醋酸的电
离平衡: CH3COOH
CH3COO-+H+
发生移动?(尽可能多)
【人教版】化学选修四弱电解质的电 离精品 教学课 件-PPT 优秀课 件(实 用教材 )
醋酸溶液中存在电离平衡 CH3COOH
【人教版】化学选修四弱电解质的电 离精品 教学课 件-PPT 优秀课 件(实 用教材 )
小结:影响弱酸电离程度(电离度) 的因素
➢一种弱电解质电离程度大小,与酸的种类、 温度、浓度是否有关?有何关系?
【人教版】化学选修四弱电解质的电 离精品 教学课 件-PPT 优秀课 件(实 用教材 )
【人教版】化学选修四弱电解质的电 离精品 教学课 件-PPT 优秀课 件(实 用教材 )
浓
度ห้องสมุดไป่ตู้
C(HA)
C(H+)或C(A-) 时间
强电解质和弱电解质
强电解质:能够全部电离的电解质称为强 电解质,包括强酸、强碱和绝大部分盐; 弱电解质:部分电离的电解质称为弱电解 质,包括弱酸、弱碱、水。
请思考:弱电解质的水溶液中存在的微粒有哪 些?(以乙酸溶液)为例进行说明。
H2O、CH3COOH、H+、CH3COO-
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对 于同一种多元弱酸的K1、K2、K3之间存在着一定的规律,此规 律是________,产生此规律的原因是_________________。
【人教版】化学选修四弱电解质的电 离精品 教学课 件-PPT 优秀课 件(实 用教材 )
溶液导电性强吗?
探究作业
思考:哪些外界条件的改变可以使醋酸的电
离平衡: CH3COOH
CH3COO-+H+
发生移动?(尽可能多)
【人教版】化学选修四弱电解质的电 离精品 教学课 件-PPT 优秀课 件(实 用教材 )
醋酸溶液中存在电离平衡 CH3COOH
【人教版】化学选修四弱电解质的电 离精品 教学课 件-PPT 优秀课 件(实 用教材 )
小结:影响弱酸电离程度(电离度) 的因素
➢一种弱电解质电离程度大小,与酸的种类、 温度、浓度是否有关?有何关系?
【人教版】化学选修四弱电解质的电 离精品 教学课 件-PPT 优秀课 件(实 用教材 )
【人教版】化学选修四弱电解质的电 离精品 教学课 件-PPT 优秀课 件(实 用教材 )
浓
度ห้องสมุดไป่ตู้
C(HA)
C(H+)或C(A-) 时间
强电解质和弱电解质
强电解质:能够全部电离的电解质称为强 电解质,包括强酸、强碱和绝大部分盐; 弱电解质:部分电离的电解质称为弱电解 质,包括弱酸、弱碱、水。
请思考:弱电解质的水溶液中存在的微粒有哪 些?(以乙酸溶液)为例进行说明。
H2O、CH3COOH、H+、CH3COO-
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对 于同一种多元弱酸的K1、K2、K3之间存在着一定的规律,此规 律是________,产生此规律的原因是_________________。
【人教版】化学选修四弱电解质的电 离精品 教学课 件-PPT 优秀课 件(实 用教材 )
溶液导电性强吗?
3.1 弱电解质的电离 课件(人教版选修4)

并测定两种酸溶液的 pH。填写下表:
1 mol·L-1 HCl 1 mol·L-1 CH3COOH
实 与镁 现象 产生无色气泡且较快 产生无色气泡且较慢
验 反应 结论 Mg与盐酸反应速率大,表明盐酸中c(H+)较大
溶液 数值 操
不相同
的 作
结论
相同物质的量浓度的盐酸和醋酸中
pH
c(H+)不相同
视频导学
4.9×10-10,其中,氢离子的浓度最大的是____H__F____,未 电离的溶质分子浓度最大的是____H__C_N___。
基础自学落实·重点互动探究
题目解析
一定温度下,当溶液的浓度 一定时,c(H+)随电离常数 的增大而增大。题中K(HF) >K(CH3COOH)>K(HCN), 故氢离子浓度HF溶液最大, 余下的未电离的HF 分子最 少,而 HCN 溶液中未电离 的 HCN 分子浓度最大。
高中化学精品课件 • 选修 4
第一节 弱电解质的电离
本节知识目录
弱电解质 的电离
目标定位 知识回顾 学习探究 自我检测
探究点一 强电解质和弱电解质 探究点二 弱电解质的电离平衡 探究点三 电离平衡常数
学习目标定位 1.能准确判断强电解质和弱电解质。 2.会描述弱电解质的电离平衡,能正确书写弱电解质的电离方程式,会分析 电离平衡的移动。 3.知道电离平衡常数的意义。
C.加入少量 0.1 mol·L-1HCl 溶液,溶液中 c(H+)减小 加入NaOH,与H+反应,c(H+) D.加入少量 CH3COONa 固体,平衡向正反应方向移动 变小,平衡向正方向移动;
碳酸是分步电离的,第一步电离常数
表达式为
K1=c
H+·cHCO- 3 cH2CO3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020/12/18
11
讨论: 强弱电解质在水中的电离过程是否相同? 溶液中存在的微粒是否相同?以盐酸和 醋酸为例说明
2020/12/18
12
二、弱电解质的电离
醋酸的电离:
C3C HO → O C3 H C HO -+H O +
HC3 H CO - O C3 H COOH
电离方程式可表示为:
2020/12/18
2020/12/18
6
实验 1 分别试验等体积、等浓度的盐酸和醋酸溶液与等量镁条的反应;并测这两种酸的pH。
与镁条反应的现象 溶液的pH
2020/12/18
1mol/L HCl
1mol/L HAc
快
慢
小
大
7
镁条和酸的反应的实质是什么?
M 2 g H M 2 g H 2
HCl在水中电离示意图
HAc在水中电离示意图
第二步电离: K2=
HS- H++S2-
c (H+)·c(S2-) =c7(.1xH1S0-)-15
2020/12/18
21
H3PO4在水溶液中的电离方程式:
H 3P O 4 H ++H 2P O 4H 2P O 4 H ++H P O 42-
H P O 42- H ++P O 43-
特点:
①多元弱酸是分步电离的,K1》K2》K3。? ②多元弱酸的酸性由第一步电离决定。
电离常数
1.729x10
-5 1.753x10
-5 1.750x10
-5 1.703x10
-5
2020/12/18
18
实验 2 向两支分别盛有0.1mol/L醋酸和饱和硼酸溶液的试管中滴加等浓度Na2CO3溶液,观.1mol/L醋酸溶液 2020/12/18
饱和硼酸溶液 19
比较碳酸、醋酸、硼酸的酸性强弱,及其 与电离常数大小的关系?
2020/12/18
20
在上述实验中,碳酸是分子中含有两个H+的二元弱酸。分子中含有两个或两个以上H+的多 元弱酸的电离是分步进行的。
例如:二元弱酸H2S分两步电离:
第一步电离: K1 =
H2S H++HS-
c(H+)·c(HS-) c =(1H.322Sx)10 -7
强电解质——在水分子作用下,能完全电离为离子的化合物(如强酸、强碱和大多数盐)。 弱电解质——在水分子作用下,只有部分分子电离为离子的化合物(如弱酸、弱碱等)。
HCl是强电解质,HAc是弱电解质。
2020/12/18
10
下列电解质哪些是强电解质?哪些是弱电解质呢?
H2SO4 NaOH NaCl NH3·H2O HAc
新课导入
盐酸是一种强酸,具备酸的通性
2020/12/18
1
醋酸被公认为食醋的主要成分,是一种弱酸,酸性比碳酸强。
2020/12/18
2
如果上述两种酸用于卫生洁具的清洁或除水垢,常用盐酸还是醋酸?
2020/12/18
3
第三章第1节 弱电解质的电离 什么是电解质?什么是非电解质?
2020/12/18
C H 3 C O O HC H 3 C O O -+ H +
13
弱电解质电离过程中离子生成和结合成分子的速率随时间的变化
反
应
速
率
V(电离)
V(电离) = V(结合) 电离平衡状态
V(结合)
2020/12/18
时间 14
在一定条件下,当电解质分子离解成离子的速率和离子结合成分子的速率相等时, 电离过程就达到了平衡状态,这种状态叫做电离平衡状态。
16
影响电离平衡的主要因素
性质: 温度:
通常电解质越弱,电离程度越小。 电离过程是吸热过程,温度升高平衡向电离方向移动。
浓度:
浓度越大,电离程度越小。
2020/12/18
17
2.3电离常数 概念:与化学平衡类似,电离平衡的平衡常数,叫做电离常数。
醋酸在不同温度下的电离常数
温度/℃
10
20
30
40
电离平衡的特点:
2020/12/18
15
2.2影响电离平衡的因素
醋酸电离平衡时,哪些条件的改变会导致平衡移动?并指出会向哪个方向移动?
C H 3 C O O HC H 3 C O O -+ H +
①加入盐酸、 ②加入水、 ③加入NaAc溶液、 ④加入NaOH溶液 (5)加入金属锌粉
2020/12/18
2020/12/18
8
实验现象:
①HCl与镁条反应剧烈,氢离子浓度大。
②HAc与镁条反应较慢,其氢离子浓度较HCl小 。
HCl和 HAc的电离程度不同: HCl在稀水溶液中中全部电离生成H+和Cl-; HAc在水溶液中只有部分电离生成H+和Ac-。
2020/12/18
9
实验结论: 电解质在水中并不都是全部电离的,在电离程度上是有强、弱之分的。
的质量_________。(用<、=、> 表示)
a=b<c
a=b=c
2020/12/18
26
2.(多项)下列说法正确的是 (
子,且各分子、离子的浓度不变。
变 :条件改变时,电离平衡发生移动。
4.电离常数K值只随温度变化。
•多元弱酸是分步电离的,K1 》K2》K3。 •多元弱酸的酸性由第一步电离决定。
2020/12/18
25
课堂练习
1.有H+浓度相同、体积相等的三种酸: a.盐酸 b.硫酸 c.醋酸,同时加入足量的锌,则开始反应时速率 _______ ,反应完全后生成H2
4
一、电解质有强弱之分 电解质:溶于水溶液中或在熔融状态下就能够导电的化合物。 非电解质:在水溶液中和熔融状态时都不能导电的化合物。
2020/12/18
5
区别下列哪些是电解质,哪些非电解质?
① Fe 、② 盐酸③NaOH 、 ④ NH3·H2O 、 ⑤ BaSO4、 ⑥ CH3COOH 、 ⑦CO2、 ⑧乙醇、 ⑨水
23
1.离子化合物 2.共价化合物 2020/12/18
大部分的盐类 离子型氧化物
课堂小结
强电解 质
强碱
强酸
弱酸
弱
电
解
弱碱
质
水
多数有机物
电解质 非 电 解 质
某些非金属氧化物
化合 物
24
3.特点:
逆 : 弱电解质的电离是可逆的 等 : V电离=V结合≠0 动 :电离平衡是一种动态平衡 定 : 条件不变,溶液里既有离子又有分
2020/12/18
22
影响电离常数大小的因素
①通过同一温度下,不同弱电解质的电离常数不同,说明电离常数的大小首先由物质的本 性决定。
②弱电解质的电离常数受温度变化的影响。
③同一弱电解质在同一温度下发生浓度变化时, 其电离常数不变,说明弱电解质的电离常数大小不受 其浓度变化的影响。
2020/12/18
