抗肿瘤药物对细胞增殖及凋亡的影响
药物对细胞凋亡途径的影响

药物对细胞凋亡途径的影响细胞凋亡是生物体内细胞自我调节的一种重要机制,对于维持组织内正常的细胞生长和分化至关重要。
药物作为影响细胞功能的重要手段之一,也会对细胞凋亡途径产生一定的影响。
本文将探讨药物对细胞凋亡途径的影响机制,并举例说明不同药物在细胞凋亡途径中的作用。
一、药物的直接调控作用1. 药物的抗凋亡作用许多药物通过直接抑制细胞凋亡途径中的关键分子,发挥抗凋亡作用。
例如,某些肿瘤抑制剂针对细胞凋亡途径中的Bcl-2家族蛋白进行直接抑制,阻断凋亡信号的传导,从而促进细胞存活。
此外,一些免疫抑制剂也通过干扰细胞凋亡途径,抑制免疫细胞的凋亡,达到抗炎和免疫抑制的效果。
2. 药物的促进凋亡作用另一些药物则通过直接刺激细胞凋亡途径,促使细胞进入凋亡状态。
例如,化疗药物顺铂通过与DNA结合,引起DNA损伤和细胞周期阻滞,从而诱导细胞凋亡。
类似地,某些植物提取物中的有效成分也可直接影响细胞凋亡途径,对肿瘤细胞具有明显的促凋亡作用。
二、药物的间接调控作用1. 药物的抗氧化作用一些药物可以通过抑制氧化应激反应,减少细胞内活性氧自由基的生成,从而抑制细胞凋亡的发生。
例如,抗氧化剂维生素C和维生素E可通过清除活性氧自由基,保护细胞免受氧化损伤,减少细胞凋亡的发生。
2. 药物的激活凋亡信号通路有些药物虽然不能直接调节细胞凋亡途径中的关键分子,但可以通过激活特定的信号通路来间接影响细胞凋亡的发生。
例如,激动剂通过与细胞表面受体结合,触发下游信号的传导,进而导致细胞凋亡。
这类药物在肿瘤治疗中常被使用,通过抑制肿瘤细胞的生长和扩散。
三、不同药物的作用示例1. 阿司匹林对细胞凋亡途径的影响阿司匹林是一种非甾体类抗炎药,研究发现其能够通过抑制炎症反应,减少炎症细胞的凋亡,从而缓解炎症反应引起的组织损伤。
此外,阿司匹林还可以通过抑制NF-κB信号通路,减少抗凋亡蛋白的表达,促进肿瘤细胞的凋亡,具有一定的抑制肿瘤生长的效果。
2. 顺铂对细胞凋亡途径的影响顺铂是一种常用的化疗药物,通过与DNA结合,干扰DNA复制和修复过程,引起DNA损伤和细胞周期阻滞。
《新牛蛙抗肿瘤肽RGD-嵌合体肽对黑色素瘤细胞增殖和凋亡的影响及其作用机制》

《新牛蛙抗肿瘤肽RGD-嵌合体肽对黑色素瘤细胞增殖和凋亡的影响及其作用机制》一、引言随着科技的发展,新型生物活性肽因其独特的选择性及较低的副作用,逐渐在肿瘤治疗中显示出巨大潜力。
新牛蛙抗肿瘤肽(以下简称“新牛蛙肽”)及其RGD-嵌合体肽是近年来科研的热点。
该肽具有出色的抗肿瘤特性,特别是在对黑色素瘤的治疗中展现出良好的效果。
本文旨在研究新牛蛙抗肿瘤肽RGD-嵌合体肽对黑色素瘤细胞增殖和凋亡的影响及其作用机制。
二、材料与方法1. 材料本实验采用新牛蛙抗肿瘤肽RGD-嵌合体肽、黑色素瘤细胞株及正常细胞株作为研究对象。
所有实验试剂均为科研级产品,实验环境为无菌、无毒的实验室内进行。
2. 方法采用MTT法测定细胞增殖活性,利用流式细胞仪分析细胞凋亡情况,并通过蛋白质印迹法(Western blot)等方法探讨新牛蛙抗肿瘤肽RGD-嵌合体肽的作用机制。
三、结果1. 对黑色素瘤细胞增殖的影响通过MTT法检测新牛蛙抗肿瘤肽RGD-嵌合体肽对黑色素瘤细胞增殖的影响,结果显示,随着浓度的增加和时间的延长,该肽对黑色素瘤细胞的增殖抑制率显著增加,呈现出剂量-效应和时间-效应关系。
与此同时,该肽对正常细胞的生长并未产生明显的抑制作用,显示其具有良好的选择性。
2. 对黑色素瘤细胞凋亡的影响流式细胞仪分析结果显示,新牛蛙抗肿瘤肽RGD-嵌合体肽能够显著诱导黑色素瘤细胞的凋亡。
随着浓度的增加和时间的延长,凋亡的细胞比例显著增加。
而正常细胞在相同条件下并未出现明显的凋亡现象。
3. 作用机制探讨通过Western blot等方法,我们发现在新牛蛙抗肿瘤肽RGD-嵌合体肽的作用下,黑色素瘤细胞的凋亡相关蛋白(如Caspase-3、Bax等)的表达明显上调,而抗凋亡蛋白Bcl-2的表达明显下调。
这些结果提示我们新牛蛙抗肿瘤肽RGD-嵌合体肽可能是通过调节细胞凋亡相关基因的表达来抑制肿瘤细胞的生长。
此外,该肽还能够与细胞表面的特定受体结合,影响肿瘤细胞的增殖和转移能力。
抗肿瘤药物阿霉素和紫杉醇对Hela细胞增殖及凋亡的影响

抗肿瘤药物阿霉素和紫杉醇对Hela细胞增殖及凋亡的影响作者:孙昊雪来源:《中国科技纵横》2017年第22期摘要:本次实验以Hela细胞为原材料,选择阿霉素(Adriamycin)和紫杉醇(Paclitaxel)作为实验抗肿瘤药物,用MTT比色法测定细胞数目探究不同浓度的阿霉素和紫杉醇对细胞增殖的影响,用Hoechests-PI双染法探究两种药物对细胞凋亡的影响。
经过为期两周的实验我们得出的结果是在阿霉素的作用下Hela细胞的IC50值为12.53μg/ml,在紫杉醇的作用下细胞的IC50值为10.97μg/ml。
加入半数抑制药物浓度后用显微荧光拍照可观察到紫杉醇和阿霉素均能抑制细胞增殖,降低细胞活力,明显提高死亡和不健康细胞比例。
关键词:Hela细胞;阿霉素;紫杉醇;IC50;细胞凋亡;MTT比色法;Hoechests-PI双染法中图分类号:R73-361 文献标识码:A 文章编号:1671-2064(2017)22-0203-041 前言近年来,癌症的频发和高致命性引起了人们越来越多的重视,针对癌症细胞的治疗药物的研究也在蓬勃发展。
紫杉醇和阿霉素是典型的抗癌药物,对癌症细胞有着明显的杀灭和抑制作用:(1)紫杉醇(Paclitaxel),进口药商品名为Taxel,简称PTX。
紫杉醇是M期的植物类药物,对乳腺癌、卵巢癌、非小细胞肺癌获得较好的疗效。
分子式为C47H51NO14,其性状是五色透明或略带黄色的粘性溶液。
具有高度亲脂性,不溶于水。
PTX是1971年从短叶紫衫树皮中提取的具有抗肿瘤作用的活性物质。
PTX能特异性结合到微管导致微管聚合成团块和束状,而抑制微管网的正常组装。
另外其不良反应为严重骨髓抑制。
(2)阿霉素(Adriamycin),也称为14-羟基柔红霉素,简称:ADM,DOX,DXR,分子式为C27H23NO11,其形状是盐酸盐为橘红色针状结晶或橙红色粉末,呈疏松块状。
易溶于水,微溶于甲醇,几乎不溶于丙酮、乙醚或氯仿。
抗肿瘤药物的作用机制

抗肿瘤药物的作用机制直接作用机制主要包括以下几种:1.DNA和RNA的损伤:抗肿瘤药物通过与DNA和RNA结合或干扰其复制、修复等过程,导致肿瘤细胞DNA和RNA的损伤,从而干扰细胞正常的分裂和增殖,最终导致肿瘤细胞凋亡。
例如,一些化疗药物如环磷酰胺、甲氨蝶呤等可以通过与DNA结合抑制DNA的合成,阻断细胞分裂。
2.抑制酶活性:抗肿瘤药物中有些药物可以抑制一些重要的酶活性,影响细胞生长和分裂。
例如,植物生物碱紫杉醇可以通过抑制细胞分裂过程中微管的聚合和解聚过程,从而阻断肿瘤细胞的有丝分裂。
3.细胞周期阻滞:抗肿瘤药物中的一些化合物能够诱导肿瘤细胞进入细胞周期的停滞期,从而阻断肿瘤细胞的生长和分裂。
例如,苯并环磷酰胺可以在S期延迟DNA的合成和分裂;顺铂可以在G2期抑制DNA的修复,从而阻断细胞分裂。
4.干扰细胞信号传导:一些抗肿瘤药物能够干扰细胞内重要的信号通路,从而影响肿瘤细胞的生长和存活。
例如,靶向治疗药物奥曲肽可以抑制肿瘤细胞内的一种受体酪氨酸激酶活性,阻断相关信号通路的传递,从而抑制肿瘤细胞的生长。
间接作用机制主要包括以下几种:1.免疫调节:一些抗肿瘤药物能够增强机体免疫系统的活性,促进机体产生抗肿瘤免疫反应。
例如,白细胞介素-2通过增强T淋巴细胞的活性,促进抗肿瘤免疫反应。
2. Vascular endothelial growth factor (VEGF) 及其受体的抑制:VEGF是一种促血管生成的因子,一些抗肿瘤药物可以通过抑制VEGF及其受体的活性,阻断肿瘤细胞的血供,导致肿瘤细胞缺氧和营养不足,从而抑制肿瘤生长和扩散。
3.破坏肿瘤血供:肿瘤细胞依赖于良好的血供才能生长和扩散,一些抗肿瘤药物可以通过直接或间接的方式破坏肿瘤的血供。
例如,一些化疗药物能够抑制新血管的生成,使肿瘤缺氧和营养不足,从而影响肿瘤细胞的生长。
需要注意的是,不同类型的抗肿瘤药物对肿瘤的作用机制各不相同,有些药物可能具有多种作用机制。
依托泊苷联合顺铂对骨肉瘤细胞增殖和凋亡的影响

依托泊苷联合顺铂对骨肉瘤细胞增殖和凋亡的影响[摘要] 目的探讨依托泊苷联合顺铂对骨肉瘤细胞增殖和凋亡的影响,为骨肉瘤的治疗找寻新的化疗方法。
方法采用mtt法检测药物对骨肉瘤细胞增殖的影响。
倒置相差显微镜来观察用药前后细胞形态改变,用流式细胞仪检测药物分别及联合作用骨肉瘤细胞后细胞凋亡情况。
结果依托泊苷联合顺铂能明显抑制骨肉瘤细胞的生长,与两药单独使用相比较,联合用药抑制骨肉瘤细胞增殖的作用明显增强。
依托泊苷联合顺铂作用于骨肉瘤细胞后凋亡率增高。
倒置相差显微镜可见两药联用时大量骨肉瘤细胞凋亡脱落。
结论依托泊苷联合顺铂能有效抑制骨肉瘤细胞增殖,且促进骨肉瘤细胞凋亡,具有协同抗肿瘤作用。
[关键词] 骨肉瘤细胞;依托泊苷;顺铂[中图分类号] r735.7 [文献标识码] a [文章编号] 2095-0616(2013)01-37-03骨肉瘤发病率在骨原发性恶性肿瘤中占据首位,常见于儿童和青少年。
该瘤恶性程度甚高,预后差。
化疗能明显提高骨肉瘤患者的生存率,其重要性越来越受到临床治疗的关注。
目前治疗骨肉瘤的化疗药物很多,但由于药物的耐药性,单用一种化疗药对骨肉瘤的治疗作用不甚理想。
依托泊苷是鬼臼毒素的半合成衍生物,属细胞周期特异性药物,作用于晚s期及g2期。
该药是一种广谱抗肿瘤药物,是目前骨肉瘤化疗药物研究的热点[1-2]。
本实验将依托泊苷和常用骨肉瘤化疗药物顺铂单独或者联合作用于骨肉瘤细胞,观察其作用效果,来寻找安全有效的联合用药方案,为骨肉瘤的临床治疗提供新的策略。
1 材料与方法1.1 材料细胞培养:人骨肉瘤细胞株mg-63(南京凯基),含10%小牛血清(杭州四季青)1640培养基培养,于37℃、5% co2培养箱中培养。
主要试剂:依托泊苷注射液(江苏恒瑞医药股份有限公司,h32025583);注射用顺铂(山东齐鲁制药有限公司,h37021358);凯基annexinv-fitc细胞凋亡检测试剂盒(南京凯基);96孔板(北京中杉金桥生物技术有限公司);流式细胞仪型号:epics altraⅱ(american beckman);kdc-40低速离心机(科大创新股份有限公司中佳分公司);cf-板式酶标仪(北京市新风机电技术公司);yj-875型超净化工作台(苏州净化设备厂);二氧化碳细胞恒温培养箱(hf90,香港);倒置显微镜(ckx41sf,日本奥林巴斯公司)1.2 细胞培养将人骨肉瘤细胞mg-63置于含10%新生小牛血清的rpmi-1640培养基中,放入37℃,5% co2,饱和湿度的培养箱中培养传代备用。
细胞凋亡与抗肿瘤治疗的关系探讨

细胞凋亡与抗肿瘤治疗的关系探讨在医学领域,肿瘤一直是威胁人类健康的重大疾病之一。
为了战胜肿瘤,科学家们不断探索各种治疗方法。
其中,细胞凋亡这一生物学过程在抗肿瘤治疗中扮演着至关重要的角色。
细胞凋亡,简单来说,就是细胞的一种“自我毁灭”程序。
它是一个高度有序、受到严格调控的过程,对于维持生物体的正常生理功能和内环境稳定具有重要意义。
在正常情况下,细胞凋亡能够清除那些老化、受损或者不再需要的细胞,从而保持细胞群体的平衡和组织的完整性。
那么,细胞凋亡与肿瘤的发生发展又有怎样的关系呢?肿瘤的形成往往与细胞的异常增殖和存活有关。
正常细胞在受到各种内外因素的刺激时,会按照程序启动凋亡,以防止过度增殖和恶变。
然而,在肿瘤细胞中,由于基因突变等原因,细胞凋亡的机制常常受到破坏,使得肿瘤细胞能够逃脱凋亡的命运,不断增殖并形成肿瘤组织。
这就为抗肿瘤治疗提供了一个重要的思路——如果能够重新激活肿瘤细胞的凋亡程序,就有可能达到抑制肿瘤生长、甚至杀灭肿瘤细胞的目的。
目前,许多抗肿瘤治疗方法都是基于这一原理来设计的。
化疗是常见的抗肿瘤治疗手段之一。
化疗药物通过多种机制诱导肿瘤细胞凋亡。
例如,一些化疗药物可以直接损伤肿瘤细胞的 DNA,导致 DNA 损伤无法修复,从而触发细胞凋亡信号通路。
还有一些药物可以干扰细胞内的代谢过程,影响蛋白质合成或能量供应,使肿瘤细胞无法维持生存而发生凋亡。
放疗也是常用的肿瘤治疗方法。
放射线能够产生自由基,造成肿瘤细胞的 DNA 损伤,进而诱导细胞凋亡。
此外,放疗还可以影响细胞膜的结构和功能,改变细胞内的信号传导,促使肿瘤细胞走向凋亡。
除了传统的放化疗,靶向治疗在近年来也取得了显著的进展。
靶向药物能够特异性地作用于肿瘤细胞中的某些靶点,如特定的蛋白质或信号通路,从而更精准地诱导肿瘤细胞凋亡。
例如,针对某些肿瘤细胞表面过度表达的受体蛋白的靶向药物,可以阻断相应的信号传导,导致细胞凋亡的发生。
免疫治疗是当前肿瘤治疗领域的热门方向。
抗肿瘤药物阿霉素对细胞增殖及凋亡的影响实验步骤
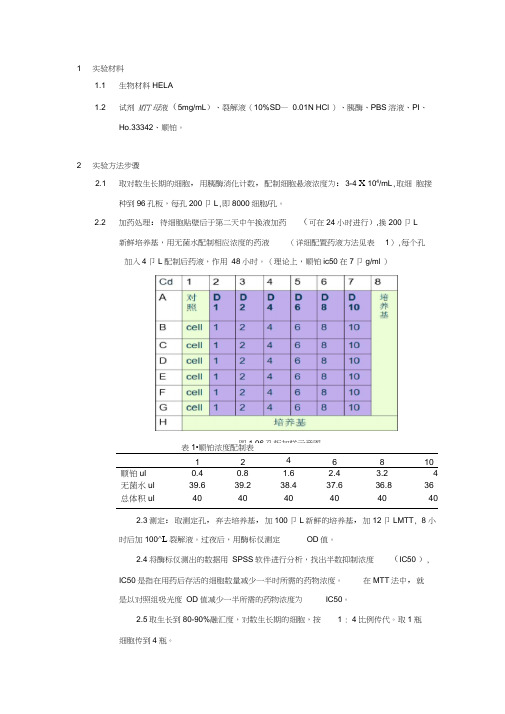
1 实验材料1.1 生物材料HELA1.2 试剂MTT母液(5mg/mL)、裂解液(10%SD—0.01N HCl )、胰酶、PBS溶液、PI、Ho.33342、顺铂。
2 实验方法步骤2.1 取对数生长期的细胞,用胰酶消化计数,配制细胞悬液浓度为:3-4 X 104/mL,取细胞接种到96孔板,每孔200卩L,即8000细胞/孔。
2.2 加药处理:待细胞贴壁后于第二天中午换液加药(可在24小时进行),换200卩L新鲜培养基,用无菌水配制相应浓度的药液(详细配置药液方法见表1),每个孔加入4卩L配制后药液,作用48小时。
(理论上,顺铂ic50在7卩g/ml )图1.96孔板加样示意图表1•顺铂浓度配制表1246810顺铂ul0.40.8 1.6 2.4 3.24无菌水ul39.639.238.437.636.836总体积ul4040404040402.3测定:取测定孔,弃去培养基,加100卩L新鲜的培养基,加12卩LMTT, 8 小时后加100^L裂解液。
过夜后,用酶标仪测定OD值。
2.4将酶标仪测出的数据用SPSS软件进行分析,找出半数抑制浓度(IC50 ),IC50是指在用药后存活的细胞数量减少一半时所需的药物浓度。
在MTT法中,就是以对照组吸光度OD值减少一半所需的药物浓度为IC50。
2.5取生长到80-90%融汇度,对数生长期的细胞,按 1 : 4比例传代。
取1瓶细胞传到4瓶。
2.6第二天加入药物或水。
本组实验加入4卩g/ml的药物培养基。
2.748 小时后,收集培养液,用胰酶适度消化细胞,用收集的培养液吹打细胞,将分散成单个的细胞悬液收集至10mL 离心管中,1000rpm, 离心15 min 去上清,用0.2毫升PBS重悬细胞。
2.8取178卩l PB细胞悬液,加入PI 20 止终浓度100卩g/r)Ho.33342 2 ^L (终浓度10卩g/ml),混匀,37度温箱中避光标记15min。
药物对细胞凋亡的影响

药物对细胞凋亡的影响细胞凋亡是生命体内一种正常的、精确调控的细胞自杀程序,它在维持细胞数量平衡、清除异常细胞和调节发育等方面发挥着重要的作用。
然而,在某些情况下,细胞凋亡的过程可能被疾病或外界因素干扰,导致细胞凋亡异常,进而引发多种疾病的发生和发展。
为了调控细胞凋亡过程,药物被广泛应用于研究和临床治疗中。
本文将探讨药物对细胞凋亡的影响,并从多个角度进行讨论。
一、药物抑制细胞凋亡一些药物能够有效地抑制细胞凋亡的发生。
这类药物可以通过多个途径阻断细胞凋亡的信号通路,包括下调凋亡相关蛋白的表达、抑制凋亡相关酶的活性以及干扰细胞凋亡相关的信号转导。
例如,特定的抗凋亡蛋白可以结合到凋亡信号传导路线的关键蛋白上,从而抑制细胞凋亡的进程。
此外,通过适当调节凋亡相关的细胞因子和生长因子的分泌以及调整凋亡相关基因的表达水平,也能达到抑制细胞凋亡的目的。
二、药物促进细胞凋亡除了抑制细胞凋亡外,一些药物也能够促进细胞凋亡的发生。
这些药物通常作用于癌细胞等异常细胞,通过引发细胞凋亡来达到抗肿瘤和治疗疾病的效果。
这类药物的作用机制复杂多样,包括激活细胞凋亡相关的蛋白和酶、干扰生长因子信号通路、引发线粒体相关的细胞凋亡途径等。
通过促进细胞凋亡,这些药物能够清除异常和恶性细胞,达到治疗疾病的目的。
三、药物调节细胞凋亡的相关途径在探讨药物对细胞凋亡的影响时,不能忽视药物对细胞凋亡相关途径的调节作用。
细胞凋亡涉及多个信号网络和途径,如线粒体途径、死亡受体途径、内质网应激途径等。
药物可以通过调节这些途径中的关键分子和蛋白的表达及活性,影响凋亡的过程和结果。
例如,某些化学药物能够控制细胞内钙离子浓度,从而调节内质网应激途径,影响细胞的生死决策。
四、药物对细胞凋亡的临床应用药物对细胞凋亡的影响已经被广泛应用于临床治疗中。
以抗肿瘤治疗为例,目前临床上采用的多种化疗药物能够通过诱导癌细胞凋亡来达到治疗效果。
此外,针对一些自身免疫性疾病和神经性疾病,药物也可以通过调节细胞凋亡来改善病情。
各种药物对肿瘤细胞的影响

各种药物对肿瘤细胞的影响肿瘤是一种常见的恶性疾病,它的快速增长和扩散对患者的健康构成了极大的威胁。
治疗肿瘤的方法有很多种,其中药物治疗是最常用的一种方式。
不同的药物可以对肿瘤细胞产生不同的影响,下面我们来探讨一下各种药物对肿瘤细胞的影响。
1. 化疗药物化疗药物是常见的肿瘤治疗药物之一。
化疗药物通过阻止肿瘤细胞的分裂和增殖,达到抑制肿瘤生长的目的。
不同种类的化疗药物对肿瘤细胞的作用机制也不同。
例如,紫杉醇是一种较新的化疗药物,它可以与细胞内的微管蛋白结合,抑制肿瘤细胞的分裂和生长。
而丝裂霉素是一种传统的化疗药物,它可以干扰肿瘤细胞的DNA合成,从而抑制肿瘤细胞的增殖和生长。
虽然化疗药物在治疗肿瘤方面有一定的效果,但是它的副作用也比较明显。
化疗药物不仅可以影响肿瘤细胞,还可以影响人体健康细胞的生长和分裂,导致一些不良反应,如恶心、呕吐、脱发等。
2. 靶向治疗药物靶向治疗药物可以选择性地作用于肿瘤细胞的某些关键分子,从而达到抑制肿瘤细胞生长的目的。
相较于化疗药物而言,靶向治疗药物对正常细胞的影响较小,因此副作用也相对较小。
靶向治疗药物的一个典型例子是激酶抑制剂。
激酶抑制剂可以干扰肿瘤细胞的信号转导通路,从而达到抑制肿瘤细胞增殖和生长的目的。
例如,伊马替尼是一种激酶抑制剂,它可以特异性地干扰白血病细胞的信号转导通路,从而达到治疗的效果。
另外一种靶向治疗药物是免疫细胞治疗药物。
免疫细胞治疗药物可以激活人体自身的免疫系统,增强免疫细胞对肿瘤细胞的攻击力度。
例如,PD-1抑制剂可以解除肿瘤细胞对T细胞的逃逸机制,增强T细胞攻击肿瘤细胞的效果。
3. 维生素类药物维生素类药物的作用机制比较复杂,既可以直接抑制肿瘤细胞的生长,也可以通过提高免疫细胞的活性来抑制肿瘤细胞的生长。
维生素D是一种具有直接抑制肿瘤细胞生长作用的维生素。
它可以促进肿瘤细胞的自噬和凋亡,从而达到抑制肿瘤细胞生长的目的。
而维生素C则主要通过提高免疫细胞活性来抑制肿瘤细胞的生长。
《新牛蛙抗肿瘤肽RGD-嵌合体肽对黑色素瘤细胞增殖和凋亡的影响及其作用机制》

《新牛蛙抗肿瘤肽RGD-嵌合体肽对黑色素瘤细胞增殖和凋亡的影响及其作用机制》一、引言黑色素瘤是一种高度侵袭性的皮肤肿瘤,其发病率逐年上升,给患者带来了极大的痛苦。
目前,针对黑色素瘤的治疗手段主要包括手术、放疗和化疗等,但这些治疗方法往往伴随着较大的副作用和复发率。
因此,寻找新的、有效的抗肿瘤药物成为了当前研究的热点。
近年来,新牛蛙抗肿瘤肽RGD-嵌合体肽因其独特的生物活性和低毒性,成为了抗肿瘤药物研究的重点。
本文旨在探讨新牛蛙抗肿瘤肽RGD-嵌合体肽对黑色素瘤细胞增殖和凋亡的影响及其作用机制。
二、方法1. 材料与试剂新牛蛙抗肿瘤肽RGD-嵌合体肽、DMEM培养基、胎牛血清、胰蛋白酶、MTT试剂、Annexin V-FITC/PI细胞凋亡检测试剂等。
2. 实验方法(1)细胞培养:黑色素瘤细胞系A375-SM和B16F10在含有10%胎牛血清的DMEM培养基中培养。
(2)药物处理:将新牛蛙抗肿瘤肽RGD-嵌合体肽以不同浓度加入细胞培养基中,观察其对细胞增殖和凋亡的影响。
(3)MTT法检测细胞增殖:通过MTT法检测药物处理后细胞的增殖情况。
(4)流式细胞术检测细胞凋亡:利用Annexin V-FITC/PI细胞凋亡检测试剂,通过流式细胞术检测细胞凋亡情况。
(5)Western blot检测相关蛋白表达:通过Western blot检测药物处理后细胞中相关蛋白的表达情况。
三、结果1. 新牛蛙抗肿瘤肽RGD-嵌合体肽对黑色素瘤细胞增殖的影响实验结果显示,新牛蛙抗肿瘤肽RGD-嵌合体肽能够显著抑制黑色素瘤细胞A375-SM和B16F10的增殖,且呈浓度依赖性。
随着肽浓度的增加,细胞增殖抑制率逐渐升高。
2. 新牛蛙抗肿瘤肽RGD-嵌合体肽对黑色素瘤细胞凋亡的影响流式细胞术检测结果显示,新牛蛙抗肿瘤肽RGD-嵌合体肽能够诱导黑色素瘤细胞发生凋亡,且呈时间依赖性。
随着药物处理时间的延长,细胞凋亡率逐渐升高。
3. 作用机制探讨Western blot检测结果显示,新牛蛙抗肿瘤肽RGD-嵌合体肽能够下调黑色素瘤细胞中抗凋亡蛋白Bcl-2的表达,同时上调促凋亡蛋白Bax和Caspase-3的表达。
FTY720对非小细胞肺癌细胞增殖、凋亡及细胞周期的影响的开题报告

FTY720对非小细胞肺癌细胞增殖、凋亡及细胞周期的影响的开题报告【摘要】非小细胞肺癌(NCSLC)是最常见的肺癌类型之一,对于其治疗一直存在挑战。
FTY720是一种免疫抑制剂,目前已经被广泛研究其在多种肿瘤细胞中的抗肿瘤作用。
本文研究了FTY720对NCSLC细胞增殖、凋亡和细胞周期的影响。
实验结果表明:FTY720可以抑制NCSLC细胞的增殖,增加NCSLC细胞的凋亡,同时诱导NCSLC细胞进入G0/G1期和G2/M期,并抑制细胞进入S期,从而减少其DNA的合成。
该研究的结果表明FTY720是一种有前途的治疗NCSLC的药物。
【关键词】FTY720;非小细胞肺癌;增殖;凋亡;细胞周期【正文】一、研究背景非小细胞肺癌是恶性肿瘤的一种,是最常见的肺癌类型之一,治疗一直存在难点。
当前,针对非小细胞肺癌的治疗方式主要包括手术切除、放疗和化疗等。
但是,这些治疗方法的效果、预后均较不理想。
因此,更有细胞学定位、更有效、副作用较小的新型治疗法成为当前研究的热点。
FTY720是一种新型免疫抑制剂,目前被广泛研究其在多种肿瘤中的抗肿瘤作用,包括乳腺癌、结直肠癌、前列腺癌等。
研究表明,FTY720能够通过多种途径发挥抗肿瘤作用,如抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡等。
二、研究目的本文旨在研究FTY720对非小细胞肺癌细胞增殖、凋亡及细胞周期的影响,以期为探索治疗非小细胞肺癌的新方法提供实验依据。
三、材料和方法1. 细胞培养:使用H460非小细胞肺癌细胞系,培养于含有10% FBS的DMEM培养基中。
2. 细胞毒性实验:采用CCK8法检测FTY720对H460细胞增殖的影响3. 细胞凋亡实验:通过流式细胞术检测FTY720对H460细胞凋亡的影响4. 细胞周期实验:使用PI染色法检测FTY720对H460细胞周期的影响3. 数据分析:使用GraphPad Prism软件处理实验数据进行统计学分析。
四、预期结果预期结果是FTY720可以抑制H460非小细胞肺癌细胞的生长,并促进其进入细胞凋亡过程。
药物对细胞增殖的影响

药物对细胞增殖的影响细胞增殖是维持生物体正常发育和组织修复的重要过程。
药物作为干预生物体的重要手段之一,对细胞增殖也具有显著的影响。
本文将探讨药物对细胞增殖的影响机制和应用前景。
一、药物对细胞周期的调控细胞周期是细胞增殖的重要环节,药物可以通过不同机制调控细胞周期,从而影响细胞增殖。
首先,一些药物可以干扰细胞周期的调控蛋白,如细胞周期蛋白依赖性激酶(Cyclin-dependent kinase,CDK)及其配体。
通过抑制或激活这些蛋白的活性,药物可以调节细胞周期过程中的不同阶段,从而影响细胞增殖速度。
其次,药物还可以通过调节细胞周期的相关信号通路,如PI3K/AKT、MAPK等信号通路,进一步改变细胞增殖的速度和幅度。
二、药物对DNA合成的影响DNA合成是细胞增殖不可或缺的过程,药物可以通过多种方式影响DNA的合成,从而抑制或促进细胞增殖。
一些抗肿瘤药物,如紫杉醇(Paclitaxel)和顺铂(Cisplatin)等,可以与DNA结合,形成可交联物或损伤DNA结构,从而导致DNA合成的阻断和损伤。
而一些促进细胞增殖的药物,如生长因子和激素类药物,则可以通过增加DNA 合成的速率和效率,进而促进细胞增殖。
三、药物对细胞凋亡的调节细胞凋亡是调节细胞增殖和维持组织稳态的重要途径。
药物可以通过直接调节凋亡相关信号通路,如调控Bcl-2家族蛋白的表达和活性,从而诱导或抑制细胞凋亡。
一些抗肿瘤药物通过促进细胞的凋亡而发挥治疗作用,而一些细胞增殖因子的拮抗物则通过抑制细胞凋亡来促进细胞增殖。
四、药物在肿瘤治疗中的应用肿瘤治疗是药物对细胞增殖影响最为广泛和深入的领域之一。
目前,肿瘤治疗药物主要包括化疗药物、靶向药物和免疫治疗药物等。
这些药物通过不同的机制作用于癌细胞,抑制其增殖和扩散。
化疗药物多通过干扰DNA合成和细胞周期,诱导癌细胞凋亡来发挥治疗作用。
靶向药物则通过特异性抑制肿瘤细胞增殖和信号传导通路来选择性杀伤癌细胞。
药物对肿瘤细胞凋亡的诱导机制

药物对肿瘤细胞凋亡的诱导机制肿瘤是一种严重威胁人类健康的疾病,而药物治疗一直是常见的治疗手段之一。
药物对肿瘤细胞凋亡的诱导机制是其治疗效果的关键。
凋亡是一种重要的细胞死亡方式,通过调控凋亡信号通路,药物可以诱导肿瘤细胞发生凋亡,从而达到治疗的目的。
本文将从凋亡的基本概念开始,详细介绍药物对肿瘤细胞凋亡的诱导机制。
一、凋亡的基本概念在细胞生命周期中,凋亡是一种正常的细胞死亡方式。
相对于坏死而言,凋亡具有以下特点:1)细胞通过凋亡过程有序地进行自我消亡,保持细胞膜的完整性,不会导致细胞内容物的泄漏和炎症反应;2)凋亡过程会涉及一系列调控因子和信号通路的参与,确保细胞凋亡的正确进行。
凋亡的主要特点包括凋亡核病变、DNA断裂和细胞膜翻转等。
二、药物对肿瘤细胞凋亡的诱导机制1. 细胞凋亡通路细胞凋亡通路是指一系列信号传导路径,参与调控细胞凋亡的各个阶段。
常见的凋亡通路包括内质网应激通路、线粒体通路和死受体通路等。
不同的药物可以通过激活或抑制这些通路来诱导肿瘤细胞的凋亡。
2. 药物诱导凋亡的机制(1)化疗药物化疗药物是一类常用的抗肿瘤药物,它们通过直接作用于肿瘤细胞,达到诱导凋亡的效果。
化疗药物可以通过调节凋亡通路上的关键蛋白,如Bcl-2家族和caspase家族,在肿瘤细胞中诱导凋亡。
例如,顺铂作为一种常用的化疗药物,通过抑制Bcl-2的表达,降低细胞内凋亡抑制因子的水平,促进肿瘤细胞的凋亡。
(2)靶向药物相比化疗药物,靶向药物更具有选择性,可以更精确地作用于特定的靶点。
靶向药物通过抑制特定信号通路的激活,干扰细胞的生长和凋亡平衡,从而诱导肿瘤细胞的凋亡。
以鱼腥草碱为例,它可以抑制蛋白酶的活性,干扰肿瘤细胞内抑制凋亡的分子相互作用,从而增加凋亡因子的表达并诱导肿瘤细胞凋亡。
(3)免疫治疗药物免疫治疗药物是近年来快速发展的一类新型抗肿瘤药物。
它们通过激活机体的免疫系统,诱导肿瘤细胞的凋亡。
常见的免疫治疗药物包括肿瘤免疫检查点抑制剂和细胞免疫疗法等。
本实验将探究抗肿瘤药物中的顺铂和阿霉素对细胞增殖与凋亡的影响

本实验将探究抗肿瘤药物中的顺铂和阿霉素对细胞增殖与凋亡的影响本实验将探究抗肿瘤药物中的顺铂和阿霉素对细胞增殖与凋亡的影响。
1.材料与⽅法1.1 材料1.1.1 细胞株⼈胃癌BGC-823细胞为本实验室常规保存的细胞,于37℃、5%co2培养箱中培养。
1.1.2 主要试剂顺铂(母液浓度5mg/ml),阿霉素(母液浓度5mg/ml),4℃冷藏。
四甲基偶氮唑盐(MTT,母液浓度5mg/ml)液,避光保存。
还有DMSO培养液,胰酶,胎⽜⾎清,DMEM培养基,裂解液(0.01MHCI,10%SDS),PBS,PI 染液,Hoechests-33342染液。
1.1.3 主要仪器⽤具荧光显微镜,CO2培养箱,离⼼机,酶标测定仪,冰箱,计数器,排枪,96孔板,酒精灯等。
1.2⽅法1.2.1 原理概述细胞增殖的检测⽅法很多,本实验选⽤的MTT检测法是检测细胞增殖活⼒的⼀种简便准确的⽅法。
其原理是在活细胞⽣长和增殖过程中,线粒体中的琥珀酸脱氢酶能使黄⾊的外源性MTT还原为⽔不溶性的蓝紫⾊结晶甲瓒(Formazan)并沉积在细胞中,⽽死细胞⽆此功能。
⼆甲基亚砜(DMSO)能溶解细胞中的甲瓒,⽤酶标仪在测定其光吸收值,在⼀定细胞数范围内,⽣成的甲瓒量的多少与细胞的数量和细胞的活⼒成正⽐。
根据测得的吸光度值(OD值),来判断活细胞数量,OD值越⼤,细胞活性越强。
其优点是简单、快速、准确,⼴泛应⽤于新药筛选、细胞毒性试验,肿瘤放射敏感性实验分析。
IC50是指在⽤药后存活的细胞数量减少⼀半时所需的药物浓度。
在MTT法中, 就是以对照组吸光度OD 值减少⼀半所需的药物浓度为IC50。
除此以外, 半数抑制浓度的含义还相当于药物对培养细胞的最⼩致死剂量的平均值, 作为反映药效的定量指标, 在各种药物的筛选中⼴泛应⽤。
本实验将以此法测定药物对细胞增殖抑制的IC50值所对应的药物浓度。
检测细胞凋亡的⽅法也有很多。
根据凋亡细胞固有的形态特征,⼈们已经设计了许多不同的细胞凋亡形态学检测⽅法。
抗肿瘤药物与TRAIL联用对喉癌HEP-2细胞株增殖、凋亡的影响

( p rme t f Otl r n oo y He d a d Nek s r e y,h rt fiitd Hopi l De a t n oa y g lg — a n c u g r t eFis f l e s t , o A a a
C o g i g Me c l Un v r i C o g i g 4 0 1 C i a) h n qn dia i e s t y, h n q Too sr et eefcso i e e tc n e tain fTRAI n h moh rp ui rg ( - , src : jci v b e v h fet fdf rn o c n rt so f o L a d c e t ea e tcd u s 5Fu DDP) n o HEP 2 cl l e rl e ain,p p o i, o hidvd al n on l. t o s MTT su e o d tc h n iio ae F - el i sp oi r t a o tss b t n iiu l a djity Meh d n f o y wa sd t ee tt eihbt n rt , CM i
Ef c ft alc m bie t - nd DDP olfr to a po o i  ̄ t o r i o s n d wih 5 Fu a on pr ie a in nd a ptssofHEP- elln 2c l ie yU i o yah, X a— YE n, Li SH EN a , ta1 N e .
22 8 6
重庆医学 20 0 8年 1 0月第 3 7卷 第 2 O期
・
论
著 ・
抗肿瘤 药 物 与 T AI R L联 用对 喉 癌 HE 一 P 2细胞 株 增 殖 、 亡 的影 响 凋
姜黄素联合顺铂对人胶质瘤细胞增殖和凋亡的影响

姜黄素联合顺铂对人胶质瘤细胞增殖和凋亡的影响姜黄素是从姜黄中提取的一种天然化合物,具有多种药理活性,包括抗肿瘤、抗炎和抗氧化等作用。
顺铂是一种广泛用于治疗多种固体肿瘤的化疗药物。
本文旨在综述姜黄素与顺铂联合治疗人胶质瘤细胞增殖和凋亡的影响。
胶质瘤是一种常见的原发性脑肿瘤,具有高度恶性和不良预后的特点。
传统的治疗方法包括手术切除、放射疗法和化疗。
然而,由于肿瘤细胞的高度侵袭性和耐药性,治疗效果不佳。
因此,寻找新的治疗方法对于提高疗效至关重要。
姜黄素因其多种抗肿瘤作用而受到广泛关注。
研究表明,姜黄素可以通过多种机制抑制胶质瘤细胞的增殖和诱导凋亡。
首先,姜黄素可以通过调节细胞周期蛋白和增加细胞周期阻滞来抑制细胞增殖。
研究发现,姜黄素可以显著降低胶质瘤细胞中的细胞周期蛋白D1和细胞周期蛋白B1的表达,从而抑制细胞周期的进行。
其次,姜黄素可以通过诱导细胞凋亡来抑制细胞增殖。
研究发现,姜黄素可以显著增加胶质瘤细胞中Caspase-3和Caspase-9的活性,从而诱导细胞凋亡。
此外,姜黄素还可以通过抑制胶质瘤细胞中的PI3K/Akt和MAPK信号通路来抑制细胞增殖。
然而,姜黄素作为单一药物的抗肿瘤效果有限,且其生物利用度较低。
因此,将姜黄素与其他化疗药物联合使用可能会产生协同的抗肿瘤效果。
顺铂是一种常用的化疗药物,对多种肿瘤细胞具有显著的抑制作用。
研究发现,姜黄素与顺铂联合使用可以显著增强其对胶质瘤细胞的抗增殖和凋亡作用。
姜黄素与顺铂联合使用可能通过多种机制增强其抗肿瘤效应。
首先,姜黄素可以增加顺铂对胶质瘤细胞的敏感性。
研究发现,姜黄素可以降低胶质瘤细胞对顺铂的耐药性,增加顺铂对细胞的毒性。
其次,姜黄素与顺铂可以共同调节细胞周期蛋白和凋亡相关蛋白的表达,增强细胞的凋亡能力。
研究发现,姜黄素与顺铂联合使用可以显著增加Caspase-3和Caspase-9的活性,并抑制细胞周期蛋白D1和细胞周期蛋白B1的表达。
甲磺酸伊马替尼联合塞来昔布对胃肠间质瘤细胞增殖及凋亡的影响

甲磺酸伊马替尼联合塞来昔布对胃肠间质瘤细胞增殖及凋亡的影响目的观察甲磺酸伊马替尼和塞来昔布联合对胃肠间质瘤细胞增殖及凋亡的影响。
方法甲磺酸伊马替尼及塞来昔布单独或联合处理胃肠间质瘤细胞株GIST-T1,MTT法检测药物对胃肠间质瘤细胞株的生长抑制,Western blot检测Bax及Bcl-2蛋白表达。
结果甲磺酸伊马替尼与塞来昔布联合应用显著增强甲磺酸伊马替尼对胃肠间质瘤细胞增殖;和甲磺酸伊马替尼及塞来昔布单用相比,二者联用后胃肠间质瘤细胞Bax表达增高及Bcl-2表达降低。
结论甲磺酸伊马替尼和塞来昔布联合应用显著抑制胃肠间质瘤细胞增殖,可能和促肿瘤细胞凋亡有关,其机制可能与Bax表达上调及Bcl-2表达下调有关。
标签:胃肠间质瘤;甲磺酸伊马替尼;塞来昔布Influence of imatinib mesylate combined with celecoxib on proliferation and apoptosis of gastrointestinal stromal tumor cellsLV?Huifang1??ZHANG?Zhandong2??XU?Chunmiao3??CHEN?Xiaobing1??C HEN?Beibei1LI?Ning1??LUO?Suxia1??HUA?Yawei21.Department of Internal Medicine,Henan Cancer Hospital,Zhengzhou 450008,China;2.Department of General Surgery,Henan Cancer Hospital,Zhengzhou 450008,China;3.Department of Radiology,Henan Cancer Hospital,Zhengzhou 450008,China[Abstract] Objective To observe the effect of IM combined with celecoxib on proliferation and apoptosis in gastrointestinal stromal tumor cells. Methods GIST-T1 cells were treated with IM or celecoxib or in combination. MTT was used to determine the inhibition of GIST-T1 cells and Western blot was used to detect the expression of Bax and Bcl-2 in cancer cells. Results After treatment with IM combined with celecoxib,the inhibitory effect of proliferation was significantly stronger than those of IM or celecoxib alone(P<0.05). In comparison with IM or celecoxib alone,the level of Bax expression was higher and the level of Bcl-2 expression was lower in GIST-T1 cells treated by both two drugs. Conclusion The combination of Imatinib mesylate and celecoxib may inhibit the cell proliferation,which might be associated with the promotion of apoptosis. The mechanism probably correlates with the upregulation of Bax and the downregulation of Bcl-2 in gastrointestinal stromal tumor cells.[Key words] Gastrointestinal stromal tumor;Imatinib mesylate;Celecoxib胃肠间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的间叶源性肿瘤,对传统放、化疗不敏感,手术切除为其主要治疗手段,但术后5年生存率较低,容易出现复发转移,预后差[1]。
简述抗肿瘤药物的作用机制

简述抗肿瘤药物的作用机制抗肿瘤药物的作用机制主要涉及以下几个方面:1.细胞毒作用:许多抗肿瘤药物通过破坏肿瘤细胞的DNA来发挥作用。
这些药物可以干扰DNA的复制、转录或修复过程,导致DNA损伤和细胞死亡。
例如,烷化剂和铂类化合物就通过与DNA结合,造成DNA结构的改变或抑制其功能。
2.抑制细胞分裂:肿瘤细胞生长迅速,需要不断地分裂来扩张。
有些抗肿瘤药物通过抑制细胞分裂过程中的关键酶或蛋白,阻止肿瘤细胞的增殖。
例如,紫杉醇可以抑制微管蛋白的聚合,从而阻止细胞分裂。
3.信号转导抑制剂:肿瘤细胞常常由于过度活跃的信号转导通路而变得异常增殖。
抗肿瘤药物可以通过抑制这些信号转导通路中的关键分子,来控制肿瘤细胞的生长。
例如,EGFR抑制剂可以阻止EGFR信号转导,从而抑制肿瘤细胞的生长。
4.免疫调节剂:近年来,免疫疗法在抗肿瘤治疗中发挥了重要作用。
一些药物通过调节免疫系统,增强机体对肿瘤的免疫反应。
例如,PD-1抑制剂可以解除对T细胞的抑制,增强其对肿瘤细胞的攻击力。
5.诱导细胞凋亡:细胞凋亡是程序性细胞死亡的过程,对于维持机体的平衡十分重要。
抗肿瘤药物可以通过诱导肿瘤细胞凋亡,来清除异常增殖的细胞。
例如,一些化疗药物可以激活凋亡信号通路,触发肿瘤细胞的自我毁灭。
6.血管生成抑制剂:肿瘤的生长需要新的血管为其提供养分。
血管生成抑制剂可以阻止肿瘤血管的形成,切断肿瘤的营养来源,从而抑制其生长。
了解抗肿瘤药物的作用机制有助于医生根据患者的具体情况制定合适的治疗方案,并在治疗过程中进行合理的药物选择和剂量调整。
依托泊苷对人骨髓瘤细胞RPMI8226增殖与凋亡的影响

依托泊苷对人骨髓瘤细胞RPMI8226增殖与凋亡的影响
人骨髓瘤是一种恶性肿瘤疾病,发展迅速,对患者造成严重的危害。
近年来,随着医学技术的不断发展,人们对于治疗骨髓瘤的方法也有了更多的选择。
其中,依托泊苷作为一种新型的治疗药物,备受关注。
本文就依托泊苷对人骨髓瘤细胞
RPMI8226增殖与凋亡的影响进行探究。
依托泊苷是一种针对细胞周期的抗肿瘤药物,主要靶向的是细胞的DNA合成和修复过程,从而抑制细胞增殖。
RPMI8226
是一种人骨髓瘤细胞系,常被用作研究骨髓瘤疾病的模型细胞。
我们通过对RPMI8226细胞系的培养和处理,观察依托泊苷对其增殖和凋亡的影响。
实验结果表明,依托泊苷处理后,RPMI8226细胞的增殖能力
受到了明显的抑制。
随着依托泊苷的加剂量的增加,细胞数量明显下降,相应的,细胞的增殖指数也呈现出明显的下降趋势。
而对于细胞凋亡,我们也通过流式细胞术的方法进行了检测。
结果表明,依托泊苷处理后,RPMI8226细胞的凋亡率呈现出
明显的上升趋势,随着依托泊苷的加剂量的增加,细胞凋亡率也明显增加。
这表明依托泊苷对于抑制人骨髓瘤细胞的增殖能力和促进其凋亡起到了重要的作用。
总体来看,本实验的结果表明,依托泊苷在治疗人骨髓瘤方面具备良好的潜力。
它可以有效地抑制骨髓瘤细胞RPMI8226的增殖能力,并促进其凋亡的发生。
这为使用依托泊苷作为治疗骨髓瘤的药物提供了新的证据和指导。
但是,需要注意的是,
实验结果仅仅是在体外进行的,其在临床上的应用还需要更深入和全面的研究。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗肿瘤药物对细胞增殖及凋亡的影响
【摘要】
本实验室自主创新实验。
本实验主要有药物对细胞对细胞增长速率的影响,药物对细胞周期时相分布及细胞凋亡的影响和细胞凋亡的形态学观察等三个内容。
通过本次实验我们了解了细胞生物学研究的基本思路和理解设计实验的基本原则的同时通过实际操作,理解了细胞增值与凋亡在有机体正常生命活动中的作用及意义,掌握细胞增值与凋亡分析的基本方法。
一、药物对细胞对细胞增长速率的影响
【实验原理】
1.细胞生长曲线:一般细胞传代之后,经过短暂的悬浮然后贴壁,随后度过潜伏期进入指数生长期。
在细胞到达包和密度后,停止生长,进入平顶期,然后退化衰亡。
典型的生长曲线可分为潜伏期,指数增长期,稳定期和衰退期。
以存活细胞数对培养时间作图,及得生长曲线,生长曲线常用与测定药物等外来因素对细胞生长的影响。
2.利用MTT比色法测定药物等外来因素对细胞生长的影响:
黄色的MTT能被活细胞线粒体脱氢酶还原成不溶鱼水的蓝紫色产物——formazan,后者被溶解所呈现的色度反映出活生活细胞的代谢水瓶,死亡细胞则没有脱氢酶活性。
Formazan产生的量与活细胞数成正比。
【实验步骤】
1.溶液的配制:
①MTT母液
②裂解液
③药物与对照组:A(对照),B,C,D
实验步骤:
2.细胞制备:
取对数生长期的细胞,用胰酶消化计数,配制悬液浓度为2.5~3×10 个/ml。
3.细胞的接种(96孔板):
设定调零组,对照组,假药组(8个平衡孔),每孔加入200ul细胞悬液。
4.加药处理:细胞贴壁后,弃培养基,换等体积的药液。
5.对细胞生长情况进行测定:
①配制MTT使用液:无血清的5ml培养基中加入600ulMTT母液避光混匀。
②待测细胞孔,弃去培养基,每孔加100ulMTT使用液。
没有细胞的孔同样重复上述操作,作为调零孔,继续培养。
6.第二天,每孔加入100ul裂解液,调零孔中也加
7.下午取出孔板,用移液器充分混匀,每孔取出150ul样品,转移到检测板中。
用考热的针头挑破孔中的气泡,用酶标仪读取OD值。
8.计算每种药物的生长抑制率(细胞生长抑制率=(1—药物组OD值/细胞对照组OD值)×100%)
二、药物对细胞周期时相分布及细胞凋亡的影响
【实验原理】
流式细胞仪(Flow Cytometer):是集激
光技术、电子物理技术、光电测量技术、计算机技术、细胞荧光化学技术以及单克隆抗体技术为一体的高科技细胞分析仪。
流式细胞术(Flow Cytometry,FCM):利用流式细胞仪对处于快速直线流动状态中的细胞或亚细胞结构进行多参数、快速的定量分析和分选的技术。
2.PI荧光探针的特性:
PI(碘化丙啶)为定量细胞化学的荧光染料,能插入双链DNA和RNA的碱基对之间,每隔5个碱基插入一个PI分子。
如样品经RNA酶消化后,样品中的
DNA可特意结合PI。
以紫外光和绿光激发。
可发射出红色荧光。
核算分子越大,则插入的PI分子越多,荧光强度越大。
3.DNA含量测定和周期时相分析:
细胞内的DNA含量随着细胞周期进程周期性变化,利用荧光探针标记的方法,通过流式细胞仪对细胞内的DNA的相对含量进行测定,可分心细胞周期各时相的百分比。
【实验步骤】
实验步骤:
1.取对数生长期细胞,收集培养液(勿
弃掉),用胰酶消化,收集至10ml离心管中,1000rpm离心15分钟,取上清。
2.PBS洗一次,吹散。
3.用注射器将细胞吸起,用力打入5ml70%预冷的乙醇中,封口,4℃过夜。
4.1000rpm 15min 收集固定细胞,PBS洗一次。
5.用0.4mlPBS重悬细胞并转至1.5ml离心管中轻轻吹打。
加RNase-A约3ul。
6.加PI约60ul,在冰浴中避光染色30min.
7.用300目尼龙网过滤,上级分析测定及打印结果。
三、细胞凋亡的形态学观察
【实验原理】
根据形态学变化经过,可将细胞凋亡分
为3个过程:
①凋亡开始时,细胞表面的特化结构(如微绒毛、细胞突起及细胞表面的褶皱)消失,但细胞膜依然完整,没有失去选择通透性;线粒体大体保持完整,但是偶尔也见到线粒体变大,嵴增多;内质网囊腔膨胀扩大;细胞骨架的结构有时变得致密和紊乱;染色质浓缩分布在核膜周围或一侧,呈眼球状
②形成凋亡小体(apoptotic body)。
产生凋亡小体有两种方式,一种为发芽脱落机制,首先染色体断裂为大小不等的片断,然后通过发芽起泡,与一些细胞器聚集在一起,形成一球形的突起,形成凋亡小体。
另一种为自噬体形成机制,凋亡细胞内线粒体、内质网等和一些细胞内的胞质成分一起被内质网膜包裹,再与细胞膜融合后,形成凋亡小根据形态学变化经过,可将细胞凋亡分
为3个过程:
③凋亡小体形成后,被巨噬细胞或者邻近的细胞吞噬消化,此过程不影响其他细胞的生理功能,也不引起周围细胞的炎症反应。
从细胞发生凋亡开始,到出现凋亡小体仅需数分钟,而被吞噬消化整个过程可持续4 h~9 h。
【实验步骤】
1.将用胰酶消化的细胞及培养基转入离
心管中1000rpm离心10min。
2.吸去上清,用200ulPBS 重悬细胞沉淀,取10ul转入0.5ml的离心管中,加入PI 26ul,Hochest2ul,37℃温箱中避光标记15min.
3.1000rpm 离心10min,弃上清,加50ulPBS重悬细胞。
4.分别从对照组和实验组中取10ul细胞细胞悬液,滴于载玻片上,盖上盖玻片。
5.荧光显微镜下观察。
