气体的熔点与沸点温度
甲烷熔沸点

甲烷熔沸点甲烷(CH4)是一种无色、无味的气体,在自然界中广泛存在于天然气和沼气中。
作为最简单的烷烃,甲烷具有许多重要的应用,例如作为燃料和化学原料。
了解甲烷的熔沸点对于理解其性质和应用具有重要意义。
甲烷的熔沸点是指在常温常压条件下,从固态转变为液态的温度称为熔点,从液态转变为气态的温度称为沸点。
对于甲烷而言,其熔点和沸点较低,使得它在常温下处于气态状态。
甲烷的熔点为-182.5摄氏度(-296.5华氏度),沸点为-161.5摄氏度(-258.7华氏度)。
这意味着当甲烷的温度降低到-182.5摄氏度时,它将从气态转变为固态;当温度升高到-161.5摄氏度时,它将从液态转变为气态。
甲烷的低熔沸点主要是由于其分子结构所决定的。
甲烷分子由一个碳原子和四个氢原子组成,碳原子的四个键角都与氢原子形成共价键。
这种简单的分子结构使得甲烷分子之间的相互作用相对较弱,因此需要较低的能量才能使其分子间相互作用减弱,从而实现相态转变。
甲烷的低熔沸点使得它成为理想的燃料。
在常温常压下,甲烷处于气态,便于储存和运输。
而且,由于甲烷分子结构的稳定性,它在燃烧过程中产生的副产品相对较少,对环境的污染较小。
因此,甲烷被广泛应用于家庭供暖、工业生产和交通运输等领域。
甲烷的低熔沸点也为科学研究提供了便利。
在实验室中,研究人员可以通过控制温度,使甲烷在不同的相态之间转变,从而探索其在不同条件下的性质和行为。
例如,在极低温下,甲烷可以形成固态冰,这种冰的结构与常规冰有所不同,对了解宇宙中冰的性质和形成过程具有重要意义。
甲烷是一种具有重要应用的气体化合物,其熔沸点较低,使得它在常温常压下处于气态。
了解甲烷的熔沸点对于理解其性质和应用具有重要意义。
甲烷的低熔沸点使其成为理想的燃料,并为科学研究提供了便利。
希望通过对甲烷熔沸点的了解,可以更好地认识和利用这一重要气体化合物。
氢气的物化性质

氢气的物化性质氢气的物理性质之一:通常状况下,氢气是没有颜色、没有气味的气体。
盛满氢气的集气瓶瓶口应朝下放置,这是因为氢气比空气轻。
标准状况下,氢气的密度为0.0899g/L,是所有气体中密度最小的。
在压强为1.01×105Pa时,无色液态氢的沸点为-252.80℃(20.2K),雪状固态氢的熔点为-259.14℃(13.86K)。
氢气难溶于水。
标准状况下,1L水中仅能溶解20mL的氢气。
氢气的物理性质之二:氢气在通常条件下为无色、无臭、无味气体;气体分子由双原子组成;熔点-259.14℃,沸点-252.8℃,临界温度33.19K,临界压力12.98大气压,气体密度0.0899g/L;水中溶解度21.4cm3/1000g水(0℃),稍溶于有机溶剂。
氢气的物理性质之三:通常情况下,氢气是一种无色、无臭、无味的气体,熔点-259.14℃,沸点-252.8℃。
在标准状况下(0℃,大气压强为1.013×105),气体的密度为0.0899g/L,跟同体积的空气相比,约为空气质量的1/14,是最轻的气体。
难溶于水,0℃、氢气压强为1.013×105Pa 时,1体积水中能溶解0.0214体积的氢气。
在大气压强为1.013×105Pa,温度为-252.8℃时,氢气液化为无色液体。
在-259.14℃,能变为雪状固体。
液态氢通常称为“液氢”,有超导性质。
氢气的化学性质之一:在常温下,氢气的化学性质是稳定的。
在点燃或加热的条件下,氢气很容易和多种物质发生化学反应。
纯净的氢气在点燃时,可安静燃烧,发出淡蓝色火焰,放出热量,有水生成。
若在火焰上罩一干冷的烧杯,可以烧杯壁上见到水珠。
2H2+O22H2O把点燃氢气的导管伸入盛满氯气的集气瓶中,氢气继续燃烧,发出苍白色火焰,放出热量,生成无色有刺激性气味的气体。
该气体遇空气中的水蒸气呈雾状,溶于水得盐酸。
H2+Cl22HCl在点燃氢气之前,一定要先检验氢气的纯度,因为不纯的氢气点燃时可能发生爆炸。
氧熔点沸点密度

氧熔点沸点密度
氧的熔点为-219.62℃,沸点为-183.0℃,相对分子质量为15.999。
它在常温常压下是无色无味的气体,体积低而轻,是一种非常重要的普遍存在元素。
氧是整个地球和生命过程中不可缺少的元素,通常被称为“氧气”。
它具有独特的化学性质,可以通过燃烧和氧化作用同其他物质发生反应。
而且它不具有色素,所以它是一种无色气体,没有气味。
氧与空气中的其它成分(如氮气、二氧化碳和水汽)混合在一起,会形成不同比例的混合气体。
例如,标准空气中,氧的含量平均为20.95%,是空气中各分子的最高比例。
氧是一种可燃气体,其燃烧热为242.127 kcal/mol,燃烧产物为氧气和二氧化碳。
氧吸收热量较快,水分子吸收热量非常快,可以迅速消除可燃气体的火焰。
氧的密度为1.429磅/立方英尺(1.429 g/L),比空气较轻,是空气中最轻的气体。
密度可以由物理开关控制,例如在高空工作可以增加氧的密度,从而减少呼吸困难的可能性。
氧气的理化及危险特性(MSDS)

急救
措施
吸入:迅速脱离现场至空气新鲜处。保持呼吸道畅通。呼吸心跳停止时,立即进行人工呼吸。就医。
贮运条件
危规号:22001
UN编号:1072
包装标志:不燃气体;氧化剂
包装类别:Ⅲ类
储存于阴凉、通风的库房。远离火种、热源。库温不超过30℃。应与易(可)燃物、活性金属粉末分开存放,切记混储。储备区应备有泄漏应急处理设备。氧气钢瓶不得沾污油脂。采用钢瓶运输时必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。严禁与易燃物或可燃物、活性金属粉末等混装混运,夏季应早晚运输,防止日光曝晒。铁路运输时要禁止溜放。
泄漏应急处理
迅速撤离泄漏污染区人员至上风处,并立即隔离,严格限制出入。建议应急处理人员戴自给正压式呼吸器,穿一般作业工作服。避免与可燃物或易燃物接触。尽可能切断泄漏源。合理通风,加速扩散。漏气容器要妥善处理,修复、检验后再用。
熔点(℃):-218.8
沸点(℃):-182.83
临界温度(℃):-118.4
临界压力(MPa):5.08
饱和蒸气压(KPa):506.62(-164℃)
燃烧热(KJ/mol):无意义
相对密度(水=1):1.14(-183℃)(空气=1):1.43
溶解性:溶于水、乙醇。
燃烧爆炸危险性
燃烧性:不会燃烧,但助燃
消防
措施
用水保持容器冷却,以防受热爆炸,急剧助长火势。迅速切断气源,用水喷淋保护切断气源的人员,然后根据着火原因选择适当灭火剂灭火。
毒性
急性
氦气最高温度

氦气最高温度
氦气是元素周期表中的一种惰性气体,其最高温度与其他气体相比有一些独特之处。
氦气在常压下的沸点为-268.9℃,在常压下的熔点为-272.2℃,这是因为在常温常压下,氦气分子之间的相互作用力非常小,导致其熔点和沸点极低。
氦气的最高温度是指其能够承受的最高温度,一般是指氦气的临界温度。
在氦气的临界点,氦气的密度和粘度都趋近于无穷大,压缩氦气会使其温度升高,一旦超过临界温度,氦气就会变成超临界流体,其物性会发生剧烈变化。
氦气的临界温度为-267.96℃,相对于其他惰性气体,氦气的临界温度是最低的,这也意味着氦气的最高温度相对较低。
虽然氦气的临界温度非常低,但是由于其独特的化学惰性和热稳定性,氦气在低温物理领域和核物理实验中有着广泛的应用。
- 1 -。
22007(氦气)

应急
处理
迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。建议应急处理人员戴自给正压式呼吸器,穿一般作业工作服。尽可能切断泄漏源。合理通风,加速扩散。如有可能,即时使用。漏气容器要妥善处理,修复、检验以后再用。
消防
措施
本品不燃。切断气源。喷水冷却容器,可能的话将容器从火场移至空旷处。
毒性
急性
毒性
LD50:无资料LC50:无资料
毒性
无资料
最高容
许浓度
中国MAC(mg/m3):未制定标准前苏联MAC(mg/m3):未制定标准
美国TVL-TWA化未制定标准美国TVL-STEL未制定标准
健康
危害
本品为惰性气体,高浓度时可使氧分压降低而有窒息危险。当空气中氦浓度达50%以上,引起严重症状:75%以上时,可在数分钟内死亡。当空气中氩浓度增高时,患者先出现呼吸加快、注意力不集中,共济失调;继之出现疲倦乏力、烦躁不安、恶心、呕吐、昏迷、抽搐,以至死亡。
急救
措施
皮肤接触:
眼睛接触:
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。就医。
贮运
条件
危规号:22007
UN编号:1046
包装标志:5
包装分类:III类
不燃性压缩气体。储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。防止阳光直射。应与易、可燃物分开存放,切忌混储。验收时要注意品名,注意验瓶日期,先进仓的先发用。搬运时,轻装轻卸,防止钢瓶以及附件破损。采用钢瓶运输时,必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫片卡牢,防止滚动。
物性参数

中文名: 甲烷
英文名: METHANE
CAS号: 74-82-8
化学式: CH4
所属族: 直链烷烃
分子量: 16.0428 g/mol 熔点: -182.456 C
沸点: -161.49 C
临界温度: -82.586 C
临界体积: 9.86E-05 m3/mol 偏心因子: 0.0115478
临界压缩因子: 0.286
偶极距: 0. debye 标准焓: -7.451997E+07 J/kmol 标准自由焓: -5.049E+07 J/kmol
绝对熵: 1.8627E+05 J/kmol/K
溶解参数: 5.68 (cal/cm3)1/2 折光率: 1.0004
等张比容: 72.618
,
,
标志号:
Ⅲ类包装:货物具有小的危险性,包装强度要求一般。
包装方法:小开口钢桶;螺纹口玻璃瓶、铁盖压口玻璃瓶、塑料瓶或金属桶(罐)外木板箱。
安瓿瓶外木板箱。
铁桶包装(工业纯)
储存于阴凉、通风仓间内。
远离火种、热源。
仓温不宜超过
防止阳光直射。
保持容器密封。
应与氧化剂分开存放。
储存间内的照
丙醇
主反应:
CO+2H2====CH3OH+90.8kJ/mol 25O C
CO2+3H2CH3OH+H2O+49kj/mol。
熔点和沸点复习+讲义+基础习题2022-2023学年北师大物理+八年级+上册
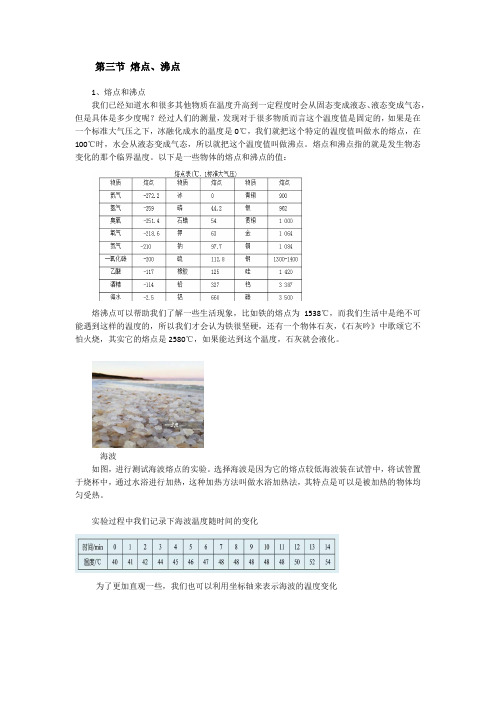
第三节熔点、沸点1、熔点和沸点我们已经知道水和很多其他物质在温度升高到一定程度时会从固态变成液态、液态变成气态,但是具体是多少度呢?经过人们的测量,发现对于很多物质而言这个温度值是固定的,如果是在一个标准大气压之下,冰融化成水的温度是0℃,我们就把这个特定的温度值叫做水的熔点,在100℃时,水会从液态变成气态,所以就把这个温度值叫做沸点。
熔点和沸点指的就是发生物态变化的那个临界温度。
以下是一些物体的熔点和沸点的值:熔沸点可以帮助我们了解一些生活现象,比如铁的熔点为1538℃,而我们生活中是绝不可能遇到这样的温度的,所以我们才会认为铁很坚硬,还有一个物体石灰,《石灰吟》中歌颂它不怕火烧,其实它的熔点是2580℃,如果能达到这个温度,石灰就会液化。
海波如图,进行测试海波熔点的实验。
选择海波是因为它的熔点较低海波装在试管中,将试管置于烧杯中,通过水浴进行加热,这种加热方法叫做水浴加热法,其特点是可以是被加热的物体均匀受热。
实验过程中我们记录下海波温度随时间的变化为了更加直观一些,我们也可以利用坐标轴来表示海波的温度变化由此我们看到海波的温度在升到48℃时不再变化,此时它已经达到自己的熔点,这时它的温度不再继续上升,但是海波仍旧在吸收热量,它所吸收的热量用于改变海波的状态,即由固态变成液态。
图中,海波处于AB 段时对应的物质状态是固态,BC 段是固态和液态并存的状态,简称固液并存态,CD 段则是液态。
但并不是所有物体都有这样一个明显的临界温度,比如修路时常用的一种材料——沥青,就没有一个明显的固态变成液态、液态变成气态的临界温度,为了区分这两种不同种类的物质,我们把前者叫做晶体,而后者叫做非晶体。
对一个非晶体而言,它的特点就是它在发生物态变化时温度也一直变化,所以它表现出来的现象就不是到达一定的温度值以后才开始发生物态变化,比如石蜡的熔化,是随着温度的不断升高它开始变软,然后变得越来越软,直到最后成为液态,石蜡的在熔化时的温度变化是这样的:2、晶体和非晶体的区别:晶体熔化特点:继续吸热,温度保持不变,晶体凝固特点:继续放热,温度保持不变,晶体熔化时的温度叫熔点,晶体在汽化时吸热温度保持不变,液化时持续放热温度不变,汽化时的温度叫做沸点。
丙烷的溶解度

丙烷的溶解度1. 介绍丙烷是一种无色、无臭的气体,化学式为C3H8。
它是烷烃家族中最简单的有机化合物之一。
丙烷在常温下是气态,但它可以在高压下液化。
在本文中,我们将探讨丙烷在不同溶剂中的溶解度以及影响溶解度的因素。
2. 丙烷的物理性质在讨论丙烷的溶解度之前,我们先来了解一下丙烷的一些物理性质。
2.1. 分子结构丙烷由三个碳原子和八个氢原子组成。
它的分子式为C3H8,结构式为CH3CH2CH3。
丙烷是一种非极性分子,由于碳原子和氢原子之间的电负性差异很小,所以丙烷分子中没有明显的正负电荷分布。
2.2. 熔点和沸点丙烷的熔点为-187.7摄氏度,沸点为-42.1摄氏度。
这意味着在常温下,丙烷是气态的,只有在低温或高压下才能液化。
2.3. 密度丙烷的密度较轻,约为0.58克/毫升。
这使得丙烷在空气中上升,而不会沉积在地面上。
3. 丙烷的溶解度丙烷是一种非极性分子,它在非极性溶剂中的溶解度较高。
下面我们将讨论丙烷在不同溶剂中的溶解度以及影响溶解度的因素。
3.1. 丙烷在水中的溶解度由于水是一种极性溶剂,而丙烷是一种非极性分子,所以丙烷在水中的溶解度非常低。
在常温下,丙烷在水中的溶解度约为0.03克/升。
这意味着丙烷几乎不溶于水,可以说是不可溶性的。
3.2. 丙烷在有机溶剂中的溶解度与水相比,有机溶剂通常是非极性的,因此丙烷在许多有机溶剂中具有较高的溶解度。
以下是丙烷在一些常见有机溶剂中的溶解度数据(以克/升为单位):•丙酮:约为200•乙醚:约为55•甲醇:约为4•苯:约为2从上述数据可以看出,丙烷在丙酮中的溶解度最高,而在苯中的溶解度最低。
3.3. 影响丙烷溶解度的因素丙烷的溶解度受到多种因素的影响。
以下是一些影响丙烷溶解度的因素:3.3.1. 温度温度是影响溶解度的重要因素之一。
一般来说,随着温度的升高,溶质的溶解度会增加。
对于丙烷来说,温度的升高会增加其在溶剂中的溶解度。
这是因为加热会增加溶质分子的动能,使其更容易与溶剂分子相互作用。
氮气的理化性质及危险特性表

康危害
侵入途径:吸入。
健康危害:空气中氮气含量过高,使吸入气氧的分压下降,引 起缺氧至息。吸入氮气浓度不太咼时,患者取初感胸闷、气短、 疲软无力;继而有烦躁不安、极度兴奋、乱跑、叫喊、神情恍 惚、步态不稳,称之为 氮酩酊,可进入昏睡或昏迷状态。 吸入高浓度,患者可迅速昏迷、因呼吸和心跳停止而死亡。潜 水员深潜时,可发生氮的麻醉作用:若从咼压环境下过快转入 常压环境,体内会形成氮气气泡,压迫神经、血管或造成微血 管阻塞,发生“减压病”。
急救方法:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如 呼吸困难,给输氧。如呼吸、心跳停止时,立即进行人工呼吸 或胸外心脏按压术。就医。
氮气的理化性质及危险特性表名称氮;氮气分子式
N2危险性类别 第类不燃气体
理化性质
外观与性状:无色无臭气体;
熔点「C):—;沸点「C):;
临界温度(°C):-147;临界压力(MPa:;
相对密度(水=1): (-196C);相对密度(空气=1):;
溶解性:微溶于水、乙醇;
燃烧爆炸
危险性
燃烧性:不燃。
危险特性:若遇高热,容器内压增大,有开裂和爆炸的危险。 储运条件:密闭操作。提供良好的自然通风条件。操作人员必 须经过专门的培训,严格遵守操作规程。防止气体泄漏到工作 场所的空气中。搬运时,轻装轻卸,防止钢瓶以及附件破损。 配备泄漏应急处理设备。存于阴凉、通风的库房。学品等混装 混运。应远离火种、热源。库温不宜超过30C。储区应备有泄 漏应急处理设备。
泄漏处理:密闭操作。提供良好的自然通风条件。操作人员必 须经过专门的培训,严格遵守操作规程。防止气体泄漏到工作 场所的空气中。搬运时,轻装轻卸,防止钢瓶以及附件破损。
配备泄漏应急处理设备。存于阴凉、通风的库房。学品等混装 混运。应远离火种、热源。库温不宜超过30C。储区应备有泄
so2的物理性质

so2的物理性质SO2是一种有机化合物,化学式为SO2,有旋光性,沸点为44.6℃,熔点为-10.3℃,相对密度为2.367(气态)2.849(液态),折射率为1.297,是一种焦炭色液体,味苦,有极强的毒性。
二、SO2的熔点SO2的熔点为-10.3℃,我国平均温度为15.3℃,根据分子结构可知,SO2对常温很不稳定,在常温下会迅速转化为其他化合物,像是H2SO4,SO3,而当SO2凝固在特殊温度时,它的物理性质也会发生很大的变化,比如熔点、沸点、密度、折射率等。
三、SO2的沸点SO2的沸点为44.6℃,当SO2温度升高到它的沸点时,它会从固体直接转化为气体,而且它的沸点也让它能够存在在较低温度的空气中,这也是为什么它的污染能够长期的来回的悬浮在空中的原因。
四、SO2的相对密度SO2的相对密度为2.367(气态)2.849(液态),当它处于气态时,它的相对密度是2.367,而处于液态时,它的相对密度是2.849,这表明SO2在不同的状态下具有不同的物理性质,同时它也非常容易蒸发,吸收空气中的湿度,而这种特性也是它常被作为食品、蔬果加工以及医药领域的催化剂的原因。
五、SO2的折射率SO2的折射率为1.297,当光射入SO2的表面,它会发生折射,穿行的光线的波长会发生改变,而这种改变又会使它产生一种极强的光学属性,对有害物质的过滤舍尔有着重要的作用,而这正是SO2常被用于后处理、杀菌等方面的原因。
六、SO2的分子结构SO2是一种非常普遍的气体,它是由一个硫原子和两个氧原子组成的多原子分子,其分子结构如图所示:结论:以上就是SO2的物理性质的简介,其熔点、沸点、密度和折射率都有一定的变化,具有明显的特性,而它的分子结构也非常的简单稳定,可以提供很多的应用场景。
因此,SO2是极具前景的一种物质,未来也将有更多的使用。
二氧化碳熔点比沸点高的原因

二氧化碳熔点比沸点高的原因好嘞,今天我们聊聊二氧化碳的熔点和沸点,真是个有趣的话题!你知道吗,二氧化碳的熔点居然比沸点还高,这可真让人挠头啊。
大家都知道,冰块在零度就融化成水,而水在100度沸腾,没错吧?可二氧化碳可不是那么简单。
它的熔点在78.5度,而沸点却在56.6度,听起来有点反常,对吧?想象一下,如果二氧化碳是个顽皮的小孩子,熔点就是它不愿意做的作业,沸点则是它想逃课的理由。
二氧化碳在常温常压下是气体状态,大家都知道的,对吧?而当温度降到78.5度时,它才开始变成固体,像是给你来了个冰雪奇缘。
不过,这不是简单的冰雪,而是干冰!干冰可不是普通的冰块,它是二氧化碳在低温下的固态形态,感觉像是科学实验中的神奇材料。
再往下说,56.6度才是它开始“咕咕叫”的温度,变成气体,嘿,这可就像是二氧化碳的“解放日”一样。
说到这里,咱们得了解一下分子结构。
二氧化碳的分子是由一个碳原子和两个氧原子组成的,听上去简单,其实可复杂了。
分子之间的吸引力可是决定它熔点和沸点的关键。
你想啊,分子像小朋友一样,如果它们之间的关系紧密,那就不容易分开,熔点自然高。
相反,沸点是说要让小朋友们兴奋起来,变得活跃,容易分开。
二氧化碳的分子在固态时,彼此之间的吸引力可强了,想要分开可没那么容易。
再说说为什么熔点高,沸点低。
这是因为二氧化碳在固态和气态之间的相互作用。
固态的二氧化碳分子紧紧挨在一起,像是在一起打排球,咱们得把它们分开,可得花点功夫。
而在气态时,分子之间的距离远了,像是小朋友们开始追逐打闹,跑得飞快,没时间停下来,所以沸点自然就低了。
生活中,你一定见过干冰吧?那种在派对上用来制造雾气的神奇东西。
那可都是靠着二氧化碳的特点哦。
干冰的使用,可真是让人感到神秘又有趣,像是一个小魔法师,把空气变得朦胧,营造出一种梦幻的氛围。
想象一下,派对上,大家都在欢笑,突然间,干冰冒出一阵阵白烟,简直就像走进了童话故事里。
再来谈谈环境问题。
物性参数

中文名: 甲烷英文名: METHANECAS号: 74-82-8化学式: CH4所属族: 直链烷烃分子量: 16.0428 g/mol 熔点: -182.456 C沸点: -161.49 C临界温度: -82.586 C临界体积: 9.86E-05 m3/mol 偏心因子: 0.0115478临界压缩因子: 0.286偶极距: 0. debye 标准焓: -7.451997E+07 J/kmol 标准自由焓: -5.049E+07 J/kmol绝对熵: 1.8627E+05 J/kmol/K溶解参数: 5.68 (cal/cm3)1/2 折光率: 1.0004等张比容: 72.618偶极距: 0.112122 debye标准焓: -1.1053E+08 J/kmol标准自由焓: -1.371498E+08 J/kmol绝对熵: 1.975559E+05 J/kmol/K溶解参数: 3.8 (cal/cm3)1/2 折光率: 1.00031等张比容: 62.5388乙醇外观与性状:无色液体,有特殊香味。
密度:0.789 g/cm^3; (液)熔点:−117.3 °C (158.8 K)沸点:78.3 °C (351.6 K)其它理化性质:危险性类别:低毒类健康危害:较高浓度蒸气对眼睛、皮肤、粘膜和上呼吸道有刺激作用。
眼角膜表层形成空泡,还可引起食欲减退和体重减轻。
涂于皮肤,引起局部轻度充血及红斑。
异丁醇环境危害:燃爆危险:本品易燃,具刺激性。
乙酸乙酯,醋酸乙酯(ethyl acetate,acetic ester)CAS No.:141-78-6(1)分子式: C4H8O2(2)相对分子质量 88.10(3)结构式 CH3-C-OCH2CH3,(4)外观与性状:无色澄清液体,有芳香气味,易挥发。
(5)凝固点-83.8℃,沸点77.1℃、闪点(开口)7.2℃,燃点425.5℃,(6)相对密度(水=1):0.90溶解度参数δ=9.1。
物料的物理化学性质及危险性

物料的物理化学性质及危险性1.丙烯外观与性状:无色有烃类气味的气体熔点(℃):-191.2沸点(℃):-47.7闪点(℃):-108自燃温度(℃):455相对密度(水=1):0.5相对密度(空气=1): 1.48燃烧性:易燃建规火灾分级:甲爆炸下限(V%): 1.0爆炸上限(V%):15.0燃烧分解产物:CO、CO2禁忌物:强酸、强氧化剂丙烯为甲类火灾易燃、易爆化学品,化学性质活泼,与空气混合能形成爆炸性混合物,其蒸汽比空气重,能在较低处扩散到很远的地方,遇火源引起燃烧,若高热,容器内压增大,有开裂爆炸的危险。
丙烯具有麻醉和窒息作用,与氧混合时表现出麻醉作用,与空气混合时,窒息作用大于麻醉作用,人吸入丙烯可引起意识丧失。
长期接触丙烯,可引起头昏,乏力、全身不适,思维不集中,个别人有胃肠功能紊乱。
2.丙烷外观与性状:无色气体,纯品无臭熔点(℃):-187.6沸点(℃):-42.1闪点(℃):-104自燃温度(℃):450相对密度(水=1): 1.56燃烧性:易燃建筑火灾分级:甲爆炸下限(V%): 2.1爆炸上限(V%):9.5燃烧分解产物:CO、CO2禁忌物:囟素、强氧化剂为甲级火灾易燃、易爆品,与空气混合能形成爆炸性混合物,遇明火、高温能引起燃烧爆炸性,若遇高热,容器内压增大,有开裂和爆炸危险。
1%丙烷对人无影响,10%以下浓度,只引起轻度头晕,在较高浓度丙烷、丁烷混合气体中中毒时,有头痛、兴奋、恶心、嗜睡、流涎、血压轻度降低、脉缓、神经反射减弱等现象。
直接和液态丙烷接触时,易引起冻伤。
3. 苯外观与性状:无色透明液体,有强烈芳香味熔点(℃):55沸点(℃):80.1闪点(℃):-11相对密度(水=1):0.88相对密度(空气=1): 2.77燃烧性:易燃建筑火灾分级:甲苯为易燃、易爆有毒化学品,与空气混合能形成爆炸性混合物,与氧化剂能发生强烈反应,其蒸汽比空气重,能在较低处扩散到很远的地方,遇火源引起燃烧,若高热,容器内压增大,有开裂爆炸的危险。
甲烷的熔沸点

甲烷的熔沸点全文共四篇示例,供读者参考第一篇示例:甲烷是一种无色、无味的天然气,在常温下是一种易挥发的液体。
甲烷的熔点是在-182.5℃,沸点是在-161.5℃。
这意味着在低于-182.5℃的温度下,甲烷会凝固成为固态,在高于-161.5℃的温度下则会变成气体。
甲烷是一种简单的碳氢化合物,由一个碳原子和四个氢原子组成。
它是地球上最常见的天然气之一,也是一种重要的燃料。
甲烷的熔点和沸点是由其分子结构和相互作用决定的。
甲烷的分子是由一个碳原子和四个氢原子组成的简单结构。
这意味着甲烷分子之间的相互作用比较弱,因此在低温下容易变成固体。
当温度降低到熔点以下时,甲烷分子会逐渐失去动能,分子之间的相互作用会增强,最终凝固成为固体。
甲烷的熔点和沸点对于其在自然环境中的存在和应用起着重要作用。
在地球上的自然条件下,甲烷主要以气态存在,是地球大气中的重要成分之一。
而在工业生产和燃烧过程中,需要对甲烷进行液化,以便输送和储存。
因此了解甲烷的熔点和沸点,有助于我们更好地控制和利用这种重要的天然气资源。
甲烷的熔点和沸点是由其分子结构和相互作用决定的。
熔点为-182.5℃,沸点为-161.5℃。
了解这些物理性质有助于我们更好地理解和利用甲烷这种重要的天然气。
希望通过本文对甲烷的熔点和沸点有了更深入的了解。
第二篇示例:甲烷是一种化学式为CH4的无色、无味气体,常用作化学反应中的原料或燃料。
在常温下,甲烷呈气态存在,但在极低温下可以被冷却成液态。
甲烷的熔点和沸点是很重要的物理性质,它们直接影响着甲烷在不同温度下的状态和用途。
甲烷的熔点是指将其从固态转变为液态的温度,通常表示为摄氏度或华氏度。
在标准大气压下,甲烷的熔点约为-182.5摄氏度。
这个极低的温度使得甲烷在常温下几乎总是以气态存在,很少出现在液态状态。
甲烷的熔点低的原因主要是由于甲烷分子之间的弱分子力,使得其在较低温度下就可以完全脱离固态结构。
甲烷的沸点则是指将其从液态转变为气态的温度。
甲烷的物理性质和化学性质

甲烷的物理性质和化学性质
甲烷(CH4)是简单烃物质,也称为沼气或沼泽气体,在空气中最常见的碳氢化合物之一,在自然界中广泛存在。
甲烷是一种无色和无味的气体混合物,以沼气形式存在,原始质量
约为87.6%甲烷、9.7%二氧化碳、2.7%氮气和少量的其他气体,如氢、氦和氩等元素。
甲烷的物理性质包括:它的比重大于1,摩尔质量为16.04,在正常温度和压力下是气体,熔点为-82.4°C,沸点为-164.4°C,相对密度大约为0.5561。
甲烷具有显著的化学性质。
它是一种碳氢化合物,因此具有许多与它相关的化学反应。
首先,它是一种很不稳定的化合物,当温度较高时,它会分解成氢气和二氧化碳,温度越高,其分解速率也越高。
此外,甲烷还与炭酸钠、氢氧化钠等化学物质进行水解反应,出现氢
气和碳酸酯。
此外,甲烷还可以与水进行缩聚反应,形成甲烷水合物。
甲烷也可以与空气中的氧合成碳氧化物。
这项反应在火腿制作过程中也很有用,因为甲烷
可以与空气中的氧分子结合,产生蛋白质焦化物,使表面变红,达到金黄色。
总之,甲烷的物理性质包括它的物理性质,例如摩尔质量、相对密度、熔点和沸点。
它的
化学性质包括其舍宾反应、水解反应、缩聚反应和氧化反应。
一般来说,这些反应都可以
用来生产和改变特定化合物的性质。
N2化学性质

氮气物理性质:单质氮在常况下是一种无色无臭的气体,在标准情况下的气体密度是1.25g·dm-3,熔点63K,沸点75K,临界温度为126K,它是个难于液化的气体。
在水中的溶解度很小,在283K时,一体积水约可溶解0.02体积的N2。
氮气在极低温下会液化成白色液体,进一步降低温度时,更会形成白色晶状固体。
通常市场上供应的氮气都盛于黑色气体瓶中保存。
化学性质氮气分子的分子轨道式为,对成键有贡献的是三对电子,即形成两个π键和一个σ键。
对成键没有贡献,成键与反键能量近似抵消,它们相当于孤电子对。
由于N2分子中存在叁键N≡N,所以N2分子具有很大的稳定性,将它分解为原子需要吸收941.69kJ/mol的能量。
N2分子是已知的双原子分子中最稳定的。
检验方法:将燃着的Mg条伸入盛有氮气的集气瓶,Mg条会继续燃烧提取出燃烧剩下的灰烬(白色粉末Mg3N2),加入少量水,产生使湿润的红色石蕊试纸变蓝的气体(氨气)反应方程式3Mg+N2=Mg3N2(氮化镁)Mg3N2+6H2O=3Mg(OH)2+2NH3由氮元素的氧化态-吉布斯自由能图也可以看出,除了NH4离子外,氧化数为0的N2分子在图中曲线的最低点,这表明相对于其它氧化数的氮的化合物来讲,N2是热力学稳定状态。
氧化数为0到+5之间的各种氮的化合物的值都位于HNO3和N2两点的连线(图中的虚线)的上方,因此,这些化合物在热力学上是不稳定的,容易发生歧化反应。
在图中唯一的一个比N2分子值低的是NH4+离子。
(详细氧化态-吉布斯自由能图请参照/jpkc/kj/kj14.ppt)由氮元素的氧化态-吉布斯自由能图和N2分子的结构均可以看出,单质N2不活泼,只有在高温高压并有催化剂存在的条件下,氮气可以和氢气反应生成氨:在放电条件下,氮气才可以和氧气化合生成一氧化氮:在水力发电很发达的国家,这个反应已用于生产硝酸。
N2与电离势小,而且其氮化物具有高晶格能的金属能生成离子型的氮化物。
