废水脱氮理论与技术
废水中氨氮的去除

废水中氨氮的去除废水中的氮常以合氮有机物、氨、硝酸盐及亚硝酸盐等形式存在.生物处理把大多数有机氮转化为氨,然后可进一步转化为硝酸盐。
目前采用的除氮工艺有生物硝化与反硝化、沸石选择交换吸附、空气吹脱及折点氯化等四种。
一、生物硝化与反硝化(生物陈氮法)(一)生物硝化在好氧条件下,通过亚硝酸盐菌和硝酸盐菌的作用,将氨氮氧化成亚硝酸盐氮和硝酸盐氮的过程,称为生物硝化作用。
生物硝化的反应过程为:由上式可知:(1)在硝化过程中,1g氨氮转化为硝酸盐氮时需氧4。
57g;(2)硝化过程中释放出H+,将消耗废水中的碱度,每氧化lg氨氮,将消耗碱度(以CaCO3计) 7。
lg。
影响硝化过程的主要因素有:(1)pH值当pH值为8。
0~8。
4时(20℃),硝化作用速度最快。
由于硝化过程中pH将下降,当废水碱度不足时,即需投加石灰,维持pH值在7.5以上;(2)温度温度高时,硝化速度快。
亚硝酸盐菌的最适宜水温为35℃,在15℃以下其活性急剧降低,故水温以不低于15℃为宜;(3)污泥停留时间硝化菌的增殖速度很小,其最大比生长速率为=0.3~0.5d—1(温度20℃,pH8.0~8。
4)。
为了维持池内一定量的硝化菌群,污泥停留时间必须大于硝化菌的最小世代时间 .在实际运行中,一般应取>2 ,或>2 ;(4)溶解氧氧是生物硝化作用中的电子受体,其浓度太低将不利于硝化反应的进行。
一般,在活性污泥法曝气池中进行硝化,溶解氧应保持在2~3mg/L以上;(5)BOD 负荷硝化菌是一类自养型菌,而BOD氧化菌是异养型菌.若BOD5负荷过高,会使生长速率较高的异养型菌迅速繁殖,从而佼白养型的硝化菌得不到优势,结果降低了硝化速率。
所以为要充分进行硝化,BOD5负荷应维持在0.3kg(BOD5)/kg(SS).d以下。
(二)生物反硝化在缺氧条件下,由于兼性脱氮菌(反硝化菌)的作用,将NO2—-N和NO3——N还原成N2的过程,称为反硝化。
反硝化过程中的电子供体(氢供体)是各种各样的有机底物(碳源)。
生物脱氮除磷原理及工艺

生物脱氮除磷原理及工艺 1 引言氮和磷是生物的重要营养源,随着化肥、洗涤剂和农药普遍使用,天然水体中氮、磷含量急剧增加,水体中蓝藻、绿藻大量繁殖,水体缺氧并产生毒素,使水质恶化,对水生生物和人体健康产生很大的危害;然而, 我国现有的城市污水处理厂主要集中于有机物的去除,污废水一级处理只是除去水中的沙砾及悬浮固体;在好氧生物处理中,生活污水经生物降解,大部分的可溶性含碳有机物被去除;同时产生N NH -3、N NO --3和-34PO 和-24SO ,其中25%的氮和19%左右的磷被微生物吸收合成细胞,通过排泥得到去除;二级生物处理则是去除水中的可溶性有机物,能有效地降低污水中的5BOD 和SS , 但对N 、P 等营养物只能去除10%~ 20% , 其结果远不能达到二级排放标准;因此研究开发经济、高效的, 适于现有污水处理厂改造的脱氮除磷工艺显得尤为重要;2 生物脱氮除磷机理生物脱氮机理污水生物脱氮的基本原理就是在将有机氮转化为氨态氮的基础上,先利用好氧段经硝化作用,由硝化细菌和亚硝化细菌的协同作用,将氨氮通过反硝化作用转化为亚硝态氮、硝态氮,即,将3NH 转化为N NO --2和N NO --3;在缺氧条件下通过反硝化作用将硝氮转化为氮气,即,将N NO --2经反亚硝化和N NO --3经反硝化还原为氮气,溢出水面释放到大气,参与自然界氮的循环;水中含氮物质大量减少,降低出水的潜在危险性,达到从废水中脱氮的目的1;错误!硝化——短程硝化:O H HNO O NH 22235.1+→+硝化——全程硝化亚硝化+硝化:O H HNO O NH 22235.1+−−−→−+亚硝酸菌错误!反硝化——反硝化脱氮:O H H CO N OH CH CH HNO 2222333][222+++→+ 反硝化——厌氧氨氧化脱氮:O H N HNO NH 22232+→+反硝化——厌氧氨反硫化脱氮:O H S N SO H NH 2242342++→+废水中氮的去除还包括靠微生物的同化作用将氮转化为细胞原生质成分;主要过程如下:氨化作用是有机氮在氨化菌的作用下转化为氨氮;硝化作用是在硝化菌的作用下进一步转化为硝酸盐氮;其中亚硝酸菌和硝酸菌为好氧自养菌,以无机碳化合物为碳源,从+4NH 或-2NO 的氧化反应中获取能量;其中硝化的最佳温度在纯培养中为25-35 ℃,在土壤中为30-40 ℃,最佳pH 值偏碱性;反硝化作用是反硝化菌大多数是异养型兼性厌氧菌,DO< mg/L 在缺氧的条件下,以硝酸盐氮为电子受体,以有机物为电子供体进行厌氧呼吸,将硝酸盐氮还原为2N 或-2NO ,同时降解有机物2;生物除磷原理磷在自然界以2 种状态存在:可溶态或颗粒态;所谓的除磷就是把水中溶解性磷转化为颗粒性磷,达到磷水分离;废水在生物处理中,在厌氧条件下,聚磷菌的生长受到抑制,为了自身的生长便释放出其细胞中的聚磷酸盐,同时产生利用废水中简单的溶解性有机基质所需的能量,称该过程为磷的释放;进入好氧环境后,活力得到充分恢复,在充分利用基质的同时,从废水中摄取大量溶解态的正磷酸盐,从而完成聚磷的过程;将这些摄取大量磷的微生物从废水中去除,即可达到除磷的目的3;聚磷菌在厌氧条件下,分解体内的多聚磷酸盐产生ATP,利用ATP 以主动运输方式吸收产酸菌提供的三类基质进入细胞内合成PHB;与此同时释放出-34PO 于环境中1; 好氧吸磷过程聚磷菌在好氧条件下,分解机体内的PHB 和外源基质,产生质子驱动力将体外的-34PO 输送到体内合成ATP 和核酸,将过剩的 -34PO 聚合成细胞贮存物:多聚磷酸盐异染颗粒; 3 生物脱氮除磷工艺从生物脱氮除磷的机理分析来看,生物脱氮除磷工艺基本上包括厌氧、缺氧、好氧3 种状态,这3个不同的工作状态可以在空间上进行分离,也可以在时间上进行分离;近年来,随着对生物脱氮除磷的机理研究不断深入,以及各种新材料、新技术、新设备的不断运用,衍生出了许多新的生物脱氮除磷工艺,其中典型的几种处理工艺如下;SBR 工艺SBR 工艺是一种新近发展起来的新型处理废水的工艺,即为序批式好氧生物处理工艺,其去除有机物的机理在于充氧时与普通活性污泥法相同,不同点是其在运行时,进水、反应、沉淀、排水及空载5个工序,依次在一个反应池中周期性运行,所以该法不需要专门设置二沉池和污泥回流系统,系统自动运行及污泥培养、驯化均比较容易;该法处理焦化废水有着独有的优势:一是不要空间分割,时序上就能创造出缺氧和好氧的环境,即具有A /O 的功能,十分有利于氨氮和COD 的去除;二是该法的沉淀是一种静止的沉淀,对污泥沉淀性能不好的废水,固液分离效果非常明显;三是该法可以省去二沉池,其占地面积相对要小一些;自动控制系统的发展和完善,为SBR 工艺的应用提供的物质基础;但因为SBR 是间歇运行的,为了解决连续进水问题,至少需要设置两套SBR 设施,进行切换运行;SBR 工艺流程图见图14;CAST 工艺CAST 实际上是一种循环SBR 活性污泥法,应器中活性污泥不断重复曝气和非曝气过程,生物反应和泥水分离在同一池内完成,与SBR 同样使用滗水器;污水首先进入选择器,污水中溶解性的有机物通过生物作用得到去除,回流污泥中硝酸盐也此时得到反硝化;然后进入厌氧区,此时为微生物释磷提供条件;第三区为主曝气区,主要进行BOD 降解,同时硝化反硝化;CAST 选择器设置在池首,防止了污泥膨胀; 3.3 MSBR 工艺连续流序批式活性污泥法工艺ModifiedSequencing Batch Reactor,简称MSBR;首先,污水进入厌氧池,回流活性污泥中的聚磷菌在此充分释磷,然后混合液进入缺氧池反硝化;反硝化后的污水进入好氧池,有机物在好氧条件下被降解,活性污泥充分吸磷后再进入起沉淀作用的SBR,澄清后上清液排放;此时另一边的SBR 在回流量的条件下进行反硝化、硝化或静置预沉;回流污泥首先进入浓缩池浓缩,上清液直接进入好氧池,而浓缩污泥进入缺氧池;这样,一方面可以进行反硝化,另一方面可先消耗掉回流浓缩污泥中的溶解氧和硝酸盐,为随后进行的厌氧释磷提供更为有利的条件;CAST 综合了以往除磷脱氮工艺的优点,保证了各污染物质降解的最大速率环境,去除有机污染物效率更高,脱氮除磷效果更好A/2工艺OA/2工艺传统OA/2工艺或称AAO工艺,在一个处理系统中同时具有厌氧区、缺氧区、好氧区,能够同时作到脱氮、O除磷和有机物的降解,其工艺流程见图2;污水进入厌氧反应区,同时进入的还有从二沉池回流的活性污泥,聚磷菌在厌氧条件下释磷,同时转化易降解COD、VFA为PHB,部分含氮有机物进行氨化;污水经过第一个厌氧反应器以后进入缺氧反应器,本反应器的首要功能是进行脱氮;硝态氮通过混合液内循环由好氧反应器传输过来,通常内回流量为2~4倍原污水流量,部分有机物在反硝化菌的作用下利用硝酸盐作为电子受体而得到降解去除;混合液从缺氧反应区进入好氧反应区,混合液中的COD浓度已基本接近排放标准,在好氧反应区除进一不降解有机物外,主要进行氨氮的硝化和磷的吸收,混合液中硝态氮回流至缺氧反应区,污泥中过量吸收的磷通过剩余污泥排除;该工艺流程简洁,污泥在厌氧、缺氧、好氧环境中交替运行,丝状菌不能大量繁殖,污泥沉降性能好5;它将厌氧段、缺氧段放在工艺的第一级, 充分发挥了厌氧菌群承受高浓度、高有机负荷能力的优势, 处理效果较好, 产生的污泥较一般的生物法少;可用于处理工业废水比重较大城市污水, 另外, 由于它是在普通活性污泥法的基础上发展起来的, 因而也较容易用于生物法处理的老污水厂的改造;A/2工艺改良O改良O A /2工艺是中国市政工程华北设计研究院提出的,工艺综合了A/O 工艺和改良UCT 工艺的优点,即在厌氧池之前增设厌氧/缺氧池;首先回流污泥和10%的污水进入厌氧/缺氧池进行反硝化以去除回流污泥中的硝酸盐;90%的污水进入厌氧区与回流污泥混合,在兼性厌氧发酵菌的作用下将部分易生物降解的大分子有机物转化为VFA ;聚磷菌释磷,同时吸收VFA 以PHB 的形式贮存于胞内;在缺氧区,反硝化菌利用污水中的有机物和经混合液回流而带来的硝酸盐进行反硝化,同时去碳脱氮;在好氧区,有机物浓度相当低,有利于自养硝化菌生长繁殖,进行硝化反应,同时聚磷菌过量摄磷;通过沉淀、排除剩余污泥达到除磷的目的;该工艺降低回流污泥中硝态氮对后续厌氧池的不利影响,有利于厌氧池的聚磷菌释磷,改善了泥水分离性能6;3.5 UCT 改良工艺改良的UCT 工艺University of Cape Town 脱氮除磷工艺由厌氧池、缺氧1 池、缺氧2 池、好氧池、沉淀池系统组成,有2 个缺氧池;缺氧1 池只接受沉淀池的回流污泥,同时缺氧1 池有混合液回流至厌氧池,以补充厌氧池中污泥的流失;回流污泥携带的硝态氮在缺氧1 池中经反硝化被完全去除;在缺氧2池中接受来自好氧池的混合液回流,同时进行反硝化,缺氧1 池出水中的N NO --3 带进厌氧池使之保持较为严格的厌氧环境,从而提高系统的除磷效率7;立体循环一体化氧化沟氧化沟是一种而有效的污水处理技术,具有稳定的处理效果,是污水生物处理技术之一;特别是用于污水脱氮,氧化沟比其它生物脱氮工艺费用低、TN 去除效率高;然而,与活性污泥法相比,氧化沟占地面积较大,在土地紧张的城市或地区,氧化沟的应用受到限制8;针对常规氧化沟存在的问题,成功地研究出立体循环一体化氧化沟;其特点是:① 氧化沟采用立体循环,在循环过程中完成降解有机物和脱氮过程;与现有氧化沟相比,占地面积可减少约50%;② 沉淀区与氧化沟合建,沉淀的污泥可自动回流到氧化沟内,可节省投资和能耗;③ 结构紧凑,运行操作简便;新型立体循环一体化氧化沟既保留氧化沟设备和运行操作简单等优点,又可减少占地面积; 4 结语污水生物脱氮除磷是当今水处理的热点与难点;新的脱氮除磷理论的提出,为生物脱氮除磷工艺指引了方向;如:SND 同时硝化反硝化工艺、SHARON 工艺、氧限制自氧硝化—反硝化工艺、厌氧氨氧化工艺以及短程硝化—厌氧氨氧化组合工艺等;但是,生物脱氮除磷工艺的发展已不仅仅要求对N,P 去除率,而且要求处理效果稳定,可靠的运行工艺;今后对此技术的研究应集中在以下方面:第一、加深除磷机理的研究;反硝化聚磷菌的出现解决了硝化菌与聚磷菌争夺碳源,污泥龄不同等主要矛盾;为新型同步脱氮除磷工艺提供了理论依据;但是对于反硝化聚磷菌的了解还不够全面,尤其是其除磷机理还待于进一步研究;应突破传统理论,从微生物的角度来调控工艺;第二、随着脱氮除磷工艺的进一步发展,许多研究者在进行小试时,都驯化出颗粒污泥,而颗粒污泥的出现改善了污泥膨胀这一难题;同时发现颗粒污泥对N,P 的去除要远远优于絮状污泥;今后在对颗粒污泥的研究上应更加深入,研究了解颗粒污泥外部的胞外聚合物是否对N,P 有吸附作用,并进一步研究颗粒污泥的形成机理,调整现有反应器的运行参数,从而加速颗粒污泥的形成,提高脱氮除磷效率;。
叙述污水脱氮原理

叙述污水脱氮原理
污水脱氮是指通过一系列的工艺方法,将污水中的氮污染物转化为无害的形式,以减少对水环境的污染。
污水中的氮主要以氨态氮(NH3-N)和硝态氮(NO3-N)的形式存在。
污水脱氮的原理主要包括生物脱氮和化学脱氮两种方法。
生物脱氮主要通过厌氧和好氧微生物的共同作用来完成。
在厌氧条件下,污水中的氨态氮由厌氧菌转化为氮气(N2)的形式,此过程称为反硝化;而在好氧条件下,厌氧转化成的亚硝酸盐(NO2-)会被其他好氧菌进一步氧化为硝酸盐(NO3-),这一过程称为硝化。
通过合理控制好氧和厌氧环境的转换,可以达到高效的脱氮效果。
化学脱氮主要通过化学方法将氨态氮转化为氮气的形式。
其中最常用的方法是硝化-反硝化法,使用硫酸盐还原剂和硫化盐
来催化氨态氮的氧化和反硝化,进而将氮气排放到大气中。
此外,还有其他一些化学方法,如曝气亚硝酸盐氧化法、生物Chemcan污水处理技术等。
除了生物脱氮和化学脱氮,还有一些辅助措施可以提高脱氮效果。
例如,在生物脱氮过程中,可以通过调节温度、pH值和
溶解氧浓度等操作条件来改善微生物的生长环境;在化学脱氮过程中,可以优化还原剂的投加量和反应时间,以提高脱氮的效率。
总之,污水脱氮是通过生物和化学方法将污水中的氮污染物转
化为无害形式的过程。
通过合理选择和组合脱氮方法,可以达到高效、环保的污水处理效果。
工艺方法——生物脱氮除磷技术

工艺方法——生物脱氮除磷技术工艺简介一、传统生物脱氮除磷技术1、传统生物脱氮原理污水经二级生化处理,在好氧条件下去除以BOD5为主的碳源污染物的同时,在氨化细菌的参与下完成脱氨基作用,并在硝化和亚硝化细菌的参与下完成硝化作用;在厌氧或缺氧条件下经反硝化细菌的参与完成反硝化作用。
2、传统生物除磷原理在厌氧条件下,聚磷菌体内的ATP进行水解,放出H3PO4和能量形成ADP;在好氧条件下,聚磷菌有氧呼吸,不断地放出能量,聚磷菌在透膜酶的催化作用下利用能量、通过主动运输从外部摄取H3PO4,其中一部分与ADP结合形成ATP,另一部分合成聚磷酸盐(PHB)储存在细胞内,实现过量吸磷。
通过排除剩余污泥或侧流富集厌氧上清液将磷从系统内排除,在生物除磷过程中,碳源微生物也得到分解。
3、常用工艺及升级改造具有代表性的常用工艺有A/O工艺、A2/O工艺、UCT工艺、SBR 工艺、Bardenpho工艺、生物转盘工艺等,这些工艺都是通过调节工况,利用各阶段的优势菌群,尽可能的消除各影响因素间的干扰,以达到适应各阶段菌群生长条件,实现水处理效果。
近年来随着研究的深入,对常用工艺有了一些改进,目前应用最广泛、水厂升级改造难度较低的是分段进水工艺。
与传统A/O工艺、A2/O工艺、UCT工艺等相比,分段进水工艺可以充分利用碳源并能较好的维持好氧、厌氧(或缺氧)环境,具有脱氮除磷效率高、无需内循环、污泥浓度高、污泥龄长等优点。
分段进水工艺适用于对A/O工艺、A2/O工艺、UCT工艺等的升级改造,通过将生化反应池分隔并使进水按一定比例分段进入各段反应池,以充分利用碳源,解决目前污水处理厂普遍存在的碳源不足和剩余污泥量过大的问题。
分段进水工艺虽然对提高出水水质有较好的效果,但该工艺并不能提高处理能力,当水厂处于超负荷运行时,分段进水改造也不能达到良好的处理效果。
二、新型生物脱氮除磷技术近年来,科学研究发现,生物脱氮除磷过程中出现了超出传统生物脱氮除磷理论的现象,据此提出了一些新的脱氮除磷工艺,如:短程硝化反硝化工艺、同步硝化反硝化工艺、厌氧氨氧化工艺、反硝化除磷工艺。
污水去除氨氮的方法

污水去除氨氮的方法物化法1.吹脱法在碱性条件下,利用氨氮的气相浓度和液相浓度之间的气液平衡关系进行分离的一种方法,一般认为吹脱与温度、PH、气液比有关。
2.沸石脱氨法利用沸石中的阳离子与废水中的NH4+进行交换以达到脱氮的目的。
应用沸石脱氨法必须考虑沸石的再生问题,通常有再生液法和焚烧法。
采用焚烧法时,产生的氨气必须进行处理,此法适合于低浓度的氨氮废水处理,氨氮的含量应在10-20mg∕1.o3.膜分离技术利用膜的选择透过性进行氨氮脱除的一种方法。
这种方法操作方便,氨氮回收率高,无二次污染。
例如:气水分离膜脱除氨氮。
氨氮在水中存在着离解平衡,随着PH升高,氨在水中NH3形态比例升高,在一定温度和压力下,NH3的气态和液态两项达到平衡。
根据化学平衡移动的原理即吕.查德里(A.1..1.EChatelier)原理。
在自然界中一切平衡都是相对的和暂时的。
化学平衡只是在一定条件下才能保持"假若改变平衡系统的条件之一,如浓度、压力或温度,平衡就向能减弱这个改变的方向移动。
”遵从这一原理进行了如下设计理念在膜的一侧是高浓度氨氮废水,另一侧是酸性水溶液或水。
当左侧温度Tl>20o C,PHl>9,Pl>P2保持一定的压力差,那么废水中的游离氨NH4+,就变为氨分子NH3,并经原料液侧介面扩散至膜表面,在膜表面分压差的作用下,穿越膜孔,进入吸收液,迅速与酸性溶液中的H+反应生成铁盐。
4.MAP沉淀法主要是利用以下化学反应:Mg2++NH4++P043-=MgNH4P04理论上讲以一定比例向含有高浓度氨氮的废水中投加磷盐和镁盐,⅛[Mg2+][NH4+][P043-]>2.5×10-13时可生成磷酸铁镁(MAP),除去废水中的氨氮。
5.化学氧化法利用强氧化剂将氨氮直接氧化成氮气进行脱除的一种方法。
折点加氯是利用在水中的氨与氯反应生成氨气脱氨,这种方法还可以起到杀菌作用,但是产生的余氯会对鱼类有影响,故必须附设除余氯设施。
污水处理工艺脱氮

污水处理工艺脱氮引言概述:污水处理是一项重要的环境保护工作,其中脱氮是其中一个关键的工艺。
脱氮工艺的目的是去除污水中的氮元素,以减少对水体的污染。
本文将从五个大点来详细阐述污水处理工艺脱氮的方法和原理。
正文内容:1. 生物脱氮工艺1.1 传统的硝化-反硝化工艺:通过好氧菌将氨氮转化成硝态氮,再通过厌氧菌将硝态氮还原成氮气释放。
1.2 间歇式生物脱氮工艺:通过控制好氧和厌氧条件的切换,使得污水中的氨氮在不同环境中转化为氮气释放。
1.3 碳源添加工艺:在污水处理过程中添加适量的碳源,促进好氧菌的生长和硝化反应,从而实现脱氮效果。
2. 物化脱氮工艺2.1 化学沉淀法:通过添加化学药剂,使污水中的氮元素与药剂发生反应生成不溶于水的沉淀物,从而实现脱氮效果。
2.2 气浮法:将污水中的氮元素转化成气态,通过气浮设备将气态氮排出,从而实现脱氮效果。
2.3 膜分离法:利用特殊的膜材料,将污水中的氮元素与其他物质分离,从而实现脱氮效果。
3. 吸附脱氮工艺3.1 活性炭吸附法:利用活性炭的大比表面积和吸附性能,将污水中的氮元素吸附到活性炭表面,从而实现脱氮效果。
3.2 生物负载吸附法:将具有高氮吸附能力的微生物负载在特定的载体上,通过微生物的代谢作用将污水中的氮元素吸附和转化为无害物质。
4. 电化学脱氮工艺4.1 电解法:通过电解污水,利用电极上的化学反应将污水中的氮元素转化为氮气释放,从而实现脱氮效果。
4.2 电化学氧化法:利用电化学氧化反应将污水中的氮元素氧化为无害物质,从而实现脱氮效果。
5. 植物脱氮工艺5.1 水生植物法:利用水生植物的吸收作用,将污水中的氮元素吸收并转化为植物组织中的有机物。
5.2 人工湿地法:通过构建人工湿地,利用湿地植物和微生物的共同作用,将污水中的氮元素去除和转化。
总结:污水处理工艺脱氮是一项关键的环境保护工作。
通过生物脱氮工艺、物化脱氮工艺、吸附脱氮工艺、电化学脱氮工艺和植物脱氮工艺等不同方法,可以有效去除污水中的氮元素,减少对水体的污染。
污水处理脱氮除磷工艺介绍及对比分析

污水处理脱氮除磷工艺介绍及对比分析2020年9月6日星期日目录一、生物脱氮 (3)1、硝化过程 (3)2、反硝化过程 (4)3、生物脱氮的基本条件 (5)4、废水生物脱氮处理方法 (6)二、化学脱氮 (7)1、吹脱法 (7)2、化学沉淀法(磷酸铵镁沉淀法) (8)3、低浓度氨氮工业废水处理技术 (9)4、不同浓度工业含氨氮废水的处理方法比较 (11)三、化学法除磷 (11)1、石灰除磷 (12)2、铝盐除磷 (12)3、铁盐除磷 (13)四、生物除磷 (13)1、生物除磷的原理 (13)2、生物除磷的影响因素: (14)3、废水生物除磷的方法有哪些 (15)4、除磷设施运行管理的注意事项 (15)一、生物脱氮脱氮技术包括化学法和生物法,由于化学法会产生二次污染,而且成本高,所以一般使用生物脱氮技术。
污水生物处理脱氮主要是靠一些专性细菌实现氮形式的转化。
含氮有机化合物在微生物的作用下首先分解转化为氨态氮NH4+或NH3,这一过程称为“氨化反应”。
硝化菌把氨氮转化为硝酸盐,这一过程称为“硝化反应”;反硝化菌把硝酸盐转化为氮气,这一反应称为“反硝化反应”。
含氮有机化合物最终转化为氮气,从污水中去除。
1、硝化过程硝化菌把氨氮转化为硝酸盐的过程称为硝化过程,硝化是一个两步过程,分别利用了两类微生物——亚硝酸盐菌和硝酸盐菌。
这两类细菌统称为硝化菌,这些细菌所利用的碳源是CO32-、HCO3-和CO2等无机碳。
第一步由亚硝酸盐菌把氨氮转化为亚硝酸盐,第二步由硝酸盐菌把亚硝酸盐转化为硝酸盐。
这两个过程释放能量,硝化菌就是利用这些能量合成新细胞和维持正常的生命活动,氨氮转化为硝态氮并不是去除氮而是减少了它的需氧量。
氧化1g氨氮大约需要消耗4.3gO2和8.64gHCO3-(相当于7.14gCaCO3碱度)。
硝化过程的影响因素:1)温度:硝化反应最适宜的温度范围是30~35℃,温度不但影响硝化菌的比增长速率,而且会影响硝化菌的活性。
氨氮去除方法及原理

氨氮去除方法及原理cdpulin LV.0 2楼根据废水中氨氮浓度的不同,可将废水分为3类:高浓度氨氮废水(NH3-N>500mg/l),中等浓度氨氮废水(NH3-N:50-500mg/l),低浓度氨氮废水(NH3-N<50mg/l)。
然而高浓度的氨氮废水对微生物的活性有抑制作用,制约了生化法对其的处理应用和效果,同时会降低生化系统对有机污染物的降解效率,从而导致处理出水难以达到要求。
故本工程的关键之一在于氨氮的去除,去除氨氮的主要方法有:物理法、化学法、生物法。
物理法含反渗透、蒸馏、土壤灌溉等处理技术;化学法含离子交换、氨吹脱、折点加氯、焚烧、化学沉淀、催化裂解、电渗析、电化学等处理技术;生物法含藻类养殖、生物硝化、固定化生物技术等处理技术。
目前比较实用的方法有:折点加氯法、选择性离子交换法、氨吹脱法、生物法以及化学沉淀法。
1.折点氯化法去除氨氮折点氯化法是将氯气或次氯酸钠通入废水中将废水中的NH3-N氧化成N2的化学脱氮工艺。
当氯气通入废水中达到某一点时水中游离氯含量最低,氨的浓度降为零。
当氯气通入量超过该点时,水中的游离氯就会增多。
因此该点称为折点,该状态下的氯化称为折点氯化。
处理氨氮污水所需的实际氯气量取决于温度、pH值及氨氮浓度。
氧化每克氨氮需要9~10mg氯气。
pH值在6~7时为最佳反应区间,接触时间为0.5~2小时。
折点加氯法处理后的出水在排放前一般需要用活性碳或二氧化硫进行反氯化,以去除水中残留的氯。
1mg残留氯大约需要0.9~1.0mg的二氧化硫。
在反氯化时会产生氢离子,但由此引起的pH值下降一般可以忽略,因此去除1mg残留氯只消耗2mg左右(以CaCO3计)。
折点氯化法除氨机理如下:Cl2+H2O→HOCl+H++Cl-NH4++HOCl→NH2Cl+H++H2ONHCl2+H2O→NOH+2H++2Cl-NHCl2+NaOH→N2+HOCl+H++Cl-折点氯化法最突出的优点是可通过正确控制加氯量和对流量进行均化,使废水中全部氨氮降为零,同时使废水达到消毒的目的。
氨氮废水处理工艺技术最全总结

氨氮废水处理工艺技术最全总结氨氮废水处理有折点氯化法、化学沉淀法、离子交换法、吹脱法和生物脱氨法等多种方法,这些技术可分为物理化学法和生物脱氮技术两大类。
一、生物脱氮法微生物去除氨氮过程需经两个阶段。
第一阶段为硝化过程,亚硝化菌和硝化菌在有氧条件下将氨态氮转化为亚硝态氮和硝态氮的过程。
第二阶段为反硝化过程,污水中的硝态氮和亚硝态氮在无氧或低氧条件下,被反硝化菌(异养、自养微生物均有发现且种类很多)还原转化为氮气。
在此过程中,有机物(甲醇、乙酸、葡萄糖等)作为电子供体被氧化而提供能量。
常见的生物脱氮流程可以分为3类,分别是多级污泥系统、单级污泥系统和生物膜系统。
1、多级污泥系统多级污泥系统可以得到相当好的BOD5去除效果和脱氮效果,其缺点是流程长、构筑物多、基建费用高、需要外加碳源、运行费用高、出水中残留一定量甲醇等。
2、单级污泥系统单级污泥系统的形式包括前置反硝化系统、后置反硝化系统及交替工作系统。
前置反硝化的生物脱氮流程,通常称为A/O流程与传统的生物脱氮工艺流程相比,A/O工艺具有流程简单、构筑物少、基建费用低、不需外加碳源、出水水质高等优点。
后置式反硝化系统,因为混合液缺乏有机物,一般还需要人工投加碳源,但脱氮的效果可高于前置式,理论上可接近100%的脱氮。
交替工作的生物脱氮流程主要由两个串联池子组成,通过改换进水和出水的方向,两个池子交替在缺氧和好氧的条件下运行。
该系统本质上仍是A/O系统,但其利用交替工作的方式,避免了混合液的回流,因而脱氮效果优于一般A/O流程。
其缺点是运行管理费用较高,且一般必须配置计算机控制自动操作系统。
3、生物膜系统将上述A/O系统中的缺氧池和好氧池改为固定生物膜反应器,即形成生物膜脱氮系统。
此系统中应有混合液回流,但不需污泥回流,在缺氧的好氧反应器中保存了适应于反硝化和好氧氧化及硝化反应的两个污泥系统。
二、物化除氮物化除氮常用的物理化学方法有折点氯化法、化学沉淀法、离子交换法、吹脱法、液膜法、电渗析法和催化湿式氧化法等。
生物脱氮新技术

生物脱氮新技术★废水物化脱氮技术1.空气吹脱法:利用废水中所含氨氮的实际浓度和平衡浓度之间存在的差异,在碱性条件下用空气吹脱,使废水中的氨氮不断地由液相转移到气相中,达到从废水中去除氨氮目的。
2.折点氯化法:将氯气或次氯酸钠投入污水,将废水中的氨氮氧化成N2的化学脱氮工艺。
可作单独工艺,也可对生物脱氮工艺的出水进行深度处理。
出水可控制氨氮在0.1mg/L。
3.选择性离子交换法:离子交换中固相交换剂和废水中NH4+间进行化学置换反应。
设备简单、易于操作,效率高;离子交换剂用量大,需频繁再生。
对废水预处理要求高,运行成本高。
4.化学沉淀法:投加Mg2+和PO43+,使之与氨氮生成难溶复盐MgNH4PO4·6H2O沉淀物,从而达到脱氮目的。
可以处理各种浓度的氨氮废水,特别是高浓度氨氮废水。
5.化学中和法:浓度大于2%-3%的氨的碱性废水要先考虑回收利用,制成硫铵。
不易回收的可与酸性水或废气(CO、CO2、SO2)中和,若中和后达不到要求,补加化学药剂再中和。
6.乳化液膜分离法:含氨废水以选择透过液膜为分离介质,在液膜两侧通过被选择透过物质(NH3)浓度差和扩散传递为推动力,使透过物质(NH3)进入膜内,达到分离的目的。
第一部分★传统废水生物脱氮过程和原理1.2.3.素矿化。
微生物:细菌、各种霉菌。
硝化作用指微生物将NH4+氧化成NO2-,再进一步氧化成NO3-的过程。
微生物:亚硝化菌:亚硝化单胞菌(Nitrosomonas),将NH4+氧化成NO2-;硝化菌:硝化杆菌(Nitrobacter),将NO2-氧化成NO3-。
(自养型微生物)反硝化作用将NO3-或NO2-还原成N2或N2O的过程。
微生物:硝化菌(异养型微生物)二、影响因素⑴ pH:通常把硝化段运行的pH控制在7.2-8.2,反硝化段pH控制在7.5-9.2 。
⑵温度:硝化反应适宜温度为30~35℃,在此范围反应速率随温度升高而加快。
污水处理技术之氨氮废水相关处理技术详解

污水处理技术之氨氮废水相关处理技术详解所属行业: 水处理关键词:氨氮废水生物脱氮脱氮工艺过量氨氮排入水体将导致水体富营养化,降低水体观赏价值,并且被氧化生成的硝酸盐和亚硝酸盐还会影响水生生物甚至人类的健康。
因此,废水脱氮处理受到人们的广泛关注。
目前,主要的脱氮方法有生物硝化反硝化、折点加氯、气提吹脱和离子交换法等。
消化污泥脱水液、垃圾渗滤液、催化剂生产厂废水、肉类加工废水和合成氨化工废水等含有极高浓度的氨氮(500mg/L以上,甚至达到几千mg/L),以上方法会由于游离氨氮的生物抑制作用或者成本等原因而使其应用受到限制。
高浓度氨氮废水的处理方法可以分为物化法、生化联合法和新型生物脱氮法。
物化法Vol.01吹脱法在碱性条件下,利用氨氮的气相浓度和液相浓度之间的气液平衡关系进行分离的一种方法。
一般认为吹脱效率与温度、pH、气液比有关。
而控制吹脱效率高低的关键因素是温度、气液比和pH。
在水温大于25 ℃,气液比控制在3500左右,渗滤液pH控制在10.5左右,对于氨氮浓度高达2000~4000mg/L的垃圾渗滤液,去除率可达到90%以上。
吹脱法在低温时氨氮去除效率不高。
采用超声波吹脱技术对化肥厂高浓度氨氮废水(例如882mg/L)进行了处理试验。
最佳工艺条件为pH=11,超声吹脱时间为40min,气水比为1000:1试验结果表明,废水采用超声波辐射以后,氨氮的吹脱效果明显增加,与传统吹脱技术相比,氨氮的去除率增加了17%~164%,在90%以上,吹脱后氨氮在100mg/L以内。
为了以较低的代价将pH调节至碱性,需要向废水中投加一定量的氢氧化钙,但容易生水垢。
同时,为了防止吹脱出的氨氮造成二次污染,需要在吹脱塔后设置氨氮吸收装置。
在处理经UASB预处理的垃圾渗滤液(2240mg/L)时发现在pH=11.5,反应时间为24h,仅以120r/min的速度梯度进行机械搅拌,氨氮去除率便可达95%。
而在pH=12时通过曝气脱氨氮,在第17小时pH开始下降,氨氮去除率仅为85%。
脱氮除磷污水处理工艺
BCFS工艺是在帕斯韦尔氧化沟(Pasveersloot)与 UCT工艺及原理的基础上开发的生物除磷脱氮新工 艺,它由5个功能相对专一的反应器组成,通过控 制反应器之间的3个循环来优化各反应器内细菌的 生存环境,具有污泥产率低、除磷脱氮效率高(均 大于90%)等特点,其出水总氮<5mg/L,正磷酸 盐含量几乎为零。
该工艺的本质是通过控制环境温度造成两类细菌不同的增长 速率,利用该动力学参数的不同造成“分选压力” 。使用无需污 泥停留(以恒化器方式运行,其SRT=HRT)的单个CSTR反应器来实 现,在较短的HRT(即SRT)和30 ~40℃的条件下,可有效地通过种群 筛选产生大量的亚硝酸盐氧化菌,并使硝化过程稳定地控制在亚 硝化阶段,以
NO2-为硝化终产物。SHARON工艺适用于含高浓度氨 (>500mg/L)废水的处理工艺,尤其适用于具有脱氮要求的预处 理或旁路处理,如污泥消化池上清夜的处理。目前荷兰已有两家 污水处理厂采用了此工艺。
SHARON工艺主要有2个反应条件,一是碱度,另一是温 度。从方程式中可看出1molNH+4需要1molHCO-3,若 碱度供应不足,pH会迅速下降,若降至6 4以下,反应将停止,这与 传统的硝化反应相似。另一方面温度要求25℃以上。温度是用 以使亚硝化菌占优势从而控制硝化过程。图1显示了温度对亚硝 化菌和硝化菌的最小泥龄的影响。当温度高于15℃时,亚硝化菌 的最小泥龄低于硝化菌的最小泥龄,因此在高温度条件下(图中为 35℃)通过控制泥龄,可将长泥龄的硝化菌清洗出系统,保证硝化 过程停留在半硝化(NO-2)阶段。
污水中氨氮的主要去除方法

本文摘自再生资源回收-变宝网()污水中氨氮的主要去除方法近20年来,对氨氮污水处理方面开展了较多的研究。
其研究范围涉及生物法、物化法的各种处理工艺,目前氨氮处理实用性较好国内运用最多的技术为:生物脱氮法、氨吹脱汽提法、折点氯化法、化学沉淀法、离子交换法、液膜法、土壤灌溉法等。
一、生物法1.生物法机理——生物硝化和反硝化机理在污水的生物脱氮处理过程中,首先在好氧条件下,通过好氧硝化菌的作用,将污水中的氨氮氧化为亚硝酸盐或硝酸盐;然后在缺氧条件下,利用反硝化菌(脱氮菌)将亚硝酸盐和硝酸盐还原为氮气而从污水中逸出。
因而,污水的生物脱氮包括硝化和反硝化两个阶段。
生物脱氮工艺流程见图1。
硝化反应是将氨氮转化为硝酸盐的过程,包括两个基本反应步骤:由亚硝酸菌参与的将氨氮转化为亚硝酸盐的反应;由硝酸菌参与的将亚硝酸盐转化为硝酸盐的反应。
在缺氧条件下,由于兼性脱氮菌(反硝化菌)的作用,将硝化过程中产生的硝酸盐或亚硝酸盐还原成N2的过程,称为反硝化。
反硝化过程中的电子供体是各种各样的有机底物(碳源)。
生物脱氮法可去除多种含氮化合物,总氮去除率可达70%—95%,二次污染小且比较经济,因此在国内外运用最多。
但缺点是占地面积大,低温时效率低。
2.传统生物法目前,国内外对氨氮污水实际处理中应用较成熟的生物处理方法是传统的前置反硝化生物脱氮,如A/O、A2/O工艺等,都能在一定程度上去除污水中的氨氮。
传统生物脱氮途径一般包括硝化和反硝化两个阶段,硝化和反硝化反应分别由硝化菌和反硝化菌作用完成,由于对环境条件的要求不同,这两个过程不能同时发生,而只能序列式进行,即硝化反应发生在好氧条件下,反硝化反应发生在缺氧或厌氧条件下。
由此而发展起来的生物脱氮工艺大多将缺氧区与好氧区分开,形成分级硝化反硝化工艺,以便硝化与反硝化能够独立地进行。
1932年,Wuhrmann利用内源反硝化建立了后置反硝化工艺(post-denitrification),Ludzack 和Ettinger于1962年提出了前置反硝化工艺(pre-denitrification),1973年Barnard结合前面两种工艺又提出了A/O工艺,以及后又出现了各种改进工艺如Bardenpho、Phoredox(A2/O)UCT、JBH、AAA工艺等,这些都是典型的传统硝化反硝化工艺。
废水脱氮的具体指标一级标准氨氮≤15mg

(三)影响硝化-反硝化的因素
2.影响反硝化作用的因素 – 营养物质:需足够有机碳源( BOD5/T-N >3) – DO:活性污泥<0.5mg/L,生物膜<1.5mg/L – 温度:最适:40 ℃ – pH :活性(6-8,最适:7.0-7.5),产物种类
环境微生物学
(三)影响硝化-反硝化的因素
5、污泥龄 为使硝化菌能在连续流的反应系统中存活并维持一定数量,微
生物在反应器的停留时间即污泥龄应大于硝化菌的最小世代期。一 般应取系统的污泥龄为硝化最小世代期的两倍以上。较长的污泥龄 可增强硝化反应的能力,并可减轻有毒物质的抑制作用。
环境微生物学
(三)影响硝化-反硝化的因素
环境微生物学
第三节 氮磷污水的生物处理
一、生物脱氮技术 (一)生物脱氮的基本原理
– 硝化作用:氨态氮经微生物的氧化而成为硝酸态氮的 过程。
环境微生物学
NH4 2O2 硝化 菌NO3- H2O 2H
第三节 氮磷污水的生物处理
一、生物脱氮技术 (一)生物脱氮的基本原理
反硝化反应的最佳温度范围为35~45℃,温度对硝化菌的影响比 反硝化菌大。
环境微生物学
(三)影响硝化-反硝化的因素
2.溶解氧 硝化反应必须在好氧条件下进行,一般应维持混合液的溶解氧浓
度为2~3mg/L,溶解氧浓度0.5~0.7 mg/L,是硝化菌可以忍受的极 限。硝化可在高溶解氧状态下进行,高达60mg/L的溶解氧浓度也不会 抑制硝化的进行,为了维持较高的硝化速率,污泥龄降低时要相应地 提高溶解氧浓度。溶解氧对反硝化反应有很大影响,主要由于氧会同 硝酸盐竞争电子供体。同时分子态氧也会抑制硝酸盐还节 氮磷污水的生物处理
污水处理脱氮工艺概述

度
三级处理(tertiary),也称高级(advanced)处理:
是在一级、二级处理的基础上,对难降解的有
机物、氮、磷等营养性物质进行进一步处理。
城市污水经传统的二级处理以后,虽然 绝大部分悬浮固体和有机物被去除了,但还 残留微量的悬浮固体和溶解的有害物,如氮 和磷等的化合物。氮、磷为植物营养物质, 能助长藻类和水生生物,引起水体的富营养 化,影响饮用水水源。
Contents
1
污水处理分类与方法
2
氮的生物去除原理
3
传统生物脱氮工艺
4
新型生物脱氮工艺
污水处理分类与方法
污水处理分类
一级处理(primary):也叫初级处理,该过程
只能除去废水中的大颗粒的悬浮物及漂浮物,
按
很难达到排放标准。
处
理
二级处理(secondary):一般可以除去细小的或
的 程
呈胶体态的悬浮物及有机物,一般能达到排放 标准。
硝化过程的影响因素:
(b)混合液中有机物含量不应过高:硝化 菌是自养菌,有机基质浓度并不是它的增殖限 制因素,若BOD值过高,将使增殖速度较快的 异养型细菌迅速增殖,从而使硝化菌不能成为 优势种属。
(c)硝化反应的适宜温度是20~30℃,15℃ 以下时,硝化反应速度下降,5℃时完全停止。
硝化过程的影响因素:
A2O脱氮工艺
内回流(硝化液)
污水 反硝化池
厌氧
反硝化池 缺氧
硝化池/去除 BOD\氨氮
好氧
外回流(污泥回流)
排水 排泥
原水分段进去各段缺氧区,从而使得原水中的碳源可以充分 用作反硝化碳源;由于原水分段进入各段,使得系统前后污泥浓度 形成一定的梯度,前端高污泥浓度可以提高系统的抗冲击能力;同 时分段进水工艺无需硝化液回流,使得该工艺的运行费用降低。
活性污泥的脱氮除磷原理及应用

在好氧条件下聚磷菌的积累可以简化的方式描述 如下: C2H4O2+0.16NH+4+1.2O2+0.2PO3-4 0.61C5H7NO2+1.2CO2+0.2HPO3(聚磷)+0.44OH+1.44H2O 在缺氧条件下, C2H4O2+0.16NH+4+0.96NO-3+0.2PO3-4 0.61C5H7NO2 +1.2CO2 +0.2HPO3(聚磷)+ 1.4OH+0.96H2O+0.48N2 在厌氧条件下,聚磷菌释放磷可以简写如下 C2H4O2+ HPO3(聚磷)+ H2O (C2H4O2)2 (贮存的有机物)+H2O + PO3-4
1.2—3.5 70—870mg BOD/(gMLSS· h) 16% CH3OH/gC5H702 N
30℃ θ=1.1
0.21—1.08 7mg NH4+- N /(gMLSSh) 0.04—0.13 mg SS/ mg NH4+- N能量 转换率为5%—35%
30℃ θ=1.1
0.28—1.44 0.02 0.02—0.07 mg VSS/mg N02--N能 量转换率10%—30%
杆状细菌 .
(2)环境因素对硝化反应的影响
※硝化菌对环境条件的变化极为敏感
①溶解氧—— 氧是电子受体,DO不能低于1.0mg/l 硝化需氧量(NOD)——4.57g(氧)/g(N) ②碱度——7.1g碱度(以CaCO3计)/1g氨态氮(以N计),一 般碱度不低于50mg/l ③PH——对PH变化敏感(硝化菌),最佳值8.0-8.4,效率最高 ④温度——适应20-30℃,15℃时硝化速度下降,低于5℃完全停 止 ⑤有机物——BOD应低于15-20mg/l ⑥污泥龄(SRT)——微生物在反应器内的停留时间(θc) N>(θc)Nmin,硝化菌最小的世代时间(θc)Nmin ⑦重金属机有害物质 重金属对硝化反应抑制 高浓度NH4+—N,高浓度NOx-—N
高盐废水脱氮技术分析

高盐废水脱氮技术分析厌氧氨氧化(anaerobic ammonia oxidation, ANAMMOX)技术是目前已知的最简单、最经济的生物脱氮技术, 自1995年被发现后就备受研究学者的关注.到目前为止, 人类已经发现了厌氧氨氧化菌的5个属, 其中只有1个属(Candidatus scalindua)是海洋性的, 且研究已证实Candidatus scalindua在海洋氮循环过程中发挥着关键性的作用:Ward等[5]研究发现海洋中30%~50%的N2 产出与厌氧氨氧化菌有关; Dalsgaard等研究发现由海洋厌氧氨氧化活动产生的N2 量约占全球N2 生成量的1/3~2/3;Thamdrup等用15N元素示踪法研究表明波罗的海沉积物中高达67%的N2 生成和海洋厌氧氨氧化作用相关. Schouten等发现海洋厌氧氨氧化菌能影响无机碳的固定, 从而对全球气候变化产生重要影响.因此对海洋厌氧氨氧化研究的不断深化不仅有利于海洋氮循环系统的完善, 而且能为全球气候的变化提供理论依据.许多行业废水, 如水产养殖废水、海产品加工废水等, 盐度较高, 不利于淡水厌氧氨氧化菌的生长, 使高盐废水的脱氮处理更困难. Kartal等研究发现经海水驯化可培养出耐盐性的淡水厌氧氨氧化菌, 但驯化时间长, 且盐度一旦超过30 g·L-1, 就会强烈抑制淡水厌氧氨氧化菌的活性, 使脱氮效果降低.与淡水厌氧氨氧化菌相比, 海洋厌氧氨氧化菌本身生长的环境就是高盐度的海洋环境(30‰~35‰, 30~35 g·L-1), 不需要经过漫长的盐度驯化就能在30 g·L-1以上的盐度环境中发挥高效的厌氧氨氧化活性, 因此可用其直接处理高盐废水, 使高盐废水的脱氮处理更加简单易行.虽然海洋厌氧氨氧化菌广泛存在于海洋环境中, 但分布却十分分散, 很难直接从海洋环境中得到高浓度的菌种, 这就对海洋厌氧氨氧化菌在废水处理方面的实际应用造成困难, 因此探究如何有效地富集培养海洋厌氧氨氧化菌就显得格外重要.目前国内对这方面研究主要还是体现在淡水厌氧氨氧化菌的富集培养上, 对海洋厌氧氨氧化菌的富集培养却鲜见报道.本试验以黄海胶州湾的底泥作为接种污泥, 进水为全海水, 在25℃条件下探究了海洋厌氧氨氧化菌的富集培养及其脱氮特性, 以期为海洋厌氧氨氧化在高盐废水处理方面的实际应用提供理论和技术指导.1 材料与方法1.1 接种污泥本试验使用的污泥是来自胶州湾的底泥, 黑色泥状, 带有臭味.污泥在进入反应器之前首先要进行淘洗, 去除里面的杂质.淘洗液的成分为0.01 g·L-1的KH2PO4、0.005 6 g·L-1的CaCl2与0.3 g·L-1的MgSO4.用淘洗液反复淘洗3次, 每次15 min, 将其静置30 min, 待污泥沉淀完全后倒掉上层的淘洗液, 然后将淘洗后的污泥倒入ASBR反应器.1.2 试验用水本试验用海水(5L)作为ASBR反应器的进水, 加入0.029 g·L-1的KH2PO4、0.136 g·L-1的CaCl2、1.2 g·L-1的KHCO3和0.3 g·L-1的MgSO4·7H2O, 微量元素Ⅰ和Ⅱ各1 mL·L-1.其中微量元素Ⅰ的成分及含量:EDTA为5 g·L-1, FeSO4·7H2O为5 g·L-1; 微量元素Ⅱ的成分及含量:EDTA为15 g·L-1, H3BO4为0.014 g·L-1, MnCl2·4H2O为0.99 g·L-1, CuSO4·5H2O为0.250 g·L-1, ZnSO4·7H2O为0.430 g·L-1, NiCl2·6H2O为0.190 g·L-1, CoCl2·6H2O为0.24 g·L-1, NaSeO4·10H2O为0.21 g·L-1.海水取自黄海(青岛麦岛周边),NH4+-N与NO2--N分别由NH4Cl与NaNO2按需提供, 将进水NH4Cl与NaNO2的初始浓度均设置为110 mg·L-1, 用1 mol·L-1的盐酸将进水pH控制在7.5±0.1范围, 进水用高纯氮气(纯度为99.99%)曝气15 min后导入ASBR反应器.1.3 试验装置试验用序批式厌氧活性污泥反应器(anaerobic sequencing batch reactor, ASBR)作为海洋厌氧氨氧化菌富集培养过程的反应器, 进水(3 min)、反应(10 h/24 h)、沉淀(45 min)、出水(2 min).反应器的结构如图 1所示:该反应器是由有机玻璃制成的圆柱体, 总体积为8 L, 有效体积为7 L.器壁的垂直方向上设有3个取样口, 取样口与排水口处的橡胶管均用夹子夹住, 防止空气中的O2进入反应器.曝完气的海水通过进水泵导入反应器, 出水通过出水管排出.反应器内设电动搅拌装置, 机械搅拌速率为80 r·min-1, 外部为水浴控温系统, 将温度控制在25℃左右.整个反应器的外围包裹一层黑布, 以防止光对海洋厌氧氨氧化菌产生抑制作用.1.取样口及进出水口;2.排泥口;3.搅拌;4.水浴循环进出水口;5.水浴恒温控制器;6.水封;7.进水蠕动泵;8.水浴循环蠕动泵;9.储水箱图 1 ASBR反应器装置示意1.4 分析项目与方法氨氮:纳氏试剂分光光度法; 亚硝酸盐氮:N-(1-萘基)-乙二胺光度法; 硝酸盐氮:麝香草酚分光光度法; pH/ORP:德国WTW pH/ORP/Oxi 340便携式pH计; 温度:水银温度计; 紫外/可见分光光度计:UV-5200.SEM检测:在沉淀中加入2.5%的戊二醛5 mL, 置于4℃冰箱中固定4 h; 用0.1 mol·L-1, pH为8.0的磷酸缓冲溶液冲洗3次, 每次10 min; 分别用浓度为30%、50%、70%、90%的乙醇进行脱水, 每次15 min, 再用100%的乙醇脱水3次, 每次15 min; 然后加入100%乙醇与乙酸异戊酯的混合液(体积比为1:1) 及纯乙酸异戊酯各一次进行置换, 每次15 min; 对样品真空干燥后, 喷金, 通过扫描电镜(HITACHIS-4300) 观察污泥形态.2 结果与讨论2.1 海洋厌氧氨氧化菌富集培养过程根据反应器中海洋厌氧氨氧化菌的脱氮特性将整个富集培养过程分为4个阶段:菌体自溶阶段(1~15 d)、活性迟滞阶段(16~152 d)、活性提高阶段(153~183 d)与稳定运行阶段(184~192 d).2.1.1 菌体自溶阶段(1~15 d)反应器水力停留时间(HRT)设置为24 h, NH4+-N与NO2--N的起始浓度均为110 mg·L-1, 历经15 d, 完成菌体自溶期.如图 2所示:出水NH4+-N的浓度高于进水, 对NH4+-N的去除率为负值, 但随着反应器的运行, 进出水NH4+-N的浓度差逐渐减小至零; 对NO2--N的去除率明显下降, 仅经过8 d, 就由第1 d的84.44%降至24.25%;该阶段几乎没有NO3--N生成.出现该现象的原因是:刚进入反应器的菌体不适应新环境自溶释放出有机氮, 进而被分解成NH4+-N, 而厌氧条件下, 唯一消耗NH4+-N的海洋厌氧氨氧化菌数量极少, 活性极弱, 使NH4+-N的消耗量小于生成量; 在接种污泥中存在着分布广泛的异养反硝化菌, 它们以死亡的菌体作为有机碳源, 将NO2--N与NO3--N转化成N2, 使出水NO2--N与NO3--N的浓度下降.在8~15 d, 对NO2--N的去除速率较1~8 d平缓, 可能是菌体已适应新环境, 自溶作用减弱, 释放的有机碳减少, 使反硝化菌活性下降, 对NO2--N与NO3--N的转化速率下降.第15 d, 对NO2--N的去除率已降至10.78%, 此时出水NH4+-N的浓度为116.10mg·L-1, 低于进水, 对NH4+-N的去除率为0.6%, 开始出现正值, 这标志着菌体自溶阶段结束.图 2 富集培养期间反应器主要指标变化该阶段n(NO2--N):n(NH4+-N)为负值, 且波动很大, 只有少数几天出现正值情况;n(NO3--N):n(NH4+-N)很小, n(NH4+-N):n(NO2--N):n(NO3--N)未呈现一定的规律, 与理论比(1:1.32:0.26) 相差甚远, NRRNH4+-N为负值, 表明此阶段海洋厌氧氨氧化菌活性极低, 几乎为零, 异养反硝化菌占反应器主体.出水pH为8.03~8.34, ΔpH为0.48~0.81, 差值较大, 这是由于该阶段反硝化作用强烈, 产生大量碱度的缘故.进水ORP为-25~-31 mV,出水ORP值为-59~-79 mV, 波动大.该阶段污泥仍为黑色泥状, 且污泥表现出来的特性与淡水厌氧氨氧化菌富集培养过程表现出来的特性一致.2.1.2 活性迟滞阶段(16~152 d)如图 2所示:16~50 d, NH4+-N的去除率不稳定, 波动很大, 甚至出现负值情况, 但大多数情况下为正值, 且去除率很低; 期间NH4+-N去除率最大值出现在第37 d, 为16.61%, 到第50 d, 去除率仅为1.35%;NO2--N的去除率总体呈下降趋势, 第16 d, 去除率为13.05%, 第47 d, 去除率降至1.63%;该阶段有少量NO3--N生成, 平均生成量为0.77 mg·L-1.这是由于NH4+-N的去除仅仅依赖海洋厌氧氨氧化菌的作用, 但该菌数量少, 活性低, 且该阶段依然存在菌体自溶现象, 导致NH4+-N的去除率低且不稳定; 对NO2--N的去除依赖海洋厌氧氨氧化菌与异养反硝化菌的共同作用, 该阶段异养反硝化菌仍占优势, 因此对NO2--N的去除贡献最大的反应依然是反硝化反应, NO2--N去除率下降标志着反硝化菌活性下降.n(NH4+-N):n(NO2--N):n(NO3--N)波动大, 未呈现一定的规律, 且n(NO2--N):n(NH4+-N)与n(NO3--N):n(NH4+-N)均小于理论值, 这可能是异养反硝化菌将NO3--N转化成NO2--N, 减少了NO2--N的净消耗量与NO3--N的生成量, 造成NO2--N的累积. NRRNH4+-N平均值为0.005 4 kg·(m3·d)-1, 很低且波动大, 有时甚至出现负值, 表明海洋厌氧氨氧化菌活性及其微弱.出水pH为7.7~8.0, 较自溶期有所下降.到第50 d, NH4+-N和NO2--N的去除率分别降至1.35%与2.62%, 可能是进水基质浓度(NH4+-N与NO2--N均为110 mg·L-1)过高对海洋厌氧氨氧化菌的活性产生抑制所致.该过程初步表明海洋厌氧氨氧化菌对高浓度的进水基质较敏感, 基质浓度过高不利于海洋厌氧氨氧化菌的富集培养.考虑到高浓度基质对菌的抑制作用, 从第51 d开始, 按海洋厌氧氨氧化反应方程式中NH4+-N与NO2--N的消耗比(1:1.32) 配水, 并将进水NH4+-N与NO2--N的浓度分别降至80mg·L-1与105.6mg·L-1.如图 2所示:反应刚开始, NH4+-N与NO2--N的去除率均略微升高(3%左右), 但并未出现持续升高现象, 而是有明显波动, 但总体呈小幅度上升趋势,第82 d, NH4+-N与NO2--N的去除率分别为22.88%与11.15%;且该阶段有明显的NO3--N生成, 平均生成量为1.51mg·L-1. n(NO2--N):n(NH4+-N)基本高于1.32, 而n(NO3--N):n(NH4+-N)基本低于0.26, 且波动均较大, 表明反硝化菌与海洋厌氧氨氧化菌对NO2--N的总消耗量大于反硝化作用NO2--N的生成量. NRRNH4+-N波动变小, 且有升高的趋势, 但基本都在0.01 kg·(m3·d)-1以下.出水pH为7.7~7.9, ORP值为-38~-46 mV, 均比高基质浓度的波动范围小, 说明降低进水基质浓度有利于海洋厌氧氨氧化菌的富集.淡水厌氧氨氧化菌活性提高的方法有两个, 一是提高反应基质的浓度; 二是缩短水力停留时间(HRT).因为海洋厌氧氨氧化菌在迟滞期初期就初步显示了对较高浓度基质敏感性的特点, 所以本试验考虑用第二种方法提高菌的活性.在第82 d, 将HRT由24 h缩短到10 h, 其余条件不变.如图 2所示:NH4+-N去除率只是略微上升, 但随后并未出现预期的持续上升现象, 而是出现明显波动, 且呈下降趋势, 到第107 d, 去除率降至7.66%, 猜想可能是HRT缩短使反应器中氮容积负荷(NLR)过高, 对海洋厌氧氨氧化菌产生较大冲击, 使脱氮效果变差.随后NH4+-N去除率略微上升, 到117 d, 升至13.73%;第82~111 d, 对NO2--N的去除率基本在10%以下, NO3--N生成量在1mg·L-1以下; 随后NO2--N的去除量与NO3--N生成量总体呈上升趋势, 到117 d, NO2--N去除率升至23.61%, NO3--N生成量为4.64 mg·L-1.该阶段NRRNH4+-N波动大[0.003 4~0.051 kg·(m3·d)-1], 但总体呈先升高后降低, 随后又升高的趋势, 第117 d, NRRNH4+-N为0.027 kg·(m3·d)-1.该阶段初步表明海洋厌氧氨氧化菌抗氮容积负荷的冲击能力差, 对HRT变化较敏感.第118 d, 保持HRT不变, 将进水NH4+-N与NO2--N的浓度分别降至50 mg·L-1与66 mg·L-1, 通过降低基质浓度来缓解高NLR对海洋厌氧氨氧化菌的冲击影响.如图 2所示:反应前期NH4+-N的去除率逐渐升高, 到122 d, 升至36.79%, 随后去除率逐渐下降, 仅经过4 d, 就降至1.6%, 最后又略微升高, 第131 d, 去除率为16.52%;NO2--N去除量和NO3--N的生成量与NH4+-N的变化一致. NRRNH4+-N仍波动较大[0.001 7~0.046kg·(m3·d)-1], 说明此时海洋厌氧氨氧化菌活性仍不稳定, 依然处于活性迟滞阶段.该现象表明短HRT造成的高NLR会对海洋厌氧氨氧化菌的活性产生抑制, 且不能通过降低基质浓度的方法消除.因此, 第132 d保持进水基质浓度不变, 将HRT重新延长至24 h, 如图 2所示:第132~143 d, NH4+-N与NO2--N的去除率总体升高, 143 d, 分别升至36.79%与14.57%, NRRNH4+-N由0.009 2 kg·(m3·d)-1升至0.016 kg·(m3·d)-1, 随后NH4+-N与NO2--N的去除率均下降, 到152 d, 分别降至4.8%与4.64%, NRRNH4+-N由0.011 kg·(m3·d)-1降至0.002 8 kg·(m3·d)-1, 从153 d开始, NRRNH4+-N持续上升, 这标志着菌体迟滞期结束.海洋厌氧氨氧化菌富集培养过程中活性迟滞时间为137 d, 占整个富集培养时间的2/3以上. Yu等用厌氧污泥富集培养淡水厌氧氨氧化菌时, 活性迟滞时间为30 d; Tang等用UASB反应器富集培养淡水厌氧氨氧化菌的迟滞期为29 d; Wang等用好氧硝化污泥富集培养淡水厌氧氨氧化菌时, 迟滞期仅有20 d.由此可见, 海洋厌氧氨氧化菌富集培养过程中活性迟滞时间要远长于淡水厌氧氨氧化菌, 这使海洋厌氧氨氧化菌的富集培养更难.2.1.3 活性提高阶段(153~183 d)从153 d开始, NH4+-N与NO2--N的去除率均持续升高, 第155 d, 去除率分别为11.76%与5.9%, 第164 d, 去除率分别为30.18%与32.93%, 第174 d, 去除率分别为70.9%与50.91%, 第183 d, 出水NH4+-N的浓度仅为0.37 mg·L-1, NO2--N的浓度仅为0.323 mg·L-1, 去除率分别升至99.47%与99.54%, 几乎达到100%. NO3--N的生成量由0.668 8 mg·L-1升至14.11 mg·L-1; NRRNH4+-N由0.003 5 kg·(m3·d)-1升至0.069 kg·(m3·d)-1, 海洋厌氧氨氧化菌活性明显提高.该阶段n(NH4+-N):n(NO2--N):n(NO3--N)为1:1.15:0.23, 接近理论比(1:1.32:0.26) , 这标志着海洋厌氧氨氧化菌已完全取代异养反硝化菌, 成为反应器的主体菌.出水pH为7.7~7.9, ORP为-37~-43 mV.本试验仅用30 d, NH4+-N与NO2--N的去除率就从7.19%与6.87%分别升至99.47%与99.54%, 活性提高期低于整个富集培养时间的1/6.赖玮毅等历经60 d才使淡水厌氧氨氧化菌活性显著提高, Xing等用污水处理厂的活性污泥富集培养淡水菌时, 活性提高期为69 d.因此前者在活性提高阶段比后者历时短.2.1.4 稳定运行阶段(184~192 d)第184 d, 将进水NH4+-N与NO2--N的浓度分别升至80 mg·L-1与105.6 mg·L-1, 如图 2所示:NH4+-N去除率稳定上升, 从起初的75.52%提升到96.98%, 而NO2--N的去除率均稳定在85%以上, 最高去除率能达到98.4%. n(NH4+-N):n(NO2--N):n(NO3--N)为1:(1.2±0.2):(0.22±0.06), 接近理论比(1:1.32:0.26) . NRRNH4+-N由0.062 kg·(m3·d)-1升至0.080 kg·(m3·d)-1, 出水pH为7.9~8.06, ORP为-49~-62 mV.本试验用黄海胶州湾的底泥, 经192d成功富集培养了海洋厌氧氨氧化菌, 在稳定运行期, NH4+-N与NO2--N的去除率分别为96.98%与95.66%. Gong等在富集培养淡水厌氧氨氧化菌时, 经120 d对NH4+-N与总氮的去除率就分别达到88.7%与83.77%;Chen等在UASB反应器中仅用40 d, 就实现了淡水厌氧氨氧化菌活性的显著提高, 此时NRR为0.55 kg·(m3·d)-1; Wang等经61 d实现了淡水厌氧氨氧化菌的富集, 对NH4+-N与NO2--N去除率均能达到91%以上.由此可见, 海洋厌氧氨氧化菌的富集培养时间要远长于淡水厌氧氨氧化菌, 但稳定运行时, 前者的脱氮效果更好.原因可能是海洋水体成分复杂, 含有众多元素及少量有机质, 其中含有的某种成分对海洋厌氧氨氧化菌的脱氮产生促进作用, 具体原因还有待探究.2.2 不同阶段周期内反应器脱氮特性海洋厌氧氨氧化菌的富集培养过程具有不同的阶段特征, 为了比较4个阶段沿程NH4+-N、NO2--N、NO3--N、pH与ORP的变化情况, 在第15、152、183与192 d, 每隔1 h 测一次水样, 看反应器内各个指标的沿程变化情况.如图 3所示:在菌体自溶期, 反应器中NH4+-N的浓度沿程波动较大, 且未呈现一定的规律; NO2--N的浓度逐渐降低, 由109.31 mg·L-1降至97.53 mg·L-1, 变化较平缓, 去除量仅为11.78 mg·L-1; NO3--N生成量仅为0.23 mg·L-1, 此现象与菌体自溶作用有关; 迟滞期NH4+-N、NO2--N、NO3--N、pH与ORP 沿程变化极平缓, 几乎无变化, 这是由于海洋厌氧氨氧化菌的活性延迟所致; 在活性提高期与稳定运行期, NH4+-N与NO2--N的沿程变化可分为3个阶段: ①前5 h, 浓度下降较平缓, 可能是废水的进入改变了反应器内的环境, 海洋厌氧氨氧化菌对新环境不适应使其活性发生延迟所致, 本试验得出的菌活性延迟时间为5 h.于德爽等在研究淡水厌氧氨氧化菌富集培养时发现:由进出水导致的菌活性延迟时间仅为0.8 h, 王晓霞等在用2:1的好养短程硝化污泥与厌氧氨氧化污泥富集淡水厌氧氨氧化菌时, 发现该时间为2 h, 均小于5 h.由此可见, 海洋厌氧氨氧化菌抗水力冲击能力更弱, 对新环境的适应能力远小于淡水厌氧氨氧化菌. ② 5~19 h, 浓度下降迅速, 充分显示出海洋厌氧氨氧化活性. ③ 19~24 h, 浓度下降平缓, 可能是反应器中NH4+-N与NO2--N的浓度较低, 低浓度基质满足不了海洋厌氧氨氧化菌的生长需求, 使其活性降低, 对NH4+-N与NO2--N的去除速率下降.图 3 周期内不同阶段各指标的变化情况4个阶段pH值均沿程不断上升, 开始时, pH值分别为7.48、7.44、7.56、7.54, 周期结束时, pH值分别为8.02、7.55、7.83、8.06, ΔpH分别为0.54、0.11、0.27、0.52.由此可见:菌体自溶期与稳定运行期pH上升速率明显快于活性迟滞期与活性提高期, 可能是这两个阶段的主体菌分别是具有高活性的反硝化菌与海洋厌氧氨氧化菌, 它们分别发生强烈的反硝化作用与厌氧氨氧化作用, 产生的碱度最多, pH上升速率最快; 在迟滞期, 反硝化菌活性低, 且厌氧氨氧化菌活性延迟, 因此迟滞期的pH值上升速率最慢. ORP值的变化情况与pH类似, 4个阶段ORP值均沿程不断下降, 由开始的-25、-23、-29、-28 mV分别降至-58、-29、-45、-62 mV, ΔORP分别为-33、-6、-16、-34 mV; 菌体自溶期与稳定运行期ORP下降速率明显快于活性迟滞期与活性提高期, 其原理与pH值变化原理相同.2.3 富集培养过程中污泥性状的变化污泥进入反应器之前为黑色泥状[图 4(a)], 带有臭味, 经淘洗后接种到ASBR反应器, 运行51 d, 污泥由黑色变为黑褐色, 仍为泥状, 未形成颗粒, 污泥沉降性能差; 51~83 d, 污泥由黑褐色泥状变为褐色絮状[图 4(b)], 但污泥沉降性能依然很差; 第132 d, 反应器中开始出现隐隐约约暗红色絮状污泥; 132~173 d, 暗红色絮状污泥逐渐变成浅红色小颗粒状[图 4(c)], 污泥沉降性能好; 在稳定运行阶段, 污泥转化为砖红色大颗粒状[图 4(d)], 将此阶段的污泥用10倍显微镜观察, 如图 5(a)所示:该污泥为砖红色颗粒状的圆球体, 内部有少量黑色物质, 结构紧密, 边缘较光滑, 与文献报道的成熟的厌氧氨氧化菌的形态类似.经扫描电镜观察, 该污泥是由大量的球状菌经胞外多聚物黏聚而成菌团.因此, 同淡水厌氧氨氧化菌富集培养类似, 也可以用污泥性状的变化来反映海洋厌氧氨氧化菌的富集情况.具体参见污水宝商城资料或更多相关技术文档。
污水生物法脱氮除磷技术及应用

3.同时生物脱氮除磷典型工艺
混合液回流 Ri 出水 进水 厌氧池 好氧池 沉淀池
缺氧池
回流污泥 R 剩余污泥
图2-23 典型的 好氧池 二沉池 出水
剩余污泥 污泥回流 (a)流程1
混合液回流 进水 前置缺氧池 出水 厌氧池 缺氧池 好氧池 二沉池
⑥有毒物质 硝化与反硝化过程都受有毒物质的影响,硝化菌 更易受到影响。对硝化菌有抑制作用的有毒物质有 Zn、Cu、Hg、Cr、Ni、Pb、CN-、HCN等。
3)生物脱氮的典型工艺
混合液回流
进水
缺氧池
好氧池
二沉池
出水
污泥回流
空气
剩余污泥
图2-20 A/O生物脱氮工艺流程
2.污水生物除磷
1)生物除磷基本原理
③ pH值 硝化菌对pH值变化十分敏感,pH值在7.0~7.8时, 亚硝酸菌的活性最好;而硝酸菌在pH值为7.7~8.1时 活性最好。反硝化最适宜的pH值在7.0~7.5。 ④碳氮比 对于硝化过程,碳氮比影响活性污泥中硝化细菌所 占的比例,过高的碳氮比将降低污泥中硝化细菌的比 例。
⑤泥龄 硝化过程的泥龄一般为硝化菌最小世代时间的2 倍以上。当冬季温度低于10℃,应适当提高泥龄。
剩余污泥 污泥回流
(b)流程2
同时生物脱氮除磷A2/O的变形工艺
4、Bardenpho同步脱氮除磷工艺
工艺特点: 各项反应都反复进行两次以上,各反应单元都有其首要功 能,同时又兼有二、三项辅助功能; 脱氮除磷的效果良好。
5、UCT工艺
—含NO3-N的污泥直接回流到厌氧池,会引起反硝化作用, 反硝化菌将争夺除磷菌的有机物而影响除磷效果,因此 提出UCT(Univercity of Cape Town)工艺。
生物脱氮基本原理

生物脱氮基本原理作者:weidongwin阅读:994次上传时间:2005-10-13推荐人:weidongwin (已传论文17套)简介:进行生物脱氮可分为氨化-硝化-反硝化三个步骤。
由于氨化反应速度很快,在一般废水处理设施中均能完成,故生物脱氮的关键在于硝化和反硝化。
关键字:生物脱氮基本原理氨化硝化反硝化同化生物脱氮是在微生物的作用下,将有机氮和NH3-N转化为N2和N x O气体的过程[1]。
废水中存在着有机氮、NH3-N、NO x--N等形式的氮,而其中以NH3-N和有机氮为主要形式。
在生物处理过程中,有机氮被异养微生物氧化分解,即通过氨化作用转化为成NH3-N,而后经硝化过程转化变为NO x--N,最后通过反硝化作用使NO x--N转化成N2,而逸入大气。
由此可见,进行生物脱氮可分为氨化-硝化-反硝化三个步骤。
由于氨化反应速度很快,在一般废水处理设施中均能完成,故生物脱氮的关键在于硝化和反硝化。
1. 氨化作用氨化作用是指将有机氮化合物转化为NH3-N的过程,也称为矿化作用。
参与氨化作用的细菌称为氨化细菌。
在自然界中,它们的种类很多,主要有好氧性的荧光假单胞菌和灵杆菌、兼性的变形杆菌和厌氧的腐败梭菌等。
在好氧条件下,主要有两种降解方式,一是氧化酶催化下的氧化脱氨[2]。
例如氨基酸生成酮酸和氨:(2-1)丙氨酸亚氨基丙酸法丙酮酸另一是某些好氧菌,在水解酶的催化作用下能水解脱氮反应。
例如尿素能被许多细菌水解产生氨,分解尿素的细菌有尿八联球菌和尿素芽孢杆菌等,它们是好氧菌,其反应式如下:(2-2)在厌氧或缺氧的条件下,厌氧微生物和兼性厌氧微生物对有机氮化合物进行还原脱氨、水解脱氨和脱水脱氨三种途径的氨化反应。
(2-3)(2-4)(2-5)2. 硝化作用硝化作用是指将NH3-N氧化为NO x--N的生物化学反应,这个过程由亚硝酸菌和硝酸菌共同完成,包括亚硝化反应和硝化反应两个步骤。
该反应历程为:亚硝化反应 (2-6)硝化反应 (2-7)总反应式(2-8)亚硝酸菌有亚硝酸单胞菌属、亚硝酸螺杆菌属和亚硝酸球菌属。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
吹脱(气提)法
空气吹脱法工艺流程图:
CaO或NaOH
进水
pH调节池
沉淀池
排泥
空气
氨和尾气
吹 脱 塔
出水
吹脱(气提)法
低浓度氨氮废水:室温下空气吹脱; 高浓度氨氮废水:蒸汽吹脱。
1000 1000 2500
水体中氮素的来源与危害
2. 氨氮废水的工业来源
氨氮废水的工业来源及其浓度
来源
氨氮浓度(mg/L)
化肥废水:
氨和尿素生产 氨-硝酸废水
200 ~ 940 130
混合化肥
600
铁-锰高炉废水
110
发电厂清洗水
2800
炼油废水 酒厂废水 制革废水
600 ~ 1400 110 ~ 380 80 ~ 160
1gNH4+-N
需要氧4.57g
碱度7.14g (以CaCO3计)
1gNO3−-N
1.每氧化1gNH4+-N为NO3−-N需要消耗碱度7.14g(以CaCO3计) (100/14=7.14)
注:每氧化14gNH4+-N为NO3−-N,产生2molH+,需要1mol 的CaCO3(分子量为100)来中和。
1.5H 2O 2.5H
1.5Cl
NH3-N 浓度
氯 浓 度
余氯
总加氯量 折点
Cl2:NH3-N 重量比
理论折点氯化曲线
折点加氯法法
重要工艺参数:
(1)准确控制氯投加量: 理论投氯量(以氯气计):NH3-N=7.6:1 实际投加量(以氯气计)通常为: (8:1)-(10:1)
(2)控制pH,控制反应副产物NO3-和NCl3; 控制pH在中性条件下进行。
生物法脱氮的基本原理
3. 反硝化作用(Denitrification )
硝酸盐和亚硝酸盐态的氮在反硝化菌的作用下被还原的过程。
NO3--N
硝态氮 NO3-N 亚硝态氮 NO2-N
NO2--N
NO
N2O
N2
同化反硝化
(细菌组成部分)
有机氮化合物
反硝化菌
氮气(主要过程)
异养型兼性菌
异化反硝化
反硝化作用(Denitrification)
NH 2Cl HOCl NCl3 H 2O
NH
4
4HOCl
HNO3
5H
4Cl
H 2O
(3)反应时间:1min;
离子交换法
基本原理:
nR A B n Rn B n nA
废水中的NH4+与阳离子交换树脂中的阳离子进行交换。 对NOx-和有机氮没有效果。
物化法脱氮的比较
常用物化法脱氮技术比较
处理 方法
处理范围及效果 进水(mg/L) 出水(mg/L)
缺点
费用估算 (元/kgNH3-N)
空气吹脱 <500
<100
低温时,效率差; 用石灰易结垢。
5~10/m3污水
蒸汽吹脱 >500
200左右
蒸汽费用高, 15~20 /m3污水
折点氯化
<30
<0.1 费用高,副产物。
水体中氮素的来源与危害
1. 水体中氮素的来源
大 气 降 水 降 尘
非 市 区 径 流
生 物 固 氮
城 市 污 水
浸 滤 液
大
地
气
表
沉
径
降
流
自然来源
人类活动
水体
水体中氮素的来源与危害
污染源
点源 (Point sources)
通过排放口 集中排放污染物
非点源,面源 (Non-point sources)
+4H
+4H
+4H
2HNO3 -2H2O
2HNO2 -2H2O
HON=NOH -H2O
+4H
2NH2OH +2H
-2H2O
-2H2O +2H
N2O -H2O
2NH3 (同化反硝化) N2 (异化反硝化)
反硝化作用(Denitrification)
反硝化过程中需要的有机物总量可按下式估算:
C=2.86[NO3--N]+1.71[NO2--N]+DO
反硝化菌属异养型兼性厌氧菌,广泛存在于土 壤和污水处理系统中。
⑴在有分子态DO存在时,它们氧化分解有机物,利用分子
氧作为最终电子受体;
⑵在无分子氧的条件下,它们以NO2-N或NO3-N为电子受体, 以有机物为电子供体,而将氮还原;
①同化反硝化,最终产物是有机氮化合物,是菌体的组成部分;
②异化反硝化,最终产物主要是分子态的氮气。
式中: C ——反硝化需要的有机物总量, 按BOD5计(mg/L);
[NO3--N]——污水中硝态氮的浓度(mg/L); [NO2--N]——污水中亚硝态氮的浓度(mg/L);
DO ——污水中溶解氧的浓度(mg/L)。
如果废水中缺少有机碳源,则应补加有机物,一般投加甲醇, 这是因为甲醇分解的产物是CO2与H2O,不残留任何难降解的 中间产物。
阴性 8~36 专性 严格好氧 0.04~0.08
硝酸菌 椭球或棒状 0.5~1.0μm
阴性 12~59 专性 严格好氧 0.02~0.06
0.04~0.13
0.02~0.07
0.6~3.6
0.3~1.7
异养菌
2.31~8.69 异养
0.08~0.3 0.4~0.8 25~100
硝化作用(Nitrification)
水体中氮素的来源与危害
3. 氮在水体中的存在形态
蛋白质 (C, O, N, H, N=15~18%)
多肽
H
有机氮 氨基酸
R C COOH NH2
尿素[CO(NH2)2]
其他(硝基、胺及铵类化合物)
无机氮
氨氮(NH3-N, NH4+-N) 亚硝态氮(NO2- -N)
硝态氮(NO3--N)
水体中氮素的来源与危害
水华 赤潮
2004年6月 浙江近海
水体中氮素的来源与危害
4. 氮素污染的危害
增加了给水处理的成本; 例如:加氯消毒 8~10gCl2/gNH3-N
引起水体缺氧;
NH4+ +
2O2
→
-
NO3
+2H+
+ H2O + 能量
14gN 64gO2 每氧化1gNH4-N为NO3-N,共需要氧4.57g
水体中氮素的来源与危害
来源
有机氮浓度 (mg/L)
400~1000 纺织废水
8
制药废水
500
180
锅炉渣洗水 10~260
水体中氮素的来源与危害
2. 氨氮废水的工业来源
氨氮废水的工业来源及其浓度
来源
焦炉废水: 稀氨水 氨蒸馏出水
煤的气化废水: 焦碳 无烟煤 褐煤
氨氮浓度(mg/L)
4000 ~ 5000 50 ~ 200
常用的离子交换剂:沸石(Zeolite)
沸石是含水的钙、钠以及钡、钾的硅铝酸盐矿物, 一般用化学式(M, N2)·O·AlO3 ·nSiO2 ·mH2O表示。 废水中的NH4+与沸石中的M+, N2+进行交换。
离子交换法
工艺流程:
进水(二级处理+过滤)
NH4+
沸石 离子 交换柱
NH4+ 补充再生液
重要的工艺参数:
(1)pH=10.5-11.5;
(2)水力负荷:2.4-7.2m3/(m2.h);
(3)气液比:填料高度>6m时,G/L=2200-2300;
(4)蒸汽用量:0.125~3 t蒸汽/ 1m3水
泡罩塔:0.08 t蒸汽/1m3水, 浮阀塔:0.13 t蒸汽/1m3水。
1.0MPa蒸汽 价格在180-200元/吨
影响硝化反应的环境因素
环境因素 微生物对生化环境的 要求
温度
4~45℃
亚硝酸菌: 30~35 ℃
硝酸菌: 35~42 ℃
溶解氧 1.5~2.0mg/L以上
工程参数 15~35 ℃
> 2.0mg/L
pH
亚硝酸菌: 7.0~7.8
硝酸菌: 7.7~8.1
7.2~8.0
硝化作用(Nitrification)
折点加氯法
基本原理:
Cl2 H2OHOCl H Cl
NH
4
HOCl
NH 2Cl H 2O H
NH 2Cl 0.5HOCl 0.5N2 0.5H 2O 1.5H 1.5Cl
NH
4
1.5HOCl
0.5N2
废水脱氮理论与技术
Nitrogen removal from wastewater: principles and technique氮素的来源与危害 二. 氮素污染控制 三. 生物脱氮原理 四. 废水生物脱氮工艺与技术 五. 废水生物脱氮新型处理技术
1 水体中氮素的来源与危害
>40
离子交换 10~50
1~3
沸石再生费用高。
10~15
3 生物脱氮的基本原理
生物法脱氮的基本原理
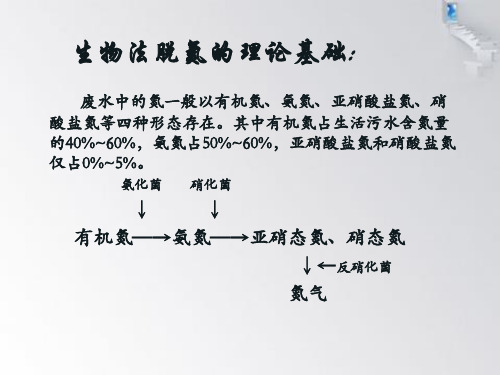
污水中氮主要以有机氮和氨氮的形式存在,通常只含有 少量亚硝酸盐和硝酸盐形态的氮。
氨化菌
亚硝酸菌+O2
