国内药品辅料批文
关于各种批文的说明

关于各种批文的说明一、药品:凭药品经营许可证经营范围及相关经营批件经营,经营范围在营业执照上登记。
一)国产药品批准文号格式:国药准字H(Z、B、j、S、F、T)+4位年数+4位顺序(例:国药准字Z20140023)其中 Z:中药; B:保健药品; j:进口药品分包装; S:生物制品; F:药用辅料; H:化学药品; T:体外生物诊断试剂(药品类管理的体外诊断试剂)二)新药证书号批准文号格式:国药证字H(Z、S)+4位年号+4位顺序三)进口药品注册证批文格式:进口药品注册证号:H(Z、S)+4位年号+4位顺序;医药产品注册证号:H(Z、S)C+4位年号+4位顺序四)补充申请批件或补充批件:改变、增加或者取消原批准事项或者内容的,提出补充申请,审批部门同意后,发给补充申请批件,补充申请批件有效期与原注册批件(或再注册批件)有效期一致。
注:进口药品分包装,应当是药品GM P生产企业申请,发给药品批准证明文件。
药品类批文一般有效期为5年二、医疗器械:凭借二类备案凭证或三类许可证经营,一类不需要备案或许可,一、二、三类须在营业执照上登记。
一)二类、三类医疗器械注册证格式:注册证编号的编排方式为:(审批部门所在地简称)+械注+(注册形式)+4位年份+管理类别+产品分类编码+4位流水数。
其中审批部门所在地的简称: 境内第三类医疗器械、进口第二类、第三类医疗器械为“国”字;境内第二类医疗器械为注册审批部门所在地省、自治区、直辖市简称;注册形式: “准”字适用于境内医疗器械;“进”字适用于进口医疗器械;“许”字适用于香港、澳门、台湾地区的医疗器械;(例:浙械注准20152400434)二)一类医疗器械备案凭证格式:一类医疗器械备案编排格式为:(备案部门所在地简称)+械备+4位年份+4位流水号。
其中:备案部门所在地简称:进口第一类医疗器械为“国”字;境内第一类医疗器械为备案部门所在地省、自治区、直辖市简称加所在地设区的市级行政区域的简称(无相应设区的市级行政区域时,仅为省、自治区、直辖市的简称);(例:浙杭械备20150324号)医疗器械注册证有效期一般为5年,2014年10以前的批文有效期一般为4年,一类备案凭证批文一般无有效期。
食品药品监管总局关于调整原料药、药用辅料和药包材审评审批事项的公告

食品药品监管总局关于调整原料药、药用辅料和药包材审评审批事项的公告【法规类别】药品管理【发文字号】食品药品监管总局公告2017年第146号【发布部门】国家食品药品监督管理总局【发布日期】2017.11.23【实施日期】2017.11.23【时效性】现行有效【效力级别】XE0303食品药品监管总局关于调整原料药、药用辅料和药包材审评审批事项的公告(食品药品监管总局公告2017年第146号)为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)与《国务院关于取消一批行政许可事项的决定》(国发〔2017〕46号),取消药用辅料与直接接触药品的包装材料和容器(以下简称药包材)审批,原料药、药用辅料和药包材在审批药品制剂注册申请时一并审评审批。
现就有关事项公告如下:一、药品注册申请人在中华人民共和国境内提出的注册分类2.2、2.3、2.4、3、4、5类药品制剂申请所使用的原料药,以及各类药品注册申请所使用的药用辅料、药包材适用于本公告要求。
二、自本公告发布之日起,各级食品药品监督管理部门不再单独受理原料药、药用辅料和药包材注册申请,国家食品药品监督管理总局药品审评中心(以下简称药审中心)建立原料药、药用辅料和药包材登记平台(以下简称为登记平台)与数据库,有关企业或者单位可通过登记平台按本公告要求提交原料药、药用辅料和药包材登记资料,获得原料药、药用辅料和药包材登记号,待关联药品制剂提出注册申请后一并审评。
三、原料药登记资料主要内容:基本信息、生产信息、特性鉴定、原料药的质量控制、对照品、药包材、稳定性等。
具体内容应当符合《关于发布化学药品新注册分类申报资料要求(试行)的通告》(国家食品药品监督管理总局通告2016年第80号)中原料药药学申报资料要求。
四、药用辅料登记资料主要内容:企业基本信息、辅料基本信息、生产信息、特性鉴定、质量控制、批检验报告、稳定性研究、药理毒理研究等。
药辅批文

辅料批文大全纤维素-乳糖Molkerei MEGGLE Wasserburg GmbH & Co.KG (德国美剂乐) 进口注册证号H20040548 进口注册标准JX20040026 80目炉甘石粉湖南尔康制药有限公司湘食药辅准字F20060004 部颁药品标准二部第5册苹果酸湖南尔康制药有限公司湘食药辅准字F20080019 GB/T 13737-92 L-苹果酸香兰素湖南尔康制药有限公司湘食药辅准字F20080023 GB 3861-83肉桂油湖南尔康制药有限公司湘食药辅准字F20080026 GB 11958-89磷酸湖南尔康制药有限公司湘食药辅准字F20080013 GB3149-2004十六醇湖南尔康制药有限公司湘食药辅准字F20080016 GB/T 16451-1996十八醇湖南尔康制药有限公司湘食药辅准字F20080017 GB/T 16451-1996十六十八醇湖南尔康制药有限公司湘食药辅准字F20080018 GB/T 16451-1996山梨酸钾湖南尔康制药有限公司湘食药辅准字F20080014 GB/T 13736-92单硬脂酸甘油酯湖南尔康制药有限公司湘食药辅准字F20080015 GB 1986-89二氧化硅湖南尔康制药有限公司湘食药辅准字FB20080002 HG 2791-1996海藻酸钠湖南尔康制药有限公司湘食药辅准字F20080024 GB 1976-80胆固醇湖南尔康制药有限公司湘食药辅准字F20080025 部颁标准二部六册玉米油湖南尔康制药有限公司湘食药辅准字F20080029 中国药典2005年版精制硫酸湖南尔康制药有限公司湘食药辅准字F20080032 中国药典1953年版三氯甲烷湖南尔康制药有限公司湘食药辅准字F20050008 中国药典2005版硫酸锌湖南尔康制药有限公司国药准字H43020200 中国药典2005版辛酸钠成都华邑药用辅料制造有限责任公司川药准字F20080007中国生物制品主要原辅料材料质控标准2000年版硫代硫酸钠成都华邑药用辅料制造有限责任公司川药准字F20080006 中国药典2005年版二部硬脂(A型、BM型)法国生产(上海源础科贸)进口注册证号H20050438 进口药品注册标准JX20040067 硬脂酸聚烃氧(40)酯南京威尔化工有限公司苏药准字(1982)第288101号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F20080002 中国药典2005年版蔗糖勐永药业公司滇药准辅字(2003)第021号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F20070002 中国药典2005年版二部苏州市中泰药用辅料有限公司苏药准字(2008)第429001号中国药典2005年版乙二胺湖南尔康制药有限公司湘食药辅准字F20070004 YY0208-95重质碳酸镁盘锦兴海制药有限公司国药准字H21022413 《中国药典》2005年版二部药用微丸丸芯杭州高成生物营养技术有限公司浙药准字F20060074号沪Q/WS-1-2274-2001上海华高药用丸芯有限公司沪药准字FF20010002 《中国药典》2005年版二部中国药科大学制药有限公司苏药准字(2003)第427401号江苏省药品标准依地酸二钠杭州利人药业有限公司国药准字H33022048 国家药监局药品标准WS-10001-(HD-1075)-2002 湖南尔康制药有限公司湘食药辅准字F20060009 国家药品标准化药地标升国标第11册月桂氮卓酮广州精细化学工业有限公司粤卫药准字(87)F-01号《中国药典》2005年版二部天门科捷制药有限公司国药准字H42021823 中国药典2005年版河南新乡高金药业有限公司豫药准字F2004005 中国药典2005年版预胶化淀粉湖州展望药业有限公司(88)浙卫药准字F-01号《中国药典》2005年版二部安徽山河药用辅料有限公司皖药准字(2001)第F004485号山东聊城阿华制药有限公司鲁卫药准字(1998)第052621号《中国药典》2005年版二部山东新大精细化工有限公司鲁药准字(2004)第208002号《中国药典》2005年版二部济南东风制药厂有限公司鲁药准字(2001)第027370号《中国药典》2005年版二部曲阜市药用辅料有限公司鲁药准字(2000)第582003号《中国药典》2005年版二部山东孔府药厂鲁卫药准字(1999)第123443号《中国药典》2005年版二部曲阜市天利药用辅料有限公司鲁药准字(2003)第631506号《中国药典》2005年版二部浙江中维药业有限公司浙卫药准字(2005)第227001号《中国药典》2005年版二部营口奥达制药辽卫药准字(1998)第700411号《中国药典》2005年版二部美国卡乐康注册证号:H20020064 进口药品注册标准Colorcon (美国进口)进口药品注册证号:F20060001 进口药品注册标准JX20010227玉米朊吴江市八坼药用辅料厂苏卫药准字(1995)400101号《江苏省药品标准》95版国家药监局药品标准WS-10001-(HD-0499)-2002高邮市日星药用辅料有限公司苏药准字(2004)第400102号中国药典WS-10001(HD-0499)-2002湖南尔康制药有限公司湘食药辅准字F20080022 中国药典2005年版右旋糖苷右旋糖苷20江苏黄海药业有限公司国药准字H19993719 《中国药典》2005年版二部上海华茂药业有限公司国药准字H20043859 国家食药监局标准YBH06892004 (高于中国药典)右旋糖酐40永安华源制药有限公司国药准字H34021186 《中国药典》2005年版二部山东金洋药业有限公司国药准字H37021686 《中国药典》2005年版二部许昌双马万通制药有限公司国药准字H41021034 《中国药典》2005年版二部硬脂酸镁湖州展望药业有限公司浙卫药准字(1996)第221401号中国药典2005年版湖州展望药业有限公司浙药准字F20060056号《中国药典》2005年版二部安徽山河药用辅料有限公司皖药准字(2001)第F004488号《中国药典》2005年版二部山东聊城阿华制药有限公司鲁卫药准字(1998)第052430号《中国药典》2005年版二部曲阜市天利药用辅料有限公司鲁药准字(2003)第631507号《中国药典》2005年版二部东营市清华海洋化工有限责任公司鲁药准字(2002)第201001号《中国药典》2005年版二部曲阜市药用辅料有限公司鲁药准字(2002)第582010号《中国药典》2005年版二部温州青山精细化工厂浙卫药准字(1996)第221402号《中国药典》2005年版二部浙江海盐六和淀粉化工有限公司浙卫药准字(2003)第221403号《中国药典》2005年版二部山东新大精细化工有限公司鲁药淮字(2005)第208004号《中国药典》2005年版二部营口奥达制药浙卫药准字(1996)第221401号《中国药典》2005年版二部浙江中维药业有限公司浙药准字(2005)第221404号《中国药典》2005年版二部山东兰鲸集团有限公司鲁卫药准字(2002)第202001号中国药典2005年版二部河南精忠威尔药业有限公司豫药准字F20040003号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F20060006 《中国药典》2005年版二部湖州展望化学药业有限公司浙卫药准字(1998)第231801号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F20060005 中国药典2005年版乙基纤维素泸州化工厂医药辅料厂川药准字(2001)第014096号WS-10001-(H-0486)-2002浙江中维药业有限公司浙药准字(2005)第226001号《中国药典》2005年版二部泰安瑞泰纤维素有限公司鲁药准字(2001)第520002号《中国药典》2005年版二部山东赫达股份有限公司鲁药准字(2003)第101003号《中国药典》2005年版二部山东聊城阿华制药有限公司鲁药准字(2002)第052372号《中国药典》2005年版二部乙基纤维素混悬液天津市爱勒易医药材料科技有限公司国药准字F20070007卡乐康进口注册证号P2******* 进口药品注册标准JX19990161乙醇太仓新太酒精有限公司苏卫药准字(2002)第200602号《中国药典》2005年版二部宁波万隆食用酒精有限公司浙卫药准字(2006)第228001号《中国药典》2005年版二部安徽安特生物化学有限公司皖药准字F20030003 中国药典2005年版广西桂西制药国药准字Z45020098 《中国药典》2005年版二部南京化学试剂厂苏卫药准字(2002)第200603号《中国药典》2005年版二部南京化学试剂有限公司苏卫药准字(1986)第200603号《中国药典》2005年版二部丰原宿州生物化工有限公司皖药准字F20030004 《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F20050014 《中国药典》2005年版二部徐州香醅酒业有限公司苏药准字(2007)第200605号中国药典2005年版郓城县明泉酒业有限公司鲁药准字(2001)第021001号《中国药典》2005年版二部山东金源医药酒精有限公司鲁药准字(2000)第598369号《中国药典》2005年版二部山东酒精总厂鲁卫药准字(1999)第630442号《中国药典》2005年版二部肥城市康王酒业有限公司鲁卫药准字(1995)第562001号《中国药典》2005年版二部山东鲁中酿酒总厂鲁卫药准字(1997)第622357号《中国药典》2005年版二部德州又一村酿酒有限公司鲁药准字(2001)第612001号《中国药典》2005年版二部山东金彩山酒业有限公司鲁药准字(2005)第580001号《中国药典》2005年版二部盐酸半胱氨酸湖北省潜江市四维氨基酸有限公司国药准字H19993457 中国药典2005年版L-盐酸赖氨酸上海协和氨基酸有限公司国药准字H31020298 中国药典2005年版杭州木材公司活性炭分公司浙卫药准字(1996)第139501号《中国药典》2005年版二部衢州市云合炭业有限公司浙药准字(2003)第39503号中国药典临安市华南活性炭有限公司浙药准字(2003)第139502号《中国药典》2005年版二部上海活性炭厂有限公司FF2002001(767,769,781)《中国药典》2005年版二部新干县申新活性炭厂赣食药准字F20040003 《中国药典》2005年版二部氧化锌安庆市造漆厂有限公司皖卫药准字(1996)第102287号中国药典2005年版氧化镁河北邢台冶金镁业有限公司国药准字H13022032 中国药典2005年版二部江苏鹏鹞药业国药准字H32026265 中国药典2005年版羊毛脂上海华亭羊毛脂厂沪卫药准字(1995)第078001号中国药典2005年版恩凯化学(南京)有限公司苏药准字(2007)第428601号中国药典2005年版湖南尔康制药有限公司湘食药辅准字F20060007 中国药典2005年版亚硫酸氢钠湖南尔康制药有限公司湘食药辅准字F20050013 《中国药典》2005年版二部纤维醋法酯苏州立新制药有限公司苏卫药准字(1999)第238002号《中国药典》2005年版二部盐酸南京化学试剂有限公司苏药准字(2008)第428701号《中国药典》2005年版二部湖南尔康制药有限公司湘药准字F20050003 《中国药典》2005年版二部成都华邑药用辅料制造有限责任公司川药准字F20080008 《中国药典》2005年版二部稀盐酸杭州利人药业有限公司浙卫药准字(1996)第177101号《中国药典》2005年版二部湖南尔康制药有限公司国药准字H43020202 《中国药典》2005年版二部南京化学试剂有限公司苏药准字(2008)第274601号中国药典2005年版广东省台山市新宁制药有限公司国药准字H44020356 中国药典2005年版无水枸橼酸湖南尔康制药有限公司湘食药辅准字F20060011 WS-10001-(HD-1564)-2005无水碳酸钠湖南尔康制药有限公司国药准字H43020195 中华人民共和国卫生部药品标准(二部)第五册无水葡萄糖河北圣雪葡萄糖有限责任公司国药准字H13022457 《中国药典》2005年版二部无水硫酸钠南京化学试剂有限公司苏药准字(2008)第428801号《中国药典》2005年版二部无水亚硫酸钠湖南尔康制药有限公司湘食药辅准字F20050002 《中国药典》2005年版二部微晶纤维素J.Rettenmaier & Sohne Gmbh+Co(德国进口) 进口药品注册证号:H20040131 进口药品注册标准JX20000294 J.Rettenmaier & Sohne Gmbh+Co(德国进口) 进口药品注册证号:H20040130 进口药品注册标准JX20000294 J.Rettenmaier & Sohne Gmbh+Co(德国进口) 进口药品注册证号:H20040132 进口药品注册标准JX20000294 上海昌为医药辅料技术有限公司进口药品注册证号JX20000294 中国药典2005版二部上海青平药业有限公司(上海天平胃舒平制药厂) 沪卫药准字(1995)第061004号安徽山河药用辅料有限公司皖药准字(2001)第F004487号《中国药典》2005年版二部湖州展望药业有限公司浙卫药准字(1996)第224101号《中国药典》2005年版二部湖州展望药业有限公司浙药准字F20060050号《中国药典》2005年版二部无锡市凯利药业有限公司苏卫药准字(2000)第340602号中国药典2000年版山东新大精细化工有限公司鲁药淮字(2005)第208003号中国药典2005版山东聊城阿华制药有限公司鲁卫药准字(1998)第052432号《中国药典》2005年版二部曲阜市药用辅料有限公司鲁药准字(2002)第582007号《中国药典》2005年版二部曲阜市天利药用辅料有限公司鲁药准字(2002)第631504号《中国药典》2005年版二部泰安瑞泰纤维素有限公司鲁药准字(2005)第520007号《中国药典》2005年版二部常熟市药用辅料有限公司苏药准字(2001)第340601号《中国药典》2005年版二部营口奥达制药辽卫药准字(1996)第000468号中国药典2005版美国FMC 进口药品注册证号H20020518~H20020522 进口药品注册标准JX20010316浙江中维药业有限公司浙药准字(2005)第224102号《中国药典》2005年版二部Asahi Kasci Chemicals Corporation(日本进口) 进口药品注册证号: H20050313 进口药品注册标准JX20020103吐温80(聚山梨酯80)温州清明化工有限公司浙卫药准字(1996)第184102号《中国药典》2005年版二部江苏晨牌药业有限公司苏卫药准字(1992)第295601号中国药典2005年版南京威尔化工有限公司苏卫药准字(2001)第423201号《中国药典》2005年版二部大连旅顺化工厂国药准字H21021050 中国药典2000年版上海申宇医药化工有限公司沪卫药准字(1995)第186001号《中国药典》2005年版二部龙游聚兴粮油医药化工有限公司浙卫药准字(1996)第184101号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F20060003 中国药典2005年版甜菊素成都菊乐制药厂川卫药准字(90)F-04-02号中国药典2005年版江苏健佳药业有限公司苏药准字(2005)第428301号中国药典2005年版北京天安甜菊糖制品有限公司京卫药准(1996)第1670001号中国药典北京天安甜菊糖制品有限公司京卫药准(92)第124号《中国药典》2005年版二部曲阜香州食品有限责任公司国药准字20040666 《中国药典》2005年版二部山东曲阜香州食品有限公司国药准字H20041106 GB8270-1999天津南大凯泰药业有限公司津卫药准字(1991)第002319号中国药典2005年版二部湖南尔康制药有限公司湘食药辅准字F20080028 中国药典2005年版碳酸氢钠自贡鸿鹤制药有限责任公司国药准字H51021274 《中国药典》2005年版二部北京凌云建材化工有限公司国药准字H11021163 中国药典上海虹光化工厂国药准字H31022716 《中国药典》2005年版二部供注射用上海虹光化工厂国药准字H31022717 《中国药典》2005年版二部河北华晨药业有限公司国药准字H10983107 《中国药典》2005年版二部碳酸钙上海碳酸钙厂国药准字H31020140 《中国药典》2005年版二部上海耀华纳米科技有限公司国药准字H31020137 中国药典碳酸钠湖南尔康制药有限公司国药准字H43020195 部颁标二部第五册三氯叔丁醇湖南尔康制药有限公司湘食药辅准字F20080007 中国药典2005年版部分预胶化淀粉美国卡乐康注册证号:H20060001 进口药品注册标准JX20010227三硅酸镁山东聊城阿华制药有限公司鲁卫药准字(1999)第052367号《中国药典》2005年版二部麝香草酚广州百花香料股份有限公司国药准字H44023847 WS-1-32-82-89司盘85(山梨醇酐三油酸酯)龙游聚兴粮油医药化工有限公司浙药准字(1996)第116301号浙江省药品标准DB33/WS-491-83-93水杨酸甲酯广州化学试剂厂粤卫药准字(1994)第100052号部颁标准江苏省洪兴化工厂国药准字H32024995 部颁标准佛山市南海中南药化厂国药准字H20043365 WS1-07(B)-89华阴市锦前程药业有限公司国药准字H20046738 WS1-07(B)-89湖南尔康制药有限公司湘食药辅准字F20080030 卫生部药品标准化学药品及制剂第一册石油醚辽阳华兴药用辅料有限公司辽卫药准字(2000)第700511号《中国药典》2005年版二部山梨酸湖南尔康制药有限公司湘食药辅准字F20070011 中国药典2005年版二部山梨醇广西南宁化学制药有限责任公司国药准字H45020273 《中国药典》2005年版二部华北制药华盈股份有限公司国药准字H19983074 《中国药典》2005年版二部石家庄华康制药有限公司国药准字H13022023 中国药典2005年版羧甲基纤维素钠淮南山河药用辅料有限公司皖药准字F20030001 中国药典上海赛璐珞厂沪卫药准字1995第125001号WS-10001-(HD-0486)-2002湖州展望药业有限公司浙药准字F20060055号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F20080012 WS-10001-(HD-0486)-2002 羧甲基纤维素湖州展望药业有限公司浙药准字F20060052号《中国药典》2005年版二部羧甲基淀粉钠湖州展望药用辅料有限公司浙卫药准字(1996)第221501号中国药典2005年版湖州展望药业有限公司浙药准字F20060059号《中国药典》2005年版二部安徽山河药业有限公司皖药准字(2001)第F004489号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F20080004 中国药典2005年版嘉兴白浪淀粉制品有限公司浙药准字(2004)第221502号《中国药典》2005年版二部曲阜市天利药用辅料有限公司鲁药准字(2002)第631505号《中国药典》2005年版二部浙江中维药业有限公司浙药准字(2005)第221503号《中国药典》2005年版二部无锡市凯利药业有限公司苏卫药准字(2000)第285401号《中国药典》2005年版二部连云港万泰医药材料有限公司苏卫药准字(2001)第285402号《中国药典》2005年版二部山东聊城阿华制药有限公司鲁卫药准字(1998)第052431号《中国药典》2005年版二部曲阜市药用辅料有限公司鲁药准字(2000)第582002号《中国药典》2005年版二部山东新大精细化工有限公司鲁药准字(2005)第208005号《中国药典》2005年版二部营口奥达制药有限公司辽卫药准字(1996)第000464号《中国药典》2005年版二部永日化学工业股份有限公司(中国台湾) 医药产品注册证号:HC20040037 进口药品注册标准JX20030193超级羧甲基淀粉钠中维药业有限公司浙药准字(2005)第221503号《中国药典》2005年版二部十二烷基硫酸钠湖南尔康制药有限公司湘食药辅准字F20060002 《中国药典》2005年版二部浙江豪森制药有限公司浙卫药准字(1996)第173403号乳酸无锡市第二制药厂国药准字H32023985 《中国药典》2005年版二部偃师乳酸有限公司国药准字H41022972 中国药典2005年版湖南尔康制药有限公司湘食药辅准字F20080031 GB2023-2003乳糖DMV International(荷兰)进口药品注册证号H20040369 进口药品注册标准JX20020301 Molkerei MEGGLE WasserburgGmbH & Co.KG (德国美剂乐)进口药品注册证号H20040359~H20040363 进口注册标准JX20040023 (6070、80、100、200目)湖南尔康制药有限公司湘食药辅准字F20080005 中国药典2005年版上海华茂药业有限公司沪卫药准字(1998)第239001号《中国药典》2005年版二部石家庄精晶药业有限公司冀药准字(2004)第015081号《中国药典》2005年版二部镇江市康富生物工程有限公司苏药准字(2007)第427702号《中国药典》2005年版二部上海运宏化工制剂辅料技术有限公司进口药品注册证号JX20020301 中国药典2005年版二部北京凤礼精求商贸有限公司经销国药准字H20030019 中国药典2005年版常州朗生生物工程有限公司苏药准字(2003)第427701号《中国药典》2005年版二部The lactose company ofNew Zealand Limited (新西兰进口) 进口药品注册证号:H20030019 进口药品注册标准JX20020090 The lactose company ofNew Zealand Limited (新西兰进口) 进口药品注册证号H20030038 JX20020090全氟丙烷核工业理化工程研究院国药准字F20080003琼脂福建泉州市泉港化工厂闽卫药准字(1996)第002360号《中国药典》2005年版二部氢氧化钾湖南尔康制药有限公司湘食药辅准字F20070001 YY0209-95氢氧化铝山东聊城阿华制药有限公司鲁卫药准字(1999)第052368号《中国药典》2005年版二部氢氧化钠湖南尔康制药有限公司湘食药辅准字F20050011 《中国药典》2005年版二部成都华邑药用辅料制造有限责任公司川药准字F20080001 中国药典2005年版二部羟丙基甲基纤维素湖州展望药业有限公司浙卫药准字(1996)第222201号《中国药典》2005年版二部安徽山河药用辅料有限公司皖药准字(2002)第F0003号中国药典2005年版营口奥达制药辽卫药准字(2000)第700542号中国药典2005年版泰安瑞泰纤维素有限公司鲁卫药准字(1995)第520001号《中国药典》2005年版二部日本Shin-Etsu Chemical 进口药品注册证号H20050403 中国药典2005年版美国药典28版浙江中维药业有限公司浙药准字(2005)第222202号《中国药典》2005年版二部The Dow Chemical Company(美国DOW公司进口) 进口药品注册证号:H20060085 进口药品注册标准JX20020062山东赫达股份有限公司鲁药准字(2002)第101001号《中国药典》2005年版二部山东聊城阿华制药有限公司鲁卫药准字(1999)第052366号《中国药典》2005年版二部曲阜市药用辅料有限公司鲁药准字(2002)第582009号《中国药典》2005年版二部卡乐康(上海)贸易有限公司进口药品注册证号:JX20020062羟丙基纤维素湖州展望药业有限公司浙药准字F20060054号《中国药典》2005年版二部湖州展望药业有限公司浙卫药准字(1996)第222001号《中国药典》2005年版二部安徽山河药用辅料有限公司皖药准字(2001)第F004486号中国药典2005年版山东聊城阿华制药有限公司鲁卫药准字(1998)第052620号《中国药典》2005年版二部营口奥达制药辽卫药准字(1994)第000446号中国药典2005年版浙江中维药业有限公司浙药准字(2005)第222002号《中国药典》2005年版二部无锡市凯利药业有限公司苏卫药准字(2000)第410301号中国药典2005年版曲阜市药用辅料有限公司鲁药准字(2002)第582009号《中国药典》2005年版二部山东赫达股份有限公司鲁药准字(2003)第101004号《中国药典》2005年版二部泰安瑞泰纤维素有限公司鲁药准字(2005)第520006号《中国药典》2005年版二部羟苯乙酯(尼泊金乙酯)广州汉普医药有限公司国药准字H44022620 《中国药典》2005年版二部太仓市新湖医药化工厂苏药准字(2002)第200608号《中国药典》2005年版二部广东台山新宁制药股份有限公司国药准字H44020160 《中国药典》2005年版二部扬州星斗药业有限公司苏卫药准字(1982)第212201号《中国药典》2005年版二部广州越秀制药厂粤卫药准字(1996)第123008号中国药典2000年版昆山市双友日用化工有限公司国药准字H32022763 《中国药典》2005年版二部浙江圣效化工有限公司浙药准字(2003)第224701号中国药典2000年版太仓市新湖医药化工厂苏卫药准字(2001)第200608号中国药典2005年版广东台山市新华制药厂国药准字H44020160 《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F20070012 中国药典2005年版羟苯甲酯(尼泊金甲酯)广东省台山市新宁制药厂国药准字H44020160 《中国药典》2005年版二部昆山市双友日用化工有限公司苏卫药准字(1987)第358001号江苏省药品标准1987年液状石蜡中国石化集团杭州炼油厂浙卫药准字(1996)第163901号《中国药典》2005年版二部杭州炼油厂浙卫药准字(1996)第166601号《中国药典》2005年版二部轻质液状石蜡中石化集团杭州炼油厂浙卫药准字(1996)第166601号WS1-80(B)-89吉林市吉化江城油脂化工有限公司吉卫药准字(1996)第211149号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F20060008 部颁二部1册葡萄糖潍坊盛泰药业有限公司国药准字H37022664 《中国药典》2005年版二部河南莲花英糖药业国药准字H19993019 《中国药典》2005年版二部山东祥瑞药业有限公司国药准字H20013420 《中国药典》2005年版二部华北制药康欣有限公司国药准字H13022450 《中国药典》2005年版二部石家庄市华营联合葡萄糖厂国药准字H13022090 WS1-05(B)-89潍坊盛泰药业有限公司国药准字H37022663 部颁标准WS1-05(B)-89秦皇岛骊骅淀粉股份公司国药准字H10973038 部颁标准硼酸自贡鸿鹤制药有限责任公司国药准字H51021268 《中国药典》2005年版二部北京燕京药业有限公司国药准字H11020496 《中国药典》2005年版二部广东台山市新华制药厂国药准字H44020353 中国药典2005年版葡甲胺上海医药(集团)有限公司国药准字H31020173 《中国药典》2005年版二部硼砂自贡鸿鹤制药有限责任公司国药准字H51021267 中国药典2005年版广东台山市新华制药厂国药准字H44020313 中国药典2005年版浓氨溶液南京化学试剂有限公司苏药准字(2008)第243401号中国药典2000年版湖南尔康制药有限公司国药准字H43020093 中国药典2005年版木糖醇浙江华康药业有限公司浙卫药准字(1998)第220902号《中国药典》2005年版二部明胶青海明胶股份有限公司青食药准字F2005001 GB2354-98蚌埠丰原明胶有限公司皖药准字F20050018 GB2354-98东光县亚星蜡制品厂冀卫药准字(2000)第060320号中国药典河北省东光县东方蜂蜡加工厂冀卫药准字(2002)第060319号中国药典罗赛洛(广东)明胶有限公司粤药准字F44030004 QB-2354-98罗赛洛(温州)明胶有限公司浙药准字(2003)第132302号中国药典2005年版二部罗赛洛(大安)明胶有限公司国药准字F20080005包头东宝乐凯彩感明胶股份有限公司国药准字F20080004甘肃明珠胶业有限责任公司国药准字F20070006海安县申宇明胶有限公司苏卫药准字(1987)第233802号中国药典2005年版二部威海永康明胶有限公司鲁卫药准字(1995)第597001号《中国药典》2005年版二部山东省沂水恒源胶业有限公司鲁药准字(2001)第571002号《中国药典》2005年版二部青岛益青明胶有限公司鲁药准字(2000)第512001号《中国药典》2005年版二部文登市明胶厂鲁卫药淮字(1995)第583001号《中国药典》2005年版二部。
辅料批文
药用辅料厂家及执行标准2008-08-04 19:51:18| 分类:默认分类| 标签:|字号大中小订阅序列辅料名称生产厂家批准文号执行标准A 桉叶油江西吉水县水南威霸药用香料提炼厂赣卫药准字(1985)第003284号部颁标准江西吉水县药用香料提炼厂赣卫药准字(1985)第003285号部颁标准昆山佳鹿香精香料公司国药准字Z32020249 中国药典2005年版二部佛山市南海中南药化厂国药准字H20057405 中国药典2005年版B 八角茴香油宝鸡市金森制药有限公司国药准字Z61021680 中国药典2005版白色油墨上海延安万象闵行药业有限公司沪卫药准字(1995)第019147号93版上海市药品标准倍他环糊精山东新大精细化工有限公司鲁药准字(2004)第208001号中国药典2005年版二部孟州华兴生物化工有限责任公司豫药准字(2001)辅383001号中国药典2005年版安徽山河药用辅料有限公司皖药准字F20030002号中国药典2005年版二部曲阜市天利药用辅料有限公司鲁药准字(2002)第631503号中国药典2005年版郁南县永光环状糊精有限公司粤药准字F44030001 中国药典2005年版二部礼泉化工有限实业公司陕卫药准字(1999)第006001号中国药典2005年版苯酚厦门东风药业有限公司国药准字H35020687 中国药典2000年版天津市天骄制药有限公司国药准字H12020622 中国药典2005年版第二部苯甲醇上海嘉华精细化工有限公司沪卫药准字(1995)第084006号中国药典2005年版徐州平光制药有限公司国药准字H32025022 中国药典2000年版二部苯甲酸天津津宝凯通福利化工厂国药准字H12020046 中国药典武汉有机实业股份有限公司国药准字H42021689 中国药典2000年版镇江前进化工有限公司国药准字H32024612 中国药典2005版二部苯甲酸钠武汉有机实业公司国药准字H42021690 中国药典2005年版溧水县观山精细化工有限公司国药准字H32025236 中国药典2000年版镇江前进化工有限公司国药准字H32024613 中国药典2000年版二部湖南尔康制药有限公司湘食药辅准字F20050006 中国药典2005年版苯扎氯铵上海经纬化工有限公司国药准字H31022874 中国药典2005年版二部5%苯扎溴铵上海运佳黄浦制药有限公司国药准字H31021811 中国药典2005年版二部薄荷素油(薄上海新嘉香料有限公司国药准字Z31020574 中国药典2005年版一部荷油)黄山天目药业有限公司国药准字Z34021098 中国药典2005年版二部安徽太岛薄荷药业有限公司国药准字Z34020003 中国药典上海新嘉香料有限公司国药准字H31020574 中国药典2005年版江西吉水县同仁天然香料厂赣卫药准字(1996)第083256号中国药典南通薄荷厂有限公司国药准字H32020273 中国药典2005年版薄荷脑黄山市天目药业有限公司国药准字Z34021097 中国药典2005年版二部安徽太岛薄荷药业有限公司国药准字Z34020002 中国药典上海新嘉香料有限公司沪卫药准字(1995)第145001号中国药典2005年版一部淮安香料油厂国药准字Z32020196 中国药典2005版丙二醇湖南尔康制药有限公司湘食药辅准字F20050012 中国药典2005年版二部锦化化工集团有限公司辽药准字F(2002)第900009号中国药典上海达昊化工新材料有限公司进口药品注册证号H20030196南京威尔化工有限公司苏药准字(2003)第214401号中国药典2005年版二部Lyondell Chemical Company(美国)国药准字H20030196 JX20010405美国利安德公司进口药品注册证号H20030196 中国药典2005年版二部丙烯酸树脂Ⅱ 湖州展望化学药业有限公司 浙药准字(2001)第224401号 中国药典2005年版二部 冰醋酸 广州化学试剂厂粤卫药准字(1996)第100040号 中国药典2005年版二部广东省台山市新宁制药厂国药准字H44020291中国药典2000年版薄膜包衣预混辅料(胃溶型) 湖州展望药业有限公司浙药准字(2001)第224502号药用薄膜衣片预混辅料(胃溶型)质量标准上海卡乐康包衣技术有限公司沪卫药准字(1998)第235001号 沪Q/WS-1-2273-99薄膜衣包衣剂 天津爱勒易医药材料公司 津卫药准字(2000)第002887号QB 天津市思露森医药材料科技有限公司 津食药监准字F20050003地方标准薄膜包衣粉 温州小伦包衣技术有限公司 浙卫药准字(2001)第224501号 浙药监注20016号文件 薄膜包衣预混剂 上海浦力膜制剂辅料科技公司沪卫药准字(1999)第028011号 沪Q/WS-1-2273-99上海卡乐康包衣技术有限公司沪卫药准字(1998)第235001号沪Q/WS-1-2273-99薄膜包衣预混剂(肠溶型) 上海现代制药股份有限公司沪卫药准字(1999)第028011号 沪Q/WS-1-2273-99蓖麻油 湖南尔康制药有限公司 国药准字Z43020915 中国药典南昌白云医药化工厂分装 内卫药准字(80)Ⅱ-48-0456 中国药典2005年版 湖北科田药业有限公司国药准字Z42020991中国药典2005年版一部 白凡士林 南京金陵石油化工公司化工一厂 苏卫药准字(1982)第301401号 中国药典2000年版 南京长江石化有限公司 苏卫药准字(82)第3014-1号 中国药典2005年版二部 湖南尔康制药有限公司 湘食药辅准字F20050009 中国药典2005年版二部 泊洛沙姆 南京威尔医药技术有限公司 苏卫药准字2001第424201号 中国药典2005年版沈阳药大药业有限责任公司(90)沈卫药准字F-03号中国药典2005年版二部C 茶油江西上饶恩泉油脂有限公司赣药准字(2001)F第166002号中国药典2005年版浙江龙游县聚兴粮油医药化工有限公司浙卫药准字(1996)第221701号中国药典2005年版超级羧甲淀粉中维药业有限公司浙药准字(2005)第221503号中国药典2005年版二部钠橙皮酊广东星群(药业)股份有限公司粤卫药准字(1994)第104067号卫生部药品标准虫白蜡东光县亚蜡毛厂冀卫药准字(2000)第050546号中国药典D 淀粉海盐六和淀粉化工有限公司浙卫药准字(1996)第220802号中国药典2005年版二部嘉兴白浪淀粉制品有限公司浙卫药准字(1996)220801号中国药典2005年版二部安徽山河药用辅料有限公司皖药准字(2002)第F0002号中国药典2005年版二部华北制药康欣有限公司冀卫药准字(1995)第000034号中国药典2005年版二部山东聊城阿华制药有限公司鲁卫药准字(1998)第052365号中国药典2005年版二部曲阜市天利药用辅料有限公司鲁卫药准字(1996)第631502号中国药典2005年版二部大豆油铁岭北亚药用油有限公司辽卫药准字(1997)第700313号中国药典2005年版二部上海太伟药业有限公司国药准字XF20010206 部颁标准1998年版第6册龙游县田雨山茶油开发有限公司浙药准字(2002)第221720号中国药典2005年版二部大豆磷脂上海太伟药业有限公司国药准字XF20010206 部颁标准1998年版低取代羟丙基淮南山河药用辅料有限公司皖药准字(2002)第F004486号中国药典2005年版二部纤维素湖州展望药业有限公司浙卫药准字(1996)第222001号中国药典2005年版二部对羟基苯甲酸昆山市双友日用化工有限公司苏卫药准字(1987)第358001号日用化工原料手册甲酯对羟基苯甲酸太仓市新湖医药化工厂苏药准字(2002)第200608号中国药典2005年版二部乙酯广州市汉普医药有限公司国药准字H44022620 中国药典1990年版碘化钾四川自贡鸿鹤制药有限责任公司国药准字H51021270 中国药典E Eudra gitNE30D (丙烯酸乙酯-甲基丙烯酸甲酯中性共聚物水分散体)Rohm Gmbh 进口药品注册证号H20010510 欧洲药典二甲硅油自贡晨光药业有限公司国药准字H51021903 中国药典2000年版二部二甲基亚砜本溪市轻化工研究所实验厂辽卫药准字(1996)第2891号中国药典2005年版二部二氧化钛江苏鹏鹞药业有限公司国药准字H32023587 中国药典2000年版F 凡士林杭州特种油品厂浙卫药准字(1996)第222101 中国药典2005年版G 甘氨酸北京建力药业有限公司国药准字H11021216 中国药典2005年版甘露醇青岛胶南明月海藻工业有限公司国药准字H37022763 中国药典2005年版二部广西南宁化学制药有限责任公司国药准字H45020272 中国药典2005年版二部河北华旭药业有限公司国药准字H10973007 中国药典2005年版蓬莱登州海藻有限公司国药准字H37020030 中国药典2005年版二部青岛海峰制碘有限公司国药准字H37020734 中国药典2005年版二部青岛宇龙海藻有限公司国药准字H45020272 中国药典2005年版二部山东洁晶集团股份有限公司国药准字H37021152 中国药典2005年版二部安微双鹤药业有限公司国药准字H34023604 中国药典2005年版二部浙江天瑞药业有限公司国药准字H20023039 中国药典2005年版二部江苏黄海药业有限公司国药准字H32022586 中国药典2005版二部甘油浙江省凤凰化工股份有限公司国药准字H33022702 中国药典2005年版二部无锡正达医药卫生用品厂国药准字H32026785 中国药典浙江遂昌惠康甘油有限公司国药准字H33020622 中国药典湖南尔康制药有限公司国药准字H43022244 中国药典2005年版汕头市紫光古汉氨基酸有限公司国药准字H44022853 中国药典2005年版杭州油脂化工有限公司浙药准字(2004)第110203号中国药典2005年版二部黑龙江省友谊甘油厂黑卫药准字(2001)第100001号中国药典2000年版二部浙江纳爱斯集团浙卫药准字(2003)第110204号中国药典2005年版二部杭州东南化工有限公司浙卫药准字(1996)第110202号中国药典硅油自贡晨光药业有限公司国药准字H51021903 中国药典2005年版枸橼酸湖南华日制药有限公司国药准字H43020597 中国药典2005年版安徽华源生物药业有限公司国药准字H34022718 中国药典2005年版无锡市第二制药厂国药准字H32023986 中国药典2000年版二部湖南华日制药有限公司国药准字H43020597 中国药典2005年版日照泰山洁晶生化有限公司国药准字H20055263 中国药典2005年版二部广东省台山市新宁制药厂国药准字H44020360 中国药典2005年版二部枸橼酸二氢钠广西南宁制药有限公司粤卫药准字(1994)第100108号粤Q/WS-1458-84 枸橼酸钠湖南尔康制药有限公司国药准字H43020205 中国药典2005年版无锡市第二制药厂国药准字H32022214H 滑石粉桂林航天药用滑石粉有限公司桂卫药准字(1988)第035001号中国药典广西龙胜华美滑石粉有限公司桂卫药准字(1994)第120001号中国药典桂林桂广滑石开发有限公司桂卫药准字(1984)058001号中国药典2000年版一部莱州市玉凤矿业滑石粉有限公司鲁卫药准字(98)第545416号中国药典2005年版莱州市凤羽滑石粉有限公司鲁卫药准字(1999)第522318号中国药典黄凡士林江西德成制药有限公司赣卫药准字(1996)第1660001号杭州特种油品厂浙卫药准字(1998)第222101号中国药典2005年版混合脂肪酸甘海盐成成日化科技有限公司浙卫药准字(1996)第169601号WS1-121-83-89油酯红棕色包衣剂上海现代制药股份有限公司沪卫药准字(1999)第028011号沪Q/WS-2273-99 上海浦东凌桥化工厂沪卫药准字(1995)第106002号中国药典红氧化铁上海一品颜料有限公司沪卫药准字(1995)第114001号中国药典2000年版二部上海氧化铁颜料厂沪卫药准字(1995)第114001号中国药典2005年版二部糊精华北制药康欣有限公司冀卫药准字(1995)第000057号中国药典2005年版潍坊盛泰药业有限公司鲁卫药准字(1999)第526305号中国药典2005年版二部山东聊城阿华制药有限公司鲁卫药准字(1998)第052429号中国药典2005年版江苏镇江市环宇药用辅料厂苏卫药准字(1994)第302202号中国药典2005年版二部安徽淮南山河药用辅料有限公司皖药准字(2002)第F0001号中国药典2000年版二部浙江海盐六和淀粉化工有限公司浙卫药准字(1998)第220902号中国药典2005年版二部嘉兴白浪淀粉制品有限公司浙卫药准字(1996)第220901号中国药典2005年版曲阜市天利药用辅料有限公司鲁卫药准字(1999)第631501号中国药典2005年版黄色包衣剂上海现代制药股份有限公司沪卫药准字(1999)第028011号沪Q/WS-1-2273-99混合脂肪酸甘成都泸天化科森公司川药准字(2002)第014299号WS1-121-83-89 油酯黑色油墨上海延安万象闵行药业有限公司沪卫药准字(1995)第019148号93版上海市药品标准黑氧化铁上海一品国际颜料有限公司沪卫药准字(1995)第114003号中国药典2005年版二部活性炭上海活性炭厂沪药准字FF20020001 中国药典2000年版二部杭州木材公司活性炭分公司浙卫药准字(1996)第139501号中国药典2005年版衢州云合炭业有限公司浙药准字(2003)第139503号中国药典2005年版二部温岭市荣泰活性炭厂浙药准字2005第319506号中国药典2005年版二部江西怀玉山活性炭有限公司赣食药准字F20040002 企业标准遂昌希顺炭业有限公司浙卫药准字(2004)第139505号药典2005版J 甲基纤维素泰安瑞泰纤维素有限公司鲁药准字(2002)第520005号中国药典2005年版聚维酮K-30 湖州展望药业有限公司浙卫药准字(2003)第224601号中国药典2005年版上海维酮贸易公司(95)沪卫药准字F-01号中国药典2005年版安徽山河药用辅料有限公司皖药准字F20060001 中国药典2005年版二部杭州神华科技发展有限公司浙卫药准字(2004)第224602号中国药典2005版二部美国进口进口药品注册证号H20040430 进口药品注册标准河南博爱新开元有限公司豫卫药准字(1995)F-10号中国药典2005年版胜利油田东胜星华化工有限责任公司鲁药准字(2002)第202001号中国药典2005年版二部天津市雅博生物工程有限公司进口药品注册证号H20040430 中国药典2005年版二部浙江茂源药业有限公司浙药准字(2004)第224602号中国药典2005年版聚乙二醇1000 南京威尔化工有限公司苏药准字(2003)第427601号中国药典2005年版二部聚乙二醇1500 辽阳华兴药用辅料有限公司辽卫药准字(2000)第700515号中国药典2005年版二部上海浦东高南化工厂沪卫药准字(1995)第105003号中国药典2005年版二部聚乙二醇4000 辽阳华兴药用辅料有限公司辽卫药准字(2000)第700512号中国药典2005年版二部天津天成制药有限公司国药准字H12020043 中国药典2005年版二部上海浦东高南化工厂沪卫药准字(1995)第105001号中国药典2005年版二部南京威尔化工有限公司苏药准字(2001)第423501号中国药典2005年版二部聚乙二醇400 北京海淀会友精细化工厂京卫药准字(95)第023号中国药典2005年版二部辽阳华兴药用辅料厂辽卫药准字(2000)第700510号中国药典聚乙二醇6000 辽阳华兴药用辅料有限公司辽卫药准字(2000)第700511号中国药典2005年版二部北京海淀会友精细化工厂京卫药准字(95)第(008)号中国药典2005年版二部南京威尔化工有限公司苏卫药准字(2001)第423601号中国药典2005年版天津天成制药有限公司国药准字H12020042 中国药典2005年版二部上海浦东高南化工厂沪卫药准字(1995)第105005号中国药典2005年版聚丙烯酸树脂安徽山河药用辅料有限公司皖药准字F20030008号中国药典2005年版二部Ⅱ湖州展望药业有限公司浙卫药准字(1996)第224201号中国药典2005年版连云港万泰医药有限公司苏卫药准字(1983)第308001号中国药典2005年版二部聚丙烯酸树脂连云港万泰医药有限公司苏卫药准字(1983)第308101号《中国药典》2005年版二部Ⅲ淮南山河药用辅料有限公司皖药准字F20030009 中国药典2005年版聚丙烯酸树脂淮南山河药用辅料有限公司皖药准字F20030010 中国药典2005年版Ⅳ聚乙烯吡咯烷BASF Aktiengesellschaft 进口药品注册证号H20050376 欧洲药典酮K25聚乙烯吡咯烷BASF Aktiengesellschaft 进口药品注册证号H20020137 欧洲药典酮K30Isp Teehn ologies.Inc 进口药品注册证号H20030278 美国药典处方集17版聚乙烯吡咯烷酮K90美国BASF公司进口药品注册证号H20020138 进口药品注册标准交联聚维酮德国BASF 进口药品注册证号H20020137 进口药品注册标准JX20010420进口(美国)进口药品注册证号H20030278 进口药品注册标准JX19990212International Specialty Products Inc. 进口药品注册证号H20030418 进口药品注册标准JX20020273交联聚维酮XL-10 上海申美医药开发科技有限公司进口药品注册证号H20030418进口药品注册标准JX20020273交联聚乙烯吡咯烷酮德国进口进口药品注册证号H20020137 进口药品注册标准精氨酸上海协和氨基酸有限公司国药准字H20023085 WS-XG-006-2000k 空心胶囊全省共有50多家生产企业中国药典2000年版口服葡萄糖石家庄市华营联合葡萄糖厂国药准字H13022090 WS1-05(B)-89 秦皇岛骊骅淀粉股份公司国药准字H10973038 部颁标准L 氯仿广州化学试剂厂粤卫药准字(1996)第100053号中国药典浙江迪耳药业有限公司浙卫药准字(1996)第175001号中国药典2005年版二部氯化钾台山市新宁制药厂国药准字H44024894 中国药典2005年版氯化钠四川自贡鸿鹤制药有限责任公司国药准字H51021266 中国药典江苏南通勤奋药业公司国药准字H32020718 中国药典天津开发区海光化学制药厂国药准字H12020004 企业标准中盐宏博集团云梦云虹制药有限公司国药准字H242022255 中国药典2000年版二部平顶山同辉药业有限公司国药准字H19983240 中国药典2005版二部磷酸二氢钠湖南九典制药有限公司国药准字H20054379湖南华纳大药厂有限公司国药准字H20034163 中国药典2005年版二部磷酸氢二钠湖南华纳大药厂有限公司国药准字H20040206 YBH01892004湖南华纳大药厂有限公司国药准字H20040206 生物制品质控标准2002年版磷酸氢钙湖州展望药业有限公司国药准字H33020093 中国药典2005年版二部偃师乳酸有限公司国药准字H41022971 中国药典2005年版二部磷脂Lipoid Gmbh 进口药品注册证号H20050440 注册标准硫酸钙湖州展望药业有限公司浙卫药准字(1996)第174701号中国药典2005年版浙江中维药业有限公司浙药准字(2005)第174702号中国药典2005年版上海青平药业有限公司沪卫药准字(1995)第061002号中国药典2005年版二部L-羟丙基纤维素安徽山河药用辅料有限公司皖药准字(2001)第F004486号中国药典2005年版二部L-盐酸赖氨酸上海协和氨基酸有限公司国药准字H31020298 中国药典2005年版绿色包衣剂上海现代制药股份有限公司沪卫药准字(1999)第028011号沪Q/WS-2273-99M 明胶青海明胶股份有限公司青食药准字F2005001 GB2354-98蚌埠丰原明胶有限公司皖药准字F20050018 GB2354-98东光县亚星蜡制品厂冀卫药准字(2000)第060320号中国药典罗赛洛(广东)明胶有限公司粤药准字F44030004 QB-2354-98罗赛洛(温州)明胶有限公司浙药准字(2003)第132302号中国药典2005年版二部木糖醇浙江华康药业有限公司浙卫药准字(1998)第220902号中国药典2005年版二部N 尼泊金广州汉普医药有限公司国药准字H44011620 中国药典2000年版P 硼砂自贡鸿鹤制药有限责任公司国药准字H51021267 中国药典2005年版广东台山市新华制药厂国药准字H44020313 中国药典2005年版硼酸北京燕京药业有限公司国药准字H11020496 中国药典2005年版二部广东台山市新华制药厂国药准字H44020353 中国药典2005年版偏重亚硫酸钠湖南尔康制药有限公司湘食药辅准字F20050004 中国药典2005年版二部葡萄糖潍坊盛泰药业有限公司国药准字H37022664 中国药典2005年版二部河南莲花英糖药业国药准字H19993019 中国药典2005年版二部山东祥瑞药业有限公司国药准字H20013420 中国药典2005年版二部Q 轻质液状石蜡中石化集团杭州炼油厂浙卫药准字(1996)第166601号WS1-80(B)-89 吉林市吉化江城油脂化工有限公司吉卫药准字(1996)第211149号WS1-80(B)-89 羟苯甲酯广东省台山市新宁制药厂国药准字H44020160 中国药典2005年版二部羟苯乙酯广州汉普医药有限公司国药准字H44022620 中国药典2005年版二部广东台山新宁制药股份有限公司国药准字H44020160 中国药典2005年版二部广州汉普医药有限公司国药准字H44022620 中国药典2005年版二部扬州星斗药业有限公司苏卫药准字(1982)第212201号中国药典2005年版二部广州越秀制药厂粤卫药准字(1996)第123008号中国药典2000年版昆山市双友日用化工有限公司国药准字H32022763 中国药典2005年版二部浙江圣效化工有限公司浙药准字(2003)第224701号中国药典2000年版广东台山市新华制药厂国药准字H44020160 中国药典2005年版羟丙基纤维素湖州展望药业有限公司浙卫药准字(1996)第222001号中国药典2005年版安徽山河药用辅料有限公司皖药准字(2001)第F004486号中国药典2005年版山东聊城阿华制药有限公司鲁卫药准字(1998)第052620号中国药典2005年版营口奥达制药辽卫药准字(1994)第000446号中国药典2005年版羟丙基甲基纤湖州展望药业有限公司浙卫药准字(1996)第222201号中国药典2005年版维素安徽山河药用辅料有限公司皖药准字(2002)第F0003号中国药典2005年版营口奥达制药辽卫药准字(2000)第700542号中国药典2005年版泰安瑞泰纤维素有限公司鲁卫药准字(1995)第520001号中国药典2005年版日本Shin-Etsu Chemical 进口药品注册证号H20050403 中国药典2005年版美国药典28版美国DOW公司进口药品注册证号H20060085 进口药品注册标准氢氧化钠湖南尔康制药有限公司湘食药辅准字F20050011 中国药典2005年版琼脂福建泉州市泉港化工厂闽卫药准字(1996)第002360号中国药典2005年版二部R 乳糖新西兰乳糖公司进口药品注册证号H20030038 JX20020090The lactose company of New Zealand Co,Ltd 进口药品注册证号H20030019 中国药典2005年版DMV International(荷兰)进口药品注册证号H20040369 进口药品注册标准JX20020301上海华茂药业有限公司沪卫药准字(1998)第239001号中国药典2000年版二部石家庄精晶药业有限公司冀药准字(2004)第015081号中国药典2000年版二部常州朗生生物工程有限公司苏药准字(2003)第427701号中国药典2005年版乳酸无锡市第二制药厂国药准字H32023985 中国药典2000年版二部偃师乳酸有限公司国药准字H41022972 中国药典2005年版S 十二烷基硫酸钠湖南尔康制药有限公司湘食药辅准字F20060002 中国药典2005年版浙江豪森制药有限公司浙卫药准字(1996)第173403号羧甲基淀粉钠湖州展望药用辅料有限公司浙卫药准字(1996)第221501号中国药典2005年版安徽山河药业有限公司皖药准字(2001)第F004489号中国药典2005年版二部嘉兴白浪淀粉制品有限公司浙药准字(2004)第221502号中国药典2005年版二部曲阜市天利药用辅料有限公司鲁药准字(2002)第631505号中国药典2005年版二部羧甲基纤维素淮南山河药用辅料有限公司皖药准字F20030001 中国药典钠上海赛璐珞厂沪卫药准字1995第125001号WS-10001-(HD-0486)-2002 山梨醇广西南宁化学制药有限责任公司国药准字H45020273华北制药华盈股份有限公司国药准字H19983074 中国药典2005年版二部石油醚辽阳华兴药用辅料有限公司辽卫药准字(2000)第700511号中国药典2005年版二部水杨酸甲酯广州化学试剂厂粤卫药准字(1994)第100052号部颁标准江苏省洪兴化工厂国药准字H32024995 部颁标准佛山市南海中南药化厂国药准字H20043365 WS1-07(B)-89华阴市锦前程药业有限公司国药准字H20046738 WS1-07(B)-89 麝香草酚广州百花香料股份有限公司国药准字H44023847 WS-1-32-82-89T 碳酸钠湖南尔康制药有限公司国药准字H43020195 部颁标二部第五册甜菊素成都菊乐制药厂川卫药准字(90)F-04-02号中国药典2005年版江苏健佳药业有限公司苏药准字(2005)第428301号中国药典2005年版北京天安甜菊糖制品有限公司京卫药准(1996)第1670001号中国药典山东曲阜香州食品有限公司国药准字H20041106 GB8270-1999江苏健佳药业有限公司苏药准字(2005)第428301号中国药典2005年版吐温-80 浙江龙游聚兴粮油医药化工有限公司浙卫药准字(1996)第1810101号中国药典2005年版温州清明化工有限公司浙卫药准字(1996)第184102号中国药典2005年版二部江苏晨牌药业有限公司苏卫药准字(1992)第295601号中国药典2005年版上海申宇医药化工有限公司沪卫药准字(1995)186001号中国药典2000年版南京威尔化工有限公司苏卫药准字(2001)第423201号中国药典2000年版大连旅顺化工厂国药准字H21021050 中国药典2000年版W 微晶纤维素安徽山河药用辅料有限公司皖药准字(2001)第F004487号中国药典2005年版二部湖州展望药业有限公司浙卫药准字(1996)第224101号中国药典2005年版二部山东新大精细化工有限公司鲁药淮字(2005)第208003号中国药典2005版山东聊城阿华制药厂鲁卫药准字(1999)第052432号中国药典2005年版二部常熟市药用辅料有限公司苏药准字(2001)第340601号中国药典2005年版营口奥达制药辽卫药准字(1996)第000468号中国药典2005版美国FMC 进口药品注册证号H20020521 中国药典2005年版微丸丸芯上海华高药用丸芯有限公司沪药准字FF20010002 中国药典2005年版无水磷酸氢二湖南九典制药有限公司国药准字H20050387 企业标准钠无水亚硫酸钠湖南尔康制药有限公司湘食药辅准字F20050002 中国药典2005年版二部X 稀盐酸杭州利人药业有限公司浙卫药准字(1996)第177101号中国药典2005年版二部湖南尔康制药有限公司湘食药辅准字F20050002 中国药典2005年版二部广东省台山市新宁制药有限公司国药准字H44020356 中国药典2005年版Y 亚硫酸氢钠湖南尔康制药有限公司湘食药辅准字F20050013 中国药典2005年版二部羊毛脂上海华亭羊毛脂厂沪卫药准字(1995)第078001号中国药典2005年版氧化镁河北邢台冶金镁业有限公司国药准字H13022032 中国药典2005年版二部江苏鹏鹞药业国药准字H32026265 中国药典2005年版氧化铁上海氧化铁颜料厂沪卫药准字(1995)第114001号中国药典2005年版氧化锌安庆市造漆厂有限公司皖卫药准字(1996)第102287号中国药典2005年版安庆菱湖漆业有限公司皖卫药准字(1996)第102287号药典2005版药用薄膜包衣湖州展望药业有限公司浙卫药准字(2001)第224502号Q/ZWYY J2.1.17-2001 预混辅料。
文解政策:药包材药用辅料关联审评审批政策解读(一)

文解政策:药包材药用辅料关联审评审批政策解读(一)药品的质量和安全问题一直备受关注,药品的包装和辅料也同样重要,它们的质量直接影响着药品的质量和安全。
为了进一步加强对药品的安全监管,国家药品监督管理局联合国家卫生健康委员会于2018年颁布了《药包材药用辅料关联审评审批规定》。
该规定主要对药品的包装和辅料进行了规范和管理,重点关注的是药包材和药用辅料之间的配合及其影响药品的质量和安全的问题。
该规定旨在加强对药品包装材料和辅料的审评审批制度,确保药品的质量和安全性。
一、药包材药用辅料关联审评审批的定义和要求1. 审评范围该规定主要适用于申请国家药品注册,包括国产新药、引进药品,以及药品的变更申请。
2. 审评要求在药品注册申请中,必须对药品的包装材料和辅料进行详细描述,并说明其对药品的质量和安全的影响。
同时,需要提供药品包装材料和辅料的质量标准和相关检验报告。
审批部门应根据药品的种类和用途,以及包装材料和辅料的质量标准和检验报告,对药物包材和药用辅料之间的相互影响进行综合评估,并审批相应的包装材料和辅料。
3. 小批量试验规定对于新的药品包装材料和药用辅料,审评部门还要求进行小批量试验来评估其对药品的质量和安全的影响。
二、对药品包装材料的要求1. 选材原则药品包装材料应具有稳定性、透明度好、不易变形和不易老化等特性。
特别是需要防止水和气的侵入,以避免药品的变质。
2. 包装清洁药品包装材料应保持清洁干燥,使用前应进行严格的消毒和清洁。
3. 记录所有信息药品包装材料应记录所有的信息,包括药品的名称、规格、批号、生产日期、有效期等。
此外,还需要包括包装材料的名称、型号、规格、批号、生产日期和有效期等信息。
4. 包装材料应符合质量标准药品包装材料应符合国家相关的质量标准和法规要求,同时应符合药品的质量和安全要求。
三、对药用辅料的要求1. 选材原则药用辅料应符合国家相关法规和标准,同时要保持稳定性和适宜性,以确保药品质量和安全。
国家药品监督管理局关于统一换发并规范药品批准文号格式的通知-国药监注[2002]33号
![国家药品监督管理局关于统一换发并规范药品批准文号格式的通知-国药监注[2002]33号](https://img.taocdn.com/s3/m/54235d1eeef9aef8941ea76e58fafab069dc447d.png)
国家药品监督管理局关于统一换发并规范药品批准文号格式的通知正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 国家药品监督管理局关于统一换发并规范药品批准文号格式的通知(国药监注[2002]33号)各省、自治区、直辖市药品监督管理局,解放军总后卫生部:药品批准文号是药品生产合法性的标志。
《药品管理法》规定,生产药品“须经国务院药品监督管理部门批准,并发给药品批准文号”。
由于历史的原因,目前,已上市药品的批准文号的格式不尽相同,这种情况,不利于进行统一管理和监督。
为加强药品批准文号管理,根据国家药品监督管理局《关于做好统一换发药品批准文号工作的通知》(国药监注(2001)582号)要求,现又规范了新的药品批准文号格式,并将在近期对全国药品生产企业已合法生产的药品统一换发药品批准文号。
现将有关事项通知如下:一、药品批准文号格式:国药准字+1位字母+8位数字,试生产药品批准文号格式:国药试字+1位字母+8位数字。
化学药品使用字母“H”,中药使用字母“Z”,通过国家药品监督管理局整顿的保健药品使用字母“B”,生物制品使用字母“S”,体外化学诊断试剂使用字母“T”,药用辅料使用字母“F”,进口分包装药品使用字母“J”。
数字第1、2位为原批准文号的来源代码,其中“10”代表原卫生部批准的药品,“19”、“20”代表2002年1月1日以前国家药品监督管理局批准的药品,其它使用各省行政区划代码(见附件一)前两位的,为原各省级卫生行政部门批准的药品。
第3、4位为换发批准文号之年公元年号的后两位数字,但来源于卫生部和国家药品监督管理局的批准文号仍使用原文号年号的后两位数字。
辅料大全质量标准

辅料批文大全海藻多糖空心胶囊秦皇岛药用胶囊有限公司国药准字F 2005《中国药典》第二部海藻多糖胶秦皇岛药用胶囊有限公司国药准字F 2005《中国药典》第二部纤维素-乳糖Molkerei MEGGLE Wasserburg GmbH & Co.KG (德国美剂乐) 进口注册证号 H 进口注册标准 JX 80目炉甘石粉湖南尔康制药有限公司湘食药辅准字F 部颁药品标准二部第5册苹果酸湖南尔康制药有限公司湘食药辅准字F GB/T 13737-92 L-苹果酸香兰素湖南尔康制药有限公司湘食药辅准字F GB 3861-83肉桂油湖南尔康制药有限公司湘食药辅准字F GB 11958-89磷酸湖南尔康制药有限公司湘食药辅准字F GB3149-2004十六醇湖南尔康制药有限公司湘食药辅准字F GB/T 16451-1996十八醇湖南尔康制药有限公司湘食药辅准字F GB/T 16451-1996十六十八醇湖南尔康制药有限公司湘食药辅准字F GB/T 16451-1996山梨酸钾湖南尔康制药有限公司湘食药辅准字F GB/T 13736-92单硬脂酸甘油酯湖南尔康制药有限公司湘食药辅准字F GB 1986-89二氧化硅湖南尔康制药有限公司湘食药辅准字FB HG 2791-1996海藻酸钠湖南尔康制药有限公司湘食药辅准字F GB 1976-80胆固醇湖南尔康制药有限公司湘食药辅准字F 部颁标准二部六册玉米油湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版精制硫酸湖南尔康制药有限公司湘食药辅准字F 中国药典1953年版三氯甲烷湖南尔康制药有限公司湘食药辅准字F 中国药典2005版硫酸锌湖南尔康制药有限公司国药准字H 中国药典2005版辛酸钠成都华邑药用辅料制造有限责任公司川药准字F中国生物制品主要原辅料材料质控标准2000年版硫代硫酸钠成都华邑药用辅料制造有限责任公司川药准字F 中国药典2005年版二部硬脂(A型、BM型)法国生产(上海源础科贸)进口注册证号H 进口药品注册标准JX硬脂酸聚烃氧(40)酯南京威尔化工有限公司苏药准字(1982)第号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版蔗糖勐永药业公司滇药准辅字(2003)第021号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版二部苏州市中泰药用辅料有限公司苏药准字(2008)第号中国药典2005年版乙二胺湖南尔康制药有限公司湘食药辅准字F YY0208-95重质碳酸镁盘锦兴海制药有限公司国药准字H 《中国药典》2005年版二部药用微丸丸芯杭州高成生物营养技术有限公司浙药准字F号沪Q/WS-1-2274-2001上海华高药用丸芯有限公司沪药准字FF 《中国药典》2005年版二部中国药科大学制药有限公司苏药准字(2003)第号江苏省药品标准依地酸二钠杭州利人药业有限公司国药准字H 国家药监局药品标准WS-10001-(HD-1075)-2002 湖南尔康制药有限公司湘食药辅准字F 国家药品标准化药地标升国标第11册月桂氮卓酮广州精细化学工业有限公司粤卫药准字(87)F-01号《中国药典》2005年版二部天门科捷制药有限公司国药准字H 中国药典2005年版河南新乡高金药业有限公司豫药准字F 中国药典2005年版预胶化淀粉湖州展望药业有限公司(88)浙卫药准字F-01号《中国药典》2005年版二部安徽山河药用辅料有限公司皖药准字(2001)第F号山东聊城阿华制药有限公司鲁卫药准字(1998)第号《中国药典》2005年版二部山东新大精细化工有限公司鲁药准字(2004)第号《中国药典》2005年版二部济南东风制药厂有限公司鲁药准字(2001)第号《中国药典》2005年版二部曲阜市药用辅料有限公司鲁药准字(2000)第号《中国药典》2005年版二部山东孔府药厂鲁卫药准字(1999)第号《中国药典》2005年版二部曲阜市天利药用辅料有限公司鲁药准字(2003)第号《中国药典》2005年版二部浙江中维药业有限公司浙卫药准字(2005)第号《中国药典》2005年版二部营口奥达制药辽卫药准字(1998)第号《中国药典》2005年版二部美国卡乐康注册证号:H 进口药品注册标准Colorcon (美国进口)进口药品注册证号:F 进口药品注册标准JX玉米朊吴江市八坼药用辅料厂苏卫药准字(1995)号《江苏省药品标准》95版国家药监局药品标准WS-10001-(HD-0499)-2002高邮市日星药用辅料有限公司苏药准字(2004)第号中国药典WS-10001(HD-0499)-2002 湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版右旋糖苷右旋糖苷20江苏黄海药业有限公司国药准字H 《中国药典》2005年版二部上海华茂药业有限公司国药准字H 国家食药监局标准YBH (高于中国药典)右旋糖酐40永安华源制药有限公司国药准字H 《中国药典》2005年版二部山东金洋药业有限公司国药准字H 《中国药典》2005年版二部许昌双马万通制药有限公司国药准字H 《中国药典》2005年版二部硬脂酸镁湖州展望药业有限公司浙卫药准字(1996)第号中国药典2005年版湖州展望药业有限公司浙药准字F号《中国药典》2005年版二部安徽山河药用辅料有限公司皖药准字(2001)第F号《中国药典》2005年版二部山东聊城阿华制药有限公司鲁卫药准字(1998)第号《中国药典》2005年版二部曲阜市天利药用辅料有限公司鲁药准字(2003)第号《中国药典》2005年版二部东营市清华海洋化工有限责任公司鲁药准字(2002)第号《中国药典》2005年版二部曲阜市药用辅料有限公司鲁药准字(2002)第号《中国药典》2005年版二部温州青山精细化工厂浙卫药准字(1996)第号《中国药典》2005年版二部浙江海盐六和淀粉化工有限公司浙卫药准字(2003)第号《中国药典》2005年版二部山东新大精细化工有限公司鲁药淮字(2005)第号《中国药典》2005年版二部营口奥达制药浙卫药准字(1996)第号《中国药典》2005年版二部浙江中维药业有限公司浙药准字(2005)第号《中国药典》2005年版二部山东兰鲸集团有限公司鲁卫药准字(2002)第号中国药典2005年版二部河南精忠威尔药业有限公司豫药准字F号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F 《中国药典》2005年版二部硬脂酸湖州展望化学药业有限公司浙卫药准字(1998)第号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版乙基纤维素泸州化工厂医药辅料厂川药准字(2001)第号 WS-10001-(H-0486)-2002 浙江中维药业有限公司浙药准字(2005)第号《中国药典》2005年版二部泰安瑞泰纤维素有限公司鲁药准字(2001)第号《中国药典》2005年版二部山东赫达股份有限公司鲁药准字(2003)第号《中国药典》2005年版二部山东聊城阿华制药有限公司鲁药准字(2002)第号《中国药典》2005年版二部乙基纤维素混悬液天津市爱勒易医药材料科技有限公司国药准字F卡乐康进口注册证号P 进口药品注册标准JX乙醇太仓新太酒精有限公司苏卫药准字(2002)第号《中国药典》2005年版二部宁波万隆食用酒精有限公司浙卫药准字(2006)第号《中国药典》2005年版二部安徽安特生物化学有限公司皖药准字F 中国药典2005年版广西桂西制药国药准字Z 《中国药典》2005年版二部南京化学试剂厂苏卫药准字(2002)第号《中国药典》2005年版二部南京化学试剂有限公司苏卫药准字(1986)第号《中国药典》2005年版二部丰原宿州生物化工有限公司皖药准字F 《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F 《中国药典》2005年版二部徐州香醅酒业有限公司苏药准字(2007)第号中国药典2005年版郓城县明泉酒业有限公司鲁药准字(2001)第号《中国药典》2005年版二部山东金源医药酒精有限公司鲁药准字(2000)第号《中国药典》2005年版二部山东酒精总厂鲁卫药准字(1999)第号《中国药典》2005年版二部肥城市康王酒业有限公司鲁卫药准字(1995)第号《中国药典》2005年版二部山东鲁中酿酒总厂鲁卫药准字(1997)第号《中国药典》2005年版二部德州又一村酿酒有限公司鲁药准字(2001)第号《中国药典》2005年版二部山东金彩山酒业有限公司鲁药准字(2005)第号《中国药典》2005年版二部盐酸半胱氨酸湖北省潜江市四维氨基酸有限公司国药准字H 中国药典2005年版L-盐酸赖氨酸上海协和氨基酸有限公司国药准字H 中国药典2005年版药用炭杭州木材公司活性炭分公司浙卫药准字(1996)第号《中国药典》2005年版二部衢州市云合炭业有限公司浙药准字(2003)第39503号中国药典临安市华南活性炭有限公司浙药准字(2003)第号《中国药典》2005年版二部上海活性炭厂有限公司 FF(767,769,781)《中国药典》2005年版二部新干县申新活性炭厂赣食药准字F 《中国药典》2005年版二部氧化锌安庆市造漆厂有限公司皖卫药准字(1996)第号中国药典2005年版氧化镁河北邢台冶金镁业有限公司国药准字H 中国药典2005年版二部江苏鹏鹞药业国药准字H 中国药典2005年版羊毛脂上海华亭羊毛脂厂沪卫药准字(1995)第号中国药典2005年版恩凯化学(南京)有限公司苏药准字(2007)第号中国药典2005年版湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版亚硫酸氢钠湖南尔康制药有限公司湘食药辅准字F 《中国药典》2005年版二部纤维醋法酯苏州立新制药有限公司苏卫药准字(1999)第号《中国药典》2005年版二部盐酸南京化学试剂有限公司苏药准字(2008)第号《中国药典》2005年版二部湖南尔康制药有限公司湘药准字F 《中国药典》2005年版二部成都华邑药用辅料制造有限责任公司川药准字F 《中国药典》2005年版二部稀盐酸杭州利人药业有限公司浙卫药准字(1996)第号《中国药典》2005年版二部湖南尔康制药有限公司国药准字H 《中国药典》2005年版二部南京化学试剂有限公司苏药准字(2008)第号中国药典2005年版广东省台山市新宁制药有限公司国药准字H 中国药典2005年版无水枸橼酸湖南尔康制药有限公司湘食药辅准字F WS-10001-(HD-1564)-2005无水碳酸钠湖南尔康制药有限公司国药准字H 中华人民共和国卫生部药品标准(二部)第五册无水葡萄糖河北圣雪葡萄糖有限责任公司国药准字H 《中国药典》2005年版二部无水硫酸钠南京化学试剂有限公司苏药准字(2008)第号《中国药典》2005年版二部无水亚硫酸钠湖南尔康制药有限公司湘食药辅准字F 《中国药典》2005年版二部微晶纤维素J.Rettenmaier & Sohne Gmbh+Co(德国进口) 进口药品注册证号:H 进口药品注册标准JXJ.Rettenmaier & Sohne Gmbh+Co(德国进口) 进口药品注册证号:H 进口药品注册标准JXJ.Rettenmaier & Sohne Gmbh+Co(德国进口) 进口药品注册证号:H 进口药品注册标准JX上海昌为医药辅料技术有限公司进口药品注册证号JX 中国药典2005版二部上海青平药业有限公司(上海天平胃舒平制药厂) 沪卫药准字(1995)第号安徽山河药用辅料有限公司皖药准字(2001)第F号《中国药典》2005年版二部湖州展望药业有限公司浙卫药准字(1996)第号《中国药典》2005年版二部湖州展望药业有限公司浙药准字F号《中国药典》2005年版二部无锡市凯利药业有限公司苏卫药准字(2000)第号中国药典2000年版山东新大精细化工有限公司鲁药淮字(2005)第号中国药典2005版山东聊城阿华制药有限公司鲁卫药准字(1998)第号《中国药典》2005年版二部曲阜市药用辅料有限公司鲁药准字(2002)第号《中国药典》2005年版二部曲阜市天利药用辅料有限公司鲁药准字(2002)第号《中国药典》2005年版二部泰安瑞泰纤维素有限公司鲁药准字(2005)第号《中国药典》2005年版二部常熟市药用辅料有限公司苏药准字(2001)第号《中国药典》2005年版二部营口奥达制药辽卫药准字(1996)第号中国药典2005版美国FMC进口药品注册证号H~H 进口药品注册标准JX浙江中维药业有限公司浙药准字(2005)第号《中国药典》2005年版二部Asahi Kasci Chemicals Corporation(日本进口) 进口药品注册证号: H 进口药品注册标准JX吐温80(聚山梨酯80)温州清明化工有限公司浙卫药准字(1996)第号《中国药典》2005年版二部江苏晨牌药业有限公司苏卫药准字(1992)第号中国药典2005年版南京威尔化工有限公司苏卫药准字(2001)第号《中国药典》2005年版二部大连旅顺化工厂国药准字H 中国药典2000年版上海申宇医药化工有限公司沪卫药准字(1995)第号《中国药典》2005年版二部龙游聚兴粮油医药化工有限公司浙卫药准字(1996)第号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字 F 中国药典2005年版甜菊素成都菊乐制药厂川卫药准字(90)F-04-02号中国药典2005年版江苏健佳药业有限公司苏药准字(2005)第号中国药典2005年版北京天安甜菊糖制品有限公司京卫药准(1996)第号中国药典北京天安甜菊糖制品有限公司京卫药准(92)第124号《中国药典》2005年版二部曲阜香州食品有限责任公司国药准字《中国药典》2005年版二部山东曲阜香州食品有限公司国药准字H GB8270-1999天津南大凯泰药业有限公司津卫药准字(1991)第号中国药典2005年版二部湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版碳酸氢钠自贡鸿鹤制药有限责任公司国药准字H 《中国药典》2005年版二部北京凌云建材化工有限公司国药准字H 中国药典上海虹光化工厂国药准字H 《中国药典》2005年版二部供注射用上海虹光化工厂国药准字H 《中国药典》2005年版二部河北华晨药业有限公司国药准字H 《中国药典》2005年版二部碳酸钙上海碳酸钙厂国药准字H 《中国药典》2005年版二部上海耀华纳米科技有限公司国药准字H 中国药典碳酸钠湖南尔康制药有限公司国药准字H 部颁标二部第五册三氯叔丁醇湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版部分预胶化淀粉美国卡乐康注册证号:H 进口药品注册标准JX三硅酸镁山东聊城阿华制药有限公司鲁卫药准字(1999)第号《中国药典》2005年版二部麝香草酚广州百花香料股份有限公司国药准字H WS-1-32-82-89司盘85(山梨醇酐三油酸酯)龙游聚兴粮油医药化工有限公司浙药准字(1996)第号浙江省药品标准DB33/WS-491-83-93水杨酸甲酯广州化学试剂厂粤卫药准字(1994)第号部颁标准江苏省洪兴化工厂国药准字H 部颁标准佛山市南海中南药化厂国药准字H WS1-07(B)-89华阴市锦前程药业有限公司国药准字H WS1-07(B)-89湖南尔康制药有限公司湘食药辅准字F 卫生部药品标准化学药品及制剂第一册石油醚辽阳华兴药用辅料有限公司辽卫药准字(2000)第号《中国药典》2005年版二部山梨酸湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版二部山梨醇广西南宁化学制药有限责任公司国药准字H 《中国药典》2005年版二部华北制药华盈股份有限公司国药准字H 《中国药典》2005年版二部石家庄华康制药有限公司国药准字H 中国药典2005年版羧甲基纤维素钠淮南山河药用辅料有限公司皖药准字F 中国药典上海赛璐珞厂沪卫药准字1995第号 WS-10001-(HD-0486)-2002 湖州展望药业有限公司浙药准字F号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F WS-10001-(HD-0486)-2002羧甲基纤维素湖州展望药业有限公司浙药准字F号《中国药典》2005年版二部羧甲基淀粉钠湖州展望药用辅料有限公司浙卫药准字(1996)第号中国药典2005年版湖州展望药业有限公司浙药准字F号《中国药典》2005年版二部安徽山河药业有限公司皖药准字(2001)第F号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版嘉兴白浪淀粉制品有限公司浙药准字(2004)第号《中国药典》2005年版二部曲阜市天利药用辅料有限公司鲁药准字(2002)第号《中国药典》2005年版二部浙江中维药业有限公司浙药准字(2005)第号《中国药典》2005年版二部无锡市凯利药业有限公司苏卫药准字(2000)第号《中国药典》2005年版二部连云港万泰医药材料有限公司苏卫药准字(2001)第号《中国药典》2005年版二部山东聊城阿华制药有限公司鲁卫药准字(1998)第号《中国药典》2005年版二部曲阜市药用辅料有限公司鲁药准字(2000)第号《中国药典》2005年版二部山东新大精细化工有限公司鲁药准字(2005)第号《中国药典》2005年版二部营口奥达制药有限公司辽卫药准字(1996)第号《中国药典》2005年版二部永日化学工业股份有限公司(中国台湾) 医药产品注册证号:HC 进口药品注册标准JX超级羧甲基淀粉钠中维药业有限公司浙药准字(2005)第号《中国药典》2005年版二部十二烷基硫酸钠湖南尔康制药有限公司湘食药辅准字 F 《中国药典》2005年版二部浙江豪森制药有限公司浙卫药准字(1996)第号乳酸无锡市第二制药厂国药准字H 《中国药典》2005年版二部偃师乳酸有限公司国药准字H 中国药典2005年版湖南尔康制药有限公司湘食药辅准字F GB2023-2003乳糖DMV International(荷兰)进口药品注册证号H 进口药品注册标准JXMolkerei MEGGLE WasserburgGmbH & Co.KG (德国美剂乐)进口药品注册证号H~H进口注册标准JX (60 70、80、100、200目)湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版上海华茂药业有限公司沪卫药准字(1998)第号《中国药典》2005年版二部石家庄精晶药业有限公司冀药准字(2004)第号《中国药典》2005年版二部镇江市康富生物工程有限公司苏药准字(2007)第号《中国药典》2005年版二部上海运宏化工制剂辅料技术有限公司进口药品注册证号JX 中国药典2005年版二部北京凤礼精求商贸有限公司经销国药准字H 中国药典2005年版常州朗生生物工程有限公司苏药准字(2003)第号《中国药典》2005年版二部The lactose company ofNew Zealand Limited (新西兰进口) 进口药品注册证号:H 进口药品注册标准JXThe lactose company ofNew Zealand Limited (新西兰进口) 进口药品注册证号H JX全氟丙烷核工业理化工程研究院国药准字F琼脂福建泉州市泉港化工厂闽卫药准字(1996)第号《中国药典》2005年版二部氢氧化钾湖南尔康制药有限公司湘食药辅准字F YY0209-95氢氧化铝山东聊城阿华制药有限公司鲁卫药准字(1999)第号《中国药典》2005年版二部氢氧化钠湖南尔康制药有限公司湘食药辅准字F 《中国药典》2005年版二部成都华邑药用辅料制造有限责任公司川药准字F 中国药典2005年版二部羟丙基甲基纤维素湖州展望药业有限公司浙卫药准字(1996)第号《中国药典》2005年版二部安徽山河药用辅料有限公司皖药准字(2002)第F0003号中国药典2005年版营口奥达制药辽卫药准字(2000)第号中国药典2005年版泰安瑞泰纤维素有限公司鲁卫药准字(1995)第号《中国药典》2005年版二部日本Shin-Etsu Chemical 进口药品注册证号H 中国药典2005年版美国药典28版浙江中维药业有限公司浙药准字(2005)第号《中国药典》2005年版二部The Dow Chemical Company(美国DOW公司进口) 进口药品注册证号:H 进口药品注册标准JX山东赫达股份有限公司鲁药准字(2002)第号《中国药典》2005年版二部山东聊城阿华制药有限公司鲁卫药准字(1999)第号《中国药典》2005年版二部曲阜市药用辅料有限公司鲁药准字(2002)第号《中国药典》2005年版二部卡乐康(上海)贸易有限公司进口药品注册证号:JX羟丙基纤维素湖州展望药业有限公司浙药准字F号《中国药典》2005年版二部湖州展望药业有限公司浙卫药准字(1996)第号《中国药典》2005年版二部安徽山河药用辅料有限公司皖药准字(2001)第F号中国药典2005年版山东聊城阿华制药有限公司鲁卫药准字(1998)第号《中国药典》2005年版二部营口奥达制药辽卫药准字(1994)第号中国药典2005年版浙江中维药业有限公司浙药准字(2005)第号《中国药典》2005年版二部无锡市凯利药业有限公司苏卫药准字(2000)第号中国药典2005年版曲阜市药用辅料有限公司鲁药准字(2002)第号《中国药典》2005年版二部山东赫达股份有限公司鲁药准字(2003)第号《中国药典》2005年版二部泰安瑞泰纤维素有限公司鲁药准字(2005)第号《中国药典》2005年版二部羟苯乙酯(尼泊金乙酯)广州汉普医药有限公司国药准字H 《中国药典》2005年版二部太仓市新湖医药化工厂苏药准字(2002)第号《中国药典》2005年版二部广东台山新宁制药股份有限公司国药准字H 《中国药典》2005年版二部扬州星斗药业有限公司苏卫药准字(1982)第号《中国药典》2005年版二部广州越秀制药厂粤卫药准字(1996)第号中国药典2000年版昆山市双友日用化工有限公司国药准字H 《中国药典》2005年版二部浙江圣效化工有限公司浙药准字(2003)第号中国药典2000年版太仓市新湖医药化工厂苏卫药准字(2001)第号中国药典2005年版广东台山市新华制药厂国药准字H 《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版羟苯甲酯(尼泊金甲酯)广东省台山市新宁制药厂国药准字H 《中国药典》2005年版二部昆山市双友日用化工有限公司苏卫药准字(1987)第号江苏省药品标准1987年液状石蜡中国石化集团杭州炼油厂浙卫药准字(1996)第号《中国药典》2005年版二部杭州炼油厂浙卫药准字(1996)第号《中国药典》2005年版二部轻质液状石蜡中石化集团杭州炼油厂浙卫药准字(1996)第号 WS1-80(B)-89吉林市吉化江城油脂化工有限公司吉卫药准字(1996)第号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F 部颁二部1册葡萄糖潍坊盛泰药业有限公司国药准字H 《中国药典》2005年版二部河南莲花英糖药业国药准字H 《中国药典》2005年版二部山东祥瑞药业有限公司国药准字H 《中国药典》2005年版二部华北制药康欣有限公司国药准字H 《中国药典》2005年版二部石家庄市华营联合葡萄糖厂国药准字H WS1-05(B)-89潍坊盛泰药业有限公司国药准字H 部颁标准WS1-05(B)-89 秦皇岛骊骅淀粉股份公司国药准字H 部颁标准硼酸自贡鸿鹤制药有限责任公司国药准字H 《中国药典》2005年版二部北京燕京药业有限公司国药准字H 《中国药典》2005年版二部广东台山市新华制药厂国药准字H 中国药典2005年版葡甲胺上海医药(集团)有限公司国药准字H 《中国药典》2005年版二部硼砂自贡鸿鹤制药有限责任公司国药准字H 中国药典2005年版广东台山市新华制药厂国药准字H 中国药典2005年版浓氨溶液南京化学试剂有限公司苏药准字(2008)第号中国药典2000年版湖南尔康制药有限公司国药准字H 中国药典2005年版木糖醇浙江华康药业有限公司浙卫药准字(1998)第号《中国药典》2005年版二部明胶青海明胶股份有限公司青食药准字F GB2354-98 蚌埠丰原明胶有限公司皖药准字F GB2354-98东光县亚星蜡制品厂冀卫药准字(2000)第号中国药典河北省东光县东方蜂蜡加工厂冀卫药准字(2002)第号中国药典罗赛洛(广东)明胶有限公司粤药准字F QB-2354-98罗赛洛(温州)明胶有限公司浙药准字(2003)第号中国药典2005年版二部罗赛洛(大安)明胶有限公司国药准字F包头东宝乐凯彩感明胶股份有限公司国药准字F甘肃明珠胶业有限责任公司国药准字F海安县申宇明胶有限公司苏卫药准字(1987)第号中国药典2005年版二部威海永康明胶有限公司鲁卫药准字(1995)第号《中国药典》2005年版二部山东省沂水恒源胶业有限公司鲁药准字(2001)第号《中国药典》2005年版二部青岛益青明胶有限公司鲁药准字(2000)第号《中国药典》2005年版二部文登市明胶厂鲁卫药淮字(1995)第号《中国药典》2005年版二部邻苯二甲酸羟丙甲基纤维素酯Shin-Etus Chemical Co.,Ltd.(日本进口)进口药品注册证号:H 进口药用辅料注册标准JX酒石酸L-酒石酸湖南尔康制药有限公司湘食药辅准字F YY0207-95硫酸镁上海宝达化工有限公司国药准字H 《中国药典》2005年版二部硫酸钙湖州展望药业有限公司浙卫药准字(1996)第号《中国药典》2005年版二部浙江中维药业有限公司浙药准字(2005)第号中国药典2005年版上海青平药业有限公司(上海天平胃舒平制药厂)沪卫药准字(1995)第号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F 中国药典2005年版磷酸氢钙。
中国药典年版药用辅料概述

药用辅料对药物稳定性的影响
• 得一到般提来高说。药但物是经有包时合也,可由以于降隔低离药了物水的分稳、定氧性气,、例光如线固,体其制稳剂定中性药可用以
辅料对稳药物稳定性产生影响的机制主要有以下几种(1)起表面催 化作用;(2)改变了液层中的PH;(3)直接与药物产生相互作用
• 是处一方种中常的用基的质润及滑赋剂形,剂与对阿处司方匹的林稳共定存性时也可将加产速生阿影司响匹,林例的如水硬解脂,酸其镁
成分以外一切物料的总称、是药物制剂的重要组成成分。
• 作为:有意加入提高药品的安全性、有效性、稳定性、依
从性为目的的。
药用辅料的作用
• 作为必须的赋形剂 • 例如片剂的粘合剂,乳剂的乳化剂,混悬剂的助悬剂,脂
质体的磷脂,气雾剂的抛射剂等等,在药物制剂中是必需 的,其在制剂中存大是不可或缺的。
• 作为附加剂或填充剂 • 要原充则分上考不虑改填变充药剂物对剂药型物的的性影能响,,可例以如选,择乳的糖余是地一较个大常,用但
原因有两个:硬脂酸镁能与阿司匹林形成相应的乙酰水杨酸镁,溶解 度增加:硬脂酸镁具弱碱性而有催化作用。有研究表明阿司匹林单独 的水解机制异于阿司匹林和硬脂酸镁一起的水解。所以选用阿司匹林 片的润滑剂时,就考虑到主药的稳定性,故而选用滑石粉或硬脂酸。 因此,药用辅料的选择应考虑对药物的稳定性的影响。
QbD:从辅料到处方设计
• 4、辅料的质量标准不断升级:FRCs
国家食品药品监督管理局药品注册司关于药用辅料使用地方批准文号有关问题的复函

国家食品药品监督管理局药品注册司关于药用辅料使用地方批准文号有关问题的复函
文章属性
•【制定机关】国家食品药品监督管理局(已撤销)
•【公布日期】2006.09.28
•【文号】食药监注函[2006]102号
•【施行日期】2006.09.28
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家食品药品监督管理局药品注册司关于药用辅料使用地方
批准文号有关问题的复函
(食药监注函[2006]102号)
山东省食品药品监督管理局:
你局《关于药用辅料仍使用地方批准文号是否合法有效的请示》(鲁食药监注函〔2006〕第81号)收悉,经研究认为鉴于我局正在制定药用辅料注册管理的有关规章,且国家未曾撤销药用辅料地方批准文号,故原省级卫生行政部门或省级药品监督管理部门合法批准的药用辅料批准文号仍合法有效。
特此函复
国家食品药品监督管理局药品注册司
二○○六年九月二十八日。
原料药批文

原料药批文
原料药批文是指国家药品监督管理部门对原料药生产企业生产的原料药进行审查后,批准该原料药可以在市场上销售和使用的文件。
原料药批文通常包括以下内容:
1. 药品名称:原料药的通用名、汉语拼音、英文名等。
2. 剂型:原料药的剂型,如片剂、胶囊剂、注射剂等。
3. 规格:原料药的规格,如每片、每粒、每支等的含量。
4. 批准文号:原料药的批准文号,是国家药品监督管理部门批准生产的证明。
5. 生产企业:原料药的生产企业名称、地址、生产许可证编号等。
6. 药品标准:原料药的质量标准,包括性状、鉴别、检查、含量测定等项目。
7. 包装:原料药的包装规格、材质、标签等。
8. 贮藏:原料药的贮藏条件,如温度、湿度等。
9. 有效期:原料药的有效期。
10. 生产工艺:原料药的生产工艺,包括原材料、生产过程、质量控制等。
11. 说明书:原料药的说明书,包括用法用量、不良反应、禁忌等。
12. 其他:其他需要说明的事项,如注意事项、药理作用等。
原料药批文是原料药生产企业生产和销售原料药的合法证明,也是药品监管部门对原料药质量进行监管的重要依据。
药用辅料批准文号规则

药用辅料批准文号规则全文共四篇示例,供读者参考第一篇示例:药用辅料批准文号是指食品药品监督管理部门核准的药用辅料的唯一标识符号。
药用辅料批准文号的规则对于药品生产企业来说非常重要,一方面可以确保药用辅料符合法规要求,另一方面也可以有效管理药品生产过程,保障药品质量和安全性。
下面我们就来详细介绍一下药用辅料批准文号的规则。
药用辅料批准文号由国家药监部门统一管理。
所有的药用辅料在使用前都必须获得相关批准文号,这是因为药用辅料是药品生产过程中不可或缺的一部分,直接影响到药品的质量和安全性。
只有通过严格的审批和管理,才能确保药用辅料的质量符合标准,以及符合国家相关法规。
药用辅料批准文号的编制规则是按照一定的规范和流程进行的。
通常情况下,药用辅料批准文号是由数字、字母和符号组成的组合形式。
数字部分代表不同的分类和规格,字母部分用于区分不同的品种和批次,符号则起到连接数字和字母的作用,构成一个完整的批准文号。
药用辅料批准文号的有效期通常是有限期限的。
一般而言,药用辅料批准文号的有效期为5年。
在有效期内,药用辅料可以在生产药品时使用,但是一旦有效期到期,就需要重新进行审批和申请,获得更新的批准文号才能继续使用。
药用辅料批准文号还需要根据实际情况进行管理和监督。
生产企业在使用药用辅料时,需要根据药用辅料批准文号进行准确的匹配和使用,不能混淆或替代。
药用辅料批准文号也需要随时准备接受监督检查,确保其质量和合规性。
药用辅料批准文号规则的制定和执行对于保障药品质量和安全至关重要。
只有严格遵循规则,才能确保药用辅料的质量和安全性,以及保障患者的用药安全。
希望各药品生产企业和相关管理部门能够加强对药用辅料批准文号规则的执行和监督,共同维护药品生产的良好秩序和社会公共利益。
【文章总字数:432】。
第二篇示例:药用辅料批准文号是指由国家药监部门颁发的一种证明,用于证明药用辅料符合相关法规规定,可以用于药品生产中。
药用辅料批准文号的规则是非常严格和细致的,它包括了申请流程、条件要求、审核标准等多方面内容。
原料药品种批文

原料药品种批文
原料药品种批文是指国家药品监督管理部门对原料药生产企业生产的特定品种原料药进行审批后颁发的许可文件。
该文件详细说明了该品种原料药的生产工艺、质量标准、检验方法等重要信息。
原料药品种批文的申请和获得需要经过严格的审查和评估,以确保该品种原料药的质量和安全性符合国家相关法规和标准的要求。
获得原料药品种批文后,生产企业可以合法地生产和销售该品种原料药,并在药品制剂生产过程中使用。
对于药品生产企业而言,获得原料药品种批文是确保原料药供应稳定和质量可靠的重要保障。
同时,原料药品种批文也是药品监管部门对药品生产企业进行监管和管理的重要依据之一。
需要注意的是,原料药品种批文的具体内容和要求可能因国家和地区的不同而有所差异。
在进行原料药生产和销售活动时,务必遵守当地相关法规和标准,并与药品监管部门保持良好的沟通和合作。
药用辅料批准文号规则

药用辅料批准文号规则全文共四篇示例,供读者参考第一篇示例:药用辅料批准文号是指国家食品药品监督管理总局(以下简称国家食药监局)对药用辅料进行批准的编号。
药用辅料是指在制药过程中,不是药品主要成分,但在药品质量、稳定性、生产工艺等方面起到关键作用的辅助物质。
药用辅料批准文号的规则对于药品生产企业和监管部门都非常重要,能够保证药用辅料的质量和安全性。
药用辅料批准文号的规则主要包括以下几个方面:1. 批准文号的组成:药用辅料批准文号一般由国家食药监局统一制定,由多位数字组成。
一般来说,批准文号由6位数字组成,前两位数字表示该药用辅料的分类,第三位数字表示制剂形式,后三位数字是顺序码。
批准文号为国食药监批准字03第12345号。
2. 批准文号的分类:药用辅料根据其用途、来源和性质等不同特点进行分类,每种分类都有相应的编号。
常见的药用辅料分类包括溶剂、填充剂、分散剂、润湿剂、粘合剂等。
通过分类编码,可以方便生产企业和监管部门对药用辅料进行管理和监督。
3. 批准文号的申请流程:生产企业在申请药用辅料批准文号时,需要提交相关证明材料,并按照国家食药监局的规定进行审批。
审批过程通常包括技术评审、质量验证、安全性评估等环节,确保药用辅料符合相关标准和法规要求。
4. 批准文号的使用范围:药用辅料批准文号是在生产许可证上的必备信息之一,生产企业必须在生产过程中严格按照批准文号规定使用药用辅料。
只有获得批准文号的药用辅料才能用于药品生产,确保药品的质量和安全性。
5. 批准文号的监管:国家食药监局对药用辅料批准文号进行监管,定期对生产企业进行检查和抽样检验,确保药用辅料的质量和安全性。
对于不符合规定的药用辅料,国家食药监局将采取相应的处罚措施,维护药品市场秩序。
药用辅料批准文号规则是保障药品生产质量和安全的重要环节。
生产企业必须严格遵守相关规定,确保药用辅料的质量和安全性。
国家食药监局也要加强对药用辅料的监管,保障公众的用药安全。
关于(品种)各种批文的说明

关于(品种)各种批文的说明一、药品类批文:均按药品类管理,凭借药品经营许可证经营,经营范围在营业执照上登记。
一)国产药品批文格式:国药准字H(Z、B、j、S、F、T)+4位年数+4位顺序(例:国药准字Z20140023)其中 Z:中药; B:保健药品; j:进口药品分包装; S:生物制品; F:药用辅料; H:化学药品; T:体外生物诊断试剂(药品类管理的体外诊断试剂)二)新药证书号的格式:国药证字H(Z、S)+4位年号+4位顺序三)进口药品批文格式:进口药品注册证号:H(Z、S)+4位年号+4位顺序;医药产品注册证号:H(Z、S)C+4位年号+4位顺序四)补充申请批件或补充批件:改变、增加或者取消原批准事项或者内容的,提出补充申请,审批部门同意后,发给补充申请批件,补充申请批件有效期与原注册批件(或再注册批件)有效期一致。
注:进口药品分包装,应当是药品GMP生产企业申请,发给药品批准证明文件。
药品类批文一般有效期为5年二、医疗器械类批文:均按医疗器械类管理,凭借二类备案凭证或三类许可证经营,一类不需要备案或许可,一、二、三类须在营业执照上登记。
一)二类、三类医疗器械批文:注册证编号的编排方式为:(审批部门所在地简称)+械注+(注册形式)+4位年份+管理类别+产品分类编码+4位流水数。
其中审批部门所在地的简称: 境内第三类医疗器械、进口第二类、第三类医疗器械为“国”字;境内第二类医疗器械为注册审批部门所在地省、自治区、直辖市简称;注册形式: “准”字适用于境内医疗器械;“进”字适用于进口医疗器械;“许”字适用于香港、澳门、台湾地区的医疗器械;(例:浙械注准20152400434)二)一类医疗器械批文:一类医疗器械备案编排格式为:(备案部门所在地简称)+械备+4位年份+4位流水号其中:备案部门所在地简称:进口第一类医疗器械为“国”字;境内第一类医疗器械为备案部门所在地省、自治区、直辖市简称加所在地设区的市级行政区域的简称(无相应设区的市级行政区域时,仅为省、自治区、直辖市的简称);(例:浙杭械备20150324号)医疗器械类批文一般有效期为5年,2014年10以前的批文有效期一般为4年,一类备案批文一般无有效期三、保健食品批文:均按保健食品类管理,凭借食品流通许可证或卫生许可证或食品证或食品经营许可证经营,并且在营业执照上登记。
药包材药用辅料关联审评审批政策解读(一)

药包材药用辅料关联审评审批政策解读(一)随着药品生产技术的不断提高和更新,药包材和药用辅料在药品制剂中占据着越来越重要的地位。
这些材料可以帮助药品更好地发挥药效和质量,同时也对药品的安全性和稳定性产生重大影响。
因此,药包材和药用辅料的审评审批政策也成为了众多制药企业和药品监管部门十分关注的话题。
一、药包材的审评审批政策药包材是指用于制药和包装的各种材料,包括药品生产过程中接触药品的包装材料、灭菌包装材料、贮存材料等。
由于药包材与药品接触,因此其质量对药品的安全性和稳定性至关重要。
为此,国家药品监管部门制定了如下审评审批政策:(一)药包材的种类目前我国主要使用的药包材包括:塑料袋、玻璃瓶、铝箔袋、硬胶囊、软胶囊、针头、留置针、输液器、输液袋、输液管等。
其中,塑料袋、玻璃瓶和铝箔袋是目前生产和使用最广泛的药包材。
(二)药包材的审评审批依据药品生产使用的药包材需要符合如下要求:1.材料应为安全无毒,不会对人体健康产生危害;2.制造和使用过程中应遵循相应的技术要求,确保其品质稳定性和可靠性;3.药包材的选用应符合药品的特性和需要,能够充分发挥药品的药效和稳定性;4.材料的包装、贮存和使用过程中应遵循相关的卫生、安全规定和操作规程,确保其干净、无菌,不会受到污染或损坏。
(三)药包材的审评审批程序药包材的审评审批程序一般包括以下环节:1.材料检查:检查各种药包材的材质、结构、尺寸、外观等是否符合要求;2.生产工艺评价:评估生产工艺的合理性和可行性,包括生产设备、生产线布局、工艺流程、工艺参数等方面的评估;3.品质评价:评估药包材的品质、稳定性和可靠性,包括对材料的化学、物理、微生物学、生物相容性等方面进行评价;4.实际使用评估:对药包材在实际生产和使用中的表现进行评估,包括材料的包装方式、存储条件、使用方法等方面的评估;5.审评结论:根据评估结果,进行审评结论,并据此向制药企业和监管部门发布相关通知。
二、药用辅料的审评审批政策药用辅料是指用于药品制剂中的各种其他材料,包括溶剂、助剂、填料、乳化剂等。
崩解剂

公司 山河药 辅 湖州展 望
来源 国产 国产
批文 有 有
价格(元/公斤) 17 15
新型超级崩解剂
结冷胶和黄原胶SM的性质和作用与超级崩解剂类似。 结冷胶和黄原胶SM的性质和作用与超级崩解剂类似。 SM的性质和作用与超级崩解剂类似
结冷胶: 结冷胶:
由线性的四糖组成的阴离子多聚糖,从假单胞菌衍生而来。 由线性的四糖组成的阴离子多聚糖,从假单胞菌衍生而来。 当4%的结冷胶用于布洛芬片剂时,崩解时间为4min,这要比 4%的结冷胶用于布洛芬片剂时,崩解时间为4min, 的结冷胶用于布洛芬片剂时 4min 用干淀粉或Avicel PH102(>15min)优越得多。 用干淀粉或Avicel PH102(>15min)优越得多。
交联聚维酮(PVPP) 交联聚维酮(PVPP)
高毛细管活性&优异的 吸水能力,无凝胶倾向
水分迅速进入片剂中, 促使网络结构膨胀
片剂崩解,活性物质释放
批文: INTERNATIONAL SPECIALTY PRODUCTS INC.(美国进 口) 进口药品注册证号:H20030278 进口药品注 册标准JX19990242 德国BASF 进口药品注册证号H20020137 进口药品 注册标准JX20010420 上海申美医药开发科技有限公司(代理ISP) 进口药 品注册证号H20030418 进口药品注册标准JX20020273
交联聚维酮 又称聚乙烯吡咯烷酮,PVPP。 分子式:(C6H9NO)N 性状:为白色流动性粉末,分子呈网状立体结构, 不溶于水、酸、碱及常用有机溶剂,但能迅速溶胀, 体积增加150% --200%,分子量大于70万。
交联聚维酮的制备方法(CN101935370A ): 50%氢氧化钠溶液作为引发剂,加入N-乙烯 基吡咯烷酮,50%氢氧化钠溶液与N-乙烯基吡咯烷 酮质量比是1∶100,在通入氮气保护的条件下,保 持溶液反应温度在128℃下反应3小时,然后快速降 温至80-85℃后使用纯化水洗涤,洗涤后,再将交联 聚维酮投入洗釜中,加入柠檬酸调节pH值为2-5,再 加入质量分数为30%双氧水80-85℃洗涤,产物用水 多次充分洗涤,在热风干燥器中干燥除去水分,最 终得到不同交联度的交联聚维酮。
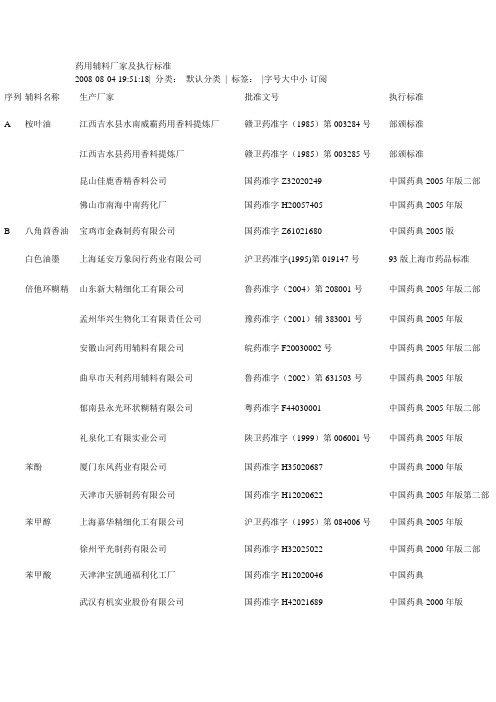
药用辅料 生产厂家-批准文号-执行标准汇总表[1]
![药用辅料 生产厂家-批准文号-执行标准汇总表[1]](https://img.taocdn.com/s3/m/f23ac42f647d27284b7351b3.png)
序列 辅料名称
生产厂家
批准文号
A 桉叶油
江西吉水县水南威霸药用香料提炼 厂
赣卫药准字(1985)第003284号
江西吉水县药用香料提炼厂
赣卫药准字(1985)第003285号
昆山佳鹿香精香料公司 佛山市南海中南药化厂
国药准字Z32020249 国药准字H20057405
B 八角茴香油 宝鸡市金森制药有限公司
国药准字H32022586
浙江省凤凰化工股份有限公司 国药准字H33022702
无锡正达医药卫生用品厂
国药准字H32026785
欧洲药典
中国药典2000年版二部 中国药典2005年版二部 中国药典2000年版 中国药典2005年版 中国药典2005年版 中国药典2005年版二部 中国药典2005年版二部 中国药典2005年版 中国药典2005年版二部 中国药典2005年版二部 中国药典2005年版二部 中国药典2005年版二部 中国药典2005年版二部 中国药典2005年版二部 中国药典2005版二部 中国药典2005年版二部 中国药典
苏药准字(2003)第214401号
Lyondell Chemical Company(美 国)
国药准字H20030196
美国利安德公司
丙烯酸树脂 Ⅱ
湖州展望化学药业有限公司
冰醋酸
广州化学试剂厂
进口药品注册证号H20030196 浙药准字(2001)第224401号 粤卫药准字(1996)第100040号
国药准字Z31020574
国药准字Z34021098
安徽太岛薄荷药业有限公司
国药准字Z34020003
上海新嘉香料有限公司
国药准字H31020574
常用辅料国内批文统计2017-420
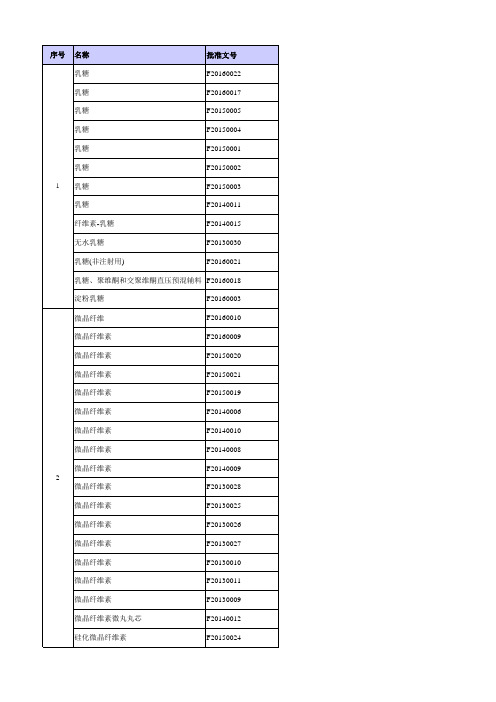
2020/12/9 2021/7/11 2020/12/31 2020/12/31 2020/9/23
---粘度3mPa.s-100000mPa.s ------------------L SSL SL LM M S630 ---- ---- ---- ----------------------
JXFL1100009(受理 号)
F20160008
38 聚维酮 K30
F20140007
聚维酮 K30 39 聚维酮 K25
F20140033 F20160007
40 聚维酮碘
H20130306
41 聚醋酸乙烯酯聚维酮混合物
F20130002
42 聚山梨酯20
JXFL1200028国
43 聚乙烯醇聚乙二醇共聚物
2018/4/7
(Asahi Kasei Chemicals Corporation)
2019/7/10
J.Rettenmaier & Sohne Gmbh+Co.KG
2020/12/21
规格 ------200目 100目 60目 70目 80目 ---80目 DT,DTHV ----
---type112 type200 PH102SCG PH302 PH112 KG802 Type101 Type102 Type12 PH302 PH101 PH102 PH301 PH102 PH200 PH101 N/A N/A
15
维生素C
H31022436
维生素C
H34021749
柠檬酸三乙酯 16
药用辅料批准文号规则-概述说明以及解释

药用辅料批准文号规则-概述说明以及解释1.引言1.1 概述药用辅料是指在药品制剂过程中,不可避免地需要添加的辅助物质。
这些辅料不仅可以改善药品的品质、稳定性和有效性,还可以提高制剂过程的可行性和经济效益。
因此,药用辅料在药品生产中扮演着重要的角色。
然而,由于药用辅料的多样性和复杂性,其使用存在一定的风险。
为了保障药品的安全性和有效性,以及满足监管要求,药用辅料需要经过严格的监管和审批程序。
在中国,药用辅料必须获得批准文号才能投入市场和使用。
药用辅料批准文号规则是指为了对药用辅料进行有效管理和监管而制定的规则和要求。
这些规则主要包括申请流程、技术要求、审核标准等内容。
药用辅料批准文号规则的实施可以有效提高药品质量和安全性,保障患者的用药安全。
本文将介绍药用辅料批准文号规则的相关内容,包括药用辅料的定义和作用,药用辅料批准文号的意义。
同时,我们还将讨论药用辅料批准文号规则的重要性和对药用辅料市场的影响。
通过深入了解药用辅料批准文号规则,我们可以更好地理解药用辅料在药品生产中的重要性,并加强对药用辅料的管理和监管。
1.2文章结构1.2 文章结构本文将按照以下结构进行讨论和分析药用辅料批准文号规则的相关内容。
1. 引言引言部分将对药用辅料批准文号规则的背景和重要性进行介绍,为后续内容的理解和阐述奠定基础。
首先概述药用辅料的定义和作用,以便读者对药用辅料的概念有一个清晰的认识。
接着介绍本文的结构和目的,明确本文的研究范围和目标。
2. 正文正文部分将详细探讨药用辅料批准文号的意义。
首先,将阐述药用辅料批准文号的定义和涵义,以便读者对该概念有一个全面的了解。
然后,将从多个角度探讨药用辅料批准文号的意义。
包括但不限于以下几方面:- 对药用辅料的质量保证:药用辅料批准文号作为一种许可证,可以有效确保药用辅料的质量和安全性,为患者提供安全可靠的药品治疗保障。
- 对药用辅料市场的规范管理:药用辅料批准文号的存在可以有效规范和管理药用辅料市场,降低市场风险和不良竞争现象,促进市场的健康发展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羟苯乙酯(xx金乙酯)广州汉普医药有限公司国药准字H《中国药典》2005年版二部太仓市新湖医药化工厂苏药准字(2002)第200608号《中国药典》2005年版二部广东台山新宁制药股份有限公司国药准字H《中国药典》2005年版二部扬州星斗药业有限公司苏卫药准字(1982)第212201号《中国药典》2005年版二部广州越秀制药厂粤卫药准字(1996)第123008号中国药典2000年版昆山市双友日用化工有限公司国药准字H《中国药典》2005年版二部浙江圣效化工有限公司浙药准字(2003)第224701号中国药典2000年版太仓市新湖医药化工厂苏卫药准字(2001)第200608号中国药典2005年版广东台山市新华制药厂国药准字H《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F中国药典2005年版羟苯甲酯(尼泊金甲酯)xxxxxx制药厂xx双友日用化工有限公司液状石蜡中国石化集团xx炼油厂xx炼油厂轻质液状石蜡中石化集团xx炼油厂xxxxxx油脂化工有限公司xxxx制药有限公司葡萄糖xxxx药业有限公司xx莲花英糖药业xx祥瑞药业有限公司xx制药xx有限公司xxxx联合葡萄糖厂xxxx药业有限公司xxxx淀粉股份公司硼酸自贡xx鹤制药有限责任公司xxxx药业有限公司xxxx新华制药厂xx甲胺xx医药(集团)有限公司硼砂自贡xx鹤制药有限责任公司xxxx新华制药厂浓氨溶液xx化学试剂有限公司xxxx制药有限公司木糖醇xx华康药业有限公司明胶xx明胶股份有限公司xxxx明胶有限公司xx亚星蜡制品厂xxxx东方蜂蜡加工厂xx(xx)明胶有限公司xx(xx)明胶有限公司xx(大安)明胶有限公司国药准字H 苏卫药准字(1987)第358001号浙卫药准字(1996)第163901号浙卫药准字(1996)第166601号浙卫药准字(1996)第166601号吉卫药准字(1996)第211149号湘食药辅准字F国药准字H国药准字H国药准字H国药准字H国药准字H国药准字H国药准字H国药准字H国药准字H国药准字H国药准字H国药准字H国药准字H苏药准字(2008)第243401号国药准字H浙卫药准字(1998)第220902号青食药准字F皖药准字F冀卫药准字(2000)第060320号冀卫药准字(2002)第060319号粤药准字F浙药准字(2003)第132302号国药准字F2005年版二部江苏省药品标准1987年2005年版二部WS1-80(B)-892005年版二部部颁二部1册2005年版二部2005年版二部WS1-05(B)-89部颁标准WS1-05(B)-89部颁标准2005年版二部中国药典2005年版二部中国药典2005年版中国药典2000年版中国药典2005年版《中国药典》2005年版二部GB2354-98GB2354-98中国药典xx药典QB-2354-98xx药典2005年版二部《xx药典》《中国药典》《中国药典》《中国药典》《中国药典》《中国药典》《中国药典》《中国药典》《xx药典》《xx药典》《xx药典》包头东宝乐凯彩感明胶股份有限公司国药准字Fxxxx胶业有限责任公司国药准字Fxxxx明胶有限公司苏卫药准字(1987)第233802号中国药典2005年版二部威海永康明胶有限公司鲁卫药准字(1995)第597001号《中国药典》2005年版二部山东省沂水恒源胶业有限公司鲁药准字(2001)第571002号《中国药典》2005年版二部青岛益青明胶有限公司鲁药准字(2000)第512001号《中国药典》2005年版二部文登市明胶厂鲁卫药淮字(1995)第583001号《中国药典》2005年版二部邻苯二甲酸羟丙甲基纤维素酯Shin-Etus Chemical Co.,Ltd.(xx进口)进口药品注册证号:H进口药用辅料注册标准JX200330酒石酸L-酒石酸湖南尔康制药有限公司湘食药辅准字FYY0207-95硫酸镁上海宝达化工有限公司国药准字H《中国药典》2005年版二部硫酸钙xx展望药业有限公司浙卫药准字(1996)第174701号《中国药典》2005年版二部浙江中维药业有限公司浙药准字(2005)第174702号中国药典2005年版上海青平药业有限公司(xx天平胃舒平制药厂)沪卫药准字(1995)第061002号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F中国药典2005年版磷酸氢钙湖州展望药业有限公司国药准字H《中国药典》2005年版二部偃师乳酸有限公司国药准字H《中国药典》2005年版二部连云港德邦精细化工有限公司国药准字H中国药典磷酸氢二钠湖南华纳大药厂有限公司国药准字H生物制品质控标准2002年版YBH湖南九典制药有限公司国药准字H国家药监局药品标准(试行)YBH成都华邑药用辅料制造有限责任公司川药准字F国家食品药品监督管理局标准YBH磷酸二氢钠湖南九典制药有限公司国药准字H《中国药典》2005年版二部湖南华纳大药厂有限公司国药准字H《中国药典》2005年版二部成都华邑药用辅料制造有限责任公司川药准字F《中国药典》2005年版二部氯化钠四川自贡鸿鹤制药有限责任公司国药准字H《中国药典》2005年版二部江苏南通勤奋药业公司国药准字H320718《中国药典》2005年版二部天津开发区海光化学制药厂国药准字H120004企业标准中盐宏博集团云梦云虹制药有限公司国药准字H5《中国药典》2005年版二部平顶山同辉药业有限公司国药准字H《中国药典》2005年版二部氯化钾台山市新宁制药厂国药准字H中国药典2005年版氯仿xx化学试剂厂粤卫药准字(1996)第100053号xx药典xxxx药业有限公司浙卫药准字(1996)第175001号中国药典2005年版二部湖南尔康制药有限公司湘食药辅准字F中国药典2005年版卡波姆xx申兴制药厂(93)卫药准字F-02号xx威尔化工有限公司苏药准字(2005)第428401号中国药典2005年版二部美国Noven 进口药品注册证号:H200581进口药用辅料注册标准JX甲醛溶液湖南尔康制药有限公司国药准字H《中国药典》2005年版二部甲壳胺烟台鲁银药业有限公司国药准字F20002交联羧甲基纤维素钠xxJRS公司FFMCCorporation(美国进口)进口药品注册证号:H进口药品注册标准JX精氨酸上海协和氨基酸有限公司国药准字HWS-XG-006-2000湖北鑫源生物工程有限公司国药准字H《中国药典》2005年版二部交联聚维酮INTERNATIONAL SPECIALTYPRODUCTS INC.(美国进口)进口药品注册证号:H进口药品注册标准JX德国BASF 进口药品注册证号Hxx申美医药开发科技有限公司(代理ISP)进口药品注册证号H聚乙烯吡咯烷酮(聚维酮)聚乙烯吡咯烷酮K25BASF Aktiengesellschaft 进口药品注册证号H聚乙烯吡咯烷酮K30xx展望药业有限公司浙卫药准字(2003)第224601号湖州展望药业有限公司浙药准字F20062号xx维酮贸易公司(95)沪卫药准字F-01号xxxx药用辅料有限公司皖药准字Fxxxx药业有限公司浙卫药准字(2004)第224602号xxxx新开元有限公司豫卫药准字(1995)F-10号胜利油田xx星华化工有限责任公司鲁药准字(2002)第2001号天津市雅博生物工程有限公司进口药品注册证号H200430 BASF Corporation(美国进口)进口药品注册证号:H200430xx威尔化工有限公司苏卫药准字(2005)第428501号xxxx药业有限公司琼药准字Fxxxx医疗保健品有限公司沪药准字FFBASF Aktiengesellschaft 进口药品注册证号HIsp Teehn ologies.Inc 进口药品注册证号HInternational SpecialtyProducts Inc. (美国进口)进口药品注册证号:H聚乙烯吡咯烷酮K90xxBASF公司进口药品注册证号H International SpecialtyProducts Inc. (美国进口)进口药品注册证号:HS630International SpecialtyProducts Inc. (美国进口)进口药品注册证号:H聚甲基丙烯酸树脂乳胶液聚甲基丙烯酸树脂乳胶液(胃崩型)xx鼎盛医药材料有限公司苏药准字(2008)第3503号xx恒阳药业有限公司苏药准字(2007)第350302号xx万泰医药材料有限公司苏卫药准字(1986)第350301号聚甲基丙烯酸树酯乳胶液(肠溶型)xx恒阳药业有限公司苏药准字(2007)第350402号xx万泰医药材料有限公司苏卫药准字(1986)第350401号xx鼎盛医药材料有限公司苏药准字(2008)第350403号进口药品注册标准JX进口药品注册标准JX200273欧洲药典xx药典2005年版《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部进口药品注册标准JX中国药典2005年版《中国药典》2005年版二部欧洲药典美国药典处方集17版进口药品注册标准JX进口药品注册标准进口药品注册标准JX进口药品注册标准JX江苏省药品标准(2008年修订)江苏省药品标准(86年)江苏省药品标准(86年)江苏省药品标准(86年)江苏省药品标准(86年)江苏省药品标准(2008年修订)Eudragit NE30D (丙烯酸乙酯-甲基丙烯酸甲酯中性共聚物水分散体)Rohm GmbH & Co.KG (德国进口)进口药品注册证号H欧洲药典甲基丙烯酸-丙烯酸乙酯共聚物水分散体Rohm GmbH & Co.KG (德国进口)进口药品注册证号:H进口药用辅料注册标准JX20020聚丙烯酸树脂聚丙烯酸树脂Ⅱ安徽山河药用辅料有限公司皖药准字F号《中国药典》2005年版二部湖州展望化学药业有限公司浙药准字(2001)第224401号《中国药典》2005年版二部湖州展望药业有限公司浙卫药准字(1996)第224201号中国药典2005年版苏州立新制药有限公司苏卫药准字(1999)第308002号中国药典2005年版连云港万泰医药有限公司苏卫药准字(1983)第308001号《中国药典》2005年版二部潍坊盛泰药业有限公司xx明天化工有限公司xxxx制药有限公司聚丙烯酸树脂Ⅲxx万泰医药有限公司xxxx药用辅料有限公司xx立新制药有限公司xxxx药业有限公司xx明天化工有限公司xxxx制药有限公司聚丙烯酸树脂Ⅳxxxx药用辅料有限公司xx万泰医药有限公司xxxx药业有限公司xx明天化工有限公司xx鼎盛医药材料有限公司xxxx制药有限公司甲基丙烯酸共聚物A型Rohm GmbH & Co.KG (德国进口) 聚乙二醇聚乙二醇400xxxx会友精细化工厂xxxx药用辅料厂xx威尔化工有限公司xxxx医药化工公司xx奥克纳米材料有限公司xxxx制药有限公司聚乙二醇600xx威尔化工有限公司xxxx制药有限公司聚乙二醇1000xx威尔化工有限公司xxxx制药有限公司聚乙二醇1500xxxx药用辅料有限公司xxxx化工厂xx威尔化工有限公司xxxx制药有限公司聚乙二醇4000xxxx药用辅料有限公司鲁药准字(2003)第526311号鲁药准字(2005)第620001号湘食药辅准字F苏卫药准字(1983)第308101号皖药准字F苏卫药准字(1999)第238102号鲁药准字(2003)第526312号鲁药准字(2005)第620002号湘食药辅准字F皖药准字F(91)卫药准字F-04号鲁药准字(2003)第526313号鲁药准字(2005)第620003号苏药准字(2008)第429201号湘食药辅准字F进口药品注册证号:H京卫药准字(95)第023号辽卫药准字(2000)第700510号苏卫药准字(2001)第423301号xx药准字(1998)第001号辽药准字F(2004)第900033号湘食药辅准字F号苏药准字(2003)第427501号湘食药辅准字F号苏药准字(2003)第427601号湘食药辅准字F号辽卫药准字(2000)第700515号沪卫药准字(1995)第105003号苏药准字(2001)第423401号湘食药辅准字F号辽卫药准字(2000)第700512号《中国药典》2005年版二部《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部《中国药典》2005年版二部中国药典2005年版2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版中国药典2005年版进口药品注册标准JX《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部中国药典《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部《中国药典》天津天成制药有限公司国药准字H120043《中国药典》2005年版二部上海浦东高南化工厂沪卫药准字(1995)第105004号《中国药典》2005年版二部南京威尔化工有限公司苏药准字(2001)第423501号《中国药典》2005年版二部北京海淀会友精细化工厂京卫药准字(95)第008号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F号中国药典2005年版聚乙二醇6000xxxx药用辅料有限公司辽卫药准字(2000)第700511号《中国药典》2005年版二部北京海淀会友精细化工厂京卫药准字(95)第(008)号《中国药典》2005年版二部江苏鹏鹞药业有限公司苏卫药准字(1993)第388401号《中国药典》2005年版二部南京威尔化工有限公司苏卫药准字(2001)第423601号《中国药典》2005年版二部天津天成制药有限公司国药准字H120042《中国药典》2005年版二部上海浦东高南化工厂沪卫药准字(1995)第105005号中国药典2005年版甲基纤维素xx瑞泰纤维素有限公司鲁药准字(2002)第520005号《中国药典》2005年版二部山东赫达股份有限公司鲁药准字(2003)第1002号《中国药典》2005年版二部山东聊城阿华制药有限公司鲁药准字(2002)第052371号《中国药典》2005年版二部含微粉硅胶的微晶纤维素xxJRS公司JXFL环拉酸钠湖南尔康制药有限公司湘食药辅准字F《中国药典》2005年版二部海藻酸湖南尔康制药有限公司湘食药辅准字F部颁化药1册活性炭上海活性炭厂沪药准字FF20001《中国药典》2005年版二部杭州木材公司活性炭分公司浙卫药准字(1996)第139501号中国药典2005年版衢州云合炭业有限公司浙药准字(2003)第139503号《中国药典》2005年版二部温岭市荣泰活性炭厂浙药准字2005第319506号中国药典2005年版二部江西怀玉山活性炭有限公司赣食药准字F企业标准xx希顺炭业有限公司浙卫药准字(2004)第139505号药典2005版江西省新干县申新活性炭厂赣药准字F中国药典氧化铁黑氧化铁上海一品国际颜料有限公司(上海氧化铁颜料厂)沪卫药准字(1995)第114003号《中国药典》2005年版二部黄氧化铁上海一品国际颜料有限公司(上海氧化铁颜料厂)沪卫药准字(1995)第114002号《中国药典》2005年版二部红氧化铁上海一品国际颜料有限公司(上海氧化铁颜料厂)沪卫药准字(1995)第114001号《中国药典》2005年版二部紫氧化铁上海一品国际颜料有限公司(上海氧化铁颜料厂)沪卫药准字(1995)第114005号《中国药典》2005年版二部棕氧化铁上海一品国际颜料有限公司(上海氧化铁颜料厂)沪卫药准字(1995)第114004《中国药典》2005年版二部糊精xx制药xx有限公司冀卫药准字(1995)第0057号《中国药典》2005年版二部潍坊盛泰药业有限公司鲁卫药准字(1999)第526305号《中国药典》2005年版二部江苏镇江市环宇药用辅料厂苏药准字(1994)第302202号《中国药典》2005年版二部安徽淮南山河药用辅料有限公司皖药准字(2002)第F0001号《中国药典》2005年版二部浙江海盐六和淀粉化工有限公司浙卫药准字(1998)第220902号《中国药典》2005年版二部曲阜市天利药用辅料有限公司鲁卫药准字(1999)第631501号《中国药典》2005年版二部山东聊城阿华制药有限公司鲁卫药准字(1998)第052429号《中国药典》2005年版二部嘉兴市白浪淀粉制品有限公司浙卫药准字(1996)第220901号《中国药典》2005年版二部廊坊淀粉厂冀卫药准字(1998)第090127号中国药典2005年版河南精忠威尔药业有限公司豫药准字F号《中国药典》2005年版二部曲阜市药用辅料有限公司鲁卫药准字(1999)第582506号《中国药典》2005年版二部兖州市六佳药用辅料有限公司鲁卫药准字(1999)第628437号《中国药典》2005年版二部山东孔府药厂鲁卫药准字(1999)第123372号《中国药典》2005年版二部东营市清华海洋化工有限责任公司鲁药准字(2004)第201002号《中国药典》2005年版二部混合脂肪酸甘油酯海盐成成日化科技有限公司浙卫药准字(1996)第169601号WS1-121-83-89xx威尔化工有限公司苏药准字(2004)第428001号WS1-121-83-89xxxxxx公司川药准字(2002)第014299号WS1-121-83-89湖南尔康制药有限公司湘食药辅准字F卫生部药品标准化学药品及制剂第一册固体脂肪36型xx富日医药化工有限公司湘药辅准字(2003)第077003号固体脂肪38型xx富日医药化工有限公司湘药辅准字(2003)第077004号黄xxxxxx制药有限公司赣卫药准字(1996)第号xx特种油品厂浙卫药准字(1998)第222101号xx双盛化工津卫药准字(1994)第002527号xxxxxx石化有限公司苏卫药准字(1982)第203201号xxxx制药有限公司湘食药辅准字Fxxxx航天药用xx有限公司桂卫药准字(1988)第035001号xxxx华美xx开发有限公司桂卫药准字(2000)第120001号xxxx矿业xx有限公司鲁卫药准字(1998)第5416号xx皓月xx厂鲁卫药准字(1999)第522318号xxxxxx厂鲁卫药准字(1995)第544001号xxxxxx矿业有限公司鲁卫药准字(1995)第551001号xxxxxx开发有限公司桂卫药准字(1984)第058001号xxxxxx开发有限公司桂卫药准字(1984)61001号xx三门发龙xx制品厂桂卫药准字(1994)119001号共聚维酮International SpecialtyProducts Inc.(美国进口)进口药品注册证号:H枸橼酸钠湖南尔康制药有限公司国药准字H430205xx第二制药厂国药准字H湖南华日制药有限公司国药准字H枸橼酸二氢钠xx制药有限公司粤卫药准字(1994)第100108号枸橼酸钾xxxx制药有限公司湘食药辅准字F枸橼酸湖南华日制药有限公司国药准字Hxxxx制药有限公司湘食药辅准字Fxx华源生物药业有限公司国药准字Hxx第二制药厂国药准字H日照xx洁晶生化有限公司国药准字Hxxxxxx制药厂国药准字H焦亚硫酸钠(偏重亚硫酸钠)xxxx制药有限公司湘食药辅准字F硅油卫生部部标准WS1-121-83-89卫生部部标准WS1-121-83-89中国药典2005年版《中国药典》2005年版二部中国药典2005年版中国药典《中国药典》2005年版二部《中国药典》2005年版一部《中国药典》2005年版一部《中国药典》2005年版一部《中国药典》2005年版一部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部进口药品注册标准JX中国药典2005年版《中国药典》2005年版二部中国药典2005年版二部粤Q/WS-1458-84中国药典2005年版《中国药典》2005年版二部《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部自贡晨光药业有限公司国药准字H中国药典2005年版甘油浙江省凤凰化工股份有限公司国药准字H《中国药典》2005年版二部无锡正达医药卫生用品厂国药准字H中国药典浙江遂昌惠康甘油有限公司国药准字H《中国药典》2005年版二部湖南尔康制药有限公司国药准字H中国药典2005年版汕头市紫光古汉氨基酸有限公司国药准字H中国药典2005年版杭州油脂化工有限公司浙药准字(2004)第110203号《中国药典》2005年版二部黑龙江省友谊甘油厂黑卫药准字(2001)第1001号《中国药典》2005年版二部浙江纳爱斯集团浙卫药准字(2003)第110204号《中国药典》2005年版二部杭州东南化工有限公司浙卫药准字(1996)第1102号xx药典xxxx日化有限责任公司xx华润油脂化学有限公司xx华润油脂化学有限公司烟台xxxx股份有限公司供注射用xxxxxx药业有限公司xxxx制药有限公司xxxxxx明月海藻工业有限公司xx化学制药有限责任公司xx化学制药有限公司xxxx药业有限公司xxxx海藻有限公司xx海峰制碘有限公司xxxx海藻有限公司xx洁晶集团股份有限公司xx药业有限公司xx天瑞药业有限公司xxxx药业有限公司xxxx制药有限公司xx注射液xx齐都药业有限公司甘氨酸xx建力药业有限公司xx蜡xxxx制药厂xxxx特种油品厂二氧化钛xxxx鹞药业有限公司xxxx集团xx制药有限公司xx宏远药业有限公司二甲基亚砜xx轻化工研究所实验厂xxxx制药有限公司二甲硅油自贡晨光药业有限公司碘化钾xx自贡xx鹤制药有限责任公司低取代羟丙基纤维素冀卫药准字(1999)第011182号鲁药准字(2003)第203001号鲁卫药准字(1995)第539001号浙药准字(2005)第110204号湘食药辅准字F国药准字H国药准字H450272桂卫药准字(1996)第132002号国药准字H国药准字H国药准字H国药准字H450272国药准字H国药准字H国药准字H国药准字H国药准字H440299国药准字H110216沪卫药准字(1995)第167002号浙卫药准字(1996)第222101国药准字H苏卫药准字(2002)第355704号苏卫药准字(2005)第355705号辽卫药准字(1996)第2891号湘食药辅准字F国药准字H国药准字H中国药典2005年版《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部中国药典2005版《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部中国药典2005年版二部《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部部颁药品标准二部第3册2005年版二部中国药典《xx药典》xxxx药用辅料有限公司皖药准字(2002)第F004486号《中国药典》2005年版二部磷脂大豆磷脂上海太伟药业有限公司国药准字XF部颁标准1998年版苏州天马医药集团天吉生物制药有限公司苏药准字(2007)第354703号国家药品标准(1998年)(二部六册)江苏曼氏生物科技有限公司苏卫药准字(2006)第354702号国家药品标准(1998年)(二部六册)注射用大豆磷脂xxxx药业有限公司苏卫药准字(1987)第356501号江苏省药品标准(87年)卵磷酯xx新先锋药业有限公司国药准字Fxxxx医药集团xx生物制药有限公司xxxx药业有限公司xx汉方现代中药研究开发有限公司进口磷脂Lipoid Gmbh大豆油xxxx药用油有限公司xxxx药业有限公司xxxx山茶油开发有限公司供注射用龙游聚兴粮油医药化工有限公司淀粉海盐六和淀粉化工有限公司xx白浪淀粉制品有限公司xxxx药用辅料有限公司xx制药xx有限公司xxxxxx制药有限公司xxxx药用辅料有限公司xx环宇药用辅料厂xx精忠威尔药业有限公司xxxx医药股份有限公司xx药用辅料有限公司xx淀粉厂xxxx药业有限公司xx六佳药用辅料有限公司xxxx药厂xx大地药业有限公司肠溶空心胶囊xxxx胶囊有限公司xxxxxx胶囊有限公司xxxx药用胶囊有限公司xx恒诚胶囊有限公司xxxx胶囊有限公司xxxx得利胶囊有限公司xxxxxx胶囊厂xxxx胶囊有限公司xxxx胶丸有限公司xx宏辉胶丸有限公司苏药准字(2007)第427102号苏药准字(2002)第427101号国药准字F进口药品注册证号H辽卫药准字(1997)第700313号国药准字XF(2002)第221720号浙药准字(2000)第231901号浙卫药准字(1996)第220802号浙卫药准字(1996)220801号皖药准字(2002)第F0002号冀卫药准字(1995)第0034号鲁卫药准字(1999)第052365号鲁卫药准字(1999)第631502号苏药准字(1994)第302104号豫药准字F号鲁卫药准字(1995)第140021号(2000)第582001号冀卫药准字(1995)第090006号鲁卫药准字(1999)第526303号鲁卫药准字(1999)第628436号鲁卫药准字(1999)第123371号鲁药准字(2005)第590001号皖药准字(2001)J005676号国药准字F国药准字F国药准字F国药准字F国药准字F国药准字F20040国药准字F20030国药准字F20011国药准字F20041国家药品标准(1998年)(二部六册)江苏省药品标准注册标准《中国药典》2005年版二部部颁标准1998年版第6册《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部中国药典2005年版《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部《中国药典》2005年版二部虫白蜡xx亚蜡毛厂冀卫药准字(2000)第0546号xx药典xxxx东方蜂蜡加工厂冀卫药准字(2000)第0545号xx药典橙皮酊xx星群(药业)股份有限公司粤卫药准字(1994)第104067号卫生部药品标准茶油xxxxxx油脂有限公司赣药准字(2001)F第166002号中国药典2005年版浙江龙游县聚兴粮油医药化工有限公司浙卫药准字(1996)第221701号中国药典2005年版醋酸钠台山市新宁制药有限公司国药准字H国家药品标准化药地标升国标第六册WS-10001-(HD-0584)-2002北京市燕京药业有限公司国药准字H国家药监局药品标准WS-10001-(HD-0584)-2002成都华邑药用辅料制造有限责任公司川药准字FWS-10001-(HD-0584)-2002湖南尔康制药有限公司湘食药辅准字F化学药品地方标准上升国家标准第六册醋酸xx化学试剂有限公司苏药准字(2008)第428901号《中国药典》2005年版二部湖南尔康制药有限公司国药准字H《中国药典》2005年版二部川蜡xx森林蜡业有限公司xx字(2003)第427701号《中国药典》2005年版二部玻璃酸钠山东博士伦福瑞达制药有限公司国药准字F20001xxxx生物化工有限公司国药准字F冰片广州市黄埔化工厂国药准字Z《中国药典》2005年版二部泊洛沙姆南京威尔医药技术有限公司苏卫药准字2001第4201号中国药典2005年版沈阳药大药业有限责任公司(90)沈卫药准字F-03号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F中国药典2005年版白凡士林xxxxxx石化有限公司苏卫药准字(1982)第301401号《中国药典》2005年版二部湖南尔康制药有限公司湘食药辅准字F《中国药典》2005年版二部蓖麻油。
