肝脏缺血再灌注肝细胞凋亡与肝细胞糖原关系的实验研究
抗氧化维生素在肝损伤中的应用研究进展

抗氧化维生素在肝损伤中的应用研究进展柳进【摘要】多种原因可导致肝损伤,其中氧化是一个重要因素,而抗氧化维生素对氧化损伤有很好的防护作用,本文综述了国内外近年抗氧化维生素在肝损伤中的应用基础和临床研究进展.【期刊名称】《吉林医药学院学报》【年(卷),期】2016(037)002【总页数】4页(P137-140)【关键词】氧化损伤;抗氧化维生素;肝损伤【作者】柳进【作者单位】中南大学公共卫生学院,湖南长沙 410008【正文语种】中文【中图分类】R575.2肝损伤是多种原因所导致的肝脏细胞凋亡坏死增加,从而出现以血清中转氨酶的活力、血清胆红素急剧升高为典型表现的体征,是多种肝脏疾病的发生、发展及最终走向肝功能衰竭的始动环节和共同途径,也是临床疾病诊疗过程中容易伴发的疾病,是严重威胁人类的健康重大公共卫生问题。
按其发生原因主要可分为化学性肝损伤、生物感染性肝损伤、酒精性肝损伤、免疫性肝损伤和机械性肝损伤。
肝损伤发生发展过程中具有机体氧化应激增强、脂质过氧化增加的特点,而抗氧化维生素具有清除自由基,防止脂质过氧化反应的良好作用且价格低廉的优势,在临床临床中具有广泛的应用价值。
我国病毒性肝炎患病率较高,其中乙型肝炎患病率占比最高,感染者若不采取积极的保肝治疗容易转归为肝纤维化、肝癌,严重威胁生命健康。
研究发现,慢性乙型肝炎病患者血清抗氧化维生素含量明显低于正常人群,并伴随机体抗氧化酶体系的活力降低,这种表现在病情进一步加深出现肝纤维化后更为显著,乙肝患者体内氧化与抗氧化平衡严重失调,氧自由基的积累引起脂质过氧化反应,是肝损伤及肝纤维化的重要机制之一[1]。
朱晓燕等[2]分析检测了不同类型乙肝感染者血清维生素C(VC)含量,结果显示还乙型肝炎患者血清中VC水平与总抗氧化能力呈正相关,与脂质过氧化物丙二醛(MDA)呈负相关。
血清VC水平随病情严重程度增高而降低,提示乙型肝炎患者体内VC水平与肝病的不同临床表现类型及严重程度有一定联系,认为VC可作为乙型肝炎辅助治疗手段之一。
急性肝损伤的病理生理学机制

② 激活Kupffer细胞、中性粒细胞、吞噬 细胞和单核细胞通过细胞膜上NADPH氧 化酶,释放大量氧自由基 ③ 缺血、缺氧可使细胞色素氧化酶功能失 调,使细胞内线粒体膜电势丧失,呼吸 链功能障碍电子传递链电子漏率增加, 从而促进氧自由基的产生
氧自由基对肝细胞损伤机制主要有: ①氧自由基对细胞膜双分子层磷脂结 构中的重要脂类进行氧化作用,生成 多种脂质过氧化物,超氧化物和过氧 化物促进铁蛋白释放铁,使其与过氧 化氢反应形成羟自由基,从而直接损 伤细胞
顺高浓度差进入细胞内
钙超载是肝细胞损伤关键机制之一: ① 激活Ca2+依赖蛋白酶,破坏细胞骨架与 胞膜联接的完整性 ② 激活Ca2+依赖磷脂酶C和磷脂酶A2, 使 双分子层结构紊乱破坏膜性结构 ③ 线粒体钙超载使其膜电位丧失,氧化磷 酸化脱偶联,引起严重能量代谢障碍, 并促进了氧自由基的产生,这些终致细 胞不可逆损伤
Stansby观察12例人类供肝在冷保存期间及 灌注后,短期供肝内的ET-1浓度均显著的 高于正常水平,Textor临床研究结果类似 上述结果提示,在肝脏缺血再灌注过程中, 肝窦内皮细胞合成及分泌ET的能力明显增 强。这可能是因为一方面缺氧及胞浆内 Ca2+浓度升高可促使内皮细胞产生ET,另 一方面在再灌注短期内由门静脉进入肝脏 的肠源性内毒性也可刺激内皮细胞产生ET
Kupffer细胞触发的炎症反应导致局
部组织炎症,表现为轻度的肝酶或胆红素
升高。这种肝缺血性损害常被临床忽视,
而机械通气、全静脉营养、儿茶酚胺等药
物的使用更加重休克肝损伤。肝损伤影响
危重病患者的死亡率,因此对肝损伤的早
期发现在临床上至关重要
治疗 急性肝损害肝继发于失血、大手术、 呼吸衰竭、二重感染、或休克,持续的微 循环衰竭、全身炎症反应过度激活及ICU治 疗策略的副作用均促进其发病。对其早期 认识,可降低死亡率
病理生理学第十章缺血再灌注损伤试题及答案

病理生理学第十章缺血再灌注损伤试题及答案Revised as of 23 November 2020第十章缺血-再灌注损伤一、选择题【A型题】1.缺血再灌注损伤最常见于下述哪一器官A.心肌 B.脑C.肝 D.肾E.肠2.最活泼有力的氧自由基是:A.-•2O B.H2O2C.OH· D.LO·E.LOO·3.认为再灌注损伤实为缺血的继续和叠加的学说为:A.钙超载 B.自由基损伤C.无复流现象 D.白细胞作用E.能量代谢障碍4.缺血-再灌注性心律失常最常见的类型:A.房性心律失常B.室性心律失常C.房室交界部阻滞D.房室传导阻滞E.房颤5.氧反常损伤程度加重,不见于:A.缺氧的时间越长B.缺氧时的温度越高C.缺氧时酸中毒程度越重D.重给氧时氧分压越高E.再灌注时pH纠正缓慢6.有关自由基的错误说法是: A.自由基是具有一个不配对电子的原子、原子团和分子的总称B.-•2O是其他活性氧产生的基础C.OH^自由基的产生需有过渡金属的存在D.体内的自由基有害无益E.自由基的化学性质极为活泼7.钙反常时细胞内钙超载的重要原因是:A.ATP减少使钙泵功能障碍B.Na+-Ca2+交换增加C.电压依赖性钙通道开放增加D.线粒体膜流动性降低E.无钙灌流期出现的细胞膜外板与糖被表面的分离8.导致染色体畸变、核酸碱基改变或DNA断裂的自由基主要为:A.-•2O B.OH·C.H2O2D.LO·E.LOO·9.缺血一再灌注时细胞内氧自由基生成增加不见于:A.中性粒细胞吞噬活动增强B.儿茶酚胺增加C.黄嘌呤氧化酶形成减少D.细胞内抗氧化酶类活性下降E.线粒体受损、细胞色素氧化酶系统功能失调10.自由基对机体的损伤最主要是通过:A.蛋白质交联B.直接损伤核酸C.引发葡萄糖交联D.脂质过氧化引起损伤E.引起染色体畸变11.下面哪个不是活性氧A.NO B.-•2OC.OH· D.CO2E.LOO·12.线粒体功能失调导致氧自由基增多,是由于进入细胞内的氧:A.1价还原增多B.2价还原增多C.3价还原增多D.4价还原增多E.5价还原增多13.下述心肌超微结构变化,哪点为心肌细胞挛缩的直接标志A.基底膜部分缺失B.明显收缩带C.线粒体肿胀、脊断裂D.出现凋亡小体E.出现糖原颗粒14.缺血-再灌注损伤导致细胞不可逆损伤的共同通路是:A.ATP缺乏B.细胞内钙超载C.无复流现象D.氧自由基作用E.白细胞浸润15.自由基攻击的细胞成分不包括:A.膜脂质 B.蛋白质C.DNA D.电解质E.线粒体16.下述哪种物质是通过促使肌浆网释放Ca2+而引起心肌细胞内钙超载A.磷脂酰肌醇B.三磷酸肌醇(IP3)C.甘油二酯(DG)D.2,3-DPGE.cAMP17.下述关于黏附分子的说法,哪一点是错误的A.可促进细胞及基质的黏附B.由血浆产生C.由整合素、选择素等一大类分子组成D.维持细胞结构E.参与细胞信号传导18.心肌顿抑最基本特征是缺血-再灌注后:A.心肌细胞坏死B.代谢延迟恢复C.结构改变延迟恢复D.收缩功能延迟恢复E.心功能立即恢复19.下述哪种酶不是自由基清除剂A.过氧化氢酶 B.过氧化物酶C.SOD D.GSH-PXE.NADH氧化酶20.白细胞激活后释放的脂质炎症介质是:A.TNFα B.IL-1C.IL-8 D.LT E.OH·21.一般认为,心肌细胞膜上何种钾离子通道是缺血预适应心肌保护的终效应器A.瞬时外向电流钾通道(Ito)B.内向整流电流钾通道(Ik1)C.ATP敏感钾通道(KATP)D.延迟外向电流钾通道(Ik)E.乙酰胆碱敏感钾通道(IKAch) 22.线粒体膜易受自由基损伤是由于外面无何种蛋白保护A.组蛋白 B.白蛋白C.球蛋白 D.免疫球蛋白E.纤维蛋白23.下述关于缺血-再灌注的说法,哪点是错误的A.缺血-再灌注必然引起组织损伤 B.缺血-再灌注损伤具有种属和器官普遍性C.自由基和钙超载是缺血-再灌注损伤的主要发生机制D.预适应可减轻或预防缺血-再灌注损伤E.缺血-再灌注可引起细胞凋亡24.下述心肌无复流现象的发生机制中哪一点是错误的A.心肌细胞肿胀B.血管内皮细胞肿胀 C.微血管通透性增高D.心肌细胞松弛E.微血管痉挛和堵塞25.缺血一再灌注诱导细胞凋亡主要与何种应激有关A.热应激 B.化学应激C.氧应激 D.机械应激E.情绪应激26.参与再灌注心律失常的一过性内向离子流主要是:A.经由Na+-Ca2+交换的钙电流B.经由L-型钙通道的钙电流C.经由T-型钙通道的钙电流D.经由快钠通道的钠电流E.氯离子电流27.心肌缺血-再灌注时导致微血管血流阻塞的主要原因是:A.血小板沉积B.红细胞集聚C.白细胞黏附D.脂肪颗粒栓塞E.气栓形成28.下述哪项是机体缺血-再灌注时的内源性保护机制A.钙超载B.无复流现象C.预适应D.心肌顿抑E.自由基产生过多29.缺血-再灌注性心律失常发生的基本条件是:A.再灌注区存在功能可恢复的心肌细胞B.缺血时间长C.缺血心肌数量多D.缺血程度重E.再灌注恢复速度快30.下述哪种酶不是钙依赖性降解酶A.磷脂酶CB.磷脂酶DC.蛋白水解酶D.谷氨酰胺酶E.核酸内切酶31.心肌缺血-再灌注损伤导致心肌舒缩功能降低,其指标不包括:A.心输出量(CO)降低B.心室舒张末期压力(VEDP)降低 c.心室收缩峰压(VPSP)降低D.心室内压最大变化速率(土dp/dtmax)降低E.射血分数(EF)降低32.下述哪种物质不是自由基清除剂A.VAB.谷胱甘肽C.FeSO4D.NADPHE.半胱氨酸33.黄嘌呤脱氢酶主要存在于下列哪种细胞内:A.单核细胞B.淋巴细胞C.心肌细胞D.血管内皮细胞E.中性粒细胞34.缺血再灌注损伤时钙离子进入细胞的主要途径是:A.细胞膜钙泵B.Na+/Ca2+交换蛋白C.电压依赖性钙通道D.受体操纵性钙通道E.顺浓度差内流35.黄嘌呤脱氢酶转变为黄嘌呤氧化酶需要:A.Na+ B.Ca2+C.Mg2+ D.Fe2+E.K+36.再灌注时氧自由基的重要来源一般认为是:A.损伤的线粒体电子传递链B.儿茶酚胺的自身氧化C.细胞内钙超载D.激活的中性粒细胞E.激活的血管内皮细胞37.再灌注时生成的氧自由基可与细胞膜发生:A.氧化反应B.还原反应C.歧化反应D.脂质过氧化反应E.Haber-Weiss反应38.β肾上腺素能受体兴奋主要通过下列哪种途径引起细胞内Ca2+升高:A.激活PLCB.激活PKCC.促进Na+/H+交换D.增加L型钙通道开放E.促进Na+/Ca+交换39.对Na+/Ca+交换蛋白直接激活的因素是:A.细胞内高H+B.细胞内高Na+C.内源性儿茶酚胺增加D.α1肾上腺素能受体兴奋E.β肾上腺素能受体兴奋40.α1受体兴奋引起钙超载的直接途径是激活:A.K+-Na+交换B.Na+/Ca+交换C.Na+/H+交换D.L型钙通道E.肌浆网钙泵41.SOD可歧化的自由基是:A.-•2O B.OH·C.1O2 D.H2O2E.LOO·42.间接激活Na+/Ca2+交换蛋白的是:A.黄嘌呤氧化酶B.NADPH氧化酶C.蛋白激酶CD.磷脂酶E.超氧化物歧化酶43. pH反常是指的是:A. 缺血细胞乳酸生成增多造成pH降低B. 缺血组织酸性产物清除减少,pH降低C. 再灌注时迅速纠正缺血组织的酸中毒反而会加重细胞损伤D. 因使用碱性药过量使缺血组织由酸中毒转变为碱中毒E. 酸中毒和碱中毒交替出现44.膜脂质过氧化使:A.膜不饱和脂肪酸减少B.饱和脂肪酸减少C.膜脂质之间交联减少D.膜流动性增加E.脂质与蛋白质的交联减少45.呼吸爆发指的是: A.缺血-再灌注性肺损伤 B.肺通气量代偿性增强 C.中性粒细胞氧自由基生成大量增加 D.线粒体呼吸链功能增加E.呼吸中枢兴奋性增高二、名词解释1. 缺血-再灌注损伤(ischemia-reperfusion injury)2. 氧反常(oxygen paradox)3. 钙反常(calcium paradox)4. pH反常(pH paradox)5. 自由基(free radical)6. 氧自由基(oxygen free radical)7.黏附分子(adhension molecule)8. 钙超载(calcium overload)9. 无复流现象(no-reflow phenomenon)10. 心肌顿抑(myocardical stunning)11. 呼吸爆发(respiratory burst)三、简答题1.简述膜脂质过氧化增强导致细胞损伤的机制。
病理生理学第十章 缺血-再灌注损伤试题及答案

第十章缺血-再灌注损伤一、选择题【A型题】1.缺血再灌注损伤最常见于下述哪一器官?A.心肌 B.脑C.肝 D.肾E.肠2.最活泼有力的氧自由基是:A.-•2O B.H2O2C.OH· D.LO·E.LOO·3.认为再灌注损伤实为缺血的继续和叠加的学说为:A.钙超载 B.自由基损伤C.无复流现象 D.白细胞作用E.能量代谢障碍4.缺血-再灌注性心律失常最常见的类型: A.房性心律失常B.室性心律失常C.房室交界部阻滞D.房室传导阻滞E.房颤5.氧反常损伤程度加重,不见于:A.缺氧的时间越长B.缺氧时的温度越高C.缺氧时酸中毒程度越重D.重给氧时氧分压越高E.再灌注时pH纠正缓慢6.有关自由基的错误说法是:A.自由基是具有一个不配对电子的原子、原子团和分子的总称B.-•2O是其他活性氧产生的基础C.OH^自由基的产生需有过渡金属的存在 D.体内的自由基有害无益E.自由基的化学性质极为活泼7.钙反常时细胞内钙超载的重要原因是: A.ATP减少使钙泵功能障碍B.Na+-Ca2+交换增加C.电压依赖性钙通道开放增加D.线粒体膜流动性降低E.无钙灌流期出现的细胞膜外板与糖被表面的分离8.导致染色体畸变、核酸碱基改变或DNA断裂的自由基主要为:A.-•2O B.OH·C.H2O2 D.LO·E.LOO·9.缺血一再灌注时细胞内氧自由基生成增加不见于:A.中性粒细胞吞噬活动增强B.儿茶酚胺增加C.黄嘌呤氧化酶形成减少D.细胞内抗氧化酶类活性下降E.线粒体受损、细胞色素氧化酶系统功能失调10.自由基对机体的损伤最主要是通过:A.蛋白质交联B.直接损伤核酸C.引发葡萄糖交联D.脂质过氧化引起损伤E.引起染色体畸变11.下面哪个不是活性氧?A.NO B.-•2OC.OH· D.CO2E.LOO·12.线粒体功能失调导致氧自由基增多,是由于进入细胞内的氧:A.1价还原增多B.2价还原增多C.3价还原增多D.4价还原增多E.5价还原增多13.下述心肌超微结构变化,哪点为心肌细胞挛缩的直接标志?A.基底膜部分缺失B.明显收缩带C.线粒体肿胀、脊断裂D.出现凋亡小体E.出现糖原颗粒14.缺血-再灌注损伤导致细胞不可逆损伤的共同通路是:A.ATP缺乏B.细胞内钙超载C.无复流现象D.氧自由基作用E.白细胞浸润15.自由基攻击的细胞成分不包括:A.膜脂质 B.蛋白质C.DNA D.电解质E.线粒体16.下述哪种物质是通过促使肌浆网释放Ca2+而引起心肌细胞内钙超载?A.磷脂酰肌醇B.三磷酸肌醇(IP3)C.甘油二酯(DG)D.2,3-DPG E.cAMP17.下述关于黏附分子的说法,哪一点是错误的? A.可促进细胞及基质的黏附B.由血浆产生C.由整合素、选择素等一大类分子组成D.维持细胞结构E.参与细胞信号传导18.心肌顿抑最基本特征是缺血-再灌注后: A.心肌细胞坏死B.代谢延迟恢复C.结构改变延迟恢复D.收缩功能延迟恢复E.心功能立即恢复19.下述哪种酶不是自由基清除剂?A.过氧化氢酶 B.过氧化物酶C.SOD D.GSH-PXE.NADH氧化酶20.白细胞激活后释放的脂质炎症介质是:A.TNFα B.IL-1C.IL-8 D.LTE.OH·21.一般认为,心肌细胞膜上何种钾离子通道是缺血预适应心肌保护的终效应器?A.瞬时外向电流钾通道(I to)B.内向整流电流钾通道(I k1)C.ATP敏感钾通道(K ATP)D.延迟外向电流钾通道(I k)E.乙酰胆碱敏感钾通道(IK Ach)22.线粒体膜易受自由基损伤是由于外面无何种蛋白保护?A.组蛋白 B.白蛋白C.球蛋白 D.免疫球蛋白E.纤维蛋白23.下述关于缺血-再灌注的说法,哪点是错误的?A.缺血-再灌注必然引起组织损伤B.缺血-再灌注损伤具有种属和器官普遍性 C.自由基和钙超载是缺血-再灌注损伤的主要发生机制D.预适应可减轻或预防缺血-再灌注损伤 E.缺血-再灌注可引起细胞凋亡24.下述心肌无复流现象的发生机制中哪一点是错误的?A.心肌细胞肿胀B.血管内皮细胞肿胀C.微血管通透性增高D.心肌细胞松弛E.微血管痉挛和堵塞25.缺血一再灌注诱导细胞凋亡主要与何种应激有关?A.热应激 B.化学应激C.氧应激 D.机械应激E.情绪应激26.参与再灌注心律失常的一过性内向离子流主要是:A.经由Na+-Ca2+交换的钙电流B.经由L-型钙通道的钙电流C.经由T-型钙通道的钙电流D.经由快钠通道的钠电流E.氯离子电流27.心肌缺血-再灌注时导致微血管血流阻塞的主要原因是:A.血小板沉积B.红细胞集聚C.白细胞黏附D.脂肪颗粒栓塞 E.气栓形成28.下述哪项是机体缺血-再灌注时的内源性保护机制?A.钙超载B.无复流现象C.预适应D.心肌顿抑E.自由基产生过多29.缺血-再灌注性心律失常发生的基本条件是:A.再灌注区存在功能可恢复的心肌细胞 B.缺血时间长C.缺血心肌数量多D.缺血程度重E.再灌注恢复速度快30.下述哪种酶不是钙依赖性降解酶?A.磷脂酶CB.磷脂酶DC.蛋白水解酶D.谷氨酰胺酶E.核酸内切酶31.心肌缺血-再灌注损伤导致心肌舒缩功能降低,其指标不包括:A.心输出量(CO)降低B.心室舒张末期压力(VEDP)降低c.心室收缩峰压(VPSP)降低D.心室内压最大变化速率(土dp/dtmax)降低E.射血分数(EF)降低32.下述哪种物质不是自由基清除剂?A.V A B.谷胱甘肽C.FeSO4 D.NADPHE.半胱氨酸33.黄嘌呤脱氢酶主要存在于下列哪种细胞内: A.单核细胞B.淋巴细胞C.心肌细胞D.血管内皮细胞E.中性粒细胞34.缺血再灌注损伤时钙离子进入细胞的主要途径是:A.细胞膜钙泵B.Na+/Ca2+交换蛋白C.电压依赖性钙通道D.受体操纵性钙通道E.顺浓度差内流35.黄嘌呤脱氢酶转变为黄嘌呤氧化酶需要:A.Na+ B.Ca2+C.Mg2+ D.Fe2+E.K+36.再灌注时氧自由基的重要来源一般认为是: A.损伤的线粒体电子传递链B.儿茶酚胺的自身氧化C.细胞内钙超载D.激活的中性粒细胞E.激活的血管内皮细胞37.再灌注时生成的氧自由基可与细胞膜发生:A.氧化反应B.还原反应C.歧化反应D.脂质过氧化反应E.Haber-Weiss反应38.β肾上腺素能受体兴奋主要通过下列哪种途径引起细胞内Ca2+升高:A.激活PLCB.激活PKCC.促进Na+/H+交换D.增加L型钙通道开放E.促进Na+/Ca+交换39.对Na+/Ca+交换蛋白直接激活的因素是:A.细胞内高H+B.细胞内高Na+C.内源性儿茶酚胺增加D.α1肾上腺素能受体兴奋E.β肾上腺素能受体兴奋40.α1受体兴奋引起钙超载的直接途径是激活:A.K+-Na+交换B.Na+/Ca+交换C.Na+/H+交换D.L型钙通道E.肌浆网钙泵41.SOD可歧化的自由基是:A.-•2O B.OH·C.1O2 D.H2O2E.LOO·42.间接激活Na+/Ca2+交换蛋白的是:A.黄嘌呤氧化酶B.NADPH氧化酶C.蛋白激酶CD.磷脂酶E.超氧化物歧化酶43. pH反常是指的是:A. 缺血细胞乳酸生成增多造成pH降低B. 缺血组织酸性产物清除减少,pH降低C. 再灌注时迅速纠正缺血组织的酸中毒反而会加重细胞损伤D. 因使用碱性药过量使缺血组织由酸中毒转变为碱中毒E. 酸中毒和碱中毒交替出现44.膜脂质过氧化使:A.膜不饱和脂肪酸减少B.饱和脂肪酸减少C.膜脂质之间交联减少D.膜流动性增加E.脂质与蛋白质的交联减少45.呼吸爆发指的是:A.缺血-再灌注性肺损伤B.肺通气量代偿性增强C.中性粒细胞氧自由基生成大量增加D.线粒体呼吸链功能增加E.呼吸中枢兴奋性增高二、名词解释1. 缺血-再灌注损伤(ischemia-reperfusion injury)2. 氧反常(oxygen paradox)3. 钙反常(calcium paradox)4. pH反常(pH paradox)5. 自由基(free radical)6. 氧自由基(oxygen free radical)7.黏附分子(adhension molecule)8. 钙超载(calcium overload)9. 无复流现象(no-reflow phenomenon)10. 心肌顿抑(myocardical stunning)11. 呼吸爆发(respiratory burst)三、简答题1.简述膜脂质过氧化增强导致细胞损伤的机制。
人参皂苷Rg1在肝脏中的作用及其研究进展

㊃综述㊃d o i:10.3969/j.i s s n.1671-8348.2020.23.035网络首发h t t p s://k n s.c n k i.n e t/k c m s/d e t a i l/50.1097.r.20200826.1636.004.h t m l(2020-08-27)人参皂苷R g1在肝脏中的作用及其研究进展*陈顺宏,黄汉飞,林杰综述,曾仲ә审校(昆明医科大学第一附属医院器官移植中心,昆明650032)[摘要]人参皂苷也称人参皂苷,是人参等中药中提取的主要活性成分之一,具有抗氧化应激㊁抗炎㊁抗凋亡㊁抗疲劳㊁阵痛㊁神经保护等药理作用,根据其结构可以分为不同的类型㊂研究发现人参皂苷R g1在多器官㊁多疾病中能发挥有效作用,随着研究的不断深入,人参皂苷R g1在肝脏损伤中的应用被逐渐发现,本文就其在肝脏疾病中的作用进行综述,为进一步开发利用提供理论基础㊂[关键词]人参皂苷R g1;再灌注损伤;脂肪肝,非酒精性;胰岛素抵抗[中图法分类号] R285.5[文献标识码] A[文章编号]1671-8348(2020)23-4021-04 R e s e a r c h p r o g r e s s o n e f f e c t s o f g i n s e n o s i d e R g1i n l i v e r*C H E N S h u n h o n g,HU A N G H a n f e i,L I N J i e,Z E N G Z h o n gә(C e n t e r o f O r g a n T r a n s p l a n t a t i o n,t h e F i r s t H o s p i t a l A f f i l i a t e d t o K u n m i n gM e d i c a l U n i v e r s i t y,K u n m i n g,Y u n n a n650032,C h i n a)[A b s t r a c t] G i n s e n o s i d e i s o n e o f t h e m a i n a c t i v e i n g r e d i e n t s e x t r a c t e d f r o m g i n s e n g.I t h a s p h a r m a c o l o g-i c a l e f f e c t s o n a n t i-o x i d a t i v e s t r e s s,a n t i-i n f l a mm a t i o n,a n t i-a p o p t o s i s,a n t i-f a t i g u e,l a b o u r p a i n s,n e r v e p r o t e c-t i o n a n d o t h e r s.A c c o r d i n g t o i t s s t r u c t u r e,i t c a n b e d i v i d e d i n t o d i f f e r e n t t y p e s.S t u d i e s h a v e f o u n d t h a t g i n-s e n o s i d e R g1c a n p l a y a n e f f e c t i v e r o l e i n m u l t i p l e o r g a n a n d d i s e a s e s.W i t h t h e d e e p e n i n g o f r e s e a r c h,t h e a p-p l i c a t i o n o f g i n s e n o s i d e R g1i n l i v e r i n j u r y h a s b e e n g r a d u a l l y d i s c o v e r e d.T h i s p a p e r r e v i e w s i t s r o l e i n l i v e r d i s e a s e s,p r o v i d i n g a t h e o r e t i c a l b a s i s f o r f u r t h e r d e v e l o p m e n t a n d u t i l i z a t i o n.[K e y w o r d s]g i n s e n o s i d e R g1;r e p e r f u s i o n i n j u r y;f a t t y l i v e r,n o n a l c o h o l i c;i n s u l i n r e s i s t a n c e人参作为传统医学中最古老的草药之一,其主要活性成分人参皂苷是从人参属的根中提取的,根据人参皂苷中甾体结构和羟基(糖基)的数量,可将其分为原人参二醇类(p r o t o p a n a x a d i o l,P P D)㊁齐墩果酸㊁拟人参皂苷元㊁原人参三醇类(p r o t o p a n a x a t r i o l, P P T)[1]㊂人参皂苷R g1(G-R g1)属于P P T㊂研究发现G-R g1在包括心脏㊁肾脏㊁神经系统等多种器官保护和多种疾病治疗中能发挥有效作用,其抗衰老㊁抗肿瘤㊁神经㊁心血管保护作用也不断被发现[2-3]㊂也有越来越多的研究证明其在多种肝脏疾病中能发挥有效作用㊂本文就近年来G-R g1在肝脏疾病中的应用及研究进展进行综述,以进一步促进G-R g1在肝脏疾病中的深入研究及临床推广应用㊂1 G-R g1治疗非酒精性脂肪肝(n o n-a l c o h o l i c f a t t y l i v e r,N A F L)非酒精性脂肪肝病(n o n a l c o h o l i c f a t t y l i v e r d i s-e a s e,N A F L D)临床主要表现为N A F L和非酒精性脂肪性肝炎(n o n a l c o h o l i c s t e a t o h e p a t i t i s,N A S H),这些疾病若在早期未得到及时的干预,可进一步发展为肝纤维化㊁肝硬化和肝细胞癌㊂同时N A F L D还会增加心血管疾病㊁癌症和肝相关死亡的风险㊂实验发现[4-6],G-R g1可以通过其抗炎㊁抗凋亡的作用,减轻急性肝衰竭(a c u t e l i v e r f a i l u r e,A L F)和酒精性肝病(a l c o h o l i c l i v e r d i s e a s e,A L D)的肝损伤㊂G-R g1也可通过改善脂质过氧化和炎症小体的活化来预防N A F L[7]㊂在N A F L D小鼠模型中,G-R g1可通过提高氧化酶活性,抑制炎症小体活化来改善N A F L,同时试验中观察到C HO P㊁C a s p a s e12表达都明显增高,表明发生N A F L D时能诱发内质网应激,而G-R g1治疗后表达明显降低,证明G-R g1能改善和干预内质网应激[8-9]㊂在肝脏中,游离脂肪酸(f r e e f a t t y a c i d,F F A s)通过β氧化消耗,以三酰甘油形式存储,而F F A s的积累会引起线粒体功能障碍㊁内质网应激和脂肪毒性的发1204重庆医学2020年12月第49卷第23期*基金项目:国家自然科学基金项目(81760119,81660113);省基础研究计划项目[2019F E001(-202)]㊂作者简介:陈顺宏(1990-),在读硕士,主要从事肝移植方面的研究㊂ә通信作者,E-m a i l:952797349@q q.c o m㊂生㊂AM P K磷酸化后抑制下游脂肪酸从头合成关键靶基因的表达,包括胆固醇调节元件结合蛋白(s t e r o l r e g u l a t o r y e l e m e n t b i n d i n g p r o t e i n s,S R E B P s)㊁脂肪酸合成酶(f a t t y a c i d s y n t h a s e,F A S)和乙酰辅酶A羧化酶(a c e t y l-C o A c a r b o x y l a s e,A C C)㊂因此,AM P K 被认为是代谢综合征的治疗靶点之一[10]㊂肖晴等[11]发现,G-R g1可通过调控AM P K通路减少N A F L D 细胞模型的脂质沉积㊂在先前的研究中证明,熊去氧胆酸钠及G-R g1均可以通过调节大鼠β-氧化途径来改善其脂代谢,而G-R g1治疗效果要好于熊去氧胆酸钠,G-R g1通过调节大鼠β-氧化相关的酶改善脂肪代谢对N A F L D大鼠的肝损伤,从而发挥治疗作用[11]㊂同时G-R g1也能通过调节N F-κB通路抑制炎性反应,对N A F L发挥保护作用[5]㊂2 G-R g1减轻肝脏胰岛素抵抗(i n s u l i n r e s i s t a n c e,I R)I R在2型糖尿病发展中有重要作用㊂肝脏是机体的主要代谢器官,对I R的影响最大,当葡萄糖摄取减少,肝糖原合成受到抑制时,就会发生I R㊂正常情况下,胰岛素通过与肝脏胰岛素受体(i n s u l i n r e c e p-t o r s,I R s)结合,启动胰岛素受体底物(i n s u l i n r e c e p-t o r s u b s t r a t e,I R S)蛋白的酪氨酸磷酸化,进而激活磷脂酰肌醇-3激酶(p h o s p h a t i d y l i n o s i t o l3-k i n a s e, P I3-K)㊂P I3-K随后激活蛋白激酶B(A k t/P K B),激活的A k t/P K B一方面磷酸化激活F O X O1,从而抑制糖异生基因如磷酸烯醇丙酮酸羧激酶(p h o s p h o e n o l-p y r u v a t e c a r b o x y k i n a s e,P E P C K)和葡萄糖-6磷酸酶(g l u c o s e-6p h o s p h a t a s e,G6P)的转录㊂另一方面, A k t/P K B导致糖原合成酶激酶3(g l y c o g e n s y n t h a s e k i n a s e,G S K3)的磷酸化失活,增加糖原的合成㊂实验证明[12],G-R g1作用后可以增加葡萄糖的摄取,并降低G6P的表达而减少肝脏葡萄糖的生成从而发挥抗I R作用㊂G-R g1处理可以上调p-I R S1(T y r465),下调p-I R S1(S e r636),促进P I3-K/A k t信号通路,从而增加葡萄糖摄取㊂生化分析显示,G-R g1作用后可明显降低血清丙氨酸转氨酶㊁天冬氨酸转氨酶㊁碱性磷酸酶㊁总胆固醇㊁三酰甘油㊁低密度脂蛋白水平,升高血清高密度脂蛋白水平,提示G-R g1改善了肝脂肪变性的程度㊂在肥胖和I R个体中,肿瘤坏死因子(T N F)-α可以通过提高I R S丝氨酸的磷酸化来抑制其酪氨酸的磷酸化,而G-R g1作用后,白细胞介素(I L)-1β㊁I L-6㊁T N F-α㊁核因子-κB(N F-κB)㊁G6P表达下调,p-A k t上调,通过抑制炎性反应和糖输出,作为肝脂肪变的潜在治疗方法[13]㊂在I R H e p G2细胞中[14],G-R g1对H e p G2细胞活力无影响,但通过降低N O X3的表达减少活性氧的产生,抑制P38MA P K信号通路的激活,增加A k t磷酸化,抑制G S K3β的表达,以剂量依赖的方式促进H e p G2细胞的葡萄糖消耗,减轻H e p G2细胞胰岛素诱导的I R㊂3 G-R g1减轻急性肝脏损伤G-R g1在多种急性肝损伤模型中发挥有效治疗作用㊂不当使用对乙酰氨基酚(A P A P)可导致继发性肝坏死的发病率和死亡率提高㊂高剂量的A P A P通过毒性代谢中间体n-乙酰-对苯醌亚胺(N A P Q I)引起肝坏死,近年来也有不少关于过量使用A P A P导致死亡的报道㊂G-R g1可通过激活N r f2信号通路在体内和体外A P A P诱导的肝损伤发挥保护作用[15-16]㊂生理条件下,k e a p1与N r f2相互作用,抑制了N r f2的活性并调节其降解,在氧化/亲电应激作用下,N r f2从K e a p1中释放并转位到细胞核中,随后激活抗氧化反应元件(a n t i o x i d a n t r e s p o n s e e l e m e n t,A R E)响应基因表达,通过与A R E的结合,N r f2调节红素氧合酶-1 (HO-1)㊁N A D(P)H醌氧化还原酶1(N Q O1)㊁谷氨酸-半胱氨酸连接酶催化修饰亚基(G C L C和G C L M)的表达;N r f2还能调节外排转运蛋白,如多药耐药相关蛋白M r p2㊁M r p3和M r p4,以及C y p酶,包括C y p2e1㊁C y p3a11和C y p1a2[17]㊂G-R g1作用能有效增强机体抗氧化和解毒能力,主要依赖于其上调N r f2核易位,下调K e a p1蛋白表达,从而上调G C L C㊁G C L M㊁HO-1㊁N Q O1等N r f2靶基因;此外,G-R g1能抑制C y p2e1㊁C y p3a11㊁C y p1a2的活性,而后者是A P A P毒性代谢物N A P Q I形成的重要酶㊂在体外实验中,G-R g1能有效提高谷胱甘肽过氧化物酶(G S H-p x)㊁谷胱甘肽(G S H)㊁过氧化氢酶(C A T)活性,抑制活性氧R O S和凋亡[18]㊂但与之矛盾的是,在神经元的缺血再灌注损伤(i s c h e m i a r e p e r f u s i o n i n j u r y,I R I)中,G-R g1可以减轻细胞损伤,伴有N r f2积累,提高N r f2的转录活动,以及促进目标基因的表达,并且G-R g1激活N r f2/A R E通路并不依赖于与K e a p1的分离,G-R g1处理并没有伴随K e a p1的改变,而是翻译后调控的结果[19]㊂这说明G-R g1的调控效果可能存在组织间差异㊂在肿瘤治疗中顺铂的应用会对肝脏造成损伤,G-R g1处理可以有效减轻这种损伤,其机制主要是通过抑制k e a p1和N r f2的结合,促进N r f2活性,减少降解,并促进N r f2相关抗氧化蛋白的表达,从而保护肝脏免受顺铂诱导的毒副作用[20]㊂在四氯化碳所致小鼠急性肝损伤模型中,G-R g1可通过激活N r f2信号通路,调节相关基因的表达水平,增强抗氧化应激和肝脏解毒能力,并可调节肝脏转运蛋白和细胞色素P450酶的表达,提高肝脏的解毒能力[21-22]㊂在D-半乳糖诱导的肝损伤中,G-R g1能明显增加超氧化物歧化酶(S O D)和G S H-p x的活性,增加G S H的消耗,部分逆转M D A的升高,通过其抗氧化特性发挥保护作用,并减轻慢性氧化应激引起的D N A损伤[23]㊂并且与薯蓣皂甙(100m g/k g)相比,G-R g1(60m g/k g)对2204重庆医学2020年12月第49卷第23期S O D有更好的上调效果[24]㊂T o l l样受体4(T L R4)作为N F-κB和MA P K s信号通路的上游因子,在炎性反应中发挥重要作用㊂有研究发现[25-26],G-R g1可以通过抑制T L R4的表达,减轻半乳糖胺诱导的小鼠急性肝损伤,同时也能竞争性抑制脂多糖与T L R4的结合,减少脂多糖刺激产生的I L-1β㊁I L-6㊁T N F-α,从而减轻脂多糖引起的肝损伤[27]㊂4 G-R g1减轻I R IG-R g1在多种器官缺血和再灌注损伤中发挥抗氧化作用,减轻组织的I R I㊂肝脏血供丰富,在手术过程中常需要阻断血管,使肝脏经历缺血和再灌注两个过程,从而造成I R I㊂实验发现,G-R g1预处理可有效减少肝细胞凋亡,抑制炎症的反应,这部分是通过N F-κB信号通路实现的[28]㊂G-R g1还能通过不同的作用机制,在多种器官中发挥减轻I R I作用㊂G-R g1可以改善小鼠缺血肢体的血流,明显地促进血管新生,抑制缺血组织细胞的凋亡,其作用机制与G-R g1增加组织血管内皮生长因子(V E G F)㊁V E G F受体㊁p-A k t及N O的表达有关[29]㊂而通过减少T N F-α㊁I L-6㊁M D A水平,提高S O D活性,对大鼠肠缺血再灌注后的肠道有保护作用[30]㊂腹腔注射G-R g1能有效改善缺血神经细胞形态改变并减少神经细胞的丢失,并且呈剂量依赖趋势,其作用随剂量增大而增强,作用机制与其抑制海马神经元的凋亡及p-J N K㊁p-E R K1/ 2的表达有关[31]㊂在大鼠局灶性脑缺血模型中,G-R g1通过下调大脑组织聚腺苷二磷酸核糖聚合酶-1 (P A R P-1)㊁肿瘤坏死因子受体1(T N F R1)的表达,对抗脑细胞坏死,通过抑制细胞凋亡来发挥脑保护作用[32]㊂5结语G-R g1已被证明在多种肝脏疾病中发挥有效作用,也逐步应用于针对肝脏损伤的治疗当中㊂与其他合成类药物相比,其具有抗氧化㊁抗炎㊁不良反应小等特点㊂G-R g1在肝脏不同疾病中的作用被不断发现,还被证明有改善纤维化[33]㊁免疫调节[34]等作用㊂随着研究的不断深入,其新的药理作用被不断发现㊂基于G-R g1的抗氧化功能和对N r f2通路的调节作用, G-R g1的作用还有待进一步发现㊂参考文献[1]S H I N B K,KWO N S W,P A R K J H.C h e m i c a ld i ve r s i t y ofg i n s e n g s a p o n i n s f r o m p a n a x g i n-s e n g[J].J G i n s e n g R e s,2015,39(4):287-298.[2]S U N J,Z H A N G L,Z H A N G J,e t a l.P r o t e c t i v ee f f e c t s o f g i n s e n o s i d e R g1o n s p l e n o c y t e s a n dt h y m o c y t e s i n a n a g i n g r a t m o d e l i n d u c e d b y d-g a l a c t o s e[J].I n t I mm u n o p h a r m a c o l,2018,58: 94-102.[3]WA N G L,Z H A O H,Z H A I Z Z,e t a l.P r o t e c-t i v e e f f e c t a n d m e c h a n i s m o f g i n s e n o s i d e R g1i n c e r e b r a l i s c h a e m i a-r e p e r f u s i o n i n j u r y i n m i c e[J].B i o m e d P h a r m a c o t h e r,2018,99:876-882.[4]L I J,Y A N G C,Z H A N G S,e t a l.G i n s e n o s i d eR g1i n h i b i t s i n f l a mm a t o r y r e s p o n s e s v i a m o d u-l a t i o n o f t h e n u c l e a r f a c t o r k a p p a B p a t h w a y a n d i n h i b i t i o n o f i n f l a mm a s o m e a c t i v a t i o n i n a l c o-h o l i c h e p a t i t i s[J].I n t J M o l M e d,2018,41(2):899-907.[5]Z H A O J,S H I Z,L I U S,e t a l.G i n s e n o s i d e s R g1f r o m p a n a xg i n s e n g:a p o t e n t i a l th e r a p y f o r a-c u t e li v e r f a i l u r e p a t i e n t s[J].E v i d B a s e d C o m-p l e m e n t A l t e r n a t M e d,2014,2014:538059.[6]肖阳,侯云鹤,尹鑫,等.人参皂苷R g1干预非酒精性脂肪肝模型大鼠肝细胞的凋亡[J].中国组织工程研究,2019,23(3):384-390.[7]O T A T,G A Y E T C,G i n s b e r g H.I n h i b i t i o n o fa p o l i p o p r o t e i n B100s e c r e t i o nb y l i p i d-i n d uc ed he p a t i c e n d o p l a s m i c r e t i c u l u m s t r e s s i n r o d e n t s[J].J C l i n I n v e s t,2008,118(1):316-332. [8]徐雅姝,黄文祥,阳成,等.人参皂苷R g1对小鼠非酒精性脂肪肝的改善作用和机制研究[J].重庆医科大学学报,2019,44(11):1434-1438. [9]X U Y,Y A N G C,Z H A N G S,e t a l.G i n s e n o s i d eR g1p r o t e c t s a g a i n s t n o n-a l c o h o l i c f a t t y l i v e r d i s e a s e b y a m e l i o r a t i n g l i p i d p e r o x i d a t i o n,e n-d o p l a s m i c r e t i c u l u m s t r e s s,a n d i n f l a mm a s o m e a c t i v a t i o n[J].B i o l P h a r m B u l l,2018,41(11): 1638-1644.[10]C HO I Y J,L E E K Y,J U N G S H,e t a l.A c t i v a-t i o n o f AM P K b y b e r b e r i n e i n d u c e s h e p a t i c l i p-i d a c c u m u l a t i o n b y u p r e g u l a t i o n o f f a t t y a c i d t r a n s l o c a s e C D36i n m i c e[J].T o x i c o l A p p lP h a r m a c o l,2017,316:74-82.[11]肖晴,黄文祥,章述军.人参皂苷R g1激活A M P K抑制体外诱导的非酒精性脂肪肝细胞模型脂质沉积[J].第三军医大学学报,2019,41(12): 1343-1349.[12]C N O P M F F,V E L L O S O L A.E n d o p l a s m i cr e t i c u l u m s t r e s s,o b e s i t y a n d d i a b e t e s[J].T r e n d s M o l M e d,2012,18(1):59-68. [13]X I A O M F,C HA O Z,S H I W N,e t a l.G i n s e n-o s i d e R g1a t t e n u a t e s h e p a t i c i n s u l i n r e s i s t a n c e i n d u c e d b y h i g h-f a t a n d h i g h-s u g a r b y i n h i b i-t i n g i n f l a mm a t i o n[J].E u r J P h a r m a c o l,2019,3204重庆医学2020年12月第49卷第23期854:247-255.[14]R I Q U E L M E A,A R R E S E M,S O Z A A,e t a l.N o n-a l c o h o l i c f a t t y l i v e r d i s e a s e a n d i t s a s s o c i-a t i o n w i t h ob e s i t y,i n s u l i n r e s i s t a nc e a nd i n-c r e a s ed se r u m l e v e l s of C-r e a c t i v e p r o t e i n i nH i s p a n i c s[J].L i v e r I n t,2009,29(1):82-88.[15]N I N G J,HO N G T,WA R D A,e t a l.C o n s t i t u-t i v e r o l e f o r I R E1α-X B P1s i g n a l i n g p a t h w a y i n t h e i n s u l i n-m e d i a t e d h e p a t i c l i p o g e n i c p r o g r a m[J].E n d o c r i n o l o g y,2011,152(6):2247-2255.[16]C H E N Q N,X I A O G G,C H A N G Y W,e t a l.G i n s e n o s i d e R g1p r o t e c t s a g a i n s t a c e t a m i n o-p h e n-i n d u c e d l i v e r i n j u r y v i a a c t i v a t i n g N r f2 s i g n a l i n g p a t h w a y i n v i v o a n d i n v i t r o[J].R e g-u l T o x i c o l P h a r m a c o l,2018,98:58-68.[17]J I A N G Y M,W A N G Y,T A N H S,e t a l.S c h i s a n-d r o l B p r o te c t s a g a i n s t a c e t a m i n o p h e n-i n d u c e d a c u t e h e p a t o t o x i c i t y i n m i c e v i a a c t i v a t i o n of t h e N R F2/A R E s ig n a l i n g p a th w a y[J].A c t aP h a r m a c o l S i n,2016,37(3):382-389. [18]O B E R K O F L E R H,P F E I F E N B E R G E R A,S OY A L S,e t a l.A b e r r a n t h e p a t i c T R I B3g e n e e x-p r e s s i o n i n i n s u l i n r e s i s t a n t o b e s e h u m a n s[J].D i a b e t o l o g i a,2010,53(9):1971-1975.[19]L E E A,S C A P A E,C O H E N D,e t a l.R e g u l a-t i o n o f h e p a t i c l i p o g e n e s i s b y t h e t r a n s c r i p t i o nf a c t o r X B P1[J].S c i e n c e,2008,320(5882):1492-1496.[20]G A O Y,C HU S,S H A O Q,e t a l.A n t i o x i d a n ta c t i v i t i e s o f g i n s e n o s i d e R g1a g a i n s t c i s p l a t i n-i n d u c e d h e p a t i c i n j u r y t h r o u g h N r f2s i g n a l i n gp a t h w a y i n m i c e[J].F r e e R a d R e s,2017,51(1):1-13.[21]齐本权.人参皂苷R g1对致小鼠急性肝损伤的保护作用[J].南通大学学报(医学版),2016,36(4):260-264.[22]Y AMA Z A K I H,H I R AMA T S U N,H A Y A K A-WA K,e t a l.A c t i v a t i o n o f t h e A k t-N F-k a p p a Bp a t h w a y b y s u b t i l a s e c y t o t o x i n t h r o u g h t h eA T F6b r a n c h o f t h e u n f o l d e d p r o t e i n r e s p o n s e[J].J I mm u n o l,2009,183(2):1480-1487. [23]X I A O M H,X I A J Y,WA N G Z L,e t a l.G i n-s e n o s i d e R g1a t t e n u a t e s l i v e r i n j u r y i n d u c e d b yD-g a l a c t o s e i n m i c e[J].E x p T h e r M e d,2018, 16(5):4100-4106.[24]L U B,X U Y,X U L,e t a l.M e c h a n i s m i n v e s t i-g a t i o n o f d i o s c i n a g a i n s t C C l4-i n d u c e d a c u t e l i v e r d a m a g e i n m i c e[J].E n v i r o n T o x i c o l P h a r-m a c o l,2012,34(2):127-135.[25]H E T Z C C E,O A K E S S A.P r o t e o s t a s i s c o n t r o lb y t h e u n f o l d e d p r o t e i n r e s p o n s e[J].N a t C e l lB i o l,2015,17(7):829-838.[26]A C H A R D C S,L A Y B U T T D R.L i p i d-i n d u c e de n d o p l a s m i c r e t i c u l u m s t r e s s i n l i v e r c e l l s r e-s u l t s i n t w o d i s t i n c t o u t c o m e s:a d a p t a t i o n w i t h e n h a n c e d i n s u l i n s i g n a l i n g o r i n s u l i n r e s i s t a n c e[J].E n d o c r i n o l o g y,2012,153(5):2164-2177.[27]O Z C A N U,C A O Q,Y I L MA Z E,e t a l.E n d o-p l a s m i c r e t i c u l u m s t r e s s l i n k s o b e s i t y,i n s u l i na c t i o n,a n d t y p e2d i ab e t e s[J].Sc i e n c e,2004,306(5695):457-461.[28]T A O T,C H E N F,B O L,e t a l.G i n s e n o s i d e R g1p r o t e c t s m o u s e l i v e r a g a i n s t i s c h e m i a-r e p e r f u-s i o n i n j u r y t h r o u g h a n t i-i n f l a mm a t o r y a n d a n t i-a p o p t o s i s p r o p e r t i e s[J].J S u r g R e s,2014,191(1):231-238.[29]王晓丽,金跃,刘鹭,等.人参皂苷R g1改善小鼠肢体缺血后血管新生[J].江苏大学学报,2018, 28(2):126-128.[30]李茜,张彦敏,关玥,等.人参皂苷R g1对大鼠肠缺血/再灌注损伤的影响[J].中国药理学通报, 2010,26(3):358-361.[31]王巧云,刘凤,吴峰阶,等.人参皂苷R g1对局灶性脑缺血再灌注损伤大鼠海马p-E R K1/2与p-J N K表达的影响[J].中国中西医结合杂志, 2013,33(2):229-234.[32]于洋,刘学政,包翠芬,等.人参皂苷R g1对局灶性脑缺血大鼠P A R P-1和T N F R1表达的影响[J].天津医药,2015,43(3):245-248.[33]W E I X,C H E N Y,H U A N G W.G i n s e n o s i d e R g1a m e l i o r a t e s l i v e r f ib r o s i s v i a s u p p r e s s i n g e p i t h e l i a lt o m e s e n c h y m a l t r a n s i t i o n a n d r e a c t i v e o x y g e ns p e c i e s p r o d u c t i o n i n v i t r o a n d i n v i v o[J].B i o F a c-t o r s,2018,44(4):327-335.[34]W A N G Y,L I U Y,Z H A N G X,e t a l.G i n s e n o s i d eR g1r e g u l a t e s i n n a t e i m m u n e r e s p o n s e s i n m a c r o-p h a g e s t h r o u g h d i f f e r e n t i a l l y m o d u l a t i n g t h e N F-κB a n d P I3K/A k t/m T O R p a t h w a y s[J].I n t I m-m u n o p h a r m a c o l,2014,23(1):77-84.(收稿日期:2020-01-18修回日期:2020-08-02)4204重庆医学2020年12月第49卷第23期。
HSP70在肝缺血再灌损伤过程中高表达的意义

HSP70在肝缺血再灌损伤过程中高表达的意义肝缺血再灌注损伤是肝脏外科手术及肝移植中常见的病理生理现象,损伤过程涉及到很多重要机制,如微循环障碍、细胞凋亡、炎症因子的释放等。
而在这应激过程中发现肝细胞内HSP70表达明显增高,有研究结果表明HSP70直接或间接参与了肝脏组织的保护和再生,提高动物模型中肝大部分切除后动物的生存率,其中涉及到了很多机制。
本综述阐述HSP70在肝缺血再灌注损伤中的保护机制,进一步研究其保护机制对减少肝外科手术后肝组织的损伤有着重要意义,对临床疾病治疗也有着很重要的意义。
标签:HSP70;肝缺血再灌注损伤;细胞保护肝缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI)是指缺血的肝脏重新获得血液供应后,并没有使肝脏的功能得以恢复,反而加重其功能代谢障碍及组织结构破坏的现象。
自1960年Jennings首次提出心肌再灌注损伤以来,临床医生陆续发现在休克治疗、心肺复苏、心脑血管栓塞再通、器官移植时均会发生缺血-再灌注损伤(ischemia-reperfusion injury,IRI)。
1975年,Toledo等[1]首先认识到IR损伤是肝移植过程中的重要病理状态,导致移植失败,但直到1980年中期再灌注损伤才在肝移植文献中广泛运用[2]。
随着肝移植的增加和边缘供体增多,肝缺血再灌(I/R)注损伤也成为国内外学者们热切关注的问题[3]。
损伤的严重程度与缺血时间、组织需氧量、是否有侧支循环等有关。
仅仅缺血不会导致缺血后的损伤,就像脑缺血足够长的时间导致脑细胞坏死,但不会发生缺血再灌注损伤,关键是缺血后的再灌注会导致组织器官功能障碍,甚至失去正常的功能。
损伤的发生机制现在研究比较充分的就是氧自由基的损伤,通过多种机制导致细胞中氧自由基的增加,增加的氧自由基除了损伤细胞生物膜,还会导致蛋白质和DNA分子结构的变化,引起DNA链的断裂,染色体的畸变和断裂等一系列改变。
小鼠肝脏部分缺血再灌注损伤模型的建立

中华消化外科杂志 2013年 9月第 12卷第 9期 ChinNo.9
·703·
·论著·
小鼠肝脏部分缺血再灌注损伤模型的建立
麻勇 汪大伟 刘连新 王建奇 王继洲 潘华洋 潘尚哈 姜洪池
【摘要】 目的 建立小鼠肝脏部分缺血再灌注损伤模型并分析损伤评估指标的变化趋势。方法 采 用 96只 7~8周龄的纯系 C57BL/6雄性小鼠作为研究对象,建立 70%肝脏缺血再灌注损伤模型。按照缺 血时间将小鼠分为假手术组和缺血 30、60、90min组,每组 24只。各组小鼠分别于再灌注后 6、12、24和 48h处死。通过检测血清 ALT、AST、TNFα、IL6和巨噬细胞炎性蛋白2(MIP2)水平以及病理组织学评 分、细胞凋亡指数等方法评估各组小鼠肝组织的损伤情况。两独立样本比较采用 t检验。结果 术后 88只小鼠存活,8只死亡,造模成功率为 91.7%(88/96)。假手术组、缺血 30、60、90min组 ALT水平分别 为(35±24)U/L、(1703±442)U/L、(5133±681)U/L和(8233±808)U/L,缺血 30、60、90min组 ALT水平 显著高于假手术组(t=6.54,12.97,17.56,P<0.05);AST水 平 分 别 为 (87±28)U/L、(2667±451)U/L、 (6333±778)U/L和(9967±1168)U/L,缺血 30、60、90min组 AST水平显著高于假手术组(t=9.89,13.89, 14.65,P<0.05);TNFα水平分别 为 (14±5)μg/L、(83±14)μg/L、(133±17)μg/L和 (202±21)μg/L, 缺血 30、60、90min组 TNFα水平显著高于假手术组(t=7.78,11.82,15.34,P<0.05);IL6水平分别为 (32±9)μg/L、(493±168)μg/L、(844±166)μg/L和(1345±198)μg/L,缺血 30、60、90min组 IL6水平 显著高于假手术组(t=4.74,8.46,11.48,P<0.05);MIP2水 平 分 别 为 (37±11)μg/L、(102±35)μg/L、 (177±32)μg/L和(279±50)μg/L,缺血 30、60、90min组 MIP2水平显著高于假手术组(t=3.05,7.28, 8.19,P<0.05);细胞凋亡指数分别为 1.7%±2.1%、22.7%±8.6%、54.3%±11.2%和 76.3%±14.8%,缺 血 30、60、90min组细胞凋亡指数显著高于假手术组(t=4.10,8.04,8.63,P<0.05)。在缺血时间相同的 情况下,随着再灌注时间的延长,各监测指标呈“抛物线”样变化趋势。结论 小鼠肝脏部分缺血再灌注损 伤模型能较好地反映小鼠肝组织的损伤情况。随着缺血时间的延长,小鼠肝脏的缺血再灌注损伤程度逐 渐加重;随着再灌注时间的延长,ALT、AST、TNFα、IL6、MIP2以及病理组织学评分和细胞凋亡指数均呈 现“抛物线”样变化趋势。 【关键词】 肝脏; 缺血再灌注损伤; 小鼠; 模型
大鼠肝脏缺血再灌注损伤模型

大鼠肝脏缺血再灌注损伤模型缺血再灌注损伤,即缺血器官、组织重新获得血液供应,不仅不能使组织、器官功能恢复,反而加重了功能代谢障碍及结构破坏。
对麻醉动物的肝中叶和肝左叶的门静脉和肝动脉进行阻断和再通,由于肝脏中叶和左叶血流的阻断和再通,引起肝脏中叶和左叶明显的再灌注损伤。
肝脏缺血过程中由于肝细胞内ATP迅速耗尽,导致乳酸酮体等的堆积,及线粒体氧化磷酸化功能低下,引发代谢性酸中毒,缺血过程中细胞缺氧使ATP含量下降,导致肝细胞内外Ca2 +重新分布,即Ca2 +内流,引起线粒体的损伤。
再灌注过程中由于氧自由基的爆发性增多,中性粒细胞的聚集,kupffer细胞的激活,细胞凋亡及其他多种细胞因子的作用,使得肝细胞膜损伤,内皮细胞损伤及肝脏微循环障碍等导致肝脏功能代谢障碍及结构破坏。
1.实验动物SPF级Wistar大鼠,健康,雄性,体重为250g-300g。
2.实验分组实验分六组:正常对照组、模型组、阳性药组、受试药组三个剂量组,每组15只动物。
3.实验周期0h、3h、6h、12h、24h、72h4.建模方法1.选取体重250g-300g大鼠,行术前12 h禁食,自由饮水。
2. 15%水合氯醛350mg/kg腹腔注射麻醉,麻醉成功后将大鼠平躺在手术台上胶带固定四肢,将大鼠腹部至剑突术区剃毛,用10%碘酒和75%乙醇术区消毒。
3.取腹正中切口1cm,打开腹腔,小心分离出肝脏左、中叶之肝蒂(左、中叶肝脏供血的门静脉和肝动脉)。
4. 用无创血管夹夹闭中叶和左叶的门静脉和肝动脉,使约70%的肝脏缺血,以防止发生严重肠系膜静脉淤血。
0.5min后,与非阻断的右叶相比,肉眼可见阻断叶明显变白,说明阻断成功,用止血钳夹闭皮肤切口临时关闭腹腔,同时将大鼠放在37℃恒温加热垫上保温。
5. 完成持续缺血60min后,重新打开腹腔,迅速取出血管夹,恢复缺血肝血流,0.5min左右可见缺血区肝脏由白色逐渐恢复为鲜红色表明再灌注成功,逐层缝合腹腔肌肉和皮肤关闭腹腔,完成手术。
灵芝保肝作用的研究进展

特产研究159Special Wild Economic Animal and Plant ResearchDOI:10.16720/ki.tcyj.2022.147灵芝保肝作用的研究进展刘洋1,2,3,韩忠明2,张瑞2,许琳1,3,王胜1,3,闫梅霞1,3※[1.中国农业科学院特产研究所,吉林长春130112;2.吉林农业大学中药材学院,吉林长春130118;3.吉林省中药材种植(养殖)重点实验室,吉林长春130112]摘要:灵芝是我国传统食药用真菌。
现代药理学研究发现,灵芝有良好的保肝护肝作用,其活性成分可通过调节肝脏组织的氧化应激水平、抑制炎症反应、调节细胞凋亡和自噬等发挥保肝作用,对酒精性肝损伤、药物性肝损伤、化学试剂致肝损伤及缺血再灌注致肝损伤等均有预防和治疗作用。
本文综述了灵芝保肝作用机制的研究进展,同时对灵芝及灵芝制品在几种肝损伤类型中的保护作用进行了归纳总结,为灵芝保肝护肝作用的研究提供参考。
关键词:灵芝;活性成分;肝损伤中图分类号:S567.3+1;R285文献标志码:A文章编号:1001-4721(2023)06-0159-07Research Progress on the Hepatoprotective Effect of Ganoderma lucidumLIU Yang1,2,3,HAN Zhongming2,ZHANG Rui2,XU Lin1,3,WANG Sheng1,3,YAN Meixia1,3※(1.Institute of Special Animal and Plant Sciences of Chinese Academy of Agricultural Sciences,Changchun130112,China;2.College of Traditional Chinese Medicinal Materials,Jilin Agricultural University,Changchun130118,China;3.Jilin Prov-incial Key Laboratory of Traditional Chinese Medicinal Materials Cultivation and Propagation,Changchun130112,China) Abstract:Ganoderma lucidum is a traditional medicinal fungus in China.Modern pharmacological studies have found that G.lucidum has good liver protection.Its active ingredients can exert hepatoprotective effects by regulating the level of oxidative stress in liver tissue,in-hibiting inflammatory responses,regulating apoptosis and autophagy,etc.It has preventive and therapeutic effects on alcohol-induced liver injury,drug-induced liver injury,chemical reagent-induced liver injury,and ischemia-reperfusion-induced liver injury.This article reviews the liver-protective mechanism of G.lucidum,and summarizes the protective effects of G.lucidum and G.lucidum products in several types of liver injury,so as to a provide a reference for the research on the protective effect of G.lucidum on the liver.Key words:G.lucidum;active ingredient;liver injury灵芝在我国已有几千年的食药用历史,《神农本草经》中记载,灵芝可补肝气、益脾气、安神、治咳逆等[1]。
缺血预处理联合后处理对兔肝缺血再灌注损伤保护作用论文

缺血预处理联合后处理对兔肝缺血再灌注损伤的保护作用【摘要】目的:评价缺血预处理联合后处理对兔肝缺血再灌注损伤的保护作用。
方法:取健康日本大耳白兔30只,体重1.5~2.0 kg,雌雄不拘,随机分为5组(n=6):假手术组(s组)、缺血再灌注组(ir组)、缺血预处理组(ip组)、缺血后处理组(ipo组)和缺血预处理联合后处理组(ip+ipo组)。
s组仅开腹,游离肝脏,分离肝门但不阻断;ir组采用阻断肝门45 min再灌注6 h的方法制备肝缺血再灌注模型;ip组阻断肝门10 min,再灌注10 min,反复3次,余操作同ir组;ipo组阻断肝门45 min后,灌注1 min,再缺血1 min,反复3个短暂的循环,再灌注6 h,ip+ipo组在ip 组的基础上再行3个灌注1 min,再缺血1min的循环,后再灌注6 h。
于再灌注6 h时,经颈动脉抽血后迅速处死兔取肝,测定血清谷丙转氨酶(alt)及天门冬氨酸氨基转移酶(ast)活性,然后取肝组织,分离肝细胞,测定线粒体膜电位及线粒体na+-k+-atp酶活性。
结果:与s组比较,其余各组血清alt和ast活性升高,线粒体na+-k+-atp酶活性及线粒体膜电位降低(p综上所述,ip和ipo联合应用能更好的保护线粒体,维持组织的能量代谢稳定,从而在再灌注早期更好的减轻肝脏的损伤。
本研究为在临床上对肝脏i-r损伤预处理提供了实验基础。
参考文献:[1] 王万铁,徐正衸,林丽娜,等.家兔肝缺血再灌注损伤时氧自由基的动态变化[j].温州医学院学报,1998,28(4):301-302.[2] 袁贵秀,常业恬,李李等.缺血后处理对兔肝脏热缺血再灌注损伤的保护[j].中国现代手术学杂志,2007,1(12):98-100.[3] 汤礼军,崔建峰,罗浩等. 肝脏缺血再灌注肝细胞凋亡与肝细胞糖原关系的实验研究[j].西南国防医药,2010,20(6):584-586.[4] 沈广海,高爽,沈兆亮等.缺血后处理通过线粒体途径减轻缺血再灌注诱导的肝细胞凋亡[j].中国医药导报,2011,8(12):21-23.[5] yang xm,proctor jb,cui l,et al.multiple,brief coronary occlusions during early reperfusion protect rabbit hearts by targeting cell signaling pathways.j am coll cardiol.2004,44:1103-1110.[6] sato h,bolli r,rokosh gd,et a1.the cardioprotection of the late phase of ischemic preconditioning is enhanced by postconditioning via a cox-2-mediated mechanism in conscious rats.am j physiol heart cire physiol.2007,293:h2557-h2564.[7] prattd s,kaplan mm.evaluation of abnormal liver-enzyme results in asymptomatic paitents[j].n engl j med,2000,342:1266-1271.[8] saris ne,eriksonnon ko.mitochondrial dysfunciton in iseheima- reperfusion[j]. acta anaestesiol scand,1995,39:171-176.[9] 甄允芳,孙庆林,汪健,等.褪黑素对大鼠肝缺血再灌注后线粒体损伤的保护作用.中华小儿外科杂志,2006,27:668-669.。
心肌缺血-再灌注损伤与细胞凋亡

心肌缺血-再灌注损伤与细胞凋亡心肌缺血-再灌注损伤目前仍是冠状动脉再通术(溶栓、PTCA或搭桥术)后一个重要的并发症,也是致死原因之一。
其病因复杂,发生机制至今尚未完全阐明。
新近分子心血管病学的研究进展发现,细胞凋亡现象存在于心血管系统的许多生理和病理过程中[1]。
对细胞凋亡参与心肌缺血-再灌注损伤的病理形成中的研究已日渐增多。
已有学者提出,细胞凋亡可能为再灌注损伤发病机制中的一个重要环节[2,3];通过干预凋亡基因的表达阻断细胞凋亡过程以减轻再灌注损伤能否成为防治再灌注损伤的有效方法已受关注。
现将目前这方面的研究进展综述如下。
1.细胞凋亡概述细胞凋亡是指在一定的生理或病理条件下,遵循自身的程序,通过启动内部机制,主要是通过内源性DNA内切酶的激活,自己结束其生命的过程。
它是一种细胞主动的死亡过程,在整个过程中牵涉到一系列特殊基因的表达以及细胞发生特征性的生化和形态学改变[4,5]。
凋亡作为细胞死亡的一种方式,与细胞增殖一起,维持着体内细胞的动态平衡。
它是生命过程中不可缺少的组成内容;是多细胞生物赖以存活的需要;是清除不需要的、已严重受损的、有潜在危险性细胞的一种防御机制。
一旦细胞凋亡的规律失常,个体生命活动就失去了正常的功能,甚至不能存活。
因此,细胞凋亡在生物体中的发育成熟、维持正常组织和器官的细胞数目恒定与生长平衡,乃至机体衰老方面都起着重要的作用[5]。
目前,虽然对细胞凋亡的激发与抑制的详细机制还未十分清楚,但已有许多研究资料证实,有多种基因参与了细胞凋亡的基因调控[6]。
有些细胞凋亡过程是由明显的诱导因素诱发的,但在更多的情况下是细胞自发性死亡过程。
通过对调控细胞凋亡的基因的研究,可以将细胞凋亡相关基因分为诱导基因(死亡基因)和抑制基因(生存基因)。
通常在生理条件下,细胞有序而协调地激活凋亡诱导基因(P53,c-myc等)和/或凋亡抑制基因(Bcl-2等),共同控制着细胞代谢功能而维持细胞内环境的动态平衡[7,8]。
病理生理学缺血再灌注损伤(完整)

历 史
认识就从这简单的现象开始
• 1955年,Sewell结扎狗冠状动脉后,如 突然解除结扎,恢复血流,动物室颤而 死亡。
• 1966 年, Jennings 第一次提出心肌再灌注
损伤的概念,证实再灌注会引起心肌超微 结构不可逆坏死,包括爆发性水肿、组织 在心肌缺血恢复血流后,缺
3. 其他(others) Cl. , CH3. , NO等
1. 氧自由基
O2
以氧为中心的自由基称为氧自由基, 如超氧阴离子(
98%
_ • O O2 1%-2% 2 _ • O2
)、羟自由基(OH• )。
细胞色素氧化酶系统
4e-+4H+
e-
e-+H+ e-+2H+ e-+H+ OH• H2O H O 2 2 SOD H2O
Haber-Weiss反应
(without Fe3+)
_ O•2
+ H2O2
O2 + OH- + OH•
SLOW
Hale Waihona Puke Fenton型 Haber-Weiss反应
Fe3+ _ O•2 + H2O2
O2 + OH- + OH•
FAST
2. 脂性自由基(lipid free radical) 氧自由基 + 多价不饱和脂肪酸 L. (烷自由基) LO. (烷氧自由基) LOO. (烷过氧自由基)
谢障碍的现象称为钙超载(calcium overload)。
钙反常(calcium paradox): 1966年
病毒生理学练习题第12章缺血再灌注损伤

第12章缺血-再灌注损伤一、选择题【A型题】1.缺血-再灌注损伤是指.A.缺血后引起的损伤 D.缺血基础上恢复血流后损伤反而加重B.在灌注后引起的损伤E.以上都不是C.缺血后恢复血流引起的后果[答案] D[题解] 缺血基础上再灌注以恢复血流,不仅不能使组织器官功能恢复,反而加重组织器官的功能障碍和结构损伤,这称为缺血—再灌注损伤。
2.下列哪一种情况不会发生缺血-再灌注损伤?A.输血输液后D.冠脉搭桥后B.溶栓疗法后E.体外循环后C.器官移植后[答案] A[题解] 缺血-再灌注损伤发生在先缺血后灌注的情况,输血输液前可有缺血或不缺血情况,而其余4种均有先缺血后再灌注的情况,因此可发生缺血-再灌注损伤。
3.下列哪一种因素不会影响缺血-再灌注损伤的发生?A.缺血时间的长短D.组织的营养状态B.组织侧枝循环有无E.电解质浓度C.对氧需求的高低[答案] D[题解] 缺血时间长短、侧枝循环有无、对氧需求高低和电解质浓度均能影响缺血-再灌注损伤的发生。
组织的营养状态与缺血-再灌注损伤发生无明显相关。
4.下列哪一种因素是缺血-再灌注损伤发生的主要机制?A.钙超载D.高能磷酸化合物缺乏B.自由基作用E.无复流现象C.白细胞作用[答案] B[题解] 上述5种都参与缺血-再灌注损伤的发生机制,但其中最重要的机制为自由基作用,因自由基可促进钙超载,胞浆内游离钙增加又可加速自由基的产生,血管内皮细胞和中性粒细胞又可作为缺血-再灌注时自由基的重要来源。
5.自由基是指A.极易被电离的原子、原子团和分子。
B.极易起氧化还原反应的原子、原子团和分子。
C.具有单价的原子、原子团和分子。
D.外层轨道上具有配对电子的原子、原子团和分子。
E.外层轨道上含有单个不配对电子的原子、原子团和分子的总称。
[答案] E[题解] 自由基是指外层轨道上含有单个不配对电子的原子、原子团和分子的总称。
6.自由基不包括A.O2-.D.Cl•B.OH•E.LOO•C.1O2[答案] C[题解] O2-.属氧自由基,Cl•为氯自由基,LOO•为烷过氧自由基;1O2为单线态氧,是一种激发态氧,易氧化不饱和脂肪酸,与H2O2均属活性氧。
HMGB1Caspase-1GSDMD信号轴介导肝细胞焦亡在肝脏缺血-再灌注损伤中的作用
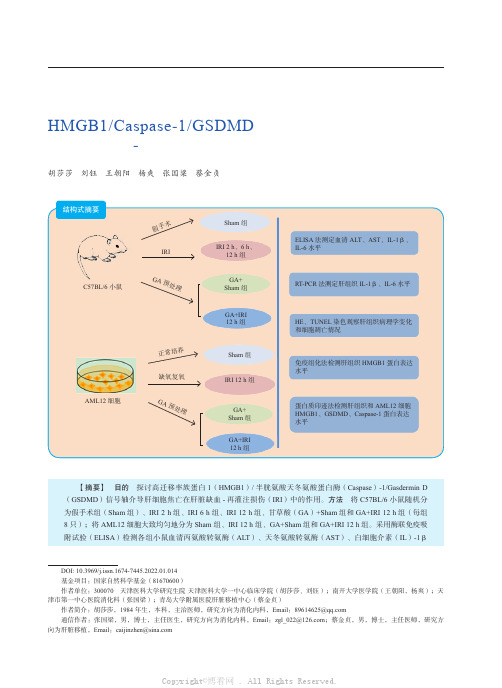
第13卷 第1期2022年1月Vol. 13 No.1Jan. 2022器官移植Organ TransplantationHMGB1/Caspase-1/GSDMD 信号轴介导肝细胞焦亡在肝脏缺血-再灌注损伤中的作用胡莎莎 刘钰 王朝阳 杨爽 张国梁 蔡金贞【摘要】 目的 探讨高迁移率族蛋白1(HMGB1)/半胱氨酸天冬氨酸蛋白酶(Caspase )-1/Gasdermin D (GSDMD )信号轴介导肝细胞焦亡在肝脏缺血-再灌注损伤(IRI )中的作用。
方法 将C57BL/6小鼠随机分为假手术组(Sham 组)、IRI 2 h 组、IRI 6 h 组、IRI 12 h 组、甘草酸(GA )+Sham 组和GA+IRI 12 h 组(每组 8只);将AML12细胞大致均匀地分为Sham 组、IRI 12 h 组、GA+Sham 组和GA+IRI 12 h 组。
采用酶联免疫吸附试验(ELISA )检测各组小鼠血清丙氨酸转氨酶(ALT )、天冬氨酸转氨酶(AST )、白细胞介素(IL )-1βDOI: 10.3969/j.issn.1674-7445.2022.01.014基金项目:国家自然科学基金(81670600)作者单位:300070 天津医科大学研究生院 天津医科大学一中心临床学院(胡莎莎、刘钰);南开大学医学院(王朝阳,杨爽);天津市第一中心医院消化科(张国梁);青岛大学附属医院肝脏移植中心(蔡金贞)作者简介:胡莎莎,1984年生,本科,主治医师,研究方向为消化内科,Email :通信作者:张国梁,男,博士,主任医生,研究方向为消化内科,Email :;蔡金贞,男,博士,主任医师,研究方向为肝脏移植,Email :·论著·IRI假手术正常培养G A预处理G A预处理ELISA 法测定血清ALT 、AST 、IL-1β、IL-6水平Sham 组IRI 2 h 、6 h 、12 h 组GA+ Sham 组GA+IRI 12 h 组Sham 组IRI 12 h 组GA+ Sham 组GA+IRI 12 h 组RT-PCR 法测定肝组织IL-1β、IL-6水平HE 、TUNEL 染色观察肝组织病理学变化和细胞凋亡情况免疫组化法检测肝组织HMGB1蛋白表达水平蛋白质印迹法检测肝组织和AML12细胞HMGB1、GSDMD 、Caspase-1蛋白表达水平C57BL/6小鼠AML12细胞缺氧复氧结构式摘要胡莎莎等.HMGB1/Caspase-1/GSDMD 信号轴介导肝细胞焦亡在肝脏缺血-再灌注损伤中的作用第1期·89·和IL-6的水平;采用逆转录聚合酶链反应(RT-PCR )检测肝组织中IL-1β和IL-6 信使核糖核酸(mRNA )水平;比较各组小鼠肝脏缺血病理学评分和细胞凋亡情况;采用免疫组织化学(免疫组化)法检测各组小鼠肝组织中HMGB1的表达情况;采用蛋白质印迹法检测小鼠肝组织和AML12细胞中HMGB1、Caspase-1、GSDMD 蛋白的表达水平。
大鼠肝缺血再灌注损伤模型评价方法综述

大鼠肝缺血再灌注损伤模型评价方法综述摘要:基于肝缺血再灌注损伤相关研究,综述了成功制作大鼠肝缺血再灌注损伤模型后大鼠肝脏微循环、病理形态学等方面的变化。
探讨大鼠肝缺血再灌注损伤模型制作成功与否的评价方法,简要归纳分析了血清学评价、病理形态学观察等模型评价方法,提出了评价大鼠肝缺血再灌注损伤模型的适宜方法,为肝缺血再灌注损伤相关研究提供参考。
关键词:肝脏;缺血再灌注损伤;模型;评价肝脏缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI)是指肝脏缺血一段时间,重新灌注血液后,肝组织功能和结构损伤反而加重的一种临床综合征,是引起肝切除、肝移植、休克后相关并发症的主要原因之一。
由于肝缺血再灌注损伤发生机制复杂,至今尚未完全阐明[1]。
目前研究集中在大鼠实验,因此制作一种稳定可靠的HIRI动物模型以研究其发生发展、预防及治疗具有重要意义[2]。
实验模型的成功制作是实验研究的基础和关键,对动物模型制作的评价显得尤为重要。
本文就大鼠HIRI模型制作的评价方法做一综述。
1.血清学评价1.大鼠血清中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)肝细胞中的酶在肝细胞损伤时可释放入血,测定其血清活性或含量可反映肝细胞损伤程度。
其中,ALT、AST为国外内学者采用最多的血清学指标[3-20],分别存在于肝细胞质和线粒体中,肝细胞膜受损时ALT、AST释放入血,血清水平升高,以反映肝组织损伤。
班跃松等[5]在进行HIRI造模时于大鼠肝缺血30min再灌注6h后,右颈总动脉抽血测定ALT活性。
结果显示与假手术组相比,H/I组大鼠血清ALT活性显著升高,提示造模成功。
尚有学者[6]经腹主动脉取血,测定血清ALT、AST活性并评价模型制作成功。
同样以ALT、AST作为判断指标,也有学者经静脉取血[9、10]提示造模成功。
ALT、AST的活性间接反映肝脏病理状态,说明HIRI造模是否成功。
