武汉大学版无机化学课后习题答案__17_碱金属和碱土金属_
《无机化学下》第四版习题答案

第13章 氢和稀有气体13-1 氢作为能源,其优点是?目前开发中的困难是什么?1、解:氢作为能源,具有以下特点:(1)原料来源于地球上储量丰富的水,因而资源不受限制;(2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境;(4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用13-2按室温和常压下的状态(气态 液态 固态)将下列化合物分类,哪一种固体可能是电的良导体?BaH 2;SiH 4;NH 3;AsH 3;PdH 0.9;HI13-3试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。
3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。
13-4试说明稀有气体的熔点 、沸点、密度等性质的变化趋势和原因?4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。
这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。
分子量越大,分子间相互作用力越大,熔点沸点越来越高。
密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。
13-5你会选择哪种稀有气体作为:(a )温度最低的液体冷冻剂;(b )电离能最低 安全的放电光源;(c )最廉价的惰性气氛。
13-6用价键理论和分子轨道理论解释HeH 、HeH +、He 2+ 粒子存在的可能性。
为什么氦没有双原子分子存在?13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型: (a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF7、 解: 4XeF 平面四边形 2XeF 直线形 3XeO 三角锥 XeO 直线形13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。
碱金属和碱土金属(课后基础习题)

碱金属和碱土金属1、碱土金属的熔点比碱金属的高,硬度比碱金属的大,试说明其原因。
2、为什么元素铍与其它非金属成键时,化学键带有较大的共价性,而其它碱土元素与非金属所成的键则带有较大的离子性?3、写出BaCl2和CaCl2的水溶液分别加入碳酸铵,接着加入醋酸、再加入铬酸钾时的反应式。
4、在碱金属中Li的电极电势最低,但Li的金属活泼性却最弱。
如何解释?5、金属Na的金属活泼性低于K、Rb、Cs,但却可用金属Na在高温下还原K、Rb、Cs的氯化物制备K、Rb、Cs单质。
为什么?6、简要说明Li+、Na+、K+、Mg2+、Ca2+、Ba2+常见的难溶盐有哪些?7、一固体混合物可能含有MgCO3、Na2SO4、Ba(NO3)2、AgNO3、CuSO4。
混合物投入水中得到无色溶液和白色沉淀,将溶液进行焰色试验,火焰呈黄色,沉淀可溶于稀盐酸并放出气体。
试判断哪些物质肯定存在,哪些物质可能存在,哪些物质肯定不存在,并分析原因。
8、一白色粉末混合物,可能含有KCl、MgSO4、BaCl2、CaCO3。
根据下列实验结果确定其实际组成。
(1)混合物溶于水得无色溶液;(2)对溶液作焰色反应,通过蓝色钴玻璃可观察到紫色;(3)向溶液中加碱,生成白色沉淀。
10、简要回答下列问题:(1)在水中LiF的溶解度小于AgF,而LiI的溶解度大于AgI;(2)同周期的碱土金属比碱金属的熔点高、硬度大;(3)锂的标准电极电势比钠的低,但钠与水反应却比锂与水反应剧烈;(4)在水中的溶解度LiClO4>NaClO4>KClO4;(5)CsF的离子性极强,CsF但的熔点却较低;(6)过氧化钠常用作制氧剂。
11、完成并配平有关的化学反应方程式。
(1)在液氨中金属钠与过量的氧气反应;(2)碳酸氢钙加热分解;(3)金属钠与亚硝酸钠反应;(4)超氧化钾投入水中;(5)氮化镁投入水中;(6)六水合氯化镁加热分解;(7)氢化钠投入水中;(8)金属镁还原四氯化钛;(9)氯化锂溶液中滴加磷酸氢二钠溶液;(10)金属铍溶于烧碱溶液。
无机化学教学资料——碱金属与碱土金属练习题

碱金属与碱土金属练习题1、在下列性质中,碱金属比碱土金属高(或大)的是( ) A:熔点 B:沸点C:硬度 D:半径2、下列性质中,碱金属和碱土金属都不具有的是( ) A:与水剧烈反应 B:与酸反应C:与碱反应 D:与强还原剂反应3、下列原子中哪一种原子第一电离势最大( )A:Na B:LiC:Be D:Mg4、碱土金属与碱金属相比较,碱土金属比相邻的碱金属多一个电子,即增加了一个单位的核电荷,所以( )A:碱土金属原子半径比相邻的碱金属大些B:碱土金属的电离能比相邻的碱金属大C:较易失去第一个电子D:比碱金属更活泼5、下列金属单质表现两性的是( )A:Li B:MgC:Ba D:Be 6、下列四种氢氧化物中溶解度最小的是( )A:LiOH B:Mg(OH)2C:Be(OH)2 D:Ba(OH)27、在NaOH溶液中通入CO2制备Na2CO3,以下各种情况中,效果最好的是( )A:热的浓NaOH溶液 B:热的稀NaOH溶液C:冷的浓NaOH溶液 D.:冷的稀NaOH溶液8、下列物质的硫酸盐在水中溶解度最小的是( )A:MgSO4 B:CaSO4C:SrSO4 D:BaSO49、下列物质热分解温度最高的是( )A. MgCOB. CaCOC. SrCOD. BaCO10、锂和镁的哪种盐溶于水( )A. 氟化物B. 碳酸盐C. 磷酸盐D. 氯化物11、碱金属,碱土金属氢氧化物中显示两性的是( )A. Mg(OH)2B. Be(OH)2C. Sr(OH)2D. LiOH12以下四种氢氧化物中碱性最强的是( )A. Ba(OH)2B. CsOHC. NaOHD. KOH13、ⅡA族金属的硫酸盐,硝酸盐的热稳定性随着原子半径的增大而( )A. 逐渐增大B. 逐渐减小C. 无法推断D. 变化不大14、"因为周期表中处于对角线位置的元素都符合对角线规则,所以锂和镁的所有性质都相同"此说法( )A. 因对果对B. 因对果错C. 因错果对D. 因错果错15、以下关于ⅠA,ⅡA族元素通性的叙述错误的是( )A、与同周期其它元素相比,碱金属原子体积大,原子间引力小,所以它们的熔沸点低,硬度小。
武汉大学版无机化学课后习题答案(第三版)(下册)

16.完成并配平下列反应式:(1)H2S+H2O2→(2)H2S+Br2→(3)H2S+I2→(4)H2S+O2→(5)H2S+ClO-+H+→3(6)Na2S+Na2SO3+H+→(7)Na2S2O3+I2→(8)Na2(9)SO2(10)H2(11)Na(12)KO(13)(14)K2(15)H2答:(1)H(2)H2H(1(2(3(4(5(6(7(8(9)2Na2O2+2CO2=2Na2CO3+O2(10)2KO2+2H2O=2KOH+O2+H2O2(11)4Fe(OH)2+O2+2H2O=4Fe(OH)3(12)5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+(13)H2SeO3+H2O2=H2SeO4+H2O17.在标准状况下,50cm3含有O3的氧气,若其中所含O3完全分解后,体积增加到52cm3。
如将分解前的混合气体通入KI溶液中,能析出多少克碘?分解前的混合气体中O3的体积分数是多少?解:5.68mg,8.1%溶液退色,求碘溶液的浓度?18.每升含12.41克Na2S2O3·5H2O的溶液35.00cm3,恰好使50.00cm3的I-3解:I 3-+2S 2O 32-=S 4O 62-+3I -1.75×10-2mol/L19.下述反应在298K 时的△H θm 为284.5kJ ·mol -13O 22O 3已知此反应平衡常数为10-54,试计算该反应的△G θm 和△S θm 。
解:307.97kJ/mol,-78.76k -1.J.mol -120.利用电极电势解释在H 2O 2中加入少量Mn 2+,可以促进H 2O 2分解反应的原因。
答:θϕMnOH 2O 2H 2O 2H 2O 2H 2O 2第十四章1. 用答:2(1(2答:(1)N P 原子半径很大,而使P 原子间的p 轨道重叠很小,不能形成多重键。
P-P 单键键能很小,很容易断开。
第17章碱金属、碱土金属_无机化学

(2) IIA盐类难溶居多,常见盐类除氯化物、硝酸
盐外, 其他难溶,如MCO3、MC2O4、M3(PO4)2、 MSO4、 MCrO4
(3) 离子型盐类溶解度的定性判断标准
巴素洛规则:阴阳离子电荷绝对值相同, 阴阳离子半径 较为接近则难溶,否则,易溶。
对应阳离子的半径小极化力较大,在水溶液中极 易同水分子结合形成水合离子,这种强烈的倾向能释 放出较大的水合能,总效应超过了需要激发时需补偿 的较高电离能和升华热等能量变化,使锂在水溶液中 的还原能力大大提高,电极电势显著下降;
17 - 2 碱金属和碱土金属单质
一、物理性质
IA
IIA
这些金属单质都具有银白色
第 17 章 碱金属和碱土金属
17 - 1 碱金属和碱土金属的通性 17 - 2 碱金属和碱土金属的单质 17 - 3 碱金属和碱土金属的化合物 17 - 4 离子晶体盐类的溶解性
17 - 1 碱金属和碱土金属的通性
金属性强; 多形成离子键 Li, Be共价倾向显著
+1
+2
ns1
ns2
锂的特殊性:
钾的沸点(766 ºC)比钠的(890 ºC)低,当反应体系的温 度控制在两沸点之间,使金属钾变成气态,金属钠和KCl 、NaCl 仍保持在液态,钾由液态变成气态,熵值大为增 加,反应的 TΔrSm 项变大,有利于ΔrGm变成负值使反应 向右进行。
同时,钾为蒸气状态,设法使其不断离开反应体系,
让体系中其分压始终保持在较小的数值,有利于反应向右
碱金属和碱土金属都有很强的还原性,与许多非金 属属单质直接反应生成离子型化合物。在绝大多数化合物 中,它们以阳离子形式存在。
碱金属和碱土金属

上页 下页 退出
小结:
ⅠA碱金属: S区 Li, Na, K, Rb, Cs, Fr ⅡA碱土金属: Be, Mg, Ca, Sr, Ba, Ra 碱金属和碱土金属原子的最外层电子排布分别 为: ns1和ns2
它们的次外层具有稀有气体原子式的稳定的电
子层结构, 对核电荷 的屏蔽作用较大,所以碱金属 元素的 I1 在同一周期中为最低。
(kg· ) cm
ⅠA 密度 -3
Li(锂) Na(钠) K(钾) Rb(铷) Cs(铯) 0.53 0.97 0.86 1.53 1.88
电负性 1.0 0.9 0.8 0.7 失去电子的倾向大,受到光照射时, 是最轻的金属元素 0.8 金属性 金属性递增 金属表面的电子易逸出,可制造光电
管,由铯光电管制成的自动报警装置, 碱金属和碱土金属的密度小,属轻金属 ∨ 可报告远处火警;制成的天文仪器可 ⅡA Be(铍) Mg(镁) Ca(钙) Sr(锶) Ba(钡) 密度-3 1.85 1.74 1.54 2.6 根据星光转变的电流大小测出太空中 3.51 (kg· ) cm 金属性 星体的亮度,推算星球与地球的距离。 电负性 1.0 0.9 0.8 0.8 0.7 金属性递增
上页 下页 退出
(kg· ) cm
ⅠA 密度 -3
1-1 碱金属和碱土金属的基本性质
Li(锂) Na(钠) K(钾) Rb(铷) Cs(铯) 0.53 0.97 0.86 1.53 1.88
电负性 1.0 0.9 0.8 0.8 0.7 氧化数 +1 +1 +1 +1 +1 E (M+/M) -3.04 -2.713 -2.924 (-2.98) (-3.026) (V) 氧化数与族号一致。 *E (Li+)反常,是由于Li的半径较小,易与 ⅡA Be(铍) Mg(镁) Ca(钙) Sr(锶) Ba(钡) 常见的化合物以离子型为主。由于Li+、 水分子结合生成水合离子放出较多能量所致3.51 密度-3 1.85 1.74 1.54 2.6 (kg· 2+半径小,其化合物具有一定共价性。 cm ) Be 电负性 1.0 0.9 0.8 0.8 0.7 氧化数 +2 +2 +2 +2 +2 E (M+/M) -1.99 -2.356 -2.84 -2.89 -2.92
无机化学第十章碱金属和碱土金属解析

S3Y“9c 4ZTⅡ碱0ri 4NA”V1b中与4MC2的ro“M4T钙土3cnF、4RF”r4ue、锶族4RC5hoR、元4PNa6钡di素是C4A氧7之ug放化4CZ间8nd射物G,4In9a性性所G5S0ne质元以A5S1bs介素把5TS2ee于B5I3r
Kr 54
Xe
6
55 Cs
56 Ba
密度/(kg·cm-3) 0.53 0.97 0.86 1.53 1.88
是最轻的元素 Ⅱ电金 管 可A负碱属(报性金失由表告属去铯B面远e和电光(铍1的处碱子电.0)电 火土的管M子警金倾制g易)0(属向成;镁.9金金制逸)的大的∨属属成出C密,自性性受a的,0度动(钙.到8天可小报)光文制,警S金照仪r造0属装(属锶.射器8光轻置性)时可电金,B递,a属0增(.钡7 )
ⅡA Be Mg Ca Sr Ba Ra
铍镁钙锶钡镭
无机化学多媒体电子教案
第结十束章 碱金属和碱土金属元素
第一节 结束
无机化学多媒体电子教案
第第十二章节s碱区金元属素和概述碱土金属元素
第二节 碱金属和 碱土金属的性质
10-2 碱金属和碱土金属的性质
ⅠA
原子序数 价电子构型 金属半径 pm
熔点 ℃
电负性 1.0 0.9 0.8 0.8 0.7
氧化数 +1 +1 +1 +1 +1
E (VM氧+/化M)数-与3.0族4 数-一2.7致13,-2.924 (-2.98) (-3.026) 密Ⅱ与度A水/由(Ek分g于·(cLm子Li-B3+结)i/e+1L、(常.合铍i8)5反B见生) e常的成2M+半,1水g化.(径7是镁合4合由小)离物于,C子1以aL.放(5i钙离4的出)半子较S径型多r2(.较锶6为能小)量主,所Ba易3致(.钡51)
武汉大学版无机化学课后习题答案__17_碱金属和碱土金属_

第十七章 碱金属和碱土金属1. 试根据碱金属和碱土金属得电子层构型说明它们化学活泼性得递变规律。
答:电子层数从上到下逐渐增多,核对最外层电子的引力逐渐减弱,因此,化学活泼性从上到下越来越强。
2. 试比较锂和钾;锂和镁得化学性质又哪些相似点和区别。
答:氢氧化钾可溶,而氢氧化锂微溶。
锂和镁具有对角线规律的相似性。
3. 金属钠是强还原剂,试写出它与下列物质得化学反应方程式:H 2O, NH 3, C 2H 5OH, Na 2O 2, NaOH, NaNO 2, MgO, TiCl 4答:2Na+2H 2O=2NaOH+H 22Na+2C 2H 5OH=2C 2H 5ONa+H 2Na+MgO=Na 2O+Mg4Na+TiCl 4=Ti+4NaCl2Na+2NH 3=2NaNH 2+H 22Na+Na 2O 2=2Na 2O4. 写出过氧化钠和下列物质的反应式:NaCrO 2, CO 2, H 2O, H 2SO 4(稀)答:2Na 2O 2+2CO 2=2Na 2CO 3+O 23Na 2O 2+2NaCrO 2+2H 2O=2Na 2CrO 4+4NaOH5. 写出氢氧化钠和氢氧化钙的主要化学性质和用途。
答:(1)同两性金属反应;(2)同非金属硼、硅反应;(3)同卤素等非金属时,非金属发生歧化;(4)能与酸反应进行中和反应,生成盐和水;(5)与酸性氧化物反应生成盐和水。
氢氧化钠的用途是常用于矿物原料和硅酸盐试样的分解。
氢氧化钙的用途是在工业上往往是使用它的悬浮液,即石灰乳。
6. 写出以食盐为原料制备金属钠、氢氧化钠、过氧化钠、碳酸钠的过程,并写出它们的化学反应方程式。
答:OH CO Na CO NaOH O Na O Na Cl H NaOH O H NaCl Cl Na NaCl 232222222222222222+→+−−→−+↑+↑+−−→−+↑+−−→−点燃电解电解7. 碱土金属的熔点比碱金属的高,硬度比碱金属的大,试说明其原因。
无机化学-碱金属与碱土金属元素-盐类化合物
Байду номын сангаас
1-1或2-2型 1-2或2-1型 1-3或3-1型 2-3或3-2型
△Gøs界线kJ•mol-1 22.8
30.8
38.5
45.6
3
(2) 半定量规则:
晶格能
△sG
MX(s) M+(aq) + X- (aq)
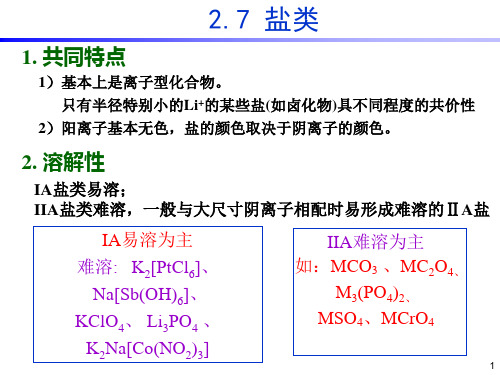
2.7 盐类
1. 共同特点
1)基本上是离子型化合物。 只有半径特别小的Li+的某些盐(如卤化物)具不同程度的共价性
2)阳离子基本无色,盐的颜色取决于阴离子的颜色。
2. 溶解性
IA盐类易溶; IIA盐类难溶,一般与大尺寸阴离子相配时易形成难溶的ⅡA盐
IA易溶为主
难溶: K2[PtCl6]、 Na[Sb(OH)6]、
2
离子晶体盐类溶解性的判断标准
(1) 溶解自由能变: MX(s) = M+(aq) + X- (aq) △sG
以溶解度0.01 mol L-1作为易溶和难溶的“界线”
MX(s) = Mn+(aq) + Xn-(aq) (n=1或2) KSP= [Mn+][Xn-] = (0.01)2 = 1×10-4 则:△Gøs = -RTlnKSP= 22.8 kJ mol-1
法。其基本原理: 先用NH3将食盐水饱和, 然后通入CO2,溶解
度较小的NaHCO3析出:
< 15 oC, 析出
NH3 + NaCl + H2O + CO2 NaHCO3 + NH4Cl
CaCO3 CaO + CO2 NH4Cl + CaO CaCl2 + NH3 + H2O
大学无机化学第18章 碱金属碱土金属习题解答

第18章碱金属碱土金属习题解答1.为什么不使用电解法制备金属钾?金属钾比金属钠活泼,但为什么可以用金属钠与KCl反应制备金属钾?答:工业上制备钾不能采用电解法,因为K容易溶在熔融的氯化物中,不易收集。
同时,在操作温度下钾迅速汽化可能发生危险,甚至形成超氧化钾导致发生爆炸反应。
工业上采用热还原法用金属钠来还原其KCl,是因为钾熔沸点低于钠的特点。
2.碱金属和碱土金属中,符合对角线规则的有哪些元素?性质有何特殊性?答:符合对角线规则的共有三对元素:锂与镁,铍与铝,硼与硅。
第一对都属于s区元素。
它们的相似性体现在:1)在充足氧气中燃烧只形成正常氧化物,不形成过氧化物2)氢氧化物热分解得到氧化物3)碳酸盐均不稳定,分解产生相应当氧化物和二氧化碳4)某些盐类如氟化物、碳酸盐。
磷酸盐均难溶于水5)氧化物共价性较强,能溶于有机溶剂6)离子水合能力较强3.如何保存金属钠?如何保存金属锂?答:金属钠保存在煤油中,金属锂保存在石蜡中。
4.OE(Na+/Na),为什么锂与水反应没有钠与水反应激烈?E(Li+/Li)>O答:锂的熔点比钠高,反应时放出的热量不足以使锂熔化,因此固态锂与水接触不如液态的钠;同时,反应产物LiOH溶解度较小,覆盖在锂的表面,阻碍了反应的进一步进行。
所以,锂与水反应没有钠与水反应激烈。
5.NaOH溶液中常混有Na2CO3,如何检验?如何制备不含Na2CO3的NaOH溶液?答:滴加稀盐酸,如果产生气泡,则认为其中含有Na2CO3。
为保证溶液不含有Na2CO3,可先配制饱和的NaOH溶液,Na2CO3在饱和的NaOH溶液中溶解度极小而析出。
过滤后用煮沸过的水稀释至所需浓度即可。
6.工业上如何制备金属钠?答:工业上电解法制备金属钠,以NaCl和CaCl2的混合物为原料,其中CaCl2起助溶剂的作用,使盐的熔点降低。
这样不仅可以节约电能,还可以有助于电解产物Na的聚集,防止其挥发。
另一方面,在产品中也会混杂部分Ca,可以利用它们熔点不同,用过滤方法提纯。
无机化学(下)_湖南大学中国大学mooc课后章节答案期末考试题库2023年

无机化学(下)_湖南大学中国大学mooc课后章节答案期末考试题库2023年1.碱金属和碱土金属元素的电离能都是自上而下递减,金属性依次增强,它们的水合离子与单质金属所成电对的电极电势也是自上而下依次减小参考答案:错误2.在 FeCl3 与 KSCN 的混合溶液中加入过量 NaF ,其现象是参考答案:变为无色3.在下列条件下,KMnO4 发生反应时产物中没有气体的是参考答案:在酸性条件下与 H2S 反应4.五价态的钒离子在 pH < 1 的溶液中存在的主要形式是参考答案:VO2+5.和相邻原子相比,Eu、Yb的原子半径为何突然增大呈现明显的“双峰效应”?参考答案:Eu、Yb倾向于分别保持4f 7 、4f 14的半满、全满结构6.H3BO3是一元弱酸,它的分子中三个氢原子只能电离出其中的一个。
参考答案:错误7.从矿石中湿法提取金的试液是参考答案:NaCN8.下列物质属于Lewis 酸的是参考答案:BF3_H3BO39.在下列氢氧化物中,不能稳定存在的是参考答案:Tl (OH)310.BF3与NH3化合是它们之间形成参考答案:配位键11.在铝盐溶液中加入 Na2CO3溶液,主要生成物为参考答案:Al(OH)3 ,CO212.下列含氧酸中属于三元酸的是参考答案:H3AsO413.用于配制潜水用的人造空气的稀有气体是参考答案:He14.下述含有非金属“X”的酸中,电离常数最大的是参考答案:HXO415.均不溶于稀酸,但都可溶于浓酸中的一组硫化物是参考答案:Bi2S3,PbS16.下述有关银的性质的正确论述是参考答案:从氢碘酸中置换出氢17.卤化氢的热稳定性从上到下减弱,其原因在于参考答案:键能减弱18.金刚石硬度最大,而热力学稳定性却小于石墨。
参考答案:正确19.氢氟酸最好储放在参考答案:聚乙烯瓶20.(CN)2是拟卤素,下列反应中与卤素无相似之处的是参考答案:(CN)2 + 2 O2 = 2 CO2 + N221.氦是最难液化的气体参考答案:正确22.石墨能够导电的原因是参考答案:石墨晶体的层内存在大π键23.在下列盐中,能与碳酸钠溶液作用,生成沉淀,而且沉淀又能溶于氢氧化钠溶液的是参考答案:AlCl324.配制 SnCl2溶液时,必须加入参考答案:盐酸25.“人造小太阳”是由氪制成的一种电光源。
无机化学第八章主族金属元素(一)碱金属和碱土金属

第八章 主族金属元素(一)碱金属和碱土金属 4.农副产品 某些农副产品也可以用来提取无机物,虽然 产量不多,但可以因地制宜,综合利用。 例如: 从向日葵壳、棉子壳、桐子壳、甜菜制酒后 的酒糟、洗羊毛的废水中提取钾盐;从海带中提 取碘;从兽骨中提取磷酸氢钙等。
第八章 主族金属元素(一)碱金属和碱土金属 5.工业废料 工业生产中排出的废水、废气和废渣(称“三 废”),是污染环境的根源,但含有大量的可用之物。 如果与三废治理相结合,可以化害为利,变废为宝。 例如: 用硫酸厂的含SO2废气制NH4HSO3,用电镀厂 的含Cr(Ⅵ)废水制Cr(Ⅲ)盐,用水泥厂的窑灰制钾 盐等。
第八章 主族金属元素(一)碱金属和碱土金属
第二节 碱
金
属
碱金属元素概述 碱金属: 锂、钠、钾、铷、铯、钫。钫具有放射性它们氧 化物的水溶液显碱性。 属于ⅠA族元素原子的价电子层构型为:ns1在周 期表中属于:s区元素。
第八章 主族金属元素(一)碱金属和碱土金属 碱金属的通性 是银白色的柔软、易熔轻金属在同周期元素中电离 能最低,很易失去,表现出强烈的金属性。它们与氧、 硫、卤素以及其他非金属都能剧烈反应,并能从许多金 属化合物中置换出金属。 碱金属的焰色反应 在火焰中加热,各具特征的焰色用来鉴定 。
→金属单质
第八章 主族金属元素(一)碱金属和碱土金属
2.天然含盐水 天然含盐水包括海水、盐湖水、地下卤水和气井水等。 采用有效的富集和特殊的提取无机盐。 地球表面的大气层是游离N2、O2 和稀有气体的大本 营,可通过液态空气分馏制取它们的单质。
3.大气 地球表面的大气层是游离钠,氧气和稀有气体的大本 营,可通过液态空气分馏制取它们的单质。
第八章 主族金属元素(一)碱金属和碱土金属
碱金属与碱土金属总结

【金属单质】Li Na K Rb CsBe Mg Ca Sr Ba1、物理性质①、共性:碱金属与碱土金属的单质都具有银白色的金属光泽,具有良好的导电性和延展性。
②、特性:碱金属a、熔点较低除Li外都在100℃以下(Cs熔点最低放手上就融化)b、沸点熔点的温度间距较大,沸点一般比熔点高700℃以上1c、较软莫氏硬度都小于1,可以用刀子切割d、.密度都娇小属于轻金属碱土金属有2个电子可以参与成键,因而金属键比碱金属的强,碱土金属的熔沸点、硬度、密度都比碱金属高得多。
2、化学性质①、共性:a、碱金属和碱土金属都是非常活泼的金属元素,同族从Li到Cs和从Be到Ba活泼性依次增强。
b、.都有很强的还原性,与许多非金属单质直接反应生成离子型化合物。
在绝大多数化合物中,它们以正离子形式存在。
②、与H2O反应碱金属及Ca Sr Ba同水反应生产氢氧化物和氢气如:2Na+2H2O=2NaOH+H22Ca+2H2O=Ca(OH)2+H2(注:a、Li Ca Sr Ba与水反应较平稳,因为它们的熔点较高,不易融化,与水反应不激烈;另一方面,由于它们的氢氧化物溶解度小,生成的氢氧化物覆盖在金属表面阻碍金属与水接触,从而减缓反应。
b、Be Mg的金属表面可以形成致密的氧化物保护膜,常温下它们对水是稳定的。
c、.其他碱金属与水反应非常剧烈,量大时会发生爆炸。
这些碱金属的熔点很低,与水反应放出的热恋是金属熔化为液态,跟有利于反应的进行;同时它们的氢氧化物溶解度很大,不会对反应起阻碍作用。
)③、与H2反应碱金属及Ca Sr Ba均可直接与H2作用,生成金属氢化物如:H2+Ca=CaH2(423-573K条件下)产物氢化钙是很强的还原剂用途:氢气发生剂、还原剂、干燥剂及还原氧化物金属④、与液氨碱金属及Ca Sr Ba均可溶于液氨中生成蓝色的导电溶液,高溶液中含有金属离子和溶剂化的只有电子,具有极强的还原能力。
3Na+2NH3(l)=Na+(NH3)+e-(NH3)⑤、制备稀有金属或贵金属由于碱金属和一些碱土金属单质都与水激烈反应,所以它们不能在水溶液中做还原剂使用。
无机化学吉大武大版_碱金属和碱土金属(与“金属”相关文档共77张)

MgO + C
CO + Mg
③ 同卤素反应,发生岐化反应:
Be2+极化力强,它的一些化合物具有较大的共价性
1173K-1473K
—安装在笔记本电脑中的锂离子电池是怎样工作的?
热还原法中常用碳或碳化物作还原剂,从金属氧化物或碳酸盐中还原出金属。
2. 单质的制备 尤其 MOH 易溶于水和醇中。
氯化物为路易斯酸BeCl2: 低温(BeCl2)2存在;AlCl3:(AlCl3)2存在。
Cl
Cl
Cl
Cl
Cl Be
Be Cl
Al
Al
Cl
Cl
Cl
Cl
第8页,共77页。
(5)其它与M+(IA)M2+(IIA)有相似性的离子:
• NH4+ — K+相似:如溶解度与晶体结构相似。 (148pm 132pm)
Li+ 红色
Ca2+ 橙红色
Na+ 黄色
Sr2+ 洋红色
K+ 、Rb+、Cs+紫色 Ba2+ 绿色
第19页,共77页。
Li
Na
K
图 Cpp-262
焰色反应
Ca
Sr
第20页,共77页。
Ba
与液氨的作用
2M 23 N ( ( l s ) H ) 2 M 22 N H 2 ( H g
蓝色溶液: 氨合电子
有金属光泽
Gc2-705-18.9
密度小
图片
硬度小:
熔点低
导电、导热性好
s区单质的熔点变化
无机化学第三版课后习题答案(武汉大学版) 很全面哦

2.2
2.0
0.0
0.2
0.4
0.6
0.8
1.0
1.2
P (105pa)
解
可得出一氯甲烷的相对分子质量是 50.495
12.(1)用理想气体状态方程式证明阿佛加德罗定律;
(2)用表示摩尔分数,证明xi = ν i V总
(3)证明
μ2
3kT
=
M
证明:(1)PV=nRT
当 p 和 T 一定时,气体的 V 和 n 成正比
同?为什么愚人金有金的光泽?为什么 ZnS(闪锌矿)呈白色﹑ HgS(朱砂)呈红色而 PbS(方铅矿) 呈黑色?天然的金刚石为什么有蓝﹑红﹑黄﹑绿色而并非全呈无色?请阅读:拿骚.颜色的物理和化学. 科学出版社,1991,168~ 182(注:“费密能”的定义在 166 页上)。请通过阅读测试一下自己的知识和 能力,以调整自己的学习方法预定目标与学习计划安排。最好阅读后写一篇小文(主题任选)。 12、解:金属键的另一种理论是能带理论。能带理论是分子轨道理论的扩展,要点有: (1)能带中的分子轨道在能量上是连续的。 (2)按能带填充电子的情况不同,可把能带分为满带、空带和导带三类。 (3)能带和能带之间存在能量的间隙,简称带隙,又称禁带宽度。 (4)能带理论能够对金属导电进行解释。 (5)能带理论是一种既能解释导体,又能解释半导体和绝缘体性质的理论。 (6)由此可见,按照能带理论,带隙的大小对固体物质的性质至关重要。 3-13 二层﹑三层为一周期的金属原子二维密置层的三维垛积模型只是最简单的当然也就是最基本的金 属堆积模型。利用以下符号体系可以判断四层﹑五层为一周期的密置层垛积模型是二层垛积和三层垛积 的混合:当指定层上下层的符号(A﹑B﹑C)相同时,该指定层用 h 表示,当指定层上下层的符号不相 同时,该指定层用 c 表示。用此符号体系考察二层垛积,得到…hhhhhh …,可称为 垛积,用以考察 三层垛积时,得到…cccccc…,可称为 c 堆积。请问:四层﹑五层为一周期的垛积属于什么垛积型?为 什么说它们是二层垛积和三层垛积的混合?(注: h 是六方——hexagonal ——的第一个字母;c 是 立方——cubic ——的第一个字母。) 13﹑解:四面垛积是…hchchch…,即 hc 垛积型,说明六方垛积和立方垛积各占 50%;五 层垛积是…hhccchhccchhccc…,即 hhccc 垛积型,说明六方垛积和立方垛积分别占 2/5 和 3/5。 3-14 温度足够高时,某些合金晶体中的不同原子将变的不可区分,Cu3Au 晶体中各原子坐标上铜原子和 金原子可以随机地出现。问:此时,该合金晶胞是什么晶胞? 14﹑解:面心立方晶胞。 3-15 温度升得足够高时,会使某些分子晶体中原有一定取向的分子或者分子中的某些基团发生自由旋 转。假设干冰晶体中的二氧化碳分子能够无限制地以碳原子为中心自由旋转,问:原先的素立方晶胞将 转化为什么晶胞? 15﹑解:面心立方晶胞。 3-16 试在金属密堆积的面心立方晶胞的透视图上画出一个二维密堆积层,数一数,在该密堆积层上每个 原子周围有几个原子,在该原子的上下层又分别有几个原子?(参考 3-54) 16﹑解:6;3。参考图解如图 3-53。 3-17 找一找,在六方最密堆积的晶胞里,四面体空隙和八面体空隙在哪里?已知纤维锌矿(ZnS)的堆 积填隙模型为硫离子作六方最密堆积,锌离子作四面体填隙,请根据以上信息画出其晶胞。 17﹑解:见:周公度.结构和物性.高等教育出版社,1993,274~293 3-18 有一种典型离子晶体结构叫做ReO3 型,立方晶胞,Re6+ 的坐标为 0,0,0;O2- 的坐标为 0,1/2, 0;1/2,0,0;0,0,1/2。请问:这种晶体结构中,铼的配位数为多少?氧离子构成什么多面体?如何 连接? 18﹑解:Re 的配位数为 6;八面体;全部以顶角相连。 3-19 实验测得金属钛为六方最密堆积结构,晶胞参数为 a=295.0,c=468.6pm ,试求钛的原子半径和密 度。 19、解:晶胞体积:V=abcsin120°=295.0×295.0×468.6×0.866×10-24= 3.53×10-16
武汉大学版无机化学课后习题答案(第三版)第17章d区元素

D区元素〔1〕1.钛的主要矿物是什么?简述从钛铁矿制取钛白得反响原理。
解:钛的主要矿物有钛铁矿FeTiO2反响原理:FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2OTiOSO4 + 2H2O =TiO2•H2O↓ + H2SO4TiO2•H2O = TiO2 + H2O2.解释TiCl3和[Ti(O2)OH(H2O)4]+ 有色得原因。
解:TiCl3显色是因为产生了电核跃迁,[Ti(O2)OH(H2O)4]+有色是因为O22-离子变形性较强,d—d跃迁所引起。
3.完成并配平以下反响方程式。
(1)Ti + HF →(2)TiO2 + H2SO4→(3)TiCl4 + H2O →(4)FeTiO3 + H2SO4→(5)TiO2 + BaCO3→(6)TiO2 + C + Cl2→解:(1) Ti + 5HF = H2TiF6 + 2H2↑(2)TiO2 + H2SO4 = TiOSO4 + H2O(3)TiCl4 + 2H2O = TiO2 + 4HCl(4)FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2O(5)TiO2+ BaCO3 = BaTiO3 + CO2↑(6)TiO2 + 2C + 2Cl2 = TiCl4+ 2CO↑4.完成以下反响(1)TiI4在真空中强热;(2)FeTiO3和碳得混合物在氯气中加热;(3)向含有TiCl-2得水溶液参加过量得氨;6(4) 向VCl 3的水溶液参加过量的氨;(5) 将VCl 2的固体加到HgCl 2水溶液中。
解:(1) TiI 4 = Ti + 2I 2(2) 2FeTiO 3 + 6C + 5Cl 2 = 2FeCl 3 + 2TiCl 4 + 6CO(3) TiCl 62- + NH 3 = [Ti(NH 3)6]4+ + 6Cl -(4) VCl 3 + Na 2SO 3 =(5) VCl 2 + HgCl 2=5. 根据以下实验写出有关的反响方程式:将一瓶TiCl 4翻开瓶塞时立即冒白烟。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十七章 碱金属和碱土金属
1. 试根据碱金属和碱土金属得电子层构型说明它们化学活泼性得递变规律。
答:电子层数从上到下逐渐增多,核对最外层电子的引力逐渐减弱,因此,化学活泼性从上到
下越来越强。
2. 试比较锂和钾;锂和镁得化学性质又哪些相似点和区别。
答:氢氧化钾可溶,而氢氧化锂微溶。
锂和镁具有对角线规律的相似性。
3. 金属钠是强还原剂,试写出它与下列物质得化学反应方程式:
H 2O, NH 3, C 2H 5OH, Na 2O 2, NaOH, NaNO 2, MgO, TiCl 4
答:2Na+2H 2O=2NaOH+H 2
2Na+2C 2H 5OH=2C 2H 5ONa+H 2
Na+MgO=Na 2O+Mg
4Na+TiCl 4=Ti+4NaCl
2Na+2NH 3=2NaNH 2+H 2
2Na+Na 2O 2=2Na 2O
4. 写出过氧化钠和下列物质的反应式:
NaCrO 2, CO 2, H 2O, H 2SO 4(稀)
答:2Na 2O 2+2CO 2=2Na 2CO 3+O 2
3Na 2O 2+2NaCrO 2+2H 2O=2Na 2CrO 4+4NaOH
5. 写出氢氧化钠和氢氧化钙的主要化学性质和用途。
答:(1)同两性金属反应;
(2)同非金属硼、硅反应;
(3)同卤素等非金属时,非金属发生歧化;
(4)能与酸反应进行中和反应,生成盐和水;
(5)与酸性氧化物反应生成盐和水。
氢氧化钠的用途是常用于矿物原料和硅酸盐试样的分解。
氢氧化钙的用途是在工业上往往是使用它的悬浮液,即石灰乳。
6. 写出以食盐为原料制备金属钠、氢氧化钠、过氧化钠、碳酸钠的过程,并写出它们的化
学反应方程式。
答:
O
H CO Na CO NaOH O Na O Na Cl H NaOH O H NaCl Cl Na NaCl 23222
2222222222222+→+−−→−+↑
+↑+−−→−+↑
+−−→−点燃电解电解
7. 碱土金属的熔点比碱金属的高,硬度比碱金属的大,试说明其原因。
答:碱土金属有两个价电子,碱金属只有一个价电子,碱土金属的金属键比相应的碱金属的
金属键强,所以,碱土金属的熔点,硬度均比相应的碱金属高。
8. 钙在空气中燃烧所得得产物和水反应放出大量得热,并能嗅到氨的气味。
试以化学反应
方程式表示这些反应。
答:3Ca+N 2=Ca 3N 2;Ca 3N 2+3H 2O=3Ca (OH )2+2NH 3↑
9. 为什么元素铍与其它非金属成键时,化学键带有较大的共价性,而其它碱土元素与非金
属所成的键则带有较大的离子性?
答:Be 的电负性较大(1.57),Be 2+的半径较小(约31pm ),使其极化能力很强,所以BeCl2
中Be-Cl 键以共价性为主,BeCl2为共价化合物。
而其他碱土金属的电负性较小但离子半径却比Be2+大的多,MgCl2,CaCl2中的键以离子性为主,化合物为离子化合物。
10. 利用镁和铍在性质上的哪些差异可以区分和分离Be(OH)2和Mg(OH)2;BeCO 3和
Mg CO 3; BeF 2和MgF 2?
答:利用Be (OH )2可溶于NaOH ,而Mg (OH )2却不溶,将两者分离。
BeCO 3受热不易分解,而MgCO 3受热易分解。
BeF 2可溶于水,而MgF 2不溶于水,将两者分离。
11. 写出重晶石为原料制备BaCl 2,BaCO 3,BaO,BaO 2的过程。
答:BaSO 4 + 4C == BaS + 4CO
BaSO 4 + 4CO == BaS + 4CO 2
BaS + 4H 2O == Ba(HS)2 + 4Ba(OH)2
Ba(HS)2 + CO 2 + H 2O == BaCO 3↓ + 2H 2S
BaCO 3 + 2HCl == BaCl 2 + CO 2 + H 2O
BaCO 3 △ BaO + CO 2
BaO + O 2 点燃
BaO 2
12. 写出BaCl 2 和CaCl 2的水溶液分别加入碳酸铵,接着加入醋酸、再加入铬酸钾时的
反应式。
答:
↑
+++↓−→−++↑
+++↓−→−+++↓=++↓=+2247223224722343324243324222222222222)(2)(CO O H KAc CaCrO HAc O Cr K CaCO CO O H KAc BaCrO HAc O Cr K BaCO Cl
NH CaCO CO NH CaCl Cl
NH BaCO CO NH BaCl
13. 设用两种途径得到NaCl (s ),用盖斯定律分别求算△f H θm NaCl(s),并作比较。
(温度 为
298K ) (1) Na(s)+ H 2O(l) −→−NaOH(s)+2
1H 2(g)
△r H θm =-140.89kJ ·mol -1
21H 2(g)+ 2
1Cl 2(g) −→− HCl(g) △r H θm =-92.31kJ ·mol -1
HCl(g)+NaOH(s) −→−NaCl(s)+H 2O(l)
△r H θm =-177.80kJ ·mol
-1 (2) 21H 2(g)+ 2
1Cl 2(g) −→− HCl(g) △r H θm =-92.31kJ ·mol -1
Na(s)+ HCl(g) −→−NaCl(s)+ 21H 2(g) △r H θm =-318.69kJ ·mol -1
答:因为H ∆为状态函数,所以两者的H ∆值相等。
均为 –411kJ/mol 。
