分析化学复习题模板
【精品】分析化学复习题.doc

第一章、绪论1.分析化学的主要任务是什么?在国民经济建设中有何作用?2.从学习和牛活实践中举出一列说明分析化学所起的作用?3.分析化学分类的依据是什么?如何分类?4.“分析化学”和“化学分析”在概念上有什么不同?5.进行分析化学有哪些步骤?6.分析工作应具备什么样的素质,才能胜任好本职工作?7.要学好分析化学,你有什么打算?■>定量分析中的误差及结果处理一、选择题1.下列叙述不正确的是()A.误差是医院真实值为标准的,偏差是以平均值为标准的。
实际工作获得的所谓“误差”, 实质上仍是偏差B.对某项测定来说,它的系统误差大小是可以测量的C.对偶然谋差來说,大小相近的正误差和负谋差出现的机会是均等的D.某测定的精密度愈好,则该测定的准确度愈好2.在滴定分析中,出现的下列情况,那种导致系统误差()A.试样未经充分混匀B.滴定管的读数读错C.滴定吋有滴液溅出D.袪码未经校准3.分析测定中的偶然误差,就统计规律来讲,其()A.数值固定不变B.止误差出现的概率大于负误差C.大误差出现的概率小,小无误差出现的概率大D.数值相等的正、负误差出现的概率均等4.分析测定中出现的下列情况,何种属于偶然-误差()A.滴定时所加的试剂中含有微量的被测物质B.某分析人员儿次读数读取同一滴定管的数值不一致C.某分析人员读取滴定管读数时总是偏高或偏低D.滴定时发现有少量的溶液溅出5.可川下列哪种方法减少分析测定中的偶然误差()A.进行对照试验B.进行空白试验C.进行仪器校准D.增加平行试验的次数6.有计算器算的2.236X101124一 1.036X0. 2000的结果为12.004471,按有效数值运算规则应将结果修约为()A. 12B.2. 0C. 12. 007.下列数据屮有效数字是四位的是()A. 0. 025B. 0. 0234C. 10. 030 &下列数据中包含两位有效位的是()A. PH二6. 5B. -5.3C. 10.09. PH=10. 20,有效数字的位数是()A.四位B.三位C.两位D. 12. 004 D. 40. 02 % D. 0. 02 D.不确定10.在秤量样品吋试样会吸收微量的水分,这属于() A.系统误差 B.偶然误差 C.过失误差 D.没有误差11・读取滴定管读数时,最后一位估计不准,这是() A.系统误差B.偶然误差C.过失误差D.没有误差12. 有四位同学测定同一试样,最后报告测定结果的平均偏差如下,其中正确的是() A. 0. 1285% B. 0. 1 %C. 0. 128%D. 0. 12850%13. 测得某水泥熟料屮的S03的含量,秤取试样量为2. 2g 下列的那份报告是合理的 ( ) A. 2. 085%B. 2.08%C. 2. 09 %D. 2. 1 %14分析硅酸盐样品中的SiO 》的含量,称取样品的质量为2.4650s 下曲的那份报告是合理 的() A. 62. 37% B. 62.3%C. 62.4%15.用25ml 的移液管移取的溶液的体积应记录为(A. 25mlB. 25. 0mlC. 25. 00ml16.下列表述不正确的是()A. 偏差是测定值与真实值之差B. 平均偏差常用來表示一组测定数据的精密度C. 平均偏差表示精密度的缺点是缩小了大误差的影响D. 平均偏差表示精密度的优点是比较简单的 17.下列衣述止确的是()A. 标准偏差能较好的反映测定数据的精密度B. 标准偏差表示单次测定的结果的相对偏差C. 变异系数即为相对平均偏差 I ).标准偏差又称变异系数1&某学牛测定铜合金中铜含量,得到以下数据:62.54% , 62.46% , 62. 50% , 62.48% , 62.52%。
完整版)分析化学考试题库有答案

完整版)分析化学考试题库有答案分析化学题库第一、二章:绪论、误差判断题:1.根据测定原理,分析化学可分为化学分析和仪器分析两大类。
(√)2.分析化学的任务包括定性分析、定量分析、结构分析和形态分析。
(×)3.用高锰酸钾法测定双氧水中过氧化氢的含量属于滴定分析。
(√)4.偶然误差是定量分析中误差的主要来源,它会影响分析结果的精密度。
(√)5.可疑值(或逸出值)必须被舍去。
(×)6.被分析的物质称为样品,与样品发生化学反应的物质称为试剂,以化学反应为基础的分析方法称为化学分析法。
(√)7.偏差是测量值与平均值之间的差异。
(×)8.绝对误差是测量值与真实值之间的差异。
(√)9.增加平行测定次数,可以减少系统误差。
(×)10.当偶然误差被消除后,分析结果的精密度越高,准确度越高。
(×)11.在滴定分析中,测定结果的精密度越高,其准确度也越高。
(×)12.相对平均偏差、样本标准偏差、总体标准偏差都可用来表示测定值的分散程度。
(×)13.增加测定次数可以提高分析结果的准确度。
(×)14.用20 mL 移液管移取 NaOH 溶液,体积数应记为 20.00 mL。
(×)15.根据测定原理,分析化学可分为化学分析和仪器分析两大类。
(√)16.用酸碱滴定法测定醋酸的含量属于化学分析。
(√)17.化学分析是分析化学的基础,仪器分析是分析化学发展的方向。
(√)18.在一定称量范围内,被称样品的质量越大,称量的相对误差就越小。
(√)19.滴定管的初读数必须为“0.00 mL”。
(×)20.测定 0.8 mL 样品溶液的含量,属于常量分析。
(×)21.测定值与真实值相接近的程度称为准确度。
(√)填空题:1.配制用的蒸馏水中含有少量被测组分,此情况属于系统误差。
2.用 50 mL 移液管移取 NaOH 溶液,体积数应记为 50.00 mL。
大学生分析化学复习资料

第一章绪论一.选择题1.试样用量为0.1 ~ 10 mg的分析称为--------- ( )(A) 常量分析(B) 半微量分析(C) 微量分析(D) 痕量分析2.试液体积在1 ~ 10 mL的分析称为--------------( )(A) 常量分析(B) 半微量分析(C) 微量分析(D) 痕量分析3.准确移取1.0 mg/mL铜的标准溶液2.50 mL,于容量瓶中稀释至500 mL, 则稀释后的溶液含铜(μg/mL)为-----------------------------------------( )(A) 0.5 (B) 2.5 (C) 5.0 (D) 254.每100 mL人体血浆中,平均含K+18.0mg和Cl-365 mg。
已知M(K+)= 39.1 g/mol, M(Cl-) =35.5 g/mol。
血浆的密度为1.0 g/mL。
则血浆中K+和Cl-的浓度为----------( )(A) 1.80 ×10-1和3.65 mol/L (B) 7.04×10-3和1.30×10-1 mol/L(C) 4.60×10-3和1.03×10-1 mol/L (D) 4.60×10-6和1.03×10-4 mol/L5.海水平均含1.08×103 μg/gNa+和270 μg/gSO42-, 海水平均密度为1.02g/mL。
已知A r(Na)=23.0, M r(SO42-)=96.1,则海水中pNa和pSO4分别为-------( )(A) 1.32 和2.54 (B) 2.96 和3.56 (C) 1.34 和2.56 (D) 4.32 和5.546.以下试剂能作为基准物的是----------( )(A) 分析纯CaO (B) 分析纯SnCl2·2H2O (C) 光谱纯三氧化二铁(D) 99.99%金属铜7.用邻苯二甲酸氢钾为基准物标定0.1 mol/L NaOH溶液,每份基准物的称取量宜为[M r(KHC8H8O4)=204.2] ---------------- ( )(A) 0.2 g左右(B) 0.2 g ~ 0.4 g (C) 0.4 g ~ 0.8 g (D) 0.8 g ~ 1.6 g8.在滴定分析中所用标准溶液浓度不宜过大,其原因是-----------------( )(A) 过量半滴造成误差大(B) 造成终点与化学计量点差值大,终点误差大(C)造成试样与标液的浪费(D) (A)、(C)兼有之(A) 0.16 (B) 0.32 (C) 0.08 (D) 0.649.今欲测定某含Fe、Cr、Si、Ni、Mn、Al等的矿样中的Cr和Ni, 用Na2O2熔融, 应采用的坩埚是------------------------------( )(A) 铂坩埚(B) 银坩埚(C) 铁坩埚(D) 石英坩埚10. 用HCl + HF分解试样宜选的坩埚是-----------------( )(A) 银坩埚(B) 瓷坩埚(C) 铂坩埚(D) 石英坩埚11.用NaOH熔融分解试样宜选的坩埚是---------------------( )(A) 铂坩埚(B) 瓷坩埚(C) 银坩埚(D) 石英坩埚12.今欲测定含Fe、Cr、Si、Ni、Mn、Al等的矿样中的Cr和Ni, 用Na2O2作熔剂, 熔融后以水提取熔块, 溶液的成分是---------------------( )(A) FeO33-、CrO42-、SiO32-、MnO4-和Ni2+(B) CrO42-、SiO32-、Ni2+、MnO4-和AlO2-(C) Cr2O72-、SiO32-、MnO4-和AlO2-(D) CrO42-、SiO32-、MnO4-和AlO2-13.欲以K2Cr2O7法测定赤铁矿中Fe2O3的含量,溶解试样一般宜用的溶剂( )(A) HCl (B) H2SO4(C) HNO3(D) HClO414.以下物质必须采用间接法配制标准溶液的是---------------( )(A) K2Cr2O7(B) Na2S2O3(C) Zn (D) H2C2O4·2H2O15.以下标准溶液可以用直接法配制的是-------------( )(A) KMnO4(B) NaOH (C) K2Cr2O7(D) FeSO416.配制以下标准溶液必须用间接法配制的是-----------------( )(A) NaCl (B) Na2C2O4(C) NaOH (D) Na2CO317.1:2 H2SO4溶液的物质的量浓度为--------------------( )(A) 6mol/L (B) 12mol/L (C) 24mol/L (D) 18mol/L二.填空题1.常量分析与半微量分析划分界限是:被测物质量分数高于________%为常量分析; 称取试样质量高于________g为常量分析。
分析化学期末考试复习题及参考答案-高起本

《分析化学》复习题一、填空题1、滴定管一次读数误差为±0.01 mL ,若滴定相对误差不大于±0.1%, 则滴定剂用量至少应为mL ,最好使体积在 mL 左右,以减小相对误差。
2、某学生分析氯化物中氯的含量,重复测定四次,结果如下:52.68%,53.17%,52.73%,52.67%。
用Q 检验法判断数据53.17%在置信度为90%时是否应当舍弃(已知Q 0.90,4=0.76),舍弃商Q 等于 ,结论是 (填舍弃或保留)。
3、莫尔法与佛尔哈德法的指示剂分别为 、 。
4、光度法测定某物质,若有干扰,应根据 和 原则选择波长。
5、NaOH 滴定HCl 时,浓度增大10倍,则滴定曲线突跃范围增大 个pH单位。
6、在一定条件下用Ce(SO 4)2标准溶液滴定相同浓度的Fe 2+溶液,已知)Ce /Ce (34++O 'ϕ=1.44V ,)Fe /Fe (23++O 'ϕ=0.68V , 则化学计量点时溶液电势为 V 。
7、在分光光度法中,以 为纵坐标,以 为横坐标,可得光吸收曲线。
浓度不同的同种溶液,其最大吸收波长 ,相应的吸光度大小 。
8、电位分析中,电位保持恒定的电极称为 电极,常用的有 电极和 电极。
9、高效液相色谱分析中,如果样品组分的分配比范围很宽,宜采用措施;在气相色谱分析中,如果样品组分的沸点范围很宽,宜采用措施,这些操作的目的都是为了改善分离效果。
10、在原子吸收法中,火焰原子化器与石墨炉原子化器相比较,后者测定的灵敏度更。
11、EDTA滴定中,介质pH越低,则αY(H)值越_ __,O'K越_ __,滴定的pM 突跃越_ __。
(填“大”、“小”)12、用普通吸光光度法测得标准溶液c1的透光率为20%,待测溶液透光率为12%,若以示差法测定,以标准溶液c1作参比,则待测溶液透光率为_ __,相当于将仪器标尺扩大_ __倍。
13、用KMnO4滴定H2C2O4溶液,第一滴KMnO4滴入后紫色褪去很慢,而随着滴定的进行反应越来越快,这是由于反应生成的有作用。
分析化学复习题及参考答案

8.碘量法测定可用直接和间接两种方式。直接法以 为标液,测定 物质。间接法以
和 为标液,测定 物质。
9.下列4次测定的结果为:27.37%、27.47%、27.43%、27.40%,相对平均偏差(d「)= 。标准偏差
(S)= °
分光光度法中用邻菲罗麻测定铁时,选择的参比溶液是 ()
A.蒸憎水B.试剂空白C.样品空白DБайду номын сангаас铁标准液
17.25.00 mL 0.4000mol/L H 3PO溶液和30.00mL 0.5000mol/L Na 3PO溶液混合,稀释至100mL,则溶液的
12的 沉淀。
3.当用0.01mol/L EDTA滴定浓度均为0.01mol/L的金属离子M和N时,若采用控制酸度方法,则准确滴
定M离子(△pM=0.2,TE<0.3%)应满足AlgK>。
4.某三元酸的电离常数分别是Ka1= 1X 10Ka2=1X 10%Ka3= 1x10-^-用NaOH标准溶液滴定时有
B. PH值越小,酸效应系数越大
C•酸效应系数越大,配位滴定曲线的PM突跃范围越大
D.酸效应曲线表示的是各金属离子能够准确滴定的最
13.高PH值
用硼砂(NazBG・10H.O式量381.4)标定0.1 mol・L,的HCI溶液,宜称取此基准物的重量为 ()
14-A.0.1〜0.2克B.0.8〜1.0克C.0.6〜0.8克D.0.4〜0.6克
(1)滴定管读数时,最后一位读数估计不准 。
(2)终点和化学计量点不符合 。
16.对于一元弱酸溶液,当pH=时,6(HA)=6 (HA) =0.5
(完整版)分析化学复习题及参考答案

分析化学复习题化学分析部分一、选择题1、实验室中常用于标定HCl溶液的基准物质是:A、NaOH;√B、硼砂;C、金属铜;D、邻苯二甲酸氢钾;E、NaCl2、铬黑T在溶液中存在下列平衡,它与金属离子形成络合物显红色, 使用该指示剂的酸度范围是:p K a2=6.3 p K a3=11.6H2In-HIn2-In3-紫红色蓝色橙色pH < 6 pH = 8~11 pH > 12A、pH < 6;B、pH > 12;√C、pH = 8~11;D、pH = 11~ 123、当TE%≤0.1%、△PM=0.2时,用EDTA准确滴定金属离子,要求lgCKˊMY值A、≥106;B≥108; C ≥8; √D、≥64、KMnO4滴定C2O42-时,反应速度由慢到快,这种现象称作:A、催化反应;√B、自动催化反应;C、诱导反应;D、副反应.5、如果氧化还原滴定,其化学计量点位于滴定突跃中点,则两电对的所转移的电子数n1与n2之间的关系为:√A、n1= n2B、n1> n2 C、n1 < n2 D、n1= 2 n26、佛尔哈德法测定Ag+时,应在硝酸的酸性条件下进行,若在中性或碱性溶液中滴定,则:A、AgCl沉淀不完全;B、Ag2CrO4 沉淀不易生成;C、AgCl 无法吸附指示剂√D、Fe3+会形成Fe(OH)3↓7、莫尔法所使用的滴定剂为:A、NH4SCN;B、NaCl;√C、AgNO3;D、EDTA。
8、沉淀的类型与聚集速度有关,影响聚集速度大小的主要相关因素是:A、物质的性质B、溶液的浓度C、过饱和度√D、相对过饱和度9、有色配合物的吸光度与下述因素无关的是:A、入射光的波长B、比色皿的厚度C、有色配合物的浓度√D、配合物稳定常数的大小10、在分光光度分析中,选择参比溶液的原则是:A、一般选蒸馏水B、一般选试剂溶液√C、根据加入试剂和被测试液的颜色性质选择D、一般选择褪色溶液。
分析化学复习题及答案

分析化学 自测试卷(二)一、填空题(每空1分,共23分)1.测定结果平均值之差叫 ,它是分析结果 的量度。
2.NaH 2PO 4是 的共轭酸,是 的共轭碱,其质子条件是 。
3.几个数据相加减,有效数字位数的保留应以几个数中 位数最少的数据为准,即 最大;几个数据相乘除,有效数字位数的保留应以几个数中 位数最少的数据为准,即 最大;4.莫尔法是以 为指示剂,以 标准溶液为滴定剂,于中性或弱碱性溶液中测定Cl -的方法。
5.配位滴定中能否准确滴定的判别式为 ,突跃范围的大小取决于和 。
6.若称量的%1.0±≤r E ,g E a 0002.0±=,则试样称量的最低量为 克;若滴定管读数误差%1.0±≤r E ,mL E a 02.0±=,则滴定时所消耗滴定剂的总体积最低量为 毫升;7. 酸碱滴定曲线,描述了滴定过程中溶液pH 变化的规律性。
滴定突跃的大小与和有关。
8.用KMnO4法测定滴定Ca2+时,采用滴定方式;测定MnO2含量时采用滴定方式。
9.用基准物Na2CO3标定HCl时,下列情况对结果将产生怎样的影响?(偏高,偏低,无影响)a、滴定速度太快,附在滴定管壁的HCl来不及流下来就读取滴定体积;b、滴定开始前,液面调节高于零点;c、称取Na2CO3时,少量Na2CO3撒在天平盘上;二、选择题:(每题1.5分,共30分)1.标定HCl的基准物质最好为:( )A KOHB 邻苯二甲酸氢钾C NaOHD 硼砂2. 在HAc的α-PH曲线图中,当αHAc= αAc- =0.5时,则A PH=PKaB PH<PKaC PH>PKaD PH=73.氧化还原指示剂的变色范围是:A pKIn±1B E′In±0.059/nC pKIn±0.059/nD E′In±14.下列有关沉淀溶解度的叙述,正确的是()A 同离子效应的影响,沉淀的溶解度增大;B 盐效应的影响,沉淀的溶解度增大;C 同一沉淀物,其晶体颗粒愈大溶解度愈大;D 沉淀反应中,杂质被保藏在沉淀内部引起的共沉淀现象叫“包夹”;5. 用0.10mol/L NaOH滴定0.10mol/L HCl,指示剂pK In=4.0,则终点误差为()A0.1% B0.2% C-0.2% D-0.1%6. 欲配制草酸钠溶液以标定0.04000mol.L-1溶液KMnO4,若使标定时两溶液消耗的体积相等,则C(Na2C2O4)为()A 0.04000mol.L-1B 0.1000mol.L-1C 0.05000mol.L-1 D0.08000mol.L-17. 已知0.1mol.L-1一元弱酸HA溶液的pH=3.0,则其0.1mol.L-1共轭碱pH是()A 11.0B 10.0C 9.0D 8.08.有两组分析数据,要比较它们的测量精密度有无显著性差异,应采用的方法是()A F检验法B t检验法C Q检验法D d4检验法9. 0.0023的有效数字是()位A 1B 2C 4D 510.空白实验的目的是:()A检查溶剂是否变质及反应条件是否正确 B 检查鉴定反应是否灵敏C鉴定溶剂中有无待测离子或干扰离子 D 检查反应条件是否符合要求11.在Pb2+、Bi3+的混合液中,用EDTA滴步Bi3+后, 继续滴定Pb2+,采用最简便的方法是()A 控制酸度法B 络合掩蔽法C 沉淀分离法D 溶剂萃取法12.下列试样适合莫尔法测定的是()A KSCNB NaCl+Na3PO4C NaCl+KBrD KI13.用K2Cr2O7标定Na2S2O3溶液的滴定方式属于()A 直接滴定B 间接滴定 C置换滴定 D 返滴定14.EDTA滴定法中所用的金属指示剂,要求它与被测金属离子形成的络合物的条件稳定常数K′MIN必须满足()A K′MI n >K′MYB K′MY /K′MI n≥102C K′MI n=K′MYD K′MI n≥10-815.用0.2mol/L盐酸滴定碳酸钠至第一等当点,此时可选用的指示剂是:A 甲基橙 B. 酚酞 C. 甲基红 D.中性红16.已知△pM' = 0.2,%Et且无其他副反应时,则络合滴定的分别滴3.0≤定判别式为()()A 5∆Kc D 7∆Kclg≥lg≥∆Kc C 5∆Kc B 7lg≤lg≤17.用0.1mol.L-1HCl滴定0.1mol.L-1NaOH突跃范围为9.7~4.3,若用0.01mol.L-1HCl滴定0.01mol.L-1NaOH,其滴定的突跃范围为()A 8.7~4.3B 9.7~5.3C 8.7~5.3 D10.7~3.318.用0.02 mol.L-1KMnO4溶液滴定0.1 mol.L-1Fe2+溶液和用0.002 mol.L-1 KMnO4溶液滴定0.01 mol.L-1 Fe2+溶液两种情况下滴定突跃的大小将()A 相同B 浓度大突跃就大C 浓度小的滴定突跃小D 无法判断19.pH = 4时用莫尔法滴定Cl-含量,将使Cl-含量结果( )A.偏高;B.偏低;C.忽高忽低D.无影响。
分析化学试A卷【范本模板】

分析化学试题(A卷)姓名: 班级:学号:单项选择题(每小题1.5分,共150分)1、下列各项叙述中不是滴定分析对化学反应要求的是(D)。
A.反应必须有确定的化学计量关系B.反应必须完全C.反应速度要快D.反应物的摩尔质量要大2、滴定管可估读到+0。
01%mL,若要求滴定的相对误差小于0.1%,至少耗用体积(B)A.10B。
20 C.30 D.403、在定量分析中,精密度与准确度之间的关系是(C)A、精密度高,准确度必然高B、准确度高,精密度也就高C、精密度是保证准确度的前提D、准确度是保证精密度的前提4、用分析天平(精确度为0。
0001)准确称取0。
2g试样,正确的记录应是(D)A。
0.2g B。
0。
20g C。
0.200g D.0。
2000g 5、下列四个数据中修改为四位有效数字后不是0。
2134的是(A)A。
0。
21334 B.0.213450 C.0。
21336D.0。
213351 6、测定试样CaCO3的质量分数,称取试样0.956g,滴定耗去EDTA标准溶液22.60mL,以下结果表示正确的是(C)A。
47。
328% B. 47。
33%C. 47。
3%D. 47%7、下列方法中,不能用来检验或消除系统误差的是(D)A.空白试验 B.对照试验C。
校正仪器D。
增加平行测定次数8、以下标准溶液可以用直接法配制的是(C)A。
KMnO4B。
NaOH C。
K2Cr2O7D。
FeSO49、在滴定中,指示剂发生颜色变化的转变点称为(C)A.变色点B.化学计量点C. 滴定终点D. 滴定中点10、准确称取10。
6000g基准NaCO3,溶解后定量转移至1L容量瓶中,用水稀释至刻度,摇匀,则NaCO3的浓度为(B)A。
0.100mol/L B.0.1000mol/LC. 0.10mol/L D。
0.1mol/L11、比较两组测定结果的精密度(B)甲组:0。
19%,0.19%,0。
20%,0.21%,0。
21%乙组:0。
分析化学复习题及答案

分析化学复习题及答案一、单选题(共64题,每题1分,共64分)1.将酚酞指示剂加到某无色溶液中,溶液仍无色,表明溶液的酸碱性为()。
A、酸性B、中性C、碱性D、不能确定其酸碱性正确答案:D2.用EDTA滴定Ca2.、Mg2.,采用铬黑T为指示剂,少量Fe3.的存在将导致()。
A、指示剂被封闭B、在计量点前指示剂即开始游离出来,使终点提前C、使EDTA与指示剂作用缓慢,使终点提前D、与指示剂形成沉淀,使其失去作用正确答案:A3.配制1000mL0.1mol/L的NaOH标准溶液时,最合适的量器和存放的溶液的容器是()。
A、量筒和试剂瓶B、滴定管和试剂瓶C、移液管和容量瓶D、量筒和容量瓶正确答案:A4.某溶液在白光下呈蓝色,该溶液吸收的可见光是()。
A、红光B、蓝光C、黄光D、绿光正确答案:C5.算式2142.01000.0)56.1800.20(..的计算结果应为()位有效数字。
A、三B、四C、一D、二正确答案:A6.用KMnO4滴定Fe2+时,酸性介质宜为()。
A、HClB、HNO3C、HAcD、H2SO4正确答案:D7.取水样100mL,用0.010mol/L的EDTA溶液滴定(pH=10),消耗10.0mLEDTA溶液,该水样的总硬度为()。
A、5.6B、56C、4.0D、40正确答案:A8.用EDTA滴定下列各组金属离子时,可用控制不同酸度分步滴定的是()。
A、Ca2+和Mg2+B、Zn2+和Pb2+C、Fe3+和Zn2+D、Cu2+和Al3+正确答案:C9.用K2Cr2O7滴定Fe2+时,以二苯胺磺酸钠作指示剂,若不加入H3PO4则会使()。
A、结果偏高B、结果偏低C、结果无误差D、终点不出现正确答案:B10.用0.1mol·L-1NaOH滴定某等浓度的三元酸H3A(Ka1=6.6.10-2,Ka2=6.3.10-7,Ka3=4.0.10-12)时,()。
A、有两个滴定终点,第一终点用甲基橙,第二终点用酚酞作指示剂B、有两个滴定终点,第一终点用酚酞,第二终点用甲基红作指示剂C、只有一个滴定终点,用酚酞指示滴定终点D、只有一个滴定终点,用甲基红指示滴定终点正确答案:A11.为使pH玻璃电极对H+响应灵敏,pH玻璃电极在使用前应在()浸泡24小时以上。
(完整版)分析化学复习题及参考答案

(完整版)分析化学复习题及参考答案分析化学复习题化学分析部分⼀、选择题1、实验室中常⽤于标定HCl溶液的基准物质是:A、NaOH;√B、硼砂;C、⾦属铜;D、邻苯⼆甲酸氢钾;E、NaCl2、铬⿊T在溶液中存在下列平衡,它与⾦属离⼦形成络合物显红⾊, 使⽤该指⽰剂的酸度范围是:p K a2=6.3 p K a3=11.6H2In-HIn2-In3-紫红⾊蓝⾊橙⾊pH < 6 pH = 8~11 pH > 12A、pH < 6;B、pH > 12;√C、pH = 8~11;D、pH = 11~ 123、当TE%≤0.1%、△PM=0.2时,⽤EDTA准确滴定⾦属离⼦,要求lgCKˊMY值A、≥106;B≥108; C ≥8; √D、≥64、KMnO4滴定C2O42-时,反应速度由慢到快,这种现象称作:A、催化反应;√B、⾃动催化反应;C、诱导反应;D、副反应.5、如果氧化还原滴定,其化学计量点位于滴定突跃中点,则两电对的所转移的电⼦数n1与n2之间的关系为:√A、n1= n2B、n1> n2 C、n1 < n2 D、n1= 2 n26、佛尔哈德法测定Ag+时,应在硝酸的酸性条件下进⾏,若在中性或碱性溶液中滴定,则:A、AgCl沉淀不完全;B、Ag2CrO4 沉淀不易⽣成;C、AgCl ⽆法吸附指⽰剂√D、Fe3+会形成Fe(OH)3↓7、莫尔法所使⽤的滴定剂为:A、NH4SCN;B、NaCl;√C、AgNO3;D、EDTA。
8、沉淀的类型与聚集速度有关,影响聚集速度⼤⼩的主要相关因素是:A、物质的性质B、溶液的浓度C、过饱和度√D、相对过饱和度9、有⾊配合物的吸光度与下述因素⽆关的是:A、⼊射光的波长B、⽐⾊⽫的厚度C、有⾊配合物的浓度√D、配合物稳定常数的⼤⼩10、在分光光度分析中,选择参⽐溶液的原则是:A、⼀般选蒸馏⽔B、⼀般选试剂溶液√C、根据加⼊试剂和被测试液的颜⾊性质选择D、⼀般选择褪⾊溶液。
分析化学题库及答案

分析化学题库及答案
一、分析化学题库:
1.为什么样品的溶解度是重要的?
2.什么因素影响离子交换色谱的分离质量?
3.为什么在溶质色谱分析中应使用色谱柱?
4.什么是利用原子吸收光谱分析金属的最常见的方法?
5.凯氏定理为什么是薄层色谱和有机分子的重要分离和分析工具?
测试中黄磷上素检测的核心原理是什么?
7.什么是四次回归法以估算未知浓度?
二、分析化学题库及答案:
1. 样品的溶解度是重要的,因为一个样品必须全部溶解,才可以进行分析测试以获得准确的结果。
2. 离子交换色谱的分离质量受到多因素的影响,包括极性度、相对分散度、离子表面张力和溶剂类型。
3. 在溶质色谱分析中应使用色谱柱,因为色谱柱可以将溶质相隔开,以便于准确的分析测试。
4. 利用原子吸收光谱分析金属的最常见的方法是激发待测气体中的原子,用紫外线等光源激发原子,然后测量光通过分析仪器时减少的光强度,从而得出原子激发频率或吸收光谱。
5. 凯氏定理是薄层色谱和有机分子的重要分离和分析工具,因为它提供了一种可以通过分析有机化合物的分布特性预测分析结果的方法。
6. AAS测试中黄磷上素检测的核心原理是原子吸收分光光度法,也就是说,黄磷被激发,产生特定吸收光谱,从而可以测量黄磷浓度。
7. 四次回归法是指确定方程的系数或常量值,以估算未知浓度,这种估算法采用了一元四次多项式模型,根据已知测定值来估算未知浓度。
分析化学复习题含答案pdf

分析化学复习题含答案pdf1. 什么是酸碱滴定的基本原理?答:酸碱滴定的基本原理是利用酸碱中和反应来测定溶液中待测物质的浓度。
在滴定过程中,当酸和碱完全中和时,达到化学计量点,此时溶液的pH值会发生变化,通过指示剂或pH计来确定滴定终点。
2. 请解释什么是摩尔浓度(M)?答:摩尔浓度(M)是指溶液中溶质的摩尔数除以溶液的体积(以升为单位)。
它表示每升溶液中含有溶质的摩尔数。
3. 什么是缓冲溶液,它有哪些特点?答:缓冲溶液是一种能够抵抗pH变化的溶液,即使加入少量的酸或碱,其pH值也不会发生显著变化。
缓冲溶液的特点包括:能够中和加入的少量酸或碱,维持溶液pH相对稳定;通常由弱酸及其共轭碱或弱碱及其共轭酸组成。
4. 简述分光光度法的工作原理。
答:分光光度法是通过测量溶液对特定波长光的吸收程度来确定溶液中物质浓度的方法。
当光通过溶液时,溶液中的化学物质会吸收特定波长的光,未被吸收的光被检测器接收,通过比尔-朗伯定律计算出溶液的吸光度,进而求得物质的浓度。
5. 什么是电位滴定,它与常规滴定有何不同?答:电位滴定是一种利用电化学传感器(如pH计)来监测滴定过程中溶液电位变化的方法,以此来确定滴定终点。
与常规滴定相比,电位滴定不需要使用指示剂,可以更精确地确定终点,并且适用于无色或不透明溶液的滴定。
6. 请解释什么是标准溶液?答:标准溶液是指已知准确浓度的溶液,通常用于校准分析仪器或作为滴定中的基准物质。
制备标准溶液时,需要精确称量一定量的纯物质,并将其溶解在一定体积的溶剂中,以获得已知浓度的溶液。
7. 什么是色谱法,它有哪些主要类型?答:色谱法是一种分离技术,利用固定相和移动相之间的相互作用差异,使混合物中的不同组分在通过色谱柱时移动速度不同,从而实现分离。
主要类型包括:柱色谱、薄层色谱、气相色谱和液相色谱。
8. 简述什么是质谱法及其应用。
答:质谱法是一种分析技术,通过电离样品分子并根据离子的质荷比(m/z)来分离和检测离子。
《分析化学》期末考试复习题及参考答案
分析化学复习题(课程代码 252402)一、填空题1、定量分析的过程通常包括_______________________________________________;定量分析的精密量器是指_____________________________________________。
2、配位滴定法中常见的滴定方式包括_______________________________________。
3、0.02000 mol·L-1的K2Cr2O7标准溶液(Mr=294.18)对Fe 2O3(M r=159.67)的滴定度为_____________________________________________________;已知试样中As2S3(M r =246.0)的质量分数为0.2000,则换算成BaSO4(M r =233.39)的质量分数为____________________________。
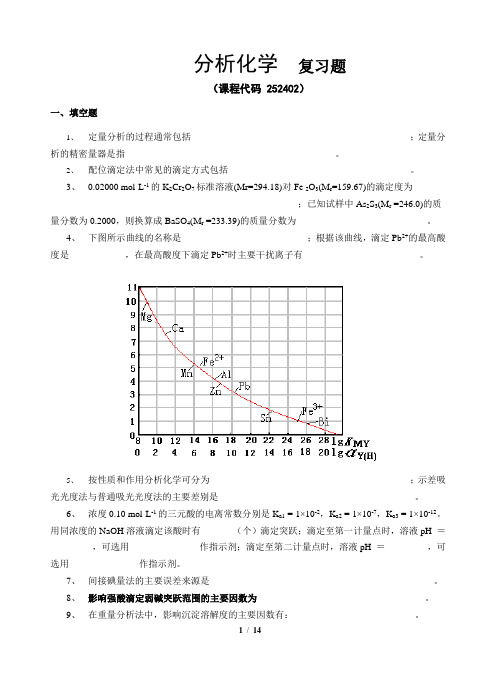
4、下图所示曲线的名称是___________________________;根据该曲线,滴定Pb2+的最高酸度是____________,在最高酸度下滴定Pb2+时主要干扰离子有_________________________。
5、按性质和作用分析化学可分为___________________________________________;示差吸光光度法与普通吸光光度法的主要差别是__________________________________________。
6、浓度0.10 mol·L-1的三元酸的电离常数分别是K a1 = 1×10-2,K a2 = 1×10-7,K a3 = 1×10-12。
用同浓度的NaOH溶液滴定该酸时有_______(个)滴定突跃;滴定至第一计量点时,溶液pH =_________,可选用_______________作指示剂;滴定至第二计量点时,溶液pH =_________,可选用_______________作指示剂。
分析化学考试复习题及答案

分析化学考试复习题及答案分析化学考试复习题:第一部分:误差及分析数据处理一.填空:√1.用丁二酮肟总量法测定Ni的含量,得到下列结果:10.48%、10.37%、10.43%、10.40% 10.47%已求得单次测定结果的平均偏差为0.036% 则相对平均偏差为();标准偏差为();相对标准偏差为()。
√2.滴定管的读数常有±的误差,在完成一次测定时的绝对误差可能为()mL;常量分析的相对误差一般要求应≤0.1%,为此,滴定时消耗标准溶液的体积必须控制在( ) mL 以上。
√3.定量分析中,影响测定结果精密度的是()误差。
√5.0.908001有()位有效数字,有()位有效数字二.选择:√1.下列有关偶然误差的论述中不正确的是(A)偶然误差具有随机性(B)偶然误差具有单向性(C)偶然误差在分析中是无法避免的(D)偶然误差的数值大小、正负出现的机会是均等的√4.如果要求分析结果达到0.1%的准确度,使用灵敏度为的天平称取试样时,至少应称取(A)0.1g (B)0.2g (C)0.05g (D)三.判断:√1.下面有关有效数字的说法是否正确(A)有效数字中每一位数字都是准确的(B)有效数字中的末位数字是估计值,不是测定结果(C)有效数字的位数多少,反映了测量值相对误差的大小(D)有效数字的位数与采用的单位有关√2.下面有关误差的叙述是否正确(A)准确度高,一定要求精密度高(B)系统误差呈正态分布(C)精密度高,准确度一定高(D)分析工作中,要求分析误差为零√3.判断下列说法是否正确(A)偏差是指测定值与真实值之差(B)随机误差影响测定结果的精密度(C)在分析数据中,所有的“0”均为有效数字(D)方法误差属于系统误差四.回答问题:√1.指出在下列情况下,都会引起哪种误差?如果是系统误差,应该采用什么方法避免?(1)读取滴定体积时,最后一位数字估计不准(2)试剂中含有微量的被测组分(3)滴定时不慎从锥形瓶中溅出一滴溶液(4)重量分析中,沉淀溶解损失√3.指出下列操作的绝对误差和相对误差第二部分滴定分析一.填空:√1.称取纯K2Cr2O7 5.8836g,配制成1000mL溶液,则此溶液的C(K2Cr2O7)为()mol L-1,C(1/6K2Cr2O7)为(),T(Fe/K2Cr2O7)为()g/ mL,T(Fe2O3/K2Cr2O7)为()g /mL,T(Fe3O4/K2Cr2O7)为()g /mL。
分析化学复习资料

分析化学复习资料一、选择题:1.测定0.8mL样品溶液的含量,则对其进行分析属:A.超微量分析 B.半微量分析 C.微量分析 D.常量分析2.按被测组分含量来分,分析方法中常量组分分析指含量:A.<0.1%B.>0.1%C.<1%D.>1%3.下列各项定义中不正确的是:A.绝对误差是测定值与真值之差B.相对误差是绝对误差在真值中所占的百分率C.偏差是指测定值与平均值之差 D.总体平均值就是真值4.定量分析结果的标准偏差代表的是:A. 分析结果的准确度B. 分析结果的精密度和准确度C. 分析结果的精密度D. 平均值的绝对误差5.在进行样品称量时,由于汽车经过天平室附近引起天平震动是属于:A.系统误差B.偶然误差C.过失误差D.操作误差6.下面数值中,有效数字为四位的是:A.ωcao=25.30%B.pH=11.50C.π=3.141D. 10007.滴定分析中需要润洗的仪器是A.锥形瓶B.滴定管C.烧杯D.容量瓶8.在锥形瓶中进行滴定时,错误的是:A.用右手前三指拿住瓶颈,以腕力摇动锥形瓶;B.摇瓶时,使溶液向同一方向作圆周运动,溶液不得溅出;C. 注意观察液滴落点周围溶液颜色的变化;D. 滴定时,左手可以离开旋塞任其自流。
9.酸碱滴定中选择指示剂的原则是:A.指示剂变色范围与化学计量点完全符合B.指示剂应在pH 7.00时变色C.指示剂的变色范围应全部或部分落入滴定pH突跃范围之内D.指示剂变色范围应全部落在滴定pH突跃范围之内10.共轭酸碱对的Ka与Kb的关系是:A.KaKb = 1B.KaKb =KwC.Ka/Kb =Kw D Kb /Ka =Kw11. 用0.1mol/L HCl滴定0.1mol/L NaOH时的pH突跃范围是9.7-4.3,用0.01mol/L HCl 滴定0.01mol/L NaOH的突跃范围是:A. 9.7~4.3B. 8.7~4.3C. 8.7~5.3D. 10.7~3.312. 一般情况下,EDTA与金属离子形成的络合物的络合比是:A.1:1B.2:1C. 1:3D.1:213.直接与金属离子配位的EDTA型体为:A. H6Y2+B.H4YC.H2Y2-D.Y4-14.某溶液主要含有Ca2+、Mg2+及少量Al3+、Fe3+,今在pH=10时加入三乙醇胺后,用EDTA 滴定,用铬黑T为指示剂,则测出的是:A.Mg2+的含量B.Ca2+、Mg2+的含量C.Al3+、Fe3+的含量D.Ca2+,Mg2+,Al3+,Fe3+的含量15.氧化还原滴定的主要依据是A.滴定过程中氢离子浓度发生变化B.滴定过程中金属离子浓度发生变化C.滴定过程中电极电位发生变化D. 滴定过程中有络合物生成。
《分析化学》复习题.doc

《分析化学》练习题1 .分析化学:关于研究物质的组成、含量、结构和形态等化学信息的分析方法及相关理论的一门科学。
2.滴定突跃:在化学计量点附近(计量点前后±0.1%范围内),溶液浓度及其相关参数所发生的急剧变化。
3.质谱分析法:利用多种离子化技术,将物质分子转化为离子后,按照其质荷比的差异分离测定,从而进行物质成分和结构分析的方法4.比移值:平面色谱中组分的移动距离与溶剂的移动距离之比。
5.分布系数:溶液中某型体的平衡浓度在溶质总浓度中所占的分数。
6.滴定误差:滴定终点与化学计量点的不完全一致引入的误差7.指示剂的封闭现象:某些金属离子与指示剂生成极稳定的配合物,滴定终点时,EDTA很难将指示剂置换出来,造成指示剂不变色或变色不敏锐,这种现象称为“指示剂封闭气8.保留时间:色谱实验中,从进样开始到某组分的色谱峰峰顶的时间间隔。
9.正相色谱:固定相的极性强于流动相极性(流动相的极性弱于固定相的极性)的色谱,称为正相色谱。
10.核磁共振:在强磁场作用下,原子核自旋能级跃迁产生的对辐射电磁波的吸收现象。
11.反相色谱:固定相的极性弱于流动相极性(流动相的极性强于固定相的极性)的色谱,称为反相色谱。
12.光学分析法:是基于物质发射的电磁辐射或物质与辐射相互作用后产生地辐射信号或发生地信号变化来测定物质性质、含量、结构的一类仪器分析方法。
13.共振线:原子从基态激发到能量最低的激发态(或第一激发态)所产生的吸收线。
14.电化学分析法:依据电化学原理和物质的电化学性质建立的一类分析方法,通常将试样溶液和两支电极构成化学电池,利用试液的电化学性质,通过测量电池的电学参数,或这些参数的变化,确定试样的化学组成或浓度。
15.核磁共振(NMR):在强磁场作用下,原子核自旋能级跃迁产生的对辐射电磁波的吸收现象。
简答题1.简述适合直接滴定分析的反应必须具备的条件?答:(1)反应按一定的反应式进行,即具有确定的化学计量关系;(2)反应必须定量进行;(3)通常要求反应完全程度达到99.9%以上;(4)反应速度快;(5)有适当的方法确定终点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
试样加入5.00 mL 氢溴酸溶液及5.00 mL 甲基异丁酮。
由于金及溴离子形成配合物而被萃取到有机相中。
用原子吸收法分别测得有机相的吸光度为0.375及0.225。
求得试样中金的含量(μg/g ) (15.0μg/g )
14、用AAS 测锑,用铅作内标。
取5.00 mL 未知锑溶液,加入2.00 mL
4.13μg · mL-1的铅溶液并稀释至10.0 mL ,测得ASb/Apb=0.808。
另取相同浓度的锑和铅溶液,ASb/Apb=1.31,计算未知液中锑的质量浓度。
(0.5095ug/mL)
练习题六
1、下列各组化合物或不同条件中,预测哪一种荧光产率高?为什么?
(1)
二氮杂菲 偶氮苯 二氮杂菲
(2) pH=3及pH =10时的苯胺 pH=10
(3) 不含氯原子
2、若一种化合物能发射荧光和磷光,则该化合物吸收光谱、荧光发射光谱、磷光发射光谱最大波长的顺序如何?为什么? 激荧磷λλλ〉〉
3、下列哪种去激发过程是分子荧光发射过程? B
1、通常在紫外-可见吸收光谱中,有机化合物的跃迁类型有、、和。
其中的跃迁所需能量最大,故其对应的最大吸收波长出现在小于 nm 范围内。
(n→π*、π→π*、 n→σ* 和σ→σ*;σ→σ*;200)
2、波长为0.0100nm的电磁辐射的能量是多少eV? D
(已知1eV=1.602×10-19)
A、0.124;
B、 12.4eV;
C、124eV;
D、1.24×105eV
3、下列化合物中,同时有n→π*、π→π*、σ→σ* 跃迁的化合物是 B
A、一氯甲烷
B、苯乙酮
C、1,3-丁二烯
D、甲醇
4、分子的紫外-可见吸收光谱呈带状光谱,其原因是什么? D
A、分子中价电子运动的离域性质;
B、分子中价电子能级的相互作用;
C、分子振动能级的跃迁伴随着转动能级的跃迁;
D、分子电子能级的跃迁伴随着振动、转动能级的跃迁。
5、下列四种波数的电磁辐射,哪一种是属于可见光区? B
A、2.0×105cm-1
B、2.0×104cm-1
C、980 cm-1
D、50.0 cm-1
6、分子能发生n-σ*跃迁,为227nm(ε为900)。
试问:若在酸中测量时,该吸收峰会怎样变化?为什么?
n-σ*跃迁产生的吸收峰消失。
7、某化合物的为305nm,而为307nm。
试问:引起该吸收的是n-π*还是π-π*跃迁?
为π-π*跃迁引起的吸收带。
8、以丁二酮肟光度法测定微量镍,若配合物NiDx2的浓度为1.70×10-5 mol·L-1,用 2.0cm吸收池在470nm波长下测得透射比为30.0%。
计算配合物在该波长的摩尔吸光系数。
(ε=1.54×104 L·mol-1·cm-1)
9、何谓生色团、助色团?
练习题八
1、一般将多分子的振动类型分为和振动,前者可分为和振动,后者又可分为、、、振动。
2、在红外光谱中,将基团在振动过程中有变化的称为。
相反则称为。
3、以下四种物质中,不吸收红外光的是哪一种? D
A、SO2
B、CO2
C、CH4
D、Cl2
4、二氧化碳分子的平动、转动和振动自由度的数目分别为 A
A、 3,2,4;
B、 2,3,4;
C、 3,4,2 ;
D、 4,2,3 。
5、一种能作为色散型红外光谱仪的透光材料的是 D
A、玻璃;
B、石英;
C、红宝石;
D、卤化物晶体。
最大一端,它是分子失去一个电子生成的,故其质荷比值是该化合物的相对分子质量。
26、下列各类化合物中,分子离子峰最强的是( A )
A、芳香环
B、醚
C、羰基化合物
D、胺
练习题12
1、电位分析法包括直接电位法和电位滴定法;能斯特方程是电位分析法的基础。
2、已知图示的电池是一个自发电池,则图中右边的电极为 B
A、正极,阳极;
B、正极,阴极
C、负极,阴极
D、负极,阳极
3、确定电化学电池阴阳极时,下列说法正确的是 A
A、发生氧化反应的电极是阳极,发生还原反应的电极是阴极;
B、发生氧化反应的电极是阴极,发生还原反应的电极是阳极;
C、电极电位高的电极是阳极,电极电位低的电极是阴极;
D、电极电位低的电极是阴极,电极电位高的电极是阳极;
4、电极发生极化时,其电极电位比起其平衡的电位来说,移动的方向是 A
A、阳极向正方向移动,阴极向负方向移动;。
