Quo-Test糖化血红蛋白检测试剂盒
糖化血红蛋白检测

糖化血红蛋白检测1.预期用途糖化血红蛋白检测试剂盒(微粒色谱法)与NycoCard READERⅡ特种蛋白金标检测仪配合使用,用于定量检测中的糖化血红电白含量。
2.检验原理糖化血红蛋白检测试剂盒采用微粒色谱的原理,试剂盒所包含的检测装置包括:多孔膜滤网、预装有反应试剂的检测管及清洗液。
确切的说,反应试剂中,含有可溶解红细胞并使血红蛋白沉淀的物质,与可与糖化血红蛋白的顺式- 二醇基结合的蓝色硼酸结合物。
当将血滴入反应试剂时,血红细胞将立即被溶解。
所有的血红蛋白随机沉淀。
硼酸结合物即可与糖化血红蛋白的顺式-二醇基结合。
将部分反应混合物置于检测设备,那么说有已沉淀的血红蛋白,无论其是否被硼酸结合物所结合,都将残留在滤网之上。
然后使用清洗液,去除多余的有色结合物。
最后使用NycoCard READERⅡ特种蛋白金标检测仪对蓝色(糖化血红蛋白)与红色(总体血红蛋白)的颜色色谱进行分析,计算二者的比率,该比率代表了样品中HbA1c的浓度。
3.储存条件及有效期试剂盒有效期内,应保存在2-8度下。
避免放在阳光直射或者高湿度的环境中,有效期是6个月。
试剂盒平直打开后,试剂R1在室温能够保存6小时。
反应板(TD)及洗涤液R2打开后室温能够保存至有效期。
使用后瓶盖应当拧紧。
4.适用仪器NycoCard READERⅡ特种蛋白金标检测仪5.样本要求在检测过程中,可以使用毛细血管血或静脉血。
血液中是否含有抗凝血剂(EDTA、肝素和NaF)均可。
在使用前,血液样本(含有抗凝血剂)在2-8度的环境中最多可存放10天。
要避免检测样本发生溶血(参阅“检测方法的局限性”)。
不要对血液样本进行冷冻。
6.检验方法6.1. 裂解红细胞,着色标记向带有试剂R1的检测管中加入5uL全血。
充分搅拌,静置2-3分钟,待其反应完全。
本过程需要使用计时器。
注意!在使用试剂R1之前,需要将其平衡至室温(20-25度)。
6.2. 添加样本再次搅拌,使悬浊液均匀。
糖化血红蛋白(HbA1c)测定试剂盒(胶乳免疫比浊法)性能指标

糖化血红蛋白(HbA1c)测定试剂盒(胶乳免疫比浊法)性能指标1.性能指标1.1外观外观应符合以下要求:a)试剂盒各组分应齐全、完整,液体无渗漏;包装标签文字符号清晰。
b)R1:乳白色液体。
c)R2:无色透明液体,无异物和凝聚物。
d)溶血剂:无色透明液体。
e)校准品、质控品:红色冻干粉。
1.2装量液体试剂装量要求不低于标示量。
1.3水分含量校准品质控品的水分含量应不超过5%。
1.4试剂空白吸光度测试空白样本,试剂空白吸光度应≤2.0。
1.5分析灵敏度在5.8%(NGSP单位)水平浓度下,吸光度差值≥0.01。
1.6线性范围1.6.1试剂盒在[2.5%,14%](NGSP单位)范围内,线性相关系数r≥0.990。
1.6.2在[2.5%,7%](NGSP单位)范围内,线性绝对偏差应不超过±0.5%(NGSP单位);在(7%,14%](NGSP单位)范围内,线性相对偏差应不超过±7%。
1.7重复性变异系数(CV)应≤3%。
1.8批间差试剂盒批间相对极差R应≤10%。
1.9准确度测试参考物质,相对偏差应不超过±7%。
1.10分析特异性当葡萄糖≤4000mg/dL、胆红素≤40mg/dL、脂肪乳剂≤2%、类风湿因子≤100IU/mL、抗坏血酸≤40mg/dL时,对试剂检测结果的偏差影响在±10%以内。
1.11量值溯源应明确分析物的量值溯源。
1.12校准品赋值结果及其不确定度的表示方式应使用规范的表示方式,主要表示方式可选择:a)赋值结果±扩展不确定度;b)赋值结果,扩展不确定度。
1.13校准品正确度量值传递的正确度应符合E≤1。
n1.14质控品赋值准确度在用校准品校准后的生化分析仪上测试定值质控品,结果应在制造商指定的赋值范围内。
1.15校准品均匀性应不超过10%。
1.15.1瓶内均匀性:CV瓶内应不超过10%。
1.15.2瓶间均匀性:CV瓶间1.16质控品均匀性应不超过10%。
糖化血红蛋白测定试剂盒(免疫比浊法)产品技术要求meigaoyi

糖化血红蛋白测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人全血中的糖化血红蛋白所占总血红蛋白的百分比。
1.1包装规格试剂1: 1×30mL, 试剂2a: 1×9.5mL, 试剂2b 1×0.5mL,前处理液:2×50ml;1.2主要组成成分试剂1主要组成成分MES缓冲液25mmol/L Tris缓冲液 PH(6.0~7.0)15mmol/L乳胶颗粒适量BSA 0.4 g/L试剂2主要组成成分MES缓冲液25mmol/L Tris缓冲液 PH(6.0~7.0)15mmol/L羊抗鼠IgG抗体适量BSA 0.4g/L鼠抗人HbA1c抗体适量前处理液主要组成成分表面活性剂适量2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为白色乳胶液体;试剂2a应为无色透明溶液;试剂2b应为无色透明溶液;前处理液:无色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白测定试剂空白吸光度,应<1.5。
2.4 分析灵敏度测定浓度为10%样品时,吸光度变化(ΔA)应不低于0.005。
2.5 准确性用于评价常规方法的参考物质GBW09182或GBW09183对试剂(盒)进行测试,重复检验3次,取测试结果均值(M),计算相对偏差(B),B≤15%。
2.6 重复性重复测定正常值和高值浓度两份样品,变异系数(CV)应不超过5%。
2.7 线性2.7.1在[2,14]% 范围内,线性回归的相关系数应不低于0.990。
2.7.2测试浓[5,14]%范围内,相对偏差≤15%;测试浓度[2,5)%范围内,绝对偏差≤1%。
2.8 批间差抽取3个不同批号试剂,对同一浓度样品进行重复检测,相对偏差<10%2.9 稳定性该产品在2℃~8℃条件下贮存有效期为18个月,取效期末的产品进行检测,应符合2.1、2.2、2.3、2.4、2.5、2.6、2.7之规定。
糖化血红蛋白测定试剂盒(荧光免疫层析法)产品技术要求12

糖化血红蛋白测定试剂盒(荧光免疫层析法)
组成:
校准信息卡:ID卡或IC卡(内含校准曲线)。
预期用途:本试剂盒用于体外定量测定人全血中糖化血红蛋白(HbA1c)的百分比含量。
糖化血红蛋白可以稳定可靠地反映出检测前120天内的平均血糖水平,且不受抽血时间,是否空腹,是否适用胰岛素等因素影响。
2.1外观
1)检测卡使用铝塑单个密封包装,标签应完整清晰,内容物齐全,卡壳应整洁、无破损,扣合紧密;
2)缓冲液为无色或淡黄色透明液体,不得有任何沉淀及絮状悬浮物。
2.2宽度
试纸条宽度为4.0±0.2mm。
2.3移行速度
液体移行速度不低于10mm/min。
2.4空白检出限
试剂盒的空白检出限不大于3%。
2.5线性
在[3,15]% 范围内,线性相关系数应满足r≥0.990。
2.6重复性
用高浓度[8,12]%、低浓度[4,6]%两水平样本重复测定10次,其测定值的变异系数(CV)应不大于10%。
2.7批间差
用3个不同批号的试剂盒分别测试样本,所得结果的相对极差(R)应不大于10%。
2.8准确度
用本试剂盒做回收试验,其回收率应在85%~115%范围内。
2.9特异性
取不含HbA1c的样本,加入以下物质平行检测3次,结果均应不大于3%。
表1 特异性
2.10 稳定性
原包装的试剂盒在2℃~30℃贮存,有效期为12个月。
在有效期满后六个月以内的试剂盒,分别检测2.1,2.3,2.4,2.5,2.6,2.7项,结果应符合各项目的要求。
糖化血红蛋白测定试剂盒(蛋白酶法)产品技术要求lepu

糖化血红蛋白测定试剂盒(蛋白酶法)适用范围:用于体外定量测定人血清中的糖化血红蛋白的含量。
1.1 规格试剂1:30mL×1,试剂2a:9.5mL×1, 试剂2b:0.5mL×1,前处理液:50mL×2;试剂1:12mL×1,试剂2:4 mL×1;试剂1:60mL×3,试剂2:60mL×3;试剂1:60mL×1,试剂2:20mL×1;试剂1a:16.8mL×1,试剂1b:7.2mL×1,试剂2:10mL×1,前处理液:30mL×1;试剂1a:33mL×2,试剂1b:14.1mL×2,试剂2:19mL×2,前处理液:60mL×2;试剂1a:15.4mL×1,试剂1b:6.6mL×1,试剂2:8mL×1,前处理液:30mL×1;试剂1a:15mL×1,试剂1b:5mL×1,试剂2:5.5mL×1,前处理液:20mL×1;试剂1a:3.5mL×3,试剂1b:4.0mL×1,试剂2:3.5mL×2,前处理液:15mL×1;试剂1a:3.5mL×6,试剂1b:4.0mL×2,试剂2:3.5mL×4,前处理液:15mL×2。
1.2主要组成成份试剂1主要成分:试剂2a主要成分:试剂2b主要组分:前处理液主要成分:2.1 外观试剂1:无色透明溶液;试剂2:无色透明溶液;前处理液:无色或淡黄色透明溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白在660nm处测定试剂空白吸光度,应≤1.5;2.4 分析灵敏度测试6%的被测物时,吸光度变化(ΔA)应≥0.020。
糖化血红蛋白测定试剂盒(胶乳凝集法)产品技术要求aiweide

糖化血红蛋白测定试剂盒(胶乳凝集法)
适用范围:本试剂用于定量测定人血中糖化血红蛋白的含量。
1.1 包装规格
试剂1:1×30mL,试剂2-a:1×9.5 mL,试剂2-b:1×0.5 mL,试剂3:2×50mL。
1.2主要组成成分
2.1 外观
试剂1:乳白色液体;试剂2a:无色澄清液体;试剂2b:无色澄清液体;试剂3:无色澄清液体。
2.2 试剂装量
应不低于试剂瓶标示装量。
2.3 试剂空白吸光度
在660nm波长处测定试剂空白吸光度,应<0.7。
2.4 分析灵敏度
测定HbA1c含量为1%样本时,其ΔA 应为0.0252~0.0308。
2.5线性范围
2.5.1 在[2,16]%范围内,线性回归的相关系数应不低于0.990。
2.5.2 测试浓度在[2,16]%范围内线性绝对偏差不超过±2%。
2.6 测量精密度
2.6.1 重复性:用三个水平质控血清重复测试其变异系数(CV)应不超过5%。
2.6.2 批间差:抽取3个不同批号的试剂,对同一份样本进行重复测定,相对极差≤10%。
2.7 准确度
以国家标准物质为检测样本时,测定结果相对偏差不超过±10%。
2.8 稳定性
取在2℃~8℃条件下贮存达到18个月的试剂进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
糖化血红蛋白

糖化血红蛋白测定试剂盒(硼化亲和法)说明书【产品名称】通用名称:糖化血红蛋白测定试剂盒(硼化亲和法)商品名称:AusW ell HbA1c英文名称:Glycated Hemoglobin Kit【包装规格】24人份/盒【预期用途】本试剂盒用于快速体外测定人体血液中糖化血红蛋白(H b A1c)的含量。
【检验原理】当样本添加到试剂中,红血球立即裂解,所有的血红蛋白沉淀,硼酸结合物与糖化血红蛋白的顺式二醇基结合。
将该反应混合物加入检测卡孔内,结合的和未被结合的血红蛋白都停留在滤膜上,加入洗涤液后多余的有色偶联物被洗涤液冲掉。
分别测定糖化血红蛋白和血红蛋白的光密度,两者比率与样本中糖化血红蛋白的百分比成比例。
【主要组成成份】◆TD/检测卡24人份塑料卡,薄膜,吸水纸。
◆R1/试剂 24×0.2ml甘氨酸缓冲液,含Z n离子、染料-硼酸结合物、表面活性剂。
◆R2/洗涤液 2.0ml吗啉缓冲液,含N a C l、表面活性剂。
【储存条件及有效期】◆储存条件:未开启的试剂:2-8℃储存,避免储存温度超过25℃或湿度大于70%。
开启后的试剂:R1/试剂:2-8℃储存,使用前平衡至室温(20-25℃),R1最多可以在室温下保存6小时。
避免阳光直射。
T D/检测卡:可以在15-25℃储存,使用前勿开封,环境湿度不要超出20-70%,使用前平衡至室温。
R2/洗涤液:可以在15-25℃下保存,使用前平衡至室温。
◆有效期:未开启的试剂盒在规定的储存条件下有效期为6个月。
【适用仪器】读数仪。
【样本要求】◆全血样本:含有或者不含抗凝剂(E D T A,肝素和氟化钠)的毛细血管血和静脉血都可以用来作为样本。
避免使用溶血样本。
◆样本在2-8℃最多保存10天,切勿冻存。
【检验方法】先在检测卡的反应孔下标记患者或质控品的标志。
操作步骤如下:◆沉淀血红蛋白:将5μl全血添加到装有R1/试剂的离心管内,混匀。
静置2分钟,最多3分钟。
糖化血红蛋白测定试剂盒(蛋白酶法)产品技术要求shijiwode
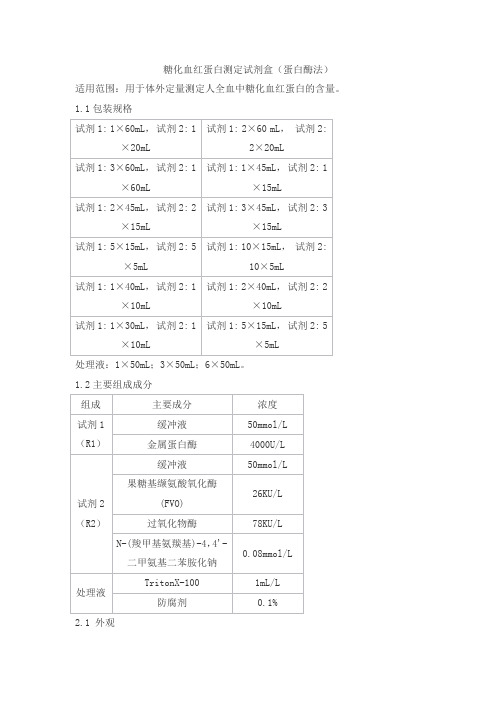
糖化血红蛋白测定试剂盒(蛋白酶法)
适用范围:用于体外定量测定人全血中糖化血红蛋白的含量。
1.1包装规格
处理液:1×50mL;3×50mL;6×50mL。
1.2主要组成成分
2.1 外观
试剂1为无色或浅黄色澄清液体,试剂2为黄色或黄绿色液体,处理液为无色液体。
试剂盒标签标识清晰,外包装完整无损。
2.2 装量
不少于瓶签标示量。
2.3 试剂空白
在700nm处测定试剂空白吸光度≤1.5。
2.4 分析灵敏度
测试5.0%的被测物时,吸光度变化(ΔA)≥0.0019。
2.5 准确度
检测三个水平国家标准物质(GBW09181、GBW09182、GBW09183)中的任两个水平,分别重复检测3次,检测值与标示值相对偏差不超过±10%。
2.6 线性
2.6.1在[1.8,12]%区间内,线性相关系数r≥0.990;
2.6.2在[1.8,
3.5]%区间内,线性绝对偏差不超过±0.35%;(3.5,12]%区间内,线性相对偏差不超过±10%。
2.7 重复性
检测高、中、低三个浓度水平的样本,变异系数CV不大于10%。
2.8 批间差
随机抽取三批试剂盒对同一份样品进行重复测定,相对极差不超过±10%。
2.9 稳定性
该产品在2℃~8℃条件下贮存有效期为12个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7的要求。
糖化血红蛋白测定试剂盒(蛋白酶法)产品技术要求senmeixikema

糖化血红蛋白测定试剂盒(蛋白酶法)适用范围:用于体外定量检测全血中糖化血红蛋白的浓度。
1.1规格a) 试剂1:1×30ml,试剂2:1×10ml,前处理液:1×90ml;b) 试剂1:2×45ml,试剂2:2×15ml,前处理液:3×90ml;c) 试剂1:2×16.8ml,试剂2:2×5.6ml,前处理液:1×100ml;d) 试剂1:2×150ml,试剂2:2×50ml,前处理液:8×100ml;e) 试剂1:2×30ml,试剂2:1×10ml,前处理液:1×90ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂1应为无色或淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液;前处理液应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1在600nm处测定试剂空白吸光度,应<1.5;2.3.2在700nm处测定试剂1和试剂2混合后的空白吸光度,应<1.5。
2.4 分析灵敏度2.4.1 测定HbA1c浓度为 800ml/dl的样品,吸光度变化(ΔA)应不低于0.03;2.4.2 测定Hb浓度为1000mg/dL的样品,吸光度变化(ΔA)应不低于0.05。
2.5 线性2.5.1在[3%,16%]范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度[6%,16%]的样品,相对偏差应不超过±15%;测试浓度[3%,6%) 的样品,绝对偏差应不超过±0.9%。
2.6 重复性2.6.1 批内重复性变异系数(CV)应不超过5%。
2.6.2 批间差对同一份样品进行重复测定,相对极差(R)应不超过10%。
2.7 准确度用国家标准物质[BW3625、GBW09181、GBW09182任选一种]对试剂盒进行测试,测定值与标准物质标示值的相对偏差应不超过±10%。
糖化血红蛋白测定试剂盒(胶乳免疫比浊法)产品技术要求模板

医疗器械产品技术要求编号:糖化血红蛋白测定试剂盒(胶乳免疫比浊法) 1.产品型号/规格及划分说明1.1规格试剂1:1×30ml,试剂2a:1×9.5ml,试剂2b:1×0.5ml,溶血剂:2×70ml 1.2 组成试剂主要组分见表1:表1 试剂主要组分用于体外定量测定人全血中糖化血红蛋白含量。
1.4 产品储存条件及有效期(体外诊断试剂适用):2℃~8℃贮存18个月。
2.性能指标2.1 外观试剂1为乳白色溶液,试剂2a为无色透明溶液,试剂2b为无色透明溶液,溶血剂为无色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3空白限试剂空白限为2%。
2.4 试剂空白测定试剂空白吸光度,应≤1.5。
2.5 分析灵敏度测定浓度为10%样品时,吸光度变化(ΔA)应不低于0.005。
2.6 线性2.6.1在[2,14]%范围内,线性回归的相关系数应不低于0.990;2.6.2测试浓度[6,14]%的样品,相对偏差应不超过±10%;测试浓度[2,6)%的样品,绝对偏差应不超过±0.6%。
2.7 重复性2.7.1 批内重复性变异系数(CV)应不超过5%。
2.7.2 批间差对同一份样品进行重复测定,相对极差(R)应不超过10%。
2.8 准确度用国家标准物质对试剂盒进行测试,测定值与标准物质标示值的相对偏差应不超过±15%。
2.9 稳定性取在2℃~8℃条件下贮存达到18个月但未超过24个月的试剂检测,应符合本技术要求2.1、2.3、2.4、2.5、2.6.1、2.7、2.8之规定。
糖化血红蛋白检测试剂盒(荧光免疫层析法)产品技术要求天宝颂原

医疗器械产品技术要求编号:
糖化血红蛋白检测试剂盒
(荧光免疫层析法)
1.性能指标
1.1物理性状
1.1.1外观
测试卡外壳应整洁完整,印刷内容清晰;测试卡内部试纸条应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
稀释液应澄清无沉淀。
1.1.2宽度
测试卡内部试纸条宽度应在 4.1mm±0.2mm 范围内。
1.1.3移行速度
液体移行速度应不低于10mm/min。
1.2精密度
1.2.1批内精密度
用HbAlc 为 6.0%、9.0%、12.0%的样本进行检测,其变异系数CV 不大于10%。
1.2.2批间精密度
任取3 批测试卡,用HbAlc 为6.0%、9.0%、12.0%的样本进行检测,其批间变异系数CV 不大于15%。
1.3准确度
用经标定HbAlc 含量比为 6.0%、9.0%、12.0%的样本进行检测,其相对偏差(B%)不大于10%。
1.4检测限
检测限应不高于4.0%。
1.5分析测量范围
其分析测量范围为 4.0%~18.0%,相关系数r2≥0.9900。
1。
糖化血红蛋白测定试剂盒(高效液相色谱法) 产品技术要求深圳市希莱恒医用电子

糖化血红蛋白测定试剂盒(高效液相色谱法)
性能指标
2.1外观
试剂应澄清、无异物。
2.2净含量
试剂的净含量不少于标示值。
2.3空白值
测量空白样本,结果应等于0。
2.4最低检测限
最低检测限应小于3%。
2.5准确度
分别用正常参考物质、异常参考物质作为样本进行检测,测试结果的相对偏差应在±8% 范围内。
2.6精密度
2.6.1重复性
重复测试浓度为 4.0%~6.5%(20.2mmol/mol~47.5mmol/mol)的样本,所得结果的变异系数(CV)度应不大于3%。
2.6.2批间差
测试浓度为4.0%~6.5%(20.2mmol/mol~47.5mmol/mol)的样本,所得结果的批间相对极差(R)应不大于3%。
2.7线性
试剂盒线性区间在4%-17%:
a)线性相关系数r 应不小于0.9900;
b)线性偏差应不超过±5% 。
糖化血红蛋白测定试剂盒综述资料

糖化血红蛋白测定试剂盒(胶乳免疫比浊法)
综述资料
目录
目录 (1)
1.产品预期用途 (1)
1.1产品预期用途 (1)
1.2与预期用途相关的临床适应症背景情况 (1)
1.3相关的临床或实验室诊断方法等 (1)
2. 产品描述 (1)
2.1技术原理 (1)
2.2主要原料及来源 (1)
2.3主要生产工艺过程 (2)
2.3.1 仪器设备 (2)
2.3.2 领料 (2)
2.3.3 R1配制 (2)
2.3.4 R2a的配制 (2)
2.3.5 R2b的配制 (3)
2.3.6 R3的配制 (3)
2.3.7 半成品检验 (3)
2.3.8 分装和密封 (3)
2.3.9 贴标 (3)
2.3.10 包装 (3)
2.3.11 成品检验 (3)
2.3.12 贮存 (3)
3. 试剂盒主要研究结果总结和评价 (3)
3.1.主要研究结果简述 (3)
3.2.试剂盒主要性能指标 (4)
3.2.1空白吸光度 (4)
3.2.2准确度评价 (4)
3.2.3分析灵敏度 (4)
3.2.4 重复性 (4)
3.2.5 批间差 (4)
3.2.6测定范围 (4)
3.2.7 相关性 (4)
3.2.8 试剂效期稳定性 (4)
3.2.9试剂开盖稳定性 (4)
4.有关生物安全性方面的说明 (4)
5.其它 (4)
5.1同类产品在国内外批准上市情况 (4)
5.2相关产品所采用的技术方法临床应用情况 (5)。
糖化血红蛋白测定试剂盒(胶乳免疫比浊法)产品技术要求完整参考版

糖化血红蛋白测定试剂盒(胶乳免疫比浊法)1范围本标准规定了糖化血红蛋白测定试剂盒的定义、产品分类、方法原理、要求、检验规则、试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
本标准适用于由本公司制备的糖化血红蛋白测定试剂盒(胶乳免疫比浊法)(以下简称试剂盒)质量检定。
该试剂盒用于体外定量测定人全血中糖化血红蛋白的含量。
临床上主要用于糖尿病的辅助诊断和血糖水平的监控。
适用于日立7600、雅培C16000、东芝(FR-120/FR-2000)、AU(480/5800)、迈瑞420、西门子2400、贝克曼DXC800 全自动生化分析仪器。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件YY/T 1227 临床化学体外诊断试剂(盒)命名GB/T 191 包装储运图示标志3定义本标准采用下列定义:3.1线性范围:是指化学反应中最低检出量与最高测定量之间的范围。
3.2单包装试剂:双试剂单包装由单瓶试剂I(R1)、试剂II(R2)组成。
3.3试剂空白吸光度:是指用蒸馏水调零的空白试剂吸光度。
3.4分析灵敏度:校准曲线的斜率。
3.5批内精密度:是指对同一份样品,用不同单包装同一批试剂,按规定的操作方法,在较稳定的条件下作20 次重复测试,所得各次结果与均值之间的符合程度。
3.6批间精密度:是指用同一份样品,用不同批试剂盒在同样条件进行测试,所得各次结果与均值之间的符合程度。
3.7准确度:是指测试值与理论值(靶值)之间的符合程度。
3.8稳定性:是指试剂盒在规定的贮存条件下、规定的有效期内的质量稳定程度。
4产品分类液体双试剂,由试剂 I(R1)、试剂 II(R2)组成,其产品规格按用户机型需要而定。
具体如5方法原理5.1检测原理本法是利用抗原抗体反应直接测定总血红蛋白(Hb)中糖化血红蛋白的百分含量的方法,因为样品中总血红蛋白(Hb)和糖化血红蛋白与胶乳有相同的非特异性吸附而固相化,当加入糖化血红蛋白的特异性单克隆抗体后形成胶乳-HbA1c-鼠抗人HbA1c 单克隆抗体的复合物,此复合物中由于羊抗鼠IgG 抗体而形成凝聚,凝聚量因胶乳表面固相化的糖化血红蛋白量的不同而不同。
糖化血红蛋白测定试剂盒(免疫比浊法)产品技术要求baiding

糖化血红蛋白测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血液中糖化血红蛋白的含量。
1.1规格校准品(选配):1mL×5。
1.2主要组成成分校准品靶值批特异,详见瓶标签。
2.1 外观2.1.1 试剂1为白色或微黄色胶乳液体,无混浊,无未溶解物。
2.1.2 试剂2为无色透明液体,无混浊,无未溶解物。
2.1.3 校准品应为无色至淡红色粉末。
2.1.4 标签内容清晰,字迹不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度A≤1.5(波长660nm,光径1cm)。
2.4 分析灵敏度测定3%的糖化血红蛋白样本,吸光度变化在0.012~0.120范围内。
2.5 线性2.5.1 [1,13]%。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.9900。
2.5.2 [1,4]%范围内,绝对偏差应不超过(0.6%);(4,13]%范围内,线性相对偏差应不超过±15%。
2.6 精密度2.6.1 批内精密度用高、中、低3个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2 批内瓶间差校准品批内瓶间差CV≤10%。
2.6.3 批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度相对偏差在±10%范围内(测试国家参考物质GBW09181、GBW09182、GBW09183)。
2.8 溯源性根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源至国家参考物质(GBW09181、GBW09182、 GBW09183)。
2.9 稳定性2.9.1 校准品复溶后2℃~8℃避光保存7天,应符合2.7要求。
2.9.2 原装试剂盒2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.3、2.4、2.5、2.6.1和2.7要求。
糖化血红蛋白测定试剂盒(胶乳免疫比浊法)产品技术要求北京瑞正善达生物
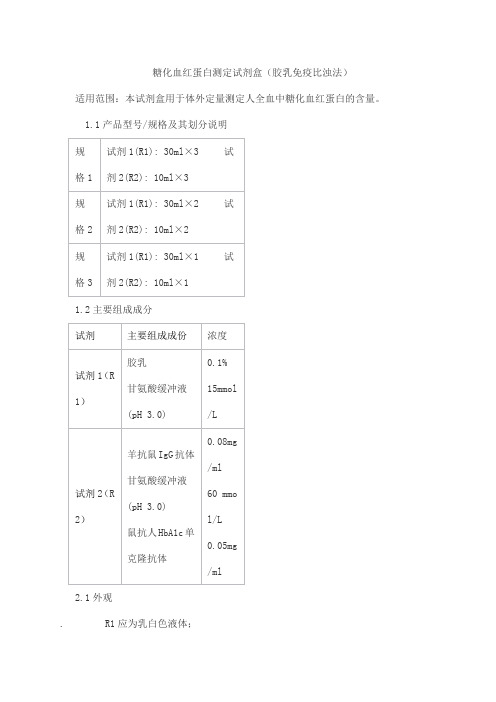
糖化血红蛋白测定试剂盒(胶乳免疫比浊法)适用范围:本试剂盒用于体外定量测定人全血中糖化血红蛋白的含量。
1.1产品型号/规格及其划分说明
1.2主要组成成分
2.1外观
.R1应为乳白色液体;
.R2应为无色透明液体;
.试剂盒标签标识清晰,外包装完整无损。
2.2 净含量
R1、R2的净含量不少于标示值。
2.3 试剂空白吸光度
在主波长660nm,副波长800nm处(光径1cm)试剂空白吸光度A≤1.00。
2.4分析灵敏度
测定1%的被测物时,吸光度变化率△A≥0.004。
2.5 线性区间
在[2,14]%线性范围内,线性相关系数r≥0.990。
在[2,14]%线性范围内,相对偏差不超过±15%。
2.6 精密度
2.6.1 重复性
用HbA1c试剂盒重复测定2个浓度的样品,其测定值的变异系数(CV%)≤5%。
2.6.2 批间差
三批HbA1c试剂盒的批间差≤5%。
2.7 准确度
用本公司HbA1c试剂盒和比对方法HbA1c试剂盒同时测定40例不同浓度的血样本,两试剂相关系数r≥0.975,每个浓度点的相对偏差不超过±15%。
2.8 稳定性
原包装的试剂盒在(2~8)℃避光保存,有效期为12个月。
试剂盒在规定的储存条件下保存至有效期满后,检测2.3、2.4、2.5、2.6.1、2.7项,结果应符合各项目的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【产品名称】糖化血红蛋白检测试剂盒(高压液相免疫荧光色谱法)
通用名称:糖化血红蛋白检测试剂盒
商品名称:魁星I号
英文名称:Quo-test A1c Reagent Kit
【包装规格】15人份/盒
【预期用途】Quo-Test魁星一号高压液相免疫荧光色谱检测仪和糖化血红蛋白检测试剂盒仅限于体外定量检测全血(指血或静脉血)中的糖化血红蛋白含量。
该检测系统用于检测糖尿病和监测糖尿病人一段时间的血糖控制情况。
高水平的糖化血红蛋白浓度指示血糖失控。
【检验原理】Quo-Test™ A1C使用的是高压液相免疫荧光色谱检测技术。
当全血标本加入Quo-Test 糖化血红蛋白检测芯片后,把检测芯片放入分析仪,通过高压将红细胞被破坏释放出血红蛋白,缓冲液里的反应成分和糖化血红蛋白免疫结合,然后这个结合体通过荧光色谱检测分析,4分钟后,检测结果会显示在屏幕上。
Quo-Test A1C结果都是跟DCCT/NGSP标准一致的,因此Quo-Test A1C与各实验室的检测结果均具有可比性。
【主要组成成份】15个铝箔独立包装的检测芯片(包含样本采集器)
l 检测芯片里的反应物包括:
l 硼化荧光反应物
l 塑料玻璃管包含醋酸铵缓冲液,溶解物和叠氮化钠(< 0.1%)
l 样本采集器内含EDTA和表面活性剂
1个定标信息卡(盒盖上标有CAL字样)
1个简便使用手册
1个使用说明书
(采血针需另购)
【储存条件及有效期】Quo-Test™糖化血红蛋白检测芯片应保存在 2至 8℃ (35º至 47ºF)环境中,使用之前必须在室温中平衡至少半小时。
产品的有效期打印在检测芯片包装外,检测芯片必须在有效期内使用。
有效期:9个月
【适用仪器】Quo-Test糖化血红蛋白检测试剂盒仅可用魁星一号高压液相免疫荧光色谱检测仪进行定量检测。
【样本要求】
l 标本收集和预处理
用采血针刺破手指,挤出一滴适合检测用量的血液,然后使用检测芯片包装中的样本采集器参照简便用户指南中方法吸取样本。
l 用静脉血标本进行Quo-Test糖化血红蛋白的检测
按照以下的操作步骤进行静脉血样本(EDTA抗凝)的检测。
静脉血标本可在冰箱中保存十天。
如果标本保存在冰箱中,使用前请将其恢复到室温,并且确定其已经完全融化。
使用吸管吸取至少10微升的血液到一表面(不会渗透进去)。
使用样本采集器吸取样本。
按照正常操作步骤进行检测芯片的检测。
【检验方法】
操作前准备
1、开机后当“Quo-Test”的logo(图像)和日期显示在显示屏上时即可进行试验操作。
将条形码扫描仪贴近条形码卡,按下按钮直到听到一声蜂鸣为止。
(只有在使用一个新批号好的试剂盒前,才需要用条形码扫描仪进行扫描试剂盒内侧的条形码,以进行校准信息的读取。
)
2、如果试剂盒保存在室温中,可直接取出使用。
如果保存在冰箱中,需将其放置在室温中平衡30分钟。
标本采集器也包含在铝箔袋中。
3、用采血针刺破手指,挤出一滴血,吸满整个标本采集器后将标本采集器完全插入到检测芯片。
检测运行
1、打开检测舱门,将检测芯片放入到检测孔中,并朝您身体方向拉动红色滑轨。
关上检测舱门,仪器将自动进行检测。
2、试验结束后检测结果将自动显示在显示屏上。
打开检测舱的门,朝身体的另一方向推进红色滑轨,取出检测芯片,关闭检测舱门。
检测结果
检测结束后,检测结果将自动显示在仪器显示屏上。
检测结果打印(如配有选配件打印机)
如果仪器和打印机相连接,当检测结束后结果将自动打印出来。
结果将打印在胶粘标签上,以方便结果保存。
【参考值(参考范围)】正常人的糖化血红蛋白浓度比值一般为4-6%。
【检验结果的解释】美国糖尿病协会认为<7%是糖尿病控制有效和并发症发生率最低的目标值。
高于7%则提示需要进行高强度的糖尿病治疗管理。
一个合格的医生应该可以正确指导病人控制血糖水平。
【注意事项】
l 该试剂盒仅使用于体外诊断
l 不能用于人体内或动物体内
l 试验完成后,检测芯片等相关物品应小心安全处理。
l 如果试验仓所有的孔、硅胶有出现扭曲变形,那么检测芯片将不能使用。
如果在显示屏上出现有错误信息提示,请按照简便使用指南上的故障排除方法进行解决或致电我公司技术支持00441932220124,该热线的工作时间为周一至周五上午八点到下午五点(英国当地时间)
【参考文献】
1. The Diabetes Control and Complications Trial Research Group. N Engl J Med 1993;
329:977–986.
2. Standards of Medical Care in Diabetes (2008). Recommendations of the American Diabetes Association. Diabetes Care. 31:S12-S34. 2008.
3. Defining the Relationship Between Plasma Glucose and HbA1c: Analysis of glucose profiles and HbA1c in the Diabetes Control and Complications Trial. Curt L. Rohlfing, Hsiao-Mei Wiedmeyer, Randie R. Little, Jack D. England, Alethea Tennill, and David E. Goldstein.
Diabetes Care 25: 275-278.
4. United Kingdom Prospective Diabetes Study Group. Lancet 1998; 352: 837–853. 【生产企业】
Quotient Diagnostics Ltd, Unit 3b, First Floor, Russell Road, Walton on Thames, KT12 3PE, United Kingdom.
电话: +44 (0)1932 220 124
传真: +44 (0)1932 250 266。
