(新)湖北省武汉市2017届高三化学五月模拟考试试题
湖北省武汉市2022届高三化学5月全仿真模拟考试试题(一)

湖北省武汉市2022届高三化学5月全仿真模拟考试试题(一)本试卷共6页,全卷满分100分。
考试时长:75分钟可能用到的相对原子质量: N:14O:16Na:23 Si:28 Cl:35.5 Mn:55一、选择题:本题共15小题,每题3分,共45分。
1.化学与生活、科技、社会发展息息相关。
下列有关说法错误的是A.“天和”核心舱电推进系统中的霍尔推进器腔体,使用的氮化硼陶瓷基复合材料属于新型无机非金属材料B.2021年我国科学家在实验室中首次成功实现二氧化碳人工合成淀粉,这项技术有利于实现“碳中和”C.冬奥火炬“飞扬”将碳纤维与高性能树脂结合在一起做成碳纤维复合材料,碳纤维和树脂都是有机高分子材料D.奥密克戎是新冠病毒变异株,传播性强,其成分中含有蛋白质,属于高分子化合物2.为阿伏加德罗常数的值,下列说法正确的是A.标准状况下,分子数为B.XeF2分子中价层电子对数为5N AC.的盐酸中,数目为D.晶体中的数目为3. 下列指定反应的离子方程式正确的是A. CO2通入足量的NaClO溶液中:CO2+2ClO−+H2O=2HClO+COB. 用惰性电极电解CuCl2水溶液:2Cl−+Cu2++2H2O Cu(OH)2↓+Cl2↑+H2↑C. 用Na2SO3溶液吸收少量Cl2:3SO+Cl2+H2O=2HSO+2Cl−+SOD. 用高锰酸钾标准溶液滴定草酸:2MnO+5C2O+16H+=2Mn2++10CO2↑+8H2O4.下列化学用语使用正确的是A.的系统命名:1,3-二丁烯B.过氧化氢的电子式:C.As原子的简化电子排布式:D.CO(NH2)2的球棍模型:5.2022年4月,世卫组织专家评估报告指出:中成药连花清瘟能有效治疗新冠病毒。
连花清瘟由于含“连翘”、“金银花”而得名。
其有效成分绿原酸的结构简式如图,下列有关绿原酸说法正确的是A.分子式为C16H14O9B.分子中最多有8个碳原子共面C.可与NaHCO3溶液反应放出CO2D.1mol该分子最多可与6mol H2发生加成反应6.M、X、Y、Z、W均为短周期元素,且原子序数依次减小,并能形成如图所示化合物,下列说法正确的是A.简单离子半径:B.简单氢化物的稳定性:C.X与W形成的某种化合物具有漂白性,可使酸性高锰酸钾溶液褪色D.由M、X、Z、W四种元素组成的化合物的水溶液可能显碱性7.在双金属催化中,双金属之间的协同作用使其有远优于单金属催化剂的催化性能。
2025届上海市延安中学化学高三第一学期期中达标检测模拟试题含解析

2025届上海市延安中学化学高三第一学期期中达标检测模拟试题考生请注意:1.答题前请将考场、试室号、座位号、考生号、姓名写在试卷密封线内,不得在试卷上作任何标记。
2.第一部分选择题每小题选出答案后,需将答案写在试卷指定的括号内,第二部分非选择题答案写在试卷题目指定的位置上。
3.考生必须保证答题卡的整洁。
考试结束后,请将本试卷和答题卡一并交回。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、物质的量相同的N2、O2、CO2混合后,通过Na2O2颗粒一段时间,测得体积变为原混合气体体积的8/9(同温同压下),此时N2、O2、CO2的物质的量之比为A.1∶1∶0 B.6∶9∶0 C.3∶4∶1 D.3∶3∶22、短周期主族元素x X、y Y、z Z、w W、m M原子序数依次增大,X和W、Z和M同主族。
其中Y元素的单质通常状况下呈气态,W元素原子半径是所在周期元素里原子半径最大的,且x+y=z=1/2m。
下列有关说法正确的是A.简单离子半径大小:Z<Y<W B.W、M组成的化合物中可能含有非极性键C.简单氢化物在水中的溶解度大小:Y<M D.X、Y、M组成的化合物一定是共价化合物3、元素的原子结构决定其性质和周期表中的位置。
下列说法正确的是A.元素原子的最外层电子数等于元素的最高化合价B.多电子原子中,在离核较近的区域内运动的电子能量较高C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素4、近几年来,雾霾天气已经严重影响了人们的日常生活。
为达成“同呼吸,共奋斗”全国各地为治理雾霾广泛开展了一系列活动。
下列活动不符合这一主题的是()A.机动车实行限行措施是减少雾霾的途径之一B.积极推广风能、太阳能、氢能等新型能源的使用C.通过吸收空气中CO2并利用廉价能源合成汽油D.将秸秆焚烧可得富含钾肥的草木灰,焚烧是一种较为理想的秸秆处理办法5、《本草经集注》记载:“鸡屎矾(碱式硫酸铜或碱式碳酸铜)不入药用,惟堪镀作,以合熟铜;投苦酒(醋)中,涂铁皆作铜色,外虽铜色,内质不变”。
2017届高三化学百所名校好题分项解析专题汇编:化学实验基础(2)含解析

2017届高三化学百所名校好题分项解析专题汇编:
化学实验基础(2)
(解析版)
1.【百强校·2016届沙市长郡中学上学期第四次月考】2015年8月12日天津港瑞海公司危险化学品仓库发生特大火灾爆炸事故,事故警示我们,化学药品的安全存放是非常重要的。
下列有关化学药品的存放说法不正确的是()
A.液溴易挥发,应用少量的水液封并放在冷暗处保存
B.硝酸见光易分解、易挥发,应用棕色广口试剂瓶密封保存
C.金属钠遇到氧气和水均立即反应,应保存在煤油中或者液体石蜡里
D.碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存
【答案】B
2.【百强校·2016届沙市长郡中学上学期第四次月考】下列实验与对应结论正确的是()
【答案】A
3.【百强校·2016届泰州中学上学期第二次质量检测】关于下列各实验装置的叙述中,不正确的是()
A.图①可用于实验室制取少量NH
3或O
2
B.可用从a处加水的方法检验图②装置的气密性
C.实验室可用图③的方法收集H
2或NH
3
D.利用图④装置制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜【答案】D。
湖北省武汉市2014届高三5月模拟考试化学试卷 有答案

武汉市2014高三五月模拟(一)化学试卷有答案可能用到的相对原子质量:H—1 C—12 N—14 Na—23 O—16 Al—23 S—32 Fe—56 Cu —647.化学与人类生产、生活、社会可待续发展密切相关。
下列说法正确的是()A.减少CO2的排放,可以减少酸雨的产生B.减少SO2的排放,可以从根本上消除雾霾C.“天宫一号"使用的碳纤维,是一种新型有机高分子材料D.用CO2合成聚碳酸酯可降解塑料,可以实现“碳"的循环利用8.用下列实验装置进行相应实验,能达到实验目的的是()A.用图l所示装置可收集NO气体B.用图2所示装置可吸收多余氨气且能防止倒吸C.用图3所示装置可实现反应:Cu+2H2O Cu(OH)2+H2↑D.用图4所示装置可分离乙醇(沸点:78.4℃)与二甲醚(沸点:24.9℃)的混合物9.分子式为C10H12O2的有机物,满足以下两个条件:①苯环上有两个取代基;②能与NaHCO3溶液反应生成气体。
满足条件的该有机物的同分异构体共有()A.9种B.12种C.15种D.18种10.已知甲、乙、丙、丁之间的转化关系如图所示。
下列说法正确的是()A.若甲为Fe,丁为氢气,则乙一定为酸B.若甲、丁为化合物,乙为水,则丙一定是气体单质C.若甲、乙、丙、丁均为化合物,则该反应一定属于复分解反应D.若甲、乙、丙、丁均为10电子微粒,且丙是可使湿润的红色石蕊试纸变蓝的气体,则丁在常温常压下呈液态11.下列实验设计及其对应的离子方程式均正确的是()A.制备Fe(OH)3胶体的反应:Fe3++3H2O Fe(OH)3(胶体)+3 H+B.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4—+6H++5H2O2 = 2Mn2++5O2↑+8H2OC.将氯气溶于水:C12+H2O = 2H++Cl—+ClO—D.用稀氢氧化钠溶液吸收二氧化氮尾气:2OH—+2NO2 = NO3—+NO+H2O12.实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程(Fe3+在pH=5时已完全沉淀)。
湖北省2017届高三4月调研考试理综化学试题Word版含答案

可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Zn-657.化学与社会、生活密切相关,下列说法正确的是A.海水淡化的方法有蒸馏法、离子交换法、电渗析法等B.明矾水解时能生成具有吸附性的胶体粒子,故可用于消毒杀菌C.Ba2+对人体无毒,故BaSO4在医学上可用作“钡餐”D.与铜质水龙头连接处的铜质水管不易发生腐蚀8.下列关于有机物的叙述正确的是A.乙烯和苯都能使溴水褪色,且褪色的原理相同B.分子式为C2H4O2,能与NaOH溶液反应的有机物一定是乙酸C.油脂和纤维素都是能发生水解反应的高分子化合物D.甲烷、苯、乙醇、乙酸和乙酸乙酯都可以发生取代反应9.中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是A.若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-△Mn2++Cl2↑+2H2OB.若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-C.若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO ↑+2H2OD.当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为CO32-+2H+=CO2↑+H2O10.设NA表示阿伏加德罗常数的值,下列说法正确的是A.25 ℃时,1 LpH = l的硫酸溶液中,含有H+的数目为0.2NAB.1 mol Na2O2与水完全反应时转移电子数目为2 NAC.向含1 mol Cl-的NH4Cl溶液中加入氨水使溶液呈中性,此时溶液中NH4+数目为NAD.向2 mL0.5 mol/L硅酸钠溶液中滴入过量盐酸制硅酸胶体,所得胶粒数目为0.001 NA11.下列实验中,对应的现象以及解释或结论都正确,且两者具有因果关系的是选项实验现象结论或解释A 将0.1 mol·L-1MgSO4溶液滴入过量NaOH溶液,再滴加几滴0.1 mol·L-1CuSO4溶液先有白色沉淀生成,后有蓝色沉淀生成Ksp[Cu(OH)2]<Ksp[Mg(OH)2]B 将一片铝箔置于酒精灯外焰上灼烧铝箔熔化但不滴落下来铝箔表面有致密Al2O3薄膜,Al2O3且熔点高于AlC 向新收集的酸雨中滴加硝酸钡溶液产生白色沉淀酸雨中一定含有SO42-D 取久置的Na2O2粉末,向其中滴加过量的盐酸产生无色气体Na2O2没有变质12.一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl)。
湖北省武汉市2024届高三下学期三模考试语文试题含答案

武汉2024届高三5月模拟考试(三)语文试题(答案在最后)★禹门已准桃花浪月殿先收桂子香★命题学校:考试时间:2024年5月30日9:00—11:30 试卷满分:150分一、现代文阅读(35分)(一)现代文阅读Ⅰ(本题共5小题,18分)阅读下面的文字,完成1~5题。
材料一:我们似乎普遍对AI技术的可能性超越具有一种令自己都会不安的信心..。
一旦人工智能跨越自身技术发展的决定性门槛,会不会反客为主,成为影响人类社会的超越性力量?就文生视频模型Sora所生成的几个视频来看,它具有强烈的传统延续性,从西方文艺复兴之后遵循着透视法原则的绘画,到近代摄影技术以及电影工业的诞生。
在某种程度上,Sora的工作再现了经过漫长时间积累与创造后所形成的电影工业中的核心部分,即从剧本到影像化这一过程。
因此这些视频似乎都有一种强烈的“电影感”。
Sora依旧遵循当下AI技术最核心的模式,即建立在广泛的数据学习与模拟之上。
其新颖之处就在于它得以脱离人类曾经需要付出众多准备和劳动才能完成的过程。
强大的数据库及其学习能力,使得它在未来几乎能够影视化所有人类通过语言描述而想象的场景或情节片段,在某种程度上它将能够使每个人都成为“导演”。
Sora的强大在于对物理世界的再现,这不仅包括具体的时空特色,如日本东京街头,还包括对于角色形象的精细再现,甚至连她脸上的瑕疵都纤毫毕露,并表达出某种感情样态。
我们或许可以说,一大部分的影视作品都将遭到淘汰,或以更加完美的方式被呈现出来。
另一方面,有一些影视作品或许始终是Sora生成视频无法取代的,即那些有着强烈导演色彩的电影、有着精彩表演的作品以及那些涉及人类具体的处境以及对其进行反思的影视。
即使是纪录片,对于物理世界的展现背后也有一双人的眼睛以及提前的设计,它是作为某种“想法”而诞生的被剪辑的作品;而对于像电影这类形式,它们往往依赖于演员的表演而实现某种目的或传达某种思想。
归根到底,它是“人”的作品,因此它必然具有强烈的“人性”或者说人的色彩。
2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)(解析版)
2023年高三化学对接新高考全真模拟试卷(八)(云南,安徽,黑龙江,山西,吉林五省通用)(考试时间:50分钟 试卷满分:100分)注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回可能用到的相对原子质量:H 1 Li7 C12 N14 O16 Na 23 Mg 24 Al 27 P 31 S 32 Cl 35.5 K39 Ca 40 Cr52 Fe 56 Cu 64 Zn 65 Ag 108 I 127 Ba 137一、选择题:本题共7个小题,每小题6分。
共42分,在每小题给出的四个选项中,只有一项是符合题目要求的。
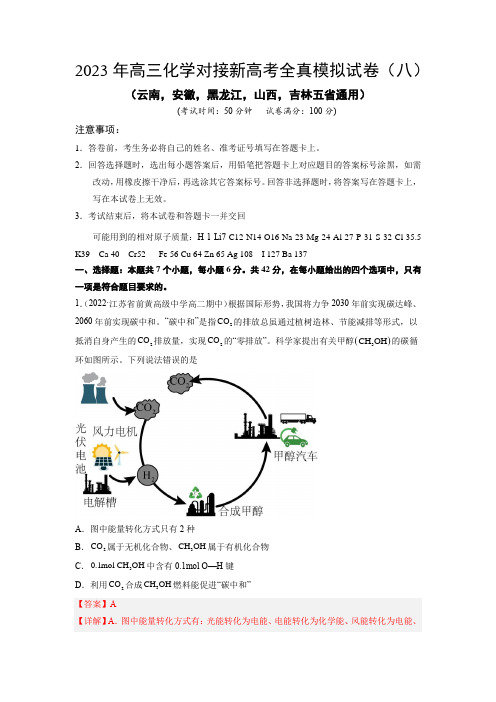
1.(2022·江苏省前黄高级中学高二期中)根据国际形势,我国将力争2030年前实现碳达峰、2060年前实现碳中和。
“碳中和”是指2CO 的排放总虽通过植树造林、节能减排等形式,以抵消自身产生的2CO 排放量,实现2CO 的“零排放”。
科学家提出有关甲醇()3CH OH 的碳循环如图所示。
下列说法错误的是A .图中能量转化方式只有2种B .2CO 属于无机化合物、3CH OH 属于有机化合物C .30.1mol CH OH 中含有0.1mol O—H 键D .利用2CO 合成3CH OH 燃料能促进“碳中和” 【答案】A【详解】A .图中能量转化方式有:光能转化为电能、电能转化为化学能、风能转化为电能、化学能转化为热能等,A 错误;B .有机物为除一氧化碳、二氧化碳、碳酸、碳酸盐以外的含碳化合物;2CO 属于无机化合物、3CH OH 属于有机化合物,B 正确;C .1分子甲醇中含有1个O -H 键,则30.1mol CH OH 中含有0.1mol O—H 键,C 正确;D .利用2CO 合成3CH OH 燃料可以充分利用二氧化碳资源,能促进“碳中和”,D 正确; 故选A 。
“七彩阳光”新高考研究联盟2017届高三上学期考试化学试题 含解析

考生须知:1.本试题卷分选择题和非选择题两部分,满分100分,考试时间90分钟。
其中加试题部分为30分,2.考生答题前,务必将自己的姓名、准考证号用黑色字迹的签字笔或钢笔填写在答题纸上。
3.选择题的答案须用2B铅笔将答题纸上对应题目的答案标号涂黑,如要改动,须将原填涂处用橡皮擦净。
4.非选择题的答案须用黑色字迹的签字笔或钢笔写在答题纸上相应区域内,答案写在本试题卷上无效。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56选择题部分一、选择题(本大题共25小题,每小题2分,共50分。
每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)1.下列化合物中,属于碱的是A.MgO B.SO2C.H2SO4 D.Ca(OH)2【答案】D【解析】试题分析:根据酸、碱、盐、氧化物的定义,MgO和SO2是氧化物,H2SO4溶于水电离出的阳离子只有H+,属于酸,Ca(OH)2溶于水电离出的阴离子只有OH-,属于碱,答案选D。
考点:考查物质的分类.2.仪器名称为“分液漏斗”的是【答案】D【解析】试题分析:根据仪器的特征,A为量筒,B为容量瓶,C为蒸馏烧瓶,D为分液漏斗,答案选D考点:考查化学实验仪器3.下列物质属于电解质的是A.石墨B.液态HCl C.葡萄糖D.Na2CO3溶液【答案】B【解析】试题分析:A.石墨属于单质,既不是电解质,也不是非电解质,A项错误;B.液态HCl溶于水能电离出离子,属于电解质,B项正确;C.葡萄糖溶于水不电离,属于非电解质,C项错误;D.碳酸钠溶液属于混合物,既不是电解质,也不是非电解质,D项错误;答案选B。
考点:考查电解质、非电解质的判断。
4.反应Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O中,还原产物是A.CuSO4B.H2SO4C.H2O D.SO2【答案】D【解析】试题分析:在反应Cu +2H 2SO 4(浓)△CuSO 4+SO 2↑+2H 2O 中,铜元素的化合价由0价升高到+2价,铜为还原剂,硫酸铜为氧化产物,硫元素由+6价降低到+4价,硫酸是氧化剂,SO 2是还原产物,答案选D 。
2017届湖北省襄阳市致远中学高三9月月考化学试题
2017届湖北省襄阳市致远中学高三9月月考化学试题总分100分第Ⅰ卷选择题(1-15每题2分,16-25每题3分共60分)一、选择题(每小题只有1个选项符合题意。
)1.设N A为阿伏加德罗常数的数值.下列说法正确的是()A.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去N A个电子B.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5N AC.标准状况下,22.4L氨水含有N A个NH3分子D.56g铁片投入足量浓H2SO4中生成N A个SO2分子2.下列除去杂质的方法正确的是()A.除去乙烷中少量的乙烯:通过酸性KMnO4溶液进行分离B.除去溴苯中少量的溴,可用苯进行洗涤、分液C.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液,然后干燥、蒸馏D.除去氯气中少量的氯化氢,通过NaOH溶液进行分离3.下列装置或操作正确且能达到实验目的的是()A.答案A B.答案B C.答案C D.答案D4.分离汽油和氯化钠溶液的混合液体,应用下列哪种分离方法()A.蒸发B.过滤C.萃取D.分液5.为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是()A.Na2CO3溶液(NaHCO3):加入适量的NaOH溶液B.NaHCO3溶液(Na2CO3):通入过量的CO2气体C.Na2O2粉末(Na2O):将混合物在O2中加热D.Na2CO3溶液(Na2SO4):加入适量的Ba(OH)2溶液,过滤6.下列关于“物质的量”“摩尔”和“摩尔质量”的叙述中正确的是()A.物质的摩尔质量等于其相对分子(原子)质量B.“物质的量”是国际单位制中的一个基本单位C.0.012 kg12C中所含的碳原子数为N AD.1 mol任何物质都含有约6.02×1023个分子7.下列溶液中的Cl-物质的量与100 mL 1 mol·L-1AlCl3溶液中Cl-物质的量相等的是()A.150 mL 1 mol·L-1NaCl溶液B.100 mL 3 mol·L-1KClO3溶液C.75 mL 2 mol·L-1MgCl2溶液D.50 mL 1 mol·L-1FeCl3溶液8.下列所得溶液的物质的量浓度等于0.1 mol·L-1的是()A.将0.1 mol氨充分溶解在1 L水中B.将10 g质量分数为98%的硫酸与990 g水混合C.将8 g三氧化硫溶于水并配成1 L溶液D.将0.1 mol氧化钠溶于水并配成1 L溶液9.某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42﹣的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为()A.11.2 g B.16.8 g C.19.6 g D.22.4 g10.将物质分门别类,更有利于物质的研究。
20162017学年度武汉市部分学校新高三起点调研测试化学试卷

2016~2017学年度武汉市部分学校新高三起点调研考试化学试卷参考答案一、选择题(本大题共14小题,每小题3分,共42分) 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 答案DCBACBBDDBADCC(一)必考题(本题包括5小题,共43分) 15.(7分) (1)(1分)(2)H 2O 2HO 2-+ H + (2分)(3)C 2H 6(g) + 7/2 O 2(g) === 2 CO 2(g) + 3H 2O(l) ΔH = -6Q kJ/mol (2分) (4)有机溶剂、灭火剂 (2分 合理的均给分) 16.(8分)(1)ClO 2(2分)(2)2ClO 2 + H 2O 2 + 2OH —=== 2 ClO 2-+ O 2 ↑ + 2 H 2O (2分) (3)① 过滤 (1分)② 用带火星木条接触该气体,看木条是否复燃。
(1分)③ K 2FeO 4在0℃时的溶解度比Na 2FeO 4、NaOH 、KOH 、Na 2SO 4均小 (2分)17.(9分)(1)>(1分) >(1分) 较高(1分)(2)①K 1= K 3 / K 2(1分) ②<(1分) 5×10ˉ10(2分) (3)使溶液中OH —浓度减小,平衡向生成CaWO 4方向移动 (2分) 18.(11分)(1)SO 2 + V 2O 5===SO 3 + 2VO 2 (2分) 4VO 2 + O 2===2V 2O 5 (2分) (2)27.3 (2分)(3)①参与正极反应(1分) 通过交换膜定向移动平衡两池溶液中的电荷(1分)②蓝色变为黄色 (1分) VO 2+ + H 2O -e —===VO 2++ 2H + (2分)19.(8分)(1)吸收分解产生的酸性气体(1分) 溶液变红(1分) (2)① D 、H 、G 、F (2分)② SO 3(1分) G 中有白色沉淀 (1分)(3)取少量固体于试管中,加入适量稀硫酸溶解,分成两份。
2020高考化学考点剖析 元素金属性的比较(解析版)

考点元素金属性的比较1.[2019北京]2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。
中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
铟与铷(37Rb)同周期。
下列说法不正确的是A.In是第五周期第ⅢA族元素B.11549In的中子数与电子数的差值为17C.原子半径:In>AlD.碱性:In(OH)3>RbOH【答案】D【解析】A.根据原子核外电子排布规则,该原子结构示意图为,因此In位于元素周期表第五周期第IIIA族,故A不符合题意;B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数,因此该原子的质子数=电子数=49,中子数为115-49=66,所以中子数与电子数之差为66-49=17,故B不符合题意;C.Al位于元素周期表的三周期IIIA族,In位于元素周期表第五周期IIIA族,同主族元素的原子,从上到下,电子层数逐渐增多,半径逐渐增大,因此原子半径In>Al,故C不符合题意;D.In位于元素周期表第五周期,铷(Rb)位于元素周期表第五周期第IA族,同周期元素,核电荷数越大,金属性越越弱,最高价氧化物对应水化物的碱性越弱,因此碱性:In(OH)3<RbOH,故D符合题意。
2.[2017·4月浙江选考]W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是A.Z、Y、X的原子半径依次减小,非金属性依次降低B.Z、Y、W的最高价氧化物的水化物的酸性依次降低C.WH4与Z元素的单质在一定条件下可发生化学变化D.W的位置是第2周期、第ⅣA族【答案】A【解析】本题为容易题。
熟记短周期元素种类,牢记元素周期律中原子半径、非金属性和金属性、最高价氧化物的酸性变化规律,易选出A选项错误。
C选项CH4和Cl2光照条件下可以发生取代反应。
元素金属性强弱判断依据1. 根据常见金属活动性顺序表判断金属元素的金属性与金属单质的活动性一般是一致的,即越靠前的金属活动性越强,其金属性越强。
高中化学考点37 化学平衡的移动(原卷版)

(3)研究发现:浸出液中含银化合物总浓度与含硫化合物总浓度及浸出液pH的关系如下图。
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是_________。
A.平衡常数大小:KM>KN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
(2)某温度下,等物质的量的碘和环戊烯( )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体B.提高温度
A.反应I2(aq)+I-(aq) I3-(aq)的ΔH>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入CCl4,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
2.(湖南省长沙市长郡中学2019届高三上学期第五次调研考试)如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
湖北省黄冈中学2017届高三5月第二次模拟考试理综化学试题含答案

可能用到的相对原子质量:H—1 C—12 N-14 O-16 F—19 K-39 Ca—40第Ⅰ卷一、选择题(本题共7小题,每小题6分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的.)7.化学与生活密切相关,下列有关说法错误的是( )A.用菜籽油浸泡花椒制得花椒油的过程主要利用其物理性质B.卤水点豆腐是Mg2+、Ca2+等使蛋白质胶体发生聚沉的过程C.热的纯碱溶液可用于除去金属表面的矿物油(如机油、润滑油等)D.亚硝酸钠易致癌,但火腿肠中允许含少量的亚硝酸钠以保持肉质新鲜8.四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是常见大气污染物。
下列有关判断不正确的是( )A.简单氢化物的热稳定性:C<A B.A、C、D的含氧酸的钠盐水溶液均显碱性C.单质B可用于铁轨的焊接D.最高价氧化物对应水化物的酸性:D>C9.三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成"而获得2016年诺贝尔化学奖。
纳米分子机器日益受到关注,机器的“车轮”常用组件如下,下列说法正确的是()①(三碟烯)②(扭曲烷)③(富勒烯)④(金刚烷)A.①③均能发生加成反应B.②④互为同系物C.①②③④均属于烃D.①②④的一氯代物均只有两种10.利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。
制备流程图如下:己知:Zn及其化合物的性质与Al及其化合物的性质相似。
下列相关说法错误的是()A.用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层B.调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnOC.由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化D.Fe3O4胶体粒子能用减压过滤法实现固液分离11.下列有关实验原理或操作正确的是()A.图1所示的装置可用于干燥、收集并吸收多余的氨气B.用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀C.图3所示装置用于Cu和浓H2SO4反应制取少量的SO2气体D.图4所示装置用于除去碳酸氢钠固体中的少量碳酸钠12.常温下,向10mL0。
河北省衡水市第二中学2024届高三高考模拟一数学试题(含答案解析)

河北省衡水市第二中学2024届高三高考模拟一数学试题学校:___________姓名:___________班级:___________考号:___________一、单选题1.已知集合{}2120,{23},P xx x Q x m x m P Q =--≤=≤≤-=∅ ∣∣,则实数m 的取值范围是().A .{0m m <∣或4}m >B .{04}m m <<∣C .{3mm <∣或4}m >D .{34}mm <<∣2.某同学统计最近5次考试成绩,发现分数恰好组成一个公差不为0的等差数列,设5次成绩的平均分数为x ,第60百分位数为m ,当去掉某一次的成绩后,4次成绩的平均分数为y ,第60百分位数为n .若y x =,则()A .m n >B .m n=C .m n<D .m 与n 大小无法判断3.吹气球时,气球的体积V (单位:L )与半径r (单位:dm )之间的关系是343V r π=.当4L 3V π=时,气球的瞬时膨胀率为()A .1dm /L 4πB .1dm /L3C .3L /dmD .4L /dmπ4.设实数x ,y 满足22154x y +=)A .B .2-C .D .前三个答案都不对5.记数列{}n a 的前n 项和为n S ,设甲:{}n a 是公比不为1的等比数列;乙:存在一个非零常数t ,使1n S t ⎧⎫+⎨⎬⎩⎭是等比数列,则()A .甲是乙的充要条件B .甲是乙的充分不必要条件C .甲是乙的必要不充分条件D .甲是乙的既不充分也不必要条件6.六氟化硫,化学式为6SF ,在常压下是一种无色、无臭、无毒、不燃的稳定气体,有良好的绝缘性,在电器工业方面具有广泛用途.六氟化硫分子结构为正八面体结构(正八面体每个面都是正三角形,可以看作是将两个棱长均相等的正四棱锥将底面粘接在一起的几何体).如图所示,正八面体E ABCD F --的棱长为a ,下列说法中正确的个数有()①此八面体的表面积为2;②异面直线AE 与BF 所成的角为45 ;③此八面体的外接球与内切球的体积之比为④若点P 为棱EB 上的动点,则AP CP +的最小值为.A .1个B .2个C .3个D .4个7.在ABC V 中,2AB AC =,AD 是A ∠的平分线,交BC 于点D ,且AC tAD =,则t 的取值范围是A .3,4⎛⎫+∞ ⎪⎝⎭B .3,14⎛⎫⎪⎝⎭C .1,2⎛⎫+∞ ⎪⎝⎭D .1,12⎛⎫⎪⎝⎭8.已知,,(1,)a b c ∈+∞,且e 9ln11,e 10ln10,e 11ln 9a b c a b c ===,则,,a b c 的大小关系为()A .a b c >>B .c a b >>C .b c a>>D .c b a>>二、多选题9.下列四个命题正确的是()A .若1i 1z +-=,则1i z --的最大值为3B .若复数12,z z满足12122,2,1z z z z ==+=,则12z z -=C .若()sin sin C A AB A AB B AC C P λλ⎛⎫ ⎪=+∈ ⎪⎝⎭R,则点P 的轨迹经过ABC V 的重心D .在ABC V 中,D 为ABC V 所在平面内一点,且1132+= AD AB AC ,则16BCD ABDS S =△△10.由倍角公式2cos 22cos 1x x =-可知,cos 2x 可以表示为cos x 的二次多项式.一般地,存在一个()*n n ∈N 次多项式()110n n n n n P t a t a t a --=+++ (0a ,1a ,…,n a ∈R ),使得()cos cos n nx P x =,这些多项式()n P t 称为切比雪夫(P .L .Tschebyscheff )多项式.运用探究切比雪夫多项式的方法可得()A .()3343P t t t=-+B .()424881P t t t =-+C.1sin 544+︒=D.1cos546︒=11.已知n S 是数列{}n a 的前n 项和,且21n n S S n +=-+,则下列选项中正确的是().A .121n n a a n ++=-(2n ≥)B .22n n a a +-=C .若10a =,则1004950S =D .若数列{}n a 单调递增,则1a 的取值范围是11,43⎛⎫- ⎪⎝⎭三、填空题12.已知:平面l αβ= ,A l ∈,B l ∈,4AB =,C β∈,CA l ⊥,3AC =,D α∈,DB l ⊥,3.DB =直线AC 与BD 的夹角是60︒,则线段CD 的长为.13.数列{}满足()2*114,13n n n a a a a n N +==-+∈,则122017111a a a +++ 的整数部分是.14.极线是高等几何中的重要概念,它是圆锥曲线的一种基本特征.对于圆222x y r +=,与点()00,x y 对应的极线方程为200x x y y r +=,我们还知道如果点()00,x y 在圆上,极线方程即为切线方程;如果点()00,x y 在圆外,极线方程即为切点弦所在直线方程.同样,对于椭圆22221x y a b +=,与点()00,x y 对应的极线方程为00221x x y y a b +=.如上图,已知椭圆C :22143x y +=,()4,P t -,过点P 作椭圆C 的两条切线PA ,PB ,切点分别为A ,B ,则直线AB 的方程为;直线AB 与OP 交于点M ,则sin PMB ∠的最小值是.四、解答题15.在数列{}n a 中,已知321212222n n a a a a n -++++= .(1)求数列{}n a 的通项公式;(2)在数列{}n a 中的1a 和2a 之间插入1个数11x ,使1112,,a x a 成等差数列;在2a 和3a 之间插入2个数2122,x x ,使221223,,,a x x a 成等差数列;…;在n a 和1n a +之间插入n 个数12,,,n n nn x x x ,使121,,,,,n n n nn n a x x x a + 成等差数列,这样可以得到新数列{}1112212233132334:,,,,,,,,,,,n n b a x a x x a x x x a a ,设数列{}n b 的前n 项和为n S ,求55S (用数字作答).16.已知椭圆2222:1(0)x y C a b a b+=>>的右焦点为F ,左顶点为A ,短轴长为点31,2⎛⎫ ⎪⎝⎭.(1)求椭圆C 的方程;(2)过点F 的直线l (不与x 轴重合)与C 交于,P Q 两点,直线,AP AQ 与直线4x =的交点分别为,M N ,记直线,MF NF 的斜率分别为12,k k ,证明:12k k ⋅为定值.17.在四棱锥P ABCD -中,底面ABCD 是边长为2的正方形,E 是BC 的中点,点F 在棱AD 上,且PA AD ⊥,2cos5PAE ∠=-,PA =(1)若平面PAB ⋂平面PCD l =,证明://l 平面ABCD ;(2)求平面PEF 与平面PCD 的夹角的余弦值的最大值.18.近年来,购买盲盒成为当下年轻人的潮流之一,为了引导青少年正确消费,国家市场监管总局提出,盲盒经营行为应规范指引,经营者不能变相诱导消费.盲盒最吸引人的地方,是因为盒子上没有标注,只有打开才会知道自己买到了什么,这种不确定性的背后就是概率.几何分布是概率论中非常重要的一个概率模型,可描述如下:在独立的伯努利(Bernoulli )试验中,若所考虑事件首次出现,则试验停止,此时所进行的试验次数X 服从几何分布,事件发生的概率p 即为几何分布的参数,记作()~X G p .几何分布有如下性质:分布列为()()11k P X k p p -==-,1,2,,,k n =⋅⋅⋅⋅⋅⋅,期望()()1111k k E X k p p p+∞-==-⋅=∑.现有甲文具店推出四种款式不同、单价相同的文具盲盒,数量足够多,购买规则及概率规定如下:每次购买一个,且买到任意一种款式的文具盲盒是等可能的.(1)现小嘉欲到甲文具店购买文具盲盒.①求他第二次购买的文具盲盒的款式与第一次购买的不同的概率;②设他首次买到两种不同款式的文具盲盒时所需要的购买次数为Y ,求Y 的期望;(2)若甲文具店的文具盲盒的单价为12元,乙文具店出售与甲文具店款式相同的非盲盒文具且单价为18元.小兴为了买齐这四种款式的文具,他应选择去哪家文具店购买更省钱,并说明理由.19.牛顿在《流数法》一书中,给出了代数方程的一种数值解法——牛顿法.具体做法如下:如图,设r 是()0f x =的根,首先选取0x 作为r 的初始近似值,若()f x 在点00(,())x f x 处的切线与x 轴相交于点1(,0)x ,称1x 是r 的一次近似值;用1x 替代0x 重复上面的过程,得到2x ,称2x 是r 的二次近似值;一直重复,可得到一列数:012,,,,,n x x x x .在一定精确度下,用四舍五入法取值,当()*1,N n n x x n -∈近似值相等时,该值即作为函数()f x 的一个零点r .(1)若32()33f x x x x =++-,当00x =时,求方程()0f x =的二次近似值(保留到小数点后两位);(2)牛顿法中蕴含了“以直代曲”的数学思想,直线常常取为曲线的切线或割线,求函数()e 3x g x =-在点(2,(2))g 处的切线,并证明:23ln31e <+;(3)若()(1ln )h x x x =-,若关于x 的方程()h x a =的两个根分别为1212,()x x x x <,证明:21e e x x a ->-.参考答案:题号12345678910答案C CACBBADABCBC题号11答案AC1.C【分析】化简集合A 后,根据P Q =∅ 分类讨论即可.【详解】由{}2120[3,4]P xx x =--≤=-∣,P Q =∅ ,当Q =∅时,需满足23m m >-,解得3m <;当Q ≠∅时,需满足34m m ≥⎧⎨>⎩,解得4m >,综上3m <或4m >.故选:C 2.C【分析】依题意不妨设这5次的分数从小到大分别为a 、a d +、2a d +、3a d +、4a d +()0,0a d >>,即可求出x 、m ,要使去掉一个数据之后平均数不变,则去掉的一定是2a d +,从而求出n ,即可判断.【详解】依题意不妨设这5次的分数从小到大分别为a 、a d +、2a d +、3a d +、4a d +()0,0a d >>,所以()123425x a a d a d a d a d a d =++++++++=+,又560%3⨯=,所以第60百分位数为23522a d a d m a d +++==+,要使4次成绩的平均分数为y 且y x =,则去掉的数据一定是2a d +,即还剩下a 、a d +、3a d +、4a d +()0,0a d >>,又460% 2.4⨯=,所以第60百分位数为3n a d =+,因为0d >,所以n m >.故选:C 3.A【分析】气球膨胀率指的是气球体积变化的值与半径变化值之间的比值,即rV∆∆,但此题所求的时瞬时变化率,故需要利用导数求解.【详解】因为343V r π=,所以r =,所以12333143r π-⎛⎫'=⨯ ⎪⎝⎭,所以,当43V π=时,12123333314313131433434344r ππππππ-⎛⎫⎛⎫⎛⎫⎛⎫'=⨯=⨯=⨯= ⎪ ⎪ ⎪ ⎪⎝⎭⎝⎭⎝⎭⎝⎭dm /L .故选:A 4.C【分析】转化为动点到两定点之间距离和,再利用焦点三角形的性质可求最小值.,点(,)P x y 是椭圆22:154x y C +=上的点,设(1,0),(1,0),(0,1)E F A -,如图.记题中代数式为M ,则||||||||||M PA PF PA PE AE =+=+≥=等号当点E ,A ,P 依次共线时取得.因此所求最小值为故选:C.5.B【分析】利用等比数列前n 项和公式,结合充分条件、必要条件的定义判断即得.【详解】设数列{}n a 的首项和公比分别为1a ,(1)≠q q ,则111n n q S a q -=⋅-,取11a t q =-,得1n n S q t +=,显然数列{1}n S t +是等比数列;反之,取1t =,0n a =,此时11n S +=,数列{1}nS t+为等比数列,而{}n a 不是等比数列,所以甲是乙的充分不必要条件.故选:B 6.B【分析】对①:计算出一个三角形面积后乘8即可得;对②:借助等角定理,找到与AE 平行,与BF 相交的线段,计算即可得;对③:借助外接球与内切球的性质计算即可得;对④:空间中的距离和的最值问题可将其转化到同意平面中进行计算.【详解】对①:由题意可得2284S =⨯=表,故①正确;对②:连接AC ,取AC 中点O ,连接OE 、OF ,由题意可得OE 、OF 为同一直线,A 、E 、C 、F 四点共面,又AE EC CF FA ===,故四边形AECF 为菱形,故//AE CF ,故异面直线AE 与BF 所成的角等于直线CF 与BF 所成的角,即异面直线AE 与BF 所成的角等于60CFB ∠=,故②错误;对③:由四边形ABCD 为正方形,有2222222AC BC AB EC AE a =+=+=,故四边形AECF 亦为正方形,即点O 到各顶点距离相等,即此八面体的外接球球心为O,半径为2aR =,设此八面体的内切球半径为r ,则有2112233E ABCD F E ABCD V S r V a ---=⨯==⨯⨯⨯表r =,则此八面体的外接球与内切球的体积之比为33R r ⎛⎫⎪⎛⎫== ⎪⎝⎭对④:将AEB 延EB 折叠至平面EBC中,如图所示:则在新的平面中,A 、P 、C 三点共线时,AP CP +有最小值,则()min 22AP CP a +=⨯=,故④错误.故选:B.【点睛】关键点点睛:本题④中,关键点在于将不共面的问题转化为同一平面的问题.7.A【解析】在ABC V 中,2AB AC =,AD 是A ∠的平分线,由角平分线性质可得2BD ABCD AC==,利用cos cos BAD CAD ∠=∠结合余弦定理化简可得22212CD AC AD =-,再代入cos CAD ∠的式子中消去CD ,通过AC tAD =,化简整理得出3cos 4CAD t∠=,即可得到t 的取值范围.【详解】在ABC V 中,2AB AC =,AD 是A ∠的平分线,∴由角平分线的性质可得2BD ABCD AC==,BAD CAD ∠=∠,在ABD △中,由余弦定理得222cos 2AB AD BD BAD AB AD +-∠=⋅,在ACD 中,由余弦定理得222cos 2AC AD CD CAD AC AD +-∠=⋅,∴22222222AB AD BD AC AD CD AB AD AC AD+-+-=⋅⋅,化简得22222AD AC CD =-,即22212CD AC AD =-,∴22223332cos 2244AD AC AD CD AD CAD AC AD AC AD AC t+-∠===⋅⋅而0,2CAD π⎛⎫∠∈ ⎪⎝⎭,故()3cos 0,14CAD t ∠=∈,∴3,4t ⎛⎫∈+∞ ⎪⎝⎭.故选:A.【点睛】本题考查了三角形内角平分线的性质以及余弦定理在解三角形中的应用,考查了转化能力与计算能力,属于中档题.8.D【分析】构造函数()()e ,1,xf x x x∞=∈+,利用导数讨论其单调性,将问题转化为比较,,,再转化为比较9ln11,10ln10,11ln 9,构造函数()()20ln g x x x =-,利用导数讨论其单调性,利用单调性即可得答案.【详解】由题知,e e e 9ln11,10ln10,11ln 9a b ca b c ===,记()()e ,1,x f x x x ∞=∈+,则()()21e x x f x x-'=,当()1,x ∈+∞时,()0f x '>,()f x 单调递增,故比较,,a b c 的大小关系,只需比较,,的大小关系,即比较9ln11,10ln10,11ln 9的大小关系,记()()20ln ,1g x x x x =->,则()20ln 1g x x x=-+-',记()20ln 1h x x x =-+-,则()21200h x x x=--<',所以()h x 在()1,+∞上单调递减,又()220338ln 81ln 8ln e 0822h =-+-=-<-<,所以,当()8,x ∈+∞时,()0h x <,()g x 单调递减,所以()()()11109g g g <<,即9ln1110ln1011ln 9<<,所以()()()f a f b f c <<,所以a b c <<.故选:D【点睛】本题难点在于构造函数()()e ,1,xf x x x∞=∈+,将问题转化成比较,,的大小关系后,需要再次构造函数()()20ln ,1g x x x x =->,对学生观察问题和分析问题的能力有很高的要求,属于难题.9.ABC【分析】A 根据复数模的几何意义及圆的性质判断;B 利用复数的运算和模的运算求解即可;C 结合重心的性质进行判断;D 利用平面向量基本定理,判断出D 点位置,进而可求.【详解】对A ,由1i 1z +-=的几何意义,知复数z 对应的动点Z 到定点(1,1)-的距离为1,即动点Z 的轨迹以(1,1)-为圆心,1为半径的圆,1i z --表示动点点Z 的轨迹以(1,1)的距离,由圆的性质知:max |i |z --==113,A 正确;对B ,设i,i,(,,,R)z m n z c d m n c d =+=+∈12,因为12122,2,1z z z z ==+=,所以,m n c d +=+=222244,,m c n d +=+=1,所以mc nd +=-2,所以12()()i z z m c n d -=-+-====,B 正确;对C ,由正弦定理的sin sin AC C AB B ⋅=⋅,即||sin ||sin AC C AB B =,()sin sin sin AB AC AP AB AC AB B AC C AB B λλ⎛⎫ ⎪∴==+ ⎪⎝⎭,设BC 中点为E ,如图:则AB +AC =2AE,则||sin AP AE AB Bλ=2 ,由平面向量的共线定理得,,A P E 三点共线,即点P 在边BC 的中线上,故点P 的轨迹经过ABC V 的重心,C 正确;对D ,如图由已知点D 在ABC V 中与AB 平行的中位线上,且靠近BC 的三等分点处,故有,,ABD ABC ACD ABC BCD S S S S S ===1123 1111236ABC ABC S S ⎛⎫--= ⎪⎝⎭ ,所以13BCD ABDS S =△△,D 错误.故选:ABC 10.BC【分析】根据两角和的余弦公式,以及二倍角的正余弦公式化简可得3cos34cos 3cos x x x =-,根据定义即可判断A 项;根据二倍角公式可推得()424cos 8cos 8cos 1P x x x =-+,即可得出B 项;根据诱导公式以及A 的结论可知,3cos544cos 183cos18︒=︒-︒,2sin 54cos 362cos 181︒=︒=︒-.平方相加,即可得出25cos 188︒+=,进而求出C 项;假设D 项成立,结合C 项,检验即可判断.【详解】对于A 项,()cos3cos 2cos 2cos sin 2sin =+=-x x x x x x x ()222cos 1cos 2cos sin x x x x=--()()222cos 1cos 2cos 1cos x x x x =---34cos 3cos x x =-.由切比雪夫多项式可知,()3cos3cos x P x =,即()33cos 4cos 3cos P x x x =-.令cos t x =,可知()3343P t t t =-,故A 项错误;对于B 项,()cos 4cos 22x x =⨯()2222cos 2122cos 11x x =-=⨯--428cos 8cos 1x x =-+.由切比雪夫多项式可知,()4cos 4cos x P x =,即()424cos 8cos 8cos 1P x x x =-+.令cos t x =,可知()424881P t t t =-+,故B 项正确;对于C 项,因为36218︒=⨯︒,54318︒=⨯︒,根据A 项3cos34cos 3cos x x x =-,可得3cos 544cos 183cos18︒=︒-︒,2cos 362cos 181︒=︒-.又cos 36sin 54︒=︒,所以2222cos 36cos 54sin 54cos 541︒+︒=︒+︒=,所以,()()22324cos 183cos182cos 1811︒-︒+︒-=.令cos180t =︒>,可知()()223243211t tt -+-=,展开即可得出642162050t t t -+=,所以42162050t t -+=,解方程可得258t ±=.因为cos18cos320t =︒>︒,所以258t =,所以,2cos 362cos 181︒=︒-512184=⨯=,所以,sin 54cos36︒=︒=C 项正确;对于D 项,假设1cos546︒=,因为1sin 544︒=,则22221si c s n o 5445⎫︒=+≠⎪⎪⎝⎭⎝⎭︒+,显然不正确,故假设不正确,故D 项错误.故选:BC.【点睛】方法点睛:根据题意多项式的定义,结合两角和以及二倍角的余弦公式,化简可求出()()34cos ,cos P x P x ,换元即可得出()()34,P t P t .11.AC【分析】对于A ,由21n n S S n +=-+,多写一项,两式相减即可得出答案.对于B ,由121n n a a n ++=-(2n ≥),多递推一项,两式相减即可得出答案少了条件2n ≥.对于C ,由分析知22n n a a +-=,所以{}n a 奇数项是以10a =为首项,2为公差的等差数列,偶数项是以21a =为首项,2为公差的等差数列,由等差数列得前n 项和公式即可得出答案.对于D ,因为数列{}n a 单调递增,根据1234n a a a a a <<<<< ,即可求出1a 的取值范围.【详解】对于A ,因为21n n S S n +=-+,当()2121n n n S S n -≥=-+-,,两式相减得:121n n a a n ++=-(2n ≥),所以A 正确.对于B ,因为121n n a a n ++=-(2n ≥),所以()+122+11=21n n a a n n ++=-+,两式相减得:22n n a a +-=(2n ≥),所以B 不正确.对于C ,21n n S S n +=-+ ,令1n =,则211S S =-+,1211a a a +=-+,因为10a =,所以21a =.令2n =,则324S S =-+,112324a a a a a ++=--+,所以32a =.因为22n n a a +-=(2n ≥),而312a a -=,所以22n n a a +-=.所以{}n a 奇数项是以10a =为首项,2为公差的等差数列.偶数项是以21a =为首项,2为公差的等差数列.则:()()10012399100139924100=+++S a a a a a a a a a a a =+++++++++ 5049504950025012=495022⨯⨯⎛⎫⎛⎫=⨯+⨯+⨯+⨯ ⎪ ⎪⎝⎭⎝⎭,所以C 正确.对于D ,21n n S S n +=-+,令1n =,则211S S =-+,1211a a a +=-+,则2121a a =-+又因为+12=21n n a a n +++,令1n =则23=3a a +,所以()3211=332122a a a a -=--+=+,同理:()4311=552223a a a a -=-+=-+,()5411=772324a a a a -=--+=+,因为数列{}n a 单调递增,所以1234n a a a a a <<<<< ,解12a a <得:113a <,解23a a <得:114a >-,解34a a <得:114a <,解45a a <得:114a >-,解56a a <得:114a <,所以1a 的取值范围是11,44⎛⎫- ⎪⎝⎭,所以D 不正确.故选:AC.【点睛】本题考查的是等差数列的知识,解题的关键是利用121n n a a n ++=-,得出{}n a 的奇数项、偶数项分别成等差数列,考查学生的逻辑推理能力和运算求解能力,属于难题.12.5【分析】作//AE BD 且AE BD =,连接,ED EC ,则CAE ∠(或其补角)为异面直线,AC BD 所成的角,所以60CAE ∠=︒或120CAE ∠=︒,证明DE EC ⊥,先求出EC ,再得CD .【详解】如图,作//AE BD 且AE BD =,连接,ED EC ,则CAE ∠(或其补角)为异面直线,AC BD 所成的角,所以60CAE ∠=︒或120CAE ∠=︒,因为//AE BD 且AE BD =,所以ABDE 是平行四边形,所以//DE AB ,4DE AB ==,因为,AB AC AB BD ⊥⊥,所以,ED AC ED AE ⊥⊥,AC AE A ⋂=,所以BD ⊥平面AEC ,CE ⊂平面AEC ,所以ED CE ⊥,3AC AE ==,若60CAE ∠=︒,则3CE =,5CD ==,若120CAE ∠=︒,则23sin 60CE =⨯︒=,CD =故答案为:5【点睛】本题考查异面直线所成角的应用,都可空间两点间的距离.解题关键是作出异面直线所成的角.构造三角形,在三角形中求线段长.13.2【详解】因为()2*114,13n n n a a a a n N +==-+∈,所以211(1)0n n n n n a a a a a ++-=->⇒>,数列{}单调递增,所以1(11)0n n n a a a +-=->,所以111(1)1111n n n n na a a a a +--=--=,所以121122111111111111()()()11111n n n n n S a a a a a a a a a a a =+++=-+-++-=------ ,所以20172017131m S a ==--,因为143a =,所以22223444131313133133133()1,()1,()12,33999818181a a a =-+==-+==-+> ,所以20172016201542a a a a >>>>> ,所以201711a ->,所以20171011a <<-,所以201512331a <-<-,因此m 的整数部分是2.点睛:本题考查了数列的综合应用问题,其中解答中涉及到数列的通项公式,数列的裂项求和,数列的单调性的应用等知识点的综合应用,着重考查了学生分析问题和解答问题的能力,以及推理与运算能力,试题有一定的难度,属于难题,本题的借助数列递推关系,化简数列为111111n n na a a +=---,再借助数列的单调性是解答的关键.14.103tyx -+-=(或330x ty -+=);【分析】(1)根据已知直接写出直线AB 的方程;(2)求出cos ,OP n →→〈〉=sin PMB ∠利用基本不等式求解.【详解】解:(1)由题得AB :4143x ty-+=,即103ty x -+-=,(2)()4,OP t →=-,3k AB t→=,∴AB →的方向向量(),3n t = ,所以cos ,OP nOP n OP n→→→→→→⋅〈〉==sin PMB ∠==,即()min sin PMB ∠=.故答案为:103tyx -+-=.15.(1)2n n a =(2)14337【分析】(1)根据数列的前n 项和求数列的通项公式,一定要分1n =和2n ≥讨论.(2)首先弄清楚新数列前55项的构成,再转化为错位相减法求和.【详解】(1)当1n =时,12a =;当2n ≥时,3312211121222222222n n n n n n a a a a a a a a a ----⎛⎫⎛⎫=++++-++++ ⎪ ⎪⎝⎭⎝⎭()2212n n =--=,所以122nn a -=⇒2n n a =,2n ≥.当1n =时,上式亦成立,所以:2n n a =.(2)由()123155n n ⎡⎤+++++-=⎣⎦ ⇒10n =.所以新数列前55项中包含数列的前10项,还包含,11x ,21x ,22x ,31x ,32x ,L ,98x ,99x .且12112a a x +=,()23212222a a x x ++=,()3431323332a a x x x +++=,()91091929992a a x x x ++++=.所以()()()239101255121029222a a a a a a S a a a +++=+++++++123910357191122a a a a a ++++=+ .设123935719T a a a a =++++ 1239325272192=⨯+⨯+⨯++⨯ 则234102325272192T =⨯+⨯+⨯++⨯ ,所以()1239102322222192T T T -=-=⨯+⨯+++-⨯ 101722=-⨯-.故:101722T =⨯+.所以1010955172211228211433722S ⨯+=+⨯=⨯+=.【点睛】关键点点睛:本题的关键是要弄清楚新数列前55项的构成.可先通过列举数列的前几项进行观察得到规律.16.(1)22143x y +=;(2)证明见解析.【分析】(1)由题意得b =,将点3(1,)2代入椭圆的方程可求得2a 的值,进而可得椭圆的方程;(2)设:1l x ty =+,1(P x ,1)y ,2(Q x ,2)y ,联立直线l 和椭圆的方程,可得122634ty y t +=-+,122934y y t =-+,直线PA 的方程为11(2)2y y x x =++,令4x =,得116(4,2y M x +,同理226(4,)2y N x +,由斜率公式计算即可.【详解】(1)因为2b =b =,再将点31,2⎛⎫ ⎪⎝⎭代入22213x y a +=得21314a +=,解得24a =,故椭圆C 的方程为22143x y +=;(2)由题意可设()()1122:1,,,,l x ty P x y Q x y =+,由221143x ty x y =+⎧⎪⎨+=⎪⎩可得()2234690t y ty ++-=,易知0∆>恒成立,所以12122269,3434t y y y y t t +=-=-++,又因为−2,0,所以直线PA 的方程为=+2,令4x =,则1162=+y y x ,故1164,2y M x ⎛⎫⎪+⎝⎭,同理2264,2y N x ⎛⎫⎪+⎝⎭,从而()()111212126266,413333y x y y k k ty ty +===-++,故()()()212121222212121222363643419189333993434y y y y t k k t t ty ty t y y t y y t t -+====-+++++--+++为定值.17.(1)证明见解析(2)14【分析】(1)证明出//CD 平面PAB ,利用线面平行的性质可得出//CD l ,再利用线面平行的判定定理可证得结论成立;(2)计算出cos PAB ∠的值,以A 为坐标原点,AB 、AD 所在直线分别为x 、y 轴,建立空间直角坐标系,设()0,,0F a ()02a ≤≤,利用空间向量法结合二次函数的基本性质可求得平面PEF 与平面PCD 的夹角的余弦值的最大值.【详解】(1)证明:因为四边形ABCD 正方形,所以//AB CD .因为CD ⊂/平面PAB ,AB ⊂平面PAB ,所以//CD 平面PAB .又因为CD ⊂平面PCD ,平面PAB ⋂平面PCD l =,所以//CD l .因为l ⊂/平面ABCD ,CD ⊂平面ABCD ,所以//l 平面ABCD .(2)解:由题意可得AE ==,PE =因为四边形ABCD 是正方形,所以AB AD ⊥.又因为PA AD ⊥,PA AB A = ,PA 、AB ⊂平面PAB ,所以AD ⊥平面PAB .因为//AD BC ,所以⊥BC 平面PAB ,因为PB ⊂平面PAB ,所以,BC PB⊥.则PB ===.所以,222cos 2PA AB PB PAB PA AB +-∠==⋅以A 为坐标原点,AB 、AD 所在直线分别为x 、y 轴,建立如图所示的空间直角坐标系.点P 到平面yAz的距离为()cos π1AP PAB -∠=,点P 到平面xAy2==.则()1,0,2P -,()2,2,0C ,()0,2,0D ,()2,1,0E ,设()0,,0F a ()02a ≤≤,则()3,2,2PC =-,()2,0,0CD =- ,设平面PCD 的法向量为()111,,x n y z = ,则1111322020PC n x y z CD n x ⎧⋅=+-=⎪⎨⋅=-=⎪⎩,取11y =,可得()0,1,1n = .设平面PEF 的法向量为()222,,m x y z = ,()3,1,2PE =-,()1,,2PF a =- ,则22222232020PE m x y z PF m x ay z ⎧⋅=+-=⎪⎨⋅=+-=⎪⎩,取24y =,可得()22,4,31m a a =-- .设平面PEF 与平面PCD 的夹角为α,则cos m n m nα⋅==⋅ 令[]11,3a t +=∈,则cosα==.当1512t =时,211484013t t ⎛⎫-⨯+⎪⎝⎭取得最小值,最小值为143,所以cos α75a =.故平面PEF 与平面PCD 的夹角的余弦值的最大值为14.18.(1)①34;②73(2)应该去乙店购买非盲盒文具,理由见解析【分析】(1)①明确第二次只需买到其余的三种文具盲盒的任意一款即可求解;②结合已知由几何分布的性质即可求解.(2)由随机变量以及相应的均值结合几何分布的性质即可求解.【详解】(1)①由题意可知,当第一次购买的文具盲盒已经确定时,第二次只需买到其余的三种文具盲盒的任意一款即可,所以34p =;②设从第一次购买文具后直到购买到两种不同款式的文具盲盒所需要的购买次数为X ,则由题意可知3~4X G ⎛⎫ ⎪⎝⎭,又1Y X =+,所以()()()4711133E Y E X E X =+=+=+=.(2)由题意,在乙店买齐全部文具盲盒所花费的费用为18472⨯=元,设从甲店买齐四种文具盲盒所需要的购买次数为Z ,从第一次购买到1i -种不同款式的文具开始,到第一次购买到i 种不同款式的文具盲盒所需要的购买次数为随机变量i Z ,则5~4i i Z G -⎛⎫ ⎪⎝⎭,其中1,2,3,4i =,而1234Z Z Z Z Z =+++,所以()()()441234114425124533i i i E Z E Z Z Z Z E Z i===+++===+++=-∑∑,所以在甲店买齐全部文具盲盒所需费用的期望为()1210072E Z =>,所以应该去乙店购买非盲盒文具.19.(1)1.83(2)22e e 30x y ---=,证明见解析(3)证明见解析【分析】(1)根据题意分别计算出12,x x ,取2x 得近似值即为方程()0f x =的二次近似值;(2)分别求出(2)g ,(2)g ',即可写出函数()g x 在点(2,(2))g 处的切线方程;设2()ln 1,1ex m x x x =-->,证明出2()(e )m x m ≤,得出2(3)(e )m m <,即可证明;(3)先判断出1201e x x <<<<,然后辅助证明两个不等式()()()1e 1e 1e h x x x ≥-≤≤-和()(01)h x x x ≥<≤即可.【详解】(1)2()361f x x x '=++,当00x =时,(0)1f '=,()f x 在点(0,3)-处的切线方程为3y x +=,与x 轴的交点横坐标为(3,0),所以13x =,(3)46f '=,()f x 在点(3,54)处的切线方程为5446(3)y x -=-,与x 轴的交点为42(,0)23,所以方程()0f x =的二次近似值为1.83.(2)由题可知,2(2)e 3g =-,()e x g x '=,2(2)e g '=,所以()g x 在(2,(2))g 处的切线为22(e 3)e (2)y x --=-,即22e e 30x y ---=;设2()ln 1,1e x m x x x =-->,则211()em x x '=-,显然()m x '单调递减,令()0m x '=,解得2e x =,所以当2(1,e )x ∈时,()0m x '>,则()m x 在2(1,e )单调递增,当2(e ,)x ∈+∞时,()0m x '<,则()m x 在2(e ,)+∞单调递减,所以2222e ()(e )ln e 10em x m ≤=--=,所以2(3)(e )m m <,即2233ln 310ln 31e e --<⇔<+.(3)由()ln h x x x x =-,得()ln h x x '=-,当01x <<时,ℎ′>0;当1x >时,ℎ′<0,所以ℎ在0,1上单调递增,在1,+∞上单调递减,所以1x =是ℎ的极大值点,也是ℎ的最大值点,即()max ()11h x h ==,又0e x <<时,()0h x >,e x >时,()0h x <,所以当方程()h x a =有两个根时,必满足1201e x x <<<<;曲线()y h x =过点()1,1和点()e,0的割线方程为1(e)1e y x =--,下面证明()()()1:e 1e 1e h x x x ≥-≤≤-,设()()()()1e 1e 1eu x h x x x =--≤≤-,则()1e 11ln ln lne e 1u x x x -⎛⎫=-+=-'- ⎪-⎝⎭,所以当1e 11e x -<<时,()0u x '>;当1e 1e e x -<<时,()0u x '<,所以()u x 在1e 11,e -⎛⎫ ⎪⎝⎭上单调递增,()()10u x u ≥=;在1e 1e ,e -⎛⎫ ⎪⎝⎭上()u x 单调递减,()()e 0u x u ≥=,所以当1e x ≤≤时,()0u x ≥,即()1()e (1e)1ef x x x ≥-≤≤-(当且仅当1x =或e x =时取等号),由于21e x <<,所以()()221e 1e a f x x =>--,解得2e e x a a >-+;①下面证明当01x <≤时,()h x x ≥,设()()ln ,01n x h x x x x x =--<≤=,因为ln 0x ≤,所以当01x <≤时,()f x x ≥(当且仅当1x =时取等号),由于101x <<所以()11a h x x =>,解得1x a ->-,②①+②,得21e e x x a ->-.【点睛】关键点睛:第三问的难点在于辅助构造出两个函数不等式,这样再利用函数单调性,得到相关不等式,然后进行估计21x x -的范围.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
湖北省武汉市2017届高三化学五月模拟考试试题可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na -23 Al-27 S-32 Co-597、下列有关化学与生产、生活的说法中,正确的是A.碳纤维、合成纤维和光导纤维都是无机非金属材料B.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去C.使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强D.铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝8、设N A为阿伏加德罗常数的值。
下列有关叙述正确的是A.在12.0 g NaHSO4晶体中,所含离子数目为0.3N AB.在1.0 L 1.0 mol/L的NaA1O2溶液中,含有的氧原子数为2N Ac.将1molCl2通入足量水中,转移电子数为N AD.常温常压下,2.2 g CO2和N2O的混合气体含有的电子数为1. 1N A9、下列有机物的说法,正确的是A.分子式为C5H12的有机物有三种,它们互为同系物B. C4H8C12有9种同分异构体(不考虑立体异构)C.石蜡油、苯、四氟乙烯都不能使溴水褪色D.等物质的量的甲烷与氯气反应后体积保持不变10、用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象和结论合理的是选项①中物质②中的物质预测②中的现象和结论A 浓盐酸二氧化锰立即产生大量黄绿色气体,证明 HC1具有还原性和酸性B 草酸溶液酸性高锰酸钾溶液溶液逐渐褪色,证明草酸具有还原性C硫酸铝饱和溶液碳酸钠饱和溶液立即产生大量气泡,证明两者相互促进水解D 蒸馏水过氧化钠粉末立即产生大量气泡,滴加酚酞溶液后变红,说明过氧化钠是碱性氧化物11.下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为Y元素的2倍。
下列说法正确的是X YZ WTA.元素X、W、Z在自然界中均可以游离态存在B.元素X、Y、W的原子半径依次递增C.实验室储存T的单质时,应在其表面覆盖少量的水D.元素Z的氧化物是制作计算机芯片的材料12.某同学做了如下实验:下列说法中正确的是A.加热铁片I所在烧杯,电流表指针会发生偏转B.用KSCN溶液检验铁片Ⅲ、IV附近溶液,可判断电池的正、负极C.铁片I、Ⅲ的腐蚀速率相等D.“电流计指针未发生偏转”,说明铁片I、铁片Ⅱ均未被腐蚀13、在25℃时,将 1.0 L wmoI/L CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。
然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。
下列叙述正确的是A. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>bB.b点混合液中 c(Na+) >c(CH3COO-)C.加入CH3COOH过程中,)3()OH()(--+•COOCHccNac增大D.25℃时,CH3COOH的电离平衡常数K a=1.0100.2-7-⨯w mol/L26、(14分)某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体(1)小组同学设计甲、乙、丙三组实验,记录如下:操作现象甲向I的锥形瓶中加入______,.向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝乙向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯Ⅲ中有气泡冒出,溶液不变蓝丙向Ⅱ中加入KMnO4固体,Ⅲ中加入适量Ⅲ中有气泡冒出,溶液变蓝0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。
为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。
学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性 KMnO4B. FeCl2C. Na2SD.品红(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2+2H2O=2I2+ 4KOH。
该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)________________________造成的,请设计实验证明他们的猜想是否正确________________________________________________。
27、(14分)草酸钴是制作氧化钴和金属钴的原料。
一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::(1)“550℃焙烧”的目的是______________________;(2)“浸出液”的主要成分是_____________________;(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;(4)“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是___________________________(用离子方程式表示);再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是_____________________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5mol /L,则滤液中 c(Mg2+)为________________ [已知K sp(MgF2) =7.35×10-11、K sp(CaF2) =1.05×10-10]。
(6)为测定制得样品的纯度,现称取1.00 g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
28、(15分)科学家积极探索新技术对CO2进行综合利用。
I. CO2可用来合成低碳烯烃。
2CO 2(g) +6H2(g)CH2 =CH2(g) +4H2O(g) ΔH= akJ/mol请回答:(1)已知:H2和CH2 =CH2的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H 2O(g)H2O(1) ΔH = -44.0 kJ/mol,则 a=____________kJ/mol。
(2)上述由CO2合成CH2=CH2的反应在__________下自发进行(填“高温”或“低温”),理由是___________________。
(3)在体积为1 L的密闭容器中,充入3 mol H2和1 mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。
下列说法正确的是_________。
A.平衡常数大小:K M>K NB.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1C.图1中M点时,乙烯的体积分数为7.7%D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态(4)保持温度不变,在体积为VL的恒容容器中以n(H2)∶n(CO2) = 3∶1的投料比加入反应物,t0时达到化学平衡。
t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。
请在图2中作出容器内混合气体的平均相对分子质量M随时间变化的图象。
II .利用“ Na—CO2”电池将CO2变废为宝。
我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO22Na2CO3+C。
放电时该电池“吸入”CO2,其工作原理如图3所示:(5)放电时,正极的电极反应式为______________________。
(6)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。
(7)选用髙氯酸钠—四甘醇二甲醚做电解液的优点是___________________________(至少写两点)。
35、【化学选修3:物质结构与性质】(15分)第二代半导体材料——(Ⅲ-V)A族化合物的特殊性能使之成为科学家的研究热点之一。
(1) 基态镓原子的价电子轨道表示式为_____________。
(2) N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,N2O的空间构型为_________,NH4NO3中N的杂化方式为_________________,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)已知NH3分子的键角约为107°,而PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH¥的键角大的原因__________________________。
(4)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有________________。
(5)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:物质BN AIN GaN熔点/℃3000 2200 1700试从结构的角度分析它们熔点不同的原因_____________________。
(6)磷化铝晶胞如图所示,A1原子的配位数为________,若两个铝原子之间的最近距离为d pm,N A代表阿伏加德罗常数的值,则磷化铝晶体的密度ρ=_________g/cm3。
白球:A1黑球:P36.【化学选修5:有机化学基础】(15分}盐酸金刚烷胺是一种治疗和预防病毒性感染的药物,可用于抑制病毒穿入宿主细胞,从结构上看是一种对称的三环状胺,可以利用环戊二烯(CPD)来制备合成,流程图如下:(1)下列关于X和金刚烷说法正确的是A.金刚烷和X互为同分异构体,均可以发生氧化反应和取代反应B.金刚烷和X均可以使溴水褪色C.金刚烷和X均具有与芳香烃相似的化学性质D.金刚烷和X均不存在手性碳原子(2)反应①的反应类型为____________,反应②的条件为________________。
(3)有机物Y的一氯代物的同分异构体的数目为___________,写出Y与氢氧化钠的乙醇溶液反应的化学方程式___________________________________。
