高一化学双向细目表1-6班
双向细目表模板

期末试题双向细目表期中试题双向细目表八年级思想品德教学工作总结本学期,本人担任八年级两个班的思想品德教学任务。
一学期来,本人认真备课、上课、听课、评课,及时布置学生搜整信息资料,做好课前后指导工作,广泛涉猎各种知识,形成比较完整的知识结构,严格要求学生,尊重学生,发扬教学民主,使学生学有所得,不断提高,从而不断提高自己的教学水平和思想觉悟,并顺利完成教育教学任务。
回顾本学期的工作,有成功的喜悦,也有失败的教训,为使今后的工作做得更好,现总结如下。
一、政治思想方面。
本人在思想上严于律己,热爱党的教育事业。
对自己要求更为严格,力争在思想上、工作上在同事、学生的心目中树立好的印象。
即教书又育人,除对自已严格要求外,还利用一切合适的场所,对学生进行思想教育,提高班上学生的思想觉悟,教育学生热爱中国共产党,热爱社会主义祖国、同时热爱家乡。
同一切不良的现象作斗争。
本学期,积极参加各类业务学习,努力提高自己的政治水平和业务水平。
二、教育教学方面。
1、要提高教学质量,关键是上好课。
为了上好课,我做了下面的工作:⑴课前准备备好课。
①认真钻研教材,对教材的基本思想、基本概念,每句话、每个字都弄清楚,了解教材的结构,重点与难点,掌握知识的逻辑,能运用自如,知道应补充哪些资料,怎样才能教好。
②了解学生原有的知识技能的质量,他们的兴趣、需要、方法、习惯,学习新知识可能会有哪些困难,采取相应的预防措施。
③考虑教法,解决如何把已掌握的教材传授给学生,包括如何组织教材、如何安排每节课的活动。
⑵课堂上的情况。
组织好课堂教学,关注全体学生,注意信息反馈,调动学生的有意注意,使其保持相对稳定性,同时,激发学生的情感,使他们产生愉悦的心境,创造良好的课堂气氛,课堂语言简洁明了,克服了以前重复的毛病,课堂提问面向全体学生,注意引发学生学习的兴趣。
2、积极参与听课、评课,虚心向同行学习教学方法,博采众长,提高教学水平。
三人行,必有我行焉。
高中化学双向细目表
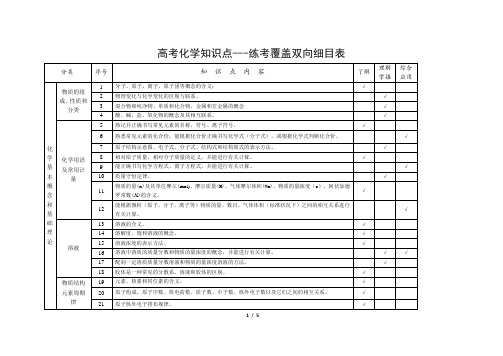
化学反应速率和化学平衡
41
化学反应速率的概念、反应速率的定量表示方法。
√
42
能正确计算化学反应的转化率(α)。
√
43
反应活化能的概念,催化剂的重要作用。
√
44
化学反应的可逆性及化学平衡的建立。
√
45
化学平衡的特征。
√
46
化学平衡常数的含义,能够用化学平衡常数进行简单计算。
√
√
47
外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。
√
81
常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
√
82
常见物质进行检验、分离和提纯的方法。
√
83
溶液配制方法。
√
84
根据化学实验的目的和要求,能做到:设计实验方案;正确选用实验装置;掌握控制实验条件的方法;预测或描述实验现象、分析或处理实验数据,得出合理结论;评价或改进实验方案。
√
10
质量守恒定律。
√
11
物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)、阿伏加德罗常数(NA)的含义。
√
12
能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
√
溶液
13
溶液的含义。
√
14
溶解度、饱和溶液的概念。
合成高分子在高新技术领域的应用以及在发展经济、提高生活质量方面中的贡献。
√
物质结构与性质模块
原子结构与元素性质
102
原子核外电子的运动状态、能级分布和排布原理。
考试命题细目表(高一化学)
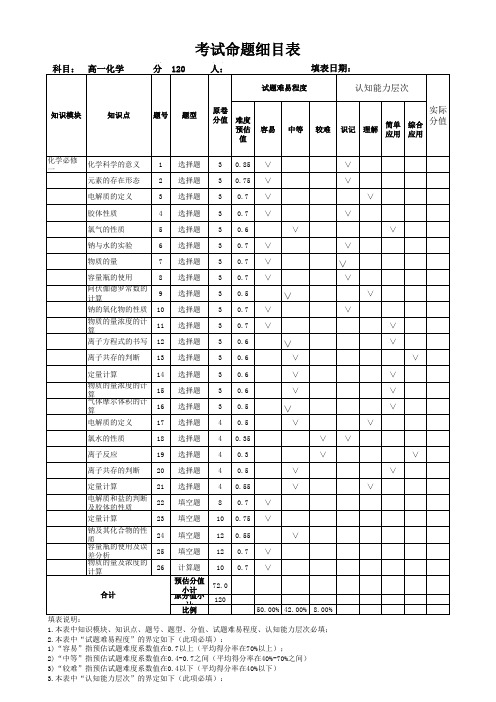
满填表
2.本表中“试题难易程度”的界定如下(此项必填):
1)“容易”指预估试题难度系数值在0.7以上(平均得分率在70%以上);
2)“中等”指预估试题难度系数值在0.4-0.7之间(平均得分率在40%-70%之间)3)“较难”指预估试题难度系数值在0.4以下(平均得分率在40%以下)3.本表中“认知能力层次”的界定如下(此项必填):
考试命题细目表1.本表中知识模块、知识点、题号、题型、分值、试题难易程度、认知能力层次必填;
2)“理解”指对该部分内容在识记的基础上,能进一步理解有关的性能和规律并能做出正确解释;3)“简单应用”指能运用该知识点分析解决简单的具体问题;
4)“综合应用”指能运用与该部分内容有关的多个知识点去分析和解决综合性的实际问题。
命题中的双向细目表

双向细目表详谈双向细目表在命题环节当中的应用一、试卷编制的具体步骤1、进行总体构思,确定试卷的目标要求明确考试的目的(为什么考)和性质:是期前预备性(摸底、预测、分组)的,或者是期中形成性(诊断、激励)的,还是期末总结性(评定)的;根据考试目的确定考试的内容、范围和要求(合格标准)。
2、拟订命题计划,设计多项细目表命题计划包括两项内容:一是编制试题的原则和要求,说明试题类型、编制试题和组配试卷的要求;二是规定试卷中试题的分布,即具体考试内容中各部分试题的数量分布和所占比例。
根据《课程标准》、《考试大纲》、教材、考试目的、性质与要求,设计好试卷多项细目表,这是试卷编制的依据。
3、选择题型,实施编制4、编选和审查试题,组编试卷5、检查、修改、试做、复核、调整、编制标准答案和评分标准二、试卷命题双向细目表(一)为什么在编制试卷时需要制定双向细目表原因之一:命题双向细目表是设计试卷的蓝图。
它使题工作避免盲目性而具有计划性,使命题者明确测验的目标,把握试题的比例与分量,提高命题的效率和质量。
原因之二:它对于审查试题的效度也有重要的指导意义。
命题双向细目表包括两个维度(双向)的表格,反映测验内容、测验目标、题型与难度之间的关系。
(二)什么是双向细目表所谓“双向细目表”,实际上就是教材内容和学习结果两个维度,其中一维反映教学的内容,另一维反映学生的学习水平。
目前在“学习水平”这一维,普遍采用布卢姆等人关于认知领域教育目标的分类,即把学习结果或认知水平分为“知识、理解、应用、分析、综合、评价”六种水平。
教材内容这一维则根据具体学科内容加以确定。
双向细目表是在命题中根据考试的目的和要求制定的测试内容和目标的具体计划,并以图表形式详细、明确地列出各项内容的量化指标,用以规范、指导编题和制卷。
案例1:高考文综Ⅱ卷政治试题双向细目表表格1:试题内容与考查范围、考点双向细目表表格2:知识与能力考核双向细目表案例2:高三月考数学试题双向细目表马鞍山市二十二中学2010届高中教学质量第一次月考数学试卷双向细目表(理科)高三数学第一次月考目的:检查前一阶段复习效果考试范围:第一次月考前已复习完成的内容,必修3和选修2-3中的概率和统计、排列组合、二项式定理、选修4-1极坐标和参数方程。
高一化学双向细目表1-6班 (1)

知识点
了
解
理
解
掌
握
应
用
题型
分
值
预设
难度
实测
难度
1.高分子材料成分识别及简单性质
√
选择
5
0.6
2.糖类、油脂、蛋白质结构与性质
√
选择
5
0.72
3.醇类,醛类等有机物生活中应用及性质
√
选择,填空
20
0.6
4.脂肪烃与含氧衍生物性质的综合考察
√
选择,
√
选择
20
0.5
19.同分异构、同系物、性质的综合考察
√
选择、填空
15
0.5
20.有机物性质、结构推断综合考察
√
选择、填空
35
0.5
试卷评价:
√
选择
5
0.5
12.有机物的实验室制备及其知识迁移
√
填空、填空
26
0.6
13.烷烃混合气体燃烧的计算与判断
√
选择
2.5
0.5
14.有机物的有关计算
√
选择、填空、计算
10
0.4
15.有机物的鉴别
√
填空
5
0.6
16.有机物除杂
√
填空
5
0.45
17.酸与醇酯化的实质考察
√
选择
2.5
0.8
18.有机物性质的迁移考察
5
0.6
5.有机物成分、结构的综合考察
√
选择
25
0.6
6、研究有机物一般经过以下几个基本方法
高一化学必修双向细目表

高一化学必修双向细目表1. 化学基础知识- 原子结构和元素周期表- 化学键和化合物的分类- 化学反应和化学方程式- 酸碱中和和中性化学反应- 物质的状态变化和相变- 化学量和化学计算- 元素周期表中的主要元素和其特性- 元素的周期性和趋势- 物质的分子结构和化学键的类型2. 化学实验技能- 实验室安全和实验室设备的使用- 常用实验方法和仪器的操作- 实验数据的记录和处理- 实验结果的分析和解释- 实验原理和实验设计3. 化学反应与能量变化- 化学反应的能量变化- 燃烧反应和氧化还原反应- 酸碱中和反应和热化学方程式- 粒子间的引力作用和化学反应的速率- 化学反应的平衡和平衡常数- 溶液中的溶解度和溶液的浓度4. 化学物质的构成与结构- 元素和化合物的构成- 原子和分子的结构- 组成物质的化学键- 元素周期表中元素的结构特性- 金属和非金属元素的性质- 化合物的分子结构和性质- 傅里叶光谱和分子结构分析5. 化学周期律与离子反应- 元素周期表和周期律规律- 同一周期和同一族的元素特性- 阴离子与阳离子的结构和特性- 离子反应的性质和反应方程式- 酸碱反应和生成离子的化学方程式- 离子溶液中的电离反应和电导率6. 环境与持续发展化学- 化学物质对环境的影响- 大气污染和水污染的原因和防治- 可持续发展和绿色化学的概念- 环境友好的化学产品和过程- 生物质资源的利用和能源转化- 化学垃圾处理和废物回收利用的方法7. 高分子物质与生物化学- 高分子物质的结构和性质- 聚合反应与高分子合成- 塑料和纤维的生产和应用- 生物大分子的结构和功能- 生物有机物的合成和代谢- 酶的催化作用和生物化学反应以上是高一化学必修双向细目表的主要内容。
这份文档包含了学习该科目所需的基础知识、实验技能以及各个单元的重点内容。
希望能对你的学习和备考有所帮助。
2018-2019学年第一学期段考双向细目表(高一化学)
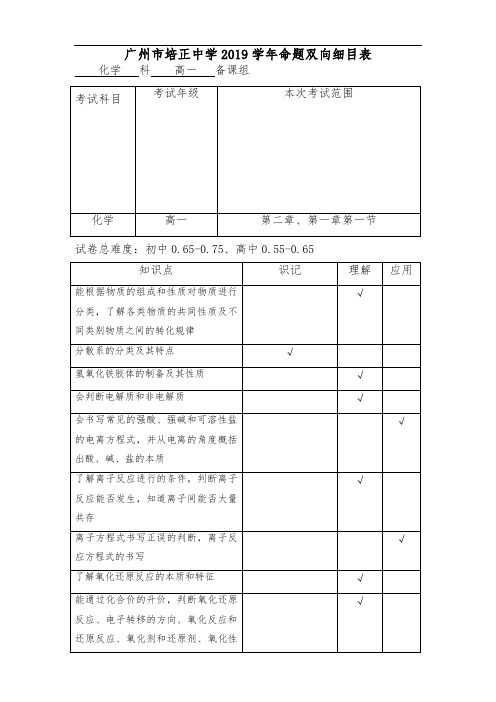
掌握粗盐提纯的操作流程
√
能够说出硫酸根离子和氯离子的检验方法
√
题型分布建议:
单选题
填空题
25题
2分
4题
50分
题
分
题
分
题
分
50%
55%
%
%
%
补充说明:
1.四道填空题分别为实验题(原理、操作、仪器)、氧化还原题(含单/双线桥法)、物质的分离提纯、检验题和实验探究题(含化学方程式、离子方程式的书写)。
√
氧化性、还原性强弱的比较
√
能用双线桥和单线桥法表达氧化还原反应电子转移的数目和方向
√
知道一些基本的实验安全措施和意外事故的紧急处理方法,能识别一些化学品安全标识
√
理解过滤和蒸发的原理,能够用过滤和蒸发的方法分离对应的混合物。
√
了解蒸馏、萃取、分液的基本原理,掌握萃取和分液的实验操作
√
了解物质分离提纯的一般方法:过滤、蒸发、蒸馏、萃取和分液过程中使用的仪器及其功能
氢氧化铁胶体的制备及其性质
√
会判断电解质和非电解质
√
会书写常见的强酸、强碱和可溶性盐的电离方程式,并从电离的角度概括出酸、碱、盐的本质
√
了解离子反应进行的条件,判断离子反应能否发生,知道离子间能否大量共存
√
离子方程式书写正误的判断,离子反应方程式的书写
√
了解氧化还原反应的本质和特征
√
能通过化合价的升价,判断氧化还原反应、电子转移的方向、氧化反应和还原反应、氧化剂和还原剂、氧化性和还原性、被氧化和被还原。
广州市培正中学2019学年命题双向细目表
化学科高一备课组
考试科目
考试年级
化学试题双向细目表
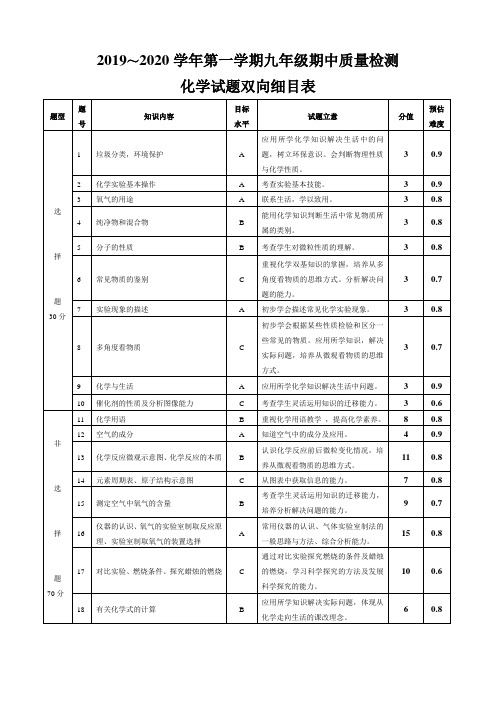
题号
知识内容
目标水平
试题立意
分值
预估难度
选
择
题
30分
1
垃圾分类,环境保护
A
应用所学化学知识解决生活中的问题,树立环保意识。会判断物理性质与化学性质。
3
0.9
2
化学实验基本操作
A
考查实验基本技能。
3
0.9
3
氧气的用途
A
联系生活,学以致用。
3
0.8
4
纯净物和混合物
B
能用化学知识判断生活中常见物质所属的类别。
11
0.8
14
元素周期表、原子结构示意图
C
从图表中获取信息的能力。
7
0.8
15
测定空气中氧气的含量
B
考查学生灵活运用知识的迁移能力,培养分析解决问题的能力。
9
0.7
16
仪器的认识、氧气的实验室制取反应原理、实验室制取氧气的装置选择
A
常用仪器的认识、气体实验室制法的一般思路与方法、综合分析能力。
15
0.8
3
0.7
9
化学与生活
A
应用所学化学知识解决生活中问题。
3
0.9
10
催化剂的性质及分析图像能力
C
考查学生灵活运用知识的迁移能力。
3
0.6
非
选
择
题
70分
11
化学用语
B
重视化学用语教学,提高化学素养。
8
0.8
12
空气的成分
A
知道空气中的成分及应用。
4
0.9
13
化学反应微观示意图、化学反应的本质
高中化学双向细目表

高中化学双向细目表高考化学双向细目表分类序号知识点内容1 物质的组成、性质和分类2 化学基本概念3 物质的分子、原子、离子、元素等概念的含义;初步了解原子团的定义4 物理变化与化学变化的区别与联系5 混合物、纯净物、单质和化合物、金属和非金属的概念6 同素异形体的概念7 酸、碱、盐、氧化物的概念及其相互联系8 熟记并正确书写常见元素的名称、符号、离子符号9 熟悉常见元素的化合价;能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价10 掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法;理解质量守恒定律的含义;掌握热化学方程式的含义11 能正确书写化学方程式、离子方程式、电离方程式、电极反应式12 了解相对原子质量、相对分子质量的涵义13 掌握物质的量的单位--摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol-1)的含义14 物质的量浓度(mol·L-1)、阿伏加德罗常数的含义15 掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系16 掌握化学反应的四种基本类型:化合、分解、置换、复分解17 理解氧化还原反应,了解氧化剂和还原剂等概念;掌握重要氧化剂、还原剂之间的常见反应18 能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式19 了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念20 了解溶液的涵义21 了解溶液的组成,理解溶质的质量分数的概念22 了解饱和溶液、不饱和溶液的概念;了解溶解度的概念;了解温度对溶解度的影响及溶解度曲线23 初步了解结晶、结晶水、结晶水合物、风化、潮解的概念24 了解胶体的概念及其重要性质和应用25 了解原子的组成及同位素的概念26 掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系注:综合应用部分不在此表中列出。
高中化学双向细目表

序号
内容
知道
了解
理
解
应
用
第一
章
物质结构儿糸周期
律
第一节
元素周期表
1、元素周期表的结构以及
周期、族等概念
V
2、原子结构与元素在周期
表中位置间的关系
V
3、通过对碱金属、卤族元素性质的探究,理解元素性质与原子结构以及元素在周期表中的位置的相互关系,掌握碱金属和卤族元糸的相似性和递变性
1、乙醇的物理性质,乙酸和乙酸乙脂的物理性质
2、乙醇的生理作用和工业制法
3、理解乙醇的结构,通过分析乙醇的结构式掌握乙醇在发生化学反应时的断键位置,从而推断乙醇所具有的化学性质
V
4、乙酸的物理性质以及它
与人们生活的关系
5、通过分析乙醇和乙酸的结构式,掌握它们发生脂化反应的原理以及实验的操作方法,分析实验现象,会熟练地书写该化学方程式
V
第二节
化学能与电能
1、火力发电中的能量转化
V
2、原电池的原理
V
3、氧化还原反应是使化学
能转换为电能的关键
V
4、通过对原电池装置的分析,掌握原电池正、负极判断方法
V
5、通过原电池装置来判断
金属的活动性顺序
V
6、几种发展中的化学电源
V
7、学会自己设计原电池
V
第三节
化学反应的速率和限度
1、化学反应速率的涵义及
V
4、掌握蛋白质的基本性质,认识蛋白质是生命现象最基本的物质基础
V
第四
章
化学与可持续发展
第一节
开发利用金属矿物和海水
资源
1、了解金属冶炼的一般原理,理解金属冶炼方法的选择同金属活动性的关系,了解常见金属的冶炼方法
化学双向细目表
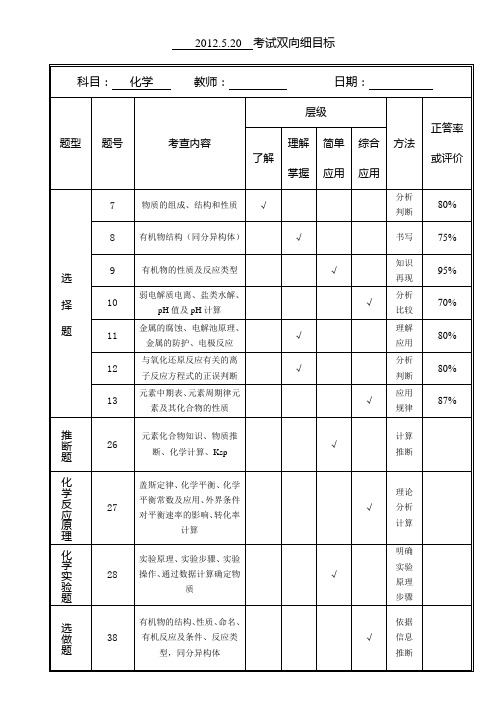
28
实验原理、实验步骤、实验操作、通过数据计算确定物质
√
明确实验原理步骤
选做题
38
有机物的结构、性质、命名、有机反应及条件、反应类型,同分异构体
√
依据信息推断
2012.5.20考试双向细目标
科目:化学教师:日期:
题型
题号
考查内容
层级
方法
正答率或评价
了解
理解
掌握
简单应用
综合
应用
选 择 题
7
物质的组成、结构和性质
√
分析判断
80%
8
有机物结构(同分异构体)
√
书写
75%
9
有机物的性质及反应类型
√
知识再现
95%
10
弱电解质电离、盐类水解、pH值及pH计算பைடு நூலகம்
√
分析
比较
70%
11
金属的腐蚀、电解池原理、金属的防护、电极反应
√
理解
应用
80%
12
与氧化还原反应有关的离子反应方程式的正误判断
√
分析
判断
80%
13
元素中期表、元素周期律元素及其化合物的性质
√
应用
规律
87%
推断题
26
元素化合物知识、物质推断、化学计算、Ksp
√
计算推断
化学反应原理
27
盖斯定律、化学平衡、化学平衡常数及应用、外界条件对平衡速率的影响、转化率计算
√
理论分析计算
(原创2023)化学高考双向细目表

(原创2023)化学高考双向细目表一、无机化学1. 元素和化合物- 1.1 元素周期表- 1.2 常见元素的性质和应用- 1.3 水和溶液中的离子反应- 1.4 化合物的命名和化学式2. 化学反应- 2.1 燃烧反应- 2.2 氧化还原反应- 2.3 酸碱中和反应- 2.4 沉淀反应- 2.5 气体生成和反应3. 化学原理- 3.1 序列化反应和电位差- 3.2 动态平衡和平衡常数- 3.3 反应速率和速率常数- 3.4 催化剂和化学反应速率二、有机化学1. 有机化合物- 1.1 碳的特性和共价键- 1.2 烃类化合物- 1.3 醇、酚、醚类化合物- 1.4 醛、酮、羧酸类化合物- 1.5 氨基酸和蛋白质2. 有机反应- 2.1 烃类的燃烧反应- 2.2 单官能团化合物的反应- 2.3 多官能团化合物的反应- 2.4 聚合反应和聚合物的合成- 2.5 脂肪酸和酯的反应3. 有机化学原理- 3.1 反应机理和反应路径- 3.2 功能团和化学性质- 3.3 离子和自由基反应- 3.4 共轭系统和共轭反应三、化学实验1. 基本实验操作- 1.1 实验室安全和实验室常识- 1.2 仪器使用和实验操作技巧- 1.3 实验记录和数据处理2. 实验现象和解释- 2.1 气体生成与气体收集- 2.2 溶液中的颜色变化- 2.3 岩石和矿石的检验- 2.4 酸碱中和和中和滴定- 2.5 电解质的电导性实验3. 实验设计和控制变量- 3.1 实验变量和实验因素- 3.2 实验设计和实验步骤- 3.3 实验结果的误差和精度- 3.4 实验报告的撰写和结论以上为高考化学学科的双向细目表,其中包含了无机化学、有机化学和化学实验三个部分的细分内容。
学生可以根据这份细目表来进行有针对性的学习和复习,以便在高考中取得好成绩。
高一细目表

方法
加强基础知识的巩固,平时指导学生多做基础性习题来巩固学生对所学知识点的掌握,在能够运用基本知识的基础上在习题的难度上在适当的加深。
二、填空题
三简答题
1
2
3
4
5
6
1
2
3
考查知识点
二次函数的值域
集合的运算
不等式及条件
复合函数求值
集合的运算
函数的综合性质
总分
10—11上学期期末高一(17)班数学学科双向细目情况分析表
一、单项选择题
1
2
3
4
5
6
7
8
9
10
考
查
知
识
点
集合及其运算
集合与元素的关系
一元一次不等式的解法
函数的定义域
一元二次函数的性质
绝对值不等式
一元二次不等式的解法
函数的性质
函数的奇偶性
函数的单调性
总分
148
148
148
148
148
148
148
148
解决方法
在理解的基础上,强化记忆。加强学生的基础教学,使学生能扎实、牢固的掌握基础知识,重点抓好基础,注重培养学生的分析、解决问题的能力。精讲精练,提高学生的分析能力以及解决计算题的能力
148
148
实得分
120
98
48
32
38
44
64
68
72
78
百分率%
81.08
66.21
54.05
21.62
25.67
29.73
43.24
45.94
48.65
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
√
填空
20
0.45
0.48
17.
试卷评价:试题难度适中,知识覆盖面大,将期中以前所学的知识全部考查。突出对基础知识、基本技能。考查学生对基础知识的运用。个别填空考查学生的分析和综合应用能力。整套试卷无偏题、怪题。1-6班的预测难度应在0.6--0.63,实测难度在0.557.
2014年_高一年级化学学科期_中_考试命题双向细目表1-6班
知识点
了
解
理
解
掌
握
应
用
题型
分
值
预设
难度
实测
难度
1.原子结构(原子序数、核电荷数、质子、中子)
√
填空
2
0.6
0.7
2.元素、核素、同位素、同素异形体
√
选择
2
0.72
0.78
3.原子核外电子排布
√
选择,填空
10
0.6
0.5
4.元素周期律的实质
学科组长审核签字后交教研处。
备课组长刘成国(签字)命题教师吴桂丽(签字)学科组长张健(签字)
说明:1、本表知识点和考试要求、层次由被考学科备课组长根据教学情况填写。
2、本表中题型、分值、预设难度系数由命题教师根据试卷情况填写。
3、本表一式二份,运行流程:
被考学科备课组长(14日)→学科组长(15日)→命题教师(22日)
→学科组长(23日)→被考学科备课组长(另一份→教研处)。
阅卷结束后,由被考学科备课组长填写实测难度系数和试卷评价。
√
选择,
2
0.6
0.45
5.同一周期内元素性质递变规律与原子结构关系
√
选择
2
0.6
0.63
6、同一主族元素性质递变规律与原子结构关系
√
选择
2
0.5
0.47
7.金属性与非金属性强弱的比较
√
填空
12
0.55
0.47
8.原子半径与离子半径大小比较
√
填空
4
0.45
0.49
9.电子式的书写
√
选择,填空
4
0.5
0.41
10.化学键类型
√
选择,填空
4
0.55
0.4
11.化学能与热能转化
√
选择
4
0.5
0.55
12.原电池工作原理、两极反应式
√
填空
16
0.6
0.48
13.常见化学电源种类及工作原理
√
选择
4
0.5
0.55
14.化学反应.5
0.65
15.化学反应速率的影响因素
√
填空
6
0.6
0.77
