杂化轨道计算解读
杂化轨道类型计算公式

杂化轨道类型计算公式
杂化轨道类型的计算公式通常基于分子的电子几何结构和原子轨道的混合方式。
具体的计算方法和公式取决于所使用的理论模型和计算工具。
下面是一些常见的杂化轨道类型及其计算公式的示例:
1. sp³杂化轨道:
sp³杂化轨道常见于碳原子形成四个等价的杂化轨道,例如甲烷(CH₄)分子中的碳原子。
其计算公式可以通过线性组合原子轨道(LCAO)法得到:
sp³= a₁s + a₂pₓ+ a₃pᵧ + a₄pᵤ
其中,s、pₓ、pᵧ、pᵤ分别表示原子轨道,a₁、a₂、a₃、a₄为相应的混合系数。
2. sp²杂化轨道:
sp²杂化轨道常见于碳原子形成三个等价的杂化轨道,例如乙烯(C₂H₄)分子中的碳原子。
其计算公式可以表示为:
sp²= a₁s + a₂pₓ+ a₃pᵧ
类似地,s、pₓ、pᵧ表示原子轨道,a₁、a₂、a₃为相应的混合系数。
3. sp杂化轨道:
sp杂化轨道常见于碳原子形成两个等价的杂化轨道,例如乙炔(C₂H₂)分子中的碳原子。
其计算公式为:
sp = a₁s + a₂pₓ
其中,s、pₓ表示原子轨道,a₁、a₂为相应的混合系数。
需要注意的是,上述示例只是常见的杂化轨道类型之一。
在实际计算中,具体的杂化轨道类型和计算公式可能会根据分。
离子的杂化轨道怎么算

离子的杂化轨道怎么算
离子的杂化轨道怎么算?
离子的杂化轨道是指在离子化合物中形成的能够描述分子几何形态和分子光学性质的轨道。
它们是由原子轨道混合而成的杂化轨道,是化学键的基础。
离子的杂化轨道计算方法如下:
1. 找出中心原子:确定分子中的中心原子,并确定它的电子数。
2. 计算价电子数:根据中心原子的化合价数以及其周围相邻原子的价电子数,计算出中心原子周围的价电子数。
3. 计算杂化轨道数目:杂化轨道数目等于中心原子的化合价数。
4. 计算杂化轨道的类型:根据杂化轨道数目,确定杂化轨道类型。
sp 是线性双原子,sp2是平面三角形,sp3是四面体,sp3d是三角双锥形,sp3d2是八面体形。
5. 计算杂化轨道的能量:根据电子云的稳定性和能量,确定杂化轨道
的能量。
sp轨道的能量最高,sp3d2轨道的能量最低。
6. 进行轨道混合:利用线性代数的方法将所需原子轨道进行线性组合,得到杂化轨道。
通过以上步骤,就可以计算出离子的杂化轨道。
需要注意的是,在计
算杂化轨道时,可以根据实际情况适当调整,例如可以将sp3d调整为dsp3。
总之,离子的杂化轨道是描述离子化合物分子几何形态和分子光学性
质的重要概念,通过以上步骤可以比较准确地计算出离子的杂化轨道。
杂化轨道计算

杂化轨道计算在化学的世界里,杂化轨道是一个极其重要的概念,它对于理解分子的结构和性质起着关键的作用。
而杂化轨道的计算则是深入掌握这一概念的重要途径。
要理解杂化轨道计算,首先得明白什么是杂化轨道。
简单来说,杂化轨道是原子在形成分子的过程中,原来不同类型的原子轨道重新组合形成新的轨道。
这种重新组合可以让原子更好地与其他原子结合,形成稳定的分子结构。
常见的杂化类型有 sp 杂化、sp²杂化和 sp³杂化。
sp 杂化是由一个 s轨道和一个 p 轨道杂化形成两个等同的 sp 杂化轨道,其夹角为 180°。
比如乙炔(C₂H₂)中的碳原子就是 sp 杂化。
sp²杂化是由一个 s 轨道和两个 p 轨道杂化形成三个等同的 sp²杂化轨道,其夹角为 120°,像乙烯(C₂H₄)中的碳原子就是这种杂化类型。
sp³杂化则是由一个 s 轨道和三个p 轨道杂化形成四个等同的sp³杂化轨道,其夹角约为1095°,例如甲烷(CH₄)中的碳原子。
那么,如何进行杂化轨道的计算呢?我们以确定中心原子的杂化类型为例。
第一步,要先确定中心原子的价层电子对数。
价层电子对数=(中心原子的价电子数+配位原子提供的电子数离子电荷数)÷ 2。
这里需要注意的是,氢原子和卤素原子作为配位原子时,提供 1 个电子;氧原子和硫原子作为配位原子时,不提供电子。
比如,对于氨气(NH₃),氮原子的价电子数是 5,氢原子作为配位原子提供 1 个电子,所以氮原子的价层电子对数=(5 + 3)÷ 2 =4 。
第二步,根据价层电子对数来确定杂化类型。
2 对电子是 sp 杂化,3 对电子是 sp²杂化,4 对电子是 sp³杂化。
继续以氨气为例,氮原子的价层电子对数是 4,所以氮原子是 sp³杂化。
除了这种通过计算价层电子对数来确定杂化类型的方法,我们还可以通过分子的几何构型来推断杂化类型。
离子的杂化轨道怎么算

离子的杂化轨道怎么算介绍离子的杂化轨道是一个重要的概念,它描述了在化学键形成时离子中电子的重新排列。
通过计算离子的杂化轨道,我们可以更好地理解分子的性质和反应机理。
本文将详细介绍离子的杂化轨道如何计算及其在化学中的应用。
什么是杂化轨道杂化轨道是由原子轨道线性组合形成的新的分子轨道,用于描述分子中的电子分布。
杂化轨道的形成是由于简单的原子轨道无法很好地描述分子的实际形态。
通过线性组合,多个原子轨道可以融合成新的杂化轨道,使得其能更好地描述分子键形成时的电子分布情况。
杂化轨道的计算方法计算离子的杂化轨道需要以下步骤:1. 确定中心原子的电子构型首先,需要确定离子中心原子的电子构型。
电子构型决定了中心原子的轨道组成和电子分布情况。
例如,对于氮离子(N3-),中心原子氮的电子构型为1s22s22p6。
2. 计算原子轨道的数量根据中心原子的电子构型,计算离子中所有原子轨道的数量。
对于氮离子,有一个2s轨道和三个2p轨道。
3. 根据杂化轨道理论确定杂化轨道的数量根据杂化轨道理论,根据中心原子的电子构型和配位数确定所需的杂化轨道数量。
例如,对于四配位的离子,如氨(NH3)分子,中心原子氮需要四个杂化轨道。
4. 确定杂化轨道的类型根据中心原子的电子构型和配位数,确定所需的杂化轨道类型。
根据不同的电子构型和配位数,杂化轨道可以是sp,sp2或sp3。
对于氮离子,由于其电子构型为1s22s22p6,配位数为3,所需的杂化轨道类型为sp2。
5. 计算杂化轨道的组成根据所需的杂化轨道类型,计算杂化轨道的具体组成。
以氮离子为例,根据sp^2杂化轨道的定义,其中一个原子轨道将保持不变,而另外两个将线性组合形成新的杂化轨道。
6. 确定分子轨道最后,通过线性组合得到杂化轨道后,可以进一步计算离子的分子轨道。
根据离子的几何构型和杂化轨道的组成,可以确定离子的分子轨道分布情况。
杂化轨道的应用离子的杂化轨道在化学中有广泛的应用,包括但不限于以下几个方面:1. 分子形状的解释通过计算离子的杂化轨道,可以解释分子的几何形状。
杂化轨道计算

创作编号:
GB8878185555334563BT9125XW
创作者:凤呜大王*
二种计算杂化轨道数的方法
方法一:
公式:杂化轨道数=[中心原子价电子数+ 配原子数-π键数-电荷数]/2例1:SO2(6+2-2)/2=3 sp2杂化。
说明:S的价电子数6;配原子为2个氧原子,氧为二价,所以硫与氧间为双键,其一为π键,共二个π键。
例2:SO3(6+3-3)/2=3 sp2杂化。
(解析同上,下同)。
例3:SO32-(6+3-3+2)/2=4 sp3杂化。
(SO32-带二个单位负电荷)。
例4:SO42-(6+4-4+2)/2=4 sp3杂化。
例5:CN-(4+1-2+1)/2=2 sp1杂化。
(氮元素为三价,所以碳氮间为叁键,其中有二个π键)
例6:NH4+(5+4-1)/2=4 sp3杂化。
例7:ClO3-(7+3-3+1)/2=4 sp3杂化。
例8:PO33-(5+3-3+3)/2=4 sp3杂化。
例9:PO43-(5+4-4+3)/2=4 sp3杂化。
例10:H-N=N-H (5+2-1)/2=3 sp2杂化。
练习:sp1杂化:BeCl2、CO2;sp2杂化:BF3、HCHO(中心原子为C:(4+3-1)/2=3;
sp3杂化CH4、NH3、H2O。
方法二:因为杂化轨道只能用于形成σ键或用来容纳孤电子对,故有:公式:杂化轨道数=中心原子价层电子对数(成键电子对数+孤电子对数)
创作编号:
GB8878185555334563BT9125XW
创作者:凤呜大王*。
求杂化轨道的公式

求杂化轨道的公式
求杂化轨道的公式是指用于计算杂化轨道的公式。
它也被用来计算各种复杂的
原子轨道。
首先,我们来看杂化轨道的定义。
杂化轨道就是以原子核为中心,一对电子能
够共存的轨道,即两个有不同极性的电子在原子层构成一个高度结合的电子二阶结构,称为杂化轨道。
它具有双斜率。
杂化轨道的公式是这样的:ψ=Ci*αi+Cj*αj,其中Ci和Cj为正交函数系数,αi为原子核中电子半径的轨道函数的关于角θ的多项式,αj为原子核中电子鞍点的轨道函数的关于角θ的多项式。
为了使其具有双斜率,需要考虑轨道交换势的贡献,公式可以修正为
ψ=Ci*αi+Cj*αj+Cij*αij,这里αij为轨道联系函数的关于角θ的多项式,
Cij为正交函数系数。
有了杂化轨道的公式,我们就可以计算双电子原子的能级,用于研究原子结构,如分子光谱等。
通过杂化轨道的公式可以计算出轨道电子能级,进而研究原子以及分子的吸收、发射和折射的光谱行为。
此外,杂化轨道的公式还可以用于精确的物理和化学计算。
总之,杂化轨道的公式是杂化轨道的基本公式,它可用于计算双电子原子能级,从而进一步研究原子及分子的光谱行为,及进行精确物理和化学计算。
杂化轨道的判断

3
4
第四步 确定杂化轨道类型:
sp2
sp3
二、杂化轨道与分子的空间结构的关系
杂化轨道数= 中心原子孤对电子对数+中心原子结合的原子数 =中心原子的价层电子对数
代表物 杂化轨道数 杂化轨道类型 VSEPR模型名称 分子的立体构型
CO2
0+2=2 sp
CH2O 0+3=3 sp2
CH4
0+4=4 sp3
sp
CH≡CH分子中碳原子的2个sp杂化轨道有1个相互重叠形成sp-spσ键,另
外1个杂化轨道与氢原子1s轨道重叠形成1个s-spσ键,未参与杂化的2个
2P轨道相互重叠形成2个π键。
BeCl2
Be ↑↓
2s
2p
sp杂化 ↑ ↑
sp
BeCl2分子中铍原子的2个sp杂化轨道与氯原子p轨道重叠形成2个sp-pσ键
SO2
1+2=3 sp2
NH3 H2O
1+3=4 sp3 2+2=4 sp3
直线形 平面三角形 正四面体形 平面三角形 四面体形 四面体形
直线形 平面三角形 正四面体形 V形 三角锥形 V形
练习5.用杂化轨道理论分析CH≡CH和BeCl2的的成键情况和空间结构。
CH≡CH
C ↑↓ ↑ ↑
2s
2p
sp杂化 ↑ ↑ ↑ ↑
一、杂化轨道类型的确定
杂化轨道数=中心原子的价层电子对数=中心原子孤对电子对数+中心原
子结合的原子数
例1.如何确定BF3和H3O+的中心原子的杂化轨道类型?
BF3
H3O+
第一步
杂化轨道的计算方法

杂化轨道的计算方法杂化轨道是描述化学中原子的电子云分布的概念。
它们是由原子轨道通过杂化形成的新的轨道,以适应化学键形成过程中的电子排列情况。
杂化轨道的计算方法主要涉及到原子轨道和杂化的轨道之间的线性组合。
一般而言,杂化轨道的计算方法可以分为以下几个步骤:1. 计算原子轨道:首先,根据原子的核电荷数和电子排布规则,可以使用量子化学的方法计算出每个原子的原子轨道。
原子轨道的计算方法包括Hartree-Fock方法、密度泛函理论等。
2. 确定杂化类型:根据分子中原子的排布情况和化学键的类型,可以确定杂化类型。
常见的杂化类型包括sp、sp2、sp3等。
每种杂化类型都有特定的轨道数量和排布方式。
3. 线性组合:根据杂化类型的确定,可以将原子轨道进行线性组合,形成新的杂化轨道。
线性组合的方法是将原子轨道按照一定的系数相加。
例如,sp杂化轨道可以由s轨道和p轨道进行线性组合得到。
4. 轨道能级计算:根据杂化结果,可以计算新的杂化轨道的能级。
通常来说,sp杂化轨道的能级比原子的s轨道低,比p轨道的能级高。
5.分析杂化结果:对于特定的分子,可以根据杂化结果来判断化学键的性质和形态,例如共价键、双键等。
还可以分析杂化轨道的几何结构,例如分子的键角和键长。
需要注意的是,杂化轨道的计算方法是一种近似的方法,它忽略了原子的真实电子分布情况,而是通过简化的线性组合来描述化学键的形成过程。
因此,在一些特殊情况下,杂化轨道的计算结果可能与实际情况有所偏差。
除了上述的基本计算方法外,还存在一些扩展的杂化轨道计算方法。
例如,分子轨道理论(Molecular Orbital Theory)可以将多个原子的原子轨道进行线性组合,得到分子轨道。
分子轨道理论是杂化轨道理论的进一步发展,可以用来描述更复杂分子体系中的电子行为。
总之,杂化轨道的计算方法涉及到原子轨道和杂化的轨道之间的线性组合。
通过计算和分析杂化轨道,可以得到原子和分子的电子云分布情况,从而理解和解释化学反应和分子性质。
杂化轨道计算

种计算杂化轨道数的方法方法一:公式:杂化轨道数=[中心原子价电子数 +配原子数一n 键数一电荷数]/2例 1 : SO 2(6+2-2)/2=3sp 2杂化。
说明: S 的价电子数6;配原子为2个氧原子,氧为二价,所以硫与氧间为双键,其一为n 键, 共二个n 键。
例 2: SO 3 (6+3-3)/2=3sp 2杂化。
(解析同上,下同)。
例 3: SO 32一(6+3-3+2)/2=4 sp 3杂化。
SO 32—带二个单位负电荷)。
例 4: SO 42一(6+4-4+2)/2=4 sp 3杂化。
例 5: CN 一 (4+1 — 2+1)/2=2 sp 1杂化。
(氮元素为三价,所以碳氮间为叁 例 10: H — N = N — H (5+2-1)/2=3 sp 2 杂化。
练习:sp 1杂化:BeCb 、CO 2; sp 2杂化:BF 3、HCHO (中心原子为C :(4+3-1)/2=3;sp 3杂化 CH 4、NH 3、H 2O 。
方法二:因为杂化轨道只能用于形成c 键或用来容纳孤电子对,故有: 公式:杂化轨道数=中心原子价层电子对数(成键电子对数+孤电子对数)结合上述信息完成下表:例 6: NH 4+ (5+4 — 1)/2=4 sp 3杂化。
例 7: CIO 3一 (7+3-3+1)/2=4 sp 3杂化。
例 8: PO 33一(5+3-3+3)/2=4sp 3杂化。
例 9: PO 43一 (5+4-4+3)/2=4sp 3杂化。
键,其中有二个n 键)。
杂化轨道数目

杂化轨道数目杂化轨道数目计算公式:(中心原子电子数+氢原子个数+卤素原子个数-氮原子个数)/2得杂化轨道数,2是sp,3是sp²,4是sp³,5是sp³d,6是sp³d²。
例:H₃COF,中心原子是C,(4+3+1)/2=4,是sp³杂化。
H₂PO₃⁻,中心原子是P,(5+2+1)/2=4,是sp³杂化。
HOCN,以C为中心原子,C的杂化,(4+1-1)/2=2,是sp杂化。
SOF₄,以S为中心原子,(6+4)/2=5,是sp³d杂化。
杂化轨道的角度函数在某个方向的值比杂化前的大得多,更有利于原子轨道间最大程度地重叠,因而杂化轨道比原来轨道的成键能力强(轨道是在杂化之后再成键)。
扩展资料:同一原子中能量相近的n 个原子轨道,组合后只能得到n个杂化轨道。
例如,同一原子的一个ns 轨道和一个npx轨道,只能杂化成两个sp杂化轨道。
这两个sp杂化轨道的形状一样,但其角度分布最大值在x轴上的取向相反。
杂化轨道比原来未杂化的轨道成键能力强,形成的化学键键能大,使生成的分子更稳定。
由于成键原子轨道杂化后,轨道角度分布图的形状发生了变化,形成的杂化轨道一头大一头小。
大的一头与别的原子成键时电子云可以得到更大程度的重叠,所以形成的化学键比较牢固。
ns轨道,np轨道,nd轨道一起参与杂化称为s-p-d型杂化,主要有以下几种类型:sp³d杂化:由一个ns、三个np轨道和一个nd轨道杂化形成五个能量等同的sp³d杂化轨道。
每个sp³d轨道都含有1/5个s、3/5个p和1/5个d成分。
构型为三角双锥。
sp³d²杂化:由一个ns、三个np轨道和二个nd轨道杂化形成六个能量等同的sp³d²杂化轨道。
每个sp³d²轨道都含有1/6个s、1/2个p和1/3个d成分。
杂化轨道计算

杂化轨道计算在化学的奇妙世界里,杂化轨道理论是理解分子结构和性质的重要工具。
它帮助我们解释了许多化合物的成键方式、几何构型以及化学性质。
而杂化轨道的计算,则是深入掌握这一理论的关键环节。
首先,我们来了解一下什么是杂化轨道。
简单来说,杂化轨道是原子在形成分子的过程中,若干不同类型、能量相近的原子轨道重新组合成一组新的轨道。
这些新的轨道在形状、方向和能量上都发生了变化,更有利于原子之间的成键。
常见的杂化类型包括 sp 杂化、sp²杂化和 sp³杂化。
sp 杂化是由一个s 轨道和一个 p 轨道杂化形成两个能量相等、夹角为 180°的直线型杂化轨道。
比如,在乙炔(C₂H₂)分子中,碳原子就采用了 sp 杂化。
sp²杂化是由一个 s 轨道和两个 p 轨道杂化形成三个能量相等、夹角为 120°的平面三角形杂化轨道。
例如,在乙烯(C₂H₄)分子中,碳原子就是 sp²杂化。
sp³杂化则是由一个 s 轨道和三个 p 轨道杂化形成四个能量相等、夹角为109°28′的正四面体杂化轨道,甲烷(CH₄)中的碳原子就是这种情况。
那么,如何计算杂化轨道呢?这需要我们先确定中心原子的价层电子对数。
价层电子对数的计算公式是:价层电子对数=(中心原子的价电子数+配位原子提供的电子数 ±离子电荷数)/ 2 。
其中,中心原子的价电子数等于其所在的族序数。
对于主族元素,配位原子提供的电子数通常为氢原子和卤素原子提供 1 个电子,氧原子和硫原子不提供电子。
如果是离子,带正电荷则减去电荷数,带负电荷则加上电荷数。
以氨气(NH₃)为例,氮原子是中心原子,其价电子数为 5,氢原子作为配位原子,每个氢原子提供 1 个电子,所以价层电子对数=(5 + 1×3)/ 2 = 4 ,氮原子采取 sp³杂化。
再比如水分子(H₂O),氧原子的价电子数为 6,氢原子每个提供1 个电子,价层电子对数=(6 + 1×2)/ 2 = 4 ,氧原子也是 sp³杂化。
杂化轨道计算

杂化轨道计算在化学的奇妙世界里,杂化轨道的概念是理解分子结构和性质的重要基石。
而掌握杂化轨道的计算,则能让我们更深入地洞察物质的微观构成和反应机制。
要明白杂化轨道计算,首先得清楚什么是杂化轨道。
简单来说,杂化轨道是原子在形成分子的过程中,若干不同类型、能量相近的原子轨道重新组合成一组新的轨道。
这些新轨道在能量和空间分布上更加有利于原子之间的成键和分子的稳定存在。
常见的杂化类型包括 sp 杂化、sp²杂化和 sp³杂化。
sp 杂化是由一个s 轨道和一个p 轨道杂化形成两个能量相同、方向相反的sp 杂化轨道,其夹角为 180°,比如乙炔(C₂H₂)中的碳原子就是 sp 杂化。
sp²杂化则是由一个 s 轨道和两个 p 轨道杂化形成三个 sp²杂化轨道,其夹角约为 120°,像乙烯(C₂H₄)中的碳原子就是这种情况。
sp³杂化是由一个 s 轨道和三个 p 轨道杂化形成四个 sp³杂化轨道,它们的空间分布呈正四面体,夹角约为109°28′,例如甲烷(CH₄)中的碳原子。
那怎么来计算杂化轨道呢?这得从原子的价层电子构型说起。
价层电子指的是原子在参与化学反应时可能用到的外层电子。
我们通过确定原子的价层电子对数,就能推测出其杂化类型。
价层电子对数的计算有个简单的公式:价层电子对数=(中心原子的价电子数+配位原子提供的电子数 ±离子电荷数)/ 2。
这里要注意,氧族元素作为配位原子时,不计算其提供的电子;如果是离子,还要加上或减去相应的电荷数。
举个例子,对于甲烷(CH₄),碳是中心原子,其价电子数为 4,氢作为配位原子,每个氢提供 1 个电子,所以价层电子对数=(4 +4×1)/ 2 = 4,因此碳原子是 sp³杂化。
再比如二氧化碳(CO₂),碳的价电子数是 4,氧作为配位原子,不计算其提供的电子,所以价层电子对数=(4 + 0)/ 2 = 2,碳原子就是 sp 杂化。
杂化轨道计算解读

杂化轨道计算解读
杂化轨道是描述电子在原子中运动的一种模型,它通过组合不同的原子轨道来形成新的分子轨道。
这种模型的使用可以帮助我们理解分子的几何结构、键的形成与性质等。
杂化轨道的计算方法主要分为两种:线性组合方法和矩阵方法。
其中线性组合方法更加直观,目前使用最广泛。
在线性组合方法中,首先要确定原子轨道的类型和数量,如s轨道、p轨道等。
然后通过对原子轨道线性组合形成新的分子轨道,这种线性组合的形式可以是加法或减法。
例如,在sp混合轨道中,s轨道与p轨道进行线性组合,形成两个等能级的新轨道。
sp混合轨道常见于碳原子,它能够形成四个sp3杂化轨道,用于形成碳氢化合物的四个单键。
杂化轨道的计算可以帮助我们解读分子的几何结构。
以CH4为例,根据VSEPR理论,碳原子的四个杂化轨道朝向四个大致相等的方向,形成一个平面的四面体结构。
这种结构能够最大程度地最小化相互斥,使分子更加稳定。
此外,杂化轨道的计算也可以解读化学键的性质。
根据Valence Bond理论,杂化轨道之间的重叠产生了化学键。
例如,氨分子的氮原子通过sp3杂化形成了一个孤对电子和三个成键轨道。
这三个成键轨道与氢原子的1s轨道重叠,形成了三个氮氢单键。
总的来说,杂化轨道的计算为我们提供了一种描述分子结构和化学键性质的有效工具。
通过对原子轨道的线性组合,我们能够解释并预测分子的几何结构和化学性质,从而进一步理解化学反应和分子的行为。
杂化轨道计算

二种计算杂化轨道数的方法
方法一:
公式:杂化轨道数=[中心原子价电子数 + 配原子数-π键数-电荷数]/2
2杂化。
sp (6+2-2)/2=3 例1:SO 2说明:S的价电子数6;配原子为2个氧原子,氧为二价,所以硫与氧间为双键,其一为π键,共二个π键。
2杂化。
(解析同上,下同)。
sp(6+3-3)/2=3 例2:SO 3232--带二个单位负电荷)。
SO sp 例3:SO杂化。
((6+3-3+2)/2=4 3323-杂化。
sp
(6+4-4+2)/2=4 例4:SO 41-杂化。
(氮元素为三价,所以碳氮间为叁sp (4+1-例5:CN2+1)/2=2
键,其中有二个π键)
+3杂化。
sp NH(5+4 -1)/2=4 例6:43-杂化。
sp (7+3-3+1)/2=4 例7:ClO 333-杂化。
sp PO:(5+3-3+3)/2=4 例8333-杂化。
sp
(5+4-4+3)/2=4 9例:PO42杂化。
sp-H (5+2-1)/2=3 例10:H-N=N
12杂化:BF 、spHCHO(中心原子为C:练习:sp 杂化:BeCl、CO;322(4+3-1)/2=3;3杂化CH、NH、HO。
sp 234
方法二:因为杂化轨道只能用于形成σ键或用来容纳孤电子对,故有:
公式:杂化轨道数=中心原子价层电子对数(成键电子对数+孤电子对数)。
化学杂化轨道计算公式

化学杂化轨道计算公式
化学中的杂化轨道理论(HybridOrbitalTheory,HOT)是描述物质结构和构型的重要理论,它能够揭示具体的原子间化学键的特征和形态。
杂化轨道理论是一种通用的计算方法,它可以用来计算物质的化学结构和构型。
关于杂化轨道理论,目前有不少研究结果已发表,但是这些研究结果往往使用不同的符号和公式,不便于实际应用。
为了便于实际应用,研究者们提出了一系列杂化轨道计算公式,以此能够统一计算不同的符号和公式,并得到准确的计算结果。
基本的杂化轨道计算公式包括:
1.能量计算公式:
总能量=基态能量+非原子轨道能量+拓扑结构能量
2.轨道(Nuclear Orbital)计算公式:
核轨道能量=质原子核轨道能量+接原子核轨道能量
3.子轨道计算公式:
原子轨道能量 =子轨道能量+外子轨道能量+子核轨道能量
4.扑结构能量计算公式:
拓扑结构能量 =缔合能量+互斥能量+结构畸变能量
以上就是杂化轨道理论的基本计算公式,它们可以用来计算不同类型的化学结构和构型,从而为化学研究工作和实际应用提供基础和支持。
此外,杂化轨道理论还可以用来计算其他化学相关领域的量,比
如分子结构、物理性能、反应机理、形成反应、转化反应等。
通过使用杂化轨道计算公式,可以更好地探究物质的化学机制,为更多化学问题的研究提供参考。
总而言之,杂化轨道理论是一种通用的计算方法,它被广泛用于描述物质结构和构型,并可以计算出物质的化学结构和构型。
杂化轨道计算公式是实现杂化轨道理论的基础,它们提供了一种通用的计算方法,可以精准的捕捉到不同的原子间化学键的存在,从而有效推进化学研究工作。
杂化轨道计算

杂化轨道计算杂化轨道是描述化学键形成过程中轨道杂化(即原子轨道的混合)的概念。
通过轨道杂化,原子可以形成稳定的化学键,并决定分子的几何构型和分子的性质。
在本文中,我们将探讨杂化轨道的计算方法及其在化学领域的应用。
1. 介绍杂化轨道的计算方法主要有两种:基于线性组合的杂化轨道理论(LCAO)和基于分子轨道理论的密度泛函理论(DFT)方法。
LCAO理论将原子轨道线性组合形成杂化轨道,从而描述键的形成过程。
DFT方法结合量子力学和统计力学的原理,通过计算分子轨道的电子密度分布来模拟分子的电子结构。
2. LCAO 杂化轨道的计算方法LCAO方法的核心思想是将原子轨道线性组合形成杂化轨道。
这种方法常用于描述有机分子中碳原子的杂化轨道形成过程。
以甲烷为例,甲烷分子中的碳原子通过将一个2s轨道和三个2p轨道线性组合形成四个sp3杂化轨道,与氢原子的1s轨道形成共价键。
通过数学计算,可以确定这些杂化轨道的形状和能量分布,进而确定分子的几何构型和分子的性质。
3. DFT 方法在杂化轨道计算中的应用密度泛函理论是一种基于统计力学和量子力学的计算方法,可用于计算分子的电子结构和杂化轨道形成过程。
通过计算分子轨道的电子密度分布,可以得到分子各个轨道的能量、分布和形状等信息。
这对于理解分子的化学性质和反应机理非常重要。
4. 杂化轨道计算在化学领域的应用杂化轨道计算在化学领域有着广泛的应用。
首先,它可以用于预测分子的几何构型和性质,如分子的偶极矩、振动频率和光谱性质等。
其次,杂化轨道计算可用于研究化学反应的机理和动力学,为设计新的催化剂和药物分子提供理论指导。
此外,在材料科学领域,杂化轨道计算也广泛应用于研究材料的电子性质和导电性能。
结论:杂化轨道计算是一种重要的化学计算方法,可用于模拟分子的电子结构和性质。
通过LCAO和DFT方法,可以获得分子的杂化轨道信息,从而理解分子的几何构型和化学性质。
杂化轨道计算在化学领域有着广泛的应用,为研究和设计新的分子和材料提供了重要的理论支持。
杂化轨道的计算方法

2、价电子对数计算法
对于ABm型分子(A为中心原子,B为配位原子),分子的价电子对数可以通过下列计算确定:n=1/2(中心原子的价电子数-每个配位原子予中心原子提供的价电子数×m),配位原子中卤素原子、氢原子提供1个价电子,氧原子和硫原子按提供2个价电子计算;若为离子,须将离子电荷计算在内:n=1/2(中心原子的价电子数-每个配位原子提供的价电子数×m±离子电荷数),阳离子取“-”,阴离子取“+”。
根据价电子对数可以有以下结论:
一般来讲,计算出的n值即为杂化轨道数,能直接对映中心原子的杂化类型。
如:SO42-的n=4,中心原子S原子为sp3杂化;NO3-的n=3,中心原子N原子为sp2杂化;ClO3-、ClO4-的n均为4,Cl原子均为sp3杂化(但离子空间构型不同,从价层电子对互斥模型看,前者为三角锥形,后者为正四面体型)。
这种方法不适用于结构模糊或复杂的分子、离子,如NO2+、H2B=NH2等的中心原子杂化类型学生就很难用该法进行判断,但可以从其它途径确定。
杂化轨道公式
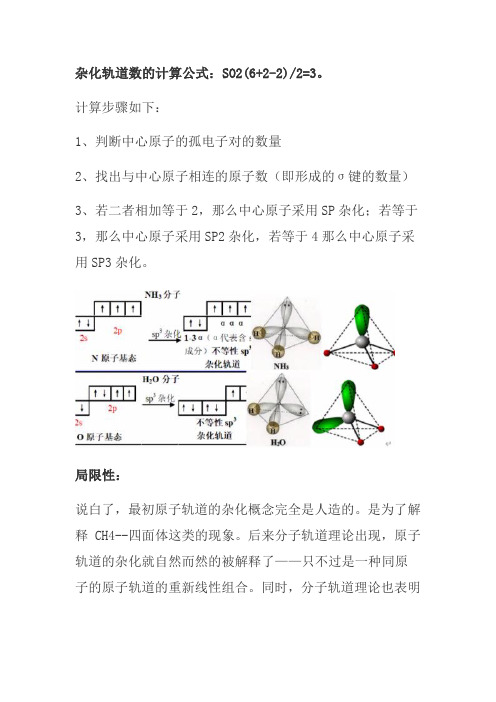
杂化轨道数的计算公式:SO2(6+2-2)/2=3。
计算步骤如下:
1、判断中心原子的孤电子对的数量
2、找出与中心原子相连的原子数(即形成的σ键的数量)
3、若二者相加等于2,那么中心原子采用SP杂化;若等于3,那么中心原子采用SP2杂化,若等于4那么中心原子采用SP3杂化。
局限性:
说白了,最初原子轨道的杂化概念完全是人造的。
是为了解释 CH4--四面体这类的现象。
后来分子轨道理论出现,原子轨道的杂化就自然而然的被解释了——只不过是一种同原子的原子轨道的重新线性组合。
同时,分子轨道理论也表明
了这种组合(杂化)没有实际上的意义,而且有时会引起混乱。
譬如:在杂化理论中,CH4中的八个成键电子是在同一种sp3轨道能级上。
但其实,它们是分在两个不同的能级上的(试验和分子轨道理论都表明了这一点)。
但是由于杂化概念的方便,特别是在有机化学中被用来表示一个原子在分子中的几何环境。
时至今日,杂化轨道仅被用来描述几何形状或环境。
杂化轨道计算

杂化轨道计算在化学的世界里,杂化轨道的概念是理解分子结构和性质的重要基石。
而杂化轨道的计算,则是深入探究这一领域的关键步骤。
首先,让我们来明确一下什么是杂化轨道。
简单来说,杂化轨道是原子在形成分子的过程中,原来不同类型的原子轨道重新组合形成的新的原子轨道。
这种重新组合可以使原子在成键时更加有效地重叠,从而增强化学键的稳定性。
那么,为什么要进行杂化轨道的计算呢?这是因为通过计算杂化轨道,我们能够预测分子的几何构型、化学键的性质以及分子的反应活性等重要信息。
常见的杂化轨道类型包括 sp、sp²、sp³等。
sp 杂化是由一个 s 轨道和一个 p 轨道杂化而成,形成两个能量相等、方向相反的杂化轨道,其夹角为 180 度。
比如,在乙炔(C₂H₂)分子中,碳原子就是 sp 杂化。
sp²杂化是由一个 s 轨道和两个 p 轨道杂化而成,形成三个杂化轨道,它们在同一平面上,夹角为120 度。
例如,在乙烯(C₂H₄)分子中,碳原子就是 sp²杂化。
sp³杂化则是由一个 s 轨道和三个 p 轨道杂化而成,形成四个等价的杂化轨道,其空间构型为正四面体,夹角约为 1095 度。
甲烷(CH₄)分子中的碳原子就是 sp³杂化的典型例子。
接下来,我们来探讨一下如何计算杂化轨道。
一种常用的方法是根据分子的几何构型来判断杂化类型。
例如,如果分子的几何构型是直线形,那么中心原子通常是 sp 杂化;如果是平面三角形,中心原子一般是 sp²杂化;而对于正四面体构型,中心原子往往是 sp³杂化。
另一种方法是通过价层电子对互斥理论(VSEPR)来计算。
首先,确定中心原子的价电子数,然后加上周围原子提供的电子数(氢原子提供 1 个电子,其他原子提供的电子数等于其化合价的绝对值),得到价层电子总数。
再将价层电子总数除以 2 得到价层电子对数。
例如,对于氨气(NH₃)分子,氮原子的价电子数为 5,加上三个氢原子提供的 3 个电子,总价层电子数为 8,除以 2 得到 4 对价层电子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二种计算杂化轨道数的方法
方法一:
公式:杂化轨道数=[中心原子价电子数+ 配原子数-π键数-电荷数]/2
例1:SO2(6+2-2)/2=3 sp2杂化。
说明:S的价电子数6;配原子为2个氧原子,氧为二价,所以硫与氧间为双键,其一为π键,共二个π键。
例2:SO3(6+3-3)/2=3 sp2杂化。
(解析同上,下同)。
例3:SO32-(6+3-3+2)/2=4 sp3杂化。
(SO32-带二个单位负电荷)。
例4:SO42-(6+4-4+2)/2=4 sp3杂化。
例5:CN-(4+1-2+1)/2=2 sp1杂化。
(氮元素为三价,所以碳氮间为叁键,其中有二个π键)
例6:NH4+(5+4-1)/2=4 sp3杂化。
例7:ClO3-(7+3-3+1)/2=4 sp3杂化。
例8:PO33-(5+3-3+3)/2=4 sp3杂化。
例9:PO43-(5+4-4+3)/2=4 sp3杂化。
例10:H-N=N-H (5+2-1)/2=3 sp2杂化。
练习:sp1杂化:BeCl2、CO2;sp2杂化:BF3、HCHO(中心原子为C:(4+3-1)/2=3;
sp3杂化CH4、NH3、H2O。
方法二:因为杂化轨道只能用于形成σ键或用来容纳孤电子对,故有:公式:杂化轨道数=中心原子价层电子对数(成键电子对数+孤电子对数)
价层电子对数中心原
子杂化
类型
电子对
的空间
构型
成键电
子对数
孤电
子
对数
分子的
空间构
型
实例
2 sp 直线 2 0 直线BeCl2、CO2
3 sp2三角形3 0 三角形BF3、SO3 2 1 V形SnBr2、PbCl2
4 sp3四面体4 0 四面体CH4、CCl4 3 1 三角锥NH3、PCl3 2 2 V形H2O
结合上述信息完成下表:
代表物杂化轨道数杂化轨道类型分子结构CO22+0=2 sp 直线形
CH2O 3+0=3 sp2平面三角形CH44+0=4 sp3正四面体形SO22+1=3 sp2V形
NH33+1=4 sp3三角锥形H2O 2+2=4 sp3V形。
