比热容的测量
大学物理实验空气比热容比的测定实验报告

大学物理实验空气比热容比的测定实验报告一、实验目的1、学习用绝热膨胀法测定空气的比热容比。
2、观测热力学过程中状态的变化及基本物理规律。
3、学习使用气压计、温度计等实验仪器。
二、实验原理气体的比热容比γ定义为定压比热容 Cp 与定容比热容 Cv 之比,即γ = Cp / Cv 。
对于理想气体,比热容比γ只与气体分子的自由度有关。
单原子分子气体(如氦、氖等)γ = 5/3,双原子分子气体(如氧气、氮气等)γ ≈ 7/5。
本实验采用绝热膨胀法测定空气的比热容比。
实验装置主要由储气瓶、玻璃管、气阀、压强计等组成。
实验过程中,首先关闭放气阀,使瓶内充满一定压强的气体。
打开放气阀,瓶内气体迅速绝热膨胀,压强降低,温度也随之降低。
由于放气时间很短,可以认为这是一个绝热过程。
绝热过程满足方程:p1V1^γ =p2V2^γ其中 p1、V1 为膨胀前气体的压强和体积,p2、V2 为膨胀后气体的压强和体积。
当瓶内气体压强从 p1 变化到 p2 时,测量出相应的压强值,再根据储气瓶的体积,就可以计算出空气的比热容比γ。
三、实验仪器1、储气瓶:储存一定量的气体。
2、压强计:测量瓶内气体的压强。
3、温度计:测量气体的温度。
4、气阀:控制气体的进出。
四、实验步骤1、实验前准备检查实验仪器是否完好,储气瓶及各连接处是否漏气。
读取初始压强 p0 和环境温度 T0 。
2、打开放气阀,使瓶内气体迅速绝热膨胀,待瓶内压强稳定后,关闭放气阀。
3、等待一段时间,使瓶内气体温度恢复到环境温度,读取此时的压强 p1 。
4、重复步骤 2 和 3 多次,记录多组数据。
5、实验结束后,整理实验仪器。
五、实验数据记录与处理|实验次数|初始压强 p0 (Pa) |最终压强 p1 (Pa) |环境温度 T0 (K) ||::|::|::|::|| 1 |_____ |_____ |_____ || 2 |_____ |_____ |_____ || 3 |_____ |_____ |_____ || 4 |_____ |_____ |_____ || 5 |_____ |_____ |_____ |根据绝热过程方程p1V1^γ = p2V2^γ,可得γ = ln(p0 / p1) /ln(V1 / V2) 。
空气比热容比的测量实验报告

空气比热容比的测量实验报告一、实验目的1、了解绝热膨胀法测量空气比热容比的原理和方法。
2、学习使用绝热膨胀法测量空气比热容比的实验仪器。
3、掌握数据处理和误差分析的方法,提高实验技能和科学素养。
二、实验原理比热容比γ定义为气体的定压比热容Cp与定容比热容Cv之比,即γ = Cp / Cv。
对于理想气体,γ是一个常数。
在本实验中,采用绝热膨胀法测量空气的比热容比。
实验装置主要由贮气瓶、U 形管压强计、打气球、阀门等组成。
首先,向贮气瓶内打入一定量的气体,使其压强达到一个较高的值P1。
然后迅速打开阀门,让气体绝热膨胀,此时瓶内气体的温度迅速降低,压强也随之下降到 P2。
由于过程绝热,满足绝热方程:P1V1^γ =P2V2^γ ①同时,根据波义耳定律,在等温过程中有:P1V1 = P2V2 ②由①②两式可得:γ = ln(P1 / P2) / ln(V2 / V1)在实验中,通过测量贮气瓶内气体压强的变化 P1 和 P2,以及相应的体积变化 V1 和 V2,就可以计算出空气的比热容比γ。
三、实验仪器1、贮气瓶:用于储存实验气体。
2、 U 形管压强计:测量贮气瓶内气体的压强。
3、打气球:向贮气瓶内打气。
4、阀门:控制气体的进出。
四、实验步骤1、实验前准备检查实验仪器是否完好,U 形管压强计中的液面是否平衡。
用打气球向贮气瓶内缓慢打气,使 U 形管压强计中的液面高度差达到一定值(例如 50cm 左右),记录此时的压强 P1。
2、绝热膨胀过程迅速打开阀门,让气体绝热膨胀,观察 U 形管压强计中液面的变化,待液面稳定后,记录此时的压强 P2。
3、重复实验重复上述步骤 5 6 次,以减小测量误差。
4、数据处理根据测量得到的 P1、P2 值,计算出每次实验的比热容比γ。
求平均值,并计算相对误差。
五、实验数据记录与处理|实验次数| P1(cmHg)| P2(cmHg)|γ ||::|::|::|::|| 1 | 525 | 382 | 142 || 2 | 518 | 375 | 143 || 3 | 532 | 388 | 141 || 4 | 520 | 378 | 142 || 5 | 528 | 385 | 141 || 6 | 530 | 386 | 142 |平均值:γ =(142 + 143 + 141 + 142 + 141 + 142)/ 6 = 142理论值:空气的比热容比γ约为 140相对误差:E =(142 140)/ 140 × 100% = 143%六、误差分析1、实验过程中,气体并非完全绝热,存在一定的热交换,导致测量结果偏大。
比热容的测定方法

比热容的测定方法
1. 混合法呀,就像你调鸡尾酒一样。
把不同温度的东西放一块儿,然后通过测量温度变化来算出比热容呢!比如说把热水和冷水混在一起,你想想看这多有意思呀!
2. 量热计法,这就像是给物体做个专门的体检。
把东西放进去,仔细测量各种数据,最后找到它的比热容,哇,是不是感觉很专业呢!
3. 冷却法呀,你可以联想一下给发烧的人降温的过程。
我们让热的物体慢慢冷却,通过观察冷却的情况来确定比热容,这很神奇吧!
4. 绝热法,这不就像是给物体包上一层温暖的毛毯嘛!看看它在绝热的情况下温度怎么变化,然后就能算出比热容啦,是不是很妙?
5. 电加热法,就好像给物体通上电流来取暖一样。
通过电的作用和温度的变化来搞清楚比热容,是不是很独特呀!
6. 我们还可以用热线法,想象一下有根热线在探测物体呢。
靠它来获取信息从而得到比热容,多好玩呀!
7. 辐射法,这如同太阳光照在物体上一样。
研究这种辐射带来的影响来测定比热容,很新奇吧!
8. 声波法呢,就像是用声音去和物体交流。
通过声波的传播和反应来找出比热容,哇塞,这也太独特了吧!
9. 还有相变法,就好比水变成冰的过程。
关注这个过程里的各种变化来确定比热容,太有意思啦!
我觉得这些测定比热容的方法都各有各的奇妙之处,都值得我们去深入了解和探索呀!。
比热容是如何测量的?

比热容是如何测量的?比热容是热学中一个重要的物理量,它用来描述物体在吸热或放热过程中的热量变化情况。
本文将介绍比热容的定义以及几种常用的测量方法。
一、比热容的定义比热容是指单位质量物质在单位温度变化下吸收或释放的热量。
它的计量单位是焦耳每千克每开尔文(J/kg·K)。
比热容可以用来表征物质的热惯性,即物体吸收或放出热量所需的温度变化。
二、恒压热容法恒压热容法是一种常用的测量比热容的方法。
在恒定的压力条件下,通过测量物质在不同温度下的热量变化,可以计算出比热容。
具体的实验步骤如下:1. 将待测物质置于一个恒温容器中,比如热水浴或恒温槽。
2. 在容器中加入一定量的热量,使物质温度升高。
3. 同时记录物质温度与所输入的热量变化值。
4. 通过计算物质的比热容,可以得出比热容的数值。
恒压热容法适用于固体、液体和气体等不同状态的物质,具有广泛的应用。
三、差热法差热法也是一种常用的测量比热容的方法。
它通过测量物质与热源之间的温度差异,计算比热容。
实验步骤如下:1. 将物质与热源接触,在一段时间内加热或冷却物质。
2. 同时记录物质温度的变化以及与热源接触的时间。
3. 利用热流量和温度差的关系,计算出物质的比热容。
差热法对于固体和液体热容的测量更为常见,它的优点是不需要特殊的设备,适用于简单实验。
四、绝热量热容法绝热量热容法是一种精确测量比热容的方法。
它通过控制物体与外界的热量交换,在绝热条件下测量比热容。
实验步骤如下:1. 将待测物质置于一个绝热容器中,确保与外界几乎没有热量交换。
2. 在一定时间范围内记录物质温度的变化。
3. 通过计算物质热量变化和温度变化的关系,得到比热容的数值。
绝热量热容法的优点是可以减少外界的热量干扰,提高测量的精确性。
但它需要精密的仪器和较长的实验时间。
综上所述,比热容可以通过恒压热容法、差热法和绝热量热容法进行测量。
每种方法都有其适用的范围和优缺点。
科学家们通过不断改进和创新,使比热容的测量方法更加准确和方便,为热学研究提供了重要的工具。
空气比热容比的测量实验报告

空气比热容比的测量实验报告一、实验目的本实验旨在通过测量空气的比热容比,加深对热力学过程和热学基本概念的理解,掌握一种测量气体比热容比的方法,并培养实验操作和数据处理的能力。
二、实验原理空气比热容比γ定义为定压比热容Cp与定容比热容Cv之比,即γ = Cp / Cv。
在热力学中,理想气体的绝热过程满足方程:pV^γ =常数。
在本实验中,我们利用一个带有活塞的圆柱形绝热容器,容器内封闭一定质量的空气。
通过改变活塞的位置,使容器内的气体经历绝热膨胀或绝热压缩过程。
测量绝热过程中气体压强和体积的变化,从而计算出空气的比热容比。
三、实验仪器1、储气瓶:储存一定量的压缩空气。
2、打气球:用于向储气瓶内充气。
3、压强传感器:测量气体压强。
4、体积传感器:测量气体体积。
5、数据采集器:采集和记录压强和体积的数据。
6、计算机:处理和分析实验数据。
四、实验步骤1、仪器调试检查各仪器连接是否正确,确保无漏气现象。
打开数据采集器和计算机,设置好采集参数。
2、测量初始状态用打气球向储气瓶内缓慢充气,直至压强达到一定值,记录此时的压强p1和体积V1。
3、绝热膨胀过程迅速打开活塞,使气体绝热膨胀,记录压强和体积的变化,直到压强稳定,此时的压强为p2,体积为V2。
4、绝热压缩过程迅速关闭活塞,使气体绝热压缩,记录压强和体积的变化,直到压强稳定,此时的压强为p3,体积为V3。
5、重复实验重复上述步骤多次,以减小测量误差。
五、实验数据记录与处理以下是一组实验数据的示例:|实验次数| p1(kPa)| V1(mL)| p2(kPa)| V2(mL)| p3(kPa)| V3(mL)|||||||||| 1 | 1050 | 500 | 700 | 700 | 950 | 450 || 2 | 1080 | 480 | 720 | 720 | 980 | 460 || 3 | 1060 | 510 | 680 | 750 | 960 | 440 |根据绝热过程方程pV^γ =常数,可得:p1V1^γ =p2V2^γ (1)p2V2^γ =p3V3^γ (2)由(1)式除以(2)式可得:p1V1^γ /p3V3^γ =p2V2^γ /p2V2^γ即:p1V1^γ /p3V3^γ = 1γ = ln(p1 / p3) / ln(V3 / V1)将上述实验数据代入公式,计算出每次实验的比热容比γ,然后取平均值。
固体比热容的测量

固体比热容的测量一、 实验目的 1、 掌握基本的量热方法——混合法;2、 测定金属的比热容;3、 学习一种修正散热的方法。
二、 实验仪器量热器、温度计( 0C 和 0C 各一支)、物理天平、待测金属粒、冰、停表、加热器、量筒等。
三、 实验原理1、 混合法测比热容依据热平衡原理,温度不同的物体混合后,热量将由高温物体传给低温物体,如果在混合过程中和外界无热量交换,最后达到均匀稳定的平衡温度。
根据能量守恒定律,高温物体放出的热量就应等于低温物体吸收的热量,即:本实验即根据热平衡原理用混合法测定固体的比热。
设量热器(包括搅拌器和温度计插入水中部分)的热容为C ,实验时,量热器内先盛以质量为0m ,温度为1t 的冷水,之后,把加热到温度为2t 质量为m 的待测金属块投入量热器中,经过热交换后,水量热器与金属块达到共同的末温θ,依热平衡方程有:))(()(1002t C c m t mc -+=-θθ (1)即 )())((2100θθ--+=t m t C c m c (2) 量热器的热容C 可以根据其质量和比热容算出。
设量热器筒和搅拌器由相同的物质制成,其质量为1m ,比热容为1c ,则C c m C '+=11 (3)式中C '为温度计插入水中部分的热容。
C '的值可由下式求出:式中V 为温度计插入水中部分的体积。
{}10-⋅'C J C 表示C '以J ·0C -1为单位时的数值,而{}3cm V 表示V 以cm 3为单位时的数值。
2、 系统误差的修正上述讨论是在假定量热器与外界没有热交换时的结论。
实际上只要有温度差异就必然会有热交换存在,因此实验结果总是存在系统误差,有时甚至很大,以至无法得到正确结果。
所以,校正系统误差是量热学实验中很突出的问题。
为此可采取如下措施:1)要尽量减少与外界的热量交换,使系统近似孤立体系。
此外,量热器不要放在电炉旁和太阳光下,实验也不要在空气流通太快的地方进行。
测量比热容比的方法

测量比热容比的方法在理解测量比热容比的方法之前,我们需要了解一些相关背景知识。
比热容是指物质在吸收或释放能量时所需要的热量。
我们通常使用比热容来描述物质的热学特性,以及其与其他物质之间的差异。
比热容是一个常数,通常用J/(g·K)表示。
比热容比是指两种物质比较其比热容的比率。
比热容比可以非常有用,因为它可以用来确定两种物质之间的相似性或不同之处。
还可以使用比热容比来推导出物质的其他性质,例如热传导性、密度等。
测量比热容比的方法有多种,下面介绍常见的三种方法:一、恒压比热容法恒压比热容法是最常见的测量比热容的方法之一。
该方法通过加热一定质量的物质并记录其溫度变化,来测量恒定压力下的比热容。
首先,我们需要将一定量(例如1克)的物质放置在恒温器中。
通过提供热量来加热这个系统,并记录溫度的变化。
一旦物质达到平衡,我们可以通过下列的公式来计算比热容:Cp = Q / (m * ΔT)其中,Cp是恒压比热容,Q是输入热量,m是物质的质量,ΔT是溫度的变化量。
如果我们想计算两种物质之间的比热容比,则需要按照相同的步骤对两种物质进行测量,最终比较它们的比热容即可。
二、恒容比热容法恒容比热容法是另一种常见的测量比热容比的方法。
该方法与恒压比热容类似,但其通过维持固定体积的条件下来测量恒定容积下的比热容。
实现该方法的一种常见方式是使用坚固的容器,例如热容量应该比测量物质的容积要大。
对于比较两种物质之间的比热容比,我们需要通过将不同的物质放入相同的容器中,以确保容积相等。
通过加热或降低温度来测量比热容,并按照上面提供的公式计算它们的比热容。
三、热量测量法热量测量法也是用于测量比热容比的一种方法。
该方法类似于通过测量输入的热量和物质的温度变化来计算比热容的恒压比热容法,但它的工作原理是不同的。
相反,热量测量法通过测量增加了热量的容器和物质的溫度变化来固定比热容,而不是提供固定质量的物质和确定的压力或容积。
无论使用哪种方法来测量比热容比,我们都必须控制实验条件,例如温度、容器尺寸等,以确保实验的准确性和可重复性。
空气比热容比的测定

实验二 空气比热容比和液体粘滞系数的测定(一) 空气比热容比的测定【实验简介】空气的比热容比 又称气体的绝热指数, 是系统在热力学过程中的重要参量。
测定 值在研究气体系统的内能, 气体分子的热运动以及分子内部的运动等方面都有很重要的作用。
如气体系统作绝热压缩时内能增加, 温度升高;反之绝热膨胀时, 内能减少, 温度降低。
在生产和生活实践中广泛应用的制冷设备正是利用系统的绝热膨胀来获得低温的。
除此以外, 测定比热容比还可以研究声音在气体中的传播。
由上可见, 测定气体的比热容比是一个重要的实验。
本实验采用绝热膨胀法测定空气的 值。
【实验目的】1.用绝热膨胀法测定空气的比热容比。
2.观察热力学过程中系统的状态变化及基本物理规律。
3.学习使用空气比热容比测定仪和福廷式气压计。
【实验仪器】空气比热容比测定仪(FD —NCD 型, 包括主机, 10升集气瓶连橡皮塞和活塞, 打气球, 硅压力传感器及同轴电缆, AD590温度传感器及电缆)、低压直流电源(VD1710—3A )、电阻箱(或 定值标准电阻)、福廷式气压计(共用)。
【实验原理】1.理想气体的绝热过程有 , 叫做理想气体的比热容比或绝热指数。
和 分别是理想气体的定压摩尔热容和定体摩尔热容, 二者之间的关系为 ( 为普适气体恒量) 2.如图所示, 关闭集气瓶上的活塞 , 打开 , 用打气球缓慢而稳定地将空气打入集气瓶内, 瓶内空气的压强逐渐增大, 温度逐渐升高。
当压强增大到一定值时, 关闭 , 停止打气。
待集气瓶内的温度降至室温 状态稳定时, 这时瓶内气体处处密度均匀, 压力均匀, 温度均匀。
此时取瓶内体积为 的一部分气体作为我们的研究对象, 系统处于状态1 , 这部分气体在接下来的膨胀中体积可以恰好充满整个瓶的容积 。
突然打开活塞 进行放气, 放掉多余的气体, 使系统迅速的膨胀, 达到状态2 , 随即又迅速关闭 。
是环境大气压。
由于放气过程迅速, 可视为绝热过程, 故有1102PV PV γγ= (1)3.关闭 后, 瓶内气体的温度会由 缓慢回升至室温 , 与此同时, 压强也会逐渐增大。
4 固体比热容的测量
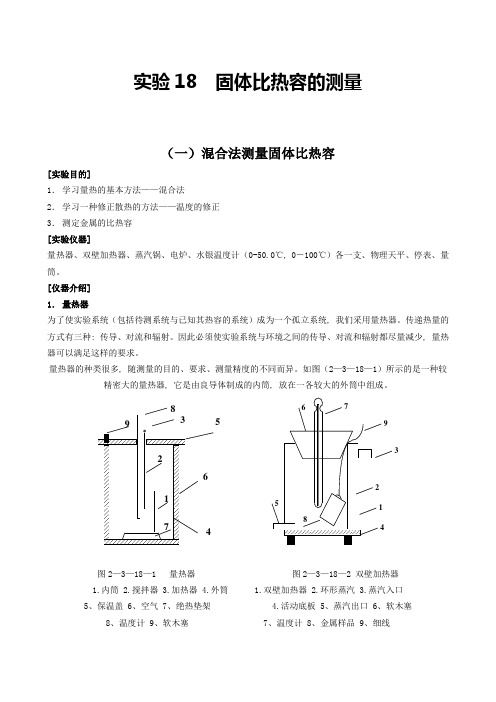
实验18 固体比热容的测量(一)混合法测量固体比热容[实验目的]1.学习量热的基本方法——混合法2.学习一种修正散热的方法——温度的修正3.测定金属的比热容[实验仪器]量热器、双壁加热器、蒸汽锅、电炉、水银温度计(0-50.0℃, 0-100℃)各一支、物理天平、停表、量筒。
[仪器介绍]1.量热器为了使实验系统(包括待测系统与已知其热容的系统)成为一个孤立系统, 我们采用量热器。
传递热量的方式有三种: 传导、对流和辐射。
因此必须使实验系统与环境之间的传导、对流和辐射都尽量减少, 量热2.外筒是双层结构, 空气封闭其中, 因为空气是热的不良导体, 故可避免空气传导而引起热量的损失;外筒上端的木盖可严密地盖着, 避免空气对对流所引起的热量损失;外筒的内壁和内筒的外壁均电镀得十分光亮, 可减少热辐射, 外筒的底部放上一个隔外筒的外表再包一层绒布, 这样就能使整个系统尽可能根据上述测量的T-t数据, 以T为纵坐标, 以t为横坐标, 即得如图(2—3—18—4)的T-t曲线。
A点对应的时刻就是测水温开始的时间 , B点对应的时刻就是, 而不是5分钟末的时间。
然后作图即得混合前后冷水的初温和末温T。
把各个物理量的测量值代入式(2-3-18-1)即可算出金属样品的比热容。
图(2—3—18—4)中的G点所对应的温度应为室温所在的位置, 这样才不影响温度的修正。
[实验内容和要求]1. 混合法测定铜块的比热容2.混合过程中散热的温度修正法3.混合前量热器(含水)系统温度低于室温(加冰块), 测量系统随时间吸热变化的温度。
4. 混合过程快速测量变化的温度5. 数据处理:Cx与标准值求百分误差[注意事项]1. 作温度值修正法曲线图, FE垂直于t轴, 满足S1=S2, 图中G点对应的温度接近室温为佳。
2. 从曲线图中定出初温T2和末温T。
[实验思考]请分析本实验主要的误差来源。
(二)冷却法测量金属的比热容[实验目的]学习冷却法测量金属比热容的方法[实验仪器]FB312型冷却法金属比热容测量仪[实验原理]根据牛顿冷却定律, 用冷却法测定金属的比热容是量热学常用方法之一。
比热容的测量 实验报告

( )
Δx Δy Δx^2 Δy^2
1 -2.08158
-180 4.332991
32400
2 -1.7448
-150 3.044337
22500
3 -1.38653
-120 1.922469
14400
4 -1.02533
-90 1.051298
8100
5 -0.66112
-60 0.437073
3600
的电热电源时的升温规律
当量热器中所称放的待测液体的质量为 m,比热容为 c,通电前后量热器 的初温和末温分别为 和 ,在测量过程中没有热量散逸的情况下,应有
[(
)]
()
本实验中采用拟合测量法,在同一来呢供热系统的容器内,盛不同质量的
待测液体,做几次实验,分别测出各次实验中的液体质量 及相应的总热
容 ,然后用直线拟合的方法求出待测液体的比热容,从而解决了(2)式
6 -0.35202
-30 0.123916
900
7 -0.0016
0 2.6E-06
0
8 0.332009
30 0.11023
900
9 0.688134
60 0.473528
3600
10 1.047299
90 1.096835
8100
11 1.369169
120 1.874624
14400
12 1.734278
12
f-t曲线 线性拟合曲线
对 m 和 Cs 进行拟合
m(g)
256.41 374.58
Cs(J/K) 619.6654 854.6516
456.18 1027.759
541.81 1235.758
《液体比热容的测量》课件

数据记录与处理
数据记录表
设计数据记录表,包括液 体样品名称、质量、初始 温度、最终温度、加热时 间等。
数据处理与分析
根据实验数据计算比热容 值,分析误差来源,得出 结论。
图表展示
制作图表展示实验数据, 便于观察和分析数据变化 趋势。
05
实验结果分析
数据处理与图表展示
数据处理
将实验测得的数据进行整理、筛 选和计算,得出每组实验数据对 应的比热容值。
液体比热容的物理意义
反映了物质在温度变化时吸收或释放 热量的能力,对于理解物质热性质、 热工设备设计等方面具有重要意义。
实验目的
01
掌握液体比热容的测量 原理和方法。
02
学习使用热量计进行实 验操作和数据处理。
03
理解实验过程中误差产 生的原因及减小误差的 方法。
04
通过实验加深对液体比 热容概念的理解,提高 实验技能和科学素养。
探索更精确的测量方法和技术 ,减小实验误差。
将实验结果与其他测量方法进 行比较,验证实验的准确性和 可靠性。
THANKS
感谢观看
02
比热容的基本概念
比热容的定义
01
比热容是指单位质量的物质温度 升高或降低1摄氏度所吸收或放出 的热量。
02
常用符号c表示,单位为焦耳每千 克摄氏度(J/kg·℃)。
比热容的物理意义
比热容是物质的一种特性,反映了物质吸收或放出热量的能 力。
物质的比热容越大,说明该物质在相同条件下吸收或放出的 热量越多。
操作流程如下 1. 将液体倒入测量杯中,称重并记录。
2. 将测量杯放入恒温水槽中,记录初始温度。
实验装置及操作流程
3. 开启加热器对液体 进行加热,同时使用 搅拌器使液体均匀受 热。
比热容的测量

• 如果在同一时刻测出物体内两个不同点的温度, 则其温度可表示为
qR k 1 r12 1 kFo 2k 2 2 R 2
-
qR k 1 r22 2 kFo 2k 2 2 R 2
根据定压比热容的定义可知只要测出气体的质量测出定压过程中气体与外界交换的热量并测出气体吸收该热量引起的温度变化便可由比热容的定义式计算出气体定压过程的比热气体温度变化实验装置导热系数的测定测定方法1
比热容的测量
• 测量原理:根据比热容的定义 • 测量方法 1.绝热量热法 2.水卡计法 3.气体定压比热容的测定
q 1 2 t1 t 2 r12 r22 2R
ห้องสมุดไป่ตู้
q r12 r22 2 Rt1 t2
准稳态法测定导热系数的装置
热线法的原理
• 原理:在初始温度均匀分布的无限大物体中, 放置一个常功率的线热源。当线热源发热时, 物体内部的温度将逐步变化,而变化的速率与 介质的物性有关。据此。可以根据介质温度的 变化来测定介质的导热系数。 • 当线热源足够长时,介质内的温度分布可表示 为 ql r0 C ln 2 4a
ql ln 1 ln 2 4 1 2
气体在喷管中的流动
• 实验目的是: 1.巩固和验证有关喷管基本理论。熟悉不同形式 喷管的机理,掌握气流在喷管中的流速、流量、 压力变化的基本规律及有关测试方法。 2.对渐缩喷管或缩放喷管进行下列测定: 测定不同工况时气流在喷管中的流量; 确定临界压力。 测定不同工况时气流沿喷管各截面
比热容的定义
比热容测试

比热容测试(Specific Heat Capacity Test)是一种量化测量物质温度变化所需的热量的实验。
它是一种热力学测试,用于测量物质抵抗热能的能力,以及温度变化所需的热量量和物质的改变。
比热容测试是一种常用的实验,它可以帮助科学家们更好地理解物质如何在温度变化时发挥作用,以及物质的各种性质如何影响温度变化。
比热容测试具有多种应用,其中最常见的应用是测量液体的比热容,它可以测量液体的热量传递率和热容量。
测量液体的比热容可以帮助更好地理解液体的热物理性质,并且可以为液体的流动性和传热性等性质提供重要的参考资料。
比热容测试也可以用于测量固体物质的比热容,它可以帮助科学家们更好地理解固体物质的热物理性质。
例如,比热容测试可以帮助科学家们更好地理解固体物质在加热过程中的温度变化,以及固体物质的改变和性质变化。
此外,比热容测试还可以用来测量各种物质的比热容,以及它们的表现在不同环境中的温度变化情况,可以帮助科学家们更好地理解物质在不同环境中的温度变化规律。
总之,比热容测试是一种重要的实验,它可以帮助科学家们更好地理解物质的热物理性质,以及物质在温度变化时的变化情况,从而为科学研究提供重要的参考资料。
比热容的测量_实验报告

一、实验目的1. 了解比热容的概念和意义;2. 掌握测量物质比热容的方法和步骤;3. 熟悉实验器材的使用方法;4. 通过实验,提高学生的动手能力和分析问题、解决问题的能力。
二、实验原理比热容是指单位质量物质温度升高1K所需吸收的热量。
其公式为:c = Q/(mΔT),其中c为比热容,Q为吸收的热量,m为物质质量,ΔT为温度变化。
实验原理:利用量热器测量物质在吸收热量过程中的温度变化,通过公式计算得到物质的比热容。
三、实验器材1. 量热器(包括量热器筒、搅拌器、温度计等);2. 待测物质;3. 热源(如电热丝);4. 天平;5. 秒表;6. 搅拌棒;7. 温度计;8. 计算器。
四、实验步骤1. 准备实验器材,确保量热器内无水滴、杂质等;2. 用天平称量待测物质的质量m;3. 将待测物质放入量热器筒中,用温度计测量初始温度T1;4. 将电热丝插入量热器筒中,接通电源,加热待测物质;5. 观察温度计,当温度升高至预定值时,关闭电源,立即用搅拌棒搅拌量热器筒中的物质,使其温度均匀;6. 待温度稳定后,记录终温T2;7. 计算比热容c = Q/(mΔT),其中Q为加热过程中电热丝产生的热量,可由功率和时间计算得到。
五、实验数据及结果1. 待测物质质量m:100g;2. 初始温度T1:25.0℃;3. 终温T2:35.0℃;4. 加热时间t:30s;5. 电热丝功率P:100W。
根据公式Q = Pt,计算得到Q = 100W × 30s = 3000J。
比热容c = Q/(mΔT) = 3000J/(100g × 10K) = 0.3J/(g·K)。
六、实验分析1. 通过实验,成功测量了待测物质的比热容,验证了实验原理;2. 实验过程中,温度计、搅拌棒等器材的使用较为熟练,提高了实验技能;3. 在实验过程中,注意了实验安全,遵守实验操作规程。
七、实验总结1. 本实验通过测量物质比热容,加深了对比热容概念的理解;2. 实验过程中,掌握了测量物质比热容的方法和步骤,提高了实验操作能力;3. 通过实验,培养了学生的团队合作精神,提高了学生的综合素质。
固体比热容的测量(混合法)※

固体比热容的测量(混合法)※固体比热容的测量通常采用热力学混合法。
该方法是通过测量一个固体和一个已知比热容的液体在等温条件下混合的温度变化来计算固体的比热容。
以下是介绍固体比热容测量方法的步骤。
1. 确定实验所需材料及器具:固体样品、液体样品、烧杯、温度计、加热装置。
2. 准备工作:将烧杯插在下部加热器上,加热器温度不宜过高。
在加热过程中根据需要将匀流器或稳压器直接接在下部加热器的出口处,以便能调节加热器温度。
3. 将固体样品测量摆放在烧杯的底部;加入一定量的液体样品(如水)至烧杯内,使用温度计在稳定状态温度 $T_1$ 时记录该液体样品的温度值。
4. 加热加热器保持不变的温度 $T_2$ ,并将其稳定在潜在值。
当加热器温度稳定时,关闭加热器并快速将计算出固体样品的质量称量到烧杯中。
5. 快速搅拌烧杯使固体样品均匀混合在液体样品中,迅速记录该混合溶液的初始温度变化值 $T_3$ 。
6. 监测混合液体的温度,记录其平衡后的温度值 $T_4$ 。
7. 计算固体的比热容:根据热平衡原理及混合溶液的热量关系计算固体的比热容。
具体计算方法如下:由热平衡原理:$mc\Delta T_3 + mc\Delta T_1 = Mc\Delta T_4$其中 $m$ 和 $c$ 分别为溶液中的总质量和比热容,$M$ 为固体质量;因为 $c$ 是已知的,则由方程可得$c_s = \frac{(M/m)c(T_4 - T_1) - c(T_3 - T_1)}{(T_4 - T_3)}$其中 $c_s$ 为固体比热容。
注意:1. 实验要求精密地称量所有样品和溶液,严格按照实验步骤操作。
2. 请使用精密实验用的温度计,将其放置在容器内部并充分混合液体和固体。
3. 在实验过程中,请保持室温和实验空间温度尽可能稳定。
4. 实际工作中,若有多部位同时测量固体中的比热容,需要分别比对各个测量值。
总结:热力学混合法是实验室中比较简便的测量固体比热容的方法。
气体比热容比的测定实验报告及数据

气体比热容比的测定实验报告及数据一、实验目的1、了解气体比热容比的物理意义。
2、学习用绝热膨胀法测定空气的比热容比。
3、掌握相关实验仪器的使用方法。
二、实验原理气体的比热容比γ定义为定压比热容Cp与定容比热容Cv之比,即γ = Cp / Cv。
对于理想气体,比热容比γ只与气体分子的自由度有关。
对于单原子分子气体(如氦气、氩气等),γ = 5/3;对于双原子分子气体(如氧气、氮气等),γ ≈ 7/5;对于多原子分子气体,γ 值更大。
本实验采用绝热膨胀法测定空气的比热容比。
实验装置主要由储气瓶、打气球、U 形压强计、阀门等组成。
当储气瓶内的气体被绝热压缩时,气体温度升高,压强增大;当气体绝热膨胀时,温度降低,压强减小。
通过测量气体绝热膨胀前后的压强和温度变化,可以计算出气体的比热容比。
根据绝热过程方程:$P_1^{1 \gamma}T_1^{\gamma} = P_2^{1 \gamma}T_2^{\gamma}$其中,$P_1$、$T_1$为绝热压缩前气体的压强和温度,$P_2$、$T_2$为绝热膨胀后气体的压强和温度。
两边取对数可得:$\ln{P_1} +\gamma\ln{T_1} =\ln{P_2} +\gamma\ln{T_2}$整理可得:$\gamma =\frac{\ln{P_1} \ln{P_2}}{\ln{T_2} \ln{T_1}}$三、实验仪器1、储气瓶:储存实验气体。
2、打气球:用于向储气瓶内充气。
3、 U 形压强计:测量储气瓶内气体的压强。
4、温度计:测量气体的温度。
5、阀门:控制气体的进出。
四、实验步骤1、实验前,检查仪器是否完好,U 形压强计是否调零,温度计是否准确。
2、打开阀门,用打气球向储气瓶内缓慢充气,直至 U 形压强计的示数达到一定值(例如 150 mmHg)。
关闭阀门,记录此时的压强$P_1$和温度$T_1$。
3、迅速打开阀门,使储气瓶内的气体绝热膨胀,当 U 形压强计的示数稳定后,关闭阀门,记录此时的压强$P_2$和温度$T_2$。
金属比热容的测量

实验步骤:
• 1.用铜-康铜热电偶测量温度,由数字电压 表mV数查表即可换算成温度。
• 2. 将三种金属样品(铜、铁、铝)用物理天平 质量M,再根据MCu>MFe>MAl这一特点,把 它们区别开来。
3.使热电偶热端的铜导线与数字表的正端
相连;冷端铜导线与数字表的负端相连。
当数字电压表读数为某一定值即200 时, 两样品的表面状况也相同(如涂层、色泽等),而周围介质(空气)的性质当然也不变,则有
利用简化后的公式:
C2
C1
M1(t)2 M2(t)1
计算铁和铝的比热容 ,选取铜的比热容 0.0940cal/(goC)计算。
实验数据处理 1.将数据填入下表
次数 样品
1
2
3
4
5
平均 值
误差
Fe Cu Al
2.利用公式:
为金属样品在 时的温度下降速率。
同温度的比热容,通过作冷却曲线可测量各 F、三位半数字电压表、G、冰水混合物组成。
C、铜-康铜热电偶、D、热电偶支架、 面积,m为常数, 为金属样品的温度, 铁、铜、铝的次序,分别测 其单位时间的热量损失 ( )与
比热容:单位质量的物质,其温度升高1K(oC)
种金属在不同温度时的比热容。
量其温度下降速度,每一样品重复测量5次。
附:热电偶分度表
感谢观看
0.156 0.549 0.951 1.361 1.780 2.207 2.643 3.087 3.538 3.998
0.195 0.589 0.992 1.403 1.822 2.250 2.687 3.131 3.584 4.044
0.234 0.629 1.032 1.444 1.865 2.294 2.731 3.176 3.630 4.091
金属比热容的测量常用文档

时冷却速率之比,就可以求出待测的金属 如果已知标准金属样品的比热容C1质量M1;
材料的比热容C 。 F、三位半数字电压表、G、冰水混合物组成。
2 于是当周围介质温度不变(即室温 恒定而样品又处于相同温度
利用简化后的公式:
C2
C1
M1(t)2 M2(t)1
计算铁和铝的比热容 ,选取铜的比热容 0.0940cal/(goC)计算。
实验数据处理 1.将数据填入下表
次数 样品
1
2
3
4
5
平均 值
误差
Fe Cu Al
2.利用公式:
C2
C1
M1(t)2 M2(t)1
计算铁和铝的比热容
0
1
2
3
4
5
6
7
温度
实验步骤:
• 1.用铜-康铜热电偶测量温度,由数字电压 表mV数查表即可换算成温度。
• 2. 将三种金属样品(铜、铁、铝)用物理天平 质量M,再根据MCu>MFe>MAl这一特点,把 它们区别开来。
3.使热电偶热端的铜导线与数字表的正端 相连;冷端铜导线与数字表的负端相连。 当数字电压表读数为某一定值即200 oC 时, 切断电源移去电炉,样品继续安放在与外 界基本隔绝的金属圆筒内自然冷却(筒口须 盖上盖子)。当温度降到接近102 时o开C 始 记录,测量样品由102 下降oC到98 所o需C 要时间 。按t 铁、铜、铝的次序,分别测 量其温度下降速度,每一样品重复测量5次。
0.156 0.549 0.951 1.361 1.780 2.207 2.643 3.087 3.538 3.998
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
比热容的测量物质比热容的测量是物理学的基本测量之一,属于量热学的范围。
量热学的基本概念和方法在许多领域中有广泛应用,特别是在新能源的开发和新材料的研制中,量热学的方法都是必不可少的。
由于散热因素多而且不易控制和测量,量热实验的精度往往较低。
为了做量热实验,常常需要分析产生各种误差的因素,考虑减少误差的方法,提高实验能力。
1. 实验目的(1) 学习测量液体比热容的原理和方法;(2) 了解量热实验中产生误差的因素及减少误差的措施。
2. 实验原理当一个孤立的热学系统最初处于平衡态时,它有一初温T1;当外界给予该系统一定热量后,它又达到新的平衡时,有一末温T2。
如果该系统中没有发生化学变化或相的转变,那么该系统获得的热量为=(m1c1 + m2c2 + …)(T2-T1) (1)式中m1,m2,…为组成系统的各种物质的质量,c l,c2,…为相应物质的比热容。
比热容的含义是单位质量的物质温度升高1K所吸收的热量,单位为焦耳/千克⋅开或焦耳/克⋅开。
20℃纯水的比热容为4.182 J/g⋅K,其他物质的比热容大都小于纯水。
例如变压器油20℃时的比热容为1.892 J /g⋅K,金属的比热容在0.13—1.3J/g⋅K之间。
物质的质量m与其比热容c的乘积称为热容。
用大写字母C 表示,单位为焦耳/开,即J/K。
进行物质比热容的测量时,必须用到量热器、温度计、搅拌器等等。
它们是由多种不同材料制成的。
为了简便而又不影响结果,可将量热系统里除待测物质以外的其他所有器具的热容量统统折合成水所相当的热容W,称为它们的“水当量”。
本实验是测定液体的比热容。
方法可有多种,如混合法(将已知热容和温度的固体与待测液体混合的方法),比较法(将待测液体与已知比热容的纯水在同样实验条件下比较的方法)等。
本实验中采用直接测量比热容的方法,即由电热丝给待测液体供热,直接测出比热容,既可以避免混合法中由于固体投入液体的过程中产生的散热误差,又可减少比较法中不易满足实验条件而带来的麻烦。
在量热器内安装电热丝,通以电流,在一定的时间内电热丝放出的热量为(2)式中V为加在电热丝两端的电压,R为电热丝的电阻,τ为通电的时间。
式中各量的单位均为SI单位。
如果该量热器中所盛放的待测液体的质量为m,比热容为c,通电前后量热器的初温和末温分别为T1和T2,在测量过程中没有热量散逸的情况下应有(3)由(3)式可得[ ](4)这里,量热系统的水当量W的确定是个困难问题。
当然,可以将量热筒、搅拌器和温度计的质量和比热容分别测出或查出,然后进行计算。
这显然比较麻烦,误差也不小,而且某些材料的比热容还不一定能查出。
本实验中巧妙地采用拟合测量法来解决这个问题。
在同一量热系统的容器内,盛不同质量的待测液体,做几次实验,分别测出各次实验中的液体质量m i及相应的总热容C si,然后用直线拟合的方法求出待测液体的比热容。
就每一次不同的m i,(4)式可改写为[](5)上式右侧为各次测量中量热系统的总热容C si(6)由(6)式可知系统总热容C si和质量m i是线性关系,直线斜率即比热容c,直线的截距为水当量W(严格说W也不是定值,只是相对于待测液体热容来说,它所占的比例小,其值的变动可忽略)。
这样,就解决了实验中求水当量的困难。
另外,式(5)和(6)的成立条件是在量热实验过程中没有热量散逸。
实验中从T1升温到T2的过程中不可避免地存在散热问题。
为了减少散热,实验时使量热筒内外温差以及量热筒的初末温差不要过大(也不要过小,以至降低测量准确程度),还要考虑散热影响。
考虑到实验时量热筒周围空气处于自然对流状态,由传热学理论可知,系统因散热引起的温度变化速率与系统和环境间温度差近似符合以下关系式dd≈ k θ 5/4(7)式中T为系统温度,θ为环境温度,T>θ。
而仅考虑加热时,令,(5)式可写成微分形式[ dd],则有dd(8)综合考虑(7)式和(8)式,系统总升温速率应为系统内热源加热引起的温度变化速率与系统因散热引起的温度变化速率之和,即ddkθ5/4(9)记内外温差(T-θ) = δ, 实验中θ近似保持恒定,则d T =d(T-θ) =dδ,上式可变形为dδk δ5/4d (10)一般总使加热功率显著大于散热热流,即P >> kC siδ5/4,这时上式左边可作近似展开,展开后积分略去四次方以上的项后左右交换,可得[δ49(k )δ9/47(k )δ7/ 49(k )3δ 9/4]a即:f k ,δ a(11)如果已知kC si的值[可以证明,本实验中kC si近似为定值,我们可以通过控温法测得kC si——固定加热功率使系统温度稳定,T-θ恒定,则(9)式左侧为0,kC si可求],通过实验测出一定质量液体m i在某一恒定电功率P i加热时一系列时间τ和温差δ=T-θ的值之后,就可以拟合出直线方程fδa bf δ a,其斜率b,进而可得b (12)(4) 时间与温度测量时间测量采用秒表计时。
温度的测量可以采取直接测量也可以采取间接测量,我们实验中采用镍铬康铜热电偶(E型)来间接测量,当热电偶冷端温度为0℃时其温差电势可以由下式来表述:U0.058655 4.503×10 5(13)其中,温差电势U(T)单位为mV,温度T单位为℃。
实际实验时量热系统浸在一个大水箱内,利用水的比热容大,量热系统散热对其温度影响很小因而可以模拟恒定的环境温度θ,同时测温热电偶的冷端也浸在水箱中,这时由数字毫伏表测得的热电偶热端(位于量热筒内的液体中)、冷端(位于模拟环境温度的水箱中)间的电势应为与两者所处温度相对应的(13)式决定的电势的差值:∆U U U θ (14)实验中T的计算过程为:首先用水银温度计测量水箱温度θ(考虑到量热系统散热使得实验过程中水箱水温有所改变,可以简化取实验起始、结束两个时刻水箱内水温的平均值作为水箱温度θ),再把θ代入(13)式求出U(θ),根据(14)式,由数字毫伏表测得的ΔU加上U(θ)即可得出U(T),最后由式(13)解二次方程就可以得到T。
3. 实验装置:实验装置如图1所示。
其水箱容积较大,盛以足量的水后可以保持环境温度不变。
量热筒是不锈钢制成的圆筒,筒壁光亮,以减少因辐射而产生的热传递。
筒的外盖和支架均用绝热材料制成。
加热丝、温度计、搅拌器和小漏斗都安装在量热筒的外盖上,量热筒上还配有一金属内盖为防止蒸发用的。
整个量热筒及其支架放置在水箱中的空腔内。
电热丝是用电阻温度系数很低的锰铜丝绕制的,其阻值可用比较法测出,加热时电热丝接直流稳压电源,电压调至10~20V,用数字万用表20V档监测(精度约0.1%)。
搅拌器小电机接5V直流电源,以尽量减小其电功率。
量热筒内的液体温度用热电偶测量,其输出电势差由数字毫伏表测量。
水箱温度由0~100℃的水银温度计(分度值为1℃)测量。
小漏斗是用来注入待测液体的。
4. 实验步骤(1) 熟悉实验装置中加热器、搅拌电机、热电偶等的相对位置和工作条件。
(2) 用水银温度计测量水箱温度θ,实验开始、结束时各测1次。
(3) 测6组不同煤油质量的升温“曲线”用6组不同质量的煤油{m i}和相应的加热功率{P i=V i2/R},分别测量出温差δ=T-θ与时间τ的对应数据(直接测量量为温差电势差ΔU和参考端水箱内的温度θ),每隔30秒读一次温差电势值。
注意事项如下:①实验前,应将量热筒的内外壁擦干净。
筒内各器件上也不留残液。
②首次煤油质量稍大于250g,,或体积稍大于300ml,以使加热丝没入煤油中。
此后每次适当给量热筒内添加约80 g(100ml)煤油后调整加热电压再测升温曲线,保证搅拌时量热筒内煤油不荡出。
③煤油中的热电偶端既不能碰到加热丝和搅拌用的扇叶,又必须没入煤油中,必须认真查看,否则数据将错误。
热电偶输出端和数字毫伏表相连,端钮和其它导电部分避免互相触碰。
另外还尤其要防止两股热电偶丝扭结造成自身短路致使温度测量错误。
④既要注意听到搅拌电机的声音,又要监视电机电压使其不超过6伏。
⑤建议每组测量12~16个连续的温差电势,开始2~3个数据一般舍去不用,因为初始几个读数尚未达到动平衡状态。
⑥必须调节加热电压(加热电压V用数字万用表直流20V档测量),使30秒内温升对应的温差电势增加约在0.012~0.030mV之间,即让30秒的温升约0.2~0.5度,之后保持加热电压恒定测量τ、ΔU。
⑦在加热回路中接入开关。
在测量开始时才通电加热,加热稳定后记录数据。
测完数据后应断开开关。
(4) 控温法测量常量kC si的值(本实验中近似认为kC si为常量,只需测一次即可)在T-θ>15℃时(即ΔU >0.9mV),调节加热电压取较小的合适值,使温差T-θ在几分钟内基本保持不变(即让温差电势的改变不大于±0.001mV),这时有kθ5/40,由此可得常量kC si(单位为WK-5/4)kθ 5/4控温θ 5/4(15)(5) 测量加热丝的电阻(1次测量即可)用比较法,将20.0Ω的电阻箱和加热丝串连,所加电源电压约取3V,用数字万用表的2V档分别测量电阻箱和加热丝上的电压后根据比例关系可以求出加热丝电阻R。
5. 数据处理步骤简述(1) 直线拟合求总热容C si课上用实验室Excel模板对6组煤油质量m i的升温曲线数据进行处理,以(11)式中的f k ,δδ49(k )δ9/47(k )δ7/ 49(k )3δ 9/4图1测液体比热容实验装置图为自变量、以时间τ为因变量拟合直线,得直线斜率b i ,再乘以电热丝加热功率P i 得总热容C si =P i b i 。
*课后可以自己选取1条升温曲线数据进行数据处理,求C si ,进一步加深对实验原理的理解。
(2) 求煤油的比热容c以m i 为自变量,C si 为因变量,求出C si =m i c +W 的斜率,即为所求的煤油比热容c 。
(3) 求比热容c 的不确定度(A 类)∆c最小二乘法直线拟合时斜率b (即比热容c )的相对标准差与相关系数的关系为:()()212--=-n r b S b (16)用此式可求出比热容的标准差S c 。
若不考虑B 类不确定度分量的影响,只计算与直线拟合有关的A 类不确定度,则c 的不确定度为∆c ≈∆c (A 类) = t ⋅ S c (17)最后写出比热容的完整结果。
(17)式中t 是置信概率为95%的t 分布的因子。
t 与自由度ν = n −2有关, n =4时,t = 4.30;n = 5时,t = 3.18;n = 6时,t = 2.78。
6. 其它实验注意事项(1) 小心操作,尽量不使煤油洒出(遗洒的少量煤油要及时擦干净,废纸扔进纸篓)。
煤油应通过漏斗缓缓倒入小不锈钢筒内,切勿直接倒入水箱空腔内。
