蛋白质的结构dl
亮氨酸同分异构体

亮氨酸同分异构体亮氨酸是一种存在于人体内的非必需氨基酸,也是一种生物活性较强的分子。
亮氨酸具有一个手性碳原子,因此存在多个同分异构体。
同分异构体指的是具有相同分子式但空间结构不同的分子。
以下将详细介绍亮氨酸的同分异构体。
首先,亮氨酸的同分异构体主要有两种:L-亮氨酸和D-亮氨酸。
它们分别是左旋和右旋的光学异构体,其化学性质和生物活性也有所不同。
L-亮氨酸是最常见的亮氨酸同分异构体,也是在自然界中存在的唯一形式。
它是蛋白质合成中必需的氨基酸之一,参与构建蛋白质链的过程。
L-亮氨酸的空间结构与D-亮氨酸完全不同,因此其化学性质和生物活性也有较大差异。
L-亮氨酸在人体内具有多种功能,如参与肌肉合成和修复,促进生长发育,提供能量等。
与L-亮氨酸相比,D-亮氨酸在生物体内含量较少,且其生物活性也相对较低。
D-亮氨酸在自然界中很少见,但在实验室中可以通过合成或改造微生物基因工程的方法制备得到。
D-亮氨酸在一些特定的生物过程中扮演重要角色,比如参与细菌细胞壁的合成和维持细胞结构的稳定性。
除了L-亮氨酸和D-亮氨酸,还存在其他亮氨酸的同分异构体。
例如,DL-亮氨酸是由等量的L-亮氨酸和D-亮氨酸混合而成的混合物。
DL-亮氨酸的性质介于L-亮氨酸和D-亮氨酸之间,具有部分的生物活性。
另外,还有一种叫做3-氢基-4-甲基亮氨酸的同分异构体,它与L-亮氨酸的结构非常相似,但在化学性质上有一定差异。
同分异构体在生物体内起着不同的作用,它们参与了许多重要的生物过程。
通过研究同分异构体的性质和功能,科学家可以更好地了解分子的构建和特性,进而为生物医学领域的研究和药物设计提供基础。
此外,对亮氨酸同分异构体的研究还有助于人们更好地了解蛋白质合成和代谢过程,为保健和营养学领域的研究提供重要参考。
总结一下,亮氨酸是一种存在于人体内的非必需氨基酸,具有多个同分异构体。
其中,L-亮氨酸是最常见的形式,具有重要的生物活性。
D-亮氨酸在生物体内含量较少,具有较低的生物活性。
dl氨基酸分类方法

dl氨基酸分类方法dl氨基酸是指由两种光学异构体混合而成的氨基酸。
它们的名称中含有“dl”前缀,代表了它们的光学异构体性质。
在化学中,分子的光学异构体是由于手性中心的存在而引起的。
光学异构体是指具有相同分子式和结构式,但在三维空间中呈镜像对称的两种分子形式。
在自然界中,大多数有机分子都存在手性,即它们的光学异构体。
在生物学中,氨基酸是生命体中非常重要的基本组成部分,它们的手性对生命体的正常生理功能有着重要的影响。
根据光学异构体的性质,可以将dl氨基酸分为两类:D型和L型。
D型氨基酸是指具有右旋性的光学异构体,而L型氨基酸是指具有左旋性的光学异构体。
这两种形式的氨基酸在自然界中的存在比例不同,L型氨基酸在生物体中普遍存在,而D型氨基酸的存在比例较少。
在自然界中,大多数氨基酸都是L型氨基酸。
例如,天然蛋白质中的氨基酸都是L型氨基酸。
这是因为生物体内的酶只能识别和催化特定手性的氨基酸,对于光学异构体的选择性很高。
因此,L型氨基酸是生物体内蛋白质合成的基础。
而D型氨基酸的存在比例较少,但在一些特定的生物体中可以被发现。
例如,细菌细胞壁中的一些氨基酸是D型氨基酸。
此外,一些药物中也含有D型氨基酸。
除了D型和L型氨基酸之外,还存在一些非天然的氨基酸。
这些氨基酸是人工合成的,不属于自然界中的氨基酸。
它们可以通过化学合成或生物工程技术得到。
非天然氨基酸在药物研发、蛋白质工程和材料科学等领域具有重要的应用价值。
总结起来,dl氨基酸是指由两种光学异构体混合而成的氨基酸。
根据它们的光学异构体性质,可以将dl氨基酸分为D型和L型氨基酸。
在自然界中,大多数氨基酸都是L型氨基酸,而D型氨基酸的存在比例较少。
除了这两种形式的氨基酸之外,还存在一些非天然的氨基酸,它们具有重要的应用价值。
对于了解氨基酸的分类和性质,对于生命科学和化学科学的研究具有重要的意义。
蛋白质的结构层级

蛋白质的结构层级蛋白质是生物体中最基本的大分子之一,它在维持生命活动中发挥着重要作用。
蛋白质的结构层级描述了蛋白质分子从原子级别到整体结构的组织和排列方式。
本文将从最基本的一级结构开始,逐层介绍蛋白质的结构层级。
一级结构:氨基酸序列蛋白质的一级结构是指由氨基酸组成的线性序列。
氨基酸是蛋白质的构建单元,共有20种不同的氨基酸。
它们以特定的顺序连接在一起,形成多肽链,通过脱水缩合反应形成肽键。
不同的氨基酸序列决定了蛋白质的功能和特性。
二级结构:α-螺旋和β-折叠蛋白质的二级结构是指多肽链中氨基酸的局部排列方式。
其中最常见的二级结构包括α-螺旋和β-折叠。
α-螺旋是一种螺旋状的结构,多肽链围绕中心轴形成螺旋,每转一圈约有 3.6个氨基酸残基。
β-折叠是由多个β-折叠片段相互连接而成,形成一种折叠的结构。
α-螺旋和β-折叠是由氢键和内部相互作用力稳定的。
三级结构:立体构型蛋白质的三级结构是指整个多肽链的立体构型。
它是由一级结构中相邻氨基酸残基之间的相互作用力和二级结构之间的相互作用力所决定的。
蛋白质的三级结构可以是球状、螺旋状或片状等不同的立体构型。
这种立体构型的形成主要依赖于静电相互作用、氢键、疏水效应和范德华力等力的作用。
四级结构:多个多肽链的组装一些蛋白质由多个多肽链组装而成,这种组装形成了蛋白质的四级结构。
四级结构的形成是通过多个多肽链之间的非共价相互作用力,如离子键、氢键和范德华力等稳定的。
四级结构可以使蛋白质形成复杂的功能结构,例如酶和抗体等。
蛋白质的结构层级是相互关联、相互作用的。
一级结构决定了二级结构的形成,而二级结构决定了三级结构的形成,最终四级结构决定了蛋白质的整体功能和特性。
蛋白质的结构层级对于理解蛋白质的功能和性质具有重要意义。
总结:蛋白质的结构层级包括一级结构、二级结构、三级结构和四级结构。
一级结构是指氨基酸的线性序列,二级结构是指氨基酸的局部排列方式,三级结构是指整个多肽链的立体构型,四级结构是指多个多肽链的组装。
关于蛋白质分子三级结构的描述

关于蛋白质分子三级结构的描述蛋白质是生命体中的主要生物分子,其功能与其特定的三维结构密切相关。
蛋白质的三级结构是指其链上各个氨基酸残基之间的空间排列方式,包括了蛋白质的局部结构、次级结构、超级结构等层次。
蛋白质的三级结构对其功能的发挥起着重要作用,并对蛋白质的稳定性和可折叠性产生影响。
本文将对蛋白质的三级结构进行详细描述。
蛋白质的三级结构由其氨基酸序列及其氨基酸残基之间的非共价相互作用所决定。
这些相互作用包括了氢键、范德华力、离子键和疏水相互作用等。
通过这些非共价相互作用,蛋白质可以在细胞中形成稳定的结构。
蛋白质的局部结构是指相互作用在局部产生的结构模式。
其中最常见的局部结构是α螺旋和β折叠,它们是蛋白质中常见的结构单元。
α螺旋是一种右旋稳定结构,其中氢键将多个氨基酸残基链接在一起。
β折叠是由两个或多个β片段通过氢键相互连接而成的结构,常形成蛋白质的折叠面。
除此之外,还有一些其他的局部结构,如β转角、β螺旋和短片段等。
蛋白质的次级结构是指具有相对独立的局部结构模式在蛋白质链上的排列方式。
其中最常见的次级结构是α螺旋和β折叠。
蛋白质的次级结构对蛋白质的稳定性起着重要作用。
一些氨基酸序列中具有多个α螺旋和β折叠可以形成更复杂的次级结构,如α+β结构,这些次级结构可以进一步形成蛋白质的域。
蛋白质的超级结构是由多个次级结构组合形成的更大的结构单元。
蛋白质的超级结构决定了蛋白质的整体形状和功能。
超级结构的组合方式是通过一些特定的连接模式实现的,如两个蛋白质链之间的非共价连接、蛋白质链的环状连接以及链内的交链连接等。
超级结构的形成更多是通过蛋白质的序列信息以及非共价相互作用的共同作用完成的。
总之,蛋白质的三级结构涉及了蛋白质的局部结构、次级结构和超级结构。
蛋白质的三级结构对其功能的发挥起着重要作用,决定了蛋白质的形状和稳定性。
蛋白质的三级结构的形成依赖于其氨基酸序列以及其残基之间的非共价相互作用。
对蛋白质的三级结构的研究有助于我们更好地理解蛋白质的功能和机制,也为药物设计和生物工程提供了重要的基础。
蛋白质分类和结构

对生物体起支持和保护作用,主要指硬蛋白包括胶原蛋白、角
二、蛋白质的结构
(三)根据功能
1.活性蛋白质(active protein)
包括生命活动过程中一切有活性的蛋白质以及它们的前体分子,
绝大多数蛋白质属于活性蛋白质,包括酶、激素蛋白、运输蛋白 控制生长和分化蛋白、毒蛋白、膜蛋白等。
(转运蛋白)、贮存蛋白、运动蛋白、保护或防御蛋白、受体蛋白、
2.非活性蛋白质(passive protein)
蛋白质
一、蛋白球状蛋白质
2.纤维状蛋白质
(二)根据组成和溶解度
1.单纯蛋白质: 也称简单蛋白质,完全由氨基酸组 成的蛋白质。
2.缀合蛋白质:也称结合蛋白质, 由蛋白质和非蛋白质两部分组成。
“传闻了吗?小帕克给我们球队签了个新球员?” “是从哪队挖来的强壮援兵?以球队的状况,也的确需求添加实力了。” “狗屎的强壮援兵,是个我国人。” “我国人?恶作剧吧?尽管他们人许多,可传闻他们没几个会踢球的。” “球队自身就投入不大,这下要糟蹋掉一个名额了。多给一个人薪酬,还不如多给我们点钱。哎,若是薪水能抵达英乙水平,我就不用去开卡车了。” “我明日也得送货去伦敦那儿。哎,自从老帕克把球队交给小帕克后,我们球队是越来越不可了。” “``````” 斯劳队签了个新球员并且仍是个我国人的音讯,第二天就现已传得球队里许多人都知道了。在下午练习前,先参与的人就聚在一起谈论起还在公交上往斯劳镇赶来的杨大业。 杨大业还没有驾照,哪怕是李鸿情愿把车给他开去练习,也没办法用。而李安娜有自己的事不可能天天都专门回唐人街送他来斯劳队练习。因而,他就挑选了坐公交赶去球队参与练习。 由于是业余联赛的球队,练习时刻一般都安排在下午,并且一般也只需两个小时。一般也是到了周未才会有竞赛。除非参与英足总杯,不然一周也只需一场竞赛,就是赛季比较长。这些都是杨 大业从帕克昨日的介绍里了解到的。 这些状况,除了有自己的球场、有教练还有那些低得不幸的薪水外,其实并不比英华队强多少。 在公交上闲逛了一个来小时,杨大业才总算抵达了斯劳队。 等杨大业来练习场时,斯劳队的球员现已到齐了。他看到,一个应该是教练容貌的人正在对着球员训着话。 在对球员说话的正是劳森。看他的表情,心境好像有些不怎样好。 “前天的竞赛,我们又输了。本周的竞赛,我们若是再输就成最终一名了。我绝不允许~”劳森正预备来段鼓励球员的讲演,俄然死后传来打断的声响。 “对不住,教练。” “嗯?”劳森眉头拧成一团,脸色十分不善地盾声回头看向死后。 “那个,您是教练吧。我是新签约的球员杨大业,前来报导!”见到劳森不善的神色,杨大业仍是堆起友善笑脸地提到。 “你就是小帕克那混蛋弄来的我国人?”一见是我国面孔,原本就心境欠好的劳森整个脸都冷了下来。 “那个~应该就是我了。”杨大业立刻就感觉状况有些不妙啊。连是老板的帕克都被骂成混蛋了,他的到来现在看起来好像并不受欢迎。 尽管杨大业心底是有些不喜欢帕克这个的混蛋,但是他怎样也是球队老板。杨大业觉得连老板都这待遇了,他这个初来咋到的,估量日子不会好过。 “很好。”劳森嘴上说着好,但表情都一点都不让杨大业觉得好。只见劳森垂头看了下手表,然后慢慢说道:“扣除你跟我说话的这二十秒,你抵达这儿的时刻,刚好迟到了0.5分钟。你第一天 签到就迟到了。” “那个,对不住。教练。我是第一次从伦敦坐公交赶过来的,由于不熟悉状况,错过了前一班车。我绝不是有意迟到的。”杨大业急速解说道。 “嗯,好。”劳森允许,这让杨大业暗自松了口气。可劳森很快又接着说:“看来,你也意识到自己迟到了。很好。现在给我绕着球场跑十圈。” “对不住。教练。我仅仅由于第一天~”杨大业没想到自己第一天签到就享用这样的待遇。想要持续解说,但被劳森给打断了。 “限时15分钟。” “额!”看着劳森不容质疑的姿态,杨大业有些呆若木鸡。他但是记住一般球场一圈都快350米了,这十圈就是3500米,并且还限时。我的天啊!我这是出门没看黄历了! “快去。这是对你迟到的赏罚。”劳森冷着脸喝道。 第一天签到,杨大业只需还想成为球队的一员,他就不能抵挡教练。他无法地把自己身上的跨包放到一旁后就开端围着球场跑起来。 “哈哈,这个不幸的我国佬。刚一来就享用这种待遇。” “谁叫他迟到了不是吗?哈哈~我国佬公然本质不可。难怪十几亿人都出不了会踢球的人。” “你看他瘦得跟个山公好像的,这样的家伙,底子没什么战斗力。” 天地良心,杨大业尽管不可壮,但肯定不衰弱。仅仅假如跟斯劳队这些大部分看着像健美先生的英国佬的确无法比。 “来了个没用的废物,看着就糟心。我们需求的是实在有战斗力的队友。哎,小帕克公然就是没有老帕克靠谱。” “``````” 杨大业一跑起来,斯劳队的那些连招待都没打过的准队友们就嘲笑了起来。不少人对杨大业品头论足,未了还要感叹一番球队远景昏暗。 杨大业才刚跑不远,天然也听到了其它人的戏弄与嘲笑。可杨大业也无法停下来辩驳,他大部分注意力只能放在十圈跑上面。十圈要15分钟完结,底子不能慢慢跑,一般人连热身都没就来跑, 底子不可能完结。 关于那些谈话中透露出的隐约排挤,杨大业只能在心中决议要靠自己的实在水平来获得我们的认同。 “看到了吗?尽管我们不是工作球队,可根本的球员操行仍是要有的。不仔细对待练习的,就是这结果。”劳森这是借着杨大业来击打球员了。 说实话,这种需求靠副业来保持日子的球员,并欠好办理。许多工作是无法强制的,搞欠好,人家但是一拍屁股不踢了。 “我们可不是那个没用的我国佬。”有球员嘻笑着回道。劳森想要击打一翻的意图看来是达不成了。 接下来,还有球员自顾自地说着话。 “那个我国人能坚持下来吗?” “15分钟跑十圈?我国佬怎样可能做得到?” “我觉得,估量得20分钟。乃至更多。” “教练,你让他15分钟跑完。会不会要求太高了?究竟他仅仅一个我国人。”未了,居然有人向劳森这么说道。 劳森闻言也回头看向正在围着球场跑步的杨大业,见杨大业跑的速度比他预想得更快,有些惊奇。不过,很快,又皱着眉摇了摇头。 “这个我国佬,跑得速度还能够。不过,我看他这样跑,跑一半,估量就跑不动了。”前面问话的那人持续说道。 “闭嘴吧。现在开端去热身,然后再进行分组练习。本周我们的压力很大,练习都给我仔细一点。”劳森喝骂了一声。 “走了,热身去了。你们觉得那个我国佬,能在我们热身好时跑完十圈吗?” “我觉得他不可。顶多跑个七八圈,那家伙就跑不动了。”斯劳队的其它人一边进行热身,还一边讨论着杨大业。
dl-缬氨酸和缬氨酸的区别-概述说明以及解释

dl-缬氨酸和缬氨酸的区别-概述说明以及解释1.引言概述部分的内容可以包括对dl-缬氨酸和缬氨酸的基本介绍和背景说明。
以下是一个示例:引言1.1 概述缬氨酸和dl-缬氨酸是两种相关的有机化合物,它们在生物体内起着重要的作用。
缬氨酸是一种天然存在于机体内的氨基酸,而dl-缬氨酸则是其对映异构体。
在细胞的生物化学过程中,氨基酸是构成蛋白质的基本单元之一。
缬氨酸是一种非必需氨基酸,这意味着人体可以通过合成来满足其需求,而无需从外部摄入。
它在人体内具有多种功能和作用。
相比之下,dl-缬氨酸是一种合成产物,具有与缬氨酸相似的化学结构和性质。
它的存在形式包括两种对映异构体,即D-缬氨酸和L-缬氨酸。
在这两种对映异构体中,L-缬氨酸是生物体的主要形式。
缬氨酸和dl-缬氨酸在生物体内的作用机制和应用领域也存在一些差异。
缬氨酸在人体内参与了多个生理过程,包括蛋白质合成、免疫调节和抗氧化等。
它还被广泛应用于医学、食品和农业领域。
而dl-缬氨酸在化工和制药领域具有重要的应用价值。
它可以用作合成某些药物和化学物质的中间体,也可以用于生产具有抗氧化和保健功效的食品添加剂。
本文将重点探讨缬氨酸和dl-缬氨酸的区别,并分析它们在不同领域的重要性和潜在应用。
通过对缬氨酸和dl-缬氨酸的研究,我们可以更好地了解它们在生物体内的功能和作用,为进一步的研究和应用提供参考。
1.2 文章结构文章结构部分的内容可以包括以下内容:文章结构的目的是为了引导读者更好地理解和阅读整篇文章,同时也给作者提供一个清晰的框架来组织思路和内容。
本文主要包含三个部分,分别是引言、正文和结论。
在引言部分,首先要对缬氨酸和缬氨酸的区别进行一个简要的概述,引起读者的兴趣。
然后明确文章的目的,即通过对缬氨酸和缬氨酸的详细介绍和比较,让读者对它们有一个全面的了解。
正文部分是文章的核心部分,包括缬氨酸的定义和特点、缬氨酸的功能和作用以及缬氨酸的应用领域。
在这个部分,需要对每个主题进行详细的阐述,包括相关的定义、特点、机制、实验结果等,并且可以通过对比的方式,突出缬氨酸和缬氨酸之间的差异和联系。
什么是蛋白质

什么是蛋白质
蛋白质是生物体内一类重要的大分子有机化合物,由氨基酸构成。
它们在生命体内担任着多种关键的生物学功能,包括结构支持、酶催化、运输、信号传导等。
蛋白质是生命体内最复杂、最多样化的大分子之一,对维持细胞结构和功能至关重要。
蛋白质的基本结构单位是氨基酸。
氨基酸是由氨基基团(NH₂)、羧基基团(COOH)、一个氢原子和一个侧链组成的。
蛋白质是通过氨基酸之间的肽键形成的多肽链。
蛋白质的氨基酸序列编码了其结构和功能。
蛋白质的功能非常多样,包括:
1. 结构:一些蛋白质在细胞和组织中提供支持和结构。
例如,胶原蛋白是结缔组织中的主要蛋白质,赋予组织强度和弹性。
2. 酶:酶是催化生化反应的蛋白质,可以加速化学反应的进行,从而维持细胞代谢。
3. 运输:携带和传递物质,如血液中的血红蛋白负责输送氧气。
4. 免疫:免疫球蛋白参与免疫系统的功能,识别和抵御外部入侵的病原体。
5. 信号传导:通过激活或抑制细胞内信号通路来调节细胞功能的蛋白质。
6. 运动:肌肉中的肌动蛋白和微管蛋白等负责细胞和组织的运动。
蛋白质的功能和结构高度特异,它们的三维结构决定了它们的功能。
蛋白质的合成由基因编码的DNA信息进行,遵循中心法则,即DNA 转录成mRNA,再由mRNA翻译成蛋白质。
蛋白质的合成过程发生在细胞的核糖体中。
d型氨基酸、dl型氨基酸、l型氨基酸

d型氨基酸、dl型氨基酸、l型氨基酸D型氨基酸、DL型氨基酸、L型氨基酸在化学结构上,氨基酸是一类含有氨基和羧基的有机化合物,是构成蛋白质的基本组成部分。
根据它们的结构和性质的不同,氨基酸可以分为多种类型,其中包括D型氨基酸、DL型氨基酸和L型氨基酸。
D型氨基酸是指具有D-构型的氨基酸,其中D-构型表示化合物的手性(对映异构体)是右旋的。
在自然界中,D型氨基酸相对较少,大多数生物体内的氨基酸都是L型氨基酸。
然而,D型氨基酸在某些生物过程中仍然起着重要的作用。
例如,D-半胱氨酸是一种重要的抗氧化剂,具有保护细胞免受氧化损伤的作用。
DL型氨基酸是指同时包含D-构型和L-构型的氨基酸。
DL型氨基酸通常是合成氨基酸的产物,也可以通过化学合成得到。
在实验室中,DL型氨基酸常用于研究氨基酸的性质和反应机制。
然而,由于DL 型氨基酸不具有生物活性,因此在生物体内很少发现DL型氨基酸的存在。
L型氨基酸是指具有L-构型的氨基酸,其中L-构型表示化合物的手性是左旋的。
在自然界中,绝大多数生物体内的氨基酸都是L型氨基酸。
L型氨基酸是蛋白质的构建单位,它们通过肽键连接在一起形成多肽链,进而组成蛋白质分子。
L型氨基酸在生物体内具有重要的功能,包括参与代谢过程、调节生理功能、构建细胞结构等。
虽然D型氨基酸和L型氨基酸在结构上只有手性上的差异,但它们对于生物体的影响却是不同的。
由于生物体内的酶对于氨基酸的手性具有选择性,因此D型氨基酸很少能够被生物体利用。
而L型氨基酸则是生物体正常生理功能所必需的。
总的来说,D型氨基酸、DL型氨基酸和L型氨基酸在结构和性质上存在差异。
D型氨基酸在自然界中较少出现,但在某些生物过程中仍然具有重要作用;DL型氨基酸主要用于实验室研究;而L型氨基酸是构成蛋白质的基本组成部分,对于生物体的正常功能至关重要。
深入了解和研究这些氨基酸的特性,有助于我们更好地理解生物体的生理过程和开展相关的生物医学研究。
高二生物知识点总结

高二生物知识点总结高二生物知识点总结总结是在一段时间内对学习和工作生活等表现加以总结和概括的一种书面材料,它可使零星的、肤浅的、表面的感性认知上升到全面的、系统的、本质的理性认识上来,因此我们要做好归纳,写好总结。
但是总结有什么要求呢?以下是小编帮大家整理的高二生物知识点总结,欢迎大家借鉴与参考,希望对大家有所帮助。
高二生物知识点总结1生命活动的主要承担者——蛋白质一、氨基酸及其种类氨基酸是组成蛋白质的基本单位(或单体)。
结构要点:每种氨基酸都至少含有一个氨基(-NH2)和一个羧基(-COOH),并且都有一个氨基和一个羧基连接在同一个碳原子上。
氨基酸的种类由R基(侧链基团)决定。
二、蛋白质的结构氨基酸、二肽、三肽、多肽、多肽链、一条或若干条多肽链盘曲折叠、蛋白质氨基酸分子相互结合的方式:脱水缩合一个氨基酸分子的氨基和另一个氨基酸分子的羧基相连接,同时失去一分子的水。
连接两个氨基酸分子的化学键叫做肽键三、蛋白质的功能1、构成细胞和生物体结构的重要物质(肌肉毛发)2、催化细胞内的生理生化反应)3、运输载体(血红蛋白)4、传递信息,调节机体的生命活动(胰岛素)5、免疫功能(抗体)四蛋白质分子多样性的原因构成蛋白质的氨基酸的种类,数目,排列顺序,以及空间结构不同导致蛋白质结构多样性。
蛋白质结构多样性导致蛋白质的功能的多样性。
规律方法1、构成生物体的蛋白质的20种氨基酸的结构通式为:NH2-C-COOH根据R基的不同分为不同的氨基酸。
氨基酸分子中,至少含有一个-NH2和一个-COOH位于同一个C 原子上,由此可以判断是否属于构成蛋白质的氨基酸。
2、n个氨基酸脱水缩合形成m条多肽链时,共脱去(n-m)个水分子,形成(n-m)个肽键,至少存在m个-NH2和m个-COOH,形成的蛋白质的分子量为n?氨基酸的平均分子量-18(n-m)3、氨基酸数=肽键数+肽链数4、蛋白质总的分子量=组成蛋白质的氨基酸总分子量-脱水缩合反应脱去的水的总分子量高二生物知识点总结2新陈代谢是生物最基本的特征,是生物与非生物的最本质的区别。
第七版生物化学名词解释

第七版生物化学名词解释第一章蛋白质的结构与功能(1)肽键:蛋白质中前一氨基酸的α-羧基与后一氨基酸的α-(2)(3)肽键平面:肽键中的C-N键具有部分双键的性质,不能旋转,因此,肽键中的C、O、N、H(4)蛋白质分子的一级结构:蛋白质分子的一级结构是指构成蛋白质分子的氨基酸在多肽链中的排列顺序和连接方式(5)(6)蛋白质的等电点:在某-pH溶液中,蛋白质分子可游离成正电荷和负电荷相等的兼性离子,即蛋白质分子的净电荷等于零,此时溶液的pH⑺蛋白质变性:在某些理化因素作用下,蛋白质特定的空间构象被破坏,从而导致其理化性质改变和生物学活性的丧失的现象。
⑻协同效应:一个亚基与其配体结合后,能影响另一亚基与配体结合的能力。
(正、负)如血红素与氧结合后,铁原子就能进入卟啉环的小孔中,继而引起肽链位置的变动。
⑼变构效应:蛋白质分子因与某种小分子物质(效应剂)相互作用而致构象发生改变,从而改变其活性的现象。
⑽分子伴侣:分子伴侣是细胞中一类保守蛋白质,可识别肽链的非天然构象,促进各功能域和整体蛋白质的正确折叠。
细胞至少有两种分子伴侣家族——热休克蛋白和伴侣素。
第二章核酸的化学结构与功能(1)核酸变性:在某些理化因素的作用下,核酸双链间氢键断裂,双螺旋解开,变成无规则的线团,此(2)DNA的复性作用:变性的DNA在适当的条件下,两条彼此分开的多核苷酸链又可重新通过氢键连接,形成原来的双螺旋结构,并恢复其原有的理化性质,此即DNA的复性。
(3)杂交:两条不同来源的单链DNA,或一条单链DNA,一条RNA,只要它们有大部分互补的碱基顺序(4)增色效应:DNA变性时,A260(5)解链温度:在DNA热变性时,通常将DNA变性50%时的温度叫解链温度用Tm表示。
(6)DNA的一级结构:DNA的一级结构是指DNA链中,脱氧核糖核苷酸的组成,排列顺序第三章酶学(1)辅酶:与酶蛋白结合的较松,用透析等方法易于与酶分开。
辅基:与酶蛋白结合的比较(2)酶的活性中心:必需基团在酶分子表面的一定区域形成一定的空间结构,直接参与了将作用物转变为产物的反应过程,这个区域叫酶的活性中心。
蛋白质基本单位结构式

蛋白质基本单位结构式
蛋白质是生物体内的重要有机物质,它是由一系列氨基酸通过肽键连接而成的。
每个氨基酸由一个中心碳原子连接着一个氨基基团、一个羧基和一个侧链。
这些氨基酸通过肽键的形成,形成一个个具有独特结构和功能的多肽链。
蛋白质的基本单位结构是由氨基酸构成的肽链。
肽链的一端是氨基末端,另一端是羧基末端。
氨基酸的侧链在肽链中以不同的方式相互作用,形成不同的结构和功能。
蛋白质的结构分为四个层次:一级结构、二级结构、三级结构和四级结构。
一级结构是指氨基酸的线性排列顺序,由氨基酸序列决定。
二级结构是指氨基酸链的局部折叠方式,常见的二级结构有α螺旋和β折叠。
三级结构是指整个蛋白质链的折叠方式和空间结构,由各个二级结构之间的相互作用决定。
四级结构是指由多个蛋白质链相互作用形成的复合物。
蛋白质的结构决定了它的功能。
不同的结构可以使蛋白质具有不同的功能,如酶的催化作用、抗体的免疫作用、肌肉的收缩作用等。
蛋白质结构的稳定性对其功能的发挥也起着重要作用。
蛋白质的结构研究对于理解生物体的生命过程和疾病机制具有重要意义。
通过研究蛋白质的结构,可以设计新的药物和治疗方法,促进生物技术和医学的发展。
蛋白质是生物体的重要组成部分,它的结构和功能的研究对于人类的生命健康具有重要意义。
通过不断深入的研究和探索,我们可以更好地理解蛋白质的奥秘,为人类的健康和疾病的治疗提供更多的可能性。
王镜岩-生物化学-第5章_蛋白质的三维结构

(一)-螺旋 -helix
1.α螺旋的结构
在 α 螺 旋 中, 多 肽 主 链按 右 手 或 左 手方 向 盘 绕 ,形 成右手螺旋或左手螺旋 , 相 邻 的 螺 圈之 间 形 成 链内 氢键,构成螺旋的每个Cα 都取相同的二面角Φ、Ψ。
典型的α螺旋特征:
① 二面角:Φ= -57°, Ψ= - 48°,是一种右手螺旋; ② 每圈螺旋:3.6个a.a残基, 高度:0.54nm ; ③ 每个残基绕轴旋转100°,沿轴上升0.15nm;
共价键和次级键键能对比
• 肽键
• 二硫键 • 离子键 • 氢键 • 疏水键
90kcal/mol
3kcal/mol 1kcal/mol 1kcal/mol 0.1kcal/mol
数量巨大
• 范德华力
这四种键能远小于共价键,称次级键
提问:次级键微弱但却是维持蛋白质三级结构中主 要的作用力,原因何在?
氢键是两个极性基团之间的弱键,也就是一个偶极 (dipole) 的带正电荷的一端被另一偶极带负电荷的一端所吸引形成的 键。存在于肽链与肽链之间,亦存在于同一螺旋肽链之中。 氢键虽然是弱键,但蛋白质分子中的氢键很多,故对蛋白质 分子的构象起着重要的作用。 方向用键角表示,是 指X—H与H…Y之间的 夹角,一般为180~ 250。
包括 三种弱的作用力: 定向效应: 极性基团间 诱导效应: 极性与非极性基团 间 分散效应: 非极性基团间
范德华力非常依赖原子间的距离,只有当两个非键合 原子处于一定距离时(当相互靠近到大约0.4~ 0.6nm(4~6A)时),才能达到最大。
疏水键是蛋白质分子中疏水性较强的一些氨基酸(如缬氨酸、 亮氨酸、异亮氨酸、苯丙氨酸等)的侧链避开水相自相粘附聚 集在一起,形成孔穴,对维持蛋白质分子的稳定性起一定作 用。 它在维持蛋白质的三级结
DL-蛋氨酸 饲料级 指标和用途
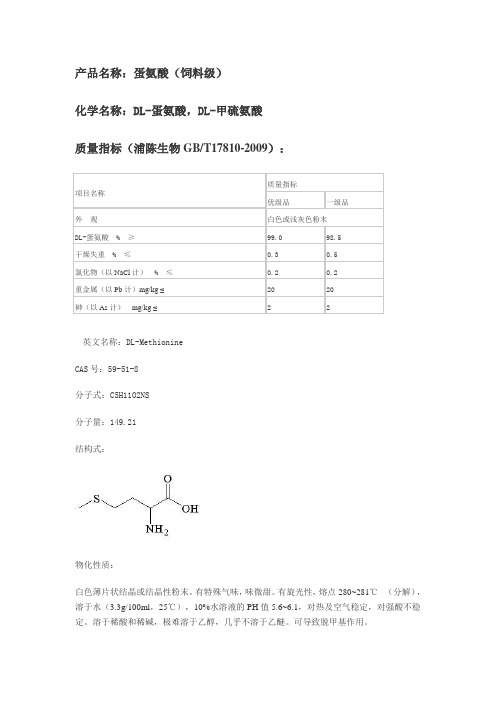
产品名称:蛋氨酸(饲料级)化学名称:DL-蛋氨酸,DL-甲硫氨酸质量指标(浦陈生物GB/T17810-2009):英文名称:DL-MethionineCAS号:59-51-8分子式:C5H11O2NS分子量:149.21结构式:物化性质:白色薄片状结晶或结晶性粉末。
有特殊气味,味微甜。
有旋光性,熔点280~281℃(分解),溶于水(3.3g/100ml,25℃),10%水溶液的PH值5.6~6.1,对热及空气稳定,对强酸不稳定。
溶于稀酸和稀碱,极难溶于乙醇,几乎不溶于乙醚。
可导致脱甲基作用。
用途:蛋氨酸是生物合成蛋白质的“骨架”氨基酸,是禽畜类动物生长所必需的氨基酸之一,对动物的新陈代谢有很强的调节作用,广泛应用于饲料、医药、食品和化妆品等领域。
在饲料工业中,蛋氨酸的用量最大,用作饲料的营养强化剂,弥补氨基酸平衡的饲料添加剂,饲料中添加1kg蛋氨酸,相当于鱼粉50kg的营养价值。
蛋氨酸在饲料中的添加量一般为0.05%~0.2%。
在医药方面,蛋氨酸可作为氨基酸输液和复合氨基酸的主要成分,还可用于合成药用维生素,利用其抗脂肪肝的作用,可用于生产保肝制剂。
在食品方面,蛋氨酸用于食品的氨基酸强化及食品保健品的加工,可用作营养增补剂。
包装:产品采用袋装,包装袋分为三层,外层为聚乙烯复合布,中层为牛皮纸,内层为低密度聚乙烯薄膜,每包净重25kg。
也可根据用户合同要求并按有关安全规定进行包装。
储运:本品应贮存于阴凉、干燥、通风处,贮存大批货物时,应安装导电平衡设备,防止静电荷的聚集。
在运输过程中防止雨淋、受潮和日晒,严禁与有毒品混运。
保质期:在原包装内、规定贮存条件下,保持期为自生产之日起5年内。
dl-丙氨酸 分类

dl-丙氨酸分类
dl-丙氨酸(dl-Alanine)是一种氨基酸,它包含着赋有生物活性的羧基和氨基官能团。
dl-丙氨酸被归类为非极性、无电荷的氨基酸之一。
它是由一个甲基基团和一个氨基基团组成的二元羧酸。
根据它的化学结构和侧链性质,丙氨酸可以被分类为以下几类:
1.氨基酸类别:dl-丙氨酸是众多氨基酸之一,氨基酸按照其
化学性质和侧链结构可以分为极性氨基酸(例如赖氨酸、
谷氨酸)和非极性氨基酸(例如丙氨酸、丙氨酸)等。
2.构象类别:丙氨酸属于α-氨基酸,其氨基与羧基在同一个
碳上,形成一个平面结构。
这种分子构象对于蛋白质的二
级结构(如α-螺旋)起着重要的作用。
3.生物学功能类别:丙氨酸在生物体内具有重要的生物学功
能。
它是蛋白质合成的组成部分,参与体内代谢过程,以
及作为神经递质或信号分子发挥作用。
4.蛋白质结构类别:丙氨酸的存在可以影响蛋白质的立体构
型和功能。
在蛋白质结构中,丙氨酸的输入位置和数量可
以对蛋白质的稳定性、折叠和相互作用产生影响。
dl-丙氨酸作为氨基酸家族中的一员,其分类可根据不同研究领域和目的而有所不同。
以上分类是其中一些常见的分类方式。
蛋白质和核酸结构的异同

蛋白质和核酸结构的异同引言蛋白质和核酸是生物体中两个重要的生物大分子,扮演着关键的功能角色。
它们在结构上有一些共同的特征,但也存在一些明显的差异。
本文将介绍蛋白质和核酸的结构异同,并探讨其在生物学中的重要性。
一、蛋白质的结构蛋白质是由氨基酸组成的聚合物,在生物体内具有广泛的功能。
蛋白质的结构层次可以分为四级结构:一级结构、二级结构、三级结构和四级结构。
1. 一级结构蛋白质的一级结构指的是氨基酸的线性排列顺序。
氨基酸通过酰胺键(肽键)连接在一起,形成多肽链。
蛋白质的一级结构由氨基酸的种类、数量和排列顺序决定。
2. 二级结构蛋白质的二级结构是指氨基酸链中局部区域的折叠方式。
常见的二级结构包括α-螺旋和β-折叠。
α-螺旋是由螺旋状的氢键连接形成的,而β-折叠是由β-折叠片段通过氢键连接形成的。
3. 三级结构蛋白质的三级结构是指整个蛋白质分子的立体构型。
蛋白质的三级结构由氨基酸之间的相互作用力(如氢键、离子键、疏水作用等)决定。
4. 四级结构某些蛋白质由多个蛋白质亚基组装而成,形成具有功能和稳定性的复合物。
这种复合物的结构被称为蛋白质的四级结构。
二、核酸的结构核酸是存储和传递遗传信息的分子。
DNA和RNA是两种常见的核酸。
1. DNA的结构DNA(脱氧核糖核酸)是由四种不同的核苷酸(腺嘌呤、鸟嘌呤、胞嘧啶和鸟苷)组成的双链螺旋结构。
它的结构包括磷酸基团、五碳糖基团和碱基。
2. RNA的结构RNA(核糖核酸)与DNA的结构类似,但在五碳糖基团中含有核糖而不是脱氧核糖。
RNA的结构包括磷酸基团、五碳糖基团和碱基。
三、蛋白质和核酸结构的异同虽然蛋白质和核酸在结构上有一些共同之处,但它们也存在一些明显的差异。
1. 组成单位蛋白质由氨基酸组成,而核酸由核苷酸组成。
2. 功能蛋白质具有多样化的功能,包括催化反应、结构支持和信号传导等。
而核酸主要参与遗传信息的存储和传递。
3. 结构层次蛋白质的结构层次更加复杂,包括一级、二级、三级和四级结构。
生物化学名词解释

肽键:一个氨基酸的a-羧基与另一个氨基酸的a-氨基缩合脱去一份子水形成的化学键叫肽键。
蛋白质的一级结构:蛋白质肽链中氨基酸的排列顺序称为蛋白质的一级结构。
蛋白质的二级结构:多肽链主链的局部空间结构即主链构象,称为蛋白质的二级结构。
蛋白质的三级结构:指蛋白质分子中的各个二级结构的空间位置以及与氨基酸侧链基团之间的相对空间位置关系,也即多肽链的整体构象。
蛋白质的四级结构:许多蛋白质分子是由两条或两条以上具有独立三级结构的多肽链组成。
这些多肽链之间借次级键缔合在一起,蛋白质分子的这种结构形式称为蛋白质分子的四级结构。
蛋白质别构效应:凡蛋白质(或亚基)因与某小分子物质相互作用而发生构想变化,导致蛋白质(或亚基)功能变化,称为蛋白质别构效应。
分子病:犹豫遗传物质DNA突变而导致某蛋白质一级结构变化所引起的疾病称为分子病。
蛋白质的等电点:当蛋白质溶液处于某一PH值时,蛋白质分子解离成正负离子的趋势相等成为兼性离子,此时,该溶液的PH值称为该蛋白质的等电点(PI)。
蛋白质变性:在某些理化因素作用下,使蛋白质严格的空间结构收到破坏但不包括肽键的断裂,从而引起蛋白质理化性质改变,生物学活性丧失,称为蛋白质的变性。
蛋白质组:蛋白质组是指一种细胞或一种生物锁表达的全部蛋白质,即“一种基因组所表达的全套蛋白质”。
增色效应:增色效应是指与天然DNA相比,变性DNA因其双螺旋破坏,使碱基充分外露,因此紫外吸收增加。
减色效应:减色效应是指变性DNA复性形成双螺旋结构后,其紫外吸收会降低。
分子杂交:两条来源不同但有碱基互补关系的DNA单链分子,或DNA单链分子与RNA分子,在去掉变性条件后互补的区域能够退火复性形成双链DNA分子或DNA/RNA异质双链分子,这一过程叫分子杂交。
Tm:DNA解链曲线的重点,即DNA变性达50%时的温度。
核小体:是染色质的基本组成单位,有DNA和5种组蛋白共同构成。
非mRNA小RNA:细胞的不同部位存在的许多其他种类的小分子RNA,统称为非mRN小RNA (small non-messenger RNAs,snmRNAs)。
蛋白质的结构(dl)

(3) 蛋白质的等电点(PI):蛋白质以兼性离子存 在时,溶液的pH值,就是蛋白质的等电点。
Pr
NH3+ OHCOOH H+
Pr
NH3+ COO-
OHH+
Pr
NH2 COO-
正离子
pH< pI
两性离子 pH﹦pI
负离子
pH > pI
含碱性氨基酸残基较多的, pI偏碱,反之,偏 酸。含酸碱氨基酸残基数目相近者,等电点为 中性偏酸。 如鱼精蛋白: pI=12~12.4 如胃蛋白酶:pI=1~2.5
0 20 40 60 80 100 O2分压 氧结合曲线 (氧解离曲线)
蛋白质各级结构的意义
一级结构 (氨基酸序列) ↓ 有形体? 二级结构 ( helix, sheet) ↓ Domain (结构域) 三级结构 (monomer) 有生命? ↓ 有智慧? 四级结构 (dimer)
序列 ↓ 构象 ↓ 活性 ↓ 调节
胰凝乳蛋白酶原
弹性蛋白酶原
羧肽酶原
羧肽酶
一级结构是空间构象的基础 蛋白质的空间构象归根到底是由一级结 构决定 一级结构与功能的关系是十分重要的 一级结构与功能的关系实际上反映的也 是高级结构与功能的关系
(二)蛋白质高级结构与功能的关系
蛋白质的构象并不是固定不变的。 别构现象:有些蛋白质表现其生物活性 时,其构象发生改变,从而改变整个分 子的性质,这种现象叫别构现象。 血红蛋白在表现其输氧功能时就具有别 构现象。
Garrett & Grisham (1999) Biochemistry (2e) p.181
三级结构中的离子键
可与金属离子形成离子键: Cys, His, Glu, Asp
蛋白质基本单位结构式

蛋白质基本单位结构式蛋白质是生物体内的重要分子,它们不仅构成了细胞的基本结构,还参与了许多生物过程。
蛋白质的基本单位结构可以用氨基酸来描述。
氨基酸是蛋白质的构成单元,它们由一些共同的部分组成,包括一个氨基基团(NH2)、一个羧基基团(COOH)和一个侧链基团(R)。
氨基酸的侧链基团可以是各种不同的化学结构,这使得蛋白质能够拥有多样的结构和功能。
通过共价键连接,氨基酸可以形成多肽链。
在多肽链中,氨基基团与羧基基团相互结合,形成了肽键。
多个氨基酸通过肽键的连接形成了多肽链,其中每个氨基酸的侧链基团向外延伸。
蛋白质的结构可以分为四个层次:一级结构、二级结构、三级结构和四级结构。
一级结构指的是多肽链的线性序列,即氨基酸的排列顺序。
不同的氨基酸序列决定了蛋白质的功能和结构。
二级结构是指多肽链的局部折叠形式。
常见的二级结构包括α-螺旋和β-折叠。
α-螺旋是一种右旋螺旋形状,由多个氨基酸残基组成。
β-折叠是一种折叠形式,由多个β-链组成。
三级结构是指整个多肽链的三维空间结构。
蛋白质的三级结构由各种相互作用力(如氢键、离子键、范德华力和疏水相互作用等)稳定。
四级结构是指由多个多肽链相互作用形成的复合物。
多个多肽链通过各种相互作用力(如氢键、离子键和范德华力等)相互结合,形成具有特定功能的蛋白质。
蛋白质的结构决定了它们的功能。
不同的蛋白质拥有不同的结构和功能,可以参与细胞的代谢、运输、信号传导等生物过程。
蛋白质的结构也可以受到各种因素(如温度、pH值和化学物质等)的影响,从而改变其功能。
通过研究蛋白质的结构,科学家可以更好地理解生物体内的生物过程,并开发新的药物和治疗方法。
蛋白质的结构解析也为生物技术和生物工程提供了重要的基础。
蛋白质的基本单位结构是由氨基酸组成的多肽链。
蛋白质的结构可以分为一级结构、二级结构、三级结构和四级结构,不同的结构决定了蛋白质的功能和特性。
通过研究蛋白质的结构,可以更好地理解生物体内的生物过程,并为药物研发和生物工程提供基础。
什么是蛋白质

什么是蛋白质蛋白质是一类重要的有机化合物,由氨基酸组成。
它在生命体内起着举足轻重的作用,是细胞的基本组成部分,也是生命体内许多生物化学反应的催化剂。
蛋白质在维持生物体的结构、功能和代谢中发挥着不可替代的作用,被称为生命之源。
下面将对蛋白质的结构、功能和来源进行详细的介绍。
首先,蛋白质的基本结构是由氨基酸组成的肽链。
氨基酸是一种由碳、氢、氧和氮组成的有机化合物,其中氮是氨基酸的独特之处。
通过共价键连接的氨基酸形成了肽键,将氨基酸连接成肽链。
蛋白质的结构可以分为四个层次:一级结构是由氨基酸直线连接而成的肽链序列,二级结构是肽链在空间中的折叠方式,常见的二级结构有α螺旋和β折叠,三级结构是蛋白质在空间中的整体构象,而四级结构是由多个肽链或多个蛋白质子单元组装而成的复合物。
蛋白质的功能多种多样。
首先,蛋白质是生命体内的结构物质,构成了细胞的骨架,维持细胞的形状和机械强度。
例如,胶原蛋白是皮肤、骨骼和血管中最主要的组成成分,具有支撑和保护作用。
其次,蛋白质参与许多生物化学反应,是酶的重要组成部分,酶是生物体内催化化学反应的催化剂。
例如,消化系统中的胰蛋白酶能够促进蛋白质的水解,将蛋白质分解为氨基酸。
此外,蛋白质还能运输物质,如红细胞中的血红蛋白能够结合氧气并将其输送到身体各个组织和器官。
蛋白质的来源多种多样。
人类可以通过膳食摄入蛋白质。
动物性食物如肉、鱼、奶制品等含有丰富的蛋白质,植物性食物如大豆、豆腐、蔬菜等也含有一定量的蛋白质。
此外,人体还可以通过合成蛋白质来满足需要,合成蛋白质的原料是氨基酸。
人体可以通过膳食中的蛋白质,或者通过新陈代谢过程中分解产生的氨基酸来合成蛋白质。
合成的蛋白质将用于维持细胞的正常功能、修复受损组织和产生新的生物分子。
总之,蛋白质是一类重要的有机化合物,是生命体内的基本组成部分。
它具有多样的结构和功能,参与了细胞的构建、代谢和调节过程。
蛋白质的来源主要是膳食摄入和体内合成。
了解蛋白质的结构和功能对于深入理解生命活动、保持健康具有重要的意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Hexokinase 具有两个结能域
domain domain
Alberts et al (1994) Molecular Biology of the Cell (3e) p.196
细胞色素C的空间结构
4、肌红蛋白的结构
肌红蛋白是哺乳动物肌肉中运输氧的 蛋白质。
是1957年由John Kendrew 用X射线晶 体分析法测定的有三维结构的第一个 蛋白质。
由153个氨基酸残基组成的一条多肽链。 分子内含有一个血红素辅基。 相对分子量 17800 d
血红素分子
2+
His
(六)蛋白质的四级结构
1、寡聚蛋白和蛋白质亚基
分子量较大的蛋白质往往由两条或两条 以上的多肽链组成,这些肽链相互之间以非 共价键结合,每条多肽链各自具有一定的三 级结构,但肽链单独存在时不具有生物活性, 这种肽链就称为——蛋白质的亚基
3、球蛋白分子结构的一般特征
一条肽链往往是通过一部分а-螺旋,一 部分ß-折叠,拐角处形成ß-转角或无轨 卷曲盘绕折叠成致密的—球形分子
具有极性侧链的氨基酸残基几乎分布在 分子的表面—亲水的表面
而非极性氨基酸侧链的残基包埋在分子 的内部形成—疏水的核
分子表面往往有一个裂隙(口袋;凹 槽),常常是疏水的环境。这一部位常 常是球蛋白的—活性部位
镰刀型红细胞贫血病是1904年首先被发 现的一种分子病。病人的血红蛋白(HbS)与正常人血红蛋白(Hb-A)相比, 链第6位氨基酸不同。
HbA Val-His-Leu-Thr-Pro-Glu-Glu-Lys-
HbS Val-His-Leu-Thr-Pro-Val-Glu-Lys-
仅仅这一点差别,就使患者的红细胞在 氧缺乏时呈镰刀状,易胀破发生溶血, 运氧机能降低,引起头昏、胸闷等贫血 症状。
超二级结构类型:
2、结构域
多肽链在超二级结构的基础上进一步的 盘绕折叠成紧密的近似球状的结构,在 空中彼此分隔,相互独立,结构域之间 通过共价的、松散的肽链相连(铰链 区)。
对于有些较小的蛋白质分子,结构域和三级结构是一个意思,即这些蛋白质分 子是单结构域的。
(五)蛋白质三级结构:
1、概念
三级结构中的离子键
可与金属离子形成离子键: Cys, His, Glu, Asp
金属离子对蛋白质的贡献: (1) 稳定蛋白质的结构 (2) 参与蛋白质的功能
三级结构中的疏水作用力
疏水性氨基酸基团 亲水性基团
以水溶性蛋白质而言 (脂溶性蛋白质恰相反)
Alberts et al (2002) e Cell (4e) p.135
亚基聚合在一起形成具有一定生物学功能 的蛋白质分子——寡聚蛋白
2、蛋白质的四级结构
寡聚蛋白质中亚基的空间排布、 相互关系和相互作用力,称之为蛋 白质的四级结构。
亚基的种类和数量 均一四级结构 不均一四级结构
亚基的空间排布 亚基间的相互作用力 次级键
3、血红蛋白的四级结构
Hb分子量为 65000 d Hb是由2条а链和2条ß链组成的四聚
Mathews et al (2000) Biochemistry (3e) p.239
2、种属差异与分子进化
同源蛋白质:不同种属中完成相同功能的蛋白 质。
五、蛋白质结构与功能的关系
蛋白质分子具有多种多样的生物功 能是以其极其复杂的结构为基础的。这 不仅需要一定的化学结构,更重要的是 需要特定的空间结构作基础。研究蛋白 质结构与功能之间的关系是分子生物学 的一个重要方面。
(一)一级结构与功能的关系
1、分子病
分子病(molecular disease):是一种遗传性疾 病,由于DNA分子上基因突变,而合成了失去正 常生物活性的异常蛋白质,或者是缺失某种蛋白 质,从而影响了机体正常的生理功能而产生的疾 病。 研究表明几乎所有遗传病都与pr分子结构改变有 关。
(四)超二级结构和结构域
近年来在研究蛋白质构象、 功能和进化的变化时,发现在蛋 白质二级结构和三级结构之间存 在着两个过渡层次,即超二级结 构和结构域。
1、超二级结构
多肽链内若干顺序上相邻的二 级结构的构象单元在空间折叠中靠 近,彼此相互作用,形成有规则的, 在空间上能辨认的二级结构的组合 体。
超二级结构在结构层次上高于 二级结构,但不具有功能。超二级 结构的形式主要有:-螺旋组合 ( ); -折叠组合( ); -螺旋-折叠组合( );;希 腊钥匙结构
包括主侧链在内的所有原子 在三维空间的排列。
一条多肽链在二级结构的基础上, 由于顺序上相隔较远的氨基酸残基侧链 的相互作用,进行范围更广泛的盘绕、 折叠,形成很不规范但特定的空间构象。
back
具有三级结构的蛋白质分子,往 往具有球形、椭球形的物理外形,称 之为球蛋白。
球蛋白常常是生物体内具有一定 生理功能的活性蛋白质。 例如:肌红蛋白(Mb);
三级结构中的二硫键
C CH2 SH
SH
CH2
C
C
CH2 SH
SH CH2 C
分子间
Oxidation Reduction
分子內
C
CH2 SS
CH2 C C
CH2 SS
CH2 C
Adapted from Alberts et al (2002) Molecular Biology of the Cell (4e) p.152
核糖核酸酶; 细胞色素C;
2、稳定三级结构的作用力
氢键 疏水力(疏水作用力) 范氏引力(分子间的作用力) 离子键(盐键) 酯键 二硫键
二级结构氢键 三级结构氢键
a helix 胰脏 trypsin inhibitor
三级结构中的氢键
b sheet
Garrett & Grisham (1999) Biochemistry (2e) p.181
体。 а链由141个氨基酸组成,ß链由146
个氨基酸组成,各自都有一定的氨 基酸排列顺序。 两种亚基的一级结构差别较大,但 它们的二、三级结构却大致相同, 而且与肌红蛋白极为相似。
血红蛋白的四级结构
Myoglobin
Hemoglobin
Mathews et al (2000) Biochemistry (3e) p.214
