蛋白质组学及其在微生物学研究中的应用精品课件
蛋白质组学及技术介绍最全PPT

C中y间2,部Cy分3是,C平y5衡部分二b维ala凝nc胶e g电rou泳p 法:
• reporter group:质量为114Da、115 Da、116 Da、117Da,因此iTRAQ试剂共四种;
2在、二多维维电电泳泳的技基术础,上包进括行二荧二维光维凝标胶记凝电胶泳法电、泳自由的流原动电理泳是法、第毛一细管向区基带电于泳蛋法等白;质的等电点不同 二级质谱: 肽质量用指纹等图电谱(聚PM焦F)分。离,第二向则按分子量的不同用SDS-PAGE分 iT1R.AQ试剂是一种小离分,子同把重复元素杂化蛋学物白质混,包合括物三部中分的: 蛋白质在二维平面上分开。 定义:同位素标记相对和绝2-对D定E量有(is较oba好ric的tag分s f辨or r率ela,tiveSaDndSa-PbsAolGuteEq或ua单ntit相atiIoEn,Fi的TRA最Q)好技术分由AB SCIEX公司研发的一种 体例外如同 :种Le同i等位通素过标2-记辨DE的和率相基对仅质与辅为绝助对1激0定光0量解个技析术蛋电。离白飞,行时而间2质-D谱等E蛋大白约质组为学3相0关0技0个术对蛋膀白胱癌。患者的尿蛋白进行分离鉴定,获得14个差
蛋白质组学及技术介绍
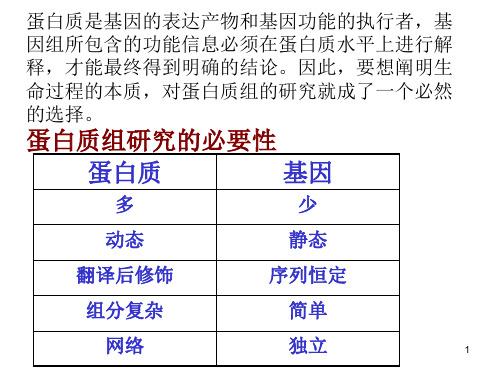
概念
蛋白质组是在一个细胞的整个生命过程中由基因组表达的以及表达后修饰 的全部蛋白质。
蛋白质组学-PPT课件

iTRAQ 结构
iTRAQ包括三部分:报告部分、肽反应部分、平 衡部分。 1、报告部分:有八种,因此iTRAQ可同时标记8 组样品。 2、肽反应部分:能与肽N端及赖氨酸侧链发生共 价连接而标记上肽段,几乎可以标记所有蛋白质。 3、平衡部分:保证iTRAQ标记的同一肽段的质荷 比相同。
辉骏生物:fitgene/
辉骏生物:fitgene/
免费服务热线:400-699-1663
2:蛋白质组学研究内容
2.1:蛋白质的表达模式 (1)生理、病理或不同发育状态下蛋白质组表达差异蛋白质信息库。 (2)蛋白质及其组成质点的分离、分析、鉴定。 2.2:蛋白质的功能模式 (1)蛋白质结构分析。 (2)蛋白之间相互作用,翻译后修饰,细胞定位等。
3: 化学标记法—iTRAQ
简介:
iTRAQ试剂是可与氨基酸末端氨基及赖氨酸侧链氨基连接的胺标记同重元素。在质谱图 中,任何一种iTRAQ试剂标记不同样本中的同一蛋白质表现为相同的质荷比。 在串联质谱 中,信号离子表现为不同质荷比(113-119,121)的峰,因此根据波峰的高度及面积,可以 鉴定出蛋白质和分析出同一蛋白质不同处理的定量信息。
辉骏生物:fitgene/
免费服务热线:400-699-1663
1:双向电泳
基于2D-PAGE 的经典定量分 析方法。 1、样品准备 和定量:抽提 对照组和各种 不同实验组的 蛋白质。 2、蛋白质分 离:蛋白质经 过2D-PAGE分离 后染色(银染、 考染等)。 3、蛋白质的 定性与定量分 析:通过与对 照组相Image Master 7.0分 析出实验组中 差异点,质谱 鉴定差异点蛋 白质,同时应用 软件分析出其 表达量的变化。
辉骏生物:fitgene/
蛋白质组学ppt
电转印到膜上
图像分析
Western blot检测
选择目标蛋白斑点,胶内酶切
质谱分析(MALDI/TOF或ESI/MS/MS)
获得肽质量指纹谱或肽序列标签
数据库检索鉴定蛋白质
Western blot、 免疫组化验证 蛋白质并确定 其定位
根据氨基酸序 列合成寡核苷 酸探针,克隆 基因
蛋白质功能研究,包 括蛋白质生物活性、 抗体制备、蛋白质相 互作用等方面
7
3.2.3 蛋白质组研究技术
一、双向凝胶电泳技术 二、液相色谱技术 三、生物质谱技术与蛋白质鉴定 四、蛋白质相互作用的研究技术
8
一、双向凝胶电泳技术 (一)2-DE的概念 two dimensional gel electrophoresis
• 2-DE是指第一向的固相pH梯度(immobilized pH gradient,IPG)等电聚焦电泳与第二向SDSPAGE组成的分离系统,也称双向聚丙烯酰胺凝 胶电泳,简称2-DE。等电聚焦电泳是基于蛋白质 等电点(pI)的差异进行分离,SDS-PAGE则是 根据蛋白质分子量(Mw)的不同进行分离。
22
(三)双向凝胶电泳图谱的计算机分析 • 细胞或组织样本经2-DE分离后,得到一张含有成
百上千个蛋白质斑点的凝胶电泳图谱。凝胶图谱 分析包括确定蛋白质斑点的位置、大小、染色深 浅、pI和分子量;图谱间的比较、差异蛋白质斑 点的确定;图谱质量的优化、数据的储存管理、 数据库分析等内容。借助先进的计算机技术和生 物信息学工具,能客观、有效地从电泳图谱中提 取到有价值的信息。
记等
19
(一)考马斯亮蓝染色
考马斯亮蓝染色是最常用的蛋白质染色 方法。考马斯亮蓝R-250化学名为三苯基甲 烷,R代表红蓝色。考马斯亮蓝R-250与蛋 白质的碱性基团可逆结合,染色线性范围 可达1~55μg,灵敏度为30~100ng蛋白质 。考马斯亮蓝染色的最大优点是染色重复 性好,操作简便,不影响后续的质谱鉴定 ,灵敏度比常用的氨基黑高100倍,但低于 银染色和荧光染色,不能满足对低丰度蛋 白质的检测要求,样品用量大。
微生物蛋白质组学ppt课件

■ 互补与互助
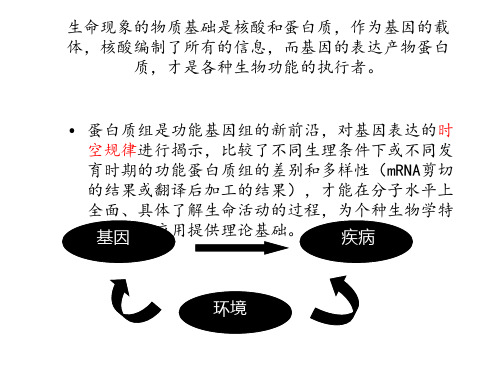
— 在后基因组时代,蛋白质组研究和基因组研究依然是形影相随的两个重要领 域。基因组与蛋白质组之间既为互相补充又能互相帮助。
— mRNA是介于基因和蛋白质之间的中间产物。因为mRNA既是基因的产物, 又比蛋白质要容易分析,所以,研究mRNA的表达模式也是了解基因组和蛋 白质组的一个重要途径。由此专门形成了一个新的研究领域:转录组。研究 转录组的主要手段是基因芯片技术、SAGE(基因表达序列分析)技术。
羟肉桂酸)中,基质吸收激光提供的能量而蒸发,携带部分样品分子进入 气相,并将一部分能量传递给样品分子使其离子化。
飞行时间质谱(TOFMS)由离子源(S)引出极、漂移区(D)和检测器组成。 当离子在离子源内形成后在离子源内电场E的作用下进入无场漂移区。在理想状 态下,所有进入漂移区的离子具有相同的动能(KE). 测定离子在漂移区内的飞行时间即可计算出它的质荷比。
蛋白质分离 技术双Fra bibliotek电泳和差异凝胶电泳
■ 双向电泳(Two dimension elctrophresis,2DE)是根据不同蛋白质 等电点和分子量的不同利用第一向等电聚焦和第二向SDS-PAGE电泳 将蛋白质混合物中的各种蛋白分离开。 ■ 差异凝胶电泳(differential gel electrophoresis,DIGE)是在2DE基 础上建立的蛋白质分离技术。该方法将待比较的两个样品蛋白质分别 用不同的荧光染料(Cy2、Cy3、Cy5)进行标记后,等量混合再进行双 向电泳。由于荧光染料的发光波长不同,可以在一块凝胶上检测两个 样品,并通过蛋白点不同荧光信号间的比率确定蛋白量的差异。
离子源
引出极 漂移管D
压加 速 电
+ +
+
S
D
蛋白质组学及技术介绍通用课件

蛋白质组学技术可以对蛋白质相互作用进行系统研究,发现新的药物靶点,并对药物作用过程中蛋白 质的应答变化进行监测,从而对新药进行有效的筛选和评价。同时,蛋白质组学还可以用于研究药物 的作用机制,解析药物在体内的生物过程,为新药的研发提供重要的理论支持。
生物进化研究
总结词
蛋白质组学在生物进化研究中的应用主要表 现在对不同物种间蛋白质结构和功能的比较 分析,揭示生物进化的规律和机制。
动物实验伦理
减少动物使用
尽量采用其他替代方法,减少动物的使用数量和痛苦。
优化实验方案
在必须使用动物的情况下,应优化实验方案,尽量减少动物的痛苦 和死亡。
严格遵循法律法规
遵守国家和地区的动物保护法律法规,确保实验的合法性。
数据共享与知识产权保护
数据共享
鼓励在学术领域内共享数据,促进科研合作和知识进步。
详细描述
蛋白质组学通过对不同物种间相似蛋白质的 同源性进行分析,可以发现物种间的亲缘关 系和进化历程。同时,蛋白质组学还可以通 过对蛋白质结构和功能的比较分析,发现物 种间在适应环境变化过程中产生的蛋白质变 异和进化机制。这些研究对于深入理解生物
进化的过程和机制具有重要意义。
04
蛋白质组学研究展望
通过测定蛋白质的氨基酸序列,确定蛋白质的组成和 结构。
质谱分析
通过测量蛋白质离子的质量和电荷比值,推断蛋白质 的分子量和肽链组成。
数据库搜对,确定蛋白质的身份。
蛋白质定量技术
同位素标记技术
01
通过同位素标记目标蛋白质,利用其与未标记蛋白质在质谱中
鉴定蛋白质之间的相互作用关系,了解蛋白 质的功能网络。
蛋白质修饰分析
研究蛋白质的翻译后修饰,如磷酸化、糖基 化、乙酰化等,以揭示其调控机制。
微生物与蛋白质研究微生物在蛋白质组学中的应用

微生物与蛋白质研究微生物在蛋白质组学中的应用蛋白质是生物体内非常重要的一类大分子,它们在细胞过程、代谢调控、信号传递等多个方面发挥着重要作用。
随着科学技术的进步,研究蛋白质的组成、结构和功能变得越来越重要。
而微生物在蛋白质组学中的应用引起了广泛的关注。
本文将探讨微生物在蛋白质组学中的应用和意义。
一、微生物样本在蛋白质组学中的重要性蛋白质组学研究的首要任务是确定蛋白质样本。
微生物是蛋白质组学研究中常用的样本,其原因主要有以下几点:首先,微生物繁殖周期短,代谢活跃,相对于人类或者其他复杂的生物体,生长和繁殖速度更快。
这就为蛋白质组学的研究提供了一个优势样本。
在短时间内,可以获取更多丰富的蛋白质信息。
其次,微生物的基因组序列完全已知,并且微生物的基因组较小。
这使得微生物在蛋白质组学中成为了优秀的研究对象。
研究人员可以对微生物进行全面的蛋白质组学研究,以探索蛋白质的变异、修饰、相互作用等多个方面的信息。
最后,微生物生长环境相对简单,而且可以轻松进行培养。
这为实验研究提供了便利。
与其他生物样本相比,在蛋白质组学研究中,微生物的样本选择更加简单、可控,从而能够更好地探究蛋白质的特性和功能。
二、微生物在蛋白质组学中的应用方式1. 蛋白质质谱技术蛋白质组学的核心技术之一是质谱技术。
微生物在蛋白质质谱研究中得到了广泛应用。
通过质谱技术,可以快速、准确地鉴定和定量微生物中的蛋白质。
典型的蛋白质质谱技术包括质谱图谱分析、蛋白质结构分析以及蛋白质和其他生物分子的相互作用研究等。
质谱技术的发展使得研究者能够更好地揭示微生物中蛋白质的多样性和功能特性,这有助于了解微生物的生物学过程和代谢调控等相关信息。
2. 蛋白质组学数据库蛋白质组学数据库是整理和存储蛋白质组学数据的重要平台。
微生物在蛋白质组学数据库中占据了很大一部分的资源。
蛋白质组学数据库不仅可以提供微生物蛋白质的组成和结构信息,还可以为研究者提供丰富的蛋白质相互作用数据库,从而帮助研究者更好地理解微生物生物学过程中的蛋白质调控网络。
蛋白质组学PPT课件

功能蛋白质组学 结构蛋白质组学
.
11
人类蛋白质组学研究进展
2001年成立国际人类蛋白质组组织(HUPO), 2003.12.15启动两个首批行动计划 1.人类肝脏蛋白质组计划(HLPP)由中国军事医学科学
院副院长贺福初院士领导,16国80多个实验室参加。 中国第一次领导重大国际协作计划。 2. 人类血浆蛋白质组计划(HPPP)由美国科学家牵头, 13国47个实验室参加。
双向电泳后的凝胶
经染色后蛋白呈现二维
分布图: 水平方向反映出蛋
白在pI上的差异, 垂直方向反映出它
聚焦后凝 胶放置在 SDS凝胶 上,进行 第二向电 泳
们在分子量上的差别。
第二向电泳: SDS-PAGE
pH9
.
pH9
pH3
分子量大 分子 量小
pH3
18
(1)等电聚焦 凝胶电泳 ( IFE)
利用载体两 性电解质在电场 作用下沿电场方 向在凝胶内形成 一个连续而稳定 的pH梯度。
根据一定的配方计算后,将适宜的IPG试剂添加至混 合物中用于凝胶聚合,在聚合中缓冲基团通过乙烯键共 价聚合至聚丙烯酰胺骨架中而形成pH梯度。通过这种方 式生成的IPG不会发生电渗作用,因而可以进行特别稳 定的IEF分离达到真正的平衡状态。
.
5
第一节 蛋白质组及蛋白质组学基本概念
.
6
什么是蛋白质组?
蛋白质组(proteome):
PROTEOME = PROTE in +genOME Proteins expressed by a genome.
是指“特定细胞、组织乃至机体作为一个 生命单元中所有蛋白质的集合,即生命体中携 带的基因信息在某一时段所表达的全部蛋白质。
【推荐PPT】蛋白质组学及技术介绍文档

发现新的疾病标志物,鉴定疾病相关蛋白质作为早期临床诊断标志。
该系统利用谱真法核细、胞疏调控水转性录起相始互过程作中用,D色N A谱结法合结等构;域(binding domain,BD)识别DNA上的特异序列并使转录激活结构域
生物质谱技术是蛋白质组学研究中最重要的鉴定技术,其基本原 理是样品分子离子化后,根据不同离子之间的荷质比(M/E)的差异 来分离并确定分子量。对于经过双向电泳分离的目标蛋白质用胰蛋白 酶酶解(水解Lys或Arg的-C端形成的肽键)成肽段,对这些肽段用质 谱进行鉴定与分析。目前常用的质谱包括两种:基质辅助激光解吸电 离-飞行时间质谱(MALDI-TOF-MS)和电喷雾质谱(ESI- MS)。
蛋白质组学及技术 介绍
概念
蛋白质组是在一个细胞的整个生命过程中由基因组表达的以及表达后修饰 的全部蛋白质。
蛋白质组学是蛋白质组概念的延伸。是蛋白质的规模化研究,从蛋白质 水平和生命本质层次上研究和发现生命活动的规律和重要生理、病理现象的 本质,揭示基因活动的动态表达。
蛋白质水平的分析不仅为生物分子体系提供最有效的实时分析模型而且 也获得了DNA和RNA水平上不易获得的信息。
二维凝胶电泳法:
二维凝胶电泳的原理是第一向基于蛋白质的等电点不同 用等电聚焦分离,第二向则按分子量的不同用SDS-PAGE分 离,把复杂蛋白混合物中的蛋白质在二维平面上分开。
2-DE有较好的分辨率,E或单相IEF的最好分 辨率仅为100个蛋白,而2-DE大约为3000个蛋白。
蛋白质肽段的鉴定:
研究技术
它的基本原理是在非变性条件下裂解细胞,保留细胞内相互作用的蛋白质,将目的蛋白的抗体加入细胞裂解液中,使目的蛋白在体内 的相互作用蛋白成电下来。
蛋白质组学ppt

临床样本都是各种细胞或组织混杂, 临床样本都是各种细胞或组织混杂, 而且状态不一, 而且状态不一,如肿瘤中癌变的上皮类 细胞总是与血管、基质细胞等混杂。 细胞总是与血管、基质细胞等混杂。
激光捕获显微切割(laser 激光捕获显微切割(laser capture microdissection, microdissection,LCM)
胶体扩散染料
主要用于高灵敏度检出电转印至硝酸纤维素和 PVDF膜上的蛋白质,不用于胶内染色。 最好的胶体金染色的灵敏度与PAGE胶内的银 染类似。
这种技术主要包括印度墨水染料、胶体金属染 料等。
有机荧光团染料
包括共价结合和非共价结合的荧光团染料两类。后者最为常 用,其典型代表是已经商品化的SYPRO Red、 Orange、 Ruby等荧光染料。 这三种染料可对SDS-PAGE胶内蛋白质进行一步染色,约 30~60min完成,灵敏度为2~10ng。染色后的凝胶用标准的 实验室300nm紫外透射仪进行照像保存,其线性范围为3个 数量级。 这三种染料的电泳染色结果与在酵母中通过SAGE所获得的 基因表达水平的动态范围相匹配。 在Tris/甘氨酸转印缓冲液中染色后,蛋白质可被转印至膜上 并进行免疫染色或Edman测序来鉴定蛋白质。
美国国立癌症研究院(NCI)投资1 000万 美国国立癌症研究院(NCI)投资1 000万 美元建立肺、直肠、乳腺、 美元建立肺、直肠、乳腺、卵巢肿瘤的蛋 白质组数据库。 白质组数据库。 NCI和FDA共同投资 NCI和FDA共同投资数百万美元建立癌症不同 阶段的蛋白质组数据库。 阶段的蛋白质组数据库。 英国建立三个蛋白质组研究中心对已完成 或即将完成全基因组测序的生物体进行蛋 白质组研究。 白质组研究。
同一基因组在不同细胞、 同一基因组在不同细胞、不同组织中的表达情 况各不相同 。
蛋白质组学技术及其在病原微生物研究中的应用

皮 类细胞 ,而 这类细 胞在 肿瘤 中总 是与 血管 、基质细 胞等
混 杂 。所 以 ,常 规 采用 的癌和 癌旁组 织 或肿瘤 与正常 组 织 进 行差 异比较 ,实 际上 是多种 细胞 甚至 组织蛋 白质 组混 合 物 的比 较 。而 蛋 白质 组研 究 需 要 的 通常 是 单 一 的 细胞 类
所谓 蛋 白质组 (rt me, 即指 某 一物 种 、个体 、组 Poe ) o
织 、细胞 乃至 体液在 精确 控制 其环 境条件 之下 ,特 定时 刻
趋 势有 以下几个 方 面。 21 蛋 白质 组研 究 中的样 品 制备 . 由于 样 品和 原 始材 料
的 种类繁 多 ,最佳 的对 各种类 型的 样品制 备方 法必须 通过 经 验来决 定 。通常 可采 用细胞 或组 织 中的全 蛋 白质 组分进
杂 ,而且状 态 不一 。如肿 瘤组 织 中 ,பைடு நூலகம் 生癌变 的往往 是上
规模 、有 系统地 研究 蛋 白质的特 征及 结构 ,包括 蛋 白质的 表达 水平 、翻 译后修 饰 、蛋 白质问的 相互 作用 等 。
蛋 白质组 学研 究对 象主要 集 中在原 核生物 和基 因 序列
被 完全 搞清 或大 部分 已知 的生 物体 上 【。对人 类蛋 白质组 2 ] 的研 究 目前 多围绕 于特异 的组 织 、细 胞和 疾病 方面 ,并 已
物理 、化学 、生物 学性 质与 功能 ,最终 获得 每个 蛋 白质 的 性质 ,表达 变化 及翻 译后加 工等 各方 面的 大规模信 息 【 。 2 '
蛋 白质组 学(rt mi ) 以蛋 白质组 为研 究对 象 ,大 Poe c 是 o s
如专 门分离 出细胞 核 、线粒 体或 高尔基 体等 细胞器 的蛋 白 质成分 。样 品预 分级不 仅可 以提 高低 丰度蛋 白质 的上样 量 和检 测 ,还 可 以针对 某一细 胞器 的蛋 白质组 进行研 究 。对 临床 组织样 本进 行研 究 ,寻找疾病 标 记分 子是 蛋 白质组 研 究 的 重要 方 向 之 一 。但 临 床 样本 都 是 各 种 细胞 或 组 织 混
蛋白质组学PPT课件
蛋白质组定义
1,基因组表达的全部蛋白质。 2,在一种细胞/组织内存在的全部蛋白 质。
Proteome
• 1994 M.Wilkins and K.W.Williams
•
Macquarie University in Sydney
• Total Proteins Complement of a Genome
环境
ቤተ መጻሕፍቲ ባይዱ
REAL COMPLEXITY…
IS IN CELLULAR ROTEOMES • BEYOND THE GENOME… • Tissue Specific Expression • Alternate Splicing, (1/3 of all genes) • Post-Translational Modifications
Functional
Proteomics
• During human development, cell express different proteins
• Normal and cancer cells express different proteins
• Cell treated with and without drug express different proteins
– Types and Level:
– Signal Sequence cleavage – Glycosylation
– Phosphorylation – Farnylation – Isoprenylation – Acetylation
• All combine > 100-1000 fold increase in complexity
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
内经过一定时间后,各组分将分别聚焦在各自等
电点相应的pH位置上,形成分离的蛋白质区带。
精品 PPT 可修改
15
传统O’Farrell系统双向电泳的缺陷。
pH凝胶制作的不稳定和重复性差限制了 等点聚焦电泳技术的应用,
Bjellgvist等发展并完善了固相pH梯 度等电聚焦技术,GÖrg等成功地将之 应用于双向电泳。
精品 PPT 可修改
5
蛋白质组是:
对应于基因组的所有蛋白质构成的整 体,不是局限于一个或几个蛋白质。
同一基因组在不同细胞、不同组织中 的表达情况各不相同 。
在空间和时间上动态变化着的整体。
精品 PPT 可修改
6
蛋白质组学(proteomics)
指应用各种技术手段来研究蛋白质组的一门新 兴科学,其目的是从整体的角度分析细胞内动 态变化的蛋白质组成成份、表达水平与修饰状 态,了解蛋白质之间的相互作用与联系,揭示 蛋白质功能与细胞生命活动规律。
精品 PPT 可修改
18
双向电泳典型过程包括:
①蛋白质样品制备:要防止蛋白质酶降解蛋白质。
②上样
一种是IPG胶条重泡胀衙利用加样杯边运行等点聚焦边上 样。
别一种是将样品与重泡胀液混合,在IPG胶条泡胀的同时 样品出参入了胶条。
③IPG的运行和平衡
④SDS-聚丙烯酰胺凝胶电泳
⑤胶上蛋白质检测和定量:
2、蛋白质组功能模式(目前主要集中在蛋白 质相互作用网络关系)的研究
精品 PPT 可修改
8
大规模的蛋白质分析过程
样品制备
是蛋白质组研究的第一步也是最关键的一步。
蛋白质分离(技术):
二维电泳(核心技术)、多维色谱
蛋白质分析与鉴定(技术):
质谱技术(核心技术)、蛋白质芯片技术、酵母双杂 交技术和噬菌体表面展示技术等。
优点
精品 PPT 可修改
16
固相pH梯度等电聚焦的优点
◆克服了载体两性电解质阴极漂移等缺点。 ◆稳定的可以随意精确设定的pH梯度。
尤 其 可 在 较 窄 的 pH 范 围 内 进 行 第 二 轮分析,大大提高了分辨率及重复性。
精品 PPT 可修改
17
第二向SDS-PAGE电泳
垂直板电泳 水平超薄胶电泳
精品 PPT 可修改
3
➢ mRNA水平的基因表达研究取得进 展,但mRNA与蛋白质间的相关系 数仅为0.4~0.5
➢ 蛋白质自身特点难以从DNA和mRNA 水平得到解答
精品 PPT 可修改
4
蛋白质组学的概念
蛋白质组是澳大利亚学者Williams 和Wilkins于1994年首先提出,
被定义为:一个基因组/一种生物或 一种细胞/组织所表达的全部蛋白质。
精品 PPT 可修改
7
蛋白质组学研究的内容
1、蛋白质表达模式(或蛋白质组组成)的研究
蛋白质组组成的分析鉴定是蛋白质组学中的 与基因组学相对应的主要内容。它要求对蛋白质组 进行表征,即实现所有蛋白质的分离、鉴定及其图 谱化。双向凝胶电泳(2-DE)和质谱(Mass spectrometry)技术是当前分离鉴定蛋白质的两大支 柱技术
质分子带负电荷向阳极移动,直至某一pH位点时
原
失去电荷而停止移动,此处介质的pH恰好等于聚 焦蛋白质分子的等电点(pI)。同理,位于酸性
理 区域的蛋白质分子带正电荷向阴极移动,直到它
们的等电点上聚焦为止。可见在该方法中,等电
点是蛋白质组分的特性量度,将等电点不同的蛋
白质混合物加入有pH梯度的凝胶介质中,在电场
◆ 在2-D胶上有些蛋白质点量太少,难以进 行质谱鉴定;操作费时、费力,自动化程度低 难于与质谱联用实现自动化性质联用。
精品 PPT 可修改
21
ห้องสมุดไป่ตู้
2、新型非凝胶技术
◆高效液相色谱法 High performance liquid chromatography,HPLC ◆毛细管电泳 capillary electrophoresis,CE ◆液相等点聚焦和毛细管色谱 capillary electrochromatography
精品 PPT 可修改
13
特点
可分离10—100 kD分子量的蛋白质 高灵敏度和高分辨率 便于计算机进行图像分析处理 与质谱分析匹配
精品 PPT 可修改
14
第一向IEF电泳
在IEF的电泳中,具有pH梯度的介质其分布是从
阳极到阴极,pH值逐渐增大。而蛋白质分子具有
两性解离及等电点的特征,这样在碱性区域蛋白
荧光染色灵敏度比考染高而与银染相仿,线性范围要远 高地银染,与质谱兼容性好。
⑥图像采集、分析及数据处理
精品 PPT 可修改
19
精品 PPT 可修改
20
2-DE技术的缺点
◆ 所能分离的蛋白质的性质有一定限制,如蛋白质分
离范围一般为8~200kD,对极碱性蛋白质,疏水性蛋 白质,包含信号蛋白和转录因子的低丰度蛋白质难于 有效分离。
(一)、二维(双向)凝胶电泳(twodimensional electrophoresis,2-DE):
◆ 利用蛋白质的等电点和分子量,结合凝胶 化学特性,分离各种蛋白质的方法。
精品 PPT 可修改
12
原理
◆第一向在高压电场下对蛋白质进行等电 聚焦电泳技术(IEF)将蛋白质混合物按照 等电点高低进行分离, 再在第一向垂直 方向上进行第二向SDS-聚丙烯酰胺凝胶 电 泳 (SDS-PAGE) 按 照 相 对 分 子 质 量 大 小 进行蛋白质分离。
★ 蛋白质组发展的瓶颈是缺乏自动化的蛋白质分析 的完整途径。
精品 PPT 可修改
9
第二节 蛋白质组学研究基本技术
典型的蛋白质组学研究常分为四个步骤:
从生物学物质(如细胞、组织、体液等) 提取蛋白质混合液
分离蛋白质混合液
将有意义的蛋白质消化 成肽进行质谱分析
将质谱获得的数据利用各种
生物信息精学品 P工PT 具可修进改行分析
第11章
蛋白质组学及其在微生物学 研究中的应用
精品 PPT 可修改
1
主要内容
第一节 引言 第二节 蛋白质组学研究基本技术 第三节 微生物蛋白质组学
精品 PPT 可修改
2
第一节 引言
背景
➢ 基因组时代 →后基因组时代 ➢ 核苷酸序列本身很难直接与生命功能和生命
现象挂起钩,而蛋白质才是生物功能的最终 执行者。 ➢ 蛋白质数目大大超过基因数目。 蛋白质随时 间和空间而变化。
10
蛋白质组学发展依赖于高通量分离、鉴 定和解析蛋白质技术的进步。
重要技术突破主要包括三点:
固相化pH梯度二维电泳(IPG-2-DE)的 发明与完善;
生物质谱,即应用软电离技术对生物大分 子进行分析的质谱技术的发展;
生物信息学发展。
精品 PPT 可修改
11
一、蛋白质组研究中的蛋白质分离
