初中化学方程式上册汇总
化学九年级上册方程式

化学九年级上册方程式
1. 红磷燃烧:红磷这小家伙在氧气里一烧,就变成了五氧化二磷。
方程式是:4P + 5O₂点燃 2P₂O₅。
2. 硫燃烧:硫粉燃烧起来,和氧气结合生成二氧化硫,就像一场火热的约会!方程式:S + O₂点燃 SO₂。
3. 铁在氧气中燃烧:铁可真是个热情的家伙,在氧气里一烧,就变成了四氧化三铁。
方程式:3Fe + 2O₂点燃 Fe₃O₄。
4. 过氧化氢分解制取氧气:过氧化氢在二氧化锰这个“小助手”的帮助下,分解成水和氧气,就像变魔术一样!方程式:2H₂O₂ MnO₂ 2H₂O + O₂↑。
5. 氯酸钾受热分解制取氧气:氯酸钾在加热和二氧化锰的催化下,分解成氯化钾和氧气,努力地为我们产生氧气呢!方程式:2KClO₃加热 2KCl + 3O₂↑。
6. 高锰酸钾受热分解制取氧气:高锰酸钾加热之后,就分解成了锰酸钾、二氧化锰和氧气,这可是个大变身!方程式:2KMnO₄加热 K₂MnO₄ + MnO₂ + O₂↑。
7. 水通电分解:水通上电,就分解成了氢气和氧气,这电的力量可真神奇!方程式:2H₂O 通电 2H₂↑ + O₂↑。
8. 氢气燃烧:氢气和氧气一相遇,燃烧起来就生成了水,真是一场美丽的“结合”。
方程式:2H₂ + O₂点燃 2H₂O。
初三上册化学方程式大全

初三上册化学方程式大全一、氧气的性质1、镁在空气中燃烧:2Mg + O₂点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O₂点燃 Fe₃O₄3、铜在空气中受热:2Cu + O₂加热 2CuO4、铝在空气中燃烧:4Al + 3O₂点燃 2Al₂O₃5、氢气中空气中燃烧:2H₂+ O₂点燃 2H₂O6、红磷在空气中燃烧:4P + 5O₂点燃 2P₂O₅7、硫粉在空气中燃烧: S + O₂点燃 SO₂8、碳在氧气中充分燃烧:C + O₂点燃 CO₂9、碳在氧气中不充分燃烧:2C + O₂点燃 2CO二、实验室制氧气1、加热氯酸钾(有少量的二氧化锰):2KClO₃加热 2KCl +3O₂ ↑2、加热高锰酸钾:2KMnO₄加热 K₂MnO₄+ MnO₂+ O₂↑3、过氧化氢在二氧化锰作催化剂条件下分解反应:2H₂O₂二氧化锰 2H₂O + O₂ ↑三、水的性质1、水在直流电的作用下分解:2H₂O 通电 2H₂↑+ O₂ ↑2、生石灰溶于水:CaO + H₂O == Ca(OH)₂四、二氧化碳的性质1、碳在氧气中充分燃烧:C + O₂点燃 CO₂2、二氧化碳通过灼热碳层: C + CO₂高温 2CO3、一氧化碳在氧气中燃烧:2CO + O₂点燃 2CO₂4、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO₂+H₂O === H₂CO₃5、碳酸不稳定而分解:H₂CO₃=== H₂O + CO₂↑6、二氧化碳通入澄清石灰水:Ca(OH)₂+ CO₂==== CaCO₃↓+ H₂O7、大理石与稀盐酸反应(实验室制二氧化碳):CaCO₃+ 2HCl == CaCl₂+ H₂O + CO₂↑五、燃料及其利用1、甲烷在空气中燃烧:CH₄+ 2O₂点燃 CO₂+ 2H₂O2、酒精在空气中燃烧:C₂H₅OH + 3O₂点燃 2CO₂+ 3H₂O这些化学方程式是初三上册化学中的重要知识点,需要同学们熟练掌握和理解。
化学九年级上册全部化学方程式

化学九年级上册全部化学方程式1. 镁在空气中燃烧:2Mg + O2 =点燃= 2MgO2. 铁在氧气中燃烧:3Fe + 2O2=点燃= Fe3O43. 铜在空气中受热:2Cu + O2 =加热= 2CuO4. 铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O35. 氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 =点燃= 2P2O57. 硫粉在空气中燃烧:S + O2 =点燃= SO28. 碳在氧气中充分燃烧:C + O2 =点燃= CO29. 碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO10. 一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 =点燃=CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O13.玻义耳研究空气的成分实验2HgO =加热= Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 =加热= K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 (MnO2催化剂)=2H2O+ O2 ↑(实验室制氧气原理2)16.水在直流电的作用下分解(研究水的组成实验):2H2O =通电= 2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO319.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO =加热= Cu + H2O22. 镁还原氧化铜:Mg + CuO =加热= Cu + MgO23. 碳在氧气中充分燃烧:C + O2 =点燃= CO224.木炭还原氧化铜:C+ 2CuO =高温=2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 =高温= 4Fe + 3CO2↑26.煤炉的底层:C + O2 =点燃= CO227.煤炉的中层:CO2 + C =高温= 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 =点燃= 2CO229.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3=高温= CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O34.一氧化碳还原氧化铜:CO+ CuO =加热= Cu + CO235.一氧化碳的可燃性:2CO + O2 =点燃= 2CO236.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑37.甲烷在空气中燃烧:CH4 + 2O2 =点燃= CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O40.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO41.铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O442. 铜在空气中受热:2Cu + O2 =加热=2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O344. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg 55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH 77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓+ NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl。
九上化学方程式大全

九上化学方程式大全一、燃烧反应(描述现象要点:光或火焰,放热,生成物的颜色、状、态气味) 1、碳充分燃烧:C+O 2 =点燃CO 2 (基本反应类型:化合反应) (空气中:红热)(氧气中:发出白光,放出热量,产生使石灰水变浑浊的无色气体) 2、碳不充分燃烧:2C+O 2 =点燃2CO (基本反应类型:化合反应) 3、硫燃烧:S+O 2 =点燃SO 2 (基本反应类型:化合反应)(空气中:淡蓝色火焰,放出热量,产生具有刺激气味的气体) (氧气中:蓝紫色火焰,放出热量,产生具有刺激气味的气体) 4、磷燃烧:4P+5O 2 =点燃2P 2O 5 (基本反应类型:化合反应) (产生大量白烟,P 2O 5污染空气) 5、铁燃烧:3Fe+2O 2=点燃Fe 3O 4 (基本反应类型:化合反应)(氧气中:剧烈燃烧,火星四射,放出大量热,生成黑色固体) (瓶底留少量水或细沙,防止溅落的高温熔化物炸裂瓶底。
) 6、镁燃烧:2Mg+O 2=点燃2MgO (基本反应类型:化合反应) (发出耀眼的白光,生成白色固体)7、氢气燃烧:2H 2+O 2 =点燃2H 2O (基本反应类型:化合反应) (产生淡蓝色火焰,干冷烧杯壁有小水株) 8、一氧化碳燃烧:2CO+O 2 =点燃2CO 2 (基本反应类型:化合反应) (产生蓝色火焰,产生使石灰水变浑浊的无色气体) 9、甲烷燃烧:CH 4+2O 2 =点燃CO 2+2H 2O (产生明亮的蓝色火焰) 10、乙醇燃烧: C 2H 5OH+3O 2 =点燃2CO 2+3H 2O 二、常见气体制备方程式 (一)制取氧气1、过氧化氢与二氧化锰混合制氧气:2H 2O 2 =MnO22H 2O + O 2↑ (基本反应类型:分解反应) 2、加热氯酸钾和二氧化锰制备氧气:2KClO 3 =MnO 2 △=2KCl+3O 2↑ (基本反应类型:分解反应) 3、加热高锰酸钾:2KMnO 4 =加热K 2MnO 4 + MnO 2 + O 2↑ (基本反应类型:分解反应) (棉花:防止高锰酸钾粉末堵塞导管)(先撤导管后灭酒精灯:防止水倒流回试管底部而炸裂试管) 4、加热氧化汞:2HgO =加热2Hg+O 2↑ (基本反应类型:分解反应)5、电解水:2H 2O =通电H 2↑+O 2↑ (基本反应类型:分解反应)(电极:正氧负氢;体积比:氢二氧一;质量比:氧八氢一;加入硫酸或氢氧化钠的目的:增强水的导电性) (二)制取二氧化碳1、石灰石跟稀盐酸反应制二氧化碳:CaCO 3 + 2HCl = CaCl 2 + H 2O+ CO 2↑(基本反应类型:复分解反应)2、碳酸不稳定:H 2CO 3 = H 2O+CO 2↑ (基本反应类型:分解反应) 3、高温煅烧石灰石:CaCO 3 =高温 CaO+CO 2↑(CO 2工业制法,基本反应类型:分解反应) (三)制取氢气 1、锌跟稀硫酸反应:Zn + H 2SO 4=ZnSO 4 + H 2↑(实验室制氢气,基本反应类型:置换反应)2、锌跟稀盐酸:Zn + 2HCl=ZnCl2+ H2↑(实验室制氢气,基本反应类型:置换反应)3、镁跟稀盐酸反应:Mg + 2HCl=MgCl2+ H2↑(基本反应类型:置换反应)三、其他方程式1、二氧化碳使澄清石灰水变浑浊(CO2的检验):Ca(OH)2+ CO2=CaCO3↓+ H2O2、二氧化碳溶于水:CO2+H2O = H2CO3 (基本反应类型:化合反应)(CO2通入紫色石蕊试液,试液由紫色变为红色)3、木炭粉跟氧化铜高温共热:C+2CuO=高温2Cu+CO2↑(基本反应类型:置换反应)(黑色粉末逐渐变红,生成能使澄清石灰水变浑浊的气体)4、木炭粉还原氧化铁:3C+2Fe2O3=高温4Fe+3CO2↑(基本反应类型:置换反应)5、一氧化碳还原氧化铜:CO+CuO =加热Cu+CO 2(要有尾气处理装置)6、H 2还原氧化铜:H 2+CuO =加热Cu+H 2O (基本反应类型:置换反应) (反应前先通一段时间气体:排尽装置中的空气或氧气;反应结束后继续通一段时间气体,直至试卷冷却至常温下:防止生成的Cu 重新被氧化成氧化铜)7、一氧化碳还原氧化铁(赤铁矿炼铁): 3CO+Fe 2O 3 =高温2Fe+3CO 28、一氧化碳还原四氧化三铁(磁铁矿炼铁): 4CO+Fe 3O 4=高温3Fe+4CO 2四、金属与盐溶液反应(基本反应类型:置换反应) 1.铁与硫酸铜溶液:Fe + CuSO 4 = Cu + FeSO 4 (湿法冶铜,不能用铁桶盛放硫酸铜溶液原理。
九年级上册所有化学公式

九年级上册所有化学公式一、氧气相关的化学方程式。
1. 镁在空气中燃烧。
- 化学方程式:2Mg + O_2{点燃}{===}2MgO- 现象:发出耀眼的白光,生成白色固体。
2. 铁在氧气中燃烧。
- 化学方程式:3Fe + 2O_2{点燃}{===}Fe_3O_4- 现象:剧烈燃烧,火星四射,生成黑色固体。
3. 铜在空气中受热。
- 化学方程式:2Cu+O_2{}{===}2CuO- 现象:红色固体变为黑色。
4. 铝在空气中氧化。
- 化学方程式:4Al + 3O_2===2Al_2O_3- 现象:铝表面变暗。
5. 氢气在空气中燃烧。
- 化学方程式:2H_2+O_2{点燃}{===}2H_2O- 现象:产生淡蓝色火焰,放出热量。
6. 红磷在空气中燃烧。
- 化学方程式:4P + 5O_2{点燃}{===}2P_2O_5- 现象:产生大量白烟。
7. 硫粉在空气中燃烧。
- 化学方程式:S+O_2{点燃}{===}SO_2- 现象:在空气中发出淡蓝色火焰,在氧气中发出蓝紫色火焰,生成有刺激性气味的气体。
8. 碳在氧气中充分燃烧。
- 化学方程式:C + O_2{点燃}{===}CO_2- 现象:发出白光,放出热量。
9. 碳在氧气中不充分燃烧。
- 化学方程式:2C+O_2{点燃}{===}2CO二、制取氧气的化学方程式。
1. 加热高锰酸钾制取氧气。
- 化学方程式:2KMnO_4{}{===}K_2MnO_4+MnO_2+O_2↑2. 加热氯酸钾和二氧化锰制取氧气。
- 化学方程式:2KClO_3frac{_MnO_2}{}2KCl + 3O_2↑3. 过氧化氢在二氧化锰的催化下分解制取氧气。
- 化学方程式:2H_2O_2frac{_MnO_2}{}2H_2O+O_2↑三、水相关的化学方程式。
1. 水的电解。
- 化学方程式:2H_2O{通电}{===}2H_2↑+O_2↑四、碳和碳的氧化物相关的化学方程式。
1. 木炭还原氧化铜。
初中化学方程式(上册总结)

一.初中化学方程式(上册)注:按照教材上出现的顺序编写1.碳酸氢铵受热分解: 43322NH HCO NH H O CO ∆==↑++↑2.二氧化硫使高锰酸钾溶液褪色:242244245SO +2KMnO +2H O == K SO +2MnSO +2H SO3.石蜡在氧气中燃烧:222+O H O CO →+点燃石蜡现象:(1)火焰明亮发出白光(2)放出热量(3)烧杯壁出现水雾(4)生成一种能使澄清石灰水变浑浊的气体4.碳在氧气中燃烧:22C+O CO ==点燃现象:(1)发出白光(2)放出热量(3)生成一种能使澄清石灰水变浑浊的气体5.氯化氢气体和氨气混合(浓盐酸和浓氨水反应): 34NH +HCl==NH Cl6.碘化钾与硝酸银反应: 33KI+AgNO ==AgI +KNO ↓7.铜绿(碱式碳酸铜)与盐酸反应: 223222Cu (OH)CO +4HCl == 2CuCl +3H O+CO ↑现象:(1)绿色粉末逐渐溶解(2)有气泡产生(3)溶解后液体呈蓝绿色8.铜绿(碱式碳酸铜)受热分解: 22322Cu (OH)CO ==2CuO+H O+CO ∆↑现象:(1)绿色粉末变成黑色(2)试管内壁有水珠生成(3)澄清石灰水变浑浊9.镁带在空气氧气中燃烧:22Mg+O 2Mg O ==点燃现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末10.铜丝加热: 22Cu + O ==2CuO ∆11.红磷白磷在氧气中燃烧(研究空气组成的实验):2254P+5O 2P O ==点燃现象:(1)发出白光(2)放出热量(3)生成大量白烟12.硫在空气氧气中燃烧:22S+O SO ==点燃现象:A 、在纯的氧气中燃烧 (1)发出明亮的蓝紫火焰(2)放出热量(3)生成一种有刺激性气味的气体B 、在空气中燃烧 (1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体13.铁丝在氧气中燃烧:2343Fe+2O Fe O ==点燃现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体14.加热高锰酸钾(实验室制氧气原理1):424222K M n O =K M n O + M n O + O ∆↑15.过氧化氢在二氧化锰作催化剂条件下分解(实验室制氧气原理2):2M nO 22222H O =2H O + ↑16.植物的光合作用文字表达式:===++光照叶绿体二氧化碳水葡萄糖氧气17.二氧化碳与水反应:2223CO +H O == H CO 18.碳酸不稳定分解:2322H CO ==H O+CO ∆↑19.大理石和稀盐酸(实验室制二氧化碳原理):3222CaCO +2HCl == CaCl +H O+CO ↑ 20. 二氧化碳使澄清石灰水变浑浊(鉴别二氧化碳气体):2232CO +Ca(OH) == CaCO +H O ↓ 21. 生石灰和水反应:22CaO+H O == Ca(OH)22. 电解水实验(研究水的组成实验):2222H O==2H + O ↑↑通电23.氢气和氧气点燃:2222H +O 2H O ==点燃现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾24.甲烷在空气中燃烧:4222CH +2O ==CO +2H O 点燃25.乙炔在空气中燃烧:222222C H +5O ==4CO +2H O 点燃26.碳与氧气反应:22C+O (2CO ==点燃不充足) 27.一氧化碳点燃:222CO+O 2CO ==点燃现象:(1)发出蓝色的火焰(2)放热(3)澄清石灰水变浑浊28.硫酸铜与氢氧化钠反应: 42242NaOH+CuSO =Cu(OH)+Na SO ↓29.玻义耳研究空气的成分实验:氧化汞分解 2 2HgO==2Hg+ O ∆↑ 汞加热 2 2Hg+O ==2HgO ∆30.铝在空气中形成氧化膜:2234Al+3O ==2Al O 31.锌与盐酸反应: 22Zn+2HCl==ZnCl +H ↑32.氯酸钾用二氧化锰做催化剂分解制氧气(实验室制氧气原理):2MnO 322KClO ===2KCl+3O ∆↑33.氯化铁与氢氧化钠反应:33FeCl +3NaOH==Fe(OH)+3NaCl ↓ 34.电解氯化镁: 22MgCl ==Mg+ Cl ↑通电35.锌与稀硫酸反应: 2442Zn+ H SO ==ZnSO + H ↑36.石灰石浆吸收废气中的二氧化硫:322422CaCO +2SO +O ==2CaSO +2CO 37.乙醇(酒精)在空气中燃烧:25222C H OH+3O ==2CO +3H O 点燃38.氢气还原氧化铜: 22H + CuO==Cu + H O ∆39.镁在二氧化碳中燃烧:22Mg+CO ==2MgO+C 点燃40.高温煅烧石灰石(工业制取二氧化碳原理):32CaCO ==CaO+CO ↑高温41.碳酸钠和稀盐酸反应(灭火器原理):2322Na CO +2HCl==2NaCl+H O+CO ↑42.铁和盐酸反应:22Fe+2HCl==FeCl +H ↑ 43.铁和稀硫酸反应:2442Fe+H SO ==FeSO +H ↑ 44.铝和盐酸反应:322Al+6HCl==2AlCl +3H ↑ 45.铝和稀硫酸: 2424322Al+3H SO ==Al (SO )+3H ↑ 46.锌和盐酸的反应:22Zn+2HCl==ZnCl +H ↑47.锌和稀硫酸反应(实验室制氢气原理)2442Zn+H SO ==ZnSO +H ↑ 48.铁和硫酸铜溶液反应(湿法炼铜原理):44Fe+CuSO == Cu+FeSO现象:(1)铁表面覆盖一层红色的物质(2)溶液由蓝色变成浅绿色 49.一氧化碳还原氧化铁: (高炉炼铁原理):2323CO+Fe O ==2Fe+3CO 高温现象:(1)红色粉未变成黑色(2)澄清石灰水变浑浊50.电解铝: 2322Al O ==4Al+ 3O ↑通电51.碳还原二氧化碳:2CO + C==2CO 高温52.锌和硫酸铜溶液反应:44Zn+CuSO == Cu+ZnSO 53.氧化铜与稀硫酸反应: 2442CuO+H SO == CuSO +H O 54.焦炭还原氧化铁:2323C+ 2Fe O ==4Fe + 3CO ↑高温55.用盐酸除去铁锈:2332Fe O +6HCl == 2FeCl +3H O二.常见元素的化合价口诀:一价氢氯钾钠银, 二价氧钙镁钡锌, 三铝四硅五价磷; 二三铁, 二四碳,H +Cl -K +Na +Ag + 22222O C a M g B a Zn -++++345A l S i P +++ 2+3Fe Fe + 24C C ++ 二四六硫, 三五氮; 铜汞二价最常见(一五七氯常常见) 单质零价永不变。
九年级化学上册必背化学方程式

九年级化学上册必背化学方程式点燃1.镁在空气(或氧气)中燃烧: 2M g + O 2 2M g O点燃 2.铁在氧气中燃烧: 3F e + 2O 2F e 3O 4点燃3.氢气在空气(或氧气)中燃烧: 2H 2 + O 22H 2 O点燃4.红磷在空气(或氧气)中燃烧: 4P + 5O 2点燃5.硫粉在空气(或氧气)中燃烧: S + O 2点燃6.碳在空气(或氧气)中充分燃烧: C + O 27.碳在空气中不充分燃烧: 2C + O 2点燃2CO点燃8.一氧化碳在空气(或氧气)中燃烧: 2CO + O 22CO 29.二氧化碳和碳在高温条件下反应: CO 2 + C高温2CO10.二氧化碳溶解于水: CO 2 + H 2 O H 2 CO 311.生石灰溶于水: C a O + H 2 O C a (OH )212.水在直流电的作用下分解: 2H 2 O2H 2 ↑ +O 2 ↑13.加热氯酸钾和二氧化锰的混合物: 2KC l O 32KC l + 3O 2 ↑13.加热高锰酸钾: 2KM n O 4K 2M n O 4 + M n O 2 + O 2 ↑ 14.分解过氧化氢: 2H 2 O 22H 2 O + O 2 ↑通电15.高温煅烧氧化钙: C a CO 3高温C a O + CO 2 ↑16.碳酸不稳定而分解: H 2 CO 3 H 2 O + CO 2 ↑17.氢气还原氧化铜: H 2 + C u OC u + H 2 O高温18.木炭还原氧化铜:C+2CuO=2Cu+CO 2 ↑19.焦炭还原氧化铁:3C + 2F e 2 O 34F e + 3CO 2 ↑点燃20.甲烷在空气(或氧气)中燃烧: CH 4 + 2O 2CO 2 + 2H 2 O点燃21.酒精在空气(或氧气)中燃烧: C 2H 5 OH + 3O 22CO 2 + 3H 2 O 22.一氧化碳还原氧化铜: CO + C u OC u + CO 223.二氧化碳通入澄清石灰水中: CO 2 + C a (OH )2 C a CO 3 ↓ +H 2 O24.锌和稀硫酸反应: Z n + H 2 SO 4 Z n SO 4 + H 2 ↑高温。
初中上册化学方程式总结大全

初中化学方程式总结化合反应1、镁在空气中燃烧:2Mg + O2点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43、铝在空气中燃烧:4Al + 3O2点燃2Al2O34、氢气在空气中燃烧:2H2 + O2点燃2H2O5、红磷在空气中燃烧:4P + 5O2点燃2P2O56、硫粉在空气中燃烧:S + O2点燃SO27、碳在氧气中充分燃烧:C + O2点燃CO28、碳在氧气中不充分燃烧:2C + O2点燃2CO9、二氧化碳通过灼热碳层:C + CO2高温2CO10、一氧化碳在氧气中燃烧:2CO + O2点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO22H2O+ O2↑16、加热高锰酸钾:2KMnO4加热K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO + CO2↑置换反应20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO 加热Cu + H2O24、木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25、甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O26、水蒸气通过灼热碳层:H2O + C 高温H2 + CO27、焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O30、酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2== CaCO3↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 == Na2CO3 + H2O35、石灰石与稀盐酸反应CaCO3 + 2HCl = CaCl2 + H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器)Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43. 铜在空气中受热:2Cu + O2加热2CuO4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2点燃2H2O6. 红磷在空气中燃烧:4P + 5O2点燃2P2O57. 硫粉在空气中燃烧:S + O2点燃SO28. 碳在氧气中充分燃烧:C + O2点燃CO29. 碳在氧气中不充分燃烧:2C + O2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O 二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl +3O2↑16. 加热高锰酸钾:2KMnO4加热K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3高温CaO + CO2↑三、其它反应:二氧化碳溶解于水:CO2 + H2O === H2CO3生石灰溶于水:CaO + H2O === Ca(OH)2氧化钠溶于水:Na2O + H2O ==== 2NaOH三氧化硫溶于水:SO3 + H2O ==== H2SO4硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 + 5H2O无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O四、几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO2五.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4=== Fe2(SO4)3+3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O (5)酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4+ Cu(OH)2==== CuSO4+ 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓+ HNO3 63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4+ BaCl2 ==== BaSO4↓+ 2HCl (7)碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4==== Cu(OH)2↓+ Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3==== Fe(OH)3↓+ 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2==== Mg(OH)2↓+ 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓+ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2+ Na2CO3=== CaCO3↓+ 2NaOH(8)盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓+ 2NaCl化学方程式 反应现象 应用2Mg+O 2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟 白色信号弹2Hg+O 2点燃或Δ2HgO 银白液体、生成红色固体 拉瓦锡实验 2Cu+O 2点燃或Δ2CuO 红色金属变为黑色固体 4Al+3O 2点燃或Δ2Al 2O 3 银白金属变为白色固体3Fe+2O 2点燃Fe 3O 4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O 2高温2Fe 2O3C+O 2 点燃CO 2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O 2 点燃SO 2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H 2+O 2 点燃2H 2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水) 高能燃料4P+5O 2 点燃2P 2O 5 剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量CH 4+2O 2点燃2H 2O+CO 2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 甲烷和天然气的燃烧2C 2H 2+5O 2点燃2H 2O+4CO 2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 氧炔焰、焊接切割金属 2KClO 3−−→−¤MnO2 2KCl +3O 2↑ 生成使带火星的木条复燃的气体 实验室制备氧气2KMnO 4Δ K 2MnO 4+MnO 2+O 2↑ 紫色变为黑色、生成使带火星木条复燃的气体 实验室制备氧气2HgO Δ2Hg+O 2↑ 红色变为银白、生成使带火星木条复燃的气体 拉瓦锡实验2H 2O 通电2H 2↑+O 2↑ 水通电分解为氢气和氧气 电解水Cu 2 (OH) 2CO 3Δ2CuO+H 2O+CO 2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体 铜绿加热NH 4HCO 3ΔNH 3↑+ H 2O +CO 2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体 碳酸氢铵长期暴露空气中会消失Zn+H 2SO 4=ZnSO 4+H 2↑ 有大量气泡产生、锌粒逐渐溶解 实验室制备氢气Fe+H 2SO 4=FeSO 4+H 2↑ 有大量气泡产生、金属颗粒逐渐溶解 Mg+H 2SO 4 =MgSO 4+H 2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H 2SO 4=Al 2 (SO 4)3+3H 2↑ 有大量气泡产生、金属颗粒逐渐溶解 Fe 2O 3+3H 2 Δ 2Fe+3H 2O 红色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢气的还原性Fe 3O 4+4H 2 Δ3Fe+4H 2O 黑色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢气的还原性WO 3+3H 2Δ W +3H 2O 冶炼金属钨、利用氢气的还原性 MoO 3+3H 2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl 2Δ或点燃2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、 H 2+Cl 2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的形成、制备盐酸CuSO 4+2NaOH=Cu(OH) 2↓+Na 2SO 4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验2C +O 2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因 2CO+O 2点燃2CO 2 蓝色火焰 煤气燃烧C + CuO 高温2Cu+ CO 2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属2Fe 2O 3+3C 高温4Fe+ 3CO 2↑ 冶炼金属 Fe 3O 4+2C 高温3Fe + 2CO 2↑ 冶炼金属 C + CO 2 高温2COCO 2 + H 2O = H 2CO 3 碳酸使石蕊变红 证明碳酸的酸性H2CO3ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3高温CaO+ CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+ CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+ CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+ CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+ CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3 CO2冶炼金属原理Fe3O4+4CO高温3Fe+4 CO2冶炼金属原理WO3+3CO高温W+3 CO2冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl —的原理Fe2O3+3H2SO4= Fe2(SO4)3+3 H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3 H2SO4= Al2(SO4)3+3 H2O 白色固体溶解CuO+ H2SO4=CuSO4+ H2O 黑色固体溶解、溶液呈蓝色ZnO+ H2SO4=ZnSO4+ H2O 白色固体溶解MgO+ H2SO4=MgSO4+ H2O 白色固体溶解2NaOH+ H2SO4=Na2SO4+2 H2OCu(OH)2+ H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+ H2SO4=CaSO4+2H2OMg(OH)2+ H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3 H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3 H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+ H2O 白色固体溶解CuO+2 HNO3=Cu(NO3)2+ H2O 黑色固体溶解、溶液呈蓝色ZnO+2 HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2 HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2 HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+ HNO3NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2 H2O白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3 H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2 H2OFe(OH)3+3HNO3=Fe(NO3)3+3 H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓+2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4·H2O 蓝色晶体变为白色粉末CuSO4·H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2↑MgCO3+2HCl= MgCl2+H2O+ CO2↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体。
九年级上册化学方程式总结

(一)化合反应
1、磷在氧气中燃烧:4P+5O2=点燃=2P2O5
2、硫在氧气中燃烧:S+O2=点燃=SO2
3、木炭在氧气中燃烧:C+O2=点燃=CO2
4、铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O4
5、镁在空气中燃烧:2Mg+O2=点燃=2MgO
6、铜在空气中加热:2Cu+O2=△=2CuO
(三)置换反应
18、锌和稀硫酸反应(实验室制H2):Zn+H2SO4=ZnSO4+H2↑
19、氢气还原氧化铜:H2+CuO=△=Cu+H2O
20、木炭还原氧化铜:C+2CuO=高温=2Cu+CO2↑
21、碳还原氧化铁:3C+2Fe2O3=高温=4Fe+3CO2↑
22、铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO4
23、铜和硝酸汞溶液:Cu+Hg(NO3)2=Hg+Cu(NO3)2
24、氢气还原氧化铜:H2+CuO=△=Cu+H2O
(四)复分解反应
25、大理石和稀盐酸(实验室制CO2):CaCO3+2HCl=CaCl2+H2O+CO2↑
26、碳酸钠和盐酸(灭火器原理):Na2CO3+2HCl=2NaCl+H2O+CO2↑
(五)其他:
27、二氧化碳使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O
28、一氧化碳还原氧化铜:CO+CuO=△=Cu+CO2
29、一氧化碳还原氧化铁(炼铁):3CO+Fe2O3=高温=2Fe+3CO2
九年级上册化学方程式整理

九年级上册化学方程式整理一、物质与氧气的反应1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO二、物质与碳的反应1. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO22. 酒精和氧气反应:C2H5OH + 3O2点燃2CO2 + 3H2O三、酸与金属氧化物的反应1. 用盐酸除去铁锈:Fe2O3 + 6HCl === 2FeCl3 + 3H2O2. 用盐酸检验烧碱是否变质:NaOH + HCl === NaCl + H2O3. 用盐酸和氧化铜反应:CuO + 2HCl === CuCl2 + H2O4. 用硫酸和氧化铜反应:CuO + H2SO4 === CuSO4 + H2O四、碱与非金属氧化物的反应1. 用氢氧化钠溶液吸收二氧化硫:SO2 + 2NaOH === Na2SO3 + H2O2. 用氢氧化钠溶液吸收二氧化氮和一氧化碳:NO2 + CO + 2NaOH === NaNO3 + Na2CO3 + H2O3. 用氢氧化钙溶液和二氧化碳反应:CO2 + Ca(OH)2 === CaCO3↓+ H2O4. 用氢氧化钙溶液吸收二氧化硫:SO2 + Ca(OH)2 === CaSO3↓+ H2O五、盐与金属/碱的反应1. 用锌和稀硫酸反应制取氢气:Zn + H2SO4 === ZnSO4 + H2↑3. 用铜和稀硫酸反应制取氢气:Cu + H2SO4 === ZnSO4 + H2↑不反应,因为金属活动性顺序表中铜位于氢后,活动性较弱,所以不会和酸反应。
九年级上册化学方程式大全
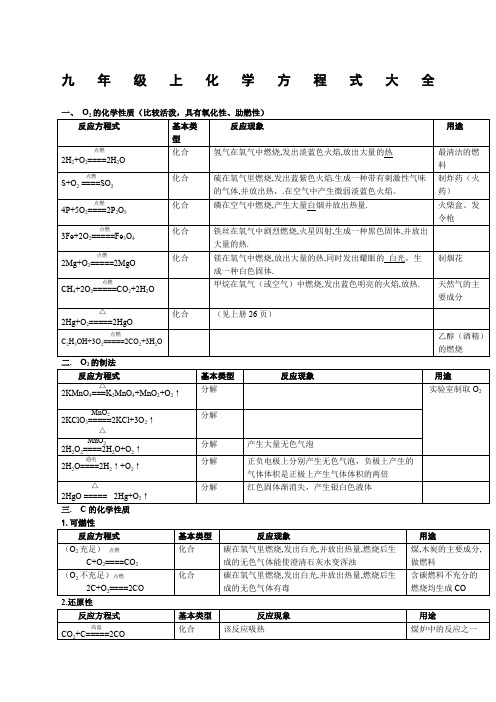
1.可燃性
反应方程式
基本类型
反应现象
用途
(O2充足)点燃
C+O2====CO2
化合
碳在氧气里燃烧,发出白光,并放出热量,燃烧后生成的无色气体能使澄清石灰水变浑浊
煤,木炭的主要成分,做燃料
(O2不充足)点燃
2C+O2====2CO
化合
碳在氧气里燃烧,发出白光,并放出热量,燃烧后生成的无色气体有毒
复分解
反应剧烈,产生大量气泡,白色固体溶解
可治疗胃酸过多
高温
CaCO3====CaO+CO2↑
分解
工业上用煅烧石灰石制取CO2
分解
实验室制取O2
MnO2
2KClO3=====2KCl+3O2↑
△
分解
MnO2
2H2O2====2H2O+O2↑
分解
产生大量无色气泡
通电
2H2O====2H2↑+O2↑
分解
正负电极上分别产生无色气泡,负极上产生的气体体积是正极上产生气体体积的两倍
△
2HgO =====2Hg+O2↑
分解
红色固体渐消失,产生银白色液体
反应现象
用途
点燃
2CO+O2=====2CO2
化合
一氧化碳在空气中燃烧,发出淡蓝色火焰,并放出热量,燃烧后生成的无色气体能使澄清石灰水变浑浊
煤气主要成分,做燃料
2.还原性
反应方程式
基本类型
反应现象
用途
△
CuO+CO====Cu+CO2
黑色的粉末逐渐变成红色的粉末,且生成一种使澄清石灰水变浑浊的无色气体
初三上册化学方程式大全

初三上册化学方程式大全1.镁在空气中燃烧:2Mg+02 点燃2MgO2.铁在氧气中燃烧:3Fe+ 202 点燃Fe3043.铜在空气中受热:2Cu+02 加热2CuO4.铝在空气中燃烧:4Al+ 302 点燃2AI2035.氢气中空气中燃烧:2H2 +02 点燃2H206.红磷在空气中燃烧:4P +502 点燃2P2057.硫粉在空气中燃烧:S+02 点燃SO28.碳在氧气中充分燃烧:C+02 点燃CO29.碳在氧气中不充分燃烧:2C +02 点燃2CO10.一氧化碳在氧气中燃烧:2C0+02 点燃2C0211.甲烷在空气中燃烧:CH4+202 点燃CO2+2H2012.酒精在空气中燃烧:C2H50H+302 点燃2C02 +3H2013.水在直流电的作用下分2H20 通电2H2↑+ 02 ↑14.加热碱式碳酸铜:Cu2(OH)2C03 加热2CuO +H20 +CO2↑15.加热氯酸钾(有少量的二氧化锰):2KCI03 ====2KCL+ 302↑16.加热高锰酸钾:2KMn04加热K2Mn04+MnO2 +O2↑17.碳酸不稳定而分H2C03===H20+CO2↑18.高温煅烧石灰石:CaC03 高温Ca0 +CO2↑19.氢气还原氧化铜:H2 +Cu0 加热Cu+H2020.木炭还原氧化铜:C+2Cu0 高温2Cu+CO2 ↑21.焦炭还原氧化铁:3C+2Fe203 高温4Fe+3C02↑22.焦炭还原四氧化三铁:2C+Fe304 高温3Fe+2C02↑23.一氧化碳还原氧化铜:CO+Cu0 加热Cu+CO224.一氧化碳还原氧化铁:3CO+ Fe203 高温2Fe+3CO225.一氧化碳还原四氧化三铁:4CO+ Fe304 高温3Fe +4C0226.锌和稀硫酸Zn+H2S04=ZnS04 +H2↑27.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑28.镁和稀硫酸Mg+H2SO4=MgSO4+H2↑29.铝和稀硫酸2A1+3H2SO4=A12(SO4)3 +3H2↑30.锌和稀盐酸Zn+2HCI ===ZnCl2 +H2↑31.铁和稀盐酸Fe+2HCl ===FeCl2 +H2↑32.镁和稀盐酸Mg+2HCI===MgCI2 +H2↑33.铝和稀盐酸2AI+6HCI==2AICI3 +3H2↑34.铁和硫酸铜溶液反应:Fe+CuS04 ===FeSO4 +Cu35.锌和硫酸铜溶液反应:Zn+CuS04 ===ZnSO4 +Cu36.铜和硝酸汞溶液反应:Cu+Hg(NO3)2 ===Cu(NO3)2 +Hg37.氧化铁和稀盐酸反应:Fe203+6HCI===2FeCl3 +3H2o38.氧化铁和稀硫酸反应:Fe203+3H2SO4 ==Fe2(SO4)3+3H2039.氧化铜和稀盐酸反应:CuO+2HCI ==== CuCI2 + H2040.氧化铜和稀硫酸反应:Cu0+H2S04 ====CuSO4 +H2041.氧化镁和稀硫酸反应:MgO+H2S04====MgSO4 +H2042.氧化钙和稀盐酸反应:Ca0+2HCl==== CaCl2 +H2043.苛性钠暴露在空气中变质:2Na0H+CO2 ====Na2C03 +H2044.苛性钠吸收二氧化硫气体:2NaOH+SO2 ====Na2S03 +H2045.苛性钠吸收三氧化硫气体:2NaOH+SO3 ====Na2S04+H2046.消石灰放在空气中变质:Ca(0H)2+C02 ==== CaCO3↓+ H2047.消石灰吸收二氧化硫:Ca(0H)2+S02====CaSO3↓+ H2048.盐酸和烧碱起反应:HCI+NaOH ==== NaCl +H2049.盐酸和氢氧化钾反应:HCI+KOH ==== KCI +H2050.盐酸和氢氧化铜反应:2HC1+Cu(OH)2 ==== CuCI2 +2H2051.盐酸和氢氧化钙反应:2HC|+Ca(OH)2 ==== CaCl2 +2H2052.盐酸和氢氧化铁反应:3HCI+Fe(OH)3 ====FeCI3 +3H2053.氢氧化铝药物治疗胃酸过多:3HCI+AI(OH)3 ==== AICI3+ 3H2054.硫酸和烧碱反应:H2S04+2NaOH ==== Na2SO4 +2H2055.硫酸和氢氧化钾反应:H2S04+2KOH ====K2SO4 +2H2056.硫酸和氢氧化铜反应:H2S04+Cu(0H)2 ====CuSO4+ 2H2057.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3===Fe2(SO4)3+ 6H2058.硝酸和烧碱反应:HNO3+NaOH ====NaNO3 +H2059.大理石与稀盐酸反应:CaC03+2HCI=== CaCl2 +H20 + CO2↑60.碳酸钠与稀盐酸反应:Na2C03+2HCI===2NaCl +H20+CO2↑61.碳酸镁与稀盐酸反应:MgCO3+2HCl===MgCI2 +H20 + CO2 ↑62.盐酸和硝酸银溶液反应:HCI+AgNO3 === AgCI↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2S04 ===Na2SO4 +H20 + CO2↑64.硫酸和氯化钡溶液反应:H2S04+BaCl2 ==== BaSO4↓+2HCI65.氢氧化钠与硫酸铜:2Na0H+CuSO4 ====Cu(OH)2↓+ Na2SO466.氢氧化钠与氯化铁:3NaOH+FeCl3 ==== Fe(OH)3↓+ 3NaCl67.氢氧化钠与氯化镁:2NaOH+MgCI2 ==== Mg(OH)2↓+ 2NaCl68.氢氧化钠与氯化铜:2NaOH+CuCI2 ==== Cu(OH)2↓+ 2NaCI69.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3 ===CaC03↓+ 2NaOH70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3 ===AgCI↓+ NaNO371.硫酸钠和氯化钡:Na2S04+BaCl2==== BaSO4↓+2NaCl72.二氧化碳溶解于水:CO2+H20 ===H2CO373.生石灰溶于水:Ca0 +H20 === Ca(OH)274.氧化钠溶于水:Na20+H20 ==== 2NaOH75.三氧化硫溶于水:SO3+H20 ==== H2SO4。
初中上册化学方程式(完整版)

初中上册化学方程式:化合反应:1、木炭燃烧C+O2 =点燃= CO22、木炭不充分燃烧2C+O2 =点燃= 2CO(O2不足)3、硫粉燃烧S+O2 =点燃= SO24、铁丝在氧气中点燃3Fe+2O2 =点燃= Fe3O45、红磷燃烧4P+5O2 =点燃=2P2O56、氢气燃烧2H2+O2 =点燃= 2H2O7、二氧化碳和水反应CO2+H2O == H2CO38、一氧化碳燃烧2CO+O2 =点燃= 2CO29、木炭还原二氧化碳C+CO2 =高温= 2CO10、生石灰和水放热CaO+H2O== Ca(OH)2分解反应11、过氧化氢和二氧化锰制取氧气2H2O2 =MnO2= 2H2O+O2↑12、高锰酸钾制取氧气2KMnO4 =△= K2MnO4+MnO2+O2↑13、氯酸钾和二氧化锰制取氧气2KClO3 = MnO2= 2KCl+3O2↑14、水通电2H2O=通电= 2H2↑+O2↑15、碳酸分解H2CO3 == CO2↑+H2O其他反应类型16、制取二氧化碳CaCO3+2HCl== CaCl2+H2O+CO2↑17、检验二氧化碳CO2+Ca(OH)2==CaCO3↓+H2O18、木炭还原氧化铜C+2CuO=高温= 2Cu+ CO2↑19、木炭还原氧化铁3C+2Fe2O3 =高温= 4Fe+3CO2↑20、一氧化碳还原氧化铜CO+CuO=△= Cu+ CO221、甲烷燃烧CH4+2O2=点燃=CO2+2H2O22、酒精燃烧C2H5OH+3O2=点燃=2CO2+3H2O23、锌粒和稀硫酸制取氢气Zn+H2SO4=== ZnSO4+H2↑(实验室制取氢气的方法)24、一氧化碳还原氧化铁3CO+Fe2O3 =高温= 2Fe+3CO225、碳酸钠与稀盐酸反应Na2CO3+2HCl== 2NaCl+H2O+CO2↑26、氢氧化钠与硫酸铜溶液反应2NaOH+CuSO4 == Cu(OH)2↓+Na2SO427、铁与硫酸铜溶液反应Fe+ CuSO4== Cu + FeSO4。
初中化学方程式上册50个

11镁在空气中燃烧:2Mg+O 2 点燃2MgO 2铁在氧气中燃烧:3Fe+2O 2点燃Fe 3O 43铜在空气中加热:2Cu+O 2△2CuO 4铝在空气中燃烧:4Al+3O 2点燃2Al 2O 3 5氢气在空气中燃烧:2H 2+O 2点燃2H 2O 6红磷在空气中燃烧:4P+5O 2 点燃2P 2O 57硫粉在空气中燃烧:S+O 2点燃SO 28碳在空气中燃烧:C+O 2点燃CO 29碳在空气中不充分燃烧:2C+O 2点燃2CO(2)化合物与氧气的反应: 10一氧化碳在氧气中燃烧:2CO+O 2点燃2CO 211甲烷在空气中燃烧:CH 4+2O 2点燃CO 2+2H 2O12酒精在空气中燃烧:C 2H 5OH+3O 2点燃2CO 2+3H 2O2H 2O2 2H 2O+O 2↑ 14加热高锰酸钾:2KMnO 4△K 2MnO 4+MnO 2+O 2↑15氯酸钾分解制氧气2KClO 3 2KCl+3O 2↑16水分解:2H 2O 通电2H 2↑+O 2↑17碳酸不稳定分解:H 2CO 3==H 2O+CO 2↑ 18加热氧化汞:2HgO△2Hg+O 2↑19高温煅烧石灰石:CaCO 3高温CaO+CO 2↑20氢气还原氧化铜:H 2+CuO△Cu+H 2O21一氧化碳还原氧化铜:CO+CuO△Cu+CuO22一氧化碳还原氧化铁:3CO+Fe 2O 3高温2Fe+3CO 223木炭还原氧化铜:C+2CuO高温2Cu+CO 2↑ 24焦炭还原氧化铁:3C+2Fe 2O 3高温4Fe+3CO 2↑2442↑ 26铁和稀硫酸反应:Fe+H 2SO 4==FeSO 4+H 2↑ 27镁和稀硫酸反应:Mg+H 2SO 4==MgSO 4+H 2↑28铝和稀硫酸:2Al+3H 2SO 4==Al 2(SO 4)3+3H 2↑ 29锌和稀盐酸反应:Zn+2HCl==ZnCl 2+H 2↑ 30铁和稀盐酸反应:Fe+2HCl==FeCl 2+H 2↑ 31镁和稀盐酸反应:Mg+2HCl==MgCl 2+H 2↑ 32铝和稀盐酸反应:2Al+6HCl==2AlCl 3+3H 2↑ (2)金属单质+盐(溶液)==另一种金属+另一种盐 33铁和硫酸铜溶液反应:Fe+CuSO 4==FeSO 4+Cu 34锌和硫酸铜溶液反应:Zn+CuSO 4==ZnSO 4+Cu 35铜和硝酸汞溶液:Cu+2AgNO 3==Cu(NO 3)2+2Ag 36铝和硫酸铜溶液:2Al+3CuSO 4==Al 2(SO 4)3+3Cu (4)酸性氧化物+碱==盐+水37除去二氧化碳:2NaOH+CO 2==Na 2CO 3+H 2O38检验二氧化碳:C a (O H )2+CO 2==CaCO 3↓+H 2O (5)酸+盐==另一种酸+另一种盐39大理石与稀盐酸:CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑ Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ CO 2+H 2O==H 2CO 3 42生石灰溶于水:CaO+H 2O==Ca(OH)243无水硫酸铜作干燥剂:CuSO 4+5H 2O==CuSO 4·5H 2O44二氧化碳通过灼热的炭层CO 2+C 高温2CO MnO 2MnO 2△。
初三化学方程式全册总结(上册)

化合反应1、镁在空气中燃烧:2Mg + O2 点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O43、铝在空气中燃烧:4Al + 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 + O2点燃 2H2O5、红磷在空气中燃烧:4P + 5O2点燃 2P2O56、硫粉在空气中燃烧: S + O2 点燃 SO27、碳在氧气中充分燃烧:C + O2 点燃 CO28、碳在氧气中不充分燃烧:2C + O2 点燃 2CO9、二氧化碳通过灼热碳层: C + CO2 高温 2CO10、一氧化碳在氧气中燃烧:2CO + O2点燃2CO Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色 Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4·H2O 蓝色晶体变为白色粉末CuSO4·H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温 CaO + CO2↑置换反应20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO27、焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO429、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO232、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O 二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2 四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸F e + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸 -------- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === Ag Cl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl(7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+O2点燃或Δ2MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl+3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4ΔK2MnO4+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑冶炼金属Fe3O4+2C高温3Fe + 2CO2↑冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2ΔCaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO+ CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢4 初三化学方程式大合集---请求加精Na2CO3+H2SO4=Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温 2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温 3Fe+4CO2 冶炼金属原理WO3+3CO高温 W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色 Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH有白色沉淀生成C a(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4·H2O 蓝色晶体变为白色粉末CuSO4·H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体11。
初三上册化学方程式大全(10篇)

初三上册化学方程式大全(10篇)1.初三上册化学方程式大全篇一跟氢有关的化学方程式:2H2+O2点燃====2H2O现象:淡蓝色的火焰Zn+H2SO4==ZnSO4+H2↑现象:有可燃烧的气体生成Mg+H2SO4==MgSO4+H2↑现象:同上Fe+H2SO4==FeSO4+H2↑现象:变成浅绿色的溶液,同时放出气体2Al+3H2SO4==Al2(SO4)3+3H2↑现象:有气体生成Zn+2HCl==ZnCl2+H2↑现象:同上Mg+2HCl==MgCl2+H2↑现象:同上Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体2Al+6HCl==2AlCl3+3H2↑现象:有气体生成H2+CuO====Cu+H2O现象:由黑色的固体变成红色的,同时有水珠生成高温2Fe2O3+3H2=====2Fe+3H2O现象:有水珠生成,固体颜色由红色变成银白色跟碳有关的化学方程式:C+O2点燃====CO2(氧气充足的情况下)现象:生成能让纯净的石灰水变浑浊的气体2C+O2点燃====2CO(氧气不充足的情况下)现象:不明显高温C+2CuO=====2Cu+CO2↑现象:固体由黑色变成红色并减少,同时有能使纯净石灰水变浑浊的气体生成高温3C+2Fe2O3=====4Fe+3CO2↑现象:固体由红色逐渐变成银白色,同时黑色的固体减少,有能使纯净的石灰水变浑浊的'气体生成CO2+C高温====2CO现象:黑色固体逐渐减少3C+2H2O=CH4+2CO现象:生成的混和气体叫水煤气,都是可以燃烧的气体2.初三上册化学方程式大全篇二跟一氧化碳有关的,但同时也跟二氧化碳有关:Fe3O4+4CO====3Fe+4CO2现象:固体由黑色变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温FeO+CO===Fe+CO2现象:固体由黑色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温Fe2O3+3CO====2Fe+3CO2现象:固体由红色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温CuO+CO====Cu+CO2现象:固体由黑色变成红色,同时有能使纯净石灰水变浑浊的气体生成3.初三上册化学方程式大全篇三跟硫酸有关的化学方程式:2NaOH(或KOH)+H2SO4==Na2SO4+2H2O现象:不明显Fe2O3+3H2SO4==Fe2(SO4)3+3H2O现象:红色固体溶解,生成黄色溶液CuO+H2SO4==CuSO4+H2O现象:黑色固体溶解,生成蓝色溶液Cu(OH)2+H2SO4==CuSO4+2H2O现象:蓝色沉淀溶解,生成蓝色溶液H2SO4+BaCl2==BaSO4↓+2HCl现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子CaCO3+H2SO4==CaSO4+H2O+CO2↑Na2CO3+H2SO4==Na2SO4+H2O+CO2↑2NaHCO3+H2SO4==Na2SO4+2H2O+2CO2↑现象:这三个反应现象同与盐酸反应现象一致4.初三上册化学方程式大全篇四跟碱有关的化学方程式:NaOH+HCl(或HNO3、H2SO4)==NaCl+H2O现象:酸碱中和反应,现象不明显CaO+H2O==Ca(OH)2现象:放出大量的热NaOH(KOH)+FeCl3(Fe(NO3)3、Fe2(SO4)3)==Fe(OH)3↓+NaCl现象:生成红棕色絮状沉淀,括号里面的反应过程相似,产物相对应就行了2NaOH(KOH)+FeCl2(Fe(NO3)2、FeSO4)==Fe(OH)2↓+2NaCl现象:生成白色絮状沉淀,括号里面的反映过程相似,产物相对应就行了2NaOH(KOH)+CuCl2(Cu(NO3)2、CuSO4)==Cu(OH)2↓+2NaCl现象:生成蓝色絮状沉淀,括号里面的反应过程相似,产物相对应就行了NH4Cl(NH4NO3、(NH4)2SO4)+NaOH(KOH)==NH3↑+H2O+NaCl现象:有可以使石蕊试纸变蓝的气体生成MgCl2(Mg(NO3)2、MgSO4)+NaOH(KOH)==Mg(OH)2↓+NaCl现象:生成白色沉淀,括号里面的反应过程相似,产物相对应就行了NaHCO3+NaOH==Na2CO3+H2O现象:不明显此反应的Na换成K是一样的Ca(HCO3)2+2NaOH==CaCO3↓+Na2CO3+2H2O现象:生成白色沉淀,此反应把Na换成K是一样的2NaOH+CO2==Na2CO3+H2O现象:无明显现象此反应的Na换成K是一样的Ca(OH)2+CO2==CaCO3↓+H2O现象:产生白色沉淀,此反应用于检验二氧化碳NaHSO4+NaOH==Na2SO4+H2O现象:无明显现象2NaOH+SO2==Na2SO3+H2O现象:无明显现象5.初三上册化学方程式大全篇五跟钡盐有关的化学方程式:BaCl2+Na2SO4==BaSO4↓+2NaCl现象:有白色的不溶于强酸的沉淀生成跟钙盐有关的化学方程式:CaCl2+Na2CO3==CaCO3↓+2NaCl现象:生成白色沉淀CaCO3+CO2+H2O==Ca(HCO3)2现象:固体逐渐溶解Ca(HCO3)2+Ca(OH)2==2CaCO3↓+2H2O现象:生成白色沉淀跟几种金属及其盐有关的化学方程式:铜:CuSO45H2O△====CuSO4+5H2O↑现象:固体由蓝色变为白色高温CuO+CO====Cu+CO2现象:固体由黑色逐渐变成红色,同时有能使纯净的石灰水变浑浊的气体生成H2+CuO====Cu+H2O现象:固体由黑色逐渐变成红色,同时有水珠生成Cu+2AgNO3==Cu(NO3)2+2Ag现象:铜表面慢慢生成了银白色金属CuCl2+2NaOH==Cu(OH)2↓+2NaCl现象:生成了蓝色絮状沉淀CuO+H2SO4==CuSO4+H2O现象:黑色固体溶解,生成蓝色溶液6.初三上册化学方程式大全篇六跟盐酸有关的化学方程式:NaOH(也可为KOH)+HCl==NaCl+H22O现象:不明显HCl+AgNO3==AgCl↓+HNO3现象:有白色沉淀生成,这个反应用于检验氯离子CaCO3+2HCl==CaCl2+H2O+CO2↑现象:百色固体溶解,生成能使纯净石灰水变浑浊的气体Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体NaHCO3+HCl==NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体Fe2O3+6HCl==2FeCl3+3H2O现象:红色固体逐渐溶解,形成黄色的溶液Fe(OH)3+3HCl==FeCl3+3H2O现象:红棕色絮状沉淀溶解,形成了黄色的溶液Cu(OH)2+2HCl==CuCl2+2H2O现象:蓝色沉淀溶解,形成黄绿色的溶液CuO+2HCl==CuCl2+H2O现象:黑色固体溶解,生成黄绿色的溶液Zn+2HCl==ZnCl2+H2↑现象:同上Mg+2HCl==MgCl2+H2↑现象:同上Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体2Al+6HCl==2AlCl3+3H2↑现象:有气体生成7.初三上册化学方程式大全篇七跟二氧化碳有关的化学方程式:C+O2点燃====CO2现象:生成能使纯净的石灰水变浑浊的气体Ca(OH)2+CO2===CaCO3↓+H2O现象:生成白色的沉淀,用于检验二氧化碳CaCO3+CO2+H2O===Ca(HCO3)2现象:白色固体逐渐溶解Ca(HCO3)△====CaCO3↓+CO2↑+H2O现象:生成白色的沉淀,同时有能使纯净的石灰水变浑浊的气体生成Cu2(OH)2CO3△====2CuO+H2O+CO2↑现象:固体由绿色逐渐变成黑色,同时有能使纯净石灰水变浑浊的气体生成2NaOH+CO2===Na2CO3+H2O(也可为KOH)现象:不明显CaCO3高温====CaO+CO2↑现象:有能使纯净石灰水变浑浊的气体生成8.初三上册化学方程式大全篇八1、2Mg+O2点燃2MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2、2Hg+O2点燃2HgO银白液体、生成红色固体拉瓦锡实验3、2Cu+O2Δ2CuO红色金属变为黑色固体4、4Al+3O2点燃2Al2O3银白金属变为白色固体5、3Fe+2O2点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热4Fe+3O2高温2Fe2O36、C+O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊7、S+O2点燃SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰8、2H2+O2点燃2H2O淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料9、4P+5O2点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量10、CH4+2O2点燃2H2O+CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧11、2C2H2+5O2点燃2H2O+4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属12、2KClO3MnO22KCl+3O2↑生成使带火星的木条复燃的气体实验室制备氧气O213、2KMnO4ΔK2MnO4+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气14、2HgOΔ2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验15、2H2O通电2H2↑+O2↑水通电分解为氢气和氧气电解水16、Cu2(OH)2CO3Δ2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热17、NH4HCO3ΔNH3↑+H2O+CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失18、Zn+H2SO4=ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气19、Fe+H2SO4=FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解20、Mg+H2SO4=MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解9.初三上册化学方程式大全篇九1、氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22、还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43、与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl10.初三上册化学方程式大全篇十1.需水浴加热的反应列表有:(1)银镜反应;(2)乙酸乙酯的水解;(3)苯的硝化;(4)糖的水解;(5)酚醛树脂的制取;(6)固体溶解度的测定;凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中上册化学方程式汇总
一、氧气的性质:
(1)单质与氧气的反应:(化合反应)
1. 镁在空气中燃烧:2Mg + O2点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4
3. 氢气中空气中燃烧:2H2 + O2点燃 2H2O
4. 红磷在空气中燃烧:4P + 5O2点燃 2P2O5
5. 硫粉在空气中燃烧: S + O2点燃 SO2
6. 碳在氧气中充分燃烧: C + O2点燃 CO2
7. 碳在氧气中不充分燃烧:2C + O2点燃 2CO (2)化合物与氧气的反应:
8.一氧化碳在氧气中燃烧:2CO + O2点燃 2CO2
9.甲烷燃烧:CH4 + 2O2点燃 CO2 + 2H2O
10.酒精燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O (3)氧气的来源:(分解反应)
11.玻义耳研究空气的成 2HgO 加热2Hg+ O2 ↑12.加热高锰酸钾2KMnO4加热K2MnO4+MnO2+O2↑
加热氯酸钾和二氧化锰2KClO3MnO22KCl+3O2↑13.过氧化氢分解反应: 2H2O2MnO22H2O+ O2 ↑二、自然界中的水:
14.电解水:2H2O 通电 2H2↑+ O2 ↑
15.生石灰溶于水:CaO + H2O === Ca(OH) 2 16.二氧化碳能溶于水: H2O + CO2=== H2CO3 三、质量守恒定律:
17.镁在空气中燃烧:2Mg + O2点燃 2MgO 18.铁和硫酸铜溶液反应:
Fe + CuSO4 ===FeSO4 + Cu
19.氢气还原氧化铜:H2+CuO 加热Cu+H2O
20.碳酸钠与稀盐酸反应: (灭火器的原理)
Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑四、碳和碳的氧化物:
(1)碳的化学性质
21.木炭还原氧化铜:C+2CuO 高温2Cu+CO2↑22.炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑23.煤炉的中层:CO2 + C高温2CO
(2)二氧化碳的制法与性质:
24.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+2HCl===CaCl2+H2O+CO2↑
25.二氧化碳可溶于水: H2O + CO2=== H2CO3 26.碳酸不稳定而分解:H2CO3===H2O+CO2↑27.高温煅烧石灰石:CaCO3高温CaO + CO2↑28.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 ==== CaCO3↓+ H2O
(3)一氧化碳的性质:
29.一氧化碳还原氧化铜:CO+CuO加热Cu + CO2五、燃料及其利用:
37.生石灰与水反应放热:CaO+H2O =Ca(OH)2 38.甲烷在空气中燃烧:CH4+2O2点燃CO2 + 2H2O 39.酒精在空气中燃烧:
C2H5OH + 3O2点燃 2CO2 + 3H2O
40.氢气中空气中燃烧:2H2 + O2点燃 2H2O
41.氢气的制法: Zn+H2SO4===ZnSO4+H2↑
1。
