有色冶金原理镁(二)
镁的性质、冶炼及应用

镁的性质、冶炼及应用一.镁的发现(1)1808年英国化学家戴维(H.Davy)电解汞和氧化镁的混合物制得镁汞齐,第一次获得金属镁。
(2)1828年法国科学家比西(A.A.B.Bussy) 用钾还原熔融氯化镁得金属镁。
(3)1833年,英国科学家法拉第(M Faraday)又用电解熔融氯化镁的方法制得金属镁,但在当时镁仍然是实验室的珍品。
(4)1886年才在德国开始用后一种方法进行镁的工业生产。
(5)中国于20世纪50年代用熔盐电解法开始以工业规模生产镁。
二.镁的性质A.物理性质镁是银白色的金属,密度1.738克/厘米3,熔点648.9℃。
沸点1090℃。
化合价+2,电离能7.646电子伏特,是轻金属之一,具有延展性,金属镁无磁性,且有良好的热消散性。
B.化学性质镁具有比较强的还原性,能与热水反应,放出氢气,燃烧时能产生眩目的白光,镁与氟化物、氢氟酸和铬酸不发生作用,也不受苛性碱侵蚀,但极易溶解于有机和无机酸中,镁能直接与氮、硫和卤素等化合,包括烃、醛、醇、酚、胺、脂和大多数油类在内的有机化学药品与镁仅仅轻微地或者根本不起作用。
镁能在能和二氧化碳发生燃烧反应,因此镁燃烧不能用二氧化碳灭火器灭火。
三.镁资源镁是10种常用有色金属之一,其蕴藏量丰富,在地壳中的含量达到2.1%-2.7%,在所有元素中排第六位,是仅次于铝、铁、钙居第四位的金属元素。
主要来自海水、天然盐湖水、白云岩、菱镁矿、水镁石和橄榄石等。
据估计,全世界的菱镁矿资源量约为120亿吨,水镁石几百万吨,海水中的镁含量估计为6×10(16次方)吨,另外还有大量的白云石和盐湖镁资源。
我国是世界上镁资源最为丰富的国家之一,镁资源矿石类型全,分布广,总储量占世界的22.5%,居世界第一:菱镁矿储量居世界首位,已探明菱镁矿储量34亿吨,占世界菱镁矿总储量的28.3%;原镁产量居于世界第一位,占世界总产量的70%多。
我国含镁白云石矿丰富,白云石资源遍及我国各省区,特别是山西、宁夏、河南、吉林、青海、贵州等省区,现已探明储量40亿吨以上;我国4大盐湖区镁盐矿产资源的远景储量达数十亿吨其中,柴达木盆地内大小不等的33个卤水湖、半干涸盐湖和干涸盐湖,蕴藏着储量占全国第一位的镁盐资源;我国海域水中的镁合金达到0.13%。
镁的冶炼及应用

书山有路勤为径,学海无涯苦作舟镁的冶炼及应用一、镁的冶炼A.融盐电解法炼镁 1.工艺方法可分为以菱镁矿为原料的无水氯化镁电解法和以海水为原料制取无水氯化镁的电解法。
其中后者最大的难点是如何去MgCl2-6H2O 中的结晶水。
电解法生产镁的工艺很多,但基本原理相同,其中最有代表性的有DOW 工艺、I.G.Farben 工艺、Magnola 工艺等。
2.生产过程镁电解采用多组分氯盐作电解质。
向氯化镁电解质中加入其他组分的目的是要降低熔点和粘度,提高熔体的电导率以及降低MgCl2 的挥发度和水解作用等。
阴极产生的液态镁因比电解质的密度小而上浮于表面;阳极产生的氯气则通过氯气罩排出。
B.皮江法炼镁 1.工艺原理皮江法生产金属镁是以煅烧白云石为原料、硅铁为还原剂、萤石为催化剂,进行计量配料。
粉磨后压制成球,称为球团。
将球团装入还原罐中,加热到1200℃,内部抽真空至13.3Pa 或更高,则产生镁蒸气。
镁蒸气在还原罐前端的冷凝器中形成结晶镁,亦称粗镁。
再经熔剂精炼,产出商品镁锭,即精镁。
2.生产工序(1)白云石煅烧:将白云石在回转窑或竖窑中加热至1100~1200℃,烧成煅白(MgOCaO)。
(2)配料制球:将煅白、硅铁粉和萤石粉计量配料、粉磨,然后压制成球。
(3)还原:将料球在还原罐中加热至1200+10℃,在13.3Pa 或更高真空条件下,保持8~10 小时,氧化镁还原成镁蒸气,冷凝后成为粗镁。
(4)精炼铸锭:将粗镁加热熔化,在约710℃高温下,用溶剂精炼后,铸成镁锭,亦称精镁。
(5)酸洗:将镁锭用硫酸或硝酸清洗表面,除去表面夹杂,使表面美观。
(6)造气车间:将原煤转换成煤气,作为燃料使用。
直接使用原煤的镁厂没有造气车间。
二、镁的应用A.铝合金生产由于镁的密度小,比强度高,并能与铝、铜、锌等金属构成高强度合金,因此,镁是重要的合金元素。
世界上镁的最大消费领域是作铝合金添加元素。
2002 年世界主要地。
有色冶金原理
有色冶金的酸碱性,习惯上用硅酸度表示,有时也用碱度表示。
认识三元系图
简单三元系图 如左下图所示,A,B,C 代表三种不同组元, 分别代表三种不同组元的初晶 区,边上的点(1、2、3)为 克 二元结晶点
化合物稳定性的判断:组成点在其对应的初晶区内则为稳定化合物。
CS-C2S-C2AS三元系图分析
(1)生产能力低,反应速度慢; (2)对设备的腐蚀性大; (3)流程长,液固分离困难.
火法冶金与湿法冶金的优缺点比较
第一章:冶金炉渣
炉渣,熔化后称为熔渣,是各种氧化物的熔体。在冶炼过程的技术经济指标在很大程度上与炉渣有关。
冶金炉渣的作用
①使脉石集中与金属或锍分离。 ②作为一种介质,其中进生着许多极为重要的冶金反应。 ③金属液滴或锍液滴的沉降分离(对机械夹杂损失起着决定性的作用) ④决定最高的冶炼温度(大致为炉渣熔化后温度加上一定过热的温度(150~250℃)) ⑤对杂质的脱除和浓度加以控制。 ⑥作为一种中间产物,杂质中含金属量高。 ⑦可调节电极插入渣中的深度调节电炉的功率。(起热传递作用)
三元系图的点线面
三元系图的点线面判断
二次结晶线与三元不变点与基元三角形的判断
二次结晶线的判断:任一结晶线相邻的两给元和点的连线与该结晶线上任一点作出的切线相交则此结晶线为共晶线,反之则为包晶线。--切线相交原则。(也可与三元不变点联系:共晶点上相连的结晶线全为共晶线,包晶点相连的结晶线至少有一条是包晶线)
冶炼对炉渣的要求
①熔点低(能耗)②密度低(与主体金属分层)③适当组成(如酸碱度)④腐蚀性小(保护炉衬)
炉渣的组成,对于大多数炉渣和钢渣,这三种氧化物是FeO、CaO、SiO2,对高炉和某些有色冶金炉渣则为CaO、Al2O3、SiO2。 组成炉渣的各种氧化物可分为三类: (1)碱性氧化物:CaO、MnO、Feo、MgO等,这类氧化物能供给氧离子O2-,如:CaO=Ca2++O2- (2)酸性氧化物: SiO2 、P2O5等,这类氧化物能吸收氧离子而形成络合阴离子,如:SiO2+2O2-=SiO44- (3)两性氧化物:Al2O3、ZnO等,这类氧化物在酸性氧化物过剩时可供给氧离子面呈碱性,而碱性氧化物过剩时则对会吸收氧离子面呈酸性,如:Al2O3=2Al3++3O2- Al2O3+O2-=2AlO2-
金属镁生产工艺原理介绍

金属镁生产工艺原理介绍1.电解法炼镁的各种工艺原理氯化熔盐电解法包括氯化镁的生产及电解制镁两大过程。
该方法又可分为以菱镁矿为原料的无水氯化镁电解法和以海水为原料制取无水氯化镁的电解法。
其中后者最大的难点是如何去除MgCl2·6H2O中的结晶水。
一般来说:采用普通的加热法可以去除部分结晶水,生成MgCl2·3/2H2O。
但MgCl2·3/2H2O在空气中加热时很容易发生水解反应,生成不利于电解过程的杂质,如Mg(OH)2。
电解法生产镁的工艺很多,但基本原理相同,其中最有代表性的有DOW工艺、I.G.Farben 工艺、Magnola工艺等。
DOW工艺1916年DOW工艺在美国Michighn的Midland首次得到应用。
当时所用的制备MgCl2的方法是将海水与煅烧白云石一起制成泥浆,与盐酸反应,生成氯化镁溶液,将其浓缩并干燥处理后生成MgCl2·3/2H20。
这种原料直接加入电解槽内进行反应,副产物氯气可以回收利用。
1941年道屋(DOW)化学公司在塔克赛斯自由港建立了一个工厂,从海水中提取镁的电解原料。
海水由引水槽引入,滤过淤泥后导人沉淀池,与石灰混合,过滤后与20 %HCl反应生成MgCl2,蒸发后得到固体氯化镁,然后经干燥炉干燥得到低水合氯化镁(MgCl2·3/2H2O),成为DOW工艺电解制镁的原料。
许多生产厂家都采用与DOW工艺类似的方法电解海水来生产镁(见图1),主要差别在于提取无水氯化镁的方法不同。
DOW化学公司通过在含大量MgCl2、NaCl 和CaCl2混合溶液的电解池中直接加入少量部分脱水氯化物来迅速脱水。
挪威诺斯克—希德罗(Norsk—Hydro)公司是欧洲最主要的镁生产商,通过在于燥的氯化氢气氛中加热MgCl2·6H2O来实现完全脱水。
前独联体则主要采用往电解池中加入无水光卤石来脱水。
最近,澳大利亚金属镁公司开发了一种制备无水氯化镁原料的全新工艺,在氯化镁溶液中加入一种称为Gylcol的物质,蒸馏脱水,然后喷雾氨生成六氨合氯化镁,接着焙烧制备高质量的无水氯化镁。
有色冶金PPT课件

Although magnesium doesn't occur in the nature in the metallic form because of its reactivity, magnesium compounds occur all over the world, and there are commercial amounts of magnesium ores in most countries, such as magnesium oxide, magnesium hydroxide, sulphates, carbonates, silicates and others.
.
4
2.1.2 Natures and Applications
.
5
Natures and Applications.性质与应用 优点: 质量轻,加工性能好 缺点:化学性质活泼难于熔炼 应用:合金元素,钢 铸铁,航天压铸,运输工业,质量 轻的物体 镁板
.
6
镁的主要物理性质:银白色、密排六方(h.c.p)结构;密度 (99.9%): 20℃ 1.738g/cm3;(镁2.70g/cm3)
(1)DOW Process(美国)道乌法——海水 (2)Amax Process(美国)阿玛克斯法——盐湖水 (3)Norsk Hydro Process(挪威)诺斯克法—氯
化镁 (4)氧化镁氯化法(中国)——氧化镁
.
18
.
19
氧化镁氯化法
氧化镁既可用于制取电解炼镁所需的无水氯化 镁,又可用于热还原法直接生产金属镁。作为 炼镁用的氧化镁,要求具有较高的纯度及良好 的化学活性;而对于热还原的氧化镁,还要求 能充分排出其所含的H2O和CO2。 目前,生产氧化镁的主要方法是菱镁矿煅烧法 和氢氧化镁法。
镁冶金学

电解质中杂质的影响;
电流密度:生产率要求保持一定的电流密度,电流 密度过高,增强了电解质循环,也会增加镁的损失。 电解温度:研究和生产实践表明,电流效率与温度 呈直线关系,温度每升高283K,电流效率大致降低 0.8%。电流效率随温度升高而降低,是由于镁被氯 气氯化的速度加快所致。
3、电解槽
1.熔点
第二章
镁冶金
电解质诸组成份的熔点如下:
MgCl2 KCl NaCl CaCl2 BaCl2 LiCl
718℃
768℃ 800℃
740℃
962℃
606℃
以光卤石为原料的电解质熔点大约为600~650℃, 以氧化镁为原料的电解质熔点大约为570~640℃。
第二章 2.密度
镁冶金
工业镁电解的一个重要特点是:液体金属镁漂浮在融 熔电解质之上。由于氯气也向上逸出,容易发生逆反
路上。 生产实践中,往往是当阴极埋入电解质中仅300~ 500mm深度时,就将电极接到直流电路上。很快加热 到993~1013K,此后在4~5h内将电解槽中的电解质 水平调整到正常水平。
2 电解工艺操作 电解工艺操作包括加料、出镁、出渣、排废电解 质、更换阳极和阴极及洗刷阴极工作面等。 1) 加料
另一种是借导镁槽使镁进入集镁室 的阿尔肯型无隔板电解槽,如图2-9所示。
第二章
镁冶金
第二章 镁冶金 3)双极性电极的镁电解槽 夏马(Sharma)提出一种多室镁电解槽,见 图2-10。
第二章 五、镁电解工艺
镁冶金
1.电解槽启动
按照加热制度,新砌筑的电解槽经烘烤、电解质加
入、阴极接通交流电源继续加热,然后接到直流电
第二章
镁冶金
二、镁电解质的组成与性质 镁电解质的组成视原料来源而异。 若是采用光卤石(KCl· MgCl2· 6H2O)作原料,则电解 质的组成通常是: MgCl2 5~15%,KCl 70~85%,NaCl 5~15%。电解 温度为680~720℃。 如用氧化镁作原料时,则电解质的组成通常是: MgCl2 12~15%,NaCl 40~45%, CaCl2 38~42%, KCl5~7%,NaCl:KCl=6~7。电解温度为690~720℃。
(轻金属冶金学1-2)镁冶金学第二讲----热还原法的原理与过程

第二讲
硅热法炼镁之
硅热法炼镁的基本原理
冶金科学与工程学院
周向阳
前言
▲我国金属镁产量增大迅速。
1990年只有0.59万吨;
1999年镁产量达到12万吨,超过美国跃居第一;
●添加剂的种类及其用量的影响 通常添加MgF2和CaF2等物质/在实际生产中通常以萤 石粉(或CaF2)作为添加剂,尽管MgF2的添加量较小,但 其经济性较CaF2差。
炉料中添加CaF2可以加速反应速度, 但其添加量有一定的范围,如下图所 示。 ※添加1%CaF2效果不显著,炉料中 添加3%CaF2对还原反应有利,添加 量过多,对镁的产出率影响不大; ※炉料中CaF2的添加量超过4%,还 原后的炉渣发软性、不易扒渣,而且 渣在扒渣时易吸附在还原罐罐壁上。
●制球压力
球团的真空热还原,在温度、还原时间、配 料比一定的条件下,随着制球压力的增大,镁的 产出率和硅的利用率增大。但是,不同矿物结构 的煅白,它有一个最佳的压力值,压型压力超过 此值后,还原温度、还原时间、配硅比增大都对 镁的产出率,硅的利用率影响不大,压型压力超 过此值后,镁的产出率和硅的利用率反而降低。
在工业生产中配硅比应取多少为好,可以根 据白云石结构、还原温度、还原时间、制球 压力的条件确定,但更需要从经济角度来考 虑,也就是说,应该考虑当时市场上硅铁与 镁的比价,当硅铁价格较高时,选择M≈1, 当镁的价格上涨时,则取≈1.25。
到底如何确定最佳的配硅比?
●还原剂的种类及硅铁中合硅量(品位)的影响 硅热法炼镁时,还原剂可以是Si、Si—Fe,也可以用 Al—Si合金或Al—Si—Fe合金,其组成如下表所示。
镁

C→D: Al(OH) 3 3H Al3 3H 2 O
M g(OH) 2 2H M g2 2H 2 O
现象:开始就存在沉淀且不变,中间沉淀增加,最后沉淀完全溶解。
图象特点:OB 的长短由 OH 来决定,BC 的长短由 AlO 来决定。 2 二、典型例题解析 例 1.相同质量的镁条分别在氧气、氮气、空气中充分燃烧,所得固体的质量由大到小 的顺序是 ;过量的镁条分别在相同状况下,相同体积的氧气、 氮气、空气中充分燃烧,生成的固体产物的质量由大到小的顺序 是 。 思路分析:本题假设空气是氧气和氮气的混合物,考查学生对MgO、Mg3N2的熟悉程度,用质量差量法可以来解 决问题。O2>空气>N2 ;N2>空气>O2
+
1
龙文教育·教务管理部
中小学 1 对 1 课外辅导专家
d.镁的制取:最基本的方法是往海水里加碱,得到氢氧化镁沉淀,将沉淀分离出来后再加入盐酸把它变成氯化镁; 之后经过滤、干燥、电解,就可得到镁,这种方法称为海水提镁法。 反应原理是:Mg2++2OH-==Mg(OH)2↓,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2 Mg+Cl2↑
3. 工业上用制盐剩下的苦卤(主要成分是 MgCl2)来制取硝酸镁,下列方案中合理可行的是( A.向苦卤中加入 AgNO3,滤出沉淀,将溶液蒸干 B.将苦卤蒸发浓缩,再加入 AgNO3,把得到的溶液蒸发结晶 C.给苦卤中加入熟石灰,分离出沉淀,用稀硝酸将沉淀溶解,再将溶液浓缩结晶 D.将苦卤浓缩结晶,再进行电解,得到金属镁,用镁和 HNO3 反应
M g2 2OH M g(OH) 2
A→E: Al(OH) 3 OH AlO 2H 2 O 2 现象:开始没有沉淀,中间产生沉淀,最后沉淀部分溶解。
镁冶金 概述+氯化镁制取-

1.2镁的性质和用途
镁的化学性质
纯镁呈银白色。由于它与氧有很大的亲和力,故其表面易被空
气氧化。在其熔点以上,镁容易在空气中燃烧,发出眩目的白 光,故镁粉或镁条广泛应用于闪光灯、信号弹、焰火等方面。 镁也用作镍和铜冶炼中的脱氧剂,以及用作金属热还原剂,用 来制取像钛、铬、钒、铍之类的高熔点金属。
镁与冷水发生缓慢反应,但与热水和酸类发生强烈的反应,生
镁具有比较强的还原性,能与沸水反应放出氢气,燃烧时能产生 眩目的白光,镁与氟化物、氢氟酸和铬酸不发生作用,也不受苛性 碱侵蚀,但极易溶解于有机和无机酸中,镁能直接与氮、硫和卤素
等化合,包括烃、醛、醇、酚、胺、脂和大多数油类在内的有机化
学药品与镁仅仅轻微地或者根本不起作用。但和卤代烃在无水的条 件下反应却较为剧烈(生成格氏试剂)镁能和二氧化碳发生燃烧反 应,因此镁燃烧不能用二氧化碳灭火器灭火。镁由于能和N₂和O2反 应,所以镁在空气中燃烧时,剧烈燃烧发出耀眼白光,放热,生成
第六章
镁冶金
2 .1 概 述
2.1.1 炼镁的历史和现状 镁是一种轻金属,化学符号为 Mg ,在元素周期表中属ⅡIA 族。原子序数为 12 ,相对原子质量 24 . 305,化合价为 +2 。 金属镁从发现到现在经历了 196年的历史。其发展大致包括 以下几个重要发展阶段。 1808年,英国戴维 (H . Davy) 电解汞和氧化镁的混合物,
璃瓶、塑料瓶或金属桶(罐)外普通木箱。[2]
运输注意事项:运输时运输车辆应配备相应品种和数量的消防
器材及泄漏应急处理设备。装运该品的车辆排气管须有阻火装
置。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。 严禁与氧化剂、酸类、卤素、氯代烃、食用化学品、等混装混 运。运输途中应防曝晒、雨淋,防高温。中途停留时应远离火 种、热源。运输用车、船必须干燥,并有良好的防雨设施。车
硅热法冶炼金属镁

镁的化学性质镁的化学性质很活泼。
固体镁在常温、干燥空气中,一般是比较稳定的,不易燃烧,但在熔融状态时,容易燃烧,并生成氧化镁(MgO)。
在 300 ℃时,镁与空气中的 N2作用生成氮化镁(Mg3N2),使镁表面成为棕黄色,并且温度达600℃时,反应迅速。
3Mg+2N2=Mg3N2镁在沸水中可与H2O作用,使水分解放出氢(H2)。
镁能溶解在无机酸(HCl、H2SO4、HNO3、H3PO4)中,但能耐氟氢酸和铬酸的腐蚀。
盐卤、硫化物、氮化物、碳酸氢钠(NaHCO3)溶液对镁有侵蚀作用。
镁在NaOH 和Na2CO3溶液中是稳定的,但有机酸能破坏镁。
镁能将许多氧化物(TiO2、UO2、Li2O 等)和氯化物(TiC l4、ZrC l4)等还原。
镁与铁不形成合金,但铁在镁中的溶解度随温度增高而增大,镁的物理化学性质镁的物理性质镁是元素周期系第二族化学元素,其晶格是密集的六方晶系。
镁的自由原子的电子排列为1s22s22p63s2,所以镁通常为两价(Mg2+)。
金属镁是一种很轻的金属,它的质量比铝还轻1/3,它还是电与热的良好导体等,其物理化学性质数值为[3]:原子序数:12原子量:24.305原子体积:13.99cm3/mol原子半径:0.15nm 离子半径(Mg2+):0.074nm密度:20℃(Mg99.9%) 1.74g/cm3熔点(651℃)1.57g/cm3液体状态1.54g/cm3熔点温度:651℃沸点温度:1107℃(p=0.1MPa)熔融潜热:(99.93% Mg)8786.4±418.4J/mol 蒸发潜热:(1107℃)127.6±6.3kJ/mol升华热:(651℃)142.3(20℃)22.9×10-4Ω〃cm-3标准电位:-2.38V ±6.3kJ/mol导热率:电化当量:0.453g/A〃h结晶收缩率:3.97% ~4.2%收缩率:(651~20℃)2%镁的蒸气压相当高,627℃时为215.95Pa,727℃时为1037.1Pa,因此镁极易挥发。
有色冶金:镁冶金技术共25页文档

35、不要以为自己成功一次就可以了 ,也不 要以为 过去的 光荣可 以被永 远肯定 。
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
55、 为 中 华 之 崛起而 读书。 ——周 恩来
有色冶金:镁冶金技术
31、别人笑我太疯癫,我笑他人看不 穿。(名 言网) 32、我不想听失意者的哭泣,抱怨者 的牢骚 ,这是 羊群中 的瘟疫 ,我不 能被它 传染。 我要尽 量避免 绝望, 辛勤耕 耘,忍 受苦楚 。我一 试再试 ,争取 每天的 成功, 避免以 失败收 常在别 人停滞 不前时 ,我继 续拼搏 。
材料学-第九讲 有色金属(二)

近二十年来,世界汽车产量持续增长,年 均增长率为2.5%。汽车工业发展程度是一个 国家发达程度的重要标志之一,而金属材料 是汽车工业发展的重要基础。出于节能与环 保的要求,汽车设计专家们想方设法减轻汽 车体重,以达到减少汽油消耗和废气排放量 的双重效果。镁合金作为最轻的结构材料, 能满足日益严格的节能的尾气排放的要求; 可生产出重量轻、耗油少、环保型的新型汽 车。 镁合金压铸件在汽车上的应用已经显示 出长期的增长态势。在过去十年里,其年增 长速度超过15%。在欧洲,已经有300种不同 的镁制部件用于组装汽车,每辆欧洲生产的 汽车上平均使用2.5kg镁。乐观的估计认为, 出于减重的需求,每辆汽车对镁的需求将提 高至70—120kg。 目前,汽车仪表、座位架、方向操纵系 统部件、引擎盖、变速箱、进气歧管、轮毂、 发动机和安全部件上都有镁合金压铸产品的 应用。
• 压铸镁合金的研究 镁合金的密度小于2g/cm3,是目前最轻的金属结构材 料,其比强度高于铝合金和钢,略低于比强度最高的纤维 增强塑料;其比刚度与铝合金和钢相当,远高于纤维增强 塑料;其耐腐蚀性比低碳钢好得多,已超过压铸铝合金A 380;其减振性、磁屏蔽性远优于铝合金;鉴于镁合金的 动力学粘度低,相同流体状态(雷诺指数相等)下的充型速 度远大于铝合金,加之镁合金熔点、比热容和相变潜热均 比铝合金低,故其熔化耗能少,凝固速度快,镁合金实际 压铸周期可比铝合金短50%。此外,镁合金与铁的亲和力 小,固溶铁的能力低,因而不容易粘连模具表面,其所用 模具寿命比铝合金高2~3倍。
金属镁的冶炼工艺简介

金属镁的冶炼工艺简介镁是一种轻金属,是十分常见的有色金属之一,也是一种轻质的金属结构材料。
近些年来,随着科学的技术进步,对新型材料的需求越来越高精尖,促进了镁的各种应用,用途和应用领域在不断扩大。
镁的冶炼方法是镁工业发展的前提和基础,现有金属镁的冶炼方法普遍存在能耗大、污染严重、流程长、成本高等问题。
开发金属镁冶炼新技术研究具有十分重要的意义。
一、金属镁简介1.1、镁的性质镁是地球上储量最丰富的轻金属元素之一,镁的比重是1.74g/cm3,只有铝的2/3、钛的2/5、钢的1/4;镁是地球上储量最丰富的轻金属元素之一,镁蕴藏量丰富,在宇宙中含量第八,在地壳中含量丰度2%,海水中含量第三。
1.2、镁的储量分布镁在自然界分布广泛,主要以固体矿和液体矿的形式存在。
固体矿主要有菱镁矿、白云石等;液体矿主要来自海水、天然盐湖水、地下卤水等。
根据美国地质调查局(USGS)2015年公布的数据显示,全球已探明的菱镁矿资源量达120亿吨,储量24亿吨。
蕴藏丰富的国家包括:俄罗斯(6.5亿吨,占总量27%);中国(5亿吨,占总量21%);韩国(4.5亿吨),具体数据见表一。
表一全球菱镁矿储量(千吨)1.3、我国镁资源储量分布情况中国是世界上镁资源最为丰富的国家之一,镁资源矿石类型全,分布广。
中国是世界上菱镁矿资源是继俄罗斯之后最为丰富的国家,特点是地区分布不广、储量相对集中,大型矿床多。
世界菱镁矿储量的21%集中在中国,产量的67%由中国提供(具体分布见表二)。
表二中国镁资源储量分布情况二、镁的应用2.1、镁的应用镁的应用主要集中在镁合金生产,炼钢脱硫,还用在稀土合金、金属还原、腐蚀保护及其他领域。
(1)金属脱硫,使用镁粉的脱硫效果比碳化钙好;(2)腐蚀保护,使用镁牺牲阳极进行阴极保护,是一种有效的防止金属腐蚀的方法,广泛用于石油管道、天然气、煤气管道和储罐、冶炼厂、加油站的腐蚀防护以及热水器、换热器、蒸发器、锅炉等设备。
镁冶金生产技术书籍

镁冶金生产技术书籍镁是一种特殊的金属,具有低密度、高强度、良好的导热性和化学稳定性等特点,因此在许多领域有着广泛的应用。
而镁冶金技术作为镁金属生产的核心技术,对于提高镁金属产能和质量至关重要。
本文将从镁冶金的基本概念、原料选取、生产工艺流程以及质量控制等方面,介绍一本关于镁冶金生产技术的书籍。
第一章:镁冶金基本概念镁冶金是指利用不同的炼冶方法将镁矿石转化为镁金属的过程。
该章节从镁的物理性质、化学性质以及镁冶金的发展历史等方面进行了详细的介绍,为读者打下了良好的基础。
第二章:镁冶金原料选取镁冶金原料的选取对于镁金属的成品质量和生产成本有着重要的影响。
本章主要介绍了镁矿石的种类、产地以及对于生产的影响。
另外,还介绍了镁金属的辅助材料的选取,如炉渣调节剂、还原剂等。
第三章:镁冶金生产工艺流程镁冶金的生产工艺流程是指通过一系列的物理和化学变化将镁矿石转化为镁金属的过程。
本章详细介绍了镁冶金的各个环节,包括矿石破碎、矿石浸出、镁的提取和精炼等。
每个环节的工艺流程、设备选取以及操作要点都有详细的描述,读者可以通过本章节了解到镁冶金的整个生产过程。
第四章:镁冶金质量控制镁金属的质量对于使用者而言至关重要。
本章主要介绍了镁冶金生产中的质量控制方法和指标。
从原料的质量检测到成品的质量标准,都有详细的解释和说明。
此外,还对镁金属的质量缺陷和常见问题进行了分析,并提供了改进措施。
第五章:镁冶金生产中的环保与安全在现代工业社会,环保与安全问题备受关注,而镁冶金生产也不例外。
本章主要介绍了镁冶金生产中的环境污染问题以及安全隐患,并提供了相应的解决方案和应对措施。
第六章:镁冶金技术发展趋势本章主要从镁冶金技术的发展历程以及国内外的研究现状等方面,展望了镁冶金技术的未来发展趋势。
针对当前的技术难题和瓶颈,提出了一些可能的解决方案,并对相关领域的研究方向进行了展望。
结语通过介绍这本关于镁冶金生产技术的书籍,希望读者能够对镁冶金技术有一个全面的了解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4
2.3.1 硅热法炼镁的基本原理
5
B、艾汉林图上标准生成自由能是指在标准状态下,即参与反应 的气态物质分压为0.1MPa,而固态或液态物质的活度均为1 时的生成自由能。
17
硅铁中含硅量不同,其还 原能力不同。在其它条件 相同的情况下,随着硅铁 中含硅量增加,还原所得 镁的产出率提高
但当含硅量超过75%以后, 镁产出率以及镁的平衡蒸 气压增加的幅度很小
考虑到含硅量越高的硅铁 其价格越贵,因此选用 75%的硅铁作还原剂比较 合理
18
影响还原过程的因素:
煅烧白云石质量:活性、分解率、杂质含量 还原剂还原能力 炉料配比:Si量高,镁实收率提高,Si利用率降低 添加剂 炉料粒度及制团:粒度太小,降低活性,太大,降低接触面积;制
C、如果参与反应的物质不是处于标准状态,则反应的自由能变
化值G应为:G= G0 + RTlnp 式中,RTlnp — 反应自
由能变化值的修正值。
在aMe + O2 = bMeO(O2为0.1MPa)形式的反应中,自
由能变化值的修正值为RTlnpb(MeO)/pa(Me) ·p(O2), 其中 pO2=0.1MPa
16
讨论:为什么使用75%的硅铁作还原剂? 85%、75%、45%和25%四种硅铁, 其中,83% 的硅铁在合金组织中几乎全部
是以游离硅存在;75%硅的硅铁是由游离 硅和FeSi2存在;45%硅的硅铁是由FeSi2 和FeSi 组成;25%的硅铁完全是由 FeSi 和 Fe3Si2组成。 之所以采用75%硅铁合金作为还原剂,是综 合考虑了技术与经济两方面因素。
团压力要适中 还原温度、真空度
19
(2) Magnetherm Process(法国) 半连续 特点:用铝土矿和白云石作原料,硅 铁为还原剂,在真空电炉进行还原反 应,反应温度1600~1700 ℃,真空 度0.226~13.332kPa; 所有炉料呈 液态,产品为液态镁,炉渣也为液态。
20
21
16 三层液电解法制取精铝的原理?三层液中各 层的特征?精炼用电解质的类型及组成?
27
思考题
1 硅热还原法的应用有几种? 2 根据CaO·MgO被Si还原的热化学原理,还原过
程为什么要在真空下进行? 3 皮江法的生产流程及主要工艺参数? 4 为什么使用75%硅铁作热法炼镁的还原剂? 5 菱镁矿与白云石哪个做炼镁原料更好?为什么? 6 比较镁电解与铝电解的异同点? 7 炼镁原料有哪些? 8 由氧化镁制取氯化镁的过程中,为什么要加碳?
25
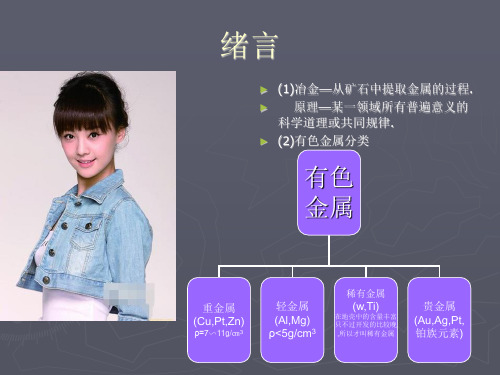
绪论及第一章思考题: 1 详细列举有色金属的分类。 2 现代铝工业的主要生产环节和辅助环节?
画出现代铝工业生产流程简图。 3 制取氧化铝的主要矿物有哪些?铝土矿的
主要类型以及中国铝土矿的特点? 4 画出从铝土矿提取铝的简要生产流程图. 5 从铝土矿中提取氧化铝的主要方法? 6 拜耳法的原理及主要流程 7 拜尔法生产氧化铝过程中,降温和加水
生产过程: A、 预热期:预热炉料,除去部分CO2和水 B、 低真空加热期:除去全部CO2和水 C、高真空加热期 真空度13.3~133.3Pa, 温度1200 ℃, 时间9h。
镁的蒸馏效率计算公式 镁 = [产出的镁量/按硅量计算的
镁量] ×100%
15
生产经验
A、白云石中氧化硅或硅酸盐的质量分数不宜超过 2%:会妨碍白云石的反应活性; B、白云石中碱金属的质量分数不宜超过0.15%: 污染镁冠,使镁冠在空气中着火燃烧; C、添加2%的氟化钙做催化剂; D、可使用铝硅合金或废铝做还原剂
6
常压下用硅还原温度需超过2100 ℃,当还原 后的SiO2与MgO造渣生成2MgO· SiO2渣时, 还原温度降至1790℃,如果炉料中有CaO存 在,能造成2CaO· SiO2渣,还原温度降至 1550 ℃。
因此,用硅(铁)还原白云石时,生成 了稳定的化合物二钙硅酸盐,此时还原起始 温度降低约600 ℃,所以用白云石做原料是 有利的。
24
添加金属或其它化合物
能除掉氧化物、氮化物和其它非金属杂质,不能除去金属杂 质
真空蒸馏法(升华精炼法)
原理:镁和杂质的蒸气压不同,在一定的温度和真空条件下, 使镁蒸发,而与杂质分离 除掉金属杂质,制取高纯镁
电解精炼 表面处理
为了减少镁锭在运输和保存时产生腐蚀现象而进行表面处理。 重铬酸盐镀膜、浸油及油纸包装、阳 极氧化和酚醛树脂涂层。
28
树立质量法制观念、提高全员质量意 识。20.10.1820.10.18Sunday, October 18, 2020 人生得意须尽欢,莫使金樽空对月。13:41:5513:41: 5513:4110/18/2020 1:41:55 PM 安全象只弓,不拉它就松,要想保安 全,常 把弓弦 绷。20.10.1813:41:5513:41O ct-2018-Oct-20 加强交通建设管理,确保工程建设质 量。13: 41:5513:41:5513:41Sunday, October 18, 2020 安全在于心细,事故出在麻痹。20.10.1820.10.1813: 41:5513:41:55October 18, 2020 踏实肯干,努力奋斗。2020年10月18日下午1时41分 20.10.1820.10.18 追求至善凭技术开拓市场,凭管理增 创效益 ,凭服 务树立 形象。2020年10月18日星期 日下午1时41分 55秒13:41:5520.10.18 严格把控质量关,让生产更加有保障 。2020年10月 下午1时 41分20.10.1813:41O ctober 18, 2020 作业标准记得牢,驾轻就熟除烦恼。2020年10月18日星期 日1时41分55秒 13:41: 5518 October 2020 好的事情马上就会到来,一切都是最 好的安 排。下 午1时41分55秒 下午1时41分13:41:5520.10.18 一马当先,全员举绩,梅开二度,业 绩保底 。20.10.1820.10.1813: 4113:41:5513: 41:55Oct-20 牢记安全之责,善谋安全之策,力务 安全之 实。2020年10月18日 星期日1时41分 55秒Sunday, October 18, 2020 相信相信得力量。20.10.182020年10月 18日星 期日1时41分55秒20.10.18
谢谢大家!
稀释的目的?
26
8 苛性比、铝土矿中氧化铝的理论溶出率的概念.
9 拜耳-烧结联合法的形式?
10 铝电解的原理及电极过程?写出电极反应及 总反应。
12 现代工业铝电解质酸度的概念和表示方法?
13 铝电解质的添加剂有那些?作用是什么?
14 电流效率的概念及计算方法?如何提高铝电 解电流效率?
15 铝电解能耗的概念及计算方法?降低电耗有 哪些方法?
11
原料与工艺参数
白云石(Mg 不低于30%, 在回转窑内煅烧 (1350 ℃ ), 硅铁(Si 75%), CaF2(萤石) (质 量分数2.5%), 熔剂 反应式: 设备 蒸馏罐用无缝钢管制成, 卧式.操作温度1200 ℃, 外 部加热. 罐长3米, 内径28厘米,装料160kg。
12
13
14
除掉粗镁中以SiO2形式存在的硅 增稠剂(CaF2、MgO):使熔剂变稠,覆盖在熔镁表面,形成粘性保护 层 BaCl2:加重剂,使金属镁与熔渣很好的分离
能除掉非金属杂质及碱金属杂质。
操作:
(1)将液态镁加热至710℃ (2)加入精炼剂(20kg/t镁) (3)搅拌10min (4)继续升温至740℃,并静置5~10min,再降温至710℃,然后浇铸
当MeO为固态,Me为气态时,则 G= G0 - RTln pa(Me)
由此可见,当金属Me的原始压力小于0.1MPa时,RTln paMe为正值, G0值为负值,结果使G值的负值减小即自由
能改变值曲线向上移动。
对于反应2Mg + O2 = 2MgO,当其原始Mg分压小于 0.1MPa时,曲线位置向上移动,意味着硅还原氧化镁的可能 性增 大。
有色金属冶金学
Non-ferrous Metallurgy
Magnesium Metallurgy 镁冶金(二)
1
2.3 Thermal Reduction Methods
根据还原剂的不同,热还原法炼镁可分为三种: 碳热还原法
以木炭、煤、焦炭等碳质材料作为还原剂,反应式:
此反应是可逆反应。标准状态下,温度高于1850℃ 反应向右进行;低于1850℃时则向左。因此,为 了防止冷却时,镁被CO氧化为MgO,需用大量与 镁不反应的中性气体(如氢气)将混合气体产物带出 高温区急冷下来。故虽然此法的还原剂较便宜,但 由于生产时需要大量氢气以及安全问题,目前已停 用。
7
用硅还原氧化镁(白云石)的平均温度随压 力的减小而降低。
剩余压力/Pa
平衡温度/ ℃
101325
2375
1333
1700
133.3
1430
13.3
1235
镁的热法实际上是真空还原法, 采取温度1100 ~ 1250℃和真空度13.3~133.3Pa,可顺利 还原出镁。真空除了能够降低还原的操作温度
之外,还能防止还原剂硅和产品镁被空气氧化。
8
•硅铁合金(含75%Si)在高温和真空下还原白 云石中的MgO,得到纯镁和硅酸二钙盐熔渣的 反应是:
2(CaO·MgO)(s) + Si (Si –Fe)(s) = 2Mg(g) + 2 CaO·SiO2(s)
Si + O2 = SiO2 2Mg + O2 = 2MgO 2MgO + Si = 2Mg + SiO2
