免疫胶体金标记手册
免疫胶体金层析法

免疫胶体金层析法
——金标记免疫法测HCG
.
原理
• 采用胶体金标记抗体,以硝酸纤维 素膜为载体,使抗原抗体反应和洗 涤在同一渗滤膜上,反应后根据在 膜上的颜色判断结果。
• 以硝酸纤维素膜为载体,利用微孔 膜毛细管作用,使膜一端的液体慢 慢向另一端渗移,犹如层析
.
← HCG分子 ← 鼠抗人HCG单抗 ← 胶体金颗粒
←胶体金标记鼠抗人HCG单抗
←羊抗鼠IgG
.
positive
HCG 阳性标本
MAX
尿中HCG与金标记的鼠抗人HCG单抗结合形成免疫复合物 随层析作用向上移动,至检测线与鼠抗人HCG抗体结合而聚集显色 在检测线未结合的金标记鼠抗人HCG单抗(IgG)随着尿液上行,到达质控 线与羊抗鼠IgG(二抗)结合而显色,作为质. 控对照。
.
方法学评价
• 该法为定性检测尿中HCG,不能确定其浓度 • 因为该法是用单抗来测定HCG,特异性较高, 黄
疸、蛋白、血细胞和浑浊度对结果观察都无影 响。、 • 晨尿中一般含有最高的HCG值,检出率较高。 • 检测时间:HCG一般在受精卵着床后几天才出现 在尿液中,而且要达到一定的量才能被检出,因 此,对于平时月经正常的妇女需在月经推迟后才 可能在尿中检出,二月经周期长或排卵异常的妇 女有可能在停经40-44天才能检出 • 尿液稀释:如果喝水过多使尿液稀释可能会导致 假阴性结果。
金标鼠抗人IgG单抗随层析作用向上移动,到达质控线,无羊抗鼠IgG( 二抗)或破坏失效,不结合而 不显色,作为质控对照。
.
大便隐血
MAX
.
注意事项
• 1. 将试条有标志线的下端浸入尿液标本中, 深度不可超过标志线(若超过,可能会出 现假阳性)
磺胺类药物免疫胶体金速测卡 说明书

上海佑隆生物科技有限公司Shanghai Youlong Biotechnology Co., Ltd磺胺类药物免疫胶体金速测卡使用说明书【产品简介】本免疫胶体金速测卡产品用于快速检测水产品等食品中的磺胺类药物残留,整个检测过程仅需20~25分钟,可适用于各类水产品加工销售企业、政府行政检测机构以及商业检测服务单位。
其检测灵敏度如下:药物名称 检出限µg/kg 药物名称 检出限µg/kg磺胺二甲基嘧啶20 磺胺甲基异恶唑 20 磺胺嘧啶20 上海佑隆生物科技有限公司 E-mail: ********************.cn【产品组成】磺胺类药物免疫胶体金速测卡(40份/盒)说明书(1份/盒)专用PBST 缓冲液(1瓶/盒)【需要使用的仪器、试剂】分析纯乙酸乙酯、分析纯正己烷50 mL 离心管、试管均质机、天平、离心机、氮(空)气吹干仪或电吹风(鼓风温度不宜过高)、微量移液器【样品处理】样品组织需要避光冷藏保存,样品处理方法如下:1. 称取5 g 捣碎的去脂肪组织于50 mL 离心管中;2. 加入8 mL 乙酸乙酯,振摇或涡旋5分钟;3. 加入5 mL 正己烷,振荡10分钟;4. 4000转/分钟离心5分钟,取中间水层7 mL 于另一50 mL 试管中,65℃氮(空)气吹干;5. 向吹干的试管中依次加入0.5 mL 正己烷和0.3 mL 专用PBST液,用滴管冲洗溶解试管内壁上残留物;静置2分钟,分层后吸取至少100 μL 下层溶液,待检。
【使用步骤】在进行测试前先完整阅读使用说明书,使用前将试剂板和待检样本溶液恢复至室温(20℃~25℃)。
♦ 从原包装袋中取出试剂板,水平放置于观察者正面,如下图右侧所示(打开后请立即使用);♦ 吸取待检样品溶液100 µL 或垂直滴加3滴于加样孔中,加样后开始计时;结果应在3~5分钟读取,其他时间判读无效。
【结果判断】♦ 阴性(-):T 线显色(检测线,靠近加样孔一端)比C 线(对照线)深或一样深,表示样品中磺胺类药物浓度低于检测限或不含磺胺类药物残留。
胶体金免疫标记原理

胶体金免疫标记原理咱先得知道啥是胶体金呢。
胶体金啊,就像是一群超级小的金粒子在溶液里开派对。
这些金粒子小得不得了,直径也就几个到几十个纳米。
它们在溶液里形成一种胶体状态,就像一群小精灵在水里欢快地游来游去。
胶体金有个很厉害的特性,就是颜色特别好看,不同大小的胶体金粒子还会呈现出不同的颜色呢,从酒红色到紫红色都有。
那这胶体金和免疫标记咋就联系上了呢?这就像是给胶体金找了个特殊的工作。
免疫标记呢,简单说就是要把能识别特定东西的抗体或者抗原给标记出来。
咱们身体里有免疫系统,抗体就像一个个小卫士,专门去识别那些外来的坏家伙,也就是抗原。
胶体金免疫标记就是把胶体金和抗体或者抗原结合起来。
想象一下啊,胶体金粒子就像一个个小珠子,抗体就像小钩子。
咱们通过一些巧妙的化学方法,就把小钩子挂到小珠子上啦。
这个过程就像是给小珠子穿上了一件有特殊功能的衣服。
当我们要检测一个样本里有没有特定的抗原或者抗体的时候,这个胶体金标记就大显身手了。
比如说我们怀疑一个样本里有某种病毒,这种病毒就是抗原啦。
我们把胶体金标记的抗体放进去,如果样本里有这个病毒,那标记了胶体金的抗体就会像找到目标的小导弹一样,“嗖”地一下就和病毒结合在一起。
然后呢,因为胶体金有颜色呀,一旦结合了,我们就能看到颜色的变化。
就好像是小珠子和病毒结合之后,它们就开始发光发亮,告诉我们:“我们找到目标啦!”如果没有那种病毒,那标记的抗体就找不到结合的对象,就不会有那种特殊的颜色变化。
这个胶体金免疫标记还有很多优点呢。
它操作起来比较简单,不需要那些特别复杂的仪器。
就像咱们做手工一样,只要按照步骤来,很容易就能完成检测。
而且它检测速度还挺快的,就像短跑运动员一样,很快就能出结果。
再说说这个胶体金免疫标记在实际生活中的应用吧。
在医疗领域,它可帮了大忙了。
比如说检测传染病,像新冠疫情的时候,胶体金法的检测试剂就发挥了不小的作用呢。
它能快速地检测出一个人是不是感染了新冠病毒。
人类免疫缺陷病毒(HIV1+2)抗体诊断试剂盒(胶体金法)标准操作规程

人类免疫缺陷病毒(HIV1+2)抗体诊断试剂盒(胶体金法)标准操作规程一. 预期用途本试剂盒定性检测人血清、血浆或者全血样品中可能存在的HIV-1/HIV-2抗体,作为HIV感染的辅助诊断方法。
二. 检测原理本试剂盒利用免疫层析原理,采用双抗原夹心法检测,在硝酸纤维膜上的检测区域包被HIV-1和HIV-2区段抗原,用胶体金标记同样含有的HIV-1和HIV-2区段的标记抗原,用抗HIV抗体作为对照线原料包被到硝酸纤维膜上形成对照线。
检测时,如果样品内还有HIV抗体时,样品中的HIV抗体可与纸条前段的“胶体金-抗原”结合,形成免疫复合物,复合物由于层析作用沿膜带移动,并在包被了抗原的检测区形成一条红色线,判为阳性;如果样品内不含有HIV抗体,检测区不会形成红色线,判为阴性。
三. 试剂1.生产厂商:北京万泰生物药业股份有限公司2.规格: 1人份/袋 10人份/盒3.试剂组成:测试卡、铝箔袋、干燥剂、说明书、样品稀释液。
测试卡主要成分:塑料卡、塑料底板、吸水滤纸、硝酸纤维膜(包括包被有HIV-1和HIV-2抗原的检测线和包被有抗HIV抗体的对照线),金垫(附着有胶体金标记的HIV-1和HIV-2区段抗原)。
四. 仪器加样器五. 样品要求:1、本试剂检测人血清、血浆或全血2、血清、血浆样品3日内检测的,置2-8℃冰箱保存;超过3日不检测的样品,应低温保存。
3、全血样品建议在采血后立即检测,不可长期放置后检测。
六. 检验方法:1、检测血清或血浆样品,用加样器取80ul血清或血浆样品,缓慢滴加在测试卡加样端中心。
2、检测全血样品:在测试卡加样端中心滴加1滴(约40ul)全血样品,后立即滴加1-2滴(约40-80ul)样品稀释液。
七. 质量控制:出现阳性对照线实验结果有效,不出现阳性对照线实验结果无效。
八. 参考值:加样完毕,室温放置30分钟观察结果,出现两条红色线为阳性,只出现一条对照线为阴性。
九. 检验结果的解释阴性:只出现一条对照线阳性:出现两条红色线。
免疫金标记技术(研究生讲义)

DIGFA与GICA的比较
DIGFA (穿透滤过型) GICA (横向流动型)
硝酸纤维素 膜的种类 试剂形式
操作步骤 观察时间
圆片膜
窄长型膜
渗滤装置及2瓶液体 单一试剂条(板) 试剂(液相形式 ) (固相形式 )
3
1
操作结束(约3min)即 操作结束后
刻观察
等待3-20min
35
IFA 穿流(FLOW THROUGH)
金免疫层析试验
( goldimmunochromatographic assay,GICA )
20
斑点金免疫渗滤试验 (dot immunogold filtration assay,DIGFA)
操作示意图 加标本 免疫金 洗涤液
盖 微孔膜 吸水垫料 底
装置分解图
21
技术类型:夹心法、间接法
双抗体夹心法
温度、稳定剂
8
呈色性
不同大小的胶体金呈现不同的颜色 小颗粒--橙黄色 中等颗粒—酒红色 较大颗粒—深红色 大颗粒—紫色
9
胶体性质
稳定性:稳定地、均匀地、呈单一分散状态悬浮
于液体中
10
胶体金 1 % 柠 檬 酸 三 胶体金特性 粒 径 钠 加 入 量 呈色 (nm) (ml)*
16
2.00
橙色
λmax 518nm
免疫金标记技术 (Immunogold labelling techique)
1
免疫技术
试剂 Ag Ab
标本 Ab Ag
2
放射性核素 荧光素 酶
化学发光剂 胶体金
标记免疫技术
试剂 Ag*
标本 Ab
Ab*
Ag
标记物
免疫胶体金标记手册

免疫胶体金标记手册浙江大学电子显微镜室浙江大学生物技术研究所胶体金免疫标记技术培训班技术资料胡东维洪健徐颖浙江大学2001年10月一、胶体金的制备根据不同的制备方法,可以制备出直径1-500nm的胶体金粒子,但做为免疫标记探针,其直径应在3-30nm范围内。
在氯化金(HAuCl4)水溶液中加入还原剂使之还原并聚积形成胶体金粒子。
使用不同种类、不同剂量的还原剂,可以控制所产生的粒子大小。
即粒子大小取决于反应溶液中最初还原试剂和还原核的数量。
还原剂浓度越高,核浓度也越高,氯化金的还原也就从更多的还原中心开始,因此产生的胶体金粒子数量越多,但体积也越小。
粒子直径每增加一倍,数量减少为原来的1/8。
以柠檬酸钠和单宁酸做还原剂,能够制备大小相对一致、直径3~16nm的胶体金。
因此一般胶体金探针均使用该方法进行。
但该方法制备的胶体金粒子直径范围较窄,而且残留的多聚单宁酸残基往往干扰某些蛋白与金粒子的结合。
此时在溶液中添加0.1~0.2%的H2O2能够去除这些残基。
双标记或制备5-10 nm的胶体金时建议使用该方法。
利用柠檬酸为还原剂,可以制备12~150 nm直径的胶体金。
但制备大体积的胶体金时,胶体金粒子的误差也同时增加。
因此做单标记时,建议使用该方法制备12-16 nm直径的胶体金。
除了上述方法外,也可以用磷作为还原剂来制备5 nm的胶体金,它避免了单宁酸残基的问题,但所形成的金粒子体积变化较大。
磷易燃且有毒,制备的残液需进一步处理,故该方法已经很少使用。
氯化金极易吸湿,故一般均以小剂量密封保存(0.5g或1g),因此在配制氯化金溶液时一次配完,暂时不用的可以用1.5 ml试管分装为1 ml保存(-20℃)。
注意各种玻璃器皿一定要洗净并用双蒸水多次冲洗,有条件时可硅化处理(1%双氯硅烷/氯仿浸泡1小时,烘干)。
配制各种试剂时均使用双蒸水,随后再用0.22 m微孔滤膜过滤后使用。
三角瓶可反复多次使用,不用时应密封保存,以防污染。
17.2-金免疫标记技术

一 洗 净 双 手
四
立 即 加 1 2 滴 缓 冲 液
操作
二 用 采 血 针 采 指 尖 血
样三 孔将 1 滴 指 尖 血 滴 入 加
??结果
步骤5:15分钟读 取结果
??结果
讨论分析
胶体金标记技术 (Immunogold labeling technique)
是以胶体金作为示 踪标记物,应用于 抗原抗体反应的一 种新型免疫标记技 术。
讨论分析
制备高质量胶体金的注意事项
(1)玻璃器皿必须彻底清洗,最好是经过硅化处理的玻璃 器皿,或用第一次配制的胶体金稳定的玻璃器皿,再用双 馏水冲洗后使用。否则影响生物大分子与金颗粒结合和活 化后金颗粒的稳定性,不能获得预期大小的金颗粒。 (2)试剂配制必须保持严格的纯净,所有试剂都必须使用 双馏水或三馏水并去离子后配制,或者在临用前将配好的 试剂经超滤或微孔滤膜(0.45µ m)过滤,以除去其中 的聚合物和其它可能混入的杂质。
讨论分析
2.鞣酸—枸橼酸钠还原法 A液:1%HAuCl4水溶液1ml加入79ml双馏水中混匀。 B液:1%枸橼酸三钠4ml,1%鞣酸0.7ml,0.1Mol/L K2CO3液0.2ml,混合,加入双馏水至20ml。
将A液、B液分别加热至60℃,在电磁搅拌下迅速将 B液加入A液中,溶液变蓝,继续加热搅拌至溶液变 成亮红色。此法制得的金颗粒的直径为5nm。如需 要制备其它直径的金颗粒,则按表15-1所列的数字 调整鞣酸及K2CO3的用量
讨论分析
示踪剂:以胶体金为指示剂,本 身形成免疫分析过程后的颜色标记
符号显示结果
自带质控对照
快速:全部检测过程 仅需 3-20分钟。
简便、经济实用
可单份检测,稳定性好
免疫电镜胶体金标记法-1

免疫电镜胶体金标记法-1金标法是Faulk和Taylor(1971)提出的,并首先用于免疫电镜。
它是利用胶体金在碱性环境中带有负电的性质,使其与抗体相吸附,从而将抗体标记。
当用金标记的抗体与抗原反应时,在光镜水平胶金液呈现鲜艳的樱红色,不需加外进行染色。
在电镜水平,金颗粒具有很高的电子密度,清晰可辨。
因此,免疫电镜胶体金标记法近年来被成功地应用于生物学的各个方面,并取得了要喜的进展,解决了一些过去未能解决的问题,80年代以来似有取代免疫电镜 PAP技术的趋势。
胶体金标记抗体技术在电镜水平应用有许多优点:首先,手续不如PAP法烦琐,不需用H2O2等损伤微细结构的处理步骤,对微细结构的影响较少。
其次,金颗粒具有很高的电子密度,在电镜下金颗粒清晰可辨,易于与其他免疫产物相区别。
因此,金标法还可以和PAP法相结合进行双重或多重染色的超微结构定位。
另外,利用不同直径的金颗粒标记不同的抗体,是研究突触小泡内神经递质共存的有力工具。
由于抗原抗体反应部位结合金颗粒数量的多少可进行粗略的免疫细胞化学定量研究。
金标抗体还可加入培养液中,对培养细胞内抗原进行标记定位。
曾有报告用金标记法于细胞内骨架的研究获满意的效果。
由于金具有强烈的继发电子的能力,因此,不仅可以用于透射电镜的超薄切片观察,也可以用于扫描电镜对细胞表面的抗原、受体进行标记定位观察。
金标液无毒性,对人体无损伤。
胶体金及胶体金标记物的制备见第五章第3节。
在原位分子杂交技术在电镜水平的应用中,胶体金的标记术被科技工作者认为是当前最理想的标记物。
一、电镜水平的免疫金染色法应用于电镜水平的免疫法,可分为包埋前染色和包埋后染色,由于包埋前染色对细胞膜的穿透性差,一般只用于细胞表面的抗原标记,如需穿透细胞膜,则需辅以冻融法或加入Triton X-100、皂素等活性剂,后者会加重细胞超微结构的破坏,因此,现较普遍采用包埋后染色,现分别介绍如下:1、包埋后染色(1)超薄切片厚50~70nm左右,载于200~300网孔的镍网上。
金标免疫项目标准操作程序

SOP_13-5 金标项目标准操作程序一、目的:统一项目操作规程,严格检验质量标准,为临床提供及时、可靠的结果报告。
二、适用范围:免疫学检验项目。
三、操作人员:检验科授权工作人员四、项目内容:丙型肝炎病毒抗体Anti—HCV检测爱滋病抗体Anti—HIV检测肌钙蛋白CTNI检测衣原体CT检测乙肝表面抗原(血清/血浆)检测胶体金法丙型肝炎病毒抗体诊断试剂盒(胶体金法)产品名称通用名:丙型肝炎病毒抗体诊断试剂盒(胶体金法)英文名:Diagnostic Kit for Antibody To Hepatitis C Virus(Colloidal Gold)包装规格:条型/卡型:40人份/盒、50人份/盒、100人份/盒预期用途丙型肝炎病毒可通过输血、血制品不洁注射、母婴和密切接触而传播,主要通过输血而引起,丙型肝炎约占输血后肝炎70%以上。
由于病毒的高变异型,目前还没有有效的丙肝疫苗面世,因此预防和控制丙型肝炎的感染和扩散变得尤为重要,而丙型肝炎的诊断是其中最关键的环节。
丙型肝炎病毒抗体作为一种重要的丙肝标志物,对其进行检测一直以来为临检所重视,是目前最主要的丙型肝炎辅助诊断手段之一。
本检测试剂盒用于定性检测人血清或血浆样本中的丙型肝炎病毒(HCV)抗体。
检验原理本品采用胶体金免疫层析技术,用用间接法原理定性检测人血清(浆)中HCV抗体。
在玻璃纤维素膜上预包被金标小鼠抗人(lgG Ab),在硝酸纤维素膜上检测线和对照线处分别包被重组丙肝混合抗原(Core、NS3、NS4、NS5,源自大肠杆菌)和人lgG抗体(丙种球蛋白)。
检测阳性样本时,血清样本中HCV-Ab与胶体金标记小鼠抗人lgG抗体结合形成复合物,由于层析作用复合物沿纸条向前移动,经过检测限时与预包被的抗原结合形成“Au-anti+lgG Ab –HCV Ab–HCV Ab”夹心物而凝聚显色,游离金标小鼠抗人lgG抗体则在对照线处与人lgG 抗体结合而富集显色。
氯霉素免疫胶体金速测盒

使用说明书 宁波美成生物科技有限公司
撕开氯霉素免疫胶体金快速检测试剂条包装,取出金标微孔。(实验 环境的温度必须20度以上。冷冻过的原奶,明显出现颗粒的,容易导 致跑板不完全,此时必须使用加热器或者离心取中间层样本进行检测) 用移液枪取0.2ml生乳金标微孔中,2分钟后用滴管吹打生乳,使微孔 中的金和生乳充分混匀,(必须使孔中红色物质充分溶解,一般为2 分钟,不充分溶解会使检测结果显示假阳性,吹打不 少于10下),将试剂条箭头指向的一端插到微孔中。 8-10分钟后判读结果
试剂条一次性使用
不要使用过期试剂条,废弃物应妥善处理 请勿触摸试剂条中央的白色膜面
切勿重复使用配备的滴管,以免交叉污染
切勿食用配备的试剂 若需直接检测标准品,我方可提供配置液 试验遇到的任何问题,请与供应商联系
胶体金标记蛋白A技术(ProteinA-goldtechnique,PAg法)

0.05mo1/LTris 缓冲生理盐水:氯化钠 8.5-9g;0.5mo1/L,pH7.4Tris-Hcl 缓冲液 100m1;加双蒸水至 1000m1,调 pH 值至 7.4。
0.02mo1/LTris 缓冲生理盐水:氯化钠 8.5-9g; o.5mo1/L, pH7.4Tris-Hcl 缓冲液 40m1, 加双蒸水至 l000m1,调 pH 值至 8.2。
那本书被木子用得很小心。袁慕野毕业要走的时候,木子去买了一块德芙巧克
对中枢神经系统切片,有主张以 1%过碘酸钾代替 H2O2 的。
2、双蒸水洗 3 次,每次 10min,第 1,2 次 浮于液滴上清洗,第 3 次以盛双蒸水的注射器沿 镍网面冲洗,水流应有适当压力,但不宜过高强, 用滤纸在网缘将水吸干。(0.05mo1/LTBSpH7.4 洗 5min×3 次?)
后染色。其主要区别于一般胶体金免疫染色在:
须 1% 卵 白 蛋 白 - PBs 或 1% 卵 白 蛋 白 0.05mol/lTris 缓冲液来封闭非特异性的结合部 位,而不是采用羊或其它的动物的正常抗血清, 因为 PAg 复合物能够与正常血清组中的 Ig 结合, 从而给出假阳性结果;②在应用第一抗血清孵育 和 PBS 冲洗后作第二抗血清即 PAg 复合物孵育前 的准备时,应用的 PBS 或 TBS 的 pH 应变更为 pH8.2。其它可参照本节中包埋后染色法进行。
关键词:胶体蛋白标记胶体金标记蛋白 A 技 术 ProteinA-goldtechniquePAg 法胶体金 PAg 复 合物制备方法简便,作为第二抗体,无种属特异 性,可以免去不同种属动物要制备不同的特异性 免疫球蛋白。PAg 复合物与包埋剂和细胞成分都 极少发生非特异性的交互作用,蛋白 A 和金粒间 非共价的结合特性既不影响蛋白 A 的活性,又能 保持高度的稳定性,PAg 复合物分子最小易于穿 透组织。PAg 复合物的原液在 4℃可保存达一年 之久。电镜水平的 PAg 染色法 PAg 法在电镜技术 的应用原则是二步标记法,可用于包埋前和包埋
胶体金金标检验法

胶体金(金标)检验法胶体金是一种常用的标记技术,有其独特的优点。
近年已在各种生物学研究中广泛使用。
免疫胶体金技术的基本原理是:氯金酸(HAuCl4)在还原剂作用下,可聚合成一定大小的金颗粒,形成带负电的疏水胶溶液。
由于静电作用而成为稳定的胶体状态,故称胶体金。
胶体金标记,实质上是蛋白质等高分子被吸附到胶体金颗粒表面的包被过程。
免疫金标记技术(Immunogold labelling techique) 主要利用了金颗粒具有高电子密度的特性,在金标蛋白结合处,在显微镜下可见黑褐色颗粒,当这些标记物在相应的配体处大量聚集时,肉眼可见紫色斑点,因而用于定性或半定量的快速免疫检测方法中。
为什么霍乱可以用胶体金(金标)检验法进行快速筛查?霍乱弧菌快速检测卡是利用单克隆抗体胶体金标记技术和膜层析技术研制而成,用于定性检测样本中可能存在的霍乱弧菌的特异性抗原A及O139血清型。
首先按常规方法制备并筛选出效价高的抗O1群A 抗原和抗O139抗原的单抗细胞株。
然后采用枸缘酸钠还原法制备胶体金颗粒,选择玻璃纤维吸附最适浓度的金标抗体。
按常规方法免疫家兔,制备霍乱弧菌的多克隆抗体。
根据检测对象(疑似病人粪便)的特殊性,研制了特异的稀释液。
一方面可裂解细菌,释放抗原,提高检测敏感性,另一方面可起到防止污染的作用。
经二年多的反复试制,我公司完成的霍乱弧菌O1群(O139)快速检测试纸,其对霍乱弧菌最低敏感性10分钟内106菌/ml阳性,达到临床最低检出量的要求,符合卫生部《霍乱防治手册》要求,且对高浓度的菌液109 菌/ml无前置反应;用萃取液、正常人粪便标本及其它大肠中寄生菌进行的特异性鉴定表明,该试纸条特异性为100%金特敏? 霍乱快速检测卡的特点是什么?最低检出量:不低于105cfu/ml适合临床需要。
快速出结果:稀释直接裂解细菌,10分钟观察结果满足疾病控制要求。
便利使用:独立包装,“插”式设计,操作简捷,避免二次污染。
人类免疫缺陷病毒标准操作规程(胶体金法)
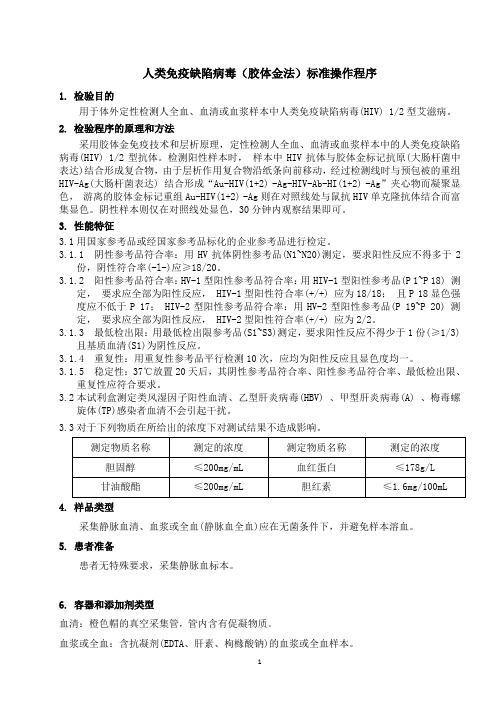
人类免疫缺陷病毒(胶体金法)标准操作程序1.检验目的用于体外定性检测人全血、血清或血浆样本中人类免疫缺陷病毒(HIV) 1/2型艾滋病。
2.检验程序的原理和方法采用胶体金免疫技术和层析原理,定性检测人全血、血清或血浆样本中的人类免疫缺陷病毒(HIV) 1/2型抗体。
检测阳性样本时,样本中HIV抗体与胶体金标记抗原(大肠杆菌中表达)结合形成复合物,由于层析作用复合物沿纸条向前移动,经过检测线时与预包被的重组HIV-Ag(大肠杆菌表达) 结合形成“Au-HIV(1+2) -Ag-HIV-Ab-HI(1+2) -Ag”夹心物而凝聚显色,游离的胶体金标记重组Au-HIV(1+2) -Ag则在对照线处与鼠抗HIV单克隆抗体结合而富集显色。
阴性样本则仅在对照线处显色,30分钟内观察结果即可。
3.性能特征3.1用国家参考品或经国家参考品标化的企业参考品进行检定。
3.1.1阴性参考品符合率:用HV抗体阴性参考品(N1~N20)测定,要求阳性反应不得多于2份,阴性符合率(-l-)应≥18/20。
3.1.2阳性参考品符合率:HV-1型阳性参考品符合率:用HIV-1型阳性参考品(P 1~P 18) 测定,要求应全部为阳性反应, HIV-1型阳性符合率(+/+) 应为18/18;且P 18显色强度应不低于P 17; HIV-2型阳性参考品符合率:用HV-2型阳性参考品(P 19~P 20) 测定,要求应全部为阳性反应, HIV-2型阳性符合率(+/+) 应为2/2。
3.1.3最低检出限:用最低检出限参考品(S1~S3)测定,要求阳性反应不得少于1份(≥1/3)且基质血清(S1)为阴性反应。
3.1.4重复性:用重复性参考品平行检测10次,应均为阳性反应且显色度均一。
3.1.5稳定性:37℃放置20天后,其阴性参考品符合率、阳性参考品符合率、最低检出限、重复性应符合要求。
3.2本试利盒测定类风湿因子阳性血清、乙型肝炎病毒(HBV) 、甲型肝炎病毒(A) 、梅毒螺旋体(TP)感染者血清不会引起干扰。
简化免疫胶体金标记技术

包埋后免疫胶体金标记技术1.试剂固定液:0.1M二钾砷酸鈉缓冲液pH7.4(4%多聚甲醛+0.1%戊二醛+4%蔗糖)洗涤液:0.1M二钾砷酸鈉缓冲液pH7.4(4%蔗糖)醛基灭活液:0.1M二钾砷酸鈉缓冲液pH7.4(4%蔗糖+0.1M甘氨酸)脱水剂:甲醇(ddH2O稀释成30%,50%,70%,80%,90%,95%)包埋剂:K4M (2.7g交联剂A+17.3单体B+0.1g引发剂C)标记封闭液:0.01M磷酸盐缓冲液pH7.4(1%BSA+0.05%TritonX-100+0.05%Tween 20) 标记洗涤液:0.01M磷酸盐缓冲液pH7.4抗体稀释液:0.01M磷酸盐缓冲液pH7.4(1%BSA+0.05%Tween 20)染色液:醋酸铀(3-4g醋酸双氧铀+100ml50%甲醇);柠檬酸铅pH12(1.33g硝酸铅+1.76g柠檬酸鈉+30mlddH2O)2. 主要仪器:镍网(喷有方华膜和碳膜)、镊子、Parafilm、自制小环、冰箱(4℃至-35℃)、紫外聚合箱、培养皿、透射电镜、离子溅射仪、超薄切片机、恒温箱(28℃)0.2二钾砷酸鈉缓冲液母液pH7.4:0.4M 二钾砷酸鈉(21.4g二钾砷酸鈉/250mlddH2O)0.2M盐酸(4.5ml/250mlddH2O)50ml二钾砷酸鈉(0.4M)中加入8ml左右0.2M盐酸,调节pH至pH7.2-7.4,加入ddH2O 至终体积为100ml,即为0.2二甲砷酸鈉缓冲液母液pH7.42.5%戊二醛母液pH7.4:25%戊二醛10ml +0.2M二钾砷酸鈉缓冲液50ml,加入ddH2O至终体积为100ml,pH无需再调,现配现用4%多聚甲醛pH7.4:a.16%多聚甲醛25ml+0.2M二钾砷酸鈉缓冲液50ml,加入ddH2O至终体积为100ml,pH无需再调,现配现用b. 2g多聚甲醛粉末+40ml ddH2O,70℃加热至粉末完全溶解,加入1.07g二钾砷酸鈉,用0.2M盐酸调至pH7.4,加入ddH2O至终体积为50ml,现配现用0. 1M磷酸盐缓冲液pH7.4:NaH2PO4∙H2O1.8g+23.25gNa2HPO4∙7H2O+NaCl 5.0g.加入ddH2O至终体积为1000mlK4M:2.7g交联剂A+17..3单体B至离心管中,充入氮气以使其充分混合,在加入0.1g引发剂C,继续充入氮气至其完全溶解,配置好的K4M包埋剂-20℃保存3%醋酸铀:3-4g醋酸双氧铀至100ml浓度为50%的甲醇中,静置过夜,过滤后4℃避光保存1%柠檬酸铅:1.33g硝酸铅+1.76g柠檬酸鈉至30mlddH2O中,剧烈混匀,加入8ml1MNaOH至溶液变得澄清,加入ddH2O至终体积为50ml,最终pH12左右3. 步骤及方法3.1 取材与固定对于培养与分离的细胞,随用随取,取材时越快越好,动物组织取材的最理想的方法是经过组织灌流固定后再用锋利的刀片将其切成1mm3以下大小的组织块,投入到固定液中继续固定。
免疫金标记检测方法标准操作程序

免疫金标记检测方法标准操作程序【目的】保证免疫金标技术检验准确性【本SOP适用范围】免疫金标技术【该SOP变动程序】本标准操作程序的变动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:专业主管、科主任。
【原理】氯化金分子在还原剂作用下聚合形成金颗粒,颗粒与颗粒之间因静电作用而相互排斥,使其保持一个比较稳定的胶体状态,故称作胶体金。
利用胶体金颗粒的高电子密度及其表面能结合生物大分子(如抗体、SPA、植物血凝素和刀豆蛋白A等)以及具有一定颜色等特性,可用光镜和电镜对细胞内抗原进行定位、定性的研究。
【方法学分类】1. 班点金免疫渗滤试验固相膜免疫测定中液体在微孔膜中穿过流出呈穿流形式,为斑点金免疫渗滤试验(dot immunogold filtration assay,DIGFA),亦有称免疫金溶胶斑点法、滴金免疫测定法等。
试验单位为三层反应盒,第一层为过滤器(滤纸层),第二层为反应膜(NC膜或MC膜)上点加有特异性抗原或抗体,第三层为吸水垫料,有称此渗滤装置为滴金反应板。
以双抗体夹心法测dsDNA为例:试验中将标本加在反应盒上,血清(标本)透过过滤层进入反应层,反应层上点有“一”字形抗IgG(或某种人血清蛋白作为试验阳性对照)及“.”形被测物相应抗体,血清中抗原与反应层中抗体结合,其余无关蛋白等滤出膜片,加入金标记抗体试剂,反应膜上“一”字形及“.”形均显红色为试验阳性,仅“一”形显红色为试验阴性(试剂盒状态良好),“一”不显色提示试剂盒质量不合格,需另取反应盒重做试验。
试剂盒基本试剂成分有滴金反应板、金标记试剂及洗涤液。
2. 斑点金免疫层析试验固相膜免疫测定中液体通过毛细管作用在膜上向前移行呈横流形式,为斑点金免疫层析试验(dotimmunogoldchromatographyassay,DIGCA)。
试验单位为一滤膜条,自上而下分有多个层次。
如单克隆双抗体法测HCG,滤膜条各区域分别为:吸水滤纸—固定有金标二抗的MC膜—固定有抗β-HCG抗体的MC膜—金标记抗。
麻疹抗体检测试剂盒胶体金法说明书

麻疹抗体检测试剂盒(胶体金法)说明书【产品名称】麻疹抗体检测试剂盒(胶体金法)【包装规格】24人份/盒48人份/盒【预期用途】用于检测试验血清中旳麻疹抗体(IgM/IgG)【检查原理】用麻疹病毒抗原固相硝酸纤维素膜,应用渗滤式间接法原理,检测血清中麻疹病毒抗体。
【重要构成成分】1、反应板24份或48份2、试剂Ⅰ1瓶0.02mol/L PH 7.4 PBS3、试剂Ⅱ1瓶胶体金标识物【储存条件及有效期】产品应储存在2℃~8℃条件中,不能冷冻;有效期24个月。
【样本规定】1、血清样品不能溶血,应为新鲜血清或2℃~8℃条件保留不超过一周。
2、高脂血症血清不能使用。
【检查措施】1、滴入二滴试剂Ⅰ于反应板中央孔中,待完全渗透;2、滴入100µl血清于反应板孔中,待完全渗透;3、滴加三滴试剂Ⅱ于反应板孔中,待完全渗透;4、渗透三滴试剂Ⅰ于反应板孔中,待完全渗透。
【成果解释】阳性:反应板孔中C端出现红色圆斑,T端出现红色圆斑,为麻疹病毒抗体阳性;阴性:反应板孔中C端出现红色圆斑,T端不出现红色圆斑,为麻疹病毒抗体阴性。
失效:反应板孔中C端不出现红色圆斑,或C端、T端均不出现红色圆斑,为试剂盒失效。
【检查措施旳局限性】1、本试剂试验仅用于检测麻疹病毒抗体而非直接检测麻疹病毒抗原,因而阳性成果并不能确诊是麻疹病毒感染。
对患者状况旳诊断应结合患者临床体征与症状和试验成果旳综合分析。
2、抗体含量低旳血清样品,不能被检测出来是也许旳。
部份麻疹病毒感染旳患者,不产生抗体或产生少许旳抗体。
此时,也许显示阴性成果。
3、试验成果可疑时,应用PCR法确诊。
【产品性能指标】1、批内精密度:阳性符合率和阴性符合率均应≥95%,反应斑点颜色深浅程度应靠近。
2、批间精密度:阳性符合率和阴性符合率均应≥95%。
【注意事项】1、本产品尚未获得产品注册证号,仅供研究,不用临床诊断。
2、试验一旦开始操作,应按操作环节持续进行,直至结束。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
浙江大学电子显微镜室浙江大学生物技术研究所胶体金免疫标记技术培训班技术资料胡东维洪健徐颖浙江大学2001年10月一、胶体金的制备根据不同的制备方法,可以制备出直径1- 500nm的胶体金粒子,但做为免疫标记探针,其直径应在3-30nm范围内。
在氯化金(HAuCI 4)水溶液中加入还原剂使之还原并聚积形成胶体金粒子。
使用不同种类、不同剂量的还原剂,可以控制所产生的粒子大小。
即粒子大小取决于反应溶液中最初还原试剂和还原核的数量。
还原剂浓度越高,核浓度也越高,氯化金的还原也就从更多的还原中心开始,因此产生的胶体金粒子数量越多,但体积也越小。
粒子直径每增加一倍,数量减少为原来的1/8。
以柠檬酸钠和单宁酸做还原剂,能够制备大小相对一致、直径3〜16nm的胶体金。
因此一般胶体金探针均使用该方法进行。
但该方法制备的胶体金粒子直径范围较窄,而且残留的多聚单宁酸残基往往干扰某些蛋白与金粒子的结合。
此时在溶液中添加0.1〜0.2%的H2O2能够去除这些残基。
双标记或制备5-10 nm的胶体金时建议使用该方法。
利用柠檬酸为还原剂,可以制备12〜150 nm直径的胶体金。
但制备大体积的胶体金时,胶体金粒子的误差也同时增加。
因此做单标记时,建议使用该方法制备12-16 nm直径的胶体金。
除了上述方法外,也可以用磷作为还原剂来制备 5 nm的胶体金,它避免了单宁酸残基的问题,但所形成的金粒子体积变化较大。
磷易燃且有毒,制备的残液需进一步处理,故该方法已经很少使用。
氯化金极易吸湿,故一般均以小剂量密封保存(0.5g或1g),因此在配制氯化金溶液时一次配完,暂时不用的可以用 1.5 ml试管分装为1 ml保存(-20 C)。
注意各种玻璃器皿一定要洗净并用双蒸水多次冲洗,有条件时可硅化处理(1%双氯硅烷/氯仿浸泡1小时,烘干)。
配制各种试剂时均使用双蒸水,随后再用0.22 m微孔滤膜过滤后使用。
三角瓶可反复多次使用,不用时应密封保存,以防污染。
制备好的胶体金保存寿命较长,可4C保存6个月以上或室温下保存1-2个月。
当出现明显悬浮物或沉淀后表示已不可再用。
但无论无何,在保存较长时间后应进行镜检,如出现大量胶体金粒子凝集,说明已经过期。
1、单宁酸/柠檬酸钠法制备3〜16 nm胶体金(1)取一250 ml三角瓶,加入79 ml双蒸水和1 ml 1 %氯化金,预热至60〜70C。
(2)取一50 ml烧杯,加入4 ml 1 %柠檬酸钠,然后根据所制备金粒子体积大小加入不同用量的单宁酸及等量的25 mM K2CO3。
预热至60〜70C。
K2CO3的作用是保持溶液的中性pH。
因此如果单宁酸的量少于0.5 ml时,对pH的影响不大,K2CO3可以省略。
(3)将上两种溶液迅速混合并充分混匀,加热至沸并保温10分钟。
自然冷却。
柠檬酸钠(ml )单宁酸(l ) 胶体金(nm ) 45000 3 42000 4 4500 6 4120 8470 10 4 10 16 2、白磷还原法制备5 nm 胶体金(1) 取250 ml 三角瓶一个,加 79 ml 双蒸水,1 ml 1%氯化金,并用 0.25 M K 2CO 3将 溶液调至中性(pH7.0 )。
(2) 取0.2 ml 饱和磷/乙醚溶液加到1.5 ml 试管中,再加0.8 ml 乙醚,混匀。
取 0.7 ml加入溶液(1)中(磷有毒且易燃,操作请带手套,多余的磷溶液用CuSO 4进行中和)。
(3) 室温下轻轻摇匀15 min ,然后加热沸腾并保持 5 min ,自然冷却。
3、柠檬酸三钠法制备12-30 nm 胶体金(Frens, 1973)(1) 取250 ml 三角瓶一个,加100 ml 双蒸水及1 ml 1%氯化金,加热沸腾;(2) 取不同量的1%柠檬酸钠加入上述溶液中。
混匀,再保持沸腾30 min ,溶液颜色首先变黑,再逐渐变红,粒子体积较小时,溶液呈桔红色,而粒子体积较大时,则颜色偏向紫色。
20注意:二旦柠檬酸钠(ml)胶体金(nm) 512 416 324 2.830 20 40 60 80Sol diameter mm)(1)由于使用试剂质量及其它方面可能存在的误差,以及制备过程中的其它问题,胶体金粒子的大小及一致性与理论值可能有偏差,因此,在制备完成后必须进行镜检。
如岀现粒子体积偏差太大,粒子凝聚,粒子边缘不清晰等问题,须重新制备。
(2)胶体金溶液最好保存在4'C 冰箱中;也可保存在室温下,一般可保存1-2个月。
但决不可保存在0C以下,否则金粒子发生凝聚。
二、蛋白-金复合体的制备一般认为胶体金粒子表面为一层AuCl2,因此,粒子表面带有负电荷,这种负电荷粒子之间相互排斥,形成稳定悬浮的胶体金溶液。
金颗粒表面可以包被一层生物大分子(如蛋白)来稳定和保护这些粒子,以免受外来电解质的影响而相互凝聚在一起。
胶体金粒子对蛋白的吸附作用取决于pH值,这是因蛋白的净电荷取决于溶液的pH值,在pH=pl时为中性。
由于在pH=pl时蛋白溶解度最小,因此这时它水化程度最小,最溶液吸附到疏水的金粒子表面。
但在实际的胶体金探针制备中,一般胶体金调整为pH=PI+0.5,这样蛋白带正电,有利于结合更稳定。
胶体金探针所用蛋白必须要经过前处理,其目的在于(1)去除高浓度的盐分,高浓度的盐分往往干扰蛋白与胶体金的吸附结合,或导致胶体金粒子的凝聚,这一步往往采用低浓度缓冲液中进行。
(2)使蛋白分子尽量分散为单体,冻干蛋白或高浓度蛋白溶液中蛋白分子往往凝聚为多聚体大分子,可同时与多个胶体金粒子结合,影响标记的灵敏度和定量分析。
(3)使蛋白具有适当的分子量。
蛋白分子量过小(30 kD ),形成的蛋白复合体往往是不稳定,可短时间内失活。
而分子量过大时,被认为影响探针的灵敏度,特别是已知蛋白的结构与活性中心的情况下,去除对活性武影响的结构部分是提高标记灵敏度,延长探针寿命(防止凝集)的有效办法。
把分子量过小的蛋白与其它蛋白(如BSA,牛血清蛋白等)结合后,能制备出稳定性更佳的探针。
当蛋白前处理完成后,接着要确定胶体金与蛋白结合的最佳pH值。
对于理化性质不确定的蛋白这一步尤为重要。
过量的蛋白与不同pH值得胶体金结合后,只有某一特定pH值能够形成结合最稳定的探针。
在高浓度电解质(如NaCI)作用下不会凝聚。
不同蛋白的适宜pH范围的宽窄大不相同。
一般选择最小适宜pH值为最佳pH值。
但有些探针的实际情况并不完全如此,最稳定发探针并不完全代表活性最好。
这要靠实验验证。
在确定最佳pH值后,最后要确定最小蛋白量,即能够形成稳定探针的蛋白的最小量。
如果在制备探针时加入太多的蛋白,不仅造成浪费,而且更为严重的是容易造成探针凝聚,并严重影响标记活性。
因为探针溶液中的游离蛋白容易抢先与标记位点结合,起到“封闭”(Blocking )作用,而胶体金探针标记不上。
在标记位点希少、被标记物含量较少的情况下要特别注意。
这里需要特别指出的是,使用不同直径的胶体金与同一蛋白结合时,除了蛋白量完全不同外,往往最佳pH也有一定变化。
因此,在探针制备每一环节应随时监测探针对分布情况、负染结合及活性。
1、抗血清的前处理一般抗血清中IgG的含量为10-25%,而绝大部分为其它蛋白。
用抗血清直接制备探针其标记活性与特异性均不理想。
因此需去除其中多数杂蛋白。
但处理环节不宜太繁,在实验室设备与经验缺乏的情况下更是如此,否则会导致IgG活性的大幅降低。
如果你的实验室在蛋白纯化方面有很强的技术支持,高度纯化后效果会更好。
大量工作表明,只用硫酸铵沉淀就可以得到足够纯度及高活性的IgG蛋白。
其基本步骤如下:(1) 取抗血清0.2 ml ;(2) 加生理盐水(0.85 % NaCI) 0.3 ml,混匀;(3) 逐滴加入饱和(NH4)2SO4 0.5 ml,充分振荡混匀,4C静置1 h;(4) 10000 rpm/min 离心20 min,弃上清;(5) 加0.5 ml生理盐水重悬浮,混匀;(6) 逐滴加0.25 ml饱和(NH4)2SO4,充分振荡混匀,4C静置1 h;(7) 10000 rpm/min 离心20 min,弃上清;(8) 重复5〜8步骤一次;(9) 加生理盐水0.5 ml重悬浮,混匀;(10) 生理盐水中透析12〜24 h;(11) 在0.2 M pH 9.0硼酸缓冲液透析12〜24 h;(12) 分装,即将使用时4C保存,备用-20C保存。
为最大限度保持抗体活性,整个过程应在4C下进行。
对于冻干抗血清或长时间保存的血清,将生理盐水透析改为3M KCNS透析,促使聚合的多聚体解聚。
如果抗血清效价较低时,不宜准备胶体金探针。
2、亲和纯化抗体的处理亲和纯化抗体多是一些商品化的通用抗体,即二抗。
一般为羊抗兔、羊抗鼠或羊抗人的抗体。
这些抗体一般有两个问题,一是IgG分子往往聚集为多聚体分子,二是往往含有较多的盐分。
因此前处理的目的在于脱盐和解聚。
其基本步骤如下:(1) 将亲和纯化抗体用生理盐水稀释为0.5-1 mg/ml浓度(2) 在3 M KCNS (硫氰酸钾)溶液中透析12 h(3) 在2 mMol pH 9.0的硼酸缓冲液中透析12 h (更换透析液数次)(4) 分装备用其它蛋白可参考此方法进行。
但注意后一种透析液的pH值应与交联时pH值一致。
在实际运用中,一般省略去3M KCNS透析这一步,特别是当蛋白分子量较小,且为非糖蛋白时。
我们建议在制备通用探针(如二抗IgG,Protein A,Protein G,Streptavidin)等时,严格使用该方法,而制备直接标记探针时,也可以忽略处理步骤。
3、IgG Fab片段的制备一般来说体积较小的探针具有相对较高的标记活性。
主要原因在于胶体金颗粒较小时有利于在标记溶液中的扩散运动;在胶体金直径一定时,蛋白分子量越小,金表面吸附的蛋白分子越多,活性位点也越密集,也容易于靶位点结合。
IgG分子量为150 kD左右,由4个亚基组成,即两条重链(H)和两条轻链(L)。
用水解酶(木瓜蛋白酶)水解后可得到两种片段,即Fab和Fc。
其中Fab是具有抗原识别活性的部分,回收后制备探针。
Fc能够与Protein A和Protein G特异性结合。
但这种分离只能在有条件的实验室进行。
其基本过程如下:(1) 用PBS( pH 7.0,含10 mM EDTA,20 mM盐酸半胱氨酸)溶解纯化的IgG(2) 加固化木瓜蛋白酶(3) 37 C 处理5h(4) 离心,去除固化木瓜蛋白酶(沉淀)(5) 过Protein G 柱(6) 纯化的Fab片段按前文方法做进一步处理注:Fab与胶体金结合的pH值为6.54、蛋白与胶体金结合最佳pH测定(例纤维素酶,pI未知)(1) 取若干个1.5ml试管,分别加入1 ml 10 nm胶体金;(2) 用25 mM K2CO3将pH 分别调为3, 4, 5, 6, 7, 8, 9, 10;(3) 取一96孔培养板,按pH从低到高分别将上述胶体金分别取100 I加入孔中,重复三次;(4) 每孔分别加入3 l浓度为1 mg/ml的纤维素酶,混合,室温下放置10-15 min ;⑸每孔分别加入20 I浓度为10% NaCI溶液,混合,室温下放置10 min;(6) 观察胶体金颜色变化,记录保持红色的最低pH(X);(7) 重复(1)-(5)步,pH 梯度为X-0.6 ;X-0.3 ;X ;X+0.3 ;X+0.6 ;X+1。
