第七章配位平衡与配位滴定精品PPT课件
合集下载
第七章配位滴定精品PPT课件

弱酸H6Y2+; b. 配位能力强;氨氮和羧氧两种配位
原子;
c. 与金属离子能形成多个多元环,配 合物的稳定性高;
d. 与大多数金属离子1∶1配位, 计算 方便;
NiY 结构
EDTA的六级解离平衡
H6Y2+ =H+ + H5Y+ H5Y+ =H+ + H4Y H4Y =H+ + H3YH3Y- =H+ + H2Y2H2Y2- =H+ + HY3HY3- =H+ + Y4-
螯合剂: 乙二胺,EDTA等 H 2C H 2C
H2
H2
N
N
CH2
Cu
CH2
N
N
H2
H2
10/21/2020
乙二胺 - Cu2+
4
EDTA的存在形式
HOOCH2C
CH2COO-
:: ::
·· ··
NH+ C C NH+
H2 H2
-OOCH2C
CH2COOH
乙二胺四乙酸 (H4Y)
乙二胺四乙酸二钠盐 (Na2H2Y)
10/21/2020
11
该螯合物的特点
1.普遍性 : EDTA能与几十种金属离子配位。
2.组成一定:除少数高价金属离子外,一般 都形成 M︰Y4-=1︰1的螯合物
3.稳定性强
4.易溶于水
10/21/2020
12
(二)、EDTA与金属配合物及其稳定性
EDTA在溶液中的存在形式
在高酸度条件下,EDTA是一个六元弱酸,
10/21/2020
8
EDTA: -pH图
1.0
原子;
c. 与金属离子能形成多个多元环,配 合物的稳定性高;
d. 与大多数金属离子1∶1配位, 计算 方便;
NiY 结构
EDTA的六级解离平衡
H6Y2+ =H+ + H5Y+ H5Y+ =H+ + H4Y H4Y =H+ + H3YH3Y- =H+ + H2Y2H2Y2- =H+ + HY3HY3- =H+ + Y4-
螯合剂: 乙二胺,EDTA等 H 2C H 2C
H2
H2
N
N
CH2
Cu
CH2
N
N
H2
H2
10/21/2020
乙二胺 - Cu2+
4
EDTA的存在形式
HOOCH2C
CH2COO-
:: ::
·· ··
NH+ C C NH+
H2 H2
-OOCH2C
CH2COOH
乙二胺四乙酸 (H4Y)
乙二胺四乙酸二钠盐 (Na2H2Y)
10/21/2020
11
该螯合物的特点
1.普遍性 : EDTA能与几十种金属离子配位。
2.组成一定:除少数高价金属离子外,一般 都形成 M︰Y4-=1︰1的螯合物
3.稳定性强
4.易溶于水
10/21/2020
12
(二)、EDTA与金属配合物及其稳定性
EDTA在溶液中的存在形式
在高酸度条件下,EDTA是一个六元弱酸,
10/21/2020
8
EDTA: -pH图
1.0
第7章 配位平衡和配位滴定法

第7章 配位平衡和配位滴定法
本章主要内容: 第一节 配位化合物的基本概念 第二节 配位平衡 第三节 配位滴定法
配位化合物的生物医药应用
实验
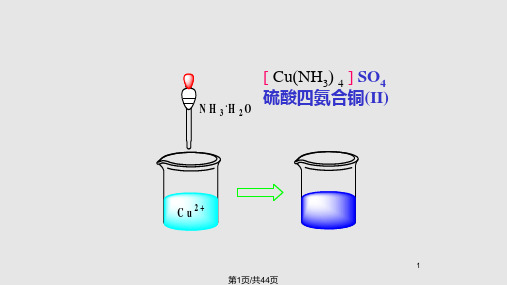
CuSO4溶液 适量氨水
(浅蓝色)
乙醇
[Cu(NH3)4]SO4晶体
(深蓝色)
Cu2(OH)2SO4
↓
过量氨水
(蓝色)
[Cu(NH3)4]2+
(深蓝色)
N
N
N
N
名称 草酸根
乙二胺
邻菲罗啉
联吡啶 乙二胺 四乙酸
缩写符号 (OX) (en)
(o-phen) (bpy)
(H4edta)
CH2 H2N
CH2 NH2
NN
乙二胺(en)
联吡啶(bpy)
O O 2–
N
N
1,10-二氮菲(邻菲咯啉)
CC
O• •
O• •
C2O42-
3.配体数和配位数
配体数:配合物中配体的总数 配位数:与中心原子结合成键的配位原子的数目 单基配体形成的配合物:
配体命名顺序
同类配体中配位原子相同,较少原子数的配体在前, 较多原子数的配体列后
例:[Pt(NH3)2 (NH2OH)NO2]Cl 氯化一硝基 ·二氨·一羟胺合铂(Ⅱ)
配离子为阴离子,则在配离子与外界阳离子之间用
“酸”字连接;若外界为氢离子,则在配离子之后缀以
“酸”字,即“某酸”。
K[Al(OH)4]
1、配合物的命名顺序 内外界顺序与一般无机化合物的命名原则相同。 阴离子名称在前,阳离子名称在后。
2、内界(配离子)的命名顺序
配体数
配体名称
合
(汉字数字) (不同配体间用圆点·分开)
本章主要内容: 第一节 配位化合物的基本概念 第二节 配位平衡 第三节 配位滴定法
配位化合物的生物医药应用
实验
CuSO4溶液 适量氨水
(浅蓝色)
乙醇
[Cu(NH3)4]SO4晶体
(深蓝色)
Cu2(OH)2SO4
↓
过量氨水
(蓝色)
[Cu(NH3)4]2+
(深蓝色)
N
N
N
N
名称 草酸根
乙二胺
邻菲罗啉
联吡啶 乙二胺 四乙酸
缩写符号 (OX) (en)
(o-phen) (bpy)
(H4edta)
CH2 H2N
CH2 NH2
NN
乙二胺(en)
联吡啶(bpy)
O O 2–
N
N
1,10-二氮菲(邻菲咯啉)
CC
O• •
O• •
C2O42-
3.配体数和配位数
配体数:配合物中配体的总数 配位数:与中心原子结合成键的配位原子的数目 单基配体形成的配合物:
配体命名顺序
同类配体中配位原子相同,较少原子数的配体在前, 较多原子数的配体列后
例:[Pt(NH3)2 (NH2OH)NO2]Cl 氯化一硝基 ·二氨·一羟胺合铂(Ⅱ)
配离子为阴离子,则在配离子与外界阳离子之间用
“酸”字连接;若外界为氢离子,则在配离子之后缀以
“酸”字,即“某酸”。
K[Al(OH)4]
1、配合物的命名顺序 内外界顺序与一般无机化合物的命名原则相同。 阴离子名称在前,阳离子名称在后。
2、内界(配离子)的命名顺序
配体数
配体名称
合
(汉字数字) (不同配体间用圆点·分开)
配位平衡和配位滴定法PPT课件
第2页/共44页
形成配合物的条件
配位键是配合物与其它物质最本质的区别
第3页/共44页
第4页/共44页
(1)中心原子:
中心原子又称中心体。根据配位化合物的 定义,中心原子是配合物中具有接受孤对 电子或能提供空轨道的离子或原子。
例: [SiF6]2-
[FeF6]3- Fe(CO)5 Ni(CO)4
22
第22页/共44页
4.无外界的配合物
[Ni(CO)4] 四羰基合镍 [Pt(NH3)2Cl2] 二氯•二氨合铂(Ⅱ)
第23页/共44页
练习:命名下列配合物
Cu(3)N 4SH O 4 硫酸四氨合铜(Ⅱ) K3Fe(NC 6S) 六异硫氰根合铁(Ⅲ)酸钾
Cu(3)N 4(H O2H)氢氧化四氨合铜(Ⅱ) Co2)(3(N N 3)O 3H三硝基•三氨合钴(Ⅲ)
EDTA配合物的结构
第10页/共44页
第11页/共44页
不是配体
(3) 配位数(coordination number) 的数目 配合物中,直接与中心原子配合的配位原 子的数目称为中心原子的配位数。
单齿配体: 配位数 = 配体的总数 多齿配位体:配位数 = 配体数*齿数
第12页/共44页
[Ca(EDTA)]2-或CaY2-
④同一金属离子,配体离子半径越大,配位数越小
如[AlF6]3- , [AlCl4]-
第16页/共44页
4、 配离子的电荷
配离子的电荷数 = 中心离子与配位体电荷的 代数和
如[Fe(CN)6]x x = 3 + (-1) 6 = 3
可由外界离子所带的电荷总数求得
[Co(en)3]Cl3
[Co(en)3]3+
形成配合物的条件
配位键是配合物与其它物质最本质的区别
第3页/共44页
第4页/共44页
(1)中心原子:
中心原子又称中心体。根据配位化合物的 定义,中心原子是配合物中具有接受孤对 电子或能提供空轨道的离子或原子。
例: [SiF6]2-
[FeF6]3- Fe(CO)5 Ni(CO)4
22
第22页/共44页
4.无外界的配合物
[Ni(CO)4] 四羰基合镍 [Pt(NH3)2Cl2] 二氯•二氨合铂(Ⅱ)
第23页/共44页
练习:命名下列配合物
Cu(3)N 4SH O 4 硫酸四氨合铜(Ⅱ) K3Fe(NC 6S) 六异硫氰根合铁(Ⅲ)酸钾
Cu(3)N 4(H O2H)氢氧化四氨合铜(Ⅱ) Co2)(3(N N 3)O 3H三硝基•三氨合钴(Ⅲ)
EDTA配合物的结构
第10页/共44页
第11页/共44页
不是配体
(3) 配位数(coordination number) 的数目 配合物中,直接与中心原子配合的配位原 子的数目称为中心原子的配位数。
单齿配体: 配位数 = 配体的总数 多齿配位体:配位数 = 配体数*齿数
第12页/共44页
[Ca(EDTA)]2-或CaY2-
④同一金属离子,配体离子半径越大,配位数越小
如[AlF6]3- , [AlCl4]-
第16页/共44页
4、 配离子的电荷
配离子的电荷数 = 中心离子与配位体电荷的 代数和
如[Fe(CN)6]x x = 3 + (-1) 6 = 3
可由外界离子所带的电荷总数求得
[Co(en)3]Cl3
[Co(en)3]3+
配位滴定法-PPT课件全

[Ca’]1 =
0.02
0.1000(初始钙浓度) 20.00+19.98
= 0.02 0.1000(初始钙浓度) / 2 39.98 / 2
0.02
C sp ca2
39.98 / 2
1.0
103
C sp ca2
PCa’1
3.0
log
C sp ca2
滴定至100.1%时
[Ca’]2
=
[CaY [Y’]2 K
sp
100%
cM(SP)
稳定常数定义可知
化学计量点时:
K' MY
[MY ]sp [M ']sp[Y ']sp
滴定终点时:
K' MY
[MY ]ep [M ']ep[Y ']ep
取对数后分别为
pM
' sp
pYs'p
lg
K
' MY
lg[MY ]sp
pM
' ep
pYe'p
lg
K
' MY
lg[MY ]ep
接近化学计量点 [MY ]sp [MY ]ep
pM ' pY ' 0
化学计量点时[MY] sp
CM (sp)
K' MY
[MY ]sp [M ']sp[Y ']sp
所以 [M ']sp =[Y ']sp =
CM (sp) K'
MY
Y' M'
TE(%) ep
ep 100%
cM(sp)
Y' 10pY' M' 10pM'
无机及分析化学 第7章 配位化合物与配位解离平衡讲课讲稿

配位数 配位数
7.1 配位化合物的组成和命名
1 配位化合物的组成
配离子电荷 配离子电荷等于中心离子和配体两者电荷的代数和。
(+3)
[Fe(CN)6]3-(赤血盐)
(+2)
[Fe(CN)6]4-(黄血盐) [Fe(CO)5]
?配合物内界是否一定带电
7.1 配位化合物的组成和命名2 配位化合物的命名配体 Nhomakorabea 配位原子
练习:
[Cu(NH3)4]SO4
K3[Fe(NCS)6] [Fe(CO)5]
7.1 配位化合物的组成和命名
1 配位化合物的组成
中心离子(或原子)
➢ 一般为带正电的过渡金属离子 [Co(NH3)6]3+, [Fe(CN)6]4-, [HgI4]2-
➢ 电中性原子:Ni(CO)4 , Fe(CO)5 , Cr(CO)6 ➢ 非金属元素原子:SiF62- , PF6-
◆难点内容:配位化合物的解离平衡常数,配位平衡移 动的计算。
主要章节
79.1.1配核位外化电合子物的的运组动成状和态命名 7.2 配离子在溶液中的解离平衡
7.1 配位化合物的组成和命名
1 配位化合物的组成
实验例:CuSO4→加NaOH , 浅蓝色沉淀Cu(OH)2 →加氨 水 ,沉淀溶解,生产绛蓝色溶液
习惯名称
K4[Fe(CN)6]:黄血盐 Fe(C5H5)2: 二茂铁 K3[Fe(CN)6]: 红血盐 K[PtCl3(C2H4)]:蔡斯盐
系统名称
[Co(NH3)5H2O]Cl3 三氯化五氨·水合钴(Ⅲ)
Cu2[SiF6]
六氟合硅 (Ⅳ) 酸亚铜
7.1 配位化合物的组成和命名
2 配位化合物的命名
EDTA配位滴定法

'
或
lgαY(H) ≤ lg
+8 K稳 ( MY )
(7-12)
由上式可求出各种离子能被准确滴定的最大lgαY(H),然 后查表7-2可得各种金属离子能被EDTA定量滴定的最高酸度 或最低pH值。 pH值越大,对准确滴定越有利。但是,随着 pH值增大,金属离子可能会发生水解,或形成多羟基配合物, 甚至形成氢氧化物沉淀,反而不能准确滴定或根本无法滴定。 因此,准确滴定单一金属离子的最高pH值,可根据氢氧化物 的沉淀溶解平衡计算。
上页 下页 返回 帮助
§7–3 EDTA配位滴定法
第七章 配位平衡与配位滴定
上 下页 返回 帮助
§7–3 EDTA配位滴定法
第七章 配位平衡与配位滴定
' 【例4】计算pH=20和pH=50时,ZnY的 K 稳 ( MY )
解
lg K 由附录四可知, 稳( ZnY ) = 1650。
(1)当pH = 2时,由表7-2查得lgα
Y(H)
= 1351
' lg K 稳 lg K ( ZnY ) = 稳( ZnY ) –lgαY(H) = 1650–1351 = 299
§7–3 EDTA配位滴定法
第七章 配位平衡与配位滴定
图中,δ为分布系数,如 [Y ] δY = [Y ' ]
(7-4)
[Y‘] = [H6Y2+ ] + [H5Y+] + … +[Y](为简化也可省去离子电荷 符号)。从图可知,在不同pH时,EDTA的主要存在形式如表71所示: 表7-1 不同pH时EDTA的主要存在形式
上页 下页 返回 帮助
§7–3 EDTA配位滴定法
第七章 配位平衡与配位滴定
或
lgαY(H) ≤ lg
+8 K稳 ( MY )
(7-12)
由上式可求出各种离子能被准确滴定的最大lgαY(H),然 后查表7-2可得各种金属离子能被EDTA定量滴定的最高酸度 或最低pH值。 pH值越大,对准确滴定越有利。但是,随着 pH值增大,金属离子可能会发生水解,或形成多羟基配合物, 甚至形成氢氧化物沉淀,反而不能准确滴定或根本无法滴定。 因此,准确滴定单一金属离子的最高pH值,可根据氢氧化物 的沉淀溶解平衡计算。
上页 下页 返回 帮助
§7–3 EDTA配位滴定法
第七章 配位平衡与配位滴定
上 下页 返回 帮助
§7–3 EDTA配位滴定法
第七章 配位平衡与配位滴定
' 【例4】计算pH=20和pH=50时,ZnY的 K 稳 ( MY )
解
lg K 由附录四可知, 稳( ZnY ) = 1650。
(1)当pH = 2时,由表7-2查得lgα
Y(H)
= 1351
' lg K 稳 lg K ( ZnY ) = 稳( ZnY ) –lgαY(H) = 1650–1351 = 299
§7–3 EDTA配位滴定法
第七章 配位平衡与配位滴定
图中,δ为分布系数,如 [Y ] δY = [Y ' ]
(7-4)
[Y‘] = [H6Y2+ ] + [H5Y+] + … +[Y](为简化也可省去离子电荷 符号)。从图可知,在不同pH时,EDTA的主要存在形式如表71所示: 表7-1 不同pH时EDTA的主要存在形式
上页 下页 返回 帮助
§7–3 EDTA配位滴定法
第七章 配位平衡与配位滴定
《配位平衡教学》课件

登录
课件界面:熟悉课件界面,了 解各个功能模块的位置和作用
课件操作流程
打开PPT课件,选择“开 始”选项卡
点击“新建幻灯片”按钮, 选择“空白”或“标题和 内容”模板
在幻灯片中输入标题和内 容,使用“插入”选项卡 添加图片、表格等元素
使用“动画”选项卡为幻 灯片添加动画效果
点击“幻灯片放映”按钮, 预览课件效果
实验目的:了解配位平衡的 基本原理和实验方法
实验步骤:配制溶液、滴定、 记录数据、分析结果等
实验注意事项:注意安全、 准确操作、认真记录等
配位平衡应用实例
化学实验:配位 平衡在化学反应 中的应用
生物医学:配位平 衡在药物设计和生 物医学中的应用
环境科学:配位 平衡在环境污染 治理中的应用
材料科学:配位平 衡在新材料设计和 合成中的应用
配位平衡教学 PPT课件内容
配位平衡基本概念
配位平衡:指在化学反应中,一种物质与另一种物质形成稳定的化学键的过程 配位平衡常数:描述配位平衡状态的常数,用于衡量配位平衡的程度 配位平衡反应:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的反应 配位平衡原理:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的原理
教学方法效果评估
学生参与度:观察学生在课堂上的参与程度,如回答问题、讨论等 学习成果:通过测试、作业等方式评估学生的学习成果 教学方法适用性:根据学生的反馈和教师的观察,评估教学方法的适用性
教学方法创新性:评估教学方法的创新性和独特性,是否对学生的学习产生积极影响
教学方法改进建议
采用互动式教学, 增加学生参与度
感谢您的观看
汇报人:
在播放过 程中,可 以通过点 击“结束” 按钮来结 束播放
课件界面:熟悉课件界面,了 解各个功能模块的位置和作用
课件操作流程
打开PPT课件,选择“开 始”选项卡
点击“新建幻灯片”按钮, 选择“空白”或“标题和 内容”模板
在幻灯片中输入标题和内 容,使用“插入”选项卡 添加图片、表格等元素
使用“动画”选项卡为幻 灯片添加动画效果
点击“幻灯片放映”按钮, 预览课件效果
实验目的:了解配位平衡的 基本原理和实验方法
实验步骤:配制溶液、滴定、 记录数据、分析结果等
实验注意事项:注意安全、 准确操作、认真记录等
配位平衡应用实例
化学实验:配位 平衡在化学反应 中的应用
生物医学:配位平 衡在药物设计和生 物医学中的应用
环境科学:配位 平衡在环境污染 治理中的应用
材料科学:配位平 衡在新材料设计和 合成中的应用
配位平衡教学 PPT课件内容
配位平衡基本概念
配位平衡:指在化学反应中,一种物质与另一种物质形成稳定的化学键的过程 配位平衡常数:描述配位平衡状态的常数,用于衡量配位平衡的程度 配位平衡反应:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的反应 配位平衡原理:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的原理
教学方法效果评估
学生参与度:观察学生在课堂上的参与程度,如回答问题、讨论等 学习成果:通过测试、作业等方式评估学生的学习成果 教学方法适用性:根据学生的反馈和教师的观察,评估教学方法的适用性
教学方法创新性:评估教学方法的创新性和独特性,是否对学生的学习产生积极影响
教学方法改进建议
采用互动式教学, 增加学生参与度
感谢您的观看
汇报人:
在播放过 程中,可 以通过点 击“结束” 按钮来结 束播放
配位化合物与配位滴定法—配合物的解离平衡(基础化学课件)

K稳越大,Ksp越大沉淀越易溶解生成配离子。
3、氧化还原反应对配位平衡的影响
氧化还原反应可改变金属离子的浓度,使 配位平衡移动。
➢在氧化还原平衡体系中加入配位剂能与其中
的氧化剂或还原剂反应生成稳定的配合物,使 金属离子浓度发生改变(即电极电势E改变)而 改变氧化还原反应的方向。
例如:
在血红色的Fe(SCN)3溶液中加入SnCl2,血红色消失。
练习
例 : 若 只 考 虑 酸 效 应 , 计 算 pH=1.0 和 pH=6.0 时 PbY的lgK‘PbY值。
配位平衡移动
(配位平衡与其它平衡一样遵循吕·查德原理 )
1、酸度对配位平衡的影响 配位体的酸效应(配体与H+结合使配离子稳定性降低的作用)
[Cu(NH3)4]2+
Cu2+ + 4NH3
L MLn
M(L)
=
[M'] [M]
主反应 辅助配位效应引起的副反应
3、配合物的条件稳定常数(有效稳定常数)
配位反应 M + Y
MY
副反应系数
αY(H)
稳定常数
K MY
[MY ] [M ][Y ]
条件稳定常数 K 'MY [MY ] [M ][Y ']
lgK’MY = lgKMY - lg αY(H)
平衡移动方向
+ 4H+
4 NH4+
酸度↑(PH越低) →配位体浓度↓→配离子稳
定性降低(酸效应越强)。
水解效应(金属离子与OH-结合使配离子稳定性降低的作用)
[FeF6]3-
Fe3+ + 6F-
平衡移动方向
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一节 配位化合物
一、配合物的定义
许多化合物可看似由简单化合物“加合”而成,例如:
Cu4 S 4N O 3 H [Cu 3)4 (]S N 4O H S4 i F2H F H 2[S6]iF
Ni4CO [Ni(C4]O)
在化合过程中,既没有质子的传递,又没有形成新的传统意义的 共价键。实际上,它们是形成了复杂离子的配位化合物(简称配合物)。
2、配位体和配位原子
与中心离子或中心原子结合的中性分子或阴离子成为配位体,简 称配体。直接与中心离子或原子以配位键结合的原子称为配位原子。
单齿配体-----提供一对孤对电子的配体 多齿配体-----两个及以上的原子提供多对孤对电子的配体
(形成螯合物)
基础化学
第七章 配位平衡与配位滴定
3、配位数---中心原子结合的配位原子总数 多为2 3 4 5 6 7 8,与中心离子电荷有关,与配位体有关。
外界
[Fe(CN)6]3+
配
离
中配 心体 原
子
配 位 数
配 离 子 电
子
荷
基础化学
第七章 配位平衡与配位滴定
1、中心离子(或原子)
中心离子(或中心原子)是配合物的形成体,位于配合物的中心,一
般 为 带 正 电 荷 的 金 属 离 子 或 中 性 原 子 。 例 如 [ Cu(NH3)4 ] SO 4 中 的 Cu2+, H2[SiF6] 中的Si2+等。
H2[PtCl6] [Cu(NH3)4]SO4
六氯合铂(Ⅳ)酸 K4[Fe(CN)6] 硫酸四氨合铜(Ⅱ) [PtCl4(NH3)2]
六氰合铁(Ⅱ)酸钾 四氯·二氨合铂(Ⅳ)
[Co(NH3)5(H2O)]Cl3 [Co(NH3)6]Cl3
(三)氯化五氨·(一)水合钴(Ⅲ) (三)氯化六氨合钴(Ⅲ)
基础化学
第七章 配位平衡与配位滴定
基础化学
第七章 配位平衡与配位滴定
31 教学基本要求 2 第一节 配位化合物
3 第二节 配合物在水溶液中的稳定性 4 第三节 EDTA配位滴定法
基础化学
第七章 配位平衡与配位滴定
知识目标:
1.掌握配合物的组成、命名、化学式的写法; 2.掌握配离子的稳定常数及其有关计算; 3.理解EDTA滴定法原理; 4.掌握EDTA滴定应用。
4、配离子电荷---中心离子与配位体电荷代数和
5、配位化合物的类型
1)简单配位化合物-----单齿配位体与单个中心离子(或原子) 所形成的配合物。
K2 [PtCl6] [Fe(H2O)6] Cl3 [Cr(H2O)6] Cl3 Na3[AlF6] 2)螯合物----由中心离子和多齿配体结合而成的环状配合物。
其中,[Cu(NH3)4]2+、[SiF]2-称为配离子,配离子与带有异种电 荷的离子组成了中性化合物,如[Cu(NH3)4]SO4,H2[SiF]2-称为 配合物。不带电荷的中性分子,如[Ni(CO)4],称为配合分子或中性
配合物。
基础化学
第七章 配位平衡与配位滴定
原子间的共用电子对由一个原子提供的共价键称为配位共 价键,简称配位键。由配位键形成的复杂化合物称为配位化 合物,简称配合物。
H2C H2C
NH2 Cu
NH2
NH2 NH2
CH2 2+ CH2
基础化学
第七章 配位平衡与配位滴定
3)多核配合物 在一个配合物中有2个或2个以上中心离子的配合物。 [Re2Cl8]24)其他配合物
配位聚合物
基础化学
第七章 配位平衡与配位滴定
三、配合物的命名
配合物的命名遵循一般无机化合物的命名原则,在配合物中, 命名时阴离子在前,阳离子在后,阴阳离子之间加“化”字或 “酸” 字;配合物内界的命名顺序为:配体数→配体→“合”→ 中心离子(或原子)(氧化数)。其中,配体数用汉语数字一、二、 三、……表示,“一”常省略;中心离子(或原子)的氧化数以罗 马数字Ⅰ、Ⅱ、Ⅲ、……标出。
阴离子先于中性分子
配合物中含有不同的 配体配体的命名顺序为:
无机物先于有机物 简单配体先于复杂配体
基础化学
第七章 配位平衡与配位滴定
同类配体的名称,可按配位原子的元素符号在英文字母中 的顺序排列,例如NH3与H2O同为配位体时,NH3排列在前,H2O排 列在后。又例如Br-、Cl- 同为配位体时,溴排列在前,氯排列 在后。下面举一些命名实例:
第七章 配位平衡与配位滴定
基础化学
第七章 配位平衡与配位滴定
补充 螯合物
1 螯合物的生成 由中心离子和多齿配体结合而成的环状配合物。
H2C H2C
NH2 Cu
NH2
NH2 NH2
CH2 2+ CH2
对螯合剂(形成螯合物的多基配体称为螯合剂)的要求: 1、同一配体须含两个及以上的配位原子; 2、配体的配位原子应有一定的间隔; 3、常见的螯合剂:大多是含N、S、O等配位原子的有机分子 或离子如 en,EDTA,C2O42-等。
基础化学
第七章 配位平衡与配位滴定
能力目标:
1.能够熟练书写配位化合物的化学式,配位化合物的 命名;
2.能够熟练准确找出中心离子、配位体、配位原子和 配位数;
3.能够运用配位平衡的知识计算出配合物溶液中各离 子浓度;
4.能够利用KMY讨论EDTA配位滴定的条件。
基础化学
第七章 配位平衡与配位滴定
配离子 一个离子(或原子)与其他离子或原子以配位键结 合,形成的具有一定特性的复杂离子(似弱电解质)。
基础化学
第七章 配位平衡与配位滴定
二、配合物的组成
内界: 中心体(原子或离子)与配位体,以配位键成键; 外界:与内界电荷平衡的反离子。
[Co(NH3)6]Cl3
中心 配体 原子
内︸界
(配位化合物)
2 螯合物的一般性质
1)螯合物的稳定性 具有螯环结构的配离子比一般的配离子具有较大的稳定性:
[Ni(NH3)6]2+:Kf = 9.1×107 [Ni(en)3]2+: Kf = 3.9×1018 螯环的形成而使配离子稳定性显著增强的作用称为螯合效应。
产生螯合效应的原因:
基础化学
第七章 配位平衡与配位滴定
螯合物通常具有五员环或六员环,可以带电荷或是电 中性分子(内配盐,在水中溶解度较小)。
基础化学
第七章 配位平衡与配位滴定
EDTA与金属离子生成的配合物中通常含有五个五员环:
基础化学
第七章 配位平衡与配位滴定
N
NN
N
M
N
NN
N
六员环螯合物
基础化学
第七章 配位平衡与配位滴定
