环化第三章
化工导论第三章

3.3.2 烃类裂解过程的二次反应 ● 烃类裂解二次反应指乙烯、丙烯继续反应生成炔 烃、二烯烃、芳烃和焦炭的反应。 烯烃的聚合、环化、缩合等反应 2C2H4 → C4H6 + H2 C2H4+ C4H6 → 苯+ H2 烯烃的生碳和生焦反应 C2H4 → C2H2 →方法和裂解炉
裂解方法分类
间接加热 最常用方法, 占99%
管式炉裂解 固定床 固体热载体 蓄热炉 砂子炉
流化床
熔盐炉
烃类裂解法
直接加热
液体热载体 气体热载体
高温蒸气裂解
自供热
部分氧化裂解
烃类热裂解流程图
裂解炉主要工艺设备要求: ① 管材要有较高的耐温性; ② 能迅速给烃类物质提供大量热; ③ 降温快。 3.3.4 裂解产物的急冷操作 ① 高温裂解气迅速降温,避免反应时间过长; ② 裂解产物初步分离; ③ 回收废热。
2、简述环氧乙烷生产的主要步骤和每个步骤的目的, 写出主要反应方程式。
可得到很多极有价值的衍生物。
3.5
石油化工系列产品
聚合
聚乙烯
环氧乙烷
塑料薄膜、成型制品
氧化
乙二醇
二氯乙烷 氯乙烯
涤纶、防冻剂、溶剂
乙烯
加氯
工程塑料、氯纶纤维
丙烯
共聚
乙丙橡胶
电线、电缆
3.5
3.5.1
石油化工系列产品
烯烃系列产品和用途
(2)丙烯 丙烯分子中含有双键和 α- 活泼氢而具有很高 的化学反应活性。在工业生产中,利用丙烯的加 成、氧化反应、羰基化、烷基化以及聚合反应, 可相应地合成一系列有机化工产品。
聚合
聚丙烯
丙纶、胶片、树脂制品
氧化
环化反应和开环课件

77%
4.2.2 阳离子环化反应 (Pericyclic Reaction on Cation)
阳离子环化是指涉及正碳离子中间体的环化反应。
1. 阳离子环化反应的特点
阳离子环化反应在自然界非常普遍,人们建立了许多体系 以模仿自然界的阳离子环化反应。
Example: 萜类和甾体化合物的生源合成
Example 1: 环酮a-自由基环化——石斛碱的合成
Example 2: Mn(Ⅲ)媒介的氧化自由基环化
自由基环化反应过程:
三乙酸锰——单电子氧化剂: 从含活泼亚甲基化合物的烯醇式
获得一个电子,形成亲电性的自由基
Ⅱ Ⅲ
Ⅲ
三乙酸锰: 促进烯醇化
自由基向碳碳双键加成: ——形成碳-碳s键
4.3 双边环化与环加成反应
Example :
2.Baldwin环化规则
环化反应难易的影响因素:
环的大小: 欲形成环的链上原子数目。
受进攻原子的杂化情况: sp3杂化( tet ); sp2杂化( trig ); sp2杂化( dig )。
断键方式: 内式( endo )电子向“环”内“流动”,形成较大的环;
﹡
﹡
一般[4+2]环加成,称为Diels-Alder反应,是有机合成
中最有用的反应之一,尤其在六元环系合成起着不可替代的
作用。
二烯体 亲二烯体 diene dienophile
双烯合成反应
形成2个s碳-碳键, 建立多样的环己烯 体系和多达4个手性 中心,较高的区域 选择性和立体选择 性
The Nobel Prize in Chemistry 1950
Baldwin环化规则不仅对亲核环化有效,也适用于自由基 环化反应和阳离子环化反应。
环化ppt1

二、环境化学
(Environmental Chemistry)
环境化学是在化学学科的传统理论和方法 环境化学是在化学学科的传统理论和方法 的基础上发展起来, 的基础上发展起来,以化学物质在环境中出现 和引起的环境问题为研究对象, 和引起的环境问题为研究对象,研究有害物质 在环境介质中的存在、化学特性、 在环境介质中的存在、化学特性、行为和效应 及其控制的化学原理和方法的科学。 及其控制的化学原理和方法的科学。
环境污染的具体表现: 环境污染的具体表现:
(1)有害物质对大气、 (1)有害物质对大气、水、土壤和动植物的污染并达到 有害物质对大气 致害的程度; 致害的程度; (2)生物界的生态系统遭到不适当的干扰和破坏; (2)生物界的生态系统遭到不适当的干扰和破坏; 生物界的生态系统遭到不适当的干扰和破坏 (3)不可再生资源被滥采滥用; (3)不可再生资源被滥采滥用; 不可再生资源被滥采滥用 (4)因固体废弃物、噪音、振动、恶臭、 (4)因固体废弃物、噪音、振动、恶臭、放射线等对环境 因固体废弃物 造成对环境的损害
环境化学的任务
研究有害化学物质在环境介质中的存在、 研究有害化学物质在环境介质中的存在、 化学特性、 化学特性、行为和效应及其控制的化学原理和 方法。 方法。 用化学的基本理论和方法发现和解决环境 问题。 问题。
环境化学的研究内容
(Study Contents )
浓度水平和形态; (1)有害物质在环境中存在的浓度水平和形态; )有害物质在环境中存在的浓度水平和形态 的来源, (2)潜在有害物质的来源,它们在个别环境介质中 )潜在有害物质的来源 和不同介质间的环境化学行为; 和不同介质间的环境化学行为; (3)有害物质对环境和生态系统以及人体健康产生 ) 效应的机制和风险性; 效应的机制和风险性; (4)有害物质已造成影响的缓解和消除以及防止产 ) 生危害的方法和途径。 生危害的方法和途径。
环化作业参考答案

T=t+273.15k=0+273.15k=273.15k μ =
������
������ 1.5 = × 10−6 ������������ + ������
273.151.5 × 10−6 0.065 × 273.15 + 14.7 = 1.39 × 10−4 (g/cm· s)
4. 将生物半致死浓度 LC50 的概念移用到细菌, 则表示处于污染物浓度为 LC50 的水介质中的细菌,其生化反应速率将降低至正常情况下的 50%。现已 知 异 养 好 氧 细 菌 的 Poct 参 数 与 LC50 ( mg/L ) 之 间 的 关 联 式 为 ������������ ������������������������=5.12-0.76������������ ������������������������,计算以下两种化合物的 LC50 值并比较它们对细 菌的毒性: ①二氯甲烷②氯苯。 已知它们的 lgPoct 数值分别为 1.26 和 2.84。 解:①二氯甲烷
=
������������������ ������������������
,并假定������������������ 值不随温度变
d ln ������ ������������ = dT R������ 2
得
ln
p2 Δ������������ 1 1 =− ×( − ) p1 ������ T2 T1
1. Freon-12(CCl2F2)正常沸点 Tb=243.4K,摩尔蒸发热������������������ =19.97kJ/mol, 求其在大气臭氧层(假定其温度为 233.0K)内的蒸气压。 已知蒸气压随温度变化的关系式为 化。 解:p1 = 101.3kpa 由
北京师范大学环境化学课件——环境化学 第三章 3-2

重金属迁移转化都可以用形态(SPECIATION) 概括无机污染物,特别是重金属和准金属等污染物,一旦进入水环境,均不能被生物降解,主要通过沉淀-溶解、氧化-还原、配合作用、胶体形成、吸附-解析等一系列物理化学作用进行迁移转化,参与和干扰各种环境化学过程和物质循环过程,最终以一种或多种形态长期存留在环境中,造成永久性的潜在危害。
天然水中颗粒物主要包括各类矿物微粒,含有铝、铁、锰、硅水合氧化物等无机分子,含有腐殖质、蛋白质等有机分子。
此外,还有油滴、气泡构成的乳状液和泡沫、表面活性剂等半胶体以及藻类、细菌、病毒等生物胶体。
水中颗粒物金属水合氧化物矿物微粒和粘土矿物腐殖质水体悬浮沉积物1. 水中颗粒物的类别金属水合氧化物Al、Fe、Mn、Si等金属的水合氧化物在天然水中以无机高分子及溶胶等形态存在,在水环境中发挥重要的胶体化学作用•Al在水中的主要形态:Al3+、Al(OH)2+、Al(OH)2+、Al(OH)3、Al(OH)4-、Al2(OH)24+等无机高分子•Fe在水中的主要形态:Fe3+、Fe(OH)2+、Fe2(OH)24+、Fe(OH)2+、Fe(OH)3、FeOOH等无机高分子•Mn与Fe类似,丰度较低,但是溶解度要高一些•H4SiO4聚合成无机高分子:Si n O2n-m(OH)2m矿物微粒和黏土矿物黏土矿物是由其他矿物经化学风化作用而生成,是天然水中最重要、最复杂的具有显著胶体化学特性的无机胶体微粒。
主要成分为铝或镁的硅酸盐,具有层状晶体结构。
黏土矿物的片层晶体基本是由两种原子层构成的,一种是硅氧四面体(硅氧片),另一种是铝氢氧原子层(水铝片),其间主要靠氢键连接,因此易于断裂开来。
石英、长石等不易破碎、颗粒较粗,缺乏黏结性;云母、蒙脱土、高岭石等硅酸盐黏土矿物,有胶体性质片层结构,容易破碎,具有黏性,可以生成稳定聚集体。
腐殖质已死的生物体在图扬中经微生物分解而形成的有机物质,主要指腐植酸,如富里酸、胡敏酸等。
环境化学(袁加程)第三章-水环境化学

3. 水体污染及水体污染源
主要的水环境污染物
悬浮物 植物性营养物 酸碱污染 难降解有机物 热污染
总碱度 = [HCO3-] + 2[CO32-] + [OH-] – [H+]
2. 天然水体中的化学平衡
酸度是指水中能与强碱发生中和作用的全部物质,亦即放 出H+或经水解能产生H+的物质总量。包括强酸、弱酸、强酸弱 碱盐等。
总酸度 = [H+] + [HCO3-] + 2[H2CO3] – [OH-]
第三章 水环境化学
第一节 水环境化学基础
天然水的基本特性 天然水体中的化学平衡 水体污染及水体污染源 水体的自净作用与水环境容量
1. 天然水的基本特性
1.1 天然水的组成
(1) 天然水的主要离子组成: K+, Na+, Ca2+, Mg2+, HCO3-, NO3-, Cl-, SO42- 为天然水中常 见的八大离子,占天然水离子总量的95-99%。
[HCO
3
]
K1[H2CO3 ] [H ]
[CO32- ]
K1K2[H2CO3 ] [H ]2
0
[H2CO3 ]
[H2CO3 ]
K1[H 2 CO 3 [H ]
]
K1K2[H2CO3 ] [H ]2
(1
K1 [H
]
K1 K 2 [H ]2
) 1
2. 天然水体中的化学平衡
环化课后习题答案

4. 在一个pH 为6.5、碱度为1.6mmol/L 的水体中,若加入碳酸钠使其碱化,问需加多少mmol/L 的碳酸钠才能使水体pH 上升至8.0。
若用NaOH 强碱进行碱化,又需加入多少碱?解:(1) 查表知pH = 6.5时, α= 1.710C T = [碱度]×α = 1.6×1.710 mmol/l = 2.736mmol/l 。
设加入的Na 2CO 3为n mmol/l查表知:当pH = 8.0时, α` = 1.018C T ` = C T + n ----------(1) C T `= [碱度]`×α` --------(2) [碱度]`= 1.6 +2 n --------(3)由 (1)、(2)和(3)解得:n = 1.07 mmol/l 。
(2)∵加入NaOH 后C T 不变 L mmol C T/688.2028.1736.2][===α碱度碱度的增加值就应是加入的NaOH 的量。
△A = [碱度]` - [碱度] = 2.688 - 1.6 = 1.088mmol/l5 具有2.00×10-3mol/L 碱度的水,pH 为7.00,请计算*23H C O ⎡⎤⎣⎦、3HCO -⎡⎤⎣⎦、23C O -⎡⎤⎣⎦和-O H ⎡⎤⎣⎦的浓度各是多少?(*23H C O ⎡⎤⎣⎦=4.49×10-4mol/L 、3HCO -⎡⎤⎣⎦=2.00×10-3mol/L 、23C O -⎡⎤⎣⎦=9.38×10-7mol/L 和-O H ⎡⎤⎣⎦=1.00×10-7mol/L ) 解:当pH = 7.00时,CO 3-的浓度与 HCO 3-的浓度相比可以忽略,查表pH = 7.00时, α= 1.224,则[HCO 3-] = [碱度] = 2.00×10-3mol/l/l 。
[H +] = [OH -] = 10-7 mol/l 。
化工原理第3章课后习题参考答案

第三章非均相物系的分离和固体流态化3. 在底面积为40m²的除尘室内回收气体中的球形固体颗粒。
气体的处理量为3600m³/h,固体的密度ρs=3600kg/m³,操作条件下气体的密度ρ=1.06kg/m³,粘度为3.4×10-5Pa•s。
试求理论上完全除去的最小颗粒直径。
解:理论上完全除去的最小颗粒直径与沉降速度有关。
需根据沉降速度求。
1)沉降速度可根据生产能力计算ut = Vs/A= (3600/3600)/40 = 0.025m/s (注意单位换算)2)根据沉降速度计算理论上完全除去的最小颗粒直径。
沉降速度的计算公式与沉降雷诺数有关。
(参考教材P148)。
假设气体流处在滞流区则可以按ut = d2(ρs- ρ)g/18μ进行计算∴dmin2 = 18μ/(ρs- ρ)g ·ut可以得到dmin= 0.175×10-4 m=17.53)核算Ret = dminutρ/μ< 1 ,符合假设的滞流区∴能完全除去的颗粒的最小直径d = 0.175×10-4 m = 17.5 μm5. 含尘气体中尘粒的密度为2300kg/m³,气体流量为1000m³/h,粘度为3.6×10-5Pa•s密度为0.674kg/m³,采用如图3-8所示的标准型旋风分离器进行除尘。
若分离器圆筒直径为0.4m,试估算其临界直径,分割粒径及压强降。
解:P158图3-7可知,对标准旋风分离器有:Ne = 5 ,ξ= 8.0 B = D/4 ,h = D/2(1) 临界直径根据dc = [9μB/(πNeρsui )]1/2 计算颗粒的临界直径其中:μ=3.6×10-5Pa•s;B = D/4=0.1m;Ne = 5;ρs=2300kg/m³;将以上各参数代入,可得dc = *9μB/(πNeρsui )+1/2 = *9×3.6×10×0.25×0.4/(3.14×5×2300×13.89)+1/2= 8.04×10-6 m = 8.04 μm(2)分割粒径根据d50 = 0.27[μD/ut(ρs- ρ)]1/2 计算颗粒的分割粒径∴d50 = 0.27[3.6×10-5×0.4/(13.889×2300)]1/2= 0.00573×10-3m = 5.73μm(3)压强降根据△P = ξ·ρui2/2 计算压强降∴△P = 8.0×0.674×13.8892/2 = 520 Pa7、实验室用一片过滤面积为0.1m2的滤叶对某种颗粒在水中的悬浮液进行实验,滤叶内部真空读为500mmHg,过滤5min的滤液1L,又过滤5min的滤液0.6L,若再过滤5min得滤液多少?已知:恒压过滤,△P =500mmHg ,A=0.1m,θ1=5min时,V1=1L;θ2=5min+5min=10min 时,V2=1L+0.6L=1.6L求:△θ3=5min时,△V3=?解:分析:此题关键是要得到虚拟滤液体积,这就需要充分利用已知条件,列方程求解思路:V2 + 2VVe= KA2θ(式中V和θ是累计滤液体积和累计过滤时间),要求△V3,需求θ3=15min时的累计滤液体积V3=?则需先求Ve和K。
3XX化学系第三章有机物和重金属在生物体内的富集

进入害虫体内将其麻醉。 • 对人类毒性很低。
DDT作用机理:是钠离子通道保持开放从而束 缚昆虫的神经细胞,这反而使其神经不受控制 地保持兴奋。
DDT失效:害虫很快产生抗药性。 DDT抗药性原因:害虫DDT酶催化DTT去氯化
氢反应生成DDE。
常用毒性大的: 对硫磷(1605)(parathion)、
甲基对硫磷(parathion methyl)
甲基内吸磷(1059)(demeton methyl)
毒性中等的: 敌敌畏(dichlorphos)
低毒的:
敌百虫(trichlorfon)
乐果(dimethoate)
马拉硫磷(malathion)等。
• 如Hg和Cd的致毒浓度范围低至0.001~0.01ppm (1-10ppb),它们能在生物体内逐步地、成千上万 倍地富集,如扇贝对Cd的富集因数高达22600,最后 可以通过食物链进入人体器官中积蓄起来。
瑞典某一汞污染的水域 生动物体内汞含量为0.3ppm 吃这种生动物的瑞典白鱼的汞含量3.1ppm 捕食瑞典白鱼的梭子鱼体内的汞含量高达5.8ppm 而人长期食用含汞5~6ppm的鱼就可能死亡。
对硫磷
3.6
(杀虫剂)
士的宁 尼古丁 黄曲霉素B 二噁英 肉毒毒素
2 1 0.009 0.001 0.000 01
有机化合物在水生生物体内的富集原理: 过去:通过食物链方式进行营养迁移,或生
物放大作用进行的 1971年:通过水和血液中脂肪层两相之间的
平衡交换方式进行的
辛醇-水分配系数(Kow): 有机物在水中的低溶解度可以通过它们对相
TCDD对哺乳动物也具有较大的毒性,表现为急性、慢 性和急慢性效应,在急性发作期间,肝是主要的受害器官。为 人类可疑化学致癌物。
高中化学 第三章 烃的含氧衍生物 3.3 教案 新人教版选修5(2021年整理)

安徽省望江县高中化学第三章烃的含氧衍生物3.3 教案新人教版选修5 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(安徽省望江县高中化学第三章烃的含氧衍生物3.3 教案新人教版选修5)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为安徽省望江县高中化学第三章烃的含氧衍生物3.3 教案新人教版选修5的全部内容。
第三节酯化反应教学目标知识技能:掌握酯化反应的原理、实验操作及相关问题,进一步理解可逆反应、催化作用.能力培养:培养学生用已知条件设计实验及观察、描述、解释实验现象的能力,培养学生对知识的分析归纳、概括总结的思维能力与表达能力。
科学品质:通过设计实验、动手实验,激发学习兴趣,培养求实、探索、创新、合作的优良品质。
科学方法:介绍同位素示踪法在化学研究中的使用,通过酯化反应过程的分析、推理、研究,培养学生从现象到本质、从宏观到微观、从实践到理论的科学思维方法。
教学方法:研究探索式,辅以多媒体动画演示。
课时安排:第1课时:乙酸的性质及酯化反应实验(本文略去乙酸的其它性质部分)第2课时:酯化反应问题讨论教学过程第一课时【过渡】我国是一个酒的国度,五粮液享誉海内外,国酒茅台香飘万里.“酒是越陈越香”。
你们知道是什么原因吗?【板书】乙酸的酯化反应【学生实验】乙酸乙酯的制取:学生分三组做如下实验,实验结束后,互相比较所获得产物的量。
第一组:在一支试管中加入3 mL乙醇和2 mL乙酸,按教材P71,图3—16连接好装置,用酒精灯缓慢加热,将产生的蒸气经导管通到盛有饱和碳酸钠溶液的接受试管的液面上,观察现象.第二组:在一支试管中加入3 mL乙醇,然后边振荡边慢慢加入2 mL浓硫酸和2 mL乙酸,按教材P71,图3—16连接好装置,用酒精灯缓慢加热,将产生的蒸气经导管通到盛有水的接受试管的液面上,观察现象。
绿色化学第三章课件
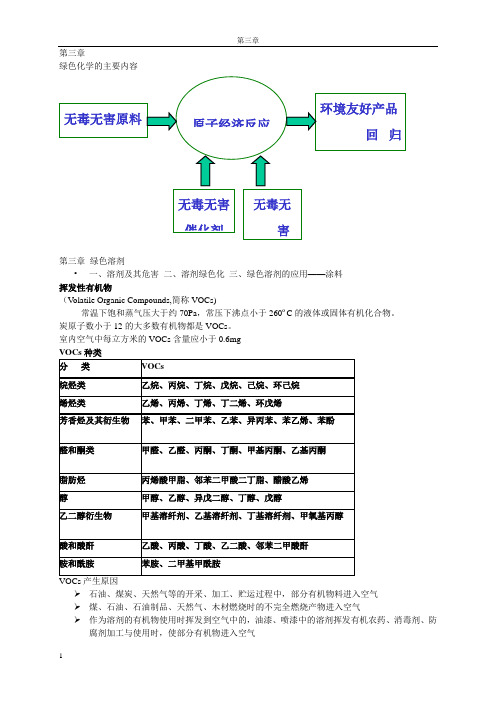
第三章绿色化学的主要内容第三章 绿色溶剂• 一、溶剂及其危害 二、溶剂绿色化 三、绿色溶剂的应用——涂料 挥发性有机物(V olatile Organic Compounds,简称VOCs)常温下饱和蒸气压大于约70Pa ,常压下沸点小于260ºC 的液体或固体有机化合物。
炭原子数小于12的大多数有机物都是VOCs 。
室内空气中每立方米的VOCs 含量应小于0.6mg➢ 石油、煤炭、天然气等的开采、加工、贮运过程中,部分有机物料进入空气 ➢ 煤、石油、石油制品、天然气、木材燃烧时的不完全燃烧产物进入空气➢ 作为溶剂的有机物使用时挥发到空气中的,油漆、喷漆中的溶剂挥发有机农药、消毒剂、防腐剂加工与使用时,使部分有机物进入空气➢ 各种合成材料、有机黏合剂及其他有机制品遇到高温时氧化与裂解,产生部分低分子有机污染物进入空气➢ 淀粉、脂肪、蛋白质、纤维素、糖类等氧化与分解时产生部分有机物进入空气 VOCs 的危害(1)大多数有毒,部分有致癌性;(2)大气中的氮氧化物、VOCs 与氧化剂发生光化学反应,生成光化学烟雾。
(3)卤烃类VOCs 可破坏臭氧层。
7. 致癌作用 苯是目前公认的致癌物 8. 致畸作用 溶剂绿色化目前研究的有效方法有: (一)、超临界流体(二)、离子溶液(三)、无溶剂化(四)、水溶液系统 (一)超临界流体➢ 超临界流体定义 超临界流体的性质 超临界流体的应用 超临界流体的优点和局限超临界流体(SCF )是指物质的温度和压力分别处在其临界温度和临界压力之上时的一种特殊的流体状态。
CO2 的相图高于临界温度和临界压力而接近临界点状态,称为超临界状态✓ 处于超临界状态时,气液两相性质非常接近,以至于无法分辨。
常见临界点• 超临界二氧化碳,其临界温度为31.06℃,临界压力为7.38Mp • 超临界水的临界点为374℃,22Mpa • 超临界甲醇为239℃,8.1Mpa 超临界流体的性质压力/MPaTc=31.06 温度/ºCPc=1.38超临界流体的主要特性1 密度类似液体,因而溶剂化能力很强,压力和温度微小变化可导致其密度显著变化2 压力和温度的变化均可改变相变3 粘度, 扩散系数接近于气体,具有很强传递性能和运动速度4 介电常数,极化率和分子行为与气液两相均有着明显的差别 超临界流体的应用超临界流体对化学反应几种效应1 可降低某些温度较高的氧化反应温度2 提高或维持非均相催化剂的活性3 提高反应速率, 改变反应历程4 使反应得以在均相中进行,并创造有利于产物从反 应区移去的条件, 实现反应与分离的一体化5 采用无毒害的超临界流体为溶剂, 既有效的利用资源,又达到对环境友好的目的 超临界二氧化碳作为溶剂的优点• 二氧化碳是超临界流体技术中最常用的溶剂,它的临界温度为31.5℃,可在室温下实现超临界操作;临界压力为7.37Mpa ,也不算高,设备加工并不困难,能耗也较小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环化第三章第三章作业1. 重金属类污染物在环境中可以发生哪些迁移和转化行为?2. 有机污染物的主要理化参数有那些?3. 简述有机污染物的主要环境行为及其参数。
4. 什么是光化学反应? 可以分为哪几类?5. 简述光吸收过程的基本原理。
6. 简述光物理过程和光化学过程7. 简述光化学的基本定律。
答案第三章:1. 重金属类污染物在环境中可以发生哪些迁移和转化行为?答:重金属类污染物的环境行为有:它们在环境中可以以游离态形式溶解,非溶解的可以挥发进入另一环境介质,也可以与某些物质形成沉淀,也可以发生氧化与还原作用,同时也可以与环境介质中某些物质形成配合物,还可以被动植物摄取,沿食物链进行迁移,难降解的物质可以富集在生物体内,同时重金属类物质还可以经过烷基化,吸附和淋溶作用在环境中进行迁移和转化。
2. 有机污染物的主要理化参数有那些?答:共有12个参数,分别是:(1)土壤(沉积物)有机碳吸附系数(K oc ):K oc =K p /X oc ,K p =C s /C w ,其中C s 和C w 分别表示污染物在土壤(沉积物)和水中达到平衡时的浓度,K p 为分配系数,X oc 为沉积物中有机碳的含量。
(2)正辛醇/水分配系数(K OW ):分配平衡时,某一有机化合物在辛醇相中的浓度(C O )与其在水相中非离解形式浓度(C W )的比值。
(3)水溶解度 (S W ):在一定温度下,该物质溶解在单位量的纯水中的最大量。
(4)正辛醇/空气分配系数(K OA ):分配平衡时,某一有机化合物在正辛醇中的浓度与空气中该化合物浓度的比值。
(5)空气颗粒物/空气分配系数(K P ):某有机物在单位浓度TSP 中颗粒物中的浓度与在空气相中的浓度的比值。
(6)蒸气压P :某物质,当气相与其纯净态(液体或固体)达到平衡时的气压。
(7)酸解离常数K a :定义为a [H ][A ][HA]K +-=(对反应HA A H -+↔+),为了表示方便,K a 通常以负对数的形式表示,即表示成p K a 。
书146页 (8)碱解离常数K b :定义为b [BH ][OH ][B]K +-=(对反应H B BH +++↔),为了表示方便,K b 通常以负对数的形式表示,即表示成p K b 。
书146页 (9)水解速率常数k T :它实际上是某pH 条件下的准一级水解反应速率常数,包括中性水解速率常数、强酸和强碱催化水解速率常数以及普通酸、普通碱催化水解速率常数等的贡献。
k T 的表达式可以简化为TA NB [H ][OH ]kk k k +-=++或者T A N B w [H ]/[H ]k k k k K ++=++,其中K w 为水的离子积常数;k A 、k B 、k N 分别为酸性催化、碱性催化、中性过程的二级反应水解速率常数,可以由实验测得。
书149页(10)气相中有机污染物与·OH 的反应速率常数k OH :k OH 是表征有机污染物在大气中归趋的重要参数。
书152页(11)水相中有机污染物被·OH 氧化降解的反应速率常数k OH :k OH 是表征有机污染物在水环境中的环境行为的基础数据。
书155页(12)微生物降解速率常数k b :bd[C][C]d[]k t -= ,符合一级反应动力学,k b 越大,降解半衰期越短,微生物降解能力越强。
书156页3. 简述有机污染物的主要环境行为及其参数。
答:环境行为分为迁移行为和转化行为。
其中,迁移行为包括挥发、吸附和分配等。
①挥发:只污染物从水相、土壤相或植物相中迁移到气相的过程。
与其相关的参数为挥发速率常数K v。
②吸附和分配:吸附是指溶质在界面层浓度升高的现象;分配是指物质在两种不同环境介质间迁移,最后达到平衡的现象。
与其相关的参数主要有土壤(沉积物)有机碳吸附系数K oc、水溶解度S w、蒸气压P、正辛醇/水分配系数K ow、正辛醇/空气分配系数K oa。
转化行为分为以下几种:①光化学反应:主要参数为量子产率和速率常数。
②酸碱解离反应:主要参数为酸碱解离常数。
③水解反应:主要参数为水解速率常数。
④自由基或活性氧引发的氧化降解反应:主要参数为在气相或水相中有机污染物与·OH的反应速率常数。
⑤生物降解反应:主要参数为微生物降解速率常数。
4. 什么是光化学反应? 可以分为哪几类?答:光化学反应(photochemical reaction ):是物质(原子、分子、自由基或离子吸收光子所引发的化学键断裂和生成的化学反应。
1、光解①光解生成自由基醛和酮分子经230~330 nm 的光照射,可以断裂为两个自由基。
过氧化合物中的O-O 键和脂肪偶氮化合物R'-N=N-R 中的C-N 键也可以发生这种类型的反应。
R'-N=N-R 光解可以产生稳定的产物N2,可以生成大量的R·自由基。
②光解生成小分子醛分子经光照射后还可以分裂为两个小分子: 2、分子内重排在某些情况下,化合物在吸收光量子后能够引起分子内重排。
例如,邻硝基苯甲醛吸收光能后,可发生如下反应:RC O HhvRH + COCHONO 2COOH NOhv邻硝基苯甲醛 3、光致异构化某些有机化合物吸收光能后,可发生光致异构化反应,例如4、摘取氢的反应当溶解在异丙醇溶液中的二苯酮受到光的照射时,激发三线态的二苯酮可以抽取异丙醇分子上的α氢,这是一个摘取氢的反应,即:5、光致聚合反应光致聚合反应实际上也是环加成反应,α,β-不饱和羰基化合物可以经光照生成二聚体。
另外,环境中八氯代二苯并二噁英的一个重要来源C 6H 5COC H hvC H C OC H H 5C OC 6H 5异丙醇6H 5COH C 6H 5C 6H 5CHOHC 6H 5PhCOH CPhOH (Ph = C 6H 5)异丙醇聚合S 11C C H H C 6H 5C 6H 5hv CC H C 6H 5H 6H 5CC H H COOH HOOChv CC H COOH H为大气液滴中五氯苯酚的光化学合成,反应如下:PCPOctachlorodibenzo-p -dioxin (OCDD) 6、光敏化反应在光化学反应中,某些化合物能够吸收光能,但自身并不参与反应,而把能量转移给另一化合物,使之成为激发态参与反应,这样的反应成为光敏化反应。
吸光的物质称为光敏剂(S ),接受能量的化合物称为受体(A )。
光敏化反应可表示为:1S()S()S h S γ+→11S()S()S T → 系间窜跃1001S()A()S()A()S S S T +→+ 能量转移 1001S()A()S()A()T S S T +→+ 能量转移1A()T →参与反应5. 简述光吸收过程的基本原理。
答:原子和分子可以平动,分子还可以振动和转ClOHClClClClOOClClClClClCl动,每一种运动都有一定的能量,这种能量是不连续的。
电子吸收一定能量后,可以由低能级向高能级跃迁。
根据分子轨道理论,电子在轨道中的分布服从Pauli不相容原子和能量最低原子。
一个分子有多少原子价电子轨道就有多少个分子轨道,分子轨道有不同能级,只有与能级间能量差相近的光子才能被粒子吸收。
分子轨道粒子吸收光子而从基态变为激发态,电子激发类型为σ-σ* ,n-σ* ,π-π*和 n-π*,并遵守朗伯-比尔定律。
跃迁和激发是两种主要形式。
6. 简述光物理过程和光化学过程答:光物理过程:激发态物质回到较低能级或激发态过程。
包括振动驰豫、内部转变、辐射荧光、系间窜越,辐射磷光、热失活和能量转移。
其中振动驰豫主要是指:在较高能级上的分子,可以通过碰撞释放能量而回到能量较低的振动态的过程。
内部转变是指电子从激发单线态回到基态,同时释放热能的过程。
激发单线态的电子具有不同振动能级的基态位置,发出紫外或可见光。
系间窜跃是电子从激发单线态回到较低的激发单线态轨道,并发生自旋反转的过程。
辐射磷光:处于某一时刻状态的分子回到基态,同时释放光能的过程。
热失活是指氧、一氧化氮等分子与激发态分子相碰撞,使能量以热的形式耗散。
能量转移使指激发态分子与分子相碰撞,使另一个分子成为激发态的过程。
光化学过程:激发态分子通过各种反应生成新物质的过程。
光化学过程包括单分子反应(光解、分子内重排、光致异构化),双分子反应(摘取氢和光致聚合)在某些情况下,化合物在吸收光量子后能够引起分子内重排和异构化反应。
而某些羰基化合物容易发生摘氢反应和光致聚合反应。
7. 简述光化学的基本定律。
光化学第一定律:只有被体系吸收的光,对于产生光化学反应才是有效的。
该定律指出,照射在反应体系中的光,必须在能量或波长上满足体系中分子激发的条件,否则将不能被分子所吸收。
但应指出的是,即使照射光的能量满足激发所需,若未被体系中的分子所吸收,则光照同样不能引发光化学反应。
光化学第二定律:分子吸收光的过程是单光子过程。
这一定律简单地说,就是每个分子只能依靠吸收一个光量子而达到它的激发态。
在普通光照射的情况下,该定律是适用的。
化学物种吸收光子后,所产生的光物理或光化学过程的相对效率可用量子产率表示,其定义式为:如果光物理和光化学过程具有发生,则∑Φi =1,即所有初级过程的量子产率之和必定等于1。
)()(单位时间单位体积吸收光子数目单位时间单位体积子数目过程所产生的激发态分⋅⋅=i i φ。
