2015 年美国FDA批准上市的45种新药
美国FDA 1个月内连续批准3种新药治疗多发性骨髓瘤

[ 8 ]陈艳芬 , 陶曙 红 , 赵越 , 等. 六味 地黄汤 生物制剂 对 阴虚
动物 的药 理 作 用研 究 [ J ] . 中药 药 理 与 临 床 , 2 0 0 7 , 2 3
( 5): 2 6 - 2 7 .
[ 9 ]付 晓 伶 , 方 肇 勤. 阴虚 证动 物 模 型 的造 模方 法 及评 析
美国 F D A最近在 1 个 月之内连续批 准了 3 种治疗 多发性骨髓瘤 的新药 。 2 0 1 5 年 1 1月 1 6日, F D A采 取 加 速 审 批 程 序 ( a c c e l e r a t e d a p p r o v a 1 ) 批准 J a n s s e n B i o t e c h公 司 的 D a r z a l e x ( d a r a t u m u m a b ) 注射剂用于治疗多发性骨髓 瘤 , 适用 于之前接受过 至少 3种药物治 疗 的患 者。D a r z a l e x 是F D A批 准的首个 用于治疗多发性骨髓 瘤的单 克隆抗 体 , 并获 F D A授予突破性疗法认证和孤儿药地 位。 2 0 1 5 年l 1月 2 0 日, F D A批 准 日本 武 田药 业 公 司 ( T a k e d a P h a r m a c e u t i c a l s ) 生产的 N i n l a r o ( i x a z o m i b ) 与 R e v l i m i d ( 1 e n a l i d o m i d e , 雷利度胺 , C e l g e n e 公 司出品 ) 和德 沙美松 ( d e x a m e t h a s o n e , 地塞米 松 ) 联 用治疗 多发性骨髓 瘤, 适用 于之 前接 受 过 至 少 1种 药 物 治 疗 的患 者 。N i n l a r o是 F D A批 准 的 首个 蛋 白酶 体 抑 制 剂 ( p r o t e a s o m e i n h i b i t o r ) 类药品 , 其作用机制是阻滞骨髓瘤细胞中的某些酶类 , 从 而阻止 骨髓 瘤细胞 的生 长和存活。F D A同时还 授予 N i n l a r o 孤儿药地位 。 美国 F D A于 2 0 1 5年 1 1 月3 0日批 准 由布迈施 贵公 司( B r i s t o 1 . M y e r s S q u i b b ) 生产 的 E m p l i c i t i ( e l o t u z u m a b ) 与 R e v l i m i d和德沙美松联用治疗多发性骨髓 瘤 , 适用 于之前接 受过 1 — 3种药 物治疗 的患者 。E m p l i e i t i 的作用机 制 是 激活和刺激机 体免疫 系统攻 击和杀灭 多发性 骨髓 瘤癌细胞 。E m p l i c i t i 同时还被 F D A授予突破性疗法认证 和孤 儿药地位 。E m p l i c i t i 是F D A批准 的第 2个用于治疗多发性骨髓瘤的单克隆抗体。 今年 更早 之前 , F D A在 2 0 1 5年 2月 2 3 日批 准 了诺华 制 药 公 司 ( N o v a  ̄ i s P h a r m a c e u t i c a l s ) 生Байду номын сангаас 的 F a r y d a k ( p a n o b i n o s t a t ) 口服片剂用于治疗多发性骨髓瘤 , 并授予其孤儿药地位 。 ( 来源: 美国 F D A政府 公告 , 2 0 1 5 . 1 1 . 3 0 夏训明 编译 )
2011年FDA批准的35个新药

2011年FDA批准的35个新药FierceBiotech最近统计了2011年FDA批准的新药,共35个,其中生物药12个,约占1/3。
另外,新批准的35个药中,有2个药:加乐显(Gadavist)和拜瑞妥(Xarelto)已分别在2009年和2010年在中国获批。
巧的是,去年11月,FDA发布了2011财年批准的新药,数目一样,也是35个,但涵盖的时间段不同。
FDA的财年是从每年的10月至次年的9月。
By Liz Jones Hollis and Jennifer Levin,编译自FierceBiotech对于制药公司来说,2011年是新药获批的丰收年。
FDA去年共批准了35个新药,是最近7年来最多的一年。
强生(Johnson & Johnson)和葛兰素史克(GlaxoSmithKline)各有3个新药获批,是获批新药最多的药企。
FDA也立刻夸耀其在2011年批准新药数目的大幅增加,并特别强调其批准了一些创新药物——如西雅图遗传学(Seattle Genetics)治疗淋巴瘤的新药Adcetris。
不过今年会批准几个新药呢?制药公司正在面临着来自仿制药公司日益激烈的竞争,而且,由于研发的乏力,在接下来的几年里,获批的新药数目很有可能下滑。
不过,就像在“15个潜在的重磅炸弹药物”报告里提到的那样,生物制药行业仍然在尽力开发新产品。
药名:Adcetris (brentuximab vedotin)适应症:霍奇金淋巴瘤和系统性间变性大细胞淋巴瘤(ALCL)公司:西雅图遗传学(Seattle Genetics)获批日期:8月19日类型:生物药简介:去年8月,FDA加速审批了西雅图遗传学的孤儿药Adcetris,该药用于治疗霍奇金淋巴瘤和间变性大细胞淋巴瘤。
这是自1977年以来FDA首次批准的霍奇金淋巴瘤治疗药物和FDA有史以来批准的首个间变性大细胞淋巴瘤药物。
美国国家癌症研究所(National Cancer Institute)估计,去年美国大约有9,060新确诊的霍奇金淋巴瘤患者,其中大约1,190人可能因此病死亡。
2015-2021年FDA批准的505b2药物

APPLICATIONNUMBERPROPRIETARY NAME ESTABLISHED NAME通用名APPLICANTNDA208746(1)PEMETREXED培美曲塞HOSPIRA INC NDA 206610ACETAMINOPHEN对乙酰氨基酚RISINGNDA 214313NOREPINEPHRINEBITARTRATE IN 5%DEXTROSENOREPINEPHRINEBITARTRATE酒石酸去甲肾上腺素BAXTER HEALTHCARECORPNDA 204803POSIMIR BUPIVACAINE布比卡因DURECT CORPNDA 204957ACETAMINOPHEN对乙酰氨基酚B BRAUN MEDICAL INCNDA 212994AZSTARYS SERDEXMETHYLPHENIDATE ANDDEXMETHYLPHENIDATE对甲苯磺酸盐和对甲苯磺酸盐COMMAVETHERAPEUTICS SANDA 211844MIDAZOLAM咪达唑仑INFORLIFE SANDA 213072ROSZET ROSUVASTATIN ANDEZETIMIBE瑞舒伐他汀和依折麦布ALTHERAPHARMACEUTICALSLLCNDA 214154NEXTSTELLIS DROSPIRENONE ANDESTETROL TABLETS屈螺酮和雌醇片MAYNE PHARMA LLCNDA 212045KLOXXADO NALOXONE HCL盐酸纳洛酮HIKMA PHARMACEUTICALS USA INCNDA214657(1)PEMETREXED SANDOZ INCNDA 211988ZYNRELEF BUPIVACAINE ANDMELOXICAM布比卡因和美洛昔康HERON THERAPEUTICSINCNDA 214253LEVOTHYROXINESODIUMCUSTOPHARM INCNDA 211488CAMCEVI LEUPROLIDE亮丙瑞林FORESEE PHARMACEUTICALS CO LTDNDA 214846MYFEMBREE RELUGOLIX 40 MG,ESTRADIOL 1 MG,AND NORETHINDRONEACETATE 0.5MGRELUGOLIX 40 mg、雌二醇 1 mg 和醋酸炔诺酮0.5 mgMYOVANT SCIENCESGMBHNDA 213378LYBALVI OLANZAPINE ANDSAMIDORPHAN奥氮平和沙美芬ALKERMES INCNDA 215025SODIUMPHENYLACETATE ANDSODIUM BENZOATE苯乙酸钠和苯甲酸钠MAIAPHARMACEUTICALSINCNDA 213218SOAANZ TORSEMIDE托拉塞米SARFEZ PHARMACEUTICALS INCNDA 213536REZIPRES EPHEDRINEHYDROCHLORIDE盐酸麻黄碱ETONPHARMACEUTICALSINCNDA 212156MICAFUNGIN米卡芬净PAR STERILE PRODUCTS LLCNDA 210282DAPTOMYCIN达托霉素HOSPIRA INC NDA 214965VERKAZIA CYCLOSPORINE环孢素SANTEN INCNDA 212303(1)DULUTEGRAVIR,LAMIVUDINE, ANDTENOFOVIRDISOPROXIL度替拉韦、拉米夫定和富马酸替诺福韦酯LUPIN LTDNDA 214902TWYNEO TRETINOIN ANDBENZOYL PEROXIDE维 A 酸和过氧化苯甲酰SOL-GELTECHNOLOGIES LTDNDA 215143SUCCINYLCHOLINECHLORIDE琥珀胆碱氯化物HIKMAPHARMACEUTICALSUSA INCNDA 210735CYCLOPHOSPHAMIDE环磷酰胺EUGIA PHARMA SPECIALITIES LTDNDA 213895VANCOMYCIN万古霉素XELLIA PHARMACEUTICALS APSNDA 214826LOREEV XR LORAZEPAM劳拉西泮ALMATICA PHARMA LLCNDA 211566(1)SITAGLIPTIN西他列汀ZYDUS WORLDWIDEDMCCNDA 213436TRUDHESA DIHYDROERGOTAMINEMESYLATE甲磺酸二氢麦角胺IMPEL NEUROPHARMANDA 215133SERTRALINEHYDROCHLORIDE盐酸舍曲林ALMATICA PHARMALLCNDA 212854ZIMHI NALOXONEHYDROCHLORIDE盐酸纳洛酮ADAMISPHARMACEUTICALSCORPNDA 213426SEGLENTIS CELECOXIB ANDTRAMADOLHYDROCHLORIDE塞来昔布和盐酸曲马多KOWAPHARMACEUTICALSAMERICA INCNDA 213978TYRVAYA VARENICLINESOLUTION伐尼克兰溶液OYSTER POINTPHARMA INCNDA 211950XIPERE TRIAMCINOLONEACETONIDE曲安奈德BAUSCH AND LOMBINCNDA 214028VUITY PILOCARPINEHYDROCHLORIDE盐酸匹洛卡品ABBVIE INCNDA 210526DYANAVEL XR AMPHETAMINE安非他明TRIS PHARMA INCNDA 213005(1)YUTREPIA TREPROSTINIL曲前列尼尔LIQUIDIATECHNOLOGIESNDA 214679EPRONTIA TOPIRAMATE托吡酯AZURITY PHARMACEUTICALS INCNDA 214869DHIVY CARBIDOPA ANDLEVODOPACARBIDOPA 和左旋多巴AVIONPHARMACEUTICALSLLCNDA 215668(1)BENDAMUSTINEHYDROCHLORIDE盐酸苯达莫司汀DR REDDYSLABORATORIES LTDNDA 213312FYARRO SIROLIMUS PROTEIN-BOUND PARTICLESSIROLIMUS 蛋白结合颗粒AADI BIOSCIENCEINCNDA 215422LYVISPAH BACLOFEN巴氯芬SAOL THERAPEUTICS RESEARCH LTDNDA 215650XACIATO CLINDAMYCINPHOSPHATE磷酸克林霉素DARE BIOSCIENCEINCNDA 215423ENTADFI TADALAFIL ANDFINASTERIDE他达拉非和非那雄胺VERU INCNDA 215935TARPEYO BUDESONIDE布地奈德CALLIDITAS THERAPEUTICS ABNDA 215019DARTISLA ODT GLYCOPYRROLATE甘氨酰吡咯酸EDENBRIDGE PHARMACEUTICALS LLCNDA 2I4032ILLUCCIX KIT FOR THEPREPARATION OF GA-68 PSMA-11GA-68 PSMA-11 制备试剂盒TELIXPHARMACEUTICALS USINCNDA 215395LANREOTIDE ACETATE醋酸来那度胺INVAGEN PHARMACEUTICALS INCNDA 214133RECORLEV LEVOKETOCONAZOLE左酮康唑STRONGBRIDGE DUBLIN LTDREVIEW CLASSIFI CATION 505(B)(2)APPROVALAPPROVAL DATE批准类型S Y1/8/2021Type 3 - New Dosage FormS Y1/15/2021Type 5 - New Formulation or New ManufacturerS Y1/15/2021Type 5 - New Formulation or New ManufacturerS Y2/1/2021Type 3 - New Dosage FormS Y2/18/2021Type 5 - New Formulation or New ManufacturerS Y3/2/2021Type 1 - New Molecular Entity and Type 4 - New CombinationS Y3/22/2021Type 5 - New Formulation or New ManufacturerS Y3/23/2021Type 4 - New CombinationS Y4/15/2021Type 1 - New Molecular EntityS Y4/29/2021Type 5 - New Formulation or New ManufacturerS Y5/6/2021Type 5 - New Formulation or New ManufacturerP Y5/12/2021Type 4 - New CombinationS Y5/17/2021Type 5 - New Formulation or New ManufacturerS Y5/25/2021Type 2 - New Active IngredientS Y5/26/2021Type 4 - New CombinationS Y5/28/2021Type 1 - New Molecular Entity and Type 4 - New CombinationS Y6/10/2021Type 5 - New Formulation or New ManufacturerS Y6/14/2021Type 5 - New Formulation or New ManufacturerS Y6/14/2021Type 5 - New Formulation or New ManufacturerNew ManufacturerS Y6/21/2021Type 5 - New Formulation or New ManufacturerS,O Y6/23/2021Type 5 - New Formulation or New ManufacturerS Y6/25/2021Type 4 - New Combination S Y7/26/2021Type 4 - New CombinationS Y8/20/2021Type 5 - New Formulation or New ManufacturerS Y8/25/2021Type 5 - New Formulation or New ManufacturerP Y8/26/2021Type 5 - New Formulation or New ManufacturerS Y8/27/2021Type 3 - New Dosage FormS Y9/2/2021Type 2 - New Active IngredientS Y9/2/2021Type 5 - New Formulation or New ManufacturerS Y10/4/2021Type 3 - New Dosage FormS Y10/15/2021Type 5 - New Formulation or New ManufacturerS Y10/15/2021Type 4 - New Combination S Y10/15/2021Type 3 - New Dosage Form S Y10/22/2021Type 3 - New Dosage FormS Y10/28/2021Type 5 - New Formulation or New ManufacturerS Y11/4/2021Type 3 - New Dosage Form S Y11/4/2021Type 3 - New Dosage FormS Y11/5/2021Type 3 - New Dosage FormS Y11/12/2021Type 5 - New Formulation or New ManufacturerNew ManufacturerP,O Y11/22/2021Type 5 - New Formulation or New ManufacturerS Y11/22/2021Type 3 - New Dosage FormP Y12/7/2021Type 5 - New Formulation or New ManufacturerS Y12/9/2021Type 4 - New CombinationP,O Y12/15/2021Type 5 - New Formulation or New ManufacturerS Y12/16/2021Type 3 - New Dosage FormS Y12/17/2021Type 3 - New Dosage Form and Type 4 - New CombinationS Y12/17/2021Type 5 - New Formulation or New ManufacturerS,O Y12/30/2021Type 2 - New Active Ingredient适应症NSCLC、Mesothelioma间皮瘤(注射剂)止痛、退烧(注射剂)升高低血压(注射剂)局部麻醉(注射剂)止痛、退烧CNS兴奋剂注射麻醉剂降低LDL-C预防妊娠阿片类拮抗剂,用于阿片类过量NSCLC、Mesothelioma间皮瘤术后止痛(注射剂)粘液性水肿昏迷myxedema coma晚期前列腺癌子宫平滑肌瘤月经量过多成人精神分裂症、成人双相 i 型障碍急性高血氨症成人心力衰竭、肾病相关水肿麻醉状态的低血压念珠菌血症、急性播散性念珠菌病、念珠菌腹膜炎和脓肿cSSSI、Bacteremia菌血症春季角结膜炎(Tentative Approval)痤疮局部治疗作为全身麻醉的辅助治疗、便于气管插管、在手术或机械通气期间提供骨骼肌松弛label not available败血症、感染性心内膜炎、皮肤和皮肤结构感染、骨感染、下呼吸道感染、艰难梭菌相关性腹泻、金黄色葡萄球菌引起的小肠结肠炎label not availablelabel not available偏头痛急性治疗MDD、OCD紧急治疗阿片类药物过量治疗需要阿片类镇痛剂且替代治疗效果不佳的成人急性疼痛。
“十三五”有望获批的24个重大新药创制品种(附潜力点评)

“十三五”有望获批的24个重大新药创制品种(附潜力点评)在目前正式立项的1525项新药创制专项项目中,哪些是“十三五”有希望的品种呢?鉴于目前已获批创新药从申报到获批的平均时间为6~8年,笔者纳入107个目前已至少进入申报临床阶段的重大新药创制一类新药(排除非自主研发品种)。
参考药物研发方向和已公开相关信息,尤其是大量专业人士在医药学论坛的前沿分析,笔者又从107个品种中筛选出24个品种,认为这些品种若能获批,将有望获得不错的市场机会。
而由于信息的不足和笔者的专业性所限,这一分析未必准确。
为了更直观地展示产品的市场前景,笔者再次启用“模板”进行评估,选择了一些明星品种作为在研品种的参考“模板”。
“模板”仅具参考性,在研品种的未来市场表现与诸多因素相关,并非模板品种销量更大者的市场容量就更大。
笔者更青睐于那些有模板作参考、有望成为me-better的品种,这些品种相对较为成熟,成功的可能性更大。
对于first-in-class,考虑到国内的药理学、病理学等基础科学还比较薄弱,开发难度相当大,但如果成功必将得到更高的认可。
抗肿瘤新药:中外研发差距不大抗肿瘤药物研发一直是肿瘤药物治疗的皇冠,因此重大新药创制的重点和大多数药企创新药研发的方向都瞄准这个领域。
新药创制政策培育的抗肿瘤1类原创新药超过50个,其中绝大多数属于替尼类。
“替尼爆炸”导致大量酪氨酸激酶抑制剂创新药排队申报临床,不少品种仅申报临床时长就超过1年。
不过,对于替尼类也要区分看待。
一些针对成熟靶点开发、进度比较靠前的品种值得关注;另外,一些新靶点创新药也值得期待,但有些目前已经出现多个失败产品的热门新靶点(如c-met)的开发仍需谨慎。
研究热门的抗体偶联物和PD-1类药物,国内同样有多个已申报临床的原创新药,中国抗肿瘤原创药的研发水平已经与国外差距不大。
法米替尼模板:舒尼替尼法米替尼是恒瑞研制的多靶点酪氨酸激酶抑制剂,主要针对C-Kit、KDR和PDGFR,目前在中国开展针对多种实体瘤的临床研究,其中针对鼻咽癌和结直肠癌的Ⅱ期临床已成功完成。
2009年美国FDA共批准26种新药上市

来源生物谷2010-1-26 10:59:57美国FDA2009年共批准26种新药上市赵晨光分享生物谷()讯:据统计美国食品药品监督管理局2009年共批准26种新药上市,而2008年FDA共批准25种新药上市。
在新批准上市的26种新药中生物技术类药物共有7种。
在药企方面,诺华制药以4种新药排在首位,强生旗下Centocor Ortho Biotech和葛兰素史克分别以两种新药紧随其后。
今年新药榜单上辉瑞和罗氏缺席的确令人吃惊。
以下是09年获批的26种新药:米那普伦盐酸盐 Savella (milnacipran HCl)适应症:纤维肌痛生产商:Forest Laboratories, Cypress Bioscience批准日期:2009年1月14日纤维肌痛是一种以全身性疼痛与疲劳为主的疾病。
根据美国风湿病学会估计大约有6百万美国人患有纤维肌痛。
虽然对于米那普伦盐酸盐(milnacipran Hcl,Savella)改善纤维肌痛症状的确切机制尚不明确,但一些研究者认为:某些脑部神经递质的异常可能是纤维肌痛的关键所在。
本品可能是通过对5-羟色胺与去甲肾上腺素(NE)再摄取的双重抑制(在体外对NE再摄取抑制的选择性更强)来改善纤维肌痛症状。
在美国进行的2项关键性III期临床研究中,共纳入2084例患者,其中1460例患者接受本品治疗,624例患者则使用安慰剂。
结果显示:与安慰剂相比,本品(剂量为100mg/天、200mg/天)能同时显著改善疼痛(视觉模拟评分)、患者整体评价(患者对变化的整体印象评分)与生理功能 (Short Form-36 总体生理健康)。
本品的安全性与耐受性良好。
最常见的不良反应为恶心。
其他常见不良反应包括便秘、潮热、多汗、呕吐、心悸、心率上升、口干与高血压。
本品所报道的大多数不良反应为轻微至中等程度。
Uloric (febuxostat)适应症:痛风生产商:Takeda批准日期:2009年2月16日Uloric (febuxostat)是美国FDA批准的近40年来首个用于治疗高尿酸症的痛风药物。
2014年第一季度FDA批准的9个新药

2014年第一季度FDA批准的9个新药一、达格列净片(Dapagliflozin)2014年1月8日FDA批准阿斯科利及BMS的达格列净用于治疗成人2型糖尿病,达格列净是一种选择性钠-葡萄糖协同转运蛋白-2 (sodium-glucose cotransporter-2,SGLT2)抑制剂,主要作用机制为降低肾小管对原尿中葡萄糖的重吸收,该作用不依赖于胰岛素。
结构式:剂量:5mg/10mg,一天一次。
达格列净不适用于治疗:1型糖尿病、血或尿液(糖尿病酮酸中毒)中酮升高、或者中度或重度肾损害,终末期肾病,或者透析人群。
由于安全性方面的担心,达格列净片批准为有条件上市,FDA要求上市后进行包括评价心血管及膀胱癌风险在内的6项临床试验。
达格列净由百时美施贵宝和阿斯利康联合开发,2012年11月12日获欧盟委员会批准用于治疗2型糖尿病,也是SGLT2类药物中全球首个获批的药物。
阿斯利康去年年底以超过40亿美元的价格买断与百时美施贵宝的糖尿病药合资企业的股份,收购价格中包括前期金和销售相关的里程碑付款。
达格列净为FDA批准的第二个SGLT2抑制剂(为第一个向FDA递交上市申请),因膀胱癌风险FDA要求补充临床数据,强生的卡格列净反而首先上市。
单用达格列净的降糖效果弱于单用卡格列净,100-300mg卡格列净降低HbA1c0.91-1.16%,5-10mg达格列净降低HbA1c 0.5-0.7%。
二、他司美琼胶囊2014年1月31日FDA批准Vanda制药的Hetlioz(商品名),褪黑激素(melatonin)MT1和MT2受体激动剂,用于治疗完全失明患者中治疗非-24-小时睡眠觉醒障碍(“非-24”)。
非-24是盲人中一种慢性的昼夜节律(人体生物钟)疾病引起睡眠时间的困扰,光线不进入他们的眼睛而不能使其人体生物钟与24-小时明暗周期同步,即该病患者可能难以入睡或保持睡眠,而且可能昏昏沉沉醒来或感觉好像他们需要更多的休息,患者睡眠模式逆转- 在白天需睡觉而晚上清醒。
2019年fda批准新药简介

卡博替尼(Caቤተ መጻሕፍቲ ባይዱozantinib)
商品名: Cometriq(Orphan) 上市公司: Exelixis 给药方式:口服 适应症:治疗转移性甲状腺髓样癌 特点:多靶点酪氨酸激酶(VEGFR-2、cMet)抑制剂,卡博替尼是过去2年中
获批用于治疗甲状腺髓样癌的第2种药物,另一种药物为阿斯利康的Caprelsa。
2019年fda批准新药简介
2019 年美国 FDA批准了 39 个新药上市, 其中有 33 个新分子实体创 2019 年以来批准数的新高 。 首轮审评通过率将近 80% ,超过往年任何时 候。 首轮通过率高的可能原因包括: ① 药物研发过程中监管者和研发企业之
间的沟通更为密切; ② 新药的适应证填补了未满足的疾病需求; ③ 追踪性
伐卡托有效改善 CF 患者的肺功能,延缓肺功能恶化。2019销售额13亿美元
托法替尼 (tofacitinib ,Xeljanz )
商品名: Xeljanz 上市公司: 辉瑞 给药方式:口服(片剂) 适应症:疗成人患者的对甲氨喋呤应答不充分或不耐受的中度至重度活动性
类风湿性关节炎。 背景: JAK-STAT信号通路功能广泛,参与细胞的增殖、分化、凋亡以免疫
IP、TP五种亚型),促进房水经葡萄膜巩膜流出,降低眼内压。他氟前列腺素 是首个不含防腐剂的前列腺素类似物的滴眼药,药效与拉坦前列腺素类似,但持 续时间更长。
阿伐那非(Avanafil)
商品名: Stendra 上市公司: Vivus 给药方式:口服 适应症:勃起功能障碍(ED)。 特点: PDE5抑制剂,用于治疗男性勃起功能障碍。同类药物还有西地那非
帕妥珠单抗 (pertuzumab ,Perjeta )
商品名:Perjeta 上市公司:罗氏 给药方式:注射 适应症:乳腺癌 背景:帕妥珠单抗是第一种可抑制人表皮生长因子受体 2(HER2)二聚化的人
美国和中国已批准的生物技术药物和分类

美国和中国已批准的生物技术药物和分类2015级研究生张锐15222105500151984 ~ 2014 年美国FDA审批上市的治疗性生物药物全球生物药物在1996年以后开始快速发展, 2001~2005年是生物药物成果最为显著的阶段。
肿瘤、免疫系统疾病、内分泌和代谢疾病、血液系统疾病、骨骼肌系统疾病是生物药物研究的重点领域,上市药物较多。
1984~2014年美国FDA共审批125个治疗性生物药物,其中首创性新药67个,占全部药物的53.60%;优于已有类似药物26个,占全部药物的20.80%;模仿跟进药物32个,占全部药物的25.60%。
1984~2014年美国FDA 审批的125个治疗性生物药物中,抗体药物为48个(38.40%),酶类药物19个(15.20%),干扰素12个(9.60%),融合蛋白类药物8个(6.40%),集落/造血刺激因子类药物8个(6. 40%),激素类药物8个(6.40%),生长因子类药物5个(4.00%)、肽类药物5个(4.00%)、溶栓类药物5个(4.00%)、毒素类药物5个(4.00%)、白细胞介素类药物2个(1.60%)。
1、抗肿瘤药首创性生物药物(Tab2)2、免疫疾病首创性生物药物(Tab3)3、胃肠道和新陈代谢及激素类首创性生物药物(Tab4)4、血液系统疾病首创性生物药物(Tab5)5、骨骼肌疾病首创性生物药物(Tab6)6、抗感染首创性生物药物(Tab7)7、泌尿和神经系统疾病首创性生物药物(Tab8)8、其他疾病首创性生物药物(Tab9)中国抗体药物产业现状截至2015 年6 月,共批准22 个抗体类药物上市,其中国内自主研发抗体药物10 种( 表1) ,进口抗体类药物12 种( 表2)。
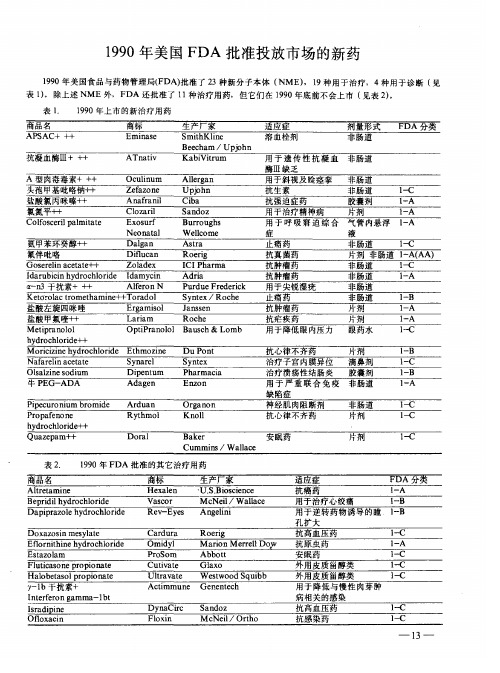
1990年美国FDA批准投放市场的新药
e o
a n
W e l le o m
As ta r Ro
e r
症
止 痛药 抗 真菌药
氮甲苯 环 癸醇 料 氟伴 毗 咯
G
o se re ru
Da l ga D if l
n
u e a n x
ig
r rn a
l in
a e e
t t e+ 十 a
o e
Zo la d e
r
IC I P h a A d ria Pur du Sy
安 眠药
胶囊剂 片剂 气管 内 悬 浮 液 非肠 道 片剂 非 肠 道 非肠 道 非肠 道 非 肠道 非肠 道 片剂 片剂 眼 药水 片剂 滴鼻剂 胶囊 剂 非肠 道
非肠 道
1一 A l一A l一A
1一 C l 一A ( A A 1
,
{
一A 1
l一 B 1一 A 1一 A 1
h lo
r
id e + + h yd r o
n d
e
o z e
o l f
in
M
N
il / o
r
t
ho
外 用 皮质山 醇类 用 于 降低与慢 性 肉 芽 肿 病 相 关 的 感染 抗 高血 压 药 抗 感 染药
合 一 斗一
’
一一
l
C C -
l
l一 C
— 13 —
表 3
.
部 分 药物 的新 适 应 症 及剂 量 形 式
商 品名
无环 鸟 昔 三 哩安定 (
。
EM)
,
9 种 用于 治 疗 1
,
4
表
19 0
美国FDA批准新药:仅比2008年多1个

产 品 ,2 0年 ,诺 华 与拜 耳达 成 了 一 07
项 合作 议 ,诺 华可 以推 i具有 自身 品 j I 牌 的 同类J 。所 以,本 文 作者 并 未把 品
■ 图l1 9 ~ 0 9 D 批准的新分子实体药物和生物制品的数目 9 6 2 0年F A
2 0 年批 准 C n y e 第 二 用 于遗 传 08 irz后 个 性 血 管 水肿 的产 品 。C n y e 一 种通 irz为
然 来 自专 业 的 制 药 公 司 ,卡 比 之 下 制 雕
B o h r p u iS 司 开 发 的重 组 人 抗 i t ea e t C 公
( a a l p i ) ,他 预 测 本 品将 会 同 S x g i tn F A 准 的 第 一 P 一 抑 制 剂 J n va D批 个D P 4 a u i ( i a l P i ) 样 达 到 数 十 亿 美 S t g i tn 元 的销 售 业 绩 。此 外 , 他 还看 好 由
肽 基 肽 酶 一 ( P ~ )抑 制 剂 O g z 4 D P4 nl a y
在 2 0 年 批 准 了2 个 新 药 , 译 者 将 其 09 6 进 行 了 对 比 , 发 现 国 内 作 者 将 诺 华
公 司 用 F多 发 性 硬 化 症 的 B 干 扰 素
批 准 , 而 是 F A 物 制 品 评 价 和 研 究 D生 中心 ( B R 批 准 市 的 , 是 由G C CE ) T
D a C r o a in y x o p r t o 公司 开 发 的用 于遗 传 性 管 水 肿 的血 浆 激 肽 释 放 酶 抑 制
剂K l i o ( c l a t d ),这 是继 a b t r e a ln ie
减轻化学治疗引起的恶心与呕吐新药--盐酸罗拉吡坦

减轻化学治疗引起的恶心与呕吐新药--盐酸罗拉吡坦陈本川【摘要】盐酸罗拉吡坦(rolapitant hydrochloride)由美国 Tesaro 制药公司开发,是神经激肽(NK)1受体拮抗药。
癌症患者化学治疗会引起恶心和呕吐,持续的恶心与呕吐还能使患者体质量减轻、脱水和营养不良。
严重影响患者的生活质量,并可能导致药物减量或治疗停止。
NK1受体拮抗药通过阻断大脑内刺激呕吐反射物质而起作用。
美国食品药品管理局(FDA)于2015年9月1日批准盐酸罗拉吡坦上市,商品名 Varubi,用于与其他止吐药联用,预防成人患者化学治疗引起的延迟性恶心和呕吐。
该文对盐酸罗拉吡坦的非临床和临床药理毒理学、临床研究、适应证、剂量与用法、用药注意事项、不良反应及知识产权状态和国内外研究进展等进行介绍。
【期刊名称】《医药导报》【年(卷),期】2016(035)005【总页数】5页(P547-551)【关键词】罗拉吡坦;神经激肽受体;癌症;化学治疗;恶心;呕吐【作者】陈本川【作者单位】湖北丽益科技有限公司,武汉 430205【正文语种】中文【中图分类】R975.4;R969恶心和呕吐是癌症患者在化学治疗(化疗)期间最常见的不良反应之一,多数发生于化疗开始阶段的24~120 h,并能持续一段时间。
一旦时间过长,可影响患者接受化疗的依从性,打乱患者的治疗节奏,导致药物减量或治疗停止。
严重的恶心呕吐不仅影响患者生活质量,还可能使患者脱水、电解质紊乱、营养不良,甚至导致严重的并发症。
Rolapitant hydrochloride(暂译名盐酸罗拉吡坦),代号SCH-619734,中文化学名为3(5S,8S)-8- { [(1R)-1-[3,5-双(三氟甲基)苯基] 乙氧基]甲基-苯基}-8-苯基-1,7-二氮杂螺[4.5]癸烷-2-酮盐酸盐一水合物。
盐酸罗拉吡坦是神经激肽(neurokinin,NK)1受体拮抗药,通过阻断大脑内刺激呕吐反射物质而起到抑制作用。
FDA批准新型抗滥用止痛药Xtampza,专利官司接踵而至

FDA批准新型抗滥用止痛药Xtampza,专利官司接踵而至2015年11月9日Collegium制药公司(COLL)宣布,美国食品和药物管理局(FDA)已经初步批准Xtampza(TM)ER (羟考酮缓释胶囊)的新药申请,用于满足那些需要每日、全天候、长期地使用阿片类药物的疼痛疾病的治疗及存在缺陷的替代治疗。
Xtampza ER作为Collegium主导产品之一,是一个抗滥用、缓释的羟考酮口服制剂。
Xtampza的有效成分是羟考酮,含有该成分的速效、缓释药品已经在FDA及世界其他多个监管机构获批。
Collegium采用了其专有的DETERx抗滥用技术开发了Xtampza,有效解决了常用给药方法造成的滥用问题,可以通过咀嚼,粉碎或溶解,然后口服、鼻息或注射使用。
虽然FDA已经确定Xtampza ER满足其所有要求的质量,安全性和有效性的标准标准,但它是受制于普渡制药长达30个月的专利诉讼,普渡制药声称Xtampza ER侵犯了目前正在上诉的三个由美国地区法院纽约南区宣布无效的专利。
如果的Collegium收到法院宣判所列出的专利是无效的及其并未侵犯专利的行为,或者等到30个月诉讼期满之后,美国食品药品管理局就可以提供Xtampza ER的最终批准,此时该产品可以在市场上销售。
Collegium制药的首席执行官说:“我们很高兴FDA咨询委员会建议批准Xtampza ER,我们期待FDA的最终审查。
”Collegium和Purdue(普渡)真像一对冤家,同样的缓释剂型,前不久FDA咨询专家小组23:0一致推荐Xtampza ER的上市申请,同一批专家前一天大比例驳回了普渡的上市申请(见相关阅读:Collegium的防致瘾止痛药Xtampza ER静候FDA批准上市)。
有这场官司也就不足为奇了!关于羟考酮(oxycodone)羟考酮(oxycodone)是从生物碱蒂巴因(thebaine)中提取的半合成阿片类药物,作为强效镇痛药在临床上应用已有80多年的历史。
2019年9—10月FDA批准新药概况

2019年9—10月FDA批准新药概况2019年9—10月,美国食品和药物管理局(FDA)批准了多个新的药物上市,这些新药的批准意味着更多的治疗选择和希望将带给患者。
下面是2019年9—10月FDA批准新药的概况。
1. Erdafitinib(红带非替尼)Erdafitinib是首个用于治疗特定类型的晚期尿路上皮癌(UC)的口服靶向治疗药物。
它适用于接受了化疗并且在FGFR阴性的患者中,癌症仍然进展的情况。
该药物的批准是基于临床试验数据,数据显示患者的整体反应率为40%,平均持续时间为5.4个月。
2. Trikafta(伊瓦卡夫托)Trikafta是一种用于治疗囊性纤维化(CF)的三联疗法。
它适用于年龄为12岁及以上,拥有两个F508del突变的CF患者。
Trikafta的批准是基于两个关键临床试验的数据,这些数据显示该药物在患者中显著改善肺功能。
3. Reblozyl(利保替哌普)Reblozyl是一种用于治疗成年患者的贫血型β-地中海贫血或依赖性β地中海贫血(TDT)的药物。
这是一种注射给药,适用于患者在不再依赖于红细胞输血的情况下,提高了血红蛋白水平。
该药物的批准是基于一项关键临床试验,数据显示患者血红蛋白水平得到长期维持。
4. Pretomanid Tablets(前曼尼片剂)Pretomanid Tablets是一种用于与质子泵抑制剂和多药联合治疗(PMDT)一起治疗多耐药结核病和极耐药结核病的药物。
该药物是唯一获得批准的,用于这种疾病的三联疗法之一,批准是基于临床试验数据,数据显示PMDT的治疗成功率接近90%。
5. Wakix(瓦克希片)Wakix是一种用于治疗成人的强迫性睡眠癖(OSA)的药物。
这是一种新的口服非优势性选择性肌动蛋白2/4(HAR2/4)受体拮抗剂,用于调节清醒和睡眠状态。
该药物的批准是基于两个临床试验的数据,数据显示Wakix显著缩短了OSA患者的睡眠时间。
6. Vyndaqel and Vyndamax (tafamidis)(俾迪拉、维达马)Vyndaqel and Vyndamax是一种用于治疗心脏淀粉样形态决性心脏病(ATTR-CM)的药物。
Insight:2015年4月CDE药品审评报告

2015 年4 月CDE 药品审评报告Insight - China Pharma Data2015 年5 月2015 年4 月CDE 药品审评报告——丁香园Insight 数据库要点∙ 4 月份药品申报量创今年以来最高点∙正大天晴近4 年来首次申报化药1.1 类新药∙齐鲁制药抢仿迅速∙每周口服一次降糖药曲格列汀遭国内药企抢仿∙GSK 提交多替拉韦进口上市申请∙江苏恒瑞镇痛新药M6G 获批临床_____________________________________________________________________________________________根据丁香园Insight - China Pharma Data 数据库最新统计,2015 年4 月CDE 共承办新的药品注册申请以受理号计有846 个,与 3 月份(719 个)相比增幅约达18%。
其中增量主要集中在化药,这也是今年以来月受理量的最高点。
以下,分别来分析化药、中药、生物制品的申报受理及审评审批情况。
一、化药申报受理情况:4 月份CDE 共承办新的化药注册申请以受理号计728 个,涉及327 个品种。
其中各个申请类型的具体数据如下所示:Insight 系列报告1. 新药(1)1.1 类新药8 个化药1.1 类新药申报临床根据Insight 数据库统计,4 月份CDE 共承办化药1.1 类新药申请以受理号计有23 个,涉及8 个品种,且均为新药临床申请。
具体数据如下所示:正大天晴申报的TQ-B3234 具体适应症暂时不详。
这是正大天晴继2011 年申报舒布替尼之后,近4 年来申报的唯一一个化药1.1 类新药。
正大天晴是国内仿制药领域领先的医药企业,但其在创新药物研发领域仍有待加强,其目前还没有获批上市的 1.1 类新药。
丹诺医药申报的TNP-2092 为消化道感染用药。
除了TNP-2092 之外,其研发管道上还有尚未申报的具有不同灭菌机理的双靶标分子新药候选物TNP-2198 和TNP-2500。
2023_年美国FDA共批准55_种新药

广东药科大学学报第40卷[33]VERHAART I E C, AARTSMA-RUS A. Therapeutic devel‐opments for Duchenne muscular dystroph y[J]. Nat Rev Neurol, 2019, 15(7):373-386.[34]MACKENZIE S J, NICOLAU S, CONNOLLY A M, et al.Therapeutic approaches for Duchenne muscular dystrophy: old and ne w[J]. Semin Pediatr Neurol, 2021, 8(37):100877.[35]张慈柳, 洪思琦, 彭镜, 等. 儿童神经系统疾病糖皮质激素治疗专家系列建议之六—进行性假肥大型肌营养不良的治疗[J]. 中国实用儿科杂志, 2022, 37(5):343-346.[36]FISCHER R, PORTER K, DONOVAN J M, et al. A Mixed-method study exploring patient-experienced and caregiver-reported benefits and side effects of corticosteroid use in Duchenne muscular dystroph y[J]. J Neuromuscul Dis, 2023, 10(4):593-613.[37]TUNG J Y, LAN T P, CHAN S H, et al. Bone microarchitec‐tural alterations in boys with Duchenne muscular dystrophy on long-term glucocorticoid treatment [J]. J Bone Miner Metab,2021, 39(4):606-611.[38]LUCE L, CARCIONE M, MAZZANTI C, et al. Theragnosisfor Duchenne muscular dystroph y[J]. Front Pharmacol, 2021, 3(12):648390.[39]谢佩玉, 戴国瑶, 朱叶华, 等. 泼尼松龙高剂量单用及低剂量联用他克莫司治疗成人微小病变肾病综合征的疗效和安全性分析[J]. 广东药科大学学报, 2023, 39(2):27-31.[40]GROUNDS M D, LLOYD E M. Considering the promise ofvamorolone for treating duchenne muscular dystroph y[J]. J Neuromuscul Dis, 2023, 10(6):1013-1030.[41]LIU Xu, WANG Yashuo, GUTIERREZ J S, et al. Disruptionof a key ligand-H-bond network drives dissociative properties in vamorolone for Duchenne muscular dystrophy treatmen t [J]. Proc Natl Acad Sci U S A, 2020, 117(39):24285-24293. [42]张贤政, 葛瑾茹, 张玲玲, 等. 进行性肌营养不良动物模型及治疗药物研究进展[J]. 中国药理学通报, 2022, 38(1):16-21.(责任编辑:刘晓涵)2023年美国FDA共批准55种新药美国FDA下属的药品评审与研究中心在2023年共批准各类新药(包括新分子实体、新治疗用生物制品)55种,但不含由生物制品评审与研究中心负责评审的疫苗、致敏性产品、血液与血液制品、细胞与基因治疗产品:(1)有20种为同类首款(first-in-class)新药(商品名,下同):Daybue,Defencath,Fabhalta,Filspari,Filsuvez,Jesduvroq,Joenja,Lamzede,Miebo,Ogsiveo,Paxlovid,Qalsody,Rivfloza,Skyclarys,Sohonos,Talvey,Truqap,Veopoz,Veozah,Xdemvy。
2015年1月FDA批准新药概况

改善银 屑病 、银 屑病关节炎 及其他炎症性 疾病 的临床疗 效。苏 金单抗 为首 个上 市 的 I L 一 1 7阻断 剂药 物 ,通过结 合I L 一 1 7 A( 白介素 - 1 7 A,一种于 炎症相关 的蛋 白 ) ,阻 止它结合 至它 的受 体 ,从而 抑制其触发在 斑块性银 屑病 发 展中起 作用的炎症反 应。
血剂 ,将与前 3 个上市 的勃林格殷格 翰的 P r a d a x a( 达 比
加群酯 ) 、拜耳 / 杨 森的 Xa r l t o( 利伐 沙班 )和百时美施 贵宝 / 辉瑞 的 E l i q u i s( 阿哌沙班 )展开竞争 。
3 重组人 甲状旁腺激素 ( Na t p a r a )
C o s e n t y x的推荐 剂量和 给药方法 是在第 1 、2 、3 和 4周以 3 0 0 mg 剂量皮下注射 ,接着每 4周 3 0 0 m g 。
在下 肢或大腿 形成 的血液凝块 ,一种潜在 的致命结 果是 血液凝块 在深静 脉脱落 ,转移至肺 动脉和 阻断血 流。依
度沙 班为 新 型 口服 抗 凝血剂 — — _ X a 因子 抑制剂 ,能 够 可逆性抑制凝血 因子 X a ,是第 4个上市 的新 型 口服抗凝
mg ,1 次/ d; 有 肌酐清 除率在 1 5 - 5 0 ml / mi n间的推荐剂 量为 3 0 m g ,1 次/ d 。② 对 D V T和 P E的治疗 ,推 荐剂 量是 6 0 m g ,1 次/ d 。S a v a y s a 不应 在非瓣膜 性房 颤且有
Na t p a r a的推荐剂量和给药方法为 : 开始剂量是在大
S a v a y s a 与华 法林相 似,但 S a v a y s a 的 出血风 险显著低 于华 法林。8 2 9 2 名受 试 者 参加 了 S a v a y s a 对有 D V T和肺 栓塞 ( p u l mo n a r y e m b o l i s m,P E) 患者的治疗研究。试验结果显示 , S a v a y s a 组静脉血栓栓塞复发率低于华法林组 ( 3 . 2 %v s 3 . 5 %) 。 S a v a y s a的推荐 剂量 和给药 方法 : ① 对 非瓣膜 房颤
指哪打哪!!!肺癌靶向药物全解析

指哪打哪肺癌靶向药物全解析肺癌是因为基因突变导致并驱动生长的,那么针对突变的基因进行治疗,就可以达到抑制肿瘤生长的作用,由于身体正常组织中不存在这些突变基因,因此药物主要针对肿瘤组织,犹如有目标的进行打击,因此称为靶向治疗。
非小细胞肺癌的靶向治疗已成为肿瘤个体化治疗的里程碑。
根据遗传物质改变的不太,已将非小细胞肺癌细分成EGFR、KRAS、ALK、RET等突变形态。
并针对患者的不同基因型突变展开精准治疗。
肺癌的高度异质性2018年6月3日,ASCO公布的LOXO292临床数据,LOXO292一夜刷屏全世界。
RET基因终结者,有效率77%,疾病控制率100%。
2018年6月15日,中国食品药品监督管理总局(CFDA)正式批准PD-1抗体纳武利尤单抗注射液(商品名欧狄沃,英文名Opdivo)上市,针对的适应症是:经过系统治疗的非小细胞肺癌(不包括敏感基因突变患者)。
2018年8月15日,国家药品监督管理局正式批准了新一代ALK 抑制剂安圣莎®(化学通用名,阿来替尼)进口注册申请,用于治疗间变性淋巴瘤激酶(Anaplastic Lymphoma Kinase,简称ALK)阳性的局部晚期或转移性非小细胞肺癌。
靶向EGFR一线化疗之前检测出EGFR突变,首选厄洛替尼、阿法替尼、吉非替尼治疗,也可选择奥希替尼治疗。
1厄洛替尼厄洛替尼于2004年11月18日获FDA批准上市,适用于肿瘤表皮生长因子受体(EGFR)19号外显子缺失或者21号外显子(L858R)突变的转移性非小细胞肺癌(NSCLC),也可联合吉西他滨(gemcitabine)作为一线治疗局部晚期、不可切除或者转移的胰腺癌。
2015年销售额为16.3亿美元。
厄洛替尼是表皮生长因子受体(EGFR)酪氨酸激酶抑制剂,后者在各种癌症中高表达或者突变,造成下游信号通路异常激活,该药能与EGFR的ATP位点结合,从而抑制其活性。
2吉非替尼吉非替尼于2003年5月5日获FDA批准上市,作为一线治疗药物用于肿瘤表皮生长因子受体(EGFR)19号外显子缺失或者21号外显子(L858R)突变的转移性非小细胞肺癌(NSCLC),2015年销售额为5.4亿美元。
一种抗精神病新药卡利拉嗪的受体作用模式介绍

卡利拉嗪(cariprazine)是一种新型抗精神病药 物,商品名为 Vraylar,于 2015年 9月获 FDA批准上 市,用于治疗成人精神分裂症和双相障碍。该药由 Actavis公司和 GedeonRichter公司生产,属于非典 型抗精神病药之一,为多巴胺 D3/D2 受体部分激动 剂,对 5-HT1A受体也具有一定的亲和力。国内目 前尚未接到允许使用的批准文件。相关资料提示该 药的最大益处是可以改善精神分裂症患者的情感淡 漠。因此,对于许多慢性患者而言,或许是可以作为 选择的药物之一。本文介绍该药物主要的受体作用 模式以供临床医生参考。
1 受体作用模式
1.1 卡利拉嗪的化学结构式
(trans-4-{2-[4-(2,3-dichlorophenyl)- piperazine-1-yl]-ethyl}-N,N -dimethylcar bamoyl-cyclohexyl-aminehydrochloride,RGH - 170
【摘要】 本文目的是系统阐述新型抗精神病药卡利拉嗪(cariprazine)的神经受体主要作用模式。抗精神病药物治疗是 临床生物干预的重要手段之一,在一定程度上可以影响疾病预后的发展趋势。新型药物的开发始终是科研人员不懈的追求。 卡利拉嗪是 2015年美国 FDA批准上市的新药,有望被引入国内,本文对其进行介绍便于临床医生参考。
Correspondingauthor:MaRui,E-mail:marui256yy@tom.com) 【Abstract】 Thepurposeofthispaperistosystematicallyillustratethemainactionmodeoftheneuroreceptorsofthenew antipsychoticdrugcariprazine.Antipsychoticdrugtherapyisoneoftheimportantmeansofclinicalbiologicalintervention,whichcan affectthedevelopmenttrendofdiseaseprognosistoacertainextent.Thedevelopmentofnewdrugshasalwaysbeentheunremitting pursuitofresearchers.AsanewdrugapprovedbyUSFDA in2015,caliprazineisexpectedtobeintroducedintoChina,soits introductionisconvenientforclinicalreference. 【Keywords】 Newantipsychoticdrug;Cariprazine;Receptoractionmode
2015年下半年美国FDA批准药物简介

2015年下半年美国FDA批准药物简介汤仲明【期刊名称】《国际药学研究杂志》【年(卷),期】2016(43)1【摘要】2015年下半年美国FDA首次批准上市含新分子实体单药或复方20个,生物制品许可申请15个,共计35个,创历史批准数量最多。
本文根据FDA批准的处方资料,简要介绍新药概况、作用机制、黑框警告、适应证、剂量和用法、禁忌证、不良反应、药物相互作用及特殊人群中使用等。
并讨论了2015年下半年在药物开发、研究和审评中的首次和重要事件。
%In the second half year of 2015,the U.S. Food and Drug Administration(FDA)approved 20 new molecular enti⁃ties single or compounds and 15 biologics license applications,a total of 35 which record number of approved innovative drugs. Ac⁃cording to the prescription information for professionals,this article briefly describes the description,mechanism of action and clinical studies,the box warning,indications and usage,dosage and administration,dosage form and strength,contraindications,warning and precautions,adverse reactions,drug interaction and use in special population of these new drugs. In addition,the first and criti⁃cal events in the history of new drug development and reaserch are emphasized.【总页数】12页(P167-178)【作者】汤仲明【作者单位】军事医学科学院放射与辐射医学研究所【正文语种】中文【中图分类】R9-14【相关文献】1.2016年下半年美国FDA批准药物简介 [J], 汤仲明2.2014年下半年美国FDA批准药物简介 [J], 汤仲明3.2015年上半年美国FDA批准药物简介 [J], 汤仲明4.2013年下半年美国FDA批准药物简介 [J], 汤仲明5.2015年下半年美国FDA批准的新分子实体与评价:心血管和精神系统疾病、抗病毒感染、女性性欲低下障碍、糖尿病治疗用药和化疗止吐药 [J], 孙树森;赵志刚因版权原因,仅展示原文概要,查看原文内容请购买。
美国FDA批准抗感染药Isavuconazonium Sulfate上市

美国FDA批准抗感染药Isavuconazonium Sulfate上市佚名
【期刊名称】《中国执业药师》
【年(卷),期】2015(0)5
【摘要】美国FDA于2015年3月6日批准安斯泰来(Astellas)公司的Isavuconazonium Sulfate(参考译名:硫酸艾沙康唑,商品名:Cresemba)胶囊、粉针剂上市,用于18岁及以上患者治疗侵袭性曲霉病、侵袭性毛霉菌病。
【总页数】1页(P43-43)
【关键词】Sulfate;美国FDA;FDA批准;抗感染药;上市;侵袭性曲霉病;毛霉菌病;商品名
【正文语种】中文
【中图分类】R692
【相关文献】
1.2017年美国FDA批准上市的抗感染新药介绍与述评 [J], 刘昌孝
2.抗感染药——Levaquin获得美国FDA的批准 [J], 贾永蕊(摘)
3.美国FDA首次批准2种专利药的仿制药上市 [J], 夏训明(编译)
4.中国自主研发抗癌药获美国FDA批准上市 [J],
5.FDA批准抗血栓药Vorapaxar Sulfate上市 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2015 年美国FDA批准上市的45种新药【小分子药物&生物制品】导读2015年,FDA一共批准了45种新药,这是自1996年以来被批准最多的一年,1996年共有53种新药获得了FDA的批准。
按照治疗领域分类,其中有14款为抗肿瘤药物,9种心血管系统药物、3种抗精神药物、2种抗病毒药物、1种抗生素、1种抗真菌药物、1种治疗糖尿病药物、1种呼吸系统药物及13种其他治疗药物。
按照药物的类型分,其中13种为生物制品,32种为化学小分子药物。
2015年,FDA一共批准了45种新药,这是自1996年以来被批准最多的一年,1996年共有53种新药获得了FDA的批准。
按照治疗领域分类,其中有14款为抗肿瘤药物(只有3个药物未被授予突破性治疗药物资格或一些其它的用来加快审评程序的资格),9种心血管系统药物、3种抗精神药物、2种抗病毒药物、1种抗生素、1种抗真菌药物、1种治疗糖尿病药物、1种呼吸系统药物及13种其他治疗药物。
其中有21个属于罕见病药物,它们中有12个新分子实体药物,9个生物制品类药物。
这21个罕见病药物的获批再次见证了《罕见病药物法案》对全球制药巨头增强罕见病药物的研发兴趣和动力起到了积极作用。
按照药物的类型分,其中13种为生物制品,32种为化学小分子药物。
以下是2015年FDA 的45种新药介绍(按照批准时间点排序)。
1.Savaysa(edoxaban)——抗凝血药物2015年1月8日,FDA批准了第一三共株式会社的抗凝血药物Savaysa(edoxaban),化合物专利为WO 03000657A1(2002 年3 月20日),用于降低非心脏瓣膜病引起的房颤患者卒中和危险血栓(系统性栓塞)风险,其预期销售峰值将达2.2亿美元。
2.Cosentyx(secukinumab)——银屑病2015年1月21日,FDA批准Cosentyx™(secukinumab)在适合接受全身治疗(指可被吸收进入血流并分布至全身各个部位的药物)或光疗的成人患者中用于治疗中至重度斑块型银屑病。
Cosentyx是首个获批的可选择性结合白细胞介素-17A(IL-17A)并抑制IL-17受体的银屑病药物。
值得一提的是,近日FDA又批准Cosentyx用于强直性脊柱炎(ankylosing spondylitis,AS)和银屑病关节炎(psoriatic arthritis,PsA)二个新适应症。
预期销售峰值达187亿美元。
3. Natpara(parathyroid hormone)——罕见病药物2015年1月23日,FDA 批准NPS 公司开发的罕见病药物Natpara 上市,同月Shire公司悄无声息的与著名的罕见病药物开发者NPS医药公司达成了收购协议。
Natpara注射用药物主要是通过替代人体的甲状旁腺激素(parathyroid hormone)来治疗一种名为甲状旁腺功能减退的罕见内分泌紊乱疾病。
甲状旁腺功能减退是一种罕见病,该病会导致患者钙缺乏和维生素D合成受阻,最终导致肌肉疼痛、骨密度问题等并发症。
美国现有6万例甲状旁腺功能减退患者。
目前尚无可供选择的有效治疗方案,Natpara是首款获批用于治疗这一疾病的激素替代疗法。
与其它治疗方案相比,Natpara可明显提高患者的血钙浓度。
Natpara的获批从某种意义上说解决了这一罕见病人群用药的可及性问题。
预期销售峰值为5亿美元。
4. Ibrance(palbociclib)——晚期乳腺癌2015年2月3日,FDA加速批准了Ibrance(palbociclib),联合来曲唑作为内分泌治疗为基础的初始方案用于治疗ER+/HER2-绝经后晚期乳腺癌。
FDA是基于其无进展生存期(PFS)加速批准了这一适应症。
palbociclib化合物专利为WO 03062236A1(2003 年1 月10日)。
预计销售峰值为30亿到50亿美元。
5.Lenvima(lenvatinib)——罕见病药物2015年2月17日,FDA批准Lenvima(乐伐替尼,lenvatinib)治疗侵袭性、分化型甲状腺癌(DTC)患者,适用于在接受放射性碘治疗后疾病仍恶化(放射性碘难治性疾病)的患者。
预计销售峰值达4.24亿美元。
甲状腺癌是一种常见的内分泌腺恶性肿瘤,占全身恶性肿瘤的1%。
韩国是全球发病率最高的国家,为67.9/10万。
有数据显示,2012年我国肿瘤登记地区甲状腺癌发病率为6.6/10万,高于全球平均发病水平(4.0/10万)。
乐伐替尼是首个获批用于治疗分化型甲状腺癌的靶向药物,颇具市场潜力,有望成为未来的重磅炸弹。
此外,乐伐替尼用于治疗肾癌、肝癌、子宫内膜癌和非小细胞肺癌等处于临床试验之中。
值得一提的是,日本卫材已于2015年2月向我国CFDA提出进口注册,因此该药登陆中国市场指日可待。
尽管日本卫材在中国获得多项与本品相关的专利,但目前国内已有江苏恒瑞、江苏奥赛康和石药集团中奇制药等多家企业向我国CFDA提出注册申请。
可见,国内企业对本品的关注度颇高。
6.Farydak(panobinostat)——罕见病药物2015年2月23日,经历大起大落的抗癌新药Farydak(帕比司他,panobinostat,LBH589)最终获得FDA青睐。
Farydak是一种新型、广谱组蛋白脱乙酰酶(HDAC)抑制剂,具有一种新的作用机制,通过阻断组蛋白脱乙酰酶(HDAC)发挥作用,该药能够对癌细胞施以严重的应激直至其死亡,而健康细胞则不受影响,用于既往接受至少2种治疗方案(包括Velcade 和一种免疫调节(IMiD)药物)治疗失败的多发性骨髓瘤(myltiple myeloma,MM)患者群体。
多发性骨髓瘤(MM)是一种不可治愈,复发率和耐药率均极高的疾病。
MM占所有肿瘤的1%,占血液系统恶心肿瘤的10%。
MM多发于60岁以上人群,衰老是MM的风险因素之一,全球约有11.4万病例。
近年来抗MM药物发展迅速。
自10多年前武田的靶向药物万珂®问世以来已有多个治疗MM的靶向药物获批。
特别要说的是,2015年FDA共批准包括2个新分子实体和2个生物制品在内的4个用于治疗MM的药物。
这4个药物分别是Farydak、Ninlaro、Empliciti和Darzalex。
Farydak是FDA批准的首个HDAC抑制剂,适用于先前已至少接受过两种标准治疗药物治疗的患者。
临床试验证实,帕比司他可延缓MM的进展。
预计销售峰值达2.5亿美元。
7.Avycaz(ceftazidime/avibactam)——感染2015年2月25日,FDA批准Avycaz(ceftazidime-avibactam,头孢他啶-阿维巴坦)与甲硝唑联合用于治疗cIAI及cUTI成人患者,其中包括肾脏感染(肾盂肾炎),适用于治疗选择有限或没有替代治疗选择的患者。
前者是由一种广谱头孢菌素(ceftazidime)与一种新型β-内酰胺酶抑制剂(avibactam)组成的复方产品,开发用于治疗革兰氏阴性细菌感染,包括对现有抗生素产品有耐药性的广谱β-内酰胺酶及肺炎克雷伯杆菌碳青霉烯酶。
Avycaz原本由森林实验室(Forest Lab)和阿斯利康联合开发。
但2014年2月,阿特维斯耗资250亿美元收购Forest Lab后将Avycaz收入囊中,而阿特维斯又收购了爱力根(Allergan),并将新公司命名为爱力根。
Avycaz预计销售峰值为10亿美元。
8.Cresemba(isavuconazonium sulfate)——罕见病药物2015年3月6日,日本安斯泰来的广谱抗真菌药Cresemba(isavuconazonium,艾沙康唑),该药主要用于治疗侵入性曲霉病和毛霉菌病,这两种真菌感染多发于血癌患者。
isavuconazonium sulfate是新一代三唑类广谱抗真菌药,用于治疗侵入性曲霉菌和毛霉菌病(这两种真菌感染多发于免疫性低下的肿瘤患者,特别是血癌患者)。
isavuconazonium sulfate具有生物利用度高、口服吸收不受食物影响以及不良反应较小的优点。
Isavuconazole sulfate的问世为临床治疗侵袭性真菌感染提供了新选择。
药物预期销售达5亿美元。
9. Unituxin(dinutuximab)——罕见病药物2015年3月10日,FDA宣布批准Unituxin(dinutuximab)作为高风险神经母细胞瘤患儿综合治疗方案(包括手术、化疗、放射治疗)中的一线治疗药物。
Unituxin预计销售峰值为6000万到1.5亿美元。
儿童高危神经母细胞瘤是一种罕见肿瘤,常见于5岁及以下儿童,患病后存活率低。
儿童神经母细胞瘤发病率约为1/10万。
Unituxin是FDA批准的首个针对高风险神经母细胞瘤患者的治疗药物,可在一定程度上满足高风险神经母细胞瘤儿童延长存活期的需求。
10.Cholbam(cholic acid)——罕见病药物2015年3月17日,FDA 批准Cholbam(胆酸)胶囊,它是获得FDA 批准用于因单一酶缺乏而导致胆汁酸合成障碍的儿科及成年患者及用于过氧化物酶体病(包括齐薇格谱系障碍)患者的首款治疗药物。
患有这种罕见、遗传性、代谢疾病的患者在临床上显示有肝脏疾病、脂肪痢(粪便中有脂肪)及脂溶性维生素吸收降低导致的并发症。
Cholbam是FDA迄今为止批准的唯一用于治疗先天性胆汁酸合成障碍(CBAS)的药物,适用于年龄≥3岁的CBAS患者。
CBAS是一种罕见遗常染色体隐性传性疾病,约占儿童胆汁淤积性疾病的1%~2%,CBAS是由胆汁酸合成过程中酶缺失所致。
CBAS早期患者可通过口服补充胆汁酸及脂溶性维生素等治疗获得良好疗效。
Cholbam的问世解决了多年来CBAS患者无药可用的尴尬局面。
11. Corlanor(ivabradine)2015年4月15日,Corlanor(ivabradine)是超极化激活环核苷酸门控(HCN)通道阻滞药,伊伐布雷定(ivabradine)的化合物专利:EP 0534859A1(1992 年9 月25日),用于降低患者心衰恶化导致的住院治疗风险。
预期销售峰值达3000万美元到1亿美元。
12. Kybella(去氧胆酸)——全球首个“双下巴”溶脂针2015年4月29日,Kybella(deoxycholic acid)是一种溶细胞药物,注入体内组织后破坏细胞膜导致细胞溶解,用于治疗成人中至重度颌下脂肪。
这是FDA批准的全球首个“双下巴”溶脂针Kybella(ATX-101),用于中度至重度“双下巴”成人,该针剂是用于消除多余颏下脂肪(双下巴)的首个也是唯一一个非手术治疗产品。
ATX-101是一种人造的脱氧胆酸(deoxycholic acid),这是人体内天然存在的一种物质,帮助分解脂肪。
