化学官能团相互转换大全(part2)
有机合成中的官能团互变与官能团保护

有机合成中的官能团互变与官能团保护官能团互变和官能团保护是有机合成中常用的两种策略,用于在合成过程中对官能团进行转化或保护,以达到所需的目的。
本文将具体介绍官能团互变和官能团保护的原理和应用。
一、官能团互变官能团互变是指将一个官能团转化为另一个官能团,通常通过一系列的反应步骤实现。
这种方法在有机合成中广泛应用,可以有效地构建复杂有机分子。
下面以几种常见的官能团互变反应为例进行介绍。
1. 羰基互变反应羰基互变反应是一种常见的官能团互变方法,通常通过氧化、还原或加成等反应来实现。
例如,醛和酮可以通过还原反应互变,常用的还原剂有金属碱金属催化剂或氧化铝。
此外,也可以通过氧化反应将醇氧化为醛或酮。
2. 环化反应环化反应是官能团互变的重要手段之一,可以将直链分子转化为环状分子。
常见的环化反应有氧化环化和还原环化。
例如,氧化还原反应可以将烯烃转化为环烃,通常采用氢化反应或氧化反应。
3. 置换反应置换反应是官能团互变的一种常见方法,通过官能团之间的取代反应来实现。
例如,烷基取代反应可以将一个烷基官能团替换为另一个烷基官能团,常用的取代试剂有碱金属、烷基卤化物等。
二、官能团保护官能团保护是在有机合成中常用的一种策略,用于保护特定的官能团,以防止其在反应过程中发生不需要的反应。
在合成过程中,有时需要对某些官能团进行保护,以确保其他官能团能够正常进行反应。
下面以几种常见的官能团保护反应为例进行介绍。
1. 羟基保护反应羟基保护反应是一种常见的官能团保护方法,通常通过酯化或硅醚化反应来实现。
酯化反应将羟基转化为酯基,以保护羟基。
硅醚化反应则将羟基转化为硅醚基,以保护羟基。
这些保护基在需要时可以通过去保护反应去除。
2. 氨基保护反应氨基保护反应是一种常见的官能团保护方法,通常通过酰化或巯基化反应来实现。
酰化反应将氨基转化为酰基,以保护氨基。
巯基化反应则将氨基转化为巯基,以保护氨基。
这些保护基在需要时可以通过去保护反应去除。
有机化学中的碳氢键官能团转化方法

有机化学中的碳氢键官能团转化方法有机化学是研究碳基化合物的科学,其中碳氢键官能团的转化是有机合成中至关重要的一步。
官能团的转化可以改变分子的性质和功能,为有机化学研究和应用提供了广阔的空间。
本文将介绍有机化学中常用的碳氢键官能团转化方法。
一、氧化还原反应氧化还原反应是有机化学中常用的转化方法之一。
在碳氢键官能团的转化中,常用的氧化剂包括酸性高锰酸钾、过氧化苯甲酸等;常用的还原剂包括亚铁氯化物、氢气等。
例如,苯可以通过酸性高锰酸钾氧化为苯酚:C6H6 + KMnO4 + H2SO4 → C6H5OH + MnSO4 + H2O二、酸碱反应酸碱反应也是有机化学中常用的转化方法。
碳氢键上的氢原子可以被酸基或碱基取代,从而引入新的官能团。
例如,甲烷可以和氢氟酸反应生成氟甲烷:CH4 + HF → CH3F + H2O三、卤代反应卤代反应是将碳氢键官能团转化为卤素取代物的常用方法。
常用的卤化剂包括氯化亚铁、溴代甲烷等。
例如,乙烷可以通过氯化亚铁反应生成氯乙烷:C2H6 + FeCl2 → C2H5Cl + HCl四、还原反应还原反应是将碳氢键上的官能团还原成烷烃的方法。
常用的还原剂包括氢气和金属催化剂。
例如,乙醛可以通过氢气还原为乙烷:CH3CHO + H2 → CH3CH3 + H2O五、亲电取代反应亲电取代反应是将碳氢键上的氢原子被亲电试剂取代的常用方法。
常用的亲电试剂包括卤素、酸酐、酰卤等。
例如,甲烷可以被溴取代为溴甲烷:CH4 + Br2 → CH3Br + HBr六、核苷取代反应核苷取代反应是一类特殊的碳氢键官能团转化方法,常用于催化剂的存在下进行。
这种反应可以将一个核苷取代为另一个核苷,引入新的官能团。
例如,氯乙烷可以和氢氧化钾反应生成乙醇:C2H5Cl + KOH → C2H5OH + KCl总结:有机化学中的碳氢键官能团转化方法包括氧化还原反应、酸碱反应、卤代反应、还原反应、亲电取代反应和核苷取代反应。
官能团转化
acidic
C6H13
thioketal: inert to LAH; react with RaNi; smell terrible and stay long; discard shoses
neutral basic O Pd-C Ph HCO2NH4 Ph Ph
(3). Wolff-Kishner reduction:
1-a C-OH
(1). for 1', 2' alcohol:
C-H
O CH3 S Cl O
O RCH2 O S O O CH3 tosylate mesylate triflate toluenesulfonyl chloride (s) ~ $ 30 / Kg methanesulfonyy chloride (l) ~ $ 30 / Kg purification textbook dry pyridine: from CaH2 and distilled
C=O 5- a b c d e f g h i j k C=O C=S C=N-OH, C=N-H C C C N C=C-OR; C=C-SR C(OR)2; C(SR)2 C-OH C-NH2; C-NO2 C-Br C-H
2- a C-OH b C-(OR)2 c C(O)OR d C-H e C=C f C-CN
(1). RCH2NH2
C-H
p-TsCl BuLi LiAlH4 RCH2-H
ArSO2Cl RCH2NH2 Hinsberg's test
O
RCH2NH
SO2Ar
BuLi - BuH N SO2Ar
RCH2N SO2Ar
tosylamide RCH2
最全官能团转换

1-a C-OH
(1). for 1', 2' alcohol:
C-H
O CH3 S Cl O
O RCH2 O S O O CH3 tosylate mesylate triflate toluenesulfonyl chloride (s) ~ $ 30 / Kg methanesulfonyy chloride (l) ~ $ 30 / Kg purification textbook dry pyridine: from CaH2 and distilled
Functional Group Interconversion
C-H 1- a b c d e f g h i j C C 6- a b c d e f g h i RC CH RCH2-SO2Ph C C C=C RCH(CO2H)-CH3 -C(O)-CH3
O X O O
C-OR C-OH C-X C-NH2 C-S C=O C=C C-CN C-CO2H C-CHO C(O)X C=C 7- a CH-CX b CH-CH c CX-CY
(4). RCH2NH2
RCH2NMe3 X
-
Ag2O
RCH2NMe3 OH-
R=CH2
R-CH3
1-d
C-S
C-H
radical mechanism
EtO2C HN MeO2C S N O
JOC, 1985, 50, 427.
EtO2C CH2Ph
Raney Nickel: Ni - Al alloy, suspension
iii NaBH3CN
NaBH3CN: stable at pH 5-6 JOC, 1976, 41, 3064. Br
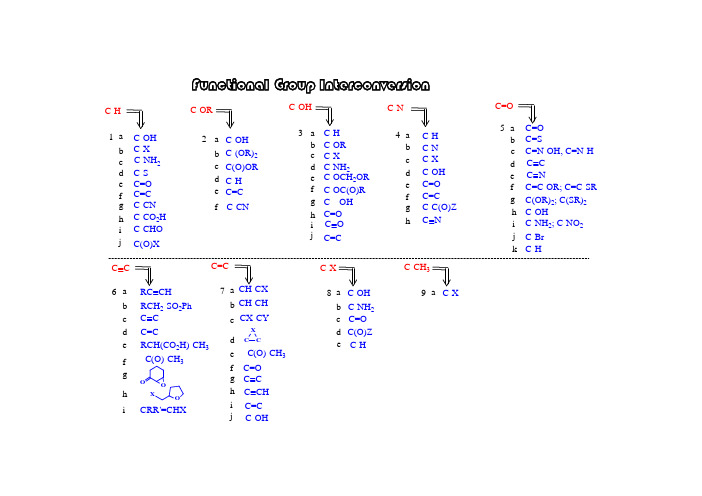
官能团相互转换大全(part1)

i 5-7-g f e d c b a e d c b a i h g f ed c ba h g f e d cb a h g f e dc b a 6-4-3-1-2-i h g f ed c b a C=C -C(O)-CH 3CH-CH CH-CX F u n c t i o n a l G r o u p I n t e r c o n v e r s i o nC=CC C C=CC C RCH 2-SO 2Ph RC CHC C C-NH 2; C-NO 2C-OHC(OR)2; C(SR)2C=C-OR; C=C-SR C C C NC=N-OH, C=N-H C=SC=O C=O C-C(O)Z C=C C=O C-OH C-X C-N C-H C-N C=O C---OH C-OC(O)R C-X C-OCH 2OR C-NH 2C-OR C-H C-OH C=C C-H C(O)OR C-(OR)2C-OH C-ORC-CHO C-CO 2H C-CN C=C C=O C-S C-X C-OH C-H C=C j C(O)XhC Nj kC-HC-Br 8-C-Xi C-OHC-OH C(O)Z d c b a e d c b a f C-NH 2C-Hj CX-CYC CXC=O h g f iC CH RCH(CO 2H)-CH 3-C(O)-CH 3O OOXCRR'=CHXjC O C-NH 2C-CN9-C-CH 3C-Xa e C=O1-adry pyridine: from CaH 2 and distilledtriflatemesylate tosylate S O O O RCH 2CF 3S OO O RCH 2CH 3CH 3CH 3CH 3OH (2). for 3' alcohol:LiAlH 4(1). for 1', 2' alcohol:1-i h g f e dc b a C-CHO C-CO 2HC-CN C=C C=O C-SC-NH 2C-X C-OH C-H CH 3CH3CH 3H n -Bu SnH C S O PhClRCH 2-HCH 3SOO O RCH 2CH 3S OOCl RCH 2OHpurification textbook~ $ 30 / Kg toluenesulfonyl chloride (s)methanesulfonyy chloride (l)~ $ 30 / Kg jC(O)XPh 2SiHCl / InCl 3PhPhPhPhJOC, 2001, 66, 7741.ii. Ph 2SiHCl / InCl 3i. p -TsCl // LiAlH 4i. ClC(S)OPh // n -Bu 3SnH Cl 2via:a unique Lewis acid catalyst, acceleratedeoxgyenationInCl 3indium trichlorideii. Et 3SiH / Lewis acidJ. Org. Chem. 2000, 65, 6179JOC, 2000, 65, 6179.CHCl 2rt, 3 hr1-bBu 3SnH: (l), easy to remove Ph 3SnH: (s), hard to remove Me 3SnH: too volatile, toxicunstable in acid, form H 2 gas; stable in weak baseNaBH 3CN: stable at pH 5-6hygroscopic, dried self, suggest: buy small amount each time(Grignard reagent)H OJOC, 1969, 34, 3923.HBrNa / NH 3; Li / NH 3; Na / EtOH Zn; Fe; Sn; Mg(3). metal reduction(2). hydride reduction(1). free radical reductionJACS, 1972, 94, 8905.n -Bu 3SnH HBrNaBH 4 / InCl 3 / CH 3CNradical reagentn -Bu 3SnH / AlBN JA CS, 2002, 124, 906.i iii NaBH 3CNi LiAlH 4i ii ii NaBH 4ii THL, 1969, 3095.JOC, 1976, 41, 3064.iv LiBHEt 3 (super hydride)mechanism uncertain, probably radicalburn filter paper if dryRaney Nickel: Ni - Al alloy, suspensionJCS Perkin Trans I, 1973, 654.(3). L iAlH 4 / CuCl 2NaBH 4 / NiCl 2NaBHEt 3 / FeCl 2 (or CoCl 2, VCl 3)(2). Li / NH 3(1). Raney NiBuLi1-d1-c 4RCH 2-HRCH 2NH 2radical mechanismChemistry:R-SH R-S-R R 2SO R 2SO 2R-SS-Rremove: Hg +; Ni(1).(2).Ar-H2Ar-NH 2RCH 2NH 2RCH 2NMe 3R=CH 2R-CH 3(4).X-RCH 2NMe 3OH -2NaH 2(3).Ar-NH 2Ar-H1-e(2). thioketal:(3). Wolff-Kishner reduction:(6). enol derivatives:SHSH/ BFTf2similar:(4). Pd-C / HCO2NH4(7). Et3SiH / CF3COOH1-fb.p. ~ 230 Chighly toxic, cancer suspected agent?= HMPT: h exa m ethyl p hosphoric t riamide (Me 2N)3P=O 1-g (1). K / Al 2O 3 K / HMPA (2). Na / NH 31-h JOC, 1980, 45, 3227HMPA: h exa m ethyl p hosphor a mide (Me 2N)3P=O yes for white mouse, uncertain for humanmodified to: NN O1-i(1). RhCl(PPh 3)3 (Wilkinson's cat)(2). Rh(DPPD)2+ Cl -DPPD = Ph 2P-CH 2CH 2-PPh 21-jHSiEt 3 / B(C 6F 5)3activator / hydride sourceRCH 2OROO RR OROR RCH 2 OCH 2CH 2OH(1). h ν / HSiCl 32-bN NH/ TBDMS-ClTBDPS-ClEt 3N / TMS-Clacid: H 2SO 4H 3PO 4BF 3-Et 2O RC-OCH 2CH=CH2RC-OCPh 3 = RC -OTr RC-O t Bu RC-OCH 3RC-OSiR 3RC-OCH 2Ph = RC-OBZl = RC-OBni. Willianson synthesis OK: Si - Cl bond longii. stability of silyl in acid/base: RC-O-TBDPS > RC-O-TBDMS >> RC-O-TBS iii. abbrev.: TBDMS = tert-butyl-dimethylsilyl = TBS =Silyl group:(RO-Tr)Trityl group: (tirphenylmethyl)i. S N 1 reactionii. abbreviation: triphenylmethyl = trityl = -CPh 3 = -Tr iii. advantage: high MW, easy to handle (small amount become large amount)baseBr Willianson synthesis (base, S N 2) not work: elimination side-product with base t -Butyl group:i. abbreviation: benzyl = PhCH 2 = Bzl = Bn ii. deprotecting: H 2 / Pd-CPhCH 2-ClPhCH 2-Br: reactivity goodPhCH 2-I: reactivity better than PhCH 2Br, generated in situ, PhCH 2Br + NaIPhCH 2-X: Benzyl- group:i. Williamson ether synthesis, S N 2 typeii. not a good protecting group, too stable to convert back to alcohol Me group:CH 3-X: CH 3I; CH 3OSO 2R; (CH 3)3O + BF 4-, (CH 3)2SO 4base: NaH, n -BuLi, Ag 2O(4). t -Bu: acid cat /(3). allyl: base /Br (6). silyl: Et 3N / R 3SiCl (5). trityl: py // Ph 3C-Br(2). PhCH 2-: base / PhCH 2-X e d cb a 2-RC=C RC-H RC(O)ORRC-(OR)2RC-OH RC-OR (1). Me: base / CH 3-X2-a (7). acetal / ketal: (see 3e)fRC-CNgenerate H 2, or butane gasJOC, 1988, 53, 2985.trimethyloxonium tetrafluoroborateJCS, 1930, 2166.(8). ArF / CsFROHradical mechanism: SiCl 3RaNi with C=S2-c2-d (1). hv / HSiCl 3(2). HCl / tBu-OO-t Bu(4). BF 3 / NaBH 42-eC-OH C-H C-OR C-NH 2C-X 3-a b c d3-a(1). [PhI(OAc)-O]2-Mn(TPP)(2). organic electrochemistry(3). X 2 / hv // OH -3-a.13-a.23-a.3(1) Me 3SiCl // MPCBA//H 3O +(2). O 2, LDA, (EtO)3PJA CS, 1975, 97, 6909.i h g f e C=O C---OH C-OC(O)RC-OCH 2OR C=Cj C O(1). Me: application: deprotecting (2). PhCH 2-(5). trityl:(6). silyl: (3). allyl: (4). t-Bu: RC-OCH 2RC-OSiR 3RC-OCH 3RC-OtBuRC-OCPh 3 = RC-OTr RC-OCH 2CH=CH 232Oi. HOAc: weak acid: good leaving groupii. H 2i. F - : HF, Py-H + F -; n -SiMe 3-SiBuMe 2-SiBuPh 2if HOBr: OK for TMDMSJOC, 1987, 52, 4973.OCOCF 3+3-b triphenylmethylorganic base: TMG3-c(1). O H -(2). K O 2 / D M S O 3-d not practically useful: R -O H cheaper than R -XJO C , 1975, 40, 1678.(2). N a 2[F e(C N )5(N O )] / K 2C O 3 / H 2O3-e(1). S ym m etry:ketal: use H 3O +acetal: use H 3O +(2). unsym etry:R O -M O M R O -M E M R O -M T M R O -T H Pi. H 3O +; ii. H C l / M eO H p -T sO H / M eO Hi. H 3O +; ii. Z nB r 2 / C H 2C l 2H gC l 2 / C H 3C N (aq.)actually, a c e t a l e x c h a n g e (3). A g 2O / H 2OT H L , 1975, 3183.JO C , 1986, 51, 3913.R O 2C(C H 2)3H RN H 2R O 2C(C H 2)3H RO H2323-f(1). base: KHCO 3 (or K 2CO 3, NH 3) / MeOH; NaOH (1 %, or 0.5 N)(3). RED: (2). acid: H 3O +PPh 3 / DEAD / RCO 2H // OH -3-gMitsunobu inversionSynthesis, 1981, 1.JOC, 1987, 52, 4235.common esters:formate = HCO 2R ------------------------ KHCO 3 (or K 2CO 3, or NH 3) / MeOH trifluoroacetate = CF 3CO 2R ------------ KHCO 3 (or K 2CO 3, or NH 3) / MeOHacetate = CH 3CO 2R = ROAc --------- KHCO 3 (or K 2CO 3, or NH 3) / MeOH benzoate = PhCO 2R = ROBz -------- NaOH (1 %) / MeOH pivalate = t Bu-CO 2R = ROPv ------ NaOH (0.5 N) / EtOH*HOi LiAlH 4ii. NaAlH 2(OCH 2CH 2OCH 3)CH 3O 2CCO 2CH 3HOOH3)266hydride:electron:Na / NH 3AGIEE, 2002, 41, 3028.。
有机官能团的转换-127页文档资料

实际上,纯粹SN2与SNl反应仅仅是亲核取代的两种 极限情况。大多数情况下,两种机理并存.并表现为竞
争反应。作用物结构、试剂以及反应条件将对反应产生 很大的影响。
作用物中心碳原子的空间效应对SN2反应影响很大。 中心碳上取代基增多,试剂进攻中心碳受阻,SN2反应
的相对速度便减小。不同结构的作用物进行SN2反应的 活性顺序是:
当取代芳烃再度发生取代时,环上巳存在的基团将
对新基进入芳坏的难易和位置产生很大的影响。这一现 象称为取代基的定位效应。一些基团使取代反应比苯更 易进行,而且将新基主要引入原有取代基的邻、对位, 这类基团称为邻对位定位基;另一类基团使芳环上的取 代比苯难于进行,新基主要进入其间位,称为间位定位 基。一般邻对位定位基对芳环的亲电取代起活化作用, 间位定位基起钝化作用。但卤原子例外,卤原子是吸电 子基因,它们的存在使苯环比较难于取代,但它们所具 有的未共用电于对与苯环组成P—共轭体系,使取代基 的邻、对位电子云密度比间位大一些,因而起邻、对定 位作用。
如果苯环上含有一个以上的取代基时,新基进入的
位置往往受定位效应最强的取代基支配。取代基定位效 应的相对强度同反应类型和反应条件有关,相同的基团
在不同的反应或不同的反应条件下,其相对活性往往有 所不同。根据单取代苯溴代的相对反应速度一些常见邻 对位定位基的定位效应的相对活性顺序为:
根据单取代苯硝化时,问硝基衍生物的产率,一些间位 定位基的相对强度如下顺序:
SN2 机理包括一个由作用物与试剂分子形成的过渡 态,反应按协同方式进行。即试剂从离去基团相反的方 向上进攻中心碳原于,试剂同中心碳之间键的形成,与
离去基团与中心碳之间键的断裂是同时进行的。在过渡 态中,进攻试剂、中心碳原子和离去基团大约处于同一 直线位置。而中心碳上的其余三个原子或基团则位于同 该直线垂直的平面上。这时,进攻试剂与离去基团分别 处于平面的两边。随着新键的逐渐形成,离去基团与中 心碳之间的键逐渐削弱,最后完全脱离中心碳,而完成 反应。
官能团化和官能团转换的基本反应

第二章 官能团化和官能团转换的基本反 应
25
(d)Reimer- Tiemann反应 将酚及其某些杂环化合物与NaOH溶液和过量的CHCl3一起加 热形成芳醛的反应称为Reimer- Tiemann反应。
OH NaOH/CHCl3/B-CD 60 C , 20min CHO
NEt2 + CHCl3 hv NEt2
Z= Hal, R'COO-; R'O- ; et.al.
酰氯为酰化剂, Lewis 酸用量需与酰氯等摩尔数,酸酐作酰化 剂,需用2摩尔以上Lewis 酸。
CH3 O CH3CH CHC Cl/AlCl3 3~4h OCH3 CH3 CH CH3 CH C OCH3 O AlCl3 AlCl3 O CH3 + O CH3 OH O 产物为混合物 CH3 CH3
(或 HBr
光照
链增长: CH3CH
CH2 + Br
CH3CHCH2Br CH3CH2CH2Br + Br
CH3CHCH2Br + HBr
链终止: (略)
第二章 官能团化和官能团转换的基本反 应 9
3. 双键的硼氢化及硼氢化-氧化,硼氢化-卤解反应 *硼氢化反应的机理
B2H 6 亲电加成 CH3CH CH2 + H BH2 - + B:电负性2.0 H:电负性2.2
+ CH3CH2
-
CH2 BH2 +
H
-
CH3CH2 H
CH2 CH3CH2CH2BH2 BH2
四中心过渡态
顺式加成
第二章 官能团化和官能团转换的基本反 应 10
* 硼氢化-氧化
1. B2H6 Et2O 2. H2O2, OH+
第二章 官能团化和官能团转化的基本反应

2 与卤化磷和亚硫酰氯反应
3ROH + PX3(P + X2) 3R-X + P(OH)3 X = Br 、 I ( 制备溴代或碘代烃) ROH + PCl5 ROH + SOCl2 R-Cl + POCl3 + HCl R-Cl + SO2 + HCl 制氯代烃
此反应产物纯净
3 与酸反应(成酯反应)
为什么简单杂环化合物的亲电取代反应一般发生在α位?
+
进攻2位
E X H E
+
E X E H X H
+ X
E H
X
+ E
+
进攻3位
H X
+
2、加成-加H2
X H2/Ni X X= O 、S、NH (THF是良好的溶剂,b.p65℃)
3、呋喃的共轭二烯性质 (吡咯、噻吩较难)呋喃芳香性最差
O
O 30℃
Br
Cl2
N H
-40℃
N H
Cl
Br2 S CH3COOH, 0 ℃ S Br
(2) 硝化
+ HNO3 N H (CH3COO)2O 5℃ N H 83% NO2 + NO2 N H 7%
(3)磺化:吡咯,呋喃对强酸敏感,需要较缓和的磺化剂, SO3-吡啶
SO3 C5H5N O O SO3H
活泼性:吡咯>呋喃>噻吩>苯
构效关系
1 烷烃的官能团化
结构特点: C:SP3杂化 正四面体 σ键
碳氢键极性较小
(特殊条件) 碳氢键断裂: 氢原子被取代
自由基机理:
Cl CH 3 33.5% 22% 28% 16.5% CH 3 CH 3 CH 3CHCH 2CH 3 Cl 2 光 CH 3-C-CH2CH 3 Cl CH 3CH CHCH 3 CH 3 Cl CH 3CHCH 2CH 2 CH 3 Cl CH 2-CHCH 2CH 3
第2章 分子的官能团化和功能团的转化

自由基反应
Br2 CH3 H3C C H CH3 300 ℃ Cl2 300 ℃ CH3 H3C C Br CH3 CH3 H2C Cl
H3C C Cl + H3C C H CH3 CH3
1
CH3 H3C C CH3 CH3 Cl2
紫外光
:
2
Cl
CH3 H3C C CH2 CH3
二、烯烃的官能团化
反应部位:碳-碳双键、双键的邻位——烯丙位
历程:亲电加成和自由基加成
产物:“Markovnikov”产物(亲电加成), “反-Markovnikov”产物(自由基加成)
立体化学:除硼氢化-氧化为顺式加成外,其余均为反 式加成。
Br2 ( HOBr ) Br Br Br Br
Cl H C CH3 HOCl H H CH3 OH H H3C H CH3 O
C H CH3
CH3 OH
Cl H C CH3 HOCl H3C H H OH CH3 OH H H CH3 O CH3
C H3C H
三、炔烃的官能团化
反应部位:碳-碳叁键、炔氢
历程:亲电加成和亲核加成
四、芳烃的官能团化
1、芳环上的亲电取代反应
2、侧链上的反应
苄基碳的卤化、氧化
3、取代苯衍生物的官能团化
碳碳叁键炔氢四芳烃的官能团化1芳环上的亲电取代反应2侧链上的反应苄基碳的卤化氧化3取代苯衍生物的官能团化五简单杂环化合物的官能团化22分子官能团化的转换一羟基的转换二氨基的转换三含卤化合物的转换四硝基的转换五氰基的转换六醛酮的转换七羧酸及其衍生物的转换
第二章
分子的官能团化 和功能团的转化
§2.1 分子的官能团化
化学官能团相互转换大全(part3)

化学官能团相互转换⼤全(part3)1N H+2C r 2O 7-2N H C l.C rO 3A g 2O :1. a m ild oxidizing agent2. m ust be freshly prepared : N aO H into A gN O 3 (aq)3. m ay involve surface change, react w ith C O 2, lightS w ern oxidation: (D M S O , ox alyl chloride, E t 3N )draw back: react at low TC ollins reagent: (C rO 3 - 2 P y)1. draw back: use 6 equivalent, a m essy reaction2. m ust b e very dry, fire easily; purify by C aH 23. an old ox idizing m aterial, isolated by C ollin. i. P C Cii. P D Civ. M v. S w vi. D D Q vii. M viii. O ix. K 2C RO Haldehyde1st alcohol2nd alcohol1st alcoholRO HORRORHO 5-hi. P C C ii. P D Ciii. C P D C (pyridinium dicho rm ate) (H 2C r 2O 7 + 2 P y) P C C (pyridinium chlorochrom ate) (P y-H C l-C rO 3)m ost w idely useduse 1 - 1.2 eq.60 %JO C , 1977, 42, 1991.S ynthesis, 1981, 165.O I OO A c O A cO2pH 6: w eak acid buffer, avoid interfere w ith ketal groupM cM urray reactioni. C orey approach: subtituted-quinone // H 3O +ii. W att approacha. PhC H O // M C PB A // H 3O +b. A rPhO // M C PB A // H 3O +c. N B S // K O H // H 3O +5-iOPhPhOPhN H 2Ph PhN H 2NCO H// H 3O +O O5-i.15-i.2i. Et 3N // H 3O+ii. TiC l 3 / pH 1 or 6iii. SiO 2 / N aO H // H 3O +JA C S, 1977, 99, 3861.iv. LD A / M oO 5-Py -v. N aO H // C H 3O H OOH 3O +vi. K M nO 4 / K O H C hem. R ev. 1955, 55, 137.35-j5-kIOOO H O (3 eq.)JA C S, 2001, 123, 3183.C H 3C H O2. D D Q / TFA.Synthesis, 1979, 537.JC S, 1932, 1875.Ph-F / D M SO 3.1. SeO 2a select oxidantindrect: change to R C -O H follow ed by oxidation direct: 1. D M A PO / D B U / C H 3C NF 4RB r RD M SO / A gB F 4- M e 2SB ull Soc. Jpn., 1981, 54, 2221. TH L, 1974, 917.2. N aIO 4 / D M FO B r84 %150 oC , 40 m inN aIO 4 / D M F a new m ethod 3. D M SO reagents:ii. D M SO / ZnSR CH B rM eR C (O )M eD M SO B rO H OO HZ nSJA C S, 2003, 68, 2480.RO44T H L , 1975, 4467.R C C H C C R R 'R C C HR C C ArR C C HC CRPhR C C Hsteric base, prevent N u attackn -B uL i: not M eL i, or t -B uL i, fire easily R X : R -B r, R -T O S , R C H O , R C (O )R n -B uL i / R 'C H O // A c 2O // K O t B uC lO M eN L iiii.ii. (Ph 3P)2PdC l 2, C uI, E t 2N H / PhIi. n-B uL i / R X6-b 6-a b c d e g 6-aCCC CCsulfonic acid: PhSO 3H ; sulfinic acid: PhSO 2H ; sulfenic acid: P hS O H iv. C uI, N aI, N a 2C O 3, RC C C H 2C lRCCHC lC H 2C C R 'RCCC H 2CCR 'Synthesis, 2000, 691.R C H 2-SO 2Ph R C C Hh fiR C H (C O 2H )-C H3-C(O )-C H 3OOOXC R R '=C H X5in fact: convert to C =C firstlyii. protect - deprotecti. m ove to term inal 6-c N H 2N H Kuse: K A P Ause: C o (C O )8 // F e(N O 3)3, E tO HJA C S , 1975, 97, 891.6-d use: i. B r 2 / C C l 4 // K O t B u6-euse: P b(O A c)4, L iC l // K O t B u // B r 2/C C l 4 // K O t B F e(N O 3)3: w eak oxidizing agent ii. B r 2 // K O HJAC S, 1941, 63, 1180.P hP hP hP h66-f, B r 2, K O tB uii. N H 2O H , N aN O 2 / H 2S O 4 // A c 2O / D M A Piii. L D A , C lP O (O E t)2ON NOD M A P :4-N ,N -D i m ethyl a m inop y ridinem ixture ofA c 2O / D M A P :N NC H 3O6-guse: T sN H N H 2 / E tO H , heatT H L , 1967, 3943.3(l)G erm an invention, as acylating agentL D A : L i N (iP r)2, ignored a long tim e, re-introduced by M ichigan S tate U. becam e fam ous, appeared every w eek 7LiN H 2 / N H 3 (l)R Xuse: LiN H 2 / N H 3 (l) / R -XO C l6-h6-i.JAC S, 1958, 80, 4599.JAC S, 1955, 77, 3293.M ePhHO SO 2C F 3B uLiM e C C Phvia:M e CPhJO C , 1978, 43, 364.A rA r'HB r A rC C A r'N aO Etvia:A r A r'B ri. N aO E t (w hen X = B r)ii. B uL i (w hen X = -O SO 2C F 3) 8R C H =C H 2:P B uR C H 2C H 2-O -P B u 3R C H 2C H 2-O HP h-S e-P B u 3P h-S e-C Nm echanism :O A c C O 2M eO A cM eOM eO 2CN 2S eNO A cC O 2M eO A c M eO M eO 2Capplied for reactions: w ithout rearrangem ent; no regiosiom er C CHO HD ean-S tark(C O 2H )2 / benzeneOC l C lC l C lOC l C lN C N COiii. P d-C ; or N i; P t, R hii. chloronaili. D D Q use base: D B Ni. C H 3I / A g 2O ii. H C H O / H C O 2H use: heatuse: heatuse base: i. R O N b7-i. p-T S O H.H 2O or C S Aii. w eak acid: H O A c; H C O 2H ; H 2C 2O 4iii strong acid: H iv. A rS eC N , P B use: C C H I C C HN H 2C CO C (S )S M e C C A c C C M s C C HO Ha7-i hg CCX C CC C CC HC O C C f e dcb a7--C(O )-C H 3C H -C HC H -C X9N aI / Zn (C u)i. Zn / acetone i. C SC l 2/C CO M s O M s C C B rB rC C O H O Hc7-C C O HIii. C SC l 2 / P(O M e)3P NN PO C l 3 / py // Snvia:C C IIapplication: i. protect alkene: via B r 2 // ZnC C C C C 36 o C C C C C =C 31 o C C C C C C l lC C B rO A cZn / H O A cOA cO A cOA cOB rO A cZn OO A c O A cO A cJO C , 1978, 43, 364.HO A c JC S.C C , 1998, 2113.ii. In / M eO Hii. purify com pound10d7-e7-i. W C l 6 / R L i ii. L iP Ph 2 / C H 3I product retention product inversion N aR C C HC H 2C H 2C H 2O H OC lRiii. N a(special structure):7-d.7-d.SR 1R 2R 1R 2(E tO )3Puse: (E tO )3PSynthesis , 1977, 1134.117-f.2not for W ittig, ylid unstableJO C , 1978, 43, 3253.JA C S, 1974, 96, 4706.C hem. Lett, 1973, 1041.T iC l 3-L iA lH 4 / T H F T iC l 3 / M g T iC l 4 / Z n T iC l 4 / K ii. M cM urry C ouplingi. use: N 2H 4 / H 2S / Pb(O A c)4B A SF, 1973, 2147.via:Z n-C uP(O E t)1. H 2S2. Pb(O A c)43. H 3O 1. H 2S2. Pb(O A c)4OON SN N NOSN NSNONNNSNN NOOSO ONOOO OOT iC l 3N 2H 412via : betaine, oxaphosphetane (N M R )expensivedifficult to prepareOE tC NPPh 3CNPPh 3HO PPh 3OC O 2M e+notPh 3PC H E tH COC O 2M enotPh 3P C H C O 2M eE tH O ++++stable ylid gives trans (E )unstable ylid gives cis (Z )w ater soluble, rem oved by extraction(com parison: O =PPh 3 highly soluble in organic solvent)use:L i Ph S ONM eCH 2// A l (H g)M e 3SiC H R -L i +Ph 3SiC H 2-L i +=== Ph 3SiC H 2B r + n-B uL i (exchange)M e 3SiC -H -M gB r === M e 3SiC H 2C l + M g (m etal reduction)Ph 3SiC -H C H 2Ph === Ph 3SiC H =C H 2 + PhL M e 3SiC -H C O 2E t === M e 3SiC H 2C O 2E t + L i (m etalation)M e 3SiC H =PPh 3 === M e 3SiC H 2PPh 3+ X - + K HR O = M eO -, E tO -use: (R O )2PO -C H R 'use: Ph 3P-C H R 'vi. Sulfoxim ide (Johnson C.)iii. Silyl W ittig R eaction (Peterson R eaction)ii. Phosphonate W ittig R eaction (H orner-Em m ons M odification)i. W ittig R eaction7-f7-f.Synthesis, 1984, 384.TH L, 1981, 2751.JO C , 1968, 33, 780.iv. C H 2(ZnI)2C hem. Lett, 1995, 259.Synlett, 1988, 12, 1369.H 2C H 2(ZnI)2v. C H 2C H B r 2, Sm , SnI 2 / C rC l 3, TH F R O Rvii. G rignard reagent:1. T M SC H M gC l use: TM SC H 2M gC l TH L, 1973, 3497.TH L, 1988, 4339.2. N aO A c, A cO Hm ethylenationR R 'e 3H advantages over the W ittig:1. by-products are m ore easily rem oved,2. reaction suffers less from steric effects. via:(olefination reaction)1953 discoverg 7-form trans alkene: form cis alkene:i. Li / N H3; or other IA m etalsii. Li / EtN H2iii. L iA lH4 / TH Fi. H2 / N i2B (P-2 catalyst)ii. H2 / Pd-C aC O3 (Lindlar catalyst)iii. H2 / Pd-B aSO4iv. B2H6 / H O A c (D iborane)v. N2H2vi. H C H O / Pd-C / E t3Nnot use H2 / Pt: m ight convert to alkaneh7-all form trans alkene:i. R2B H / B r-C N (hydroboration)C C HRHHii. D IB A L / n-B uLi / C H3I (hydroalum ination) iii. C p2ZrC lH / R X (hydrozirconation)13application: protecting groupvia dihalidevia halohydrinvia epoxidevia diene-olefin additionC=C C CX XC CH XC=CC COC=CC=CC=CC=C C=CC=CC CC CH O Hnot for double bond m ight m ove M nO2 / Ph3P C H3B r- / M TB DNNNvia diradicalJAC S, 1998, 100, 877. Ph Ph Ph7-i7-j148-a8-a.28-a.38-a.41. H I3. T sC l / C62. P I3JC S, 1905, 87, 1592.C H O H C H IP I38-a.12. F3S-N E t2SNSFO OOOC h em. R ev., 1996, 96, 1737.C H C l2FC H3SOOO HO NC H C l2C H31. C F C H F C F N E t2. H O A c / i P rO H$ 65 / 500 g$ 80 / 50 gP B r3P I3$ 35 / 1000 gP B r3$ 500 / 125 gJO C, 1993, 58, 3800.8-C-XC-O H C(O)ZdcaC-N H2C=O2. P P h3 / I2e C-H15168-d8-d.1R C OO H1. A gN O 3/K O H2. B r 2R B r B er. 1942, 75, 296.8-d.2C lOClR hC l(PPh 3)38-bN aN O 2 / H C l / H B F 4 /for arom C hem R ev., 1956, 56, 219. 8-cC F 2B r 2 / ZnFF 58 %JC S.PT I, 1993, 335.178-e8-e.1I86 %I 2 / H N O 3JA C S,1917, 39, 437.8-e.3I 2 / H N O 3PhC H 2C (O )C H 3PhC H C (O )C H 3F N S FOOF +C hem. R ev., 1996, 96, 1737.F-TEDA-B F4 JC S.C C , 1994, 149.F 2-N 2 / C FC l 3-C H C l 3JO C , 1988, 53, 2803.90 %ada m anta ne1. regioselective fluorination at the m ore substituted positions2. electrophilic in natureF -N C FCl 3-C HCl 3OO NXR 1R 3OOR 2HM g(C lO 4)2R 1R 3O OR 2XN B X / M g(C lO 4)2JO C , 2002, 67, 7429.8-e.2X = C l, B r, IX = C l, B r, IN B XN B X :i.ii.iii.iv.RRF R = C H 3C O , C O C F 3, C C l 3, N O 2 H F / electrolysis1.4-1.6 Valready industrilizedN F 3O / TB A H / C H 3C Nv.T B H A : Tetrabutylam m onium hydroxideTH L , 2003, 44, 2799.189-a9-C -C H 3C -Xa (C H 3)3AlM e 3A l98 %O rganom et. C hem. R ev., 1996, 4, 47.C H 2C l 2bridgehead m ethylation。
有机化合物的官能团反应官能团转化的化学过程

有机化合物的官能团反应官能团转化的化学过程有机化合物是由碳和氢元素组成的化合物,具有丰富的化学性质。
官能团是分子中具有特定化学性质的原子或原子团,能够参与各种反应,实现官能团之间的转化。
这些反应涉及不同的化学过程,包括取代反应、加成反应、消除反应、重排反应等。
下面将详细介绍有机化合物的官能团反应和官能团转化的化学过程。
一、取代反应取代反应是有机化学中最常见的反应之一。
它是通过一个官能团与另一个官能团的结合,将一个官能团替换为另一个官能团。
常见的取代反应有烷基取代反应、芳香核取代反应等。
烷基取代反应是通过一个烷基官能团与一个新的官能团发生反应,将原本的烷基官能团替换为新的官能团。
例如,氯代烃与碱反应生成醇,氯代烃中的氯原子即被醇官能团取代。
芳香核取代反应是指芳香烃分子中的一个氢原子被另一个官能团取代,形成新的官能团。
例如,苯与亲电试剂进行取代反应,取代的官能团可以是醇基、氨基等。
二、加成反应加成反应是指有机化合物中两个原子或原子团发生加成反应,形成一个较大的官能团或一个新的官能团。
常见的加成反应有烯烃的加成反应、烯醇的加成反应等。
烯烃的加成反应中,烯烃中的双键与试剂中的元素键结合,形成新的官能团。
例如,乙烯与氢气进行加成反应,生成乙烷。
这种反应被称为氢化反应,也是一种加成反应。
烯醇的加成反应是指烯烃和水分子发生加成反应,生成醛或酮官能团。
例如,乙烯与水反应生成乙醛。
三、消除反应消除反应是指有机化合物中的官能团脱离分子,并生成双键或三键。
常见的消除反应有酸性消除反应、碱性消除反应等。
酸性消除反应是指酸性条件下,有机化合物中的官能团被酸基去除,形成双键。
例如,醇在酸性条件下脱水反应生成烯烃。
碱性消除反应是指碱性条件下,有机化合物中的官能团被碱基去除,形成双键或三键。
例如,卤代烃与碱反应产生烯烃。
四、重排反应重排反应是指有机化合物中官能团原子间或官能团与分子内其他官能团之间的结构重新排列,生成新的官能团。
有机化学中的官能团和官能团转化反应

有机化学中的官能团和官能团转化反应有机化学是研究碳元素化合物的科学,它研究的对象是有机化合物的结构、性质和反应。
官能团是有机化合物中具有一定化学性质和反应特点的基团,它们决定了有机化合物的性质和反应途径。
在有机化学中,官能团转化反应是一种重要的反应类型,它可以将一个官能团转化为另一个官能团,从而改变有机化合物的性质和用途。
一、官能团的定义和分类官能团是有机化合物中具有一定化学性质和反应特点的基团。
它们通常由原子团组成,可以通过化学反应转化为其他官能团。
常见的官能团包括羟基、羧基、醇基、酮基、醛基、氨基等。
根据官能团的特点和性质,可以将它们分为不同的类别。
例如,羟基和醇基都是含有氧原子的官能团,它们可以通过氧化反应转化为羧基;酮基和醛基都是含有碳氧双键的官能团,它们可以通过还原反应转化为醇基。
不同的官能团转化反应有着不同的机理和条件,研究和应用这些反应可以为有机化学的发展提供重要的基础。
二、官能团转化反应的机理和条件官能团转化反应的机理和条件取决于具体的反应类型和官能团结构。
以羟基转化为羧基为例,它可以通过氧化反应实现。
一种常用的氧化剂是酸性高锰酸钾溶液,它可以将羟基氧化为羧基。
在反应中,高锰酸钾被还原为二价锰离子,羟基被氧化为羧基。
这种反应常用于醇的氧化反应,可以将醇转化为醛或酮。
官能团转化反应的条件也取决于具体的反应类型和官能团结构。
以氨基转化为酯基为例,它可以通过酯化反应实现。
酯化反应需要酸催化剂和醇作为反应物,通过酸催化剂的作用,氨基可以与醇发生酯化反应,生成酯基。
酯化反应常用于合成酯类化合物,广泛应用于食品、药品和香料等领域。
三、官能团转化反应的应用官能团转化反应在有机化学中有着广泛的应用。
它可以用于有机合成、药物合成、材料合成等领域。
通过官能团转化反应,可以将一个官能团转化为另一个官能团,从而改变有机化合物的性质和用途。
例如,氨基转化为酯基的酯化反应可以用于合成酯类化合物。
酯类化合物在食品、药品和香料等领域有着广泛的应用。
有机合成中的新型官能团官能团转化方法

有机合成中的新型官能团官能团转化方法有机合成中的新型官能团转化方法有机合成是化学领域中的一个重要研究方向,它涉及到合成有机化合物的方法和技术。
在有机合成中,官能团的转化是一个关键步骤,它可以将一个官能团转化成另一个特定的官能团。
随着科学技术的不断发展,越来越多的新型官能团转化方法被开发出来,本文将介绍其中一些新颖的方法。
1. 环合反应法环合反应是一种重要的有机合成方法,它能够在分子中形成环状结构。
在有机合成中,环合反应可以通过使用适当的试剂和条件,将已有的官能团转化为环状结构。
例如,氧化环合反应可以将醇转化为环醚,羧酸转化为内酯。
这些环合反应不仅可以构建多样化的化合物结构,还可以有效地提高合成反应的产率和选择性。
2. 氧化还原法氧化还原反应在有机合成中是一种常用的官能团转化方法。
通过氧化还原反应,可以在分子中引入或去除电荷,从而改变分子的性质和反应活性。
例如,通过还原醛或酮可以得到对应的醇,而通过氧化醇可以得到对应的醛或酮。
氧化还原反应在制备药物、天然产物合成等方面有着广泛的应用。
3. 反应活化法反应活化是一种通过引入特定官能团,提高官能团转化反应活性的方法。
例如,可以通过在分子中引入活化基团来加速亲核试剂的加成反应。
活化基团可以通过共轭系统、杂环结构等方式引入。
反应活化法在有机合成中具有重要的应用价值,能够提高反应速率和选择性。
4. 催化剂法催化剂的引入可以加速特定官能团转化反应的进行,同时在反应中起到节约原料、提高选择性等作用。
催化剂可以选择各种金属催化剂、酶等物质,根据反应类型的不同选择不同的催化剂。
例如,通过金属催化剂,在羰基化合物中引入卤素原子,从而实现烯醇和烯醇醚的高效官能团转化。
5. 等离子体法等离子体是一种高能粒子形式,在有机合成中可以用于官能团转化反应。
通过等离子体法,可以在分子中产生超过10000K的高温,实现官能团转化反应。
等离子体法广泛应用于化学合成、光化学反应等领域,可以有效地实现官能团转化反应。
第二章官能团化及转换

②取代芳环上的取代反应
CH3
H3C
+CO+HCl CH3
AlCl3
CH3CHO
H3C
CH3 80%
H O
O H
H C l
+ C H 3C N Z n C l2 H O
O H C N H 2C l- H 2 OH O C H 3
O H O
C C H 3
70 %
现在学习的是第10页,共22页
③芳环侧链上的反应
.
R C HC HC H 2
NBS
B r
B r
R C HC HC H 2+R C HC H C H 2
现在学习的是第6页,共22页
◆ N-溴代丁二酰亚胺(NBS)在光催化条件下,可使多种甾
烯的亚甲基氧化,具有良好的区域选择性.
H 3C CO O
hv/N BS/CaC O 3 TH F/H 2O
H 3C CO O
现在学习的是第2页,共22页
2.1.1 烷烃的官能团化
◆烷烃对亲电试剂和亲核试剂都不活泼,但在自由基反 应中,特别是在卤化反应里,烷烃却很活泼,由于这 些反应难以控制,其合成应用受到限制。
H3C
CH3 CH CH3
Br2
300 o C
CH3 H3C C Br
CH3
Cl2
300 o C
CH3 H3C C Cl +
CH3
CH2 Cl H3C C H
CH3
CH3
Cl2
CH3
H3CCCH3 紫 外 光 H3CC CH2Cl
CH3
CH3
注意伯、仲、叔氢的活泼性及碳自由基的稳定性.
现在学习的是第3页,共22页
有机物官能团的转化

CH3COOC2H5
酯类 RCOOR`
CH2=CH2
CH3CH2OH
CH3CHO
CH3COOH
CH=CH CH2=CHCl
CH2Br CH2Br
[ CH2—CH ]n Cl
CH2OH
CHO
CH2OH
CHO
O O=C CH2 O=C CH2
O
COOH COOH
第十五页,编辑于星期一:二十点 三十七分。
(1)有弱酸性 (2)取代反应 (3)显色反应 (4)缩聚反应
(1)氧化反应 (2)还原反应 (1)具有酸性 (2)酯化反应
水解反应
第九页,编辑于星期一:二十点 三十七分。
-C=C-或-C=O的引入
官能团引入
1.醇与卤代烃的消去反应
CH3CH2OH
浓硫酸 170℃
CH2=CH2+H2O
NaOH醇△
则有机玻璃的结构简式是
。
第二页,编辑于星期一:二十点 三十七分。
1、写出官能团的名称
分析:这是近年来高考的热点之一,它
考察了最基本的化学知识,但因为大家 很熟悉,平时就容易忘记它。
策略:平时多练习以下的官能团名
称:羟基、羧基、醛基、酯基、卤 原子、碳碳双键、碳碳三键等。
第三页,编辑于星期一:二十点 三十七分。
2、考查有机物的命名 策略:平时也需要关注常见有机
物的命名,重点是烯烃、醇和酯。
第四页,编辑于星期一:二十点 三十七分。
3、考查有机物的物理性质
规律(中学常见)
1、状态:一到四个碳原子的烃及新戊烷、 一氯甲烷、甲醛常温下为气体。
2、密度:一般烃和酯都比水轻。
3、溶解度:低级的一元的醇、醛、酸易 溶于水,其他的一般难溶于水易溶于有机 溶剂。
有机物常见官能团的变化

★★★★★有机物常见官能团的变化江油一中各类烃及烃的衍生物的相互转化,其实质是官能团之间的互换和变化。
一、 与卤素原子的有关变化:1、 取代反应: ①烷烃与卤素单质光照下反应:CH 4 + Cl 2CH 3Cl + HCl+Br 2 + HBr ③苯酚与溴水反应:+ 3Br 2+ 3HCl④醇与卤化氢反应:R OH + HBr R Br + H 2O ⑤苯同系物侧链与卤素单质反应:Cl 2 + HCl ⑥苯同系物与卤素单质反应: Br 2 + HBr 2:① 烯烃与卤素单质加成:CH 2 CH 2 + Br 2 CH 2Br CH 2Br②烯烃与卤化氢加成:CH 2 CH 2 + HCl CH 3 CH 2Cl ③炔烃与卤化氢、卤素单质加成:CH CH + Br 2 CH CHCH CH + HBr CH 2 CH 2Br光 Fe OH Br -光照Fe催化剂 △Br Br 催化剂 △二、羟基有关的变化:1、卤代烃碱性条件下水解生成醇: R 2O ROH + HX 2、 氯苯水解制苯酚:+ H 2O +HCl 3、烯烃与水加成:CH 2 CH 2 + H 2O CH 3CH 2OH4、醛、酮还原:R CHO + H 2 R CH 2OHR COR ’ + H 2 R CH ’ 5、脂水解:RCOOR ’+ H 2O RCOOH + R ’OH ①CH 3COOCH 2CH 3 + H 2O CH 3COOH + CH 3CH 2OH②+ H 2O + CH 3COOH1735COOCH 2 ③ + 3H 2O + 3C 17H 35COOH 三、与羰基有关的变化:1、 氧化反应:①烯烃氧化:2CH 2 CH 2 + O 2 2CH 3CHO ②醇氧化:2RCH 2OH + O 2 2RCHO + 2H 2O 2R CH R ’ + O 2 2R C R ’ + 2H 2O ③烯烃臭氧分解: RCH ’ RCHO + R ’CHO 2、炔烃水化: CH 2O CH 3CHO 3、羰基合成:CH 2 CH 2 + CO + H 2O CH 3CH 2CHO四、与羰基有关的变化:1、醛的催化氧化:2RCHO + O 2 2RCOOH△碱 3 催化剂 高温、高压催化剂 催化剂 催化剂 催化剂 稀硫酸 △3 催化剂△ C 17H 35COOCH C 17H 35COOCH 2 催化剂 △CH 2 2OH CHOH 催化剂 △ △催化剂 OH 催化剂 △ O O 3 Zn 、H 2O 催化剂催化剂 催化剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
JA C S, 1972, 94, 7159.L A H ------------ alm ost all: ald, ketone, acie, ester, acyl X, anhydrideN aB H4 --------------- not for acid, ester (but L iB H4 w ork for ester)B2H6 --------------- not for ester, acyl X, anhydride;from top:L iA lH4; N aB H4; N a / N H3A l (O i Pr)3 / i PrO H ----------- M eerw ein-Pondorf-V erley rxnIrC l4 / i P rO H / P(O M e)3 ------ H enbest rxnL iB H(sec Bu)3 ------------------ H. C. B row nfrom bottom:(2). stereoselective:(1). regioselective:3-h(3). H C H O reagent:M e C H O M eO HH C H OJA C S, 1935, 511, 903.C H3C H O C(C H2O H)42O rg.Syn, 1925, 4, 53.H C H O / K O HH C H O / C a(O H)2S ynthesis, 1994, 1007.PhN O2OPhN O2H O HB H / SM eJO C, 2001, 66, 7514.JO C, 2003, 68, 2030.OB H3 / T H F99.5 % transsolvent: T H F, S M e23-iR3B, H O C H2C H2O H // H2O2 // N aO HJO C, 1986, 51, 4925.C O RRR3BRRRRR3C B OH O C H2C H2O HR3C BOOH2O2O HR3HO BOOR3CH2OR3C O Hp ra c tic e3-k OO HHO HO HOO HO HHO HO HJO C , 1967, 32, 3452.H 2O 2: dangerous,skin w hiten, m etal decom poseH g (O A c)2: toxic, hard to rem ove (3). B 2H 6, H 2O 2 / O H -, H 2O(2). H g(O A c)2, H 2O // N aB H 4(1). H 3O +3-j3-j.13-j.2hydration:(1). K M nO 4 / N aO H (2). O sO 4(3). H 2O 2/H C O 2H (4). N a / E tO HH Hcis tran cis +trancisM e 2NNNC H 3HC lH 3N C H 3H H N C H 3CH H+NC H 3C l N H H C H OCO O HA C H 21. L A H R 3C N H 2RCN R 2R C N H R R 3CO HR 2C O H R C O H R C N H 2tertiarysecondary prim ary C om pare nom enclature class:not a very useful reactionC -NC -H C -N C -X C -O H C =OC =C 4-abc d ef g 4-aSO 2N H 2Ph IO A c O A cS O ON H S OON I P h Fe (T PP )C lS O ON H 2(insertion)T P PN NNNP h2. N aN 3N C O1. SO 2C l 2O 2CCO O h iC N C (O )X C -C (O )XN H 2H 2R C N O 2R C N H 2i ii4-b C F 3C O 3H // F e / H O A c1. m an y red u cin g ag en ts4-b.14-b.21.2.3.4.F e 3(C O )12 / C H 3O HJO C , 1972, 37, 930.N aB H 4 / P d -C N a 2S S n / H C l V o g el's 12.57V o g el's 12.58V o g el's 12.595.H 2 / P t (S )-CJA C S , 1965, 87, 2767.su lfid ed p latiu mn o t affect: aro m atic rin g s, k eto n es, h alid es, n itriles, am id e, eastersJA CS, 1933, 55, 4579.2H CH O N M e 2CO 2EtN H 2CO 2EtRC N CC NRCCRC N H 2iC N R N N+-C N R R'ii 1. H CH O / H CO 2H 1. RBCl 2 / base1. H C(O Et)3 // N aBH 4;2. R 2CO // N aBH 3CN N H 2NCH 3CH 3H CH O H CO O HN 3N HBCl 2N H 2C O O HN CO O HHCH 3H C(O Et)N aBH 4b.3 2. H CH O // H 2 / Pd-CN 3N O 2M eO 2CN aBH 4CoCl 26H 2O (cat)rtN H 2N O 2M eO 2CSynthesis, 1979,537.m ild conditionhigh yieldnot affect:: N O 2, C=C, CN , CO O R, CO O H2. N aBH 4 / CoCl 2-6H 2Ono t g o od , u su ally co n tain p o lyalk ylatio n p ro d u cts2. D elep in e3. N aN 3 / R E D4-d4-c 5. U n p o lu n g4. N aN 3 / R E D3. D elep in e2. G ab riel:1. N H 3N OK N 2H 42Oi. L A H , N aB H 4ii. H 2 / catiii Z n / H C l; A l (H g )i. M g // N H 2C lii. M g // P h S C H 2-N 3co m m ercial av ailab le, tetram er o f M e 3N24. C B r 4, P P h 3, N aN 3, D M F // P P h 3 / T H FJO C , 2000, 65, 7110.u ro tro p in e (乌洛托品)m eth en am in e (六甲烯胺)h ex am eth ylen etetram in e (环六亚甲基四胺)内服后遇酸分解出 H C H O ,可做尿道消毒剂, 治膀胱炎B 2H 6 / H 2N O SO 3HB 2H 6 / H 2N OC H 3C N / H 3O +B 2H 6 / N H 2C l C =CC -C -N H C O C H 3C =C C -C -N H 24-f4-e5. P 4S 10 // R aN i4. E t 3O + B F 4- // N aB H 43. B 2H 62. N aB H 3(O C O R )1. L iA lH 46. L aw esson's reagent // R 4-h4-g4-g.a4-g.b RC N H 2R C N H 2R 'formformA lH 3 / T H FB rCNB r N H 2JO C , 2000, 65, 8152.A lH T H FT H , 1989, 30, 5137.JO C , 1987, 52, 3901.R 'L i // N aB H 4R 'M gX // N aB H 4R 'M gX // L i/N H 3(l)R '2C uL i // N aB H 4T H , 1989, 30, 5139.JO C , 1993, 58, 4313.RCNR CN H 2R 'R 'M // H4-iN H 2ON HO C H 3O PhI(O A c)23JO C , 1993, 58, 2478.RCON H 2RCONIPhO A c RNCOR N HCOO C H 3C H 3O HPhI, O A ccPhI(O A c)4-i.2CN H 2R C H 2PhI(O A c)2 // K O H / C H 3O HC(O R)2C(S R)2hC-N H2C-N O2C NC C5-agfdcba5-C=C-O RC=C-S RC-O HC=N-O HC=N-HC=SC=OC=Ov. via: epox ysilan eR COC RR COC H2R242H3O+C O2H3OOO2-4OO3H3O+Z nT sN H N H2M eL i T M S C l M C P B A L A H24C H2ORRC H2ORRaq C H3C N/C H2CORRi. via:α-C O2Hii. via: α-haloketon eiii. via: ald ol p ro cessiv. via: thioen ol etherROC H2Rd raw back: req uire sim ple stru cture, use m an y p ow erful ag ents: M eL i, L A H, M C P B Aeij C-B rk C-Hii. M C P B Ai. h yd ro lysis 5-b5-c C =N -O HC =N -Hi. R aN i ii. T iC l 3iii. K M n O 4 / A l 2O 3H 3O+5-dH g 2+ / H 2OJO C , 1972, 37, 2138.JO C , 1970, 35, 858.H g S O 4 / H 2O / H 2O5-c.15-c.2T H L , 2001, 42, 4775.1. D IB A L / H 3O +5-eS tenphen reductionm ostly forJ.O rg.S yn , 1925, 3, 1874.2. H C l./ S nC l 2 / E t 2O 5-e.1R -CH 2-CN5-e.25-e.3-C H 2-C OHR -C H -C OH R 'R -C H -C OR "R 'R 'X / n -B uL i C H 3I R ''M gB r H 3O+3.O HO HH 3O +O HO H5-fH 3O +H g 2+ / C H 3C N (aq)C =C -O RC =C -SRO C H 3OH 3O +SC H 3OH g 2+3H 3O H g2+3H 3O+OO O SSS S SR SR O O O R O R 5-gH g 2+/ H 3O+H 3O + / solv (aq)H 3O + / solv (aq)H g 2+ / H 3O +O R O RO H O HH 3O +/ solv (aq)acid catalysta very com m on protecting group, deprotect back to ketoneHCO E t O E tO E tR M gX / H 3O +HCO E t O E tO E tR M gXRCHO。
