有机物官能团知识归纳表
有机化学基础知识点整理官能团的常见命名与结构式表示

有机化学基础知识点整理官能团的常见命名与结构式表示有机化学基础知识点整理官能团的常见命名与结构式表示在有机化学中,官能团是指分子中具有特定化学性质的“功能部分”。
正确命名和准确表示官能团对于理解和学习有机化学至关重要。
本文将对一些常见的官能团及其命名与结构式表示进行整理和介绍。
I. 烃类官能团烃类是由碳和氢组成的化合物,没有官能团。
常见的烃类有烷烃、烯烃和炔烃。
它们的命名和结构式表示如下:1. 烷烃:以"-ane"为后缀命名,结构式使用线段表示,每个碳原子用顶点表示。
- 甲烷:methane (CH4)- 乙烷:ethane (C2H6)- 丙烷:propane (C3H8)2. 烯烃:以"-ene"为后缀命名,结构式使用线段及双键表示。
- 乙烯:ethylene (C2H4)- 丙烯:propene (C3H6)- 戊烯:butene (C4H8)3. 炔烃:以"-yne"为后缀命名,结构式使用线段及三键表示。
- 乙炔:ethyne (C2H2)- 丙炔:propyne (C3H4)- 戊炔:butyne (C4H6)II. 卤代烃官能团卤代烃是烃类分子中的氢被卤素(氟、氯、溴、碘)取代而成的化合物。
常见的卤代烃有氯代烷、溴代烷和碘代烷。
它们的命名和结构式表示如下:1. 氯代烷:以"-chloride"为后缀命名或使用"chloro-"作为前缀,结构式在相应的碳原子上用Cl表示。
- 氯甲烷:chloromethane(CH3Cl)- 1,2-二氯乙烷:1,2-dichloroethane(CH2Cl-CH2Cl)2. 溴代烷:以"-bromide"为后缀命名或使用"bromo-"作为前缀,结构式在相应的碳原子上用Br表示。
- 溴乙烷:bromoethane(CH3CH2Br)- 2,3,4-三溴戊烷:2,3,4-tribromopentane(CH3CHBr-CHBr-CH3)3. 碘代烷:以"-iodide"为后缀命名或使用"iodo-"作为前缀,结构式在相应的碳原子上用I表示。
(完整版)【非常详细】有机化学知识点归纳

有机化学知识点归纳一、有机物的结构与性质1 、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。
原子: —X官能团 原子团(基): —OH 、—CHO (醛基) 、—COOH (羧基) 、C 6H 5— 等化学键: C=C 、—C≡C—2、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A) 官能团:无 ;通式: C n H 2n+2;代表物: CH 4B) 结构特点:键角为 109°28′,空间正四面体分子。
烷烃分子中的每个 C 原子的四个价键也都如此。
C) 物理性质: 1.常温下,它们的状态由气态、液态到固态,且无论是气体还是液体,均为无色。
一般地, C1~C4 气态, C5~C16 液态, C17 以上固态。
2.它们的熔沸点由低到高。
3.烷烃的密度由小到大,但都小于 1g/cm^3 ,即都小于水的密度。
4.烷烃都不溶于水,易溶于有机溶剂D) 化学性质:①取代反应(与卤素单质、在光照条件下)CH 4 + Cl 2 CH 3Cl + HCl , CH 3Cl + Cl 2 CH 2Cl 2 + HCl ,……。
点燃②燃烧 CH 4 + 2O 2 CO 2 + 2H 2O高温C 16H 34 催化剂C 8H 18 + C 8H 16加热、加压④烃类燃烧通式: C x H t + (x +y )O 2 点———燃 xCO 2 + y H 2O 4 2⑤烃的含氧衍生物燃烧通式 : C x H y O z + (x +y - z )O 2 点———燃 xCO 2 + yH 2O 4 2 2E) 实验室制法:甲烷: CH 3 COONa + NaOHOCH 4 个 +Na 2 CO 3△注: 1.醋酸钠:碱石灰=1: 3 2.固固加热 3.无水(不能用 NaAc 晶体) 4.CaO :吸水、稀释 NaOH 、不是催化剂(2)烯烃:A) 官能团: C=C ;通式: C n H 2n (n≥2);代表物: H 2C=CH 2B) 结构特点:键角为 120° 。
有机化学中的官能团

有机化学中的官能团官能团是决定有机化合物性质的原子或原子团,有机化学反应主要发生在官能团上,官能团很大程度上决定了有机物的反应方向。
一.常见的有机化合物官能团有以下几种:6.羧基(-COOH);酸性,与NaOH反应生成水(中和反应),与NaHCO3、Na2CO3反应生成二氧化碳,与醇发生酯化反应二.表格如下:10药学三班温林文- 汉语汉字编辑词条文,wen,从玄从爻。
天地万物的信息产生出来的现象、纹路、轨迹,描绘出了阴阳二气在事物中的运行轨迹和原理。
故文即为符。
上古之时,符文一体。
古者伏羲氏之王天下也,始画八卦,造书契,以代结绳(爻)之政,由是文籍生焉。
--《尚书序》依类象形,故谓之文。
其后形声相益,即谓之字。
--《说文》序》仓颉造书,形立谓之文,声具谓之字。
--《古今通论》(1) 象形。
甲骨文此字象纹理纵横交错形。
"文"是汉字的一个部首。
本义:花纹;纹理。
(2) 同本义[figure;veins]文,英语念为:text、article等,从字面意思上就可以理解为文章、文字,与古今中外的各个文学著作中出现的各种文字字形密不可分。
古有甲骨文、金文、小篆等,今有宋体、楷体等,都在这一方面突出了"文"的重要性。
古今中外,人们对于"文"都有自己不同的认知,从大的方面来讲,它可以用于表示一个民族的文化历史,从小的方面来说它可用于用于表示单独的一个"文"字,可用于表示一段话,也可用于人物的姓氏。
折叠编辑本段基本字义1.事物错综所造成的纹理或形象:灿若~锦。
2.刺画花纹:~身。
3.记录语言的符号:~字。
~盲。
以~害辞。
4.用文字记下来以及与之有关的:~凭。
~艺。
~体。
~典。
~苑。
~献(指有历史价值和参考价值的图书资料)。
~采(a.文辞、文艺方面的才华;b.错杂艳丽的色彩)。
5.人类劳动成果的总结:~化。
~物。
6.自然界的某些现象:天~。
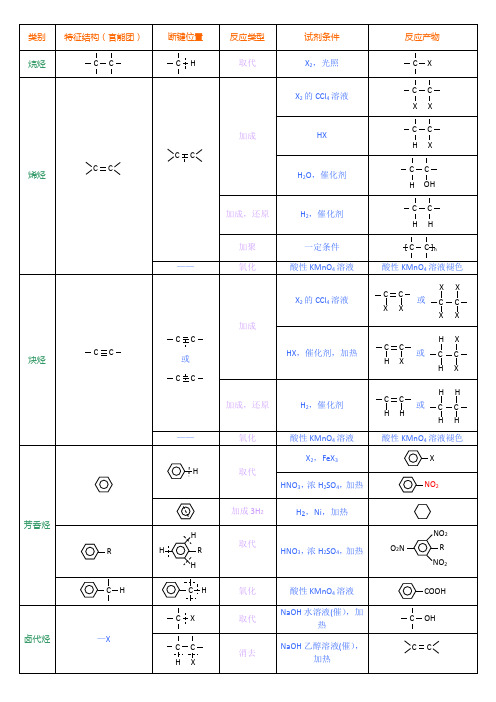
有机化学官能团高效记忆表格

物质类别
特征结构(官能团)
断键位置
反应类型
试剂条件
反应产物
烷烃
取代
X2,光照
烯烃
加成
X2的CCl4溶液
HX
H2O,催化剂
加成,还原
H2,催化剂
加聚
一定条件
—-
氧化
酸性KMnO4溶液
酸性KMnO4溶液褪色
炔烃
或
加成
X2的CCl4溶液
或
HX,催化剂,加热
或
加成,还原
H2,催化剂
或
—-
氧化
酸性KMnO4溶液
酸性KMnO4溶液褪色
芳香烃
取代
X2,FeX3
HNO3,浓H2SO4,加热
加成3H2
H2,Ni,加热
取代
HNO3,浓H2SO4,加热
氧化
酸性KMnO4溶液
卤代烃
—X
取代
NaOH水溶液(催),加热
消去
NaOH乙醇溶液(催),
加热
醇
—OH
取代、置换
Na
取代、酯化
羧酸—COOH,浓H2SO4,加热
[有机物间的相互转化关系]
图1:
Na
中和
NaOH溶液
取代、酯化
醇,浓H2SO4,加热
酯
取代、水解
稀H2SO4,加热
(或NaOH溶液,加热)
其中:
1、能使KMnO4褪色的有机物:
烯烃、炔烃、苯的同系物、醇、酚、醛、葡萄糖、麦芽糖、油脂
2、能使Br2水褪色的有机物:烯烃、炔烃、酚、醛、葡萄糖、麦芽糖、油脂
3、能与Na反应产生H2的有机物:醇、酚、羧酸、氨基酸、葡萄糖
官能团的性质及有机化学知识总结

有机物官能团与性质][知识归纳有机物官能团代表物主要化学性质取代(氯气、光照)C-C烷烃、裂化甲烷加成、氧化(使KMnO褪色)乙烯烯烃C=C、加聚4烃加成、氧化(使KMnO炔烃褪色)乙炔C=C、加聚4取代(液溴、铁)苯及其、硝化、加成苯—R氧化(使同系物KMnO甲苯褪色,除苯外)水解(NaOH/HO溴乙烷卤代烃)、消去(NaOH/醇)X—2烃置换、催化氧化、消去、脱水、酯化乙醇醇OH—的弱酸性、取代(浓溴水)、显色、酚苯酚OH还原、催化氧化、银镜反应、斐林反乙CH—生弱酸性、酯化乙酸COOH—羧酸物乙酸乙酯——COO酯水解CHO、——OH葡萄糖重/具有醇和醛的性质蔗糖CHO前者无—无还原性、水解(产物两种)要/前者有—麦芽糖CHO 有还原性、水解(产物单一)的(淀粉OnH)C水解/5106营/氢化、皂化—COO—油脂养、-氨基酸NH-COOH两性、酯化/2物其中:褪色的有机物:KMnO、能使14烯烃、炔烃、苯的同系物、醇、酚、醛、葡萄糖、麦芽糖、油脂2Br、能使水褪色的有机物:烯烃、炔烃、酚、醛、葡萄糖、麦芽糖、油脂2反应产生、能与3Na的有机物:醇、酚、羧酸、氨基酸、葡萄糖H24、NaOH、具有酸性(能与CONa反应)的有机物:酚、羧酸、氨基酸32、能发生银镜反应或与新制5Cu(OH)反应的有机物:2醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖、既有氧化性,又有还原性的有机物:醛、烯烃、炔烃67、能发生颜色(显色)反应的有机物:变蓝、蛋白质遇浓硝酸变黄、葡萄糖遇FeCl苯酚遇 Cu(OH)显紫色、淀粉遇I显绛蓝223.[有机物间的相互转化关系]图1:C4CHCOOCHCHCOOHCHOCHOHCHCHCHCH523332322CHOCOOHCHCHHCCHCHHC2222CHOCOOHBrBrOHOH OOOO或OCHCOCHC[]nO22O[有机合成的常规方法]1.引入官能团:①引入-X的方法:烯、炔的加成,烷、苯及其同系物的取代②引入-OH的方法:烯加水,醛、酮加氢,醛的氧化、酯的水解、卤代烃的水解、糖分解为乙醇和CO 2③引入C=C的方法:醇、卤代烃的消去,炔的不完全加成,*醇氧化引入C=O2.消除官能团①消除双键方法:加成反应②消除羟基方法:消去、氧化、酯化③消除醛基方法:还原和氧化.有机反应类型3.、加成、加聚、消去、氧化、还原等。
有机化学官能团高效记忆(表格)
烷烃取代X 2,光照烯烃加成 X 2的CCl 4溶液HXH 2O ,催化剂加成,还原H 2,催化剂加聚一定条件—— 氧化酸性KMnO 4溶液酸性KMnO 4溶液褪色 炔烃或加成X 2的CCl 4溶液或HX ,催化剂,加热或加成,还原 H 2,催化剂或——氧化酸性KMnO 4溶液酸性KMnO 4溶液褪色芳香烃取代X 2,FeX 3HNO 3,浓H 2SO 4,加热加成3H 2H 2,Ni ,加热取代HNO 3,浓H 2SO 4,加热氧化 酸性KMnO 4溶液 卤代烃—X取代NaOH 水溶液(催),加热消去NaOH 乙醇溶液(催),加热C C H H C CC C X X C C X H C C OH H C CC HH X NO 2 RR NO 2 NO 2O 2N R H H HC H COOHCH HC H HCH X C H XC XXC XX C C H HC C H XC C XXCC CC CC C CXC OH C C C X H C C H C X C C ]n[ C醇—OH取代、置换Na取代、酯化羧酸—COOH ,浓H 2SO 4,加热氧化O 2,Cu ,加热取代 浓HX 溶液,加热消去浓H 2SO 4,加热—CH 2—OH ——氧化 酸性KMnO 4溶液(或酸性K 2Cr 2O 7溶液)—COOH酚取代 溴水取代、置换 Na中和 NaOH 溶液 ——氧化空气 —— 酸性KMnO 4溶液-------显色反应 三氯化铁溶液 溶液变紫色 醛氧化O 2,催化剂,加热 (或银氨溶液, 或新制 Cu(OH)2 浊液)羧加成、还原H 2,催化剂,加热羧酸取代、置换 Na中和 NaOH 溶液取代、酯化醇,浓H 2SO 4,加热酯取代、水解稀H 2SO 4,加热(或NaOH 溶液,加热)高中常见有机化合物结构与性质总结O H ONa OHOH HH HOH BrBrBr O C HONaC OO C C C CX C O C H H H C O OHC C OH C H O C O HONa C O OHC OO C R O OHC O H C OHHHC OHC O OHC O C O HO C ROHO ROH C OO C RO。
有机化合物中官能团知识的整合

有机化合物中官能团知识的整合官能团是决定化合物特殊性质的原子或原子团,有机化学试题中对化学知识的考查常常是围绕官能团而展开的,故而掌握好官能团的知识是学好有机化学的重要保证。
一、官能团的确定(一)由特殊反应确定官能团的种类1.能发生加成反应的有机物分子中一定存在 2.能发生加聚反应的有机物一定为3.能与银氨溶液或新制的Cu(OH)2反应的有机物分子中一定存在 。
4.能发生酯化反应的有机物分子中一定存在 。
5.能发生水解反应的有机物分子中可能有 。
6.能发生酸碱中和反应的有机物分子中一定存在 。
7.能与钠、镁等活泼金属反应放出H 2的有机物分子中有 。
8.能和Na 2CO 3或NaHCO 3反应,放出气体的有机物分子中含有 。
[高考真题]1.化学式为C 8H 10O 的化合物A 具有如下性质: ①A+Na →慢慢产生气泡②A+RCOOH △浓−−−→−42SOH 有香味的产物 ③A −−−−→−++H KMnO 4苯甲酸④其催化脱氢的产物不能发生银镜反应⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”主要来源之一)。
试回答:(1)根据上述信息,对该化合物的结构可作出的判断是a.苯环上直接连有羟基b.肯定有醇羟基c.苯环侧链末端有甲基d.肯定是芳香烃 (2)化合物A 的结构简式为 . (3)A 和金属钠反应的化学方程式为 . 2.根据图示填空(1)化合物A 含有的官能团是 .(2)1molA 与2molH 2反应生成1molE ,其反应方程式是 . (3)与A 具有相同官能团的A 的同分异构体的结构简式是 . (4)B 在酸性条件下与Br 2反应得到D ,D 的结构简式是 .(5)F 的结构简式是 .由E 生成F 的反应类型是 . (二)由反应条件确定反应类型,确定官能团种类 1.NaOH 水溶液加热,发生水解反应 (1) (2)2.NaOH 醇溶液加热,发生 反应3.浓H2SO4加热,发生:(1) (2) (3)(4) (5)4.稀H2SO4加热,发生的是5.Cl2(或X2)和光照(hV)下,发生6.Fe+X2(纯),发生的是上取代反应7.O2( Cu或Ag)、CuO,发生醇氧化成的反应8.O2或新制Cu(OH)2或Ag(NH3)2OH,发生反应。
高考化学有机重点——官能团知识汇总

高考化学有机重点——官能团知识汇总有机化学中,官能团是同学们很头痛一个地方,不管是同分异构体的书写还是有机物的性质都离不开它。
那么今天就给大家好好的汇总一下有关高中化学有机官能团的知识。
同学们在后面的学习中也要学会利用汇总的方法去记忆,这样才能将学习的知识融会贯通!有机物官能团与性质其中:1、能使KMnO4褪色的有机物:烯烃、炔烃、苯的同系物、醇、酚、醛、葡萄糖、麦芽糖、油脂2、能使Br2水褪色的有机物:烯烃、炔烃、酚、醛、葡萄糖、麦芽糖、油脂3、能与Na反应产生H2的有机物:醇、酚、羧酸、氨基酸、葡萄糖4、具有酸性(能与NaOH、Na2CO3反应)的有机物:酚、羧酸、氨基酸5、能发生银镜反应或与新制Cu(OH)2反应的有机物:醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖6、既有氧化性,又有还原性的有机物:醛、烯烃、炔烃7、能发生颜色(显色)反应的有机物:苯酚遇FeCl3显紫色、淀粉遇I2变蓝、蛋白质遇浓硝酸变黄、葡萄糖遇Cu(OH)2显绛蓝有机物间的相互转化关系有机合成的常规方法1.引入官能团:①引入-X的方法:烯、炔的加成,烷、苯及其同系物的取代②引入-OH的方法:烯加水,醛、酮加氢,醛的氧化、酯的水解、卤代烃的水解、糖分解为乙醇和CO2③引入C=C的方法:醇、卤代烃的消去,炔的不完全加成,*醇氧化引入C=O2.消除官能团①消除双键方法:加成反应②消除羟基方法:消去、氧化、酯化③消除醛基方法:还原和氧化3.有机反应类型常见的有机反应类型有取代(包括酯化、水解)、加成、加聚、消去、氧化、还原等。
能够发生各种反应类型的常见物质如下:(1)取代反应:①烷烃、芳香烃与X2的反应②羧酸与醇的酯化反应③酯的水解反应(2)加成分应:①不饱和烃与H2、X2、HX的反应②醛与H2的反应(3)加聚反应:烯烃、炔烃在一定条件下的聚合反应。
(4)消去反应:某些醇在浓H2SO4作用下分子内脱水生成烯烃的反应。
有机物与H2的加成反应。
高中有机化学常见官能团

烷烃——无官能团:1.一般C4及以下是气态,C5以上为液态。
2.化学性质稳定,不能使酸性高锰酸钾溶液,溴水等褪色。
3.可以和卤素(氯气和溴)发生取代反应,生成卤代烃和相应的卤化氢,条件光照。
4.烷烃在高温下可以发生裂解,例如甲烷在高温下裂解为碳和氢气。
烯烃——官能团:碳碳双键1.性质活泼,可使酸性高锰酸钾溶液褪色。
2.可使溴水或溴的四氯化碳溶液褪色,发生加成反应,生成邻二溴代烷,例如乙烯和溴加成生成1,2-二溴乙烷。
3.酸催化下和水加成生成醇,如乙烯在浓硫酸催化下和水加成生成乙醇。
4.烯烃加成符合马氏规则,即氢一般加在氢多的那个C上。
5.乙烯在银或铜等催化下可以被空气氧化为环氧乙烷。
6.烯烃可以在镍等催化剂存在下和氢气加成生成烷烃7.烯烃可以发生加聚反应生成高聚物,如聚乙烯,聚丙烯,聚苯乙烯等。
实验室制乙烯通过乙醇在浓硫酸作用下脱水生成,条件170℃。
炔烃——官能团:碳碳三键1.性质与烯烃相似,主要发生加成反应。
也可让高锰酸钾,溴水等褪色。
2.炔烃加水生成的产物为烯醇,烯醇不稳定,会重排成醛或酮。
如乙炔加水生成乙烯醇,乙烯醇不稳定会重拍生成乙醛。
3.乙炔和氯化氢加成的产物为氯乙烯,加聚反应后得到聚氯乙烯。
4.炔烃加成同样符合马氏规则5.实验室制乙炔主要通过电石水解制的(用饱和食盐水)。
芳香烃——含有苯环的烃。
1.苯的性质很稳定,类似烷烃,不与酸性高锰酸钾,溴的四氯化碳反应,与溴水发生萃取(物理变化)。
2.苯可以发生一系列取代反应,主要有:和氯,溴等卤素取代,生成氯苯或溴苯和相应的卤化氢(条件:液溴,铁或三溴化铁催化,不可用溴水。
)和浓硝酸,浓硫酸的混合物发生硝化反应,生成硝基苯和水。
条件加热。
和浓硫酸反应生成苯磺酸,条件加热。
3.苯可以加氢生成环己烷。
4.苯的同系物的性质不同,取代基性质活泼,只要和苯环直接相连的碳上有氢,就可以被酸性高锰酸钾溶液氧化为苯甲酸。
如甲苯可以使酸性高锰酸钾溶液褪色,被氧化为苯甲酸。
有机化学官能团高效记忆

有机化学官能团高效记忆有机化学是化学中的一个重要分支,其研究对象为有机化合物。
在学习有机化学时,官能团的记忆是非常关键的。
掌握了官能团的特征和性质,可以帮助我们更好地理解和记忆有机化合物的结构和反应。
本文将介绍一些高效记忆有机化学官能团的方法。
一、醇官能团醇是有机化合物中常见的官能团之一,大多数以“-ol”为后缀命名。
如甲醇、乙醇等。
醇具有羟基(-OH)官能团,其特征是能够和酸、碱发生反应。
为了更好地记忆醇的性质,可以将其与常见物质相联系。
比如,甲醇可以与“汽油”联系起来,乙醇可以与“酒精”联系起来。
通过与生活中的常见物质联系,可以帮助我们更好地记忆醇官能团的性质和命名规则。
二、醛和酮官能团醛和酮都是含有碳氧双键(C=O)的官能团。
醛的通式为RCHO,酮的通式为RCOR'。
为了更好地记忆醛和酮的区别,可以将其与日常生活中的物品联系起来。
比如,醛可以与“沥青”联系起来,沥青是一种具有刺激性气味的物质,而醛类化合物在物理性质上也具有刺激性气味。
而酮可以与“香水”联系起来,香水中常常含有酮类化合物,具有特殊的气味。
通过与日常生活中的物品联系,可以帮助我们更好地记忆醛和酮的特征和命名规则。
三、醚官能团醚是一类含有氧原子连接两个碳原子的有机化合物。
醚的通式为ROR',其中R和R'可以是不同的烷基或芳基基团。
为了更好地记忆醚的性质,可以将其与“桥梁”联系起来。
醚官能团可以看作是将两个碳链“桥接”在一起的结构,如同桥梁连接两个岛屿一样。
通过与“桥梁”的形象联想,可以帮助我们更好地记忆醚的命名规则和性质。
四、酸和酯官能团酸和酯是含有羧基(-COOH)和酯基(-COOR')的官能团。
酸和酯都具有特殊的气味,为了更好地记忆它们的性质,可以将其与常见的食品酸味和水果香味联系起来。
酸味来自于酸类化合物,而水果的香味往往来自于酯类化合物。
通过与日常食物中的味道联系,可以帮助我们更好地记忆酸和酯的特征和命名规则。
有机官能团表格

羰基
—CO—
丙酮
羧酸
羧基
—COOH
乙酸
CH3COOH
酯
酯基
—COO—
乙酸乙酯
CH3COOC2H5
本文档部分内容来源于网络,如有内容侵权请告知删除,感谢您的配合!
类别官能团代表物备注名称结构式结构简式名称结构简式甲烷ch烯烃碳碳双键乙烯ch乙炔chch芳香烃溴乙烷ch醇羟基ohoh乙醇ch酚羟基ohoh苯酚cho乙醛ch羰基co丙酮羧酸羧基cooh乙酸chcoo乙酸乙酯ch
类别
官能团
代表物
备注
名称
结构式
结构简式
名称
结构简式
烃
烷烃Байду номын сангаас
——
——
——
甲烷
CH4
烯烃
碳碳双键
C=C
C=C
乙烯
CH2=CH2
炔烃
碳碳三键
C C
C C
乙炔
CH CH
芳香烃
——
——
——
苯
烃的衍生物
卤代烃
卤素原子
—X
—X
溴乙烷
CH3CH2Br
烃的含氧衍生物
醇
(醇)羟基
—OH
—OH
乙醇
CH3CH2OH
酚
(酚)羟基
—OH
—OH
苯酚
醚
醚键
C—O—C
C—O—C
乙醚
H5C2OC2H5
醛
醛基
—CHO
乙醛
CH3CHO
有机化学官能团知识小结

有机物官能团等知识小结1.有机物的官能团和它们的性质:?官能团是钥匙,它能打开未知有机物对你关闭的大门。
?官能团是地图,它能指引你走进有机物的陌生地带。
2.由反应条件确定官能团:3.根据反应物性质确定官能团:5.根据反应类型来推断官能团:①根据与H2加成时所消耗H2的物质的量进行突破:1mol —C =C —加成时需1molH2,1mol —C≡C—完全加成时需2molH2,1mol —CHO 加成时需1molH2,而1mol 苯环加成时需3molH2。
②1mol —CHO 完全反应时生成2molAg↓或1molCu2O↓。
③2mol —OH 或2mol —COOH 与活泼金属反应放出1molH2。
④1mol —COOH 与碳酸钠或碳酸氢钠溶液反应放出1molCO2↑。
⑤1mol 一元醇与足量乙酸反应生成1mol 酯时,其相对分子质量将增加42,1mol 二元醇与足量乙酸反应生成酯时,其相对分子质量将增加84。
⑥1mol 某酯A 发生水解反应生成B 和乙酸时,若A 与B 的相对分子质量相差42,则生成1mol 乙酸,若A 与B 的相对分子质量相差84时,则生成2mol 乙酸。
三个重要相对分子质量增减的规律: 1.RCH 2OHRCHORCOOHM M -2 M +14 2.RCH 2OHCH 3COOCH 2RM M +42 3.RCOOHRCOOCH 2CH 3M M +287. 【物质·简式·通式】(1)C︰H=1︰1,可能为乙炔、苯、苯乙烯、苯酚。
(2)C︰H=l︰2,可能分为单烯烃、甲醛、乙酸、甲酸甲酯、葡萄糖、果糖等。
(3)C︰H=1︰4,可能为甲烷、甲醇、尿素[CO(NH2)2](4)符合CnH2n+2一定为烷烃,符合CnH2n可能为烯烃,符合CnH2n-2可能为炔烃,符合CnH2n-6可能为苯的同系物,符合CnH2n+2O可为醇或醚,符合CnH2nO可为醛或酮,符合CnH2nO2可为一元饱和脂肪酸或其与一元饱和醇生成的酯。
常见的各类有机物的官能团

常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4 B) 结构特点:键角为109°28′,空间正四面体分子。
烷烃分子中的每个C 原子的四个价键也都如此。
C) 化学性质: ①取代反应(与卤素单质、在光照条件下)②燃烧 (2)烯烃:A) 官能团: ;通式:C n H 2n (n ≥2);代表物:H 2C=CH 2 B) 结构特点:键角为120°。
双键碳原子与其所连接的四个原子共平面。
C) 化学性质: ①加成反应(与X 2、H2、HX 、H 2O 等)②加聚反应(与自身、其他烯烃) ③燃烧 ④被酸性高锰酸钾溶液氧化→CO 2(3)炔烃:A) 官能团:—C ≡C — ;通式:C n H2n —2(n ≥2);代表物:HC ≡CH B) 结构特点:碳碳叁键与单键间的键角为180°。
两个叁键碳原子与其所连接的两个原子在同一条直线上。
C) 化学性质:同烯烃 (4)苯及苯的同系物:A) 通式:C n H2n —6(n ≥6);代表物:B)结构特点:苯分子中键角为120°,平面正六边形结构,6个C 原子和6个H 原子共平面。
C)化学性质:①取代反应(与液溴、HNO 3、H 2SO 4等)②加成反应(与H 2)(5)卤代烃 A) 官能团:—X(卤素原子); 代表物: CH 3CH 2Br B) 结构特点:卤素原子取代链烃分子(或脂环烃分子、苯环及苯环侧链上)的氢原子而得到的产物。
结构与相应的烃类似。
C) 化学性质:①水解反应( 卤素原子被羟基取代,所有卤代烃均可以发生)CH 3CH 2Br+NaOHCH 3CH 2—OH+NaBrCH 4 + Cl 2CH 3Cl + HCl 光CH 3Cl + Cl 2CH 2Cl 2 + HCl 光CH 4 + 2O 2CO 2 + 2H 2O 点C=CCH 2=CH 2 + 3O 22CO 2 + 2H 2O点燃 n CH 2=CH 2CH 2—CH 2 n催化剂CH 2=CH 2 + H 2OCH 3CH 2OH催化剂+ Br 2+ HBr Br Fe 或+ HNO 3+ H 2O 2 浓H 2SO 4 60℃ + 3H 2Ni △ 2C 2H 6 + 7O 24CO 2 + 6H 2O 点②消去反应(与卤素原子相连碳的相邻碳上有氢原子才能发生消去反应)CH 3CH 2Br+NaOHCH 2=CH 2↑+NaBr + H 2O注: 卤代烃中卤素原子的检验步骤:取少量样品→加入NaOH 或NaOH 醇溶液→加热→冷却→加稀HNO 3酸化→加AgNO 3溶液(5)醇类:A) 官能团:—OH (醇羟基); 饱和一元醇通式C n H 2n+1OH 代表物: CH 3CH 2OH 、B) 结构特点:羟基取代链烃分子(或脂环烃分子、苯环侧链上)的氢原子而得到的产物。
化学官能团知识点

化学官能团知识点官能团是决定有机化合物的化学性质的原子或原子团。
常见的官能团对应关系如:卤代烃:卤原子(-X),X代表卤族元素(F,CL,Br,I);在碱性条件下可以水解生成羟基醇、酚:羟基(-OH);伯醇羟基可以消去生成碳碳双键,酚羟基可以和NaOH反应生成水,与Na2CO3反应生成NaHCO3,二者都可以和金属钠反应生成氢气醛:醛基(-CHO);可以发生银镜反应,可以和斐林试剂反应氧化成羧基。
与氢气加成生成羟基。
酮:羰基(>C=O);可以与氢气加成生成羟基羧酸:羧基(-COOH);酸性,与NaOH反应生成水,与NaHCO3、Na2CO3反应生成二氧化碳硝基化合物:硝基(-NO2);胺:氨基(-NH2). 弱碱性烯烃:双键(>C=C<)加成反应。
炔烃:三键(-C≡C-)加成反应醚:醚键(-O-)可以由醇羟基脱水形成磺酸:磺基(-SO3H)酸性,可由浓硫酸取代生成腈:氰基(-CN)酯: 酯 (-COO-) 水解生成羧基与羟基,醇、酚与羧酸反应生成注: 苯环不是官能团,但在芳香烃中,苯基(C6H5-)具有官能团的性质。
苯基是过去的提法,现在都不认为苯基是官能团1。
卤化烃:官能团,卤原子在碱的溶液中发生“水解反应”,生成醇在碱的醇溶液中发生“消去反应”,得到不饱和烃2。
醇:官能团,醇羟基能与钠反应,产生氢气能发生消去得到不饱和烃(与羟基相连的碳直接相连的碳原子上如果没有氢原子,不能发生消去)能与羧酸发生酯化反应能被催化氧化成醛(伯醇氧化成醛,仲醇氧化成酮,叔醇不能被催化氧化)3。
醛:官能团,醛基能与银氨溶液发生银镜反应能与新制的氢氧化铜溶液反应生成红色沉淀能被氧化成羧酸能被加氢还原成醇4。
酚,官能团,酚羟基具有酸性能钠反应得到氢气酚羟基使苯环性质更活泼,苯环上易发生取代,酚羟基在苯环上是邻对位定位基能与羧酸发生酯化5。
羧酸,官能团,羧基具有酸性(一般酸性强于碳酸)能与钠反应得到氢气不能被还原成醛(注意是“不能”)能与醇发生酯化反应6。
必背专题一常见官能团及主要化学性质.doc

学习好资料欢迎下载专题一:常见官能团及主要化学性质官能团:决定化合物特殊性质原子或原子团的原子或原子团叫官能团。
官能团代表物结构特点主要化学性质卤代卤素原子:-X 烃醇醇羟基:- OH 酚酚羟基:- OH醛醛基:- CHO 羧羧基:- COOH 酸酯基:酯氨氨基:- NH2 基羧基:- COOH 酸CH3CH2Br C- X 键,易断裂有 C-O 和 O-H 键,-CH3CH2OHOH 与烃基直接相连C6H 5OH-OH直接与苯环相连CH3CHO C= O 双键具有不饱和性受 C=O 双键影响, O-HCH3COOH键能够电离,产生H +分子中 R CO-和 ORˊ之CH3COOC 2 H 5间的键易断裂H2NCH 2COOH同时还有氨基和羧基①取代反应;②消去反应①与钠反应;②取代反应;③消去反应;④氧化反应;⑤酯化反应①有弱酸性;②取代反应;③与浓溴水发生取代反应生成沉淀;④遇 FeCl3呈紫色①氧化反应;②加成反应(还原反应)①具有酸性;②酯化反应水解反应①具有两性;②取代反应;③缩聚反应醚键:醚酮羰基:烯碳碳双键:烃性质稳定,一般不与酸、碱、CH3CH2OCH 2CH3氧原子与两个烃基相连氧化剂反应①与 H 2、 HCN 加成为醇CH 3COCH 3羰基与烃基相连②不能被氧化剂氧化为羧酸分子中双键中的一个键①氧化反应;②加成反应;CH2=CH2易断裂③加聚反应学习好资料欢迎下载炔碳碳三键:分子中三键中两个键易断①氧化反应;②加成反应;-C≡ C-CH≡ CH烃裂③加聚反应。
常见的各类有机物的官能团

常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4 B) 结构特点:键角为109°28′,空间正四面体分子。
烷烃分子中的每个C 原子的四个价键也都如此。
C) 化学性质: ①取代反应(与卤素单质、在光照条件下)②燃烧 (2)烯烃:A) 官能团: ;通式:C n H 2n (n ≥2);代表物:H 2C=CH 2 B) 结构特点:键角为120°。
双键碳原子与其所连接的四个原子共平面。
C) 化学性质: ①加成反应(与X 2、H2、HX 、H 2O 等)②加聚反应(与自身、其他烯烃) ③燃烧 ④被酸性高锰酸钾溶液氧化→CO 2(3)炔烃:A) 官能团:—C ≡C — ;通式:C n H2n —2(n ≥2);代表物:HC ≡CH B) 结构特点:碳碳叁键与单键间的键角为180°。
两个叁键碳原子与其所连接的两个原子在同一条直线上。
C) 化学性质:同烯烃 (4)苯及苯的同系物:A) 通式:C n H2n —6(n ≥6);代表物:B)结构特点:苯分子中键角为120°,平面正六边形结构,6个C 原子和6个H 原子共平面。
C)化学性质:①取代反应(与液溴、HNO 3、H 2SO 4等)②加成反应(与H 2)(5)卤代烃 A) 官能团:—X(卤素原子); 代表物: CH 3CH 2Br B) 结构特点:卤素原子取代链烃分子(或脂环烃分子、苯环及苯环侧链上)的氢原子而得到的产物。
结构与相应的烃类似。
C) 化学性质:①水解反应( 卤素原子被羟基取代,所有卤代烃均可以发生)CH 3CH 2Br+NaOHCH 3CH 2—OH+NaBrCH 4 + Cl 2CH 3Cl + HCl 光CH 3Cl + Cl 2CH 2Cl 2 + HCl 光CH 4 + 2O 2CO 2 + 2H 2O 点C=CCH 2=CH 2 + 3O 22CO 2 + 2H 2O点燃 n CH 2=CH 2CH 2—CH 2 n催化剂CH 2=CH 2 + H 2OCH 3CH 2OH催化剂+ Br 2+ HBr Br Fe 或+ HNO 3+ H 2O 2 浓H 2SO 4 60℃ + 3H 2Ni △ 2C 2H 6 + 7O 24CO 2 + 6H 2O 点②消去反应(与卤素原子相连碳的相邻碳上有氢原子才能发生消去反应)CH 3CH 2Br+NaOHCH 2=CH 2↑+NaBr + H 2O注: 卤代烃中卤素原子的检验步骤:取少量样品→加入NaOH 或NaOH 醇溶液→加热→冷却→加稀HNO 3酸化→加AgNO 3溶液(5)醇类:A) 官能团:—OH (醇羟基); 饱和一元醇通式C n H 2n+1OH 代表物: CH 3CH 2OH 、B) 结构特点:羟基取代链烃分子(或脂环烃分子、苯环侧链上)的氢原子而得到的产物。
常见有机物及官能团

常见有机物及官能团一、基本概念1、有机化学:研究碳化合物的学科;除了碳酸盐、碳的部分氧化物、碳酸氢盐及某些含碳的化合物称为有机化合物,简称有机物。
2、化学键:简称键,是分子或原子之间形成特定结构的相互作用力。
分为离子键、金属键和共价键。
3、键能:打破化学键所需的能量4、共价键:(因为有机物一般由共价键形成,在这里只介绍共价键)两个或多个原子共同使用它们的外层电子,在理想情况下达到电子饱和的状态,由此组成比较稳定和坚固的化学结构叫做共价键。
以共价键形成的化合物叫共价化合物。
5、电离能:原子失去外层电子所需的能量,失去第一个电子所需的能量叫做第一电离能,记作(I1);失去第二个电子所需的能量叫第二电离能,记作(I2):以此类推。
一般地,I1<I2<I3<I4......6、电负性:原子吸引电子的能力,决定物质和键是否有极性。
7、极性:两个成共价键的原子中,正点中心与负电中心分离(即两原子电负性之差的绝对值在0.6-1.7),这样的键叫做极性共价键;反之为非极性共价键(小于0.6)。
在以极性共价键结合的分子中,正点中心与负电中心分离,这样的分子叫做极性分子;反之则为非极性分子。
键为极性,分子不一定呈极性,反之亦然。
二、常见有机物1、烃类:仅由碳氢两种元素组成的化合物,分为烷烃、烯烃与炔烃。
烯烃和炔烃统称为不饱和烃(1)烷烃:即饱和烃,仅由碳碳单键和碳氢单键构成的烃类,“烷”即饱和的意思。
分为直链烷烃、支链烷烃、环烷烃及芳香烃。
(2)烯烃:除碳碳单键和碳氢单键之外仅存在碳碳双键的烃类。
分为只有一个双键的单烯烃和有两个或以上双键的多烯烃。
(3)炔烃:含有碳碳三键的烃类。
(里面也可以有双键)分为只有一个碳碳三键的单炔烃,含有两个或以上的多炔烃和既有三键又有双键的烯炔烃。
2、醇类:可以看做是烃类的氢原子被羟基(-OH)代替,且羟基连接在非苯环碳原子上。
如果是烯烃被代替,则称为烯醇;如果是炔烃被代替,则为炔醇。
