(整理)吸附百白破联合疫苗.
2020版药典吸附无细胞百白破联合疫苗

2020版药典吸附无细胞百白破联合疫苗Xifu Wuxibao Bai Bai Po Lianhe YimiaoDiphtheria, Tetanus and Acellular Pertussis Combined Vaccine, Adsorbed本品系由无细胞百日咳疫苗原液、白喉类毒素原液及破伤风类毒素原液加入氢氧化铝佐剂制成。
用于预防百日咳、白喉、破伤风。
1 基本要求生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2 制造2.1 混合前单价原液2.1.1 无细胞百日咳疫苗原液制造应符合本品种附录的规定。
2.1.2 白喉类毒素原液制造应符合“吸附白喉疫苗”中2.1~2.2项的规定。
2.1.3 破伤风类毒素原液制造应符合“吸附破伤风疫苗”中2.1~2.2项的规定。
2.1.4 原液检定2.1.4.1 百日咳疫苗原液检定按本品种附录中2项进行。
2.1.4.2 白喉类毒素原液检定按“吸附白喉疫苗”中3.1项进行。
2.1.4.3 破伤风类毒素原液检定按“吸附破伤风疫苗”中3.1项进行。
2.2 半成品2.2.1 佐剂配制佐剂的制备和检定(通则3650)应符合批准的要求。
2.2.2 合并及稀释将白喉类毒素、破伤风类毒素及无细胞百日咳疫苗原液加入已稀释的佐剂内,调pH值至5.8~7.2,使每1ml半成品含无细胞百日咳疫苗原液应不高于18μgPN;白喉类毒素应不高于25Lf;破伤风类毒素应不高于7Lf。
2.2.3 半成品检定按3.1项进行。
2.3 成品2.3.1 分批应符合“生物制品分包装及贮运管理”规定。
2.3.2 分装应符合“生物制品分包装及贮运管理”规定。
2.3.3 规格每瓶0.5ml、1.0ml、2.0ml、5.0ml。
每1次人用剂量0.5ml,含无细胞百日咳疫苗效价应不低于4.0IU,白喉疫苗效价应不低于30IU,破伤风疫苗效价应不低于40IU。
2.3.4 包装应符合“生物制品分包装及贮运管理”规定。
吸附无细胞百白破、IPV和b型流感嗜血杆菌(结合)联合疫苗(五联疫苗)应用技术指南

尽管目前全球消灭脊灰目标尚未实现,OPV在全球脊灰
控制中发挥了极为重要的作用,其安全性已为世界各国广泛
使用的实践所证明。但不容忽视的是在已控制脊灰的发达 国家,每年发生的麻痹型脊灰病例日渐显现,且多与OPV有 关。Strebel等对1980--1995年美国的资料分析,认为平均每
服用240万剂OPV发生l例VAPP…1。据此推算,中国每年
2009年IPV引入中国,为规范IPV使用,中国疾病预防
控制中心下发了《脊髓灰质炎灭活疫苗使用指导意见》,免疫
程序按照2、3、4和18月龄各接种1剂次‘2“。建议对接种
OPV禁忌症者,特别是免疫缺陷者和正在使用免疫抑制剂者 优先考虑使用IPV。 (五)Hib感染性疾病:Hib感染呈世界性分布,病例以2
・312・
中华流行病学杂志2011年3月第32卷第3期Chin
J
Epidemiol,March 2011,V01.32.No.3
繁接触动物排泄物且预防接种较差的地区更常见。吸毒者 肠胃外用药,尤其是肌肉或皮下注射,会出现个案病例,偶有
局部暴发。据估计,全世界每年有80万到100万名破伤风死 亡病例,其中新生JL40万例扣J。2001年,全球约有28.2万人 死于破伤风,大多数发生在亚洲、非洲和南美洲。农村和热 带地区居民是高危人群,新生儿破伤风较常见。有一些不确
皇燮瘴堂杂志2011年3月第32卷第3期Chin
J
Epidemiol。March 201I,V01.32,No.3
・31l・
・标准与方案・
吸附无细胞百白破、灭活脊髓灰质炎和b型流感嗜血杆菌 (结合)联合疫苗(DTaP.IPV/Hib联疫苗)应用技术指南
中华预防医学会
【关键词】吸附无细胞百白破疫苗;灭活脊髓灰质炎疫苗;b型流感嗜血杆菌(结合)疫苗;联合疫
吸附破伤风疫苗

吸附破伤风疫苗Xifu Poshangfeng YimiaoTetanus Vaccine,Adsorbed本品系用破伤风梭状芽孢杆菌,在适宜的培养基中培养产生的毒素经甲醛脱毒、精制,加入氢氧化铝佐剂制成。
用于预防破伤风。
1基本要求生产和检定用设施、原料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2制造2.1菌种生产用菌种应符合“生物制品生产检定用菌毒种管理规程”的有关规定。
2.1.1名称及来源采用破伤风梭状芽孢杆菌CMCC64008株或其它经批准的破伤风梭状芽孢杆菌菌种。
2.1.2种子批的建立应符合“生物制品生产检定用菌毒种管理规程”的有关规定。
2.1.3种子批的传代主种子批自启开后传代应不超过5代,工作种子批启开后至疫苗生产,传代应不超过10 代。
2.1.4种子批菌种的检定2.1.4.1培养特性本菌为专性厌氧菌,适宜生长温度为37℃。
在庖肉液体培养基中培养,培养液呈浑浊、产生气体、具腐败性恶臭。
在血琼脂平皿培养基培养,菌落呈弥漫生长。
在半固体培养基穿刺培养,表现鞭毛动力。
2.1.4.2染色镜检初期培养物涂片革兰染色镜检呈阳性,杆形菌体,少见芽孢。
48小时以后培养物涂片革兰染色镜检,易转为阴性,可见芽孢,菌体呈鼓槌状,芽孢位于顶端为正圆形。
2.1.4.3生化反应不发酵糖类,液化明胶,产生硫化氢;不还原硝酸盐(附录ⅩⅣ)。
2.1.4.4产毒试验取培养物的滤液或离心上清液0.1ml注射于体重18~22g小鼠的尾根部皮下,至少4只。
于注射后12~24小时观察小鼠,应出现尾部僵直竖起、后腿强直痉挛或全身肌肉痉挛等症状,甚至死亡。
2.1.4.5特异性中和试验取适量产毒培养物的滤液或离心上清液与相应稀释的破伤风抗毒素经体外中和后,注射于体重为18~22g小鼠的腹部皮下,每只小鼠注射0.4ml,至少4 只;同时取未结合破伤风抗毒素的培养物的滤液或离心上清液0.4ml,注射小鼠的腹部皮下,作为阳性对照。
吸附无细胞百白破联合疫苗的免疫原性及免疫持久性_邹光荣

·临床研究·吸附无细胞百白破联合疫苗的免疫原性及免疫持久性邹光荣1,兰红2,项美娟1,杨汝沛2,杨晓明3,侯启明4,张量智2,王丽蝉4,李军1,陈伟1,张良豪1,王前喜11.武汉生物制品研究所有限责任公司,湖北武汉430060;2.成都市疾病预防控制中心,成都310041;3.国药集团中国生物技术股份有限公司,北京100029;4.中国食品药品检定研究院,北京100050摘要:目的观察武汉生物制品研究所有限责任公司(以下简称武汉公司)吸附无细胞百白破联合疫苗(diphtheria,tetanus and acellular pertussis combined vaccine,DTaP)的免疫原性和免疫持久性。
方法于2007年9月在成都地区选择670名未接种过百白破联合疫苗,无百日咳、白喉、破伤风疾病史的足月出生的健康婴儿,按2∶1比例随机接种3剂观察疫苗(武汉公司生产的DTaP)和对照疫苗(某厂家生产的DTaP),进行基础免疫,每剂间隔1个月,2009年3月进行加强免疫,接种剂量均为0.5ml/(剂·人)。
基础免疫接种前和全程接种后30~50d、加强免疫前和加强免疫后1个月、1、2、3年分别采集静脉血,分离血清,经ELISA法测定百日咳毒素抗体(pertussis toxin antibody,PT-Ab)、丝状凝集素抗体(filamentous hemagglutinin antibody,FHA-Ab)、白喉抗体(diphtheria antibody,D-Ab)、破伤风抗体(tetanus antibody,T-Ab)GMT,若免疫前抗体为阳性,则计算4倍增长率。
结果基础免疫试验组351例、对照组193例完成了全程接种,即544例受种者符合方案要求。
DTaP基础免疫后,试验组与对照组的4种抗体阳转率及抗体4倍增长率差异均无统计学意义(P>0.05);试验组FHA-Ab GMT明显高于对照组,差异有统计学意义(P<0.05)。
吸附无细胞百白破联合疫苗

吸附无细胞百白破联合疫苗接种告知百日咳是儿童急性呼吸道传染病,传染性强,典型症状为阵发性痉挛性咳嗽,伴有呕吐,持续2~6周,常见合并症有肺炎和百日咳脑病。
白喉也是一种急性呼吸道传染病,临床上分为咽白喉、喉白喉、鼻白喉,以及身体其他部位白喉等4种类型。
病人高热,全身中毒症状严重,常因窒息缺氧和全身衰竭而死亡。
破伤风是一种创伤感染性疾病,患者肢体疼痛,全身肌肉僵直性痉挛,呈苦笑面容,最后死于呼吸障碍。
【疫苗品种】吸附无细胞百白破联合疫苗【作用】预防百日咳、白喉、破伤风三种传染病。
【接种对象】:3月龄—6周岁儿童【价格】免费【用法剂量】3月龄以上儿童接种三次,每次剂量0.5ml,间隔1个月,1.5~2周岁加强注射1针,剂量0.5ml。
6周岁时用白破二联加强注射0.5ml。
接种途径均是上臂外侧三角肌肌注。
【不良反应】吸附无细胞百白破疫苗全身反应或局部反应均极低局部可出现红肿、疼痛、发痒或有低热、疲倦、头痛等。
一般不需特殊处理即自行消退,偶见过敏性皮疹、血管神经性水肿。
无菌性化脓:硬结不能吸收,形成接种部位化脓。
如果全身反应较重,应及时到医院治疗。
注射第1针后出现高热、惊劂等异常情况者,不再注射第2针【接种禁忌】有癫痫、神经系统疾患及抽风史者、过敏史禁用。
急性传染病(包括恢复期)及发热者暂缓注射。
为了保证您的孩子能够安全有效地接种,请向医生提供孩子目前的身体状况。
【接种后注意事项】接种后请在接种地点观察15到30分钟;注射当天不要洗澡,防止注射部位的感染;宜多饮白开水,注射后发生任何不适均可与接种医生咨询电话0745-870299以上内容已告知儿童家属,儿童家属对此表示理解,确认无以上禁忌症,自愿接种吸附无细胞百白破联合疫苗,并表示愿意承担接种疫苗可能出现的反应所产生的风险。
预约接种日期:同意接种本疫苗□不同意接种本疫苗□接种儿童姓名家长及监护人签名:接种日期:接种医生接种部位广坪中心卫生院吸附无细胞百白破联合疫苗接种告知百日咳是儿童急性呼吸道传染病,传染性强,典型症状为阵发性痉挛性咳嗽,伴有呕吐,持续2~6周,常见合并症有肺炎和百日咳脑病。
吸附无细胞百白破联合疫苗使用说明 沃森生物

吸附无细胞百白破联合疫苗使用说明【药品名称】通用名称:吸附无细胞百白破联合疫苗英文名称:Diphtheria,Tetanus and Acellular Pertussis Combined Vaccine,Adsorbed 汉语拼音:Xifu Wuxibao Bai Bai Po Lianhe Yimiao【成分和性状】本品系无细胞百日咳疫苗原液、白喉类毒素原液及破伤风类毒素原液加氢氧化铝佐剂制成。
为乳白色悬液,放置后佐剂下沉,摇动后即成均匀悬液,含防腐剂。
有效成分:百日咳杆菌有效组分、白喉类毒素及破伤风类毒素。
辅料:氢氧化铝、氯化钠、磷酸氢二钠、磷酸二氢钠【接种对象】3个月~6周岁儿童。
【作用与用途】接种本疫苗后,可使机体产生免疫应答。
用于预防百日咳、白喉、破伤风。
【规格】每瓶0.5ml,每1次人用剂量0.5ml,含无细胞百日咳疫苗效价不低于4.0IU,白喉疫苗效价不低于30IU、破伤风疫苗效价不低于40IU。
【免疫程序和剂量】(1)臀部或上臂外侧三角肌肌内注射。
(2)基础免疫:共3针,自3月龄开始至12月龄,每针间隔4~6周,每次注射0.5ml。
加强免疫:通常在基础免疫后18~24月龄内进行,注射剂量为0.5ml。
【不良反应】常见不良反应:(1)注射部位可出现红肿、疼痛、发痒。
(2)全身性反应可有低热、哭闹等,一般不需处理即可自行缓解。
罕见不良反应:(1)烦躁、厌食、呕吐、精神不振等。
(2)重度发热反应:应给予对症处理,以防高热惊厥。
(3)局部硬结,1~2月即可吸收。
严重者可伴有淋巴管或淋巴结炎,应及时就诊。
极罕见不良反应:(1)局部无菌性化脓:一般需反复抽出脓液,严重时(破溃)扩创清除坏死组织,病程较长,最后可吸收愈合。
(2)过敏性皮疹:一般在接种疫苗后72小时内出现荨麻疹应及时就诊,给予抗过敏治疗。
(3)过敏性休克:一般在注射疫苗后1小时内发生。
应及时抢救,注射肾上腺素进行治疗。
(4)过敏性紫癜:出现过敏性紫癜反应时应及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎。
什么是白破疫苗

什么是白破疫苗
一、什么是白破疫苗二、白破疫苗的不良反应三、注射白破疫苗前后禁忌
什么是白破疫苗1、什么是白破疫苗
白破疫苗是一种儿童疫苗,用于预防白喉、破伤风的发生。
白破疫苗由白喉类毒素及破伤风类毒素原液混合而成。
白破疫苗即吸附白喉破伤风联合疫苗,还有百白破就是百日咳和白喉、破伤风的三联疫苗。
本品系由白喉类毒素原液及破伤风类毒素原液加入氢氧化铝佐剂制成。
用于经吸附百白破联合疫苗全程免疫后儿童的白喉、破伤风加强免疫。
接种本疫苗后,可使机体产生免疫应答反应,用于经吸附百白破联合疫苗全程免疫后的儿童的白喉和破伤风加强免疫。
2、白破疫苗的接种时间
我国现行的免疫程序规定,新生儿出生后3足月就应开始接种百白破疫苗第一针,连续接种3针,每针间隔时间最短不得少于28天,在1岁半至2周岁时再用百白破疫苗加强免疫1针,7周岁时用精制白喉疫苗或精制白破二联疫苗加强免疫1针。
即在宝宝体内产生了抗百日咳、白喉和破伤风三种传染病的抗体。
3、白破疫苗的作用
百白破疫苗对破伤风的预防效果最好。
使用百白破疫苗基础免疫或用破伤风疫苗2针免疫后,所有被接种的血清中抗毒素都可达到保护水平以上,抗体可维持10-15年时间,保护率可达95%以上。
吸附无细胞百白破联合疫苗-详细说明书与重点

吸附无细胞百白破联合疫苗英文名:Diphtheria,T etanus and Acellular Pertussis Combined Vaccine,Adsorbed。
汉语拼音:Xifuwuxibaobaibaipolianheyimiao。
【成份】本品系由无细胞百日咳疫苗原液、白喉类毒素原液及破伤风类毒素原液加氢氧化铝佐剂制成。
为乳白色悬液,放置后佐剂下沉,摇动后即成均匀悬液,含适量硫柳汞防腐剂。
有效成分:百日咳杆菌有效组分、白喉类毒素及破伤风类毒素。
辅料:氢氧化铝佐剂,硫柳汞防腐剂。
【作用与用途】接种本疫苗后,可使机体产生免疫应答。
用于预防百日咳、白喉、破伤风。
【接种对象】3个月~6周岁儿童。
【规格】每安瓿2.0ml。
每1次人用剂量0.5ml,含无细胞百日咳疫苗效价不低于4.0IU,白喉疫苗效价不低于30IU,破伤风疫苗效价不低于40IU。
【用法用量】(1)臀部或上臂外侧三角肌肌内注射。
(2)基础免疫:共3针,自3月龄开始至12月龄,每针间隔4-6周,每次注射0.5ml。
加强免疫通常在基础免疫后18-24月龄内进行,注射剂量为0.5ml。
【不良反应】常见不良反应:(1)注射部位可出现红肿、疼痛、发痒。
(2)全身性反应可有低热、哭闹等,一般不需处理即可自行缓解。
罕见不良反应:(1)烦躁、厌食、呕吐、精神不振等。
(2)重度发热反应:应给予对症处理,以防高热惊厥。
(3)局部硬结,1~2个月即可吸收。
严重者可伴有淋巴管或淋巴结炎,应及时就诊。
极罕见不良反应:(1)局部无菌性化脓:一般需反复抽出脓液,严重时(破溃)扩创清除坏死组织,病程较长,最后可吸收愈合。
(2)过敏性皮疹:一般在接种疫苗后72小时内出现荨麻疹,应及时就诊,给予抗过敏治疗。
(3)过敏性休克:一般在注射疫苗后1小时内发生。
应及时抢救,注射肾上腺素进行治疗。
(4)过敏性紫癜:出现过敏性紫癜反应时应及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎。
武汉生物制品吸附无细胞百日咳、白喉、破伤风联合疫苗使用说明

武汉生物制品吸附无细胞百日咳、白喉、破伤风联合疫苗【用法用量】1.臀部外上方1/4处或上臂外侧三角肌附着处皮肤经消毒后肌内注射2.免疫程序与剂量基础免疫自3月龄开始,至12月龄完成3针免疫每次0.5ml每针间隔4~6周加强免疫通常在基础免疫后18~24月龄内进行注射剂量为1.5ml【注意事项】1.免疫前询问病史(尤其是既往接种史和可能发生的不良反应事件),并进行临床检查。
与其它疫苗一样,对于患有严重急性发热性疾病的个体应推迟接种本品。
然而轻微感染不是禁忌症。
如以下任何情况发生,并认为与接种DTPa或DTPw有时间上的关联时,后继接种含百日咳成份的疫苗时要慎重考虑。
可能会有某些情况,例如百日咳发病率高,当接种的潜在益处超过可能出现的危险时,特别是这些事件与永久性后遗症无关。
以下情况以前被认为是接种DTPw的禁忌症,现在被认为是一般:2.接种后48小时内体温≥40.5℃,无其它可确认的原因。
3.接种后48小时内出现虚脱或类休克状态(低张力-低反应性症状),4.接种后48小时内出现持久的﹑无法安慰的嚎哭持续时间≥3小时。
5.接种后3天内出现伴有或不伴有发热的惊厥。
高热惊厥史和惊厥发作家族史者不是接种的禁忌。
HIV感染不是禁忌症。
与其它所有注射用疫苗一样,为防止接种后可能出现的过敏反应,要准备适当的医学处理。
基于此原因,接种者注射后应进行医学监护30分钟。
对于所有白喉﹑破伤风和百日咳疫苗,每次接种应深部肌肉注射且最好轮流接种不同部位。
本疫苗用于有血小板减少症或有出血性疾病的个体时一定要注意,因为这些个体在肌注后可能产生出血。
注射后应在注射部位紧压至少两分钟(不要揉擦)。
吸附无细胞百日咳﹑白喉﹑破伤风联合疫苗在任何情况下,都不能静脉注射。
本疫苗使用前摇匀至白色均匀混悬液,并肉眼观察是否有外来物和外观的改变。
如观察到以上任何情况,应丢弃疫苗。
【不良反应】非常罕见的过敏包括类过敏性反应有过报告。
极为罕见的接种2至3天后出现的虚脱和类休克状态(低张力-低反应性情况)及惊厥亦有有报告。
吸附白喉破伤风联合疫苗(成人及青少年用)

吸附白喉破伤风联合疫苗(成人及青少年用)Xifu Baihou Poshangfeng Lianhe Yimiao(Chengren Ji Qingshaonian Yong)Diphtheria and Tetanus Combined Vaccine forAdults and Adolescents,Adsorbed本品系由白喉类毒素原液及破伤风类毒素原液加入氢氧化铝佐剂制成。
用于经白喉、破伤风疫苗基础免疫的12岁以上人群加强免疫及预防白喉的应急接种。
1.基本要求生产、检定用设施、水、器具、动物等应符合“凡例”要求;生产用原辅材料应符合现行《中国药典》的要求。
2.制造2.1混合前单价原液2.1.1白喉类毒素原液制造应符合“吸附白喉疫苗(成人及青少年用)”中2.1~2.2项的规定。
2.2.2破伤风类毒素原液制造应符合“吸附破伤风疫苗”中2.1~2.2项的规定。
2.1.3原液检定各按“吸附白喉疫苗(成人及青少年用)”和“吸附破伤风疫苗”中3.1 项进行。
2.2半成品2.2.1半成品配制2.2.1.1配方每1ml半成品中各抗原成分含量如下:白喉类毒素原液应不高于4Lf破伤风类毒素原液应不高于5Lf2.2.1.2佐剂配制(1)配制氢氧化铝可用三氯化铝加氨水法或三氯化铝加氢氧化钠法,用氨水配制须透析除氨后使用。
(2)配制成的氢氧化铝原液应为浅蓝色或乳白色的胶体悬液,不应含有凝块或异物。
(3)氢氧化铝原液应测定氢氧化铝及氯化钠含量。
氢氧化铝含量应不高于3.0mg/ml。
2.2.1.3加氯化钠至8.5g/L。
2.2.1.4可加0.05~0.10g/L硫柳汞为防腐剂。
2.2.2半成品检定按3.1项进行。
2.3成品2.3.1分批应符合“生物制品分批规程”规定。
2.3.2分装应符合“生物制品分装和冻干规程”规定。
2.3.3规格每瓶0.5ml、1.0ml、2.0ml、5.0ml。
每1次人用剂量0.5ml,含白喉类毒素效价应不低于2IU,破伤风类毒素效价应不低于40IU。
2015-2020年丽江市吸附无细胞百白破联合疫苗疑似预防接种异常反应监测分析

2015-2020 年丽江市吸附无细胞百白破联合疫苗疑似预防接种异常反应监测分析摘要:目的了解无细胞百白破联合疫苗(DTaP)疑似预防接种异常反应的发生特征,分析DTaP预防接种的安全性及监测数据报告质量情况。
方法通过中国免疫规划信息管理系统收集2015年-2020年丽江市DTaP疑似预防接种异常反应个案数据,采用描述流行病学方法进行分析。
结果年均报告发生率为78.67/10万剂;以一般反应为主(93.95%),异常反应以过敏性皮疹报告较多;男性发病数略多于女性;发生时间主要集中在第二、三季度;第1剂报告发生数高于第4剂,与其他研究不一致。
结论全市监测系统敏感性较高,DTaP接种较安全,但数据填报质量还有待加强。
关键词:DTaP ;疑似预防接种异常反应;监测吸附无细胞百白破联合疫苗是无细胞百日咳疫苗原液与白喉、破伤风类毒素混合,用吸附剂氢氧化铝制成混合疫苗,对于百日咳、白喉、破伤风这三种传染性较高的疾病具有较好的免疫效果。
适用于3月龄至5周岁的儿童接种,共需接种4剂次,基础免疫于12月龄完成,加强免疫在18~24月龄内进行接种1剂[1]。
有报道,在各类疫苗中,DTaP一直是疑似预防接种异常反应报告数较多的疫苗[3-6],为了解丽江市百白破(无细胞)疫苗接种后疑似预防接种异常反应的发生情况,以便针对性地采取预防控制措施,本文对2015-2020年接种该疫苗报告281例疑似预防接种异常反应个案进行回顾性分析,以期为该疫苗安全使用提供参考依据。
资料与方法1资料来源DTaP疑似预防接种异常反应监测数据2015-2019年来源于中国免疫规划信息管理系统AEFI监测管理系统,2020年来源于中国疾病预防控制信息系统免疫规划系统;DTaP接种剂次数来源于中国免疫规划信息管理系统预防接种信息管理系统丽江市历年常规接种上报接种剂次数。
2AEFI分类根据《全国AEFI监测技术方案(2010)》按发生原因将AEFI分为不良反应(包含一般反应、异常反应)、疫苗质量事故、疫苗接种事故、偶合症和心因性反应五类。
五联疫苗(吸附无细胞百白破灭活脊髓灰质炎和 b型流感嗜血杆菌联合疫苗)接种通知及知情同意书

五联疫苗(吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌联合疫苗)接种通知及知情同意书_____________________(家长姓名):村(居)您好!根据《中华人民共和国传染病防治法》第十一条规定,国家实行有计划的预防接种制度。
国家免疫规划疫苗是适龄儿童必须接种的疫苗,其它疫苗家长可为自己的孩子选择性接种。
国家免疫规划疫苗种类请咨询当地疾病预防控制机构。
根据卫生部《儿童免疫规划程序》要求,请于_______年_____月_____日(上午/下午)带您的孩子___________(儿童姓名)到(单位)接种(吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌联合疫苗)五联疫苗1. 五联疫苗2. 五联疫苗3. 五联疫苗4。
根据《疫苗流通和预防接种管理条例》,本产品属于第二类疫苗,由公民自费并且自愿受种;因接种第二类疫苗引起预防接种异常反应需要对受种者予以补偿的,补偿费用由相关的疫苗生产企业承担。
【疫苗作用与用途】接种后可使机体产生主动免疫,用于预防白喉、破伤风、百日咳、脊髓灰质炎和b型流感嗜血杆菌引起的侵袭性感染(如脑膜炎、败血症、蜂窝组织炎、关节炎、会厌炎等)。
【不良反应】注射后一般不良轻微,接种部位可出现轻微红肿、硬结、压痛、,偶有局部瘙痒感,一般不需特殊处理,即自行消退。
必要时可对症治疗。
全身反应:主要为发热反应(多在38.5℃以下),偶有烦躁、嗜睡、呕吐、腹泻、食欲不振,偶见非典型的皮疹,一般可自行缓解。
【禁忌】下列儿童严禁使用本品:1)对本品的任一组份或对百日咳疫苗(无细胞或全细胞百日咳)过敏,或是以前接种过含有相同组份的疫苗后出现过危及生命的不良反应者。
2)患有进行性脑病者。
3)以前接种百日咳疫苗(无细胞或全细胞百日咳疫苗)后7天内患过脑病者。
4)发热或急性疾病期间必须推迟接种本品。
【注意事项】以下情况者慎用:1.家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、患有血小板减少症或凝血障碍者。
(整理)儿童疫苗接种.

1. 出生24小时之内,我们应当接种卡介苗和乙肝疫苗。
2. 一个月龄的时候,要满30天以上,我们要接种第二针乙肝疫苗。
3. 满两个月龄的时候,我们要吃第一粒脊灰疫苗。
4. 在三个月龄的时候,我们要吃第二联脊灰疫苗,接种白百破三联疫苗的第一针。
5. 四个月龄的时候,我们要吃脊灰疫苗的第三联,接种白百破三联疫苗的第二针。
6. 五个月龄的时候,我们要接种白百破三联疫苗的第三针。
7. 满六个月龄时,我们要接种乙肝疫苗的第三针,从这里我们可以看出,乙肝疫苗的免疫程序,它是零、一、六个月接种程序,六月龄的时候,我们还要进行流脑疫苗的接种第一针。
8. 八个月龄时,我们要进行麻疹疫苗第一针的接种。
9. 九个月龄的时候,我们要进行流脑疫苗第二针的接种。
10. 当孩子满一岁的时候,我们要进行乙脑疫苗的接种。
11. 一岁半的时候,我们要进行百白破三联疫苗的加强注射,麻风三疫苗的加强注射。
12. 两岁时,我们要接种乙脑疫苗第二针。
13. 三岁时我们要进行流脑A+C疫苗的接种。
14. 四岁时,我们要加服一颗脊灰糖丸疫苗。
15. 六岁时,就是入学的年龄,我们要进行白百破二联加强注射,麻风塞加强注射,乙脑疫苗加强注射。
16. 在小学四年级的时候,我们要进行流脑A+C疫苗的加强注射。
17. 初中三年级进行白百破二联疫苗的加强注射。
18. 对于大一年级进京的新生,我们要进行白破二联的注射和麻疹疫苗的注射。
从表中我们可以看到,免疫程序随年龄的变化:1. B型流感、嗜血杆菌结合疫苗,它的适中人群为三个年龄段,第一个六月龄以下,儿童注射三针,间隔一到两个月,一年后加强一次。
第二个六到12个月儿童注射两针,间隔一个月,于出生后,第二年加强接种一次。
第三个一到5岁儿童注射一针。
2. 水痘疫苗,分两个年龄段,第一个一到12岁儿童接种一针,13岁以上接种两针,间隔6到10周。
3. 肺炎疫苗,它用于两岁以上,体弱多病的儿童,65岁以上老年人,慢性疾患或免疫功能减弱的人群,注射一针,高危人群五年后加强一次,健康人不需加强,一些容易患呼吸道疾病的儿童和癌症患者,都可以进行肺炎疫苗的接种。
各类疫苗中英文对照
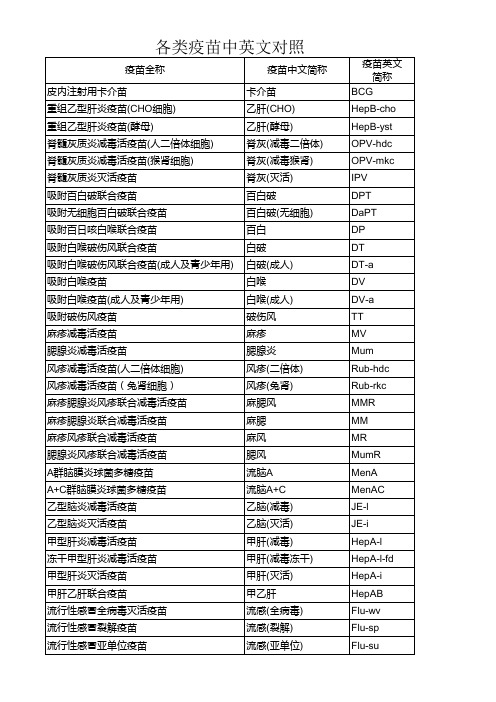
水痘 Hib 轮状病毒 肺炎23 气管炎 兰菌净 狂犬病(Vero) 狂犬病(Vero冻干) 狂犬病(地鼠肾) 出血热(Ⅰ价) 出血热(Ⅱ价) 出血热(双价) 伤寒 伤寒Vi 伤寒副伤寒甲 伤寒副伤寒甲乙 痢疾 钩体 鼠疫 炭疽 布病 霍乱 乙肝球蛋白 乙肝球蛋白(冻干) 白抗 白抗(冻干) 破抗 破抗(冻干) 破伤风球蛋白 破伤风球蛋白(冻干) 狂犬病血清 狂犬病球蛋白 狂犬病球蛋白(冻干) 结核菌素衍生物 卡介菌衍生物 锡克毒素
Var Hib Rot Pneu23 Tra Lan Rab-Vero Rab-Vero-fd Rab-hkc HFⅠ HFⅡ HFⅠ+Ⅱ Typh Typh-Vi T-pTA T-pTAB Dys Lep Plag Anth Bruc Chol HepBIG HepBIG-fd DAT DAT-fd TAT TAT-fd TIG TIG-fd RAS RIG RIG-fd TB-PPD BCG-PPD STT
冻干水痘减毒活疫苗 b型流感嗜血杆菌多糖结合疫苗 口服轮状病毒活疫苗 23价肺炎球菌多糖疫苗 气管炎疫苗 兰菌净细菌溶解物 人用狂犬病疫苗(Vero细胞) 冻干人用狂犬病疫苗(Vero细胞) 人用狂犬病疫苗(地鼠肾细胞) Ⅰ价肾综合征出血热灭活疫苗 Ⅱ价肾综合征出血热灭活疫苗 双价肾综合征出血热灭活疫苗 伤寒疫苗 伤寒Vi多糖疫苗 伤寒副伤寒甲联合疫苗 伤寒副伤寒甲乙联合疫苗 口服福氏宋内痢疾双价活疫苗 钩端螺旋体疫苗 皮肤划痕用鼠疫活疫苗 皮肤划痕人用炭疽活疫苗 皮肤划痕人用布氏菌活疫苗 霍乱疫苗 乙型肝炎人免疫球蛋白 冻干乙型肝炎人免疫球蛋白 白喉抗毒素 冻干白喉抗毒素 破伤风抗毒素 冻干破伤风抗毒素 破伤风人免疫球蛋白 冻干破伤风人免疫球蛋白 抗狂犬病血清 狂犬病人免疫球蛋白 冻干狂犬病人免疫球蛋白 结核菌素纯蛋白衍生物 卡介菌纯蛋白衍生物 锡克试验毒素
疫苗全称
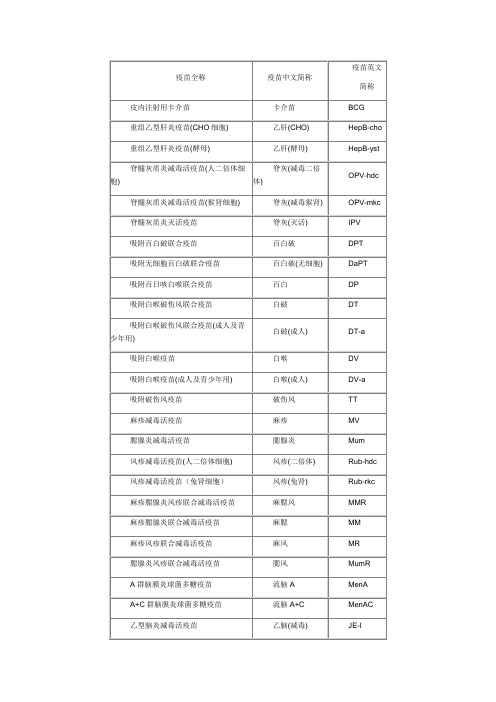
Lep
皮肤划痕用鼠疫活疫苗
鼠疫
Plag
皮肤划痕人用炭疽活疫苗
炭疽
Anth
皮肤划痕人用布氏菌活疫苗
布病
Bruc
霍乱疫苗
霍乱
Chol
乙型肝炎人免疫球蛋白
乙肝球蛋白
HepBIG
冻干乙型肝炎人免疫球蛋白
乙肝球蛋白(冻干)
HepBIG-fd
白喉抗毒素
白抗
DAT
冻干白喉抗毒素
白抗(冻干)
DAT-fd
破伤风抗毒素
HFⅠ
Ⅱ价肾综合征出血热灭活疫苗
出血热(Ⅱ价)
HFⅡ
双价肾综合征出血热灭活疫苗
出血热(双价)
HFⅠ+Ⅱ
伤寒疫苗
伤寒
Typh
伤寒Vi多糖疫苗
伤寒Vi
Typh-Vi
伤寒副伤寒甲联合疫苗
伤寒副伤寒甲
T-pTA
伤寒副伤寒甲乙联合疫苗
伤寒副伤寒甲乙
T-pTAB
口服福氏宋内痢疾双价活疫苗
痢疾
Dys
钩端螺旋体疫苗
Pneu23
气管炎疫苗
气管炎
Tra
兰菌净细菌溶解物
兰菌净
Lan
人用狂犬病疫苗(Vero细胞)
狂犬病(Vero)
Rab-Vero
冻干人用狂犬病疫苗(Vero细胞)
狂犬病(Vero冻干)
Rab-Vero-fd
人用狂犬病疫苗(地鼠肾细胞)
狂犬病(地鼠肾)
Rab-hkc
Ⅰ价肾综合征出血热灭活疫苗
出血热(Ⅰ价)
脊髓灰质炎灭活疫苗
脊灰(灭活)
IPV
吸附百白破联合疫苗
百白破
DPT
接种百白破疫苗不良反应的预防

接种百白破疫苗不良反应的预防作者:尹素文来源:《健康必读·下旬刊》2010年第11期【中图分类号】R183 【文献标识码】A 【文章编号】1672-3783(2010)11-0157-01吸附百白破联合疫苗是儿童最常使用的疫苗,预防百日咳、白喉、破伤风。
3月龄、4月龄、5月龄各接种1剂,18-24月龄加强1针,每个孩子要接种4次,此疫苗是百日咳疫苗、白喉类毒素、破伤风类毒素混合而加入氢氧化铝或磷酸铝作为佐剂而制成,为乳白色悬液,放置后佐剂下沉,摇动后即成均匀悬液,含防腐剂硫柳汞,所以较易引起不良反应,如局部红肿、疼痛、硬结、全身低热、疲惫头痛,甚至有高热者,其中最主要的是局部红肿、疼痛、硬结,占注射者的50%以上,给儿童造成了很大的痛苦,给家长带来了不满。
预防接种不良反应与受种者的个体差异、接种人员操作技术等有密切关系。
本文从接种核对、接种操作的实施、接种后留观、不良反应的处理,与家长的沟通5个方面试分析百白破疫苗不良反应发生的原因并提出预防措施。
1 接种前的核实与查对1.1 严格确定适宜接种对象:仔细核对儿童姓名和年龄,询问儿童健康状况。
了解接种对象近期的健康状况、有无感冒发热、有无过敏史等,上次接种百白破有无不适。
1.2 疫苗的存放与检查:百白破疫苗应在2~8℃避光的环境内存放,每天记录冰箱内的温度及其运转情况2次,温度的高低都可影响疫苗的效价。
存放时应按有效期的先后进行排列。
同批号疫苗应遵循“先入库、先出库”的原则。
疫苗从冰箱取出后要放置5-10分钟,使疫苗的温度与室温接近,这样可以减轻冷对局部肌肉组织的刺激,而引起肌肉收缩影响对药物的吸收,从而发生红肿、硬结检查疫苗的标签、名称、批号、有效期及生产单位,检查安瓿有无裂痕,药物有无发霉、异物、凝块、变色或冻结等,如出现上述现象不能使用。
最好选择吸附无细胞百白破进行接种,吸附无细胞百白破的不良作用要小于吸附百白破疫苗。
1.3 注射疫苗前要充分摇匀,并用注射器反复抽吸,使佐剂与百白破充分均匀混合,防止佐剂下沉注入肌肉组织而吸收不良引起硬结。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
吸附百白破联合疫苗Xifu Bai Bai Po Lianhe YimiaoDiphtheria,Tetanus and Pertussis Combined Vaccine,Adsorbed本品系由百日咳疫苗原液、白喉类毒素原液及破伤风类毒素原液加入氢氧化铝佐剂制成。
用于预防百日咳、白喉、破伤风。
1基本要求生产、检定用设施、水、器具、动物等应符合“凡例”要求;生产用原辅材料应符合现行《中国药典》的要求。
2制造2.1混合前单价原液2.1.1百日咳疫苗原液制造应符合本品种附录1的规定。
2.1.2白喉类毒素原液制造应符合“吸附白喉疫苗”中2.1~2.2项的规定。
2.1.3破伤风类毒素原液制造应符合“吸附破伤风疫苗”中2.1~2.2项的规定。
2.1.4原液检定2.1.4.1百日咳疫苗按本品种附录1中 2项进行。
2.1.4.2白喉类毒素按“吸附白喉疫苗”中3.1项进行。
2.1.4.3破伤风类毒素按“吸附破伤风疫苗”中3.1项进行。
2.2半成品2.2.1配方每1ml半成品中各抗原成分含量如下:百日咳菌应不高于9.0×109个菌(应不高于30 IOU)白喉类毒素不高于20Lf破伤风类毒素不高于5Lf2.2.2配制2.2.2.1氢氧化铝佐剂稀释按吸附后之最终浓度,将氢氧化铝原液用注射用水稀释成1.0~1.5mg/ml。
加入硫柳汞含量不高于0.1g/L,氯化钠含量补足至8.5g/L。
2.2.2.2吸附按计算量将白喉类毒素、破伤风类毒素及百日咳疫苗原液加入已稀释的氢氧化铝内,调节pH值至5.8~7.2。
2.2.3半成品检定按3.1项进行。
2.3成品2.3.1分批应符合“生物制品分批规程”规定。
2.3.2分装应符合“生物制品分装和冻干规程”规定。
2.3.3规格每瓶0.5ml、1.0ml、2.0ml、5.0ml。
每1次人用剂量0.5ml,含百日咳疫苗效价应不低于4.0IU,白喉疫苗效价应不低于30IU,破伤风疫苗效价应不低于40IU(豚鼠法)或60IU (小鼠法)。
2.3.4包装应符合“生物制品包装规程”规定。
3检定3.1半成品检定无菌检查依法检查(附录Ⅻ A),应符合规定。
3.2成品检定3.2.1鉴别试验3.2.1.1百日咳疫苗按本品种附录2进行效价测定,动物免疫后应产生相应抗体;或加枸橼酸钠或碳酸钠将佐剂溶解,离心沉淀百日咳菌体,加相应抗血清做凝集试验,应呈明显凝集反应(按本品种附录1中2.3项进行)。
3.2.1.2白喉类毒素可选择下列一种方法进行:(1)疫苗注射动物应产生抗体(附录Ⅺ C);(2)疫苗加枸橼酸钠或碳酸钠将佐剂溶解后,做絮状试验(附录Ⅺ D),应出现絮状反应;(3)疫苗经解聚液溶解佐剂后取上清,做凝胶免疫沉淀试验(附录Ⅷ C),应出现免疫沉淀反应。
3.2.1.3破伤风类毒素可选择下列一种方法进行:(1)疫苗注射动物后应产生破伤风抗体(附录Ⅺ B);(2)疫苗加入枸橼酸钠或碳酸钠将吸附剂溶解后做絮状试验(附录Ⅺ D),应出现絮状反应;(3)疫苗经解聚液溶解佐剂后取上清,做凝胶免疫沉淀试验(附录Ⅷ C),应出现免疫沉淀反应。
3.2.2物理检查3.2.2.1外观检查振摇后应呈均匀乳白色混悬液,不应有摇不散的凝块或异物。
3.3.2.2 装量按附录ⅠA中装量项进行,应不低于表示量。
3.2.3化学检定3.2.3.1pH值应为5.8~7.2(附录Ⅴ A)。
3.2.3.2氯化钠含量应为7.5~9.5g/L(附录Ⅶ G)。
3.2.3.3氢氧化铝含量应为1.0~1.5mg/ml(附录Ⅶ F)。
3.2.3.4硫柳汞含量应不高于0.1g/L(附录Ⅶ B)。
3.2.3.5游离甲醛含量应不高于0.2g/L(附录Ⅵ L)。
3.2.4效价测定3.2.4.1 百日咳疫苗按本品种附录2进行。
每1次人用剂量中百日咳疫苗的免疫效价应不低于4.0IU;且95%可信限的低限应不低于 2.0IU。
如达不到上述要求,可进行复试,但所有有效试验的结果必须以几何平均值(如用概率分析法时应用加权几何平均)计算,达到上述要求判为合格。
3.2.4.2白喉疫苗每1次人用剂量中白喉类毒素的免疫效价应不低于30IU(附录Ⅺ C)。
3.2.4.3破伤风疫苗依法测定(附录Ⅺ B),每1次人用剂量中破伤风类毒素的免疫效价应不低于40IU(附录Ⅺ B 豚鼠法),或应不低于60IU(附录Ⅺ B 小鼠法)。
3.2.5无菌检查依法检查(附录Ⅻ A),应符合规定。
3.2.6特异性毒性检查3.2.6.1百日咳疫苗应符合本品种附录3的规定。
3.2.6.2白喉、破伤风疫苗用体重250~350g豚鼠,每批制品不少于4只,每只腹部皮下注射2.5ml,分两侧,每侧1.25ml,观察30天。
注射部位可有浸润,经5~10天变成硬结,可能30 天不完全吸收。
在第10天、第20天、第30天称体重,到期体重比注射前增加,局部无化脓、无坏死、无破伤风症状及无晚期麻痹症者为合格。
4保存、运输及有效期于2~8℃避光保存和运输。
自生产之日起有效期为1年6个月;百日咳疫苗原液保存时间超过1年6个月者,自原液采集之日起总有效期不得超过3年。
5附录附录1百日咳疫苗原液制造及检定要求附录2百日咳疫苗原液效价测定方法附录3百日咳疫苗原液毒性检查方法6使用说明应符合“生物制品包装规程”规定和批准的内容。
附录1百日咳疫苗原液制造及检定要求本品系用百日咳杆菌Ⅰ相菌种,经培养后,取菌体制成悬液,加适当杀菌剂,以PBS 稀释制成。
用于制备百白破联合疫苗。
1.制造1.1菌种生产用菌种应符合“生物制品生产检定用菌毒种管理规程”规定。
1.1.1名称及来源采用百日咳杆菌Ⅰ相CMCC58001、58003、58004、58031和沪-214株含1型、2型和3型凝集原的菌株。
1.1.2种子批的建立应符合“生物制品生产检定用菌毒种管理规程”的有关规定。
1.1.3种子批的传代工作种子批菌种启开后传代不应超过10代用于生产。
1.1.4种子批菌种的检定1.1.4.1培养特性于包-姜(Bordet Gengou)培养基或其他适宜培养基上培养,各菌株应具有典型的形态及生化特性。
1.1.4.2血清学试验菌种经35~37℃培养40~48小时,取适量菌苔混悬于生理氯化钠溶液或PBS内,制成适宜浓度的菌悬液,与Ⅰ相参考血清做定量凝集反应,凝集效价应达到血清原效价之半。
同时做Fim2、Fim3检测。
1.1.4.3皮肤坏死试验菌种经35~37℃培养40~48小时,取适量菌苔混悬于PBS内稀释成不同浓度的菌液;取家兔(或豚鼠)至少2只,分别用每一稀释度的菌液注射于家兔(或豚鼠)皮内0.1ml,经72小时观察注射部位皮肤反应,如其中有1只家兔(或豚鼠)在注射含菌4.0×107以下稀释度的部位出现出血性坏死者,为阳性反应,判为合格。
1.1.4.4毒力试验用体重16~18g的小鼠至少3组,每组至少10只,在麻醉状态下从鼻腔滴入经培养20~24小时、以PBS稀释的菌液0.05ml,观察14天,记录小鼠生死情况,按Reed-Muench 法计算LD50,1LD50的菌数应不高于1.2×108。
1.1.4.5效价测定用适宜方法杀菌后,按本品种附录2进行。
1.1.5菌种保存种子批应冻干保存于8℃以下。
1.2原液制备1.2.1生产用种子冻干菌种启开后,接种于改良包-姜培养基或活性炭半综合培养基或其他适宜培养基,于35~37℃培养不超过72小时,以后各代不超过48小时,传代菌种保存不得超过14天,工作种子批启开后用于生产时不应超过10代。
1.2.2培养用适宜方法培养,培养时间不得超过48小时,经检查为纯菌后,用适当方法收集菌体,混悬于pH7.0~7.4的PBS中,制成菌悬液。
1.2.3纯菌检查菌悬液应逐瓶(罐)抽样,接种普通琼脂斜面及普通血液琼脂斜面改良包-姜培养基(或活性炭半综合培养基)各1管,置35~37℃培养2天,然后于24~26℃培养1天,有杂菌生长者应废弃。
1.2.4杀菌采用终浓度小于0.1% 甲醛溶液杀菌,亦可用经批准的其他适宜的杀菌剂和杀菌方法杀菌。
1.2.5杀菌检查依法检查(附录Ⅻ A),应符合规定。
并同时接种普通血液琼脂斜面改良包-姜培养基(或活性炭半综合培养基),分别置35~37℃培养72小时和24~26℃培养24小时。
有微生物生长者应废弃。
不同菌株不同日制造的原液应分别合并。
合并后,可加适量防腐剂,并保存于2~8℃。
2.检定2.1浓度测定每瓶原液应按“中国细菌浊度标准”测定浓度,稀释疫苗时即按此浓度计算。
2.2染色镜检每瓶原液取样稀释至成品浓度,涂片染色镜检,应为革兰阴性球杆菌,至少观察10个视野,应无杂菌。
2.3血清学试验每瓶原液应与Ⅰ相参考血清做定量凝集反应,凝集效价应达到血清原效价之半,若未能达到者,应做效价测定,合格后方可使用。
同时还应进行Fim2,Fim3的检测。
2.4效价测定每批原液进行效价测定按本品种附录2进行。
2.5无菌检查每瓶原液依法检查(附录Ⅻ A ),应符合规定。
2.6特异性毒性检查按本品种附录3进行。
3.保存及有效期于2~8℃保存。
自收菌之日起有效期为3年。
附录2百日咳疫苗原液效价测定方法1.试验材料1.1动物体重10~12g 同性或雌雄各半的NIH小鼠。
1.2百日咳参考菌苗由国家药品检定机构分发。
将该参考品按标示的要求进行稀释。
1.3供试品将供试品稀释至合适的稀释倍数。
半数有效剂量(ED50)应在所用的稀释度范围之内。
1.4攻击菌及攻击菌液1.4.1攻击菌为百日咳杆菌CMCC 58030(18323)菌株。
1.4.2培养基可用包-姜培养基(含羊血20%~30%)或其它适宜的培养基。
1.4.3培养温度及时间置35~37℃培养,第1代不超过72小时,此代菌种可置2~8℃保存2周。
攻击时菌种的培养时间为20~24小时。
1.4.4攻击菌液的制备将培养20~24小时的菌苔经肉眼检查为纯菌后,刮至适量的生理氯化钠溶液或PBS (pH7.2~7.4)中,用灭菌脱脂棉过滤,测定浓度,然后用适宜稀释液释成每0.03ml含菌8.0×104,作为试验组的攻击菌液。
然后再连续稀释,使每0.03ml分别含8000个菌、800个菌、80个菌及8个菌,以上5个不同稀释度的菌液作为对照组的攻击菌液,用于测定攻击菌液的LD50。
2试验步骤2.1免疫至少使用3个稀释度的参考菌苗和供试品,分别免疫小鼠(每个稀释度之间不超过5倍),每稀释度免疫1620只小鼠(同性或雌雄各半),每只小鼠各腹腔注射0.5ml。
同时饲养小鼠55~60只作对照用。
2.2攻击小鼠免疫后14~16天,此期间内参考菌苗和供试品的每个稀释度的免疫小鼠的健存率应至少为94%。
每只小鼠用0.25ml注射器脑内攻击0.03ml菌液(含菌8.0×104)。
