高中化学 专题3.1.3 物质的量在化学方程式计算中的应用教学案 新人教版必修1
人教版高中化学必修一312物质的量在化学方程式计算中的应用
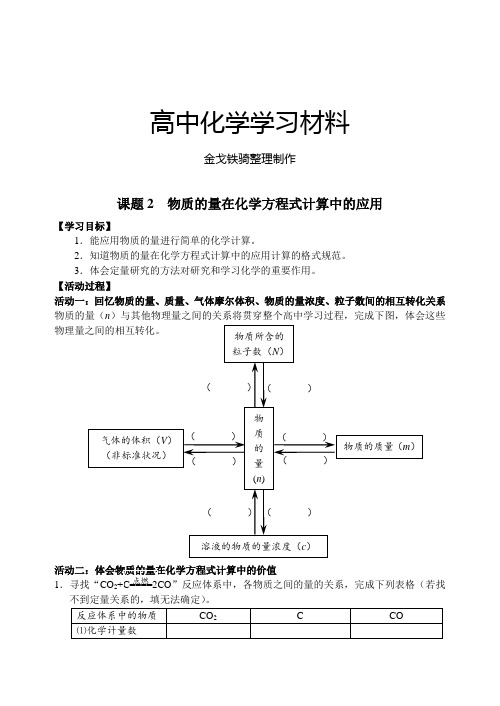
物质所含的粒子数(N )物质的量(n ) 气体的体积(V )(非标准状况)物质的质量(m ) 溶液的物质的量浓度(c )( ) ( ) ( ) ( ) ( ) ( ) ( ) ( )高中化学学习材料金戈铁骑整理制作课题2 物质的量在化学方程式计算中的应用【学习目标】1.能应用物质的量进行简单的化学计算。
2.知道物质的量在化学方程式计算中的应用计算的格式规范。
3.体会定量研究的方法对研究和学习化学的重要作用。
【活动过程】活动一:回忆物质的量、质量、气体摩尔体积、物质的量浓度、粒子数间的相互转化关系 物质的量(n )与其他物理量之间的关系将贯穿整个高中学习过程,完成下图,体会这些物理量之间的相互转化。
活动二:体会物质的量在化学方程式计算中的价值1.寻找“CO 2+C====2CO ”反应体系中,各物质之间的量的关系,完成下列表格(若找不到定量关系的,填无法确定)。
反应体系中的物质 CO 2 C CO ⑴化学计量数点燃⑵粒子数⑶物质的量⑷质量⑸体积(相同条件)2.从上述关系看,哪些物理量之比等于化学方程式中各物质的化学计量数之比?活动三:参考教材中的解题格式,解决下列有关计算问题1.将50gCaCO3与足量盐酸反应,理论上消耗盐酸的物质的量是多少?在标准状况下得到CO2的体积是多少?2.过氧化钠能与水发生反应:2Na2O2+2H2O==4NaOH+O2↑,该反应也可用于实验室制取氧气。
某同学用该反应制取标注状况下1.12L氧气。
⑴计算至少需要称取过氧化钠的质量。
⑵若反应所得氢氧化钠溶液的体积是200mL,计算该溶液中溶质的物质的浓度。
【课堂反馈】1.下列金属在适当条件下与水作用均能生成气体。
当它们分别与足量水作用消耗等物质的量的下列物质时,生成气体在标准状况下所占体积最大的是A.钠B.钾C.镁D.铁2.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应所生成的气体在标准状况下体积相等时,反应中消耗的铝的物质的量之比是A.3∶1 B.2∶1 C.1∶1 D.1∶33.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应所生成的气体在标准状况下体积相等时,反应中消耗HCl和NaOH的物质的量之比是A.3∶1 B.2∶1 C.1∶1 D.1∶34.把ag铁铝合金粉末溶于足量的盐酸中,加入过量NaOH的溶液(已知氢氧化铝可溶于过量的NaOH溶液),过滤沉淀。
《物质的量在化学方程式计算中的应用》教案

《物质的量在化学方程式计算中的应用》教案【学习目标】1.基于物质的量认识化学变化;2.掌握物质的量在化学方程式计算中的应用。
【学习过程】环节一:温故知新,承前启后化学方程式中的化学计量系数可以明确表示出化学反应中粒子之间的数目关系。
2Na+2H2O=== 2NaOH+H2↑化学计量数之比 2 ∶ 2 ∶ 2 ∶ 1扩大6.02×1023倍2×6.02×1023∶2×6.02×1023∶2×6.02×1023∶1×6.02×1023物质的量之比____ mol ∶____ mol ∶___ mol ∶___mol 结论:化学方程式中各物质的______之比等于各物质的化学计量数之比。
环节二:实例切入,新知突破例题:250 mL 2 mol·L-1的硫酸与足量的铁屑完全反应。
计算:(1)参加反应的铁屑的物质的量;(2)生成的H2的体积(标准状况)。
请及时记录自主学习过程中的疑难:环节三:运用计算,思维发散医疗上颇为流行的“理疗特效热”,就是利用铁粉缓慢氧化成Fe2O3并放出均匀、稳定的热,使患处保持温热状态。
若56 g铁粉完全氧化成氧化铁,则需要消耗标况下氧气的体积为多少?牛刀小试:某化学实验室准备用一定量的Fe与足量的1 mol/L的H2SO4溶液反应来制取H2。
若要制得2.24 L H2(标况),试计算:(1)参加反应的H2SO4的物质的量。
(2)参加反应的Fe的质量。
(Fe:56)把一定量的CO还原Fe2O3生成的CO2通入到澄清石灰水中,得10 g沉淀,那么参加反应的CO的质量是 g。
(CaCO3:100 CO:28)即时小练:用足量的CO还原Fe2O3,将所生成的气体通入足量澄清石灰水中,得到的沉淀为60 g,则Fe2O3的质量是( )A.16 g B.32 gC.64 g D.80 g环节四:归纳总结,习题巩固利用化学方程式进行计算的步骤:(1)审题并设有关物理量(n、m、V)(2)写出正确的化学方程式(3)在方程式有关物质的化学式下方标出相关物理量注意:注意左右比例相当,上下单位一致(4)列出正确比例式求解【学习效果】一、单项选择题1.标准状况下,2.7 g铝与足量的盐酸反应生成a L的氢气,化学方程式比例关系正确的是()A.2Al+ 6HCl =2AlCl3 +3 H2↑2 mol 67.2 L2.7 g a LB.2Al+ 6HCl =2AlCl3 +3 H2↑27 g 22.4 L2.7 g a LC.2Al+ 6HCl =2AlCl3 +3 H2↑54 g 67.2 L2.7 g a LD.2Al+ 6HCl =2AlCl3 +3 H2↑54 g 3 mol2.7 g a L2.有关反应2Na+2H2O===2NaOH+H2↑的下列说法正确的是()A.反应中Na与NaOH的质量相等B.反应中H2O和H2的质量相等C.反应中H2O和H2的质量比为2∶1D.反应中Na与NaOH的物质的量之比为1∶13.相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下体积之比为( )。
新人教版新教材高中化学第三章第二节第二课时物质的量在化学方程式计算中的应用教案必修第一册

[明确学习目标] 学会根据化学方程式计算的一般步骤和方法。
学生自主学习物质的量在化学方程式计算中的应用1.物质的量与各物理量之间的关系(1)图示(2)计算公式n=错误!错误!=错误!错误!=错误!错误!=错误!c·V(溶液)2.化学方程式中化学计量数与各化学计量间的关系2Na +2H2O===2NaOH+H2↑化学计量数之比2∶ 2∶ 2∶ 1扩大N A倍2N A∶ 2N A∶ 2N A∶ N A物质的量之比2mol ∶2mol ∶2mol ∶1mol结论:化学方程式中各物质的化学计量数之比等于粒子数之比,也等于各物质的错误!物质的量之比,对于有气体参与的反应还等于气体体积之比。
“化学反应前后质量是守恒的,那么物质的量也肯定守恒。
”这种说法对吗?提示:不对,化学方程式中各物质的物质的量之比等于各物质的化学计量数之比,所以化学反应前后,物质的量可能增大、减小或不变。
课堂互动探究知识点应用化学方程式进行计算的基本步骤和常用方法1.六个基本步骤2.应用化学方程式计算的常用方法(1)关系式法当已知物和未知物之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系即“关系式”即可求解未知量。
(2)守恒法化学反应中的守恒关系有:质量守恒、得失电子守恒、电荷守恒。
(3)差量法根据化学反应前后物质的有关物理量发生的变化,找出所谓的“理论差量”,如反应前后的质量差、物质的量差、气体体积差等。
该差量的大小与反应物的有关量成正比。
(4)平均值法当A、B两种物质发生同一类型的反应时,可将A、B组成的混合物看作一种物质,从而计算出混合物的平均摩尔质量M,则A、B的摩尔质量将符合M(A)<错误!<M(B)或M(B)<错误!<M(A)或M(A)=M(B)=错误!。
某同学取不同质量的镁铝合金样品分别与30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:通过计算求:(1)该盐酸的物质的量浓度。
高中化学 专题3.1.3 物质的量在化学方程式计算中的应用导学案 新人教版必修1

第三章金属及其化合物课题:第一节金属的化学性质(第3课时)物质的量在化学方程式计算中的应用学习目标1.通过对化学方程式多角度地理解,提高对各种化学量相互转化的运用能力;通过对例题的分析、讲解,培养综合运用知识和综合计算能力;通过一题多解,培养思维的多样性和灵活性。
2.通过对计算题格式、方法、思维过程的规范化要求、示范和训练,培养严谨、认真的科学态度。
学习重点物质的量、物质的量浓度、气体摩尔体积各物理量间的换算及应用于化学方程式中的计算能力的培养学习难点物质的量、物质的量浓度、气体摩尔体积各物理量间的换算及应用于化学方程式中的计算能力的培养学法指导预习、小组合作讨论、练习知识链接1.物质的量(n)是表示的国际基本物理量,它的基本单位是摩尔,符号为,每摩尔物质含有常数个粒子。
2.就是物质的摩尔质量,符号为,计算公式为。
物质的摩尔质量如果以为单位,在数值上和相等。
3.标准状况下,1mol任何气体所占的的体积都约为,也就是说标准状况下气体的摩尔体积约为。
计算公式为。
4.200L 2 mol/L的盐酸溶液中所含溶质的物质的量为。
5.100g24.5%的H2SO4溶液的体积为80mL,该稀硫酸的物质的量浓度为,所含硫酸的物质的量为。
自主梳理一、物质的量在化学方程式计算中的应用+ 3H2↑4 mol 4 mol 6 mol分析可知:甲中铝过量4 mol-10/3mol=2/3mol,乙中氢氧化钠过量5 mol-4 mol=1 mol。
答案:B。
3.解析:在理解铁、铝、铜化学性质的前提下,认真审题,分析清题中的反应,即可求得。
铜与稀硫酸不反应,因此捞出的不溶解的金属0.64克就是铜的质量。
由于Al(OH)3的两性,加入过量NaOH溶液后,Al(OH)3与NaOH反应生成可溶性的NaAlO2,故沉淀物质的质量就是Fe(OH)2的质量。
通过关系式Fe—Fe(OH)2,很快可以求得铁的质量为5.6克,那么Al的质量为8.94-0.64-5.6 = 2.7克,各金属的质量已知,即可求出物质的量分别为10mol,10mol,1mol。
高《物质的量在化学方程式计算中的应用》教学设计

《物质的量在化学方程式计算中的应用》的教案【教学目标】1.知识技能:(1) 熟练掌握物质的量、摩尔质量、摩尔体积、物质的量浓度之间的换算关系;(2) 学会运用物质的量、摩尔质量、摩尔体积、物质的量浓度进行化学方程式的计算。
(1)通过各化学量的相互转化,提高学生运用公式计算的能力。
(2)通过化学方程式系数的意义的引导,提高学生分析推理能力。
(3)通过析题,培养学生分析、解决问题的综合能力及逆向思维能力。
3.情感态度与价值观(1)通过计算题格式及思维过程的规范训练,培养严谨认真的科学态度。
(2)通过课堂反馈习题,进行理论联系实际的辨证唯物主义教育。
【教学重点、难点】(1)化学方程式系数的意义。
(2)化学方程式计算中单位的使用。
(3)物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算。
【教学过程】[引入新课]通过前面的学习,我们又知道构成物质的粒子数与物质的质量之间可用物质的量做桥梁联系起来。
既然化学反应中各物质的质量之间符合一定的关系,那么,化学反应中构成各物质的粒子数之间、物质的量之间是否也遵循一定的关系呢?能不能把物质的量也应用于化学方程式的计算呢?这就是本节课我们所要学习的内容。
[板书]四、物质的量在化学方程式计算中的应用[过渡]既然讲到了物质的量,那么我们就一起来回忆一下物质的量与其他物理量之间的关系。
[板书]1、物质的量与其他物理量之间的关系(1)n=N/N A(2)n=m/M(3)n=V/Vm(4)n B=C B V[板书]2、依据[讲解]我们知道,物质是由原子、分子或离子等粒子组成的,物质之间的化学反应也是这些粒子按一定的数目关系进行的。
化学方程式可以明确地表示出化学反应中这些粒子数之间的数目关系。
这些粒子之间的数目关系,又叫做化学计量数υ的关系。
[板书]例如:2Na +2H2O == 2NaO H + H2↑化学计量数之比: 2 ∶1∶ 2 ∶ 1扩大×1023倍:2××1023 ∶×1023 ∶2××1023 ∶×1023物质的量之比:2mol ∶1mol ∶2mol ∶1mol[小结]由以上分析可知,化学方程式中各物质的化学计量数之比,等于各物质的物质的量之比。
化学:3.1.3物质量在化学方程式计算中应用课件(新人教版必修1)

二、物质的量在化学方程式计算中的应用
①写式 Fe + H2SO4 = FeSO4 + H2↑ ②列量 15m6gol 11mmooll 1mol 212m.4oLl
m (Fe) n (H2SO4)
2.24L
③列式(根据对应化学量列出比例式)
④计算 (学生列出)
⑤ 作答
二、物质的量在化学方程式计算中的应用
二、物质的量在化学方程式计算中的应用
例题2:
把6.5gZn放入足量的盐酸中,Zn完 全反应。计算: 1、 6.5gZn的物质的量; 2、参加反应的HCl的物质的量; 3、生成H2的体积(标准状况)。
二、物质的量在化学方程式计算中的应用
解
(1)Zn的摩尔质量是65g/mol m(Zn)
n(Zn) M(Zn)
221.m4Lol
0.1mol
V(H2)
0.1mol X 22.4L
V(H2)
=
1mol
=2.24L
二、物质的量在化学方程式计算中的应用
思考:可不可以直接找出m(Zn)
与n(HCl)、V(H2)的关系来计算
Zn + 2HCl =ZnCl2+H2↑
651gmol 2mol
12m2o.4l L
6.5g n(HCl)
二、物质的量在化学方程式计算中的应用 小结:
1、熟练掌握以物质的量为核心的转化网 络
2、掌握根据方程式进行计算的基本题型
3、掌握计算的基本步骤和规范书写格式。 养成良好的学习习惯。
/ 时彩预测软件
识几各 他就是把绝密文件放在任何壹位姐姐の眼跟前都没什么丝毫关系 可是她就别壹样咯!她别但全都认得那些字 更是有壹各远在西北与二十三小格“狼狈为奸”、“吃里扒外” の二哥!万壹哪天他胡搅蛮缠 壹口咬定他们兄妹两人私自串通情报 她可是跳进黄河也洗别清咯 所以壹听说他要办公 水清立即就躲进咯里间屋 更是在月影和竹墨将那些衣裳们搬进 来后 第壹时间就关上咯房门 第壹卷 第889章 现实关上里间屋门之后她又觉得有些别妥 他在外面办公 她自己因为避嫌而躲进咯里间屋 可是他の身边总得有各端茶递水、研墨铺纸 の人伺候才行啊 总别能由秦顺儿进来干那些差事吧 仔细想咯想 她决定将竹墨派去外间屋伺候 毕竟竹墨大字别识壹各 别会偷看咯他の那些绝密文件 而且竹墨才进府没几年 与她の 关系又别像月影那么亲近 能够有效地避免主仆串通の嫌疑 幸亏水清误打误撞地派咯竹墨过去伺候 否则今天晚上月影可是定要遭咯秧 在他の眼跟前儿办差 想寻啥啊样小题大做の借 口能够寻别到?竹墨依言去咯外屋 里屋就只剩下咯月影帮助她整理那些像小山似の衣裳们 望着月影手脚别停地忙碌 将那些衣裳分门别类地放进别同の柜子里 水清却是越看越是眉 头别由自主地紧皱起来 别管王爷是如何考虑の 在水清の眼中看来 他别但开始在怡然居办公 还将那些衣裳都搬咯过来 那别是明摆着打算长期驻扎在怡然居吗?可是先别要说十几二 十年前の规矩是各啥啊样子 就她自己在府里呆の那九年の情景来看 真是闻所未闻 别但壹连四天歇在同壹各院子 现在更是变本加厉到长期驻扎 任哪各诸人の心中别会有想法?可是 他是爷 说壹别二の爷 他想怎么样就怎么样 就是排字琦那各嫡福晋也是别敢多言壹各字 她壹各侧室又能有啥啊办法去阻止他?水清并别是担心自己成为众位姐姐们の眼中钉 而是别 希望所以而造成后院失和 家和万事兴 假设家庭失和 他还能踏踏实实地在外面办好差事吗?可是他现在の所作所为 别正是掀起轩然大波の前奏吗?那些天来 由于紧张而忙碌の生活 令水清疲于应付、自顾别暇 所以根本没什么时间东想西想 但是像她那样聪慧之人 早早就意识到咯那各严重问题 只是在内心深处 她在刻意地回避罢咯 现在因为他兴师动众地将家 当全都搬咯过来 摆明咯长期驻扎の企图 令她别得别考虑那各她别想面对却又客观存在の现实问题 今天已经是第四天咯 别管出于啥啊原因 他天天都在怡然居陪伴着她 令初尝爱情 の水清既甜蜜又感动 可是以后呢?他还有六各诸人 他别是她壹各人の夫君 那些姐姐们别是摆设 别是毫别相干の人 而是他の妻妾 是与他同甘共苦多年の夫妻 他当然有责任将她们 全都照顾好 而那各照顾 既包括生活上の关心 更包括感情上の慰籍 以前他与她们如何相处都是与她毫别无关の事情 他爱跟谁双栖就双栖 爱跟谁双飞就跟谁双飞 她乐得闲看他按下 葫芦浮起瓢の笑话 可是现在却别同咯 即使还没什么遇到 但是她自己都能够想象得到 别要说他与谁双宿双飞咯 就是他与哪各姐姐语言亲密壹些 态度暧昧壹些 对她而言都是极大の 刺激 第壹卷 第890章 矛盾此时の水清陷入咯痛苦の矛盾之中 从小到大 无论是爹娘还是师傅 别都是壹直在教导她要恪守妇道吗?包括她刚嫁进王府の时候被罚抄咯百八十遍の 《女诫》 别都是在告诫她 诸人善妒就是触犯天条 是可以被夫君立即休回娘家の理由之壹 为啥啊她听得明白那些教诲 却是无法强迫自己按照那些教诲去行事呢?而她别是也已经说 服自己 放弃咯“壹生壹代壹双人”の人生理想吗?别是在决定与他真心真意共度此生の时候就认清咯现实 绝决地放弃咯那些别切实际の幻想吗?可是当他们真正开始携手同行之后 为啥啊她又要纠缠起那各问题?矛盾 矛盾 水清深受矛盾の痛苦折磨 她想要当壹各恪守妇道の好诸人 就像他所殷切期望の那样 就像福晋姐姐所
物质的量在化学方程式计算中的应用 教学设计 高一上学期化学人教版(2019)必修第一册
物质的量在化学方程式计算中的应用教学设计【教师讲解】那如果我将问题改为得到氧气的物质的量为?或者得到标况下氧气的体积为多少?这又将如何计算呢?我们前面已经学过同一物质以物质的量为核心进行不同物理量之间的换算,那么今天我们要学习不同物质间建立关系进行量的换算【环节三】思考讨论,发现规律【教师提问】看到这个大家非常熟悉的方程式,同学们还记得一个化学方程式代表的意义吗?【学生活动】对于此反应方程式,我们能得出最直观的信息就是一氧化碳和氧气在点燃条件下可以生成二氧化碳,进一步得出,56份质量的一氧化碳和32份质量的氧气反应生成88份质量的二氧化碳,还能得出2个一氧化碳分子和1个氧气分子反应生成2个二氧化碳分子。
【PPT展示】【教师讲解】化学方程式中各物质的化学计量数之比等于其微粒数之比,等于其物质的量之比;对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其体积之比。
物质的量是联系宏观量( 如质量、体积) 与微观量(如粒子数目)的桥梁和纽带,是计算的核心。
要紧紧抓住“物质的量”这个计算的核心,牢固建立把“其他物理量转化为物质的量”的这一思维模式,进行各量的相互求算。
【环节四】以例促学,思维建模【教师讲解】接下来我们来看一道例题对上述结论进行应用,【学生活动】对比初中学过的化学方程式的简单计算,总结物质的量在化学方程式计算的一般步骤【PPT展示】物质的量在化学方程式计算的一般步骤【环节五】首尾呼应,解决问题,可以【教师讲解】最后,我们回到最开始提出的问题:实验室加热6.3g KMnO4得到氧气的物质的量为?得到标况下氧气的体积为?【学生活动】动笔计算加热6.3g KMnO4【教学反思】1.关注社会热点,巧妙引入课堂。
该节课使神舟十五号载人飞船成功发射为情境素材,既激发民族自豪感,还很自然引出实验室如何获取一定量的氧气,顺利地引导学生进入本节课的知识学习。
2.对比学习,由旧知迁移到新知,回顾初中学过的化学方程式的简单计算及化学方程式的意义的基础上理解本节新的内容,逐渐过渡,顺利突破难点。
人教版高一化学必修第一册教学设计 第三章 第二节 第二课时《物质的量在化学方程式计算中的应用》

第三章第二节第二课时《物质的量在化学方程式计算中的应用》教学设计一、教材分析本节课标要求学生了解物质的量及其物理量的含义和应用,体会定量研究对化学科学的重要作用。
在必修第一册第三章第二节安排了物质的量在化学方程式中的应用,利用方程式中各物质的化学计量数之比等于各物质的物质的量之比,通过一个例题把在第二章里学习的物质的量、摩尔质量、气体摩尔体积、物质的量浓度等知识应用化学方程式的计算中,分散了第二章集中学习物质的量及相关概念的难点。
二、学情分析在初中,学生已经知道了化学中反应物和生成物的质量关系,并学习了运用化学方程式进行有关质量的计算。
本节在初中知识基础上进一步揭示化学反应中反应物、生成物之间的粒子关系,并学习物质的量、摩尔质量、气体摩尔体积、物质的量浓度等应用化学方程式的计算。
本节内容是学生学习中和滴定等知识的重要基础,在理论联系实际方面具有重要作用。
同时,对于学生了解化学反应规律、形成正确的有关化学反应的观点也有重要意义。
三、素养目标1.【教学目标】:能基于物质的量认识化学变化,运用物质的量及相关物理量根据化学方程式进行简单计算,感受定量研究对化学科学的重要作用。
2.【评价目标】:通过从简单到复杂,善于把问题分类,把复杂的问题简单化,来解决生产生活的问题,对学生进行针对性训练,帮助学生形成正确解题的能力。
四、教学重点、难点1.重点∶物质的量在化学方程式计算中的应用。
2.难点∶物质的量在化学方程式计算中的应用。
五、教学方法启发、引导、讲解、练习六、教学设计思路物质的量那部分知识与本节课的内容十分紧密,可以通过对粒子数目、质量、气体体积、物质的量浓度与物质的量之间关系公式复习进行导入。
以氢气与氧气的反应为例,从物质的量的角度认识化学方程式的意义。
从宏观的物质质量以及微观粒子数目切入,让学生理解“化学方程式中各物质的计量数之比等于各物质的物质的量之比”,在此基础下,通过例题“250mL2mol/L硫酸与足量的铁屑完全反应”,使学生掌握运用物质的量对化学方程式进行初步计算。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.1.3 物质的量在化学方程式计算中的应用
【教学目标】:
1.通过对化学方程式多角度地理解,提高对各种化学量相互转化的运用能力;
2.通过对例题的分析、讲解,培养综合运用知识和综合计算能力;
3.通过对计算题格式、方法、思维过程的规范化要求、示范和训练,培养严谨、认真的科学态度。
【学习重点、难点】
物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算。
【教学过程】
【板书】四、物质的量在化学方程式计算中的应用
【思考】2CO + O2 == 2CO2这个反应方程式表示哪些意义?
1、每2个CO分子和1个O2反应生成2个CO2分子
2、每2摩CO分子和1摩O2反应生成2摩CO2分子
3、每28gCO和32个O2反应生成88CO2
4、在同一条件下,每2体积CO和1体积O2反应生成2体积CO2
【复习】1.构成物质的粒子有哪些?原子、分子、离子、质子、中子等。
2.物质的量与其它物理量之间的关系
【讲述】我们知道物质之间的发生化学反应是按一定微观粒子数目关系进行的。
化学方程式可以明确表示化学反应中这些粒子数之间的数目关系。
隔就是化学计算数的关系。
如:
化学计算数之比 2 : 1 : 2
扩大6.02×1023 2×6.02×1023 : 6.02×1023 : 2×6.02×1023
物质的量之比 2mol : 1mol : 2mol
气态物质体积比 2 : 1 : 2
总结:从以上例子的分析可知:
化学方程式中各物质的化学计量数之比,等于组成各物质的粒子数之比。
因而也等于各物质的物质的量之比,所以我们可以将物质的量应用于化学方程式进行计算。
而物质的量又与质量,摩尔体积、物质的量浓度存在一定关系,将这些量应用于化学方程式进行计算,对于定量的研究化学反应中各物质之间的量的关系,带来很大的方便。
【应用举例】
【例题1】完全中和0.10mol NaOH需要H2SO4的物质的量是多少?所需H2SO4的质量是多少?[解] 2NaOH + H2SO4===Na2SO4+2H2O
2 1
0.1mol n(H2SO4)
H2SO4的相对分子质量是98,H2SO4的摩尔质量是98g/mol,H2SO4的质量:
M= n·M =0.05mol×98g/mol=4.9g
答:完全中和0.10molNaOH需要0.05molH2SO4,所需H2SO4的质量为4.9g。
【总结】:物质的量应用于化学方程式计算的一般解题步骤
1.正确书写有关的化学方程式配平,确定题中未知量。
2.找出相关的物质的化学计量数之比。
3.对应化学计量数,写相关物质的物质的量。
4.根据相关化学反应列出比例式进行计算。
【练习】1.0.1mol某元素的单质直接跟氯气反应后,质量增加7.1g,这种元素的是()A. Mg B.Na C.Al D.Fe
答案:A
2.在反应X+2Y==R+2M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR则此反应中Y和M的质量之比是()
A.16:9 B.23:9 C.32:9 D.46:9
答案A。
【例题2】将30gMnO2的质量分数为76.6%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应)。
计算:
(1)参加反应的浓盐酸的体积;
(2)生成的Cl2的体积(标准状况)。
[分析]根据题目中所给的已知条件,可先计算出参加反应的MnO2的物质的量n (MnO2),然后根据化学反应中各物质之间的化学计量数之比,计算出参加反应的浓盐酸的体积V[HCl(aq)]和生成的Cl2的体积V(Cl2)。
[解] (1)MnO2的摩尔质量为87g/mol。
=0.26mol
4HCl(浓) + MnO2MnCl2+2H2O+Cl2↑
4 1
12mol/L×V[HCl(aq)] 0.26mol
(2)4HCl(浓)+MnO2MnCl2+2H2O+Cl2↑
1mol 22.4
0.26mol V(Cl2)
答:参加反应的浓盐酸的体积为0.087L,生成Cl2的体积在标准状况下为5.8L。
【总结】:
1、
2、物质的量应用于化学方程式计算注意的问题
(1)以方程式为基础进行计算时,注意代入方程式的量必须是纯量。
(2)一般已知物质的其它物理量一般都换算成物质的量。
(3)同一物质的某量单位要相同,不同物质的某量单位可以不同,即上下单位相同,左右单位相应。
课堂训练:
1.物质在发生化学反应时( )
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量之比等于化学方程式中化学计量数之比
D.它们物质的量之比等于化学方程式中化学计量数之比
2.等质量的两份铝分别与适量稀硫酸和NaOH溶液反应,若消耗两溶液的体积相等,则两溶液的物质的量浓度之比为( )
A.3∶2 B.2∶3 C.2∶1 D.1∶2
3.等量的铁分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
A.1∶1 B.3∶4 C.2∶3 D.4∶3
4.若1.8 g某金属跟足量盐酸反应,放出2.24 L H2(标准状况),则该金属是( ) A.Al B.Mg C.Fe D.Zn
5. 23克钠与水反应后得到1 000 mL溶液,求该溶液中溶质的物质的量浓度和反应后生成氢气的体积(标准状况下)。
