《国内外药用辅料标准对比软件》用户手册_CN
《M4:人用药物注册申请通用技术文档(CTD)》模块一及CTD中文版

《M4:人用药物注册申请通用技术文档(CTD)》模块一及CTD中文版M4 模块一行政文件和药品信息1.0说明函(详见附:说明函)主要对于本次申请关键信息的概括与说明。
1.1目录按照不同模块分别提交申报资料目录。
1.2申请表主要包括产品名称、剂型、规格及申请事项等产品基本信息。
1.3产品信息相关材料1.3.1说明书1.3.1.1 研究药物说明书及修订说明(适用于临床试验申请)1.3.1.2 上市药品说明书及修订说明(适用于上市及上市后变更申请)境外已上市药品尚需提供该药品生产国家或者地区药品管理机构核准的原文说明书,在生产国家或者地区上市使用的说明书实样,并附中文译本。
1.3.2包装标签1.3.2.1研究药物包装标签(适用于临床试验申请)1.3.2.2 上市药品包装标签(适用于上市及上市后变更申请)境外已上市药品尚需提供该药品生产国家或者地区上市使用的包装标签实样。
1.3.3产品质量标准和生产工艺/制造和检定规程新化学实体提交生产工艺信息表和质量标准,生物制品参照现行版《中国药典》格式和容,并结合实际生产和检定要求,拟定制造和检定规程,一般分为基本要求、制造部分、检定部分、保存及运输和有效期等。
1.3.4临床试验相关资料(适用于临床试验申请)1.3.4.1临床试验计划和方案1.3.4.2知情同意书样稿1.3.4.3研究者手册1.3.5产品相关证明性文件1.3.5.1药品通用名称的命名证明文件(如适用)1.3.5.2专利信息及证明文件申请的药物或者使用的处方、工艺、用途等专利情况及其权属状态说明,以及对他人的专利不构成侵权的声明。
1.3.5.3特殊药品研制立项批准文件(如适用)麻醉药品和精神药品需提供研制立项批复文件复印件。
1.3.5.4商标信息及证明文件(如适用)1.3.5.5参比制剂/对照药合法来源文件(如适用)1.3.5.6药物临床试验相关证明文件(适用于上市申请)《药物临床试验批件》/临床试验通知书、临床试验用药质量标准及临床试验登记号/生物等效性试验备案登记号。
三硅酸镁质量标准的研究与探讨

基金项目:国家药典委员会药品标准制修订研究课题:2019Y025 第一作者简介:张凤兰,工程师;研究方向:药用辅料分析及药包材相容性研究。
Tel:18001678857;E mail:landy0108@126 com编者按:本文所述修订内容已体现在《中国药典》2020年版四部中。
三硅酸镁质量标准的研究与探讨张凤兰,赵画,郑烨(上海市食品药品包装材料测试所,上海201200)摘要 目的:修订《中国药典》2015年版四部中三硅酸镁的质量标准。
方法:按照《中国药典》2015年版的相关规定,参考现行标准及研究文献,考察本品的鉴别、重金属及砷盐。
结果:修订了鉴别(1)、重金属及砷盐方法。
结论:改进后的标准更易于观察到鉴别现象,提高了重金属项的可操作性和安全性,也避免了砷盐项中砷斑显色出现假阴性的结果。
实验结果准确、可靠,为新版《中国药典》三硅酸镁质量标准修订提供了参考。
关键词:三硅酸镁;中国药典;鉴别;砷盐;重金属中图分类号:R921 2 文献标识码:A 文章编号:1009-3656(2020)-4-0321-5doi:10 19778/j chp 2020 04 007lnvestigationanddiscussiononidentificationofmagnesiumtrisilicateZHANGFenglan,ZHAOHua,ZHENGYe(ShanghaiFoodandDrugPackagingMaterialControlCenter,Shanghai201200,China)Abstract Objective:TorevisethespecificationofmagnesiumtrisilicateintheChinesePharmacopoeia2015VolⅣ Methods:Theidentification,heavymetalandarsenicsaltofmagnesiumtrisilicatewerestudiedaccordingtotherelevantrequirementsintheChinesePharmacopoeia2015andreferringtothecurrentstandardandresearchlit erature Results:Thetestmethodsofidentification(1),heavymetalandarsenicsaltwererevised Conclusion:Therevisedmethodsmaketheobservationofidentificationphenomenoneasier,improvestheoperabilityandsafetyofheavymetalitems,andavoidsthefalsenegativeresultsofarsenicspotsinarsenicsaltitems Theexperimentalresultsareaccurateandreliable,whichprovideareferencefortherevisionofthespecificationofmagnesiumtrisili cateintheneweditionoftheChinesePharmacopoeia.Keywords:magnesiumtrisilicate;ChinesePharmacopoeia;identification;arsenicsalt;heavymetal 三硅酸镁在医药上作为抗酸剂应用,能中和胃酸和保护溃疡面,作用缓慢而持久,用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸。
程宁-药用辅料质量保证和法规控制

供应链的控制
辅料供应链谱
• 你知道你使用的成分是在 哪里生产的吗? • 你知道这些产品是怎样经 销的的? • 有什么证据证明这些?
30
IPEC草案提议
辅料供应链谱
• 对供应链谱上的生产商和经销商进行周期性的 审计以证实文件中记录的信息; • 可以由使用者的审计员或有资格的第三方审计 服务方进行审计; • 使用者应收到原始的生产商和经销商的货运文 件(运单上可删去价格信息),并对每一批货 物进行核; • 必须证明原料是从预期的经销途径获得
辅料日益引起更多关注
最近中国来源的食品和药品成分引发的事件:
• Glycerin – contaminated with DEG 甘油-污染了二甘醇(DEG) • Pet Food – Wheat Gluten contaminated with Melamine 宠物食品-麦麸污染了三聚氰胺 • Tooth Paste – contaminated with DEG 牙膏-污染了DEG • Heparin – contaminated with similar but different material – still being investigated! 肝素钠-混入了类似但不同的原料-仍然在调查中!
辅料发展的新模式
• 在药品处方中最为重要的是使用来自高品质供应商 的辅料,这些供应商的生产环境必须已符合适当的 GMP要求,并且有良好的变更通知体系; • 对所有可选的供应商必须进行完整的验证,通过以 性能为基础的检测以显示在药品中的性能和稳定性 具有同等性。 • 仅根据产品标准和价格来选择辅料将不再被接受! 必须考虑所有使用的辅料是否在适当的GMP条件下 生产!
产品连贯性和一致性 或可变性? 辅料的可变性和偏差 可引起很多问题
药神软件操作规程
首营企业1、目的保证首次发生供货关系的医疗器械生产企业和经营企业的合法资质,保证购进医疗器械产品质量,把好医疗器械购进质量关。
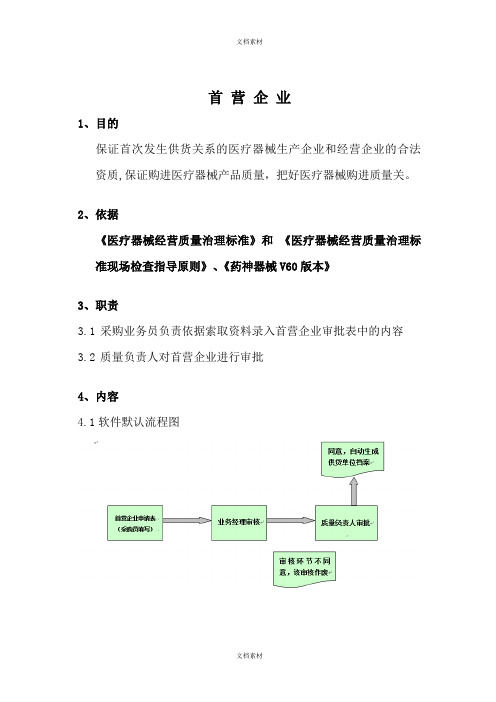
2、依据《医疗器械经营质量治理标准》和《医疗器械经营质量治理标准现场检查指导原则》、《药神器械V60版本》3、职责3.1 采购业务员负责依据索取资料录入首营企业审批表中的内容3.2 质量负责人对首营企业进行审批4、内容4.1软件默认流程图4.2软件操作流程4.3操作详解4.3.1采购员双击药神图标,填写登陆用户名和密码,登陆药神,双击进入【采购治理】主菜单下的【首营企业】操作窗口,双击【首营企业审批表】,依据索取资料录入内容〔如图〕序号功能名称使用状态部门岗位 使用人员功能位置备注1 首营企业申请 启用业务部 业务员 采购治理—首营企业—首营企业申请 5 2质管部审批启用质管部质量负责人采购治理—首营企业—首营企业质管部审批3最后填写相关的申请理由将申请表上报到业务经理。
4.3.2质量负责人双击药神图标,填写登陆用户名和密码,登陆药神,双击进入【采购治理】主菜单下的【首营企业】操作窗口,双击【首营企业质管部审批】,点击【刷新】,对比相关资质进行审核,并填写审核意见,如同意,点击【确定】,系统自动记录签名和审核通过时间,如不同意,点击【作废】。
4.4.1以上审批过程严格执行,跨越任何一步都无法看到数据,任何一个审批环节发觉的错误都需要驳回到上一步修改或者直接作废处理,首营审批完后,相应资料进入公司质量治理根底数据库,生成供货单位档案治理,根底数据包含了供货单位相关经营资质效期、供货业务员相关资质、供货单位经营范围等相关内容,可以完成计算机系统对应的供货及采购医疗器械的合法性、有效性相关联,同时与供货单位的经营范围相对应,由计算机系统进行自动跟踪、识别与操纵4.4.2质量负责人审批合格后,资质交于质量治理员,质量治理员可以打印《首营企业审批表》附于资料原件,建立《合格供货商档案》4.5供货单位维护程序4.5.1业务部依据计算机系统预警,对马上到期或已经到期的证照资质,由采购业务员负责及时索要和搜集,交质量治理员进行根底数据维护和更新维护操作规程:操作〔系统治理—根底档案治理—供货单位档案治理〕跟新记录界面:操作〔系统治理—根底档案查询—查询根底档案更新记录〕首营品种1、目的保证本企业首次采购品种的合法性2、依据《医疗器械经营质量治理标准》和《医疗器械经营质量治理标准现场检查指导原则》、《药神器械V60版本》3、职责3.1 采购员负责依据索取资料录入首营品种审批表中的内容3.2 质量负责人对比相关内容进行审批并填写审核意见4、内容4.1软件默认流程图4.2软件操作流程4.3 操作详解4.3.1采购员双击药神图标,填写登陆用户名和密码,登陆药神,双击进入【采购治理】主菜单下的【首营品种】操作窗口,双击【首营品种审批表】,依据索取资料录入内容〔如图〕最后填写相关的申请理由将申请表上报到业务经理。
IPEC全文译稿中英文对照

FOREWORD 前言The quality of excipients is critical to assure the safety, quality and efficacy of medicines. Excipients have a wide range of applications and are essential components of the drug product formulation. Characteristics that excipients impart to formulated drug products include cosmetic appearance, stability and delivery of the active ingredient. Therefore, applying appropriate Good Manufacturing Practice (GMP) principles to excipients is essential. 辅料的质量对保证药品的安全、质量和功效是至关重要的。
辅料的应用范围广泛,是药品生产配方的基本成分。
辅料的特性直接影响药品的配方,包括化妆品的外观、稳定性和活性成分的输送。
因此,应用适当的GMP 规则是辅料的基础。
In contrast to finished dosage forms and Active Pharmaceutical Ingredients (APIs), there are no specific GMP regulations for excipients. In addition, there are a large number of applications of this diverse range of materials which makes the development of excipient GMP guidelines challenging. However, there is a general expectation that excipients are manufactured to recognised GMP principles.与制剂和原料药相比,没有明确的针对辅料的GMP的规则。
药用辅料手册现行版本

药用辅料手册现行版本
《药用辅料手册》现行版本是化学工业出版社于2005年1月出版的,作者是(美)舍斯基、(英)韦勒、郑俊民。
该手册汇集了包括辅料物理性质的基本数据,如沸点、松密度和轻敲密度、压缩性、潮解性、流动性、熔点、含水量、粒度分布、流变性、比表面积和溶解度,此外很多辅料还附有扫描电镜照片。
此外,手册还附有索引,可用化学名、通用名和商品名互相查询,大多数品目的正文内都有同类物质一项,有助于制剂研发人员进行新剂型的开发。
编排有序,每一品目分为22项,读者容易查阅,并且将同类物质一
起讨论,条理清楚。
另外,还有《各国药用辅料标准对比手册1~3册》国家药典委员会编著,
中国医药科技出版社出版,其内容也相当丰富。
如需了解更多版本信息,建议查阅各大购书平台网站。
一次性进口原料药申请资料目录(精选五篇)

一次性进口原料药申请资料目录(精选五篇)第一篇:一次性进口原料药申请资料目录申请资料目录1、《进口药品批件》申请表2、申请报告3、样品使用说明4、免检申请报告5、授权委托书及受委托人身份证复印件6、生产企业GMP证书复印件及翻译件7、生产企业自由销售声明复印件及翻译件8、生产企业产品分析报告单复印件及翻译件9、申请人《企业法人营业执照》复印件10、申请人《中华人民共和国组织机构代码证》复印件11、申请人《税务登记证》复印件第二篇:原料药进口注册流程相关问题原料药进口注册流程相关问题进口化学药品注册证书核发,其分类按《药品注册管理办法》附件二注册分类,即:注册分类1、未在国内外上市销售的药品:注册分类3、已在国外上市销售但尚未在国内上市销售的药品:2进口原料药一般注册程序原料药进口注册,按照是否已有同类物质在中国上市销售,分为两种不同注册程序。
1.若拟进口原料药已有同类物质上市销售,则可按仿制要程序审批,较为快捷;2.若拟进口原料药位首次在中国上市销售,则必须按照新药程序审批,并使用该原料药制成的制剂进行临床试验(即必须与制剂捆绑注册),周期长,投资大。
API:进口原料药IDL:进口药品注册证CTP:药物临床试验批件一般程序第一步第二步准备注册SFDA获得IDL是申报资料受理和审评至少3个月9个月是否有同类API产品在中国上市否第一步第二步第三步第四步获得准备注册SFDA进行SFDA获得IDLCTP新药程序申报资料受理和审评临床试验受理和审评至少3个月9个月约1年9个月原料药进口注册流程药品注册法(局令28号)/WS01/CL0053/24529.html 申报制剂用的进口原料必须经过国家批准的一次性进口获得一次性进口批件,开展制剂研究(从所在省局开始,省局同意后,再拿着省局同意的证明去国家局申报一次性批件速度很快的,国家费用在2000同时申报进口原料的IDL在获得临床批件或者生产批件前,取得进口原料的IDL生产临床用样品的进口原料.1.一次性进口原料药的程序及需准备哪些申报资料?有申报资料模板最好。
2015年版_中国药典_提升药用辅料科学标准体系强化我国药品质量_孙会敏

表 1 2015 年版《中国药典》收录的注射用辅料品种
序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23
名称 氯化钠 甘油 PLGA( 50 /50) PLGA( 75 /25) PLGA( 85 /15) PEG300 PEG400 聚山梨酯 80 大豆磷脂 蛋黄卵磷脂 活性炭 丙二醇 氨丁三醇 大豆油 泊洛沙姆 188 磷酸氢二钾 磷酸氢二钾三水合物 聚氧乙烯( 35) 蓖麻油 海藻糖 苯甲醇 油酸钠 枸橼酸钠 木糖醇
2015 年版《中国药典》在辅料覆盖了更多的药用辅料类 别: 2010 年版《中国药典》共覆盖了 31 个药用辅料的类别, 2015 年版《中国药典》共覆盖了 66 个药用辅料的类别,比 2010 年版《中国药典》增加了一倍。药用辅料在不同的制剂 中有着不同的功能性,而过去由于药典覆盖的药用辅料类别 较少,许多药品生产企业在处方设计时找不到可用的辅料, 2015 年版《中国药典》考虑到了药品生产企业的需求,增加 了药用辅料的类别,让药品生产企业有可用的合法来源的药 用辅料。
年版《中国药典》扩大了药用辅料定义的内涵,其中对药用辅 料的定义是: “药用辅料系指生产药品和调配处方时使用的 赋形剂和附加剂,包括那些具有控制药物释放、传递功能的 物质和可能在制剂工艺过程中加入但标明要求去除的物质; 是除活性成分或前体以外,在安全性方面已进行了合理的评 估,并且包含在 药 物 制 剂 中 的 物 质。在 一 定 的 情 况 下,某 些 药用辅料可以成为活性成分,此时应符合药物要求。在作为 非活性物质 时,药 用 辅 料 除 了 赋 形、充 当 载 体、提 高 稳 定 性 外,还具有增溶、助溶、缓控释等重要功能,是可能会影响到 制剂的质量、安全性和有效性的重要成分。”以前人们总认为 药用辅料一定会存在于最终的产品中的,新版药典颠覆了这 一概念,即药用辅料不一定都是最终产品中的物质,例如活 性炭是在生产注射剂的生产工艺中吸附热原和除去杂质的 吸附剂,活性炭并不存在于最终的注射剂中,而是在生产工 艺中过滤除去的,2015 年版《中国药典》收载了活性碳( 供注 射用) 药用辅料标准; ②2015 年版《中国药典》更加强调了药 用辅料的功能性,过去人们认为药用辅料是药品中可有可无 的辅助成分,2015 年版《中国药典》药用辅料定义中更加强 调了药用辅料功能性并列举其在增溶、助溶、缓控释等方面 的重要功能; ③过去人们总认为药用辅料是惰性的物质, 2015 年版《中国药典》则指出在一定的情况下,某些药用辅 料也具有一定的活性,药辅同源现象比比皆是,药用辅料许 多品种本身就出现在中国药典化学药品的目录里,比如卵磷 脂、二甲硅油、活性炭、明胶本身都是具有一定活性的药品, 因此新版药典对药用辅料的定义更加科学。
《中国药典》2020年版第一增补本药用辅料标准解读

《中国药典》2020年版第一增补本药用辅料标准解读
陈蕾;陈英;刘雁鸣;袁耀佐;戴红;涂家生
【期刊名称】《中国药品标准》
【年(卷),期】2024(25)2
【摘要】《中国药典》2020年版第一增补本自2024年3月12日起施行,它起着重要的承上启下的作用,其中药用辅料标准新增11个、修订46个。
本次制修订药用辅料标准是基于风险管理理念和全过程管理理念,围绕保障药品临床安全性和有效性,在制定标准过程中突出对药用辅料关键质量属性的评估,增加了功能性相关指标、安全性指标,突出了标准国际协调和绿色环保标准理念,加强了标准规范性和可操作性。
本文着重介绍了《中国药典》2020年版第一增补本中药用辅料新增和修订标准的总体思路和主要特点。
以期对《中国药典》的使用者正确理解、执行或运用药典标准有所帮助。
【总页数】8页(P168-175)
【作者】陈蕾;陈英;刘雁鸣;袁耀佐;戴红;涂家生
【作者单位】国家药典委员会;广东省药品检验所;湖南省药品检验研究院;江苏省食品药品监督检验研究院;北京市药品检验研究院;中国药科大学
【正文语种】中文
【中图分类】R921.2
【相关文献】
1.《中国药典》2020年版第四部药用辅料和药包材标准体系概述
2.我委在京举办第一期《中国药典》2015年版药用辅料检测技术培训班
3.中国药典2020年版药用辅料二丁基羟基甲苯质量标准有关物质检查修订建议
4.2020年版《中国药典》药用辅料标准体系及主要特点概述
5.2015年版《中国药典》提升药用辅料科学标准体系强化我国药品质量
因版权原因,仅展示原文概要,查看原文内容请购买。
各国药用辅料收载品种索引

各国药用辅料标准对比手册
(数字版)
V1.0
用户手册
9附录
9.1各国药用辅料标准收载品种索引
38
2010 2015 38 8.5 16
2010 2015
2010 2015 38 8.5 16
38
2015 38 8.5 16
38
38 8.5
2015 38 8.5
38 8.5
2010 2015 38 8.5
38
2010 2015 38 8.5
2010 2015
38
38
2015 38
38
2015 38
2010 2015 38 8.5
2010 2015
1.本书在编译时维持了各国药典药用辅料标准的体例和单位书写方式。
2.部分品种在2010 年版药典二部作为原料药品种收载,2015 年版药典
四部增订了相应药用辅料品种。
3.收录的《中国药典》2010 年版药用辅料标准所采用检定方法的“附
录”系指原《中国药典》2010 年版二部收载附录。
9.2售后及技术支持
国家药典委员会
根据《中华人民共和国药品管理法》规定,国家药典委员会负责组织编纂
《中华人民共和国药典》及制定、修订国家药品标准,是法定的国家药品
标准工作专业管理机构。
科迈恩(北京)科技有限公司
作为复杂体系先进质量控制解决方案的提出者,科迈恩科技致力于为药
品、医疗、食品、仪器分析等领域提供专业级大数据解决方案。
《国内外药用辅料标准对比软件》用户手册-软件操作指南

各国药用辅料标准对比手册(数字版)V1.0用户手册8软件操作指南8.1各国药用辅料标准对比系统8.1.1药品标准对比分析界面图6 各国药典药用辅料标准对比系统界面《各国药用辅料标准对比手册》(数字版)软件是专为国家药品标准所开发的专业综合数据服务平台,其由数字药品标准阅读系统、药品标准对比系统、药品标准查询系统,以及国家药品标准结构化数据库系统等4部分组成。
软件的整体图形用户界面设计美观大方、功能丰富、操作简便,支持面向海内外的广大药品行业用户的数字药品标准阅读、智能对比、查询等丰富功能。
药品标准正文浏览窗口依托自主知识产权的国家药品标准数字引擎,实现了对国家药品标准的浏览、中英文对比、多国药典收载品种智能对比、检索、本地化语言,以及各类图谱数据显示等综合阅读功能。
在与药典印刷版保持内容与排版高度统一、美观大方的基础上,药品标准数字引擎为用户提供更好的交互式阅读体验,并为专业用户全面、深入地掌握及使用国家药品标准提供技术支撑平台。
以下对该数字化药品标准阅读系统的使用方法进行详细说明。
8.1.2药品标准的智能对比图7 药品标准的智能对比示例在药用辅料智能对比模式下,不同国家药用辅料标准将按照检测项目的相似程度实现自动智能合并及对比,克服了各个国家药典在体例结构及检测项目设置上的显著差异。
从而实现不同国家药用辅料标准的规范化信息加工和国际协调,从而更好地对同一品种在各国药典所收载标准的质量控制水平的整体评价及收载项目的横向比较。
图8 对比方式工具栏操作方法:首先按下“药品标准”工具栏中的“智能对比”按钮,接下来从品种索引列表或检索窗格选择待查询的具体品种,该品种的内容即以智能对比的方式予以呈现。
一些检测项目(如成分的含量测定)在不同国家药典中可能以单个或多个项目的方式进行规定,平台将会自动将检测目标及依据相同的“同类”检测项目进行归纳显示。
8.1.3药品标准的摘要对比图9药品标准的摘要对比示例在药用辅料摘要对比模式下,不同国家药用辅料标准的检测项目所规定的定量、定性检测限度信息将被提取和自动对比。
个人收集的电子版药学资料共享目录(5G多)

个人收集的电子版药学资料共享目录(约5G),有需要的联系我:350177988GMP整套软件[颗粒剂、片剂、丸剂、胶囊剂].rar生理学第7版.pdf药品注册现场核查管理和要求培训班讲义国家食品药品监督管理局培训中心.rar化学实验操作经验集锦刘宗明主编.rar药理学第7版全套课件人民卫生出版社.rar《药品经营质量管理规范》理解与实施.rar第四期药物临床试验监查员实用技能培训班.doc现代中药提取与纯化技术大全.rar天然产物化学徐任生主编(第二版).PDF药理学七年制教材人民卫生出版社(口令).pdf实用中草药彩色图集第一册.pdf实用中草药彩色图集第二册.pdf中国药典2005年版三部.pdf诊断学第7版.pdf外科学第7版.pdf内科学第7版.pdf现代医院临床药学速查实用手册.pdf瓦里安质谱仪中文操作流程.pdf制药设备与工艺设计-李晓辉.pdf微生物学(供生物制药、微生物制药专业用)-钱海伦.pdf临床诊断学.pdf生化制药学.pdf药典2005版一部.rar常见猪病讲义.ppt中国药品商品名手册.pdf药品注册指南.pdf中药新制剂开发与应用第二版.pdf药物合成反应:第二版By jessen.pdf药物相互作用与临床医生安全用药实用手册.pdf食品添加剂使用手册-孙平.pdf药用辅料应用技术(第二版).pdf诊断学(第5版).zip第三届国际药物制剂会议沈阳药科大学潘卫三教授报告.ppt药品注册工作手册.pdf药品GMP实施标准与GMP验证认证检查项目及企业自检案例实务手册.rar药品生产验证指南2003年版(完整版).pdf中华兽药大典.pdf现代制药技术.pdf临床药学演示文稿.rar当代新药合成.pdf中国医药企业与知名产品精选(原料药、中间体).pdf药物传递系统的新进展沈阳药科大学崔福德.rar鼻黏膜给药系统国内外研究进展沈阳药科大学毛世瑞.rar长效生物可降解微球的研究进展沈阳药科大学毛世瑞.rar粉体学基础及其在药物制剂中的应用沈阳药科大学崔福德.rar经皮药物传递系统的现状与发展展望沈阳药科大学方亮.rar口服缓控释制剂沈阳药科大学唐星.rar中华人民共和国药典-临床用药须知-中药卷2005版.pdf新药设计与开发徐文方主编.pdf高等制药分离工程中国药科大学王志祥.rar无菌检查和微生物限度检查操作规范光盘下集.rm无菌检查和微生物限度检查操作规范光盘上集.rm2008年度上海市药品经营(批发、零售)企业质量管理负责人上岗考试辅导班系列教材.rar中药制剂制备工艺与质量分析检验新技术实用手册.pdfGMP培训资料全集(30个资料).rar制药工艺学.pdf无菌检验及控制王旭.pdf微生物限度检验及控制王旭.pdf实验室文件的编写张华.pdf实验室管理刘伟强.pdf分析方法验证.pdf标准品、对照品管理刘伟强.pdf中药饮片鉴别技能.pdf中医药创新与国际化进展赖小平.ppt中药药效研究技术规范若干问题的探讨孙建宁.ppt中药新药临床试验中几个问题的探讨赖世隆.pdf中药现代化、国际化的必由之路姚新生等.pdf无菌检查和微生物限度检查操作规范光盘下集.rm无菌检查和微生物限度检查操作规范光盘上集.rm2008年度上海市药品经营(批发、零售)企业质量管理负责人上岗考试辅导班系列教材.rar中药制剂制备工艺与质量分析检验新技术实用手册.pdfGMP培训资料全集(30个资料).rar制药工艺学.pdf无菌检验及控制王旭.pdf微生物限度检验及控制王旭.pdf实验室文件的编写张华.pdf实验室管理刘伟强.pdf分析方法验证.pdf标准品、对照品管理刘伟强.pdf中药饮片鉴别技能.pdf中医药创新与国际化进展赖小平.ppt中药药效研究技术规范若干问题的探讨孙建宁.ppt中药新药临床试验中几个问题的探讨赖世隆.pdf中药现代化、国际化的必由之路姚新生等.pdf中药创新药物的发现与研发屠鹏飞.ppt中药、天然药物缓控释制剂研发的几点问题讨论高祟凯.ppt中国热带药用植物资源特色与研究开发刘明生.ppt中药、天然药物注册技术要求及常见问题分析(药学部分)田恒康.ppt我国民族药开发研究现状与展望张艺.ppt中华人民共和国药典-临床用药须知-化学药与生物制品卷.pdf中华中医药学会第四届中药炮制学术会议论文集.pdf含目录中草药现代研究(仪器分析卷).pdf色谱液相检测方法.pdf国家药品标准实施手册.rar中国药材学.pdfSFDA药包材标准汇编(第6辑).rarSFDA药包材标准汇编(第5辑).rarSFDA药包材标准汇编(第4辑).rarSFDA药包材标准汇编(第3辑).rarSFDA药包材标准汇编(第2辑).rarSFDA药包材标准汇编(第1辑).rar临床用药须知天津电子出版社.pdf兽药GMP培训指南.rar中华人民共和国强制检定的工作计量器具明细目录.pdf药物分析的基础知识第一章.rarSFDA实验室管理与验证培训班课件-20080630.rar新药开发中药物分析一般程序.pdf制药工艺用水的设计、验证、运行和维护.ppt美国兽医管理体制的分析与研究赵维宁.PDF色谱柱技术.pdf高效液相色谱技术.rar液相色谱柱的使用与维护.pdf江苏省中药材标准.pdf道地药和地方标准药原色图谱.pdf中华人民共和国兽药典2005版三部.pdf三部密码0123456789鼻黏膜给药系统国内外研究进展沈阳药科大学毛世瑞.rar药物传递系统的新进展沈阳药科大学崔福德.rar中国医药企业与知名产品精选(原料药、中间体).pdf当代新药合成.pdf临床药学演示文稿.rar现代制药技术.pdf中华兽药大典.pdf药品生产验证指南2003年版(完整版).pdf药品GMP实施标准与GMP验证认证检查项目及企业自检案例实务手册.rar药品注册工作手册.pdf第三届国际药物制剂会议沈阳药科大学潘卫三教授报告.ppt诊断学(第5版).zip药用辅料应用技术(第二版).pdf食品添加剂使用手册-孙平.pdf药物相互作用与临床医生安全用药实用手册.pdf药物合成反应:第二版By jessen.pdf中药新制剂开发与应用第二版.pdf药品注册指南.pdf中国药品商品名手册.pdf常见猪病讲义.ppt药典2005版一部.rar生化制药学.pdf临床诊断学.pdf微生物学(供生物制药、微生物制药专业用)-钱海伦.pdf制药设备与工艺设计-李晓辉.pdf瓦里安质谱仪中文操作流程.pdf现代医院临床药学速查实用手册.pdf欧洲gmp正文(中文稿).rar药品生产中计算机处理系统的验证指南.pdf化学药物综述资料撰写内容与格式详解.rar中药材鉴别十个演示文稿.rar药品生产验证指南.pdf现代医药工业微生物实验室质量管理与验证技术.pdf天然有机化合物提取分离与结构鉴定.pdf体内药物分析.pdf药品检验指南.pdf药物制剂工程.pdf2006最新药品质量检验检测技术标准规范实施手册.pdf药剂辅料大全-罗明生高天惠.pdf药用辅料生产质量管理规范.pdf六种辅料质量标准.doc口服缓释制剂中辅料应用.doc口服固体制剂药用辅料的应用技术.doc具有附加功能的辅料成功解决配方难题.doc药用辅料应用技术.pdf药用辅料手册(第4版).pdf保健食品检验与评价技术规范(2003版).rar中国制药装备大全.pdf中药材gap 全书.pdf中药注射剂质量标准研究.ppt注射剂生产质量关键控制点.ppt中药注射剂学.pdf现代药剂学.pdf实用注射剂配伍变化300例.pdf禽病防治技术手册.pdf化验员必读.pdf药剂专利手册(顾学裘).pdf药品包装、标签和说明书备案常见问题.ppt畜禽常用药物手册.pdf微生物及无菌知识培训.doc天然产物有效成分的分离与应用.pdf生产部操作规程与清洁规程.doc浅谈rp-hplc方法的建立.ppt气相色谱仪使用气体的纯度和选择原则.txt灭菌制剂工艺.ppt美国fda分析方法验证指南中英文对照.doc美国gmp.pdf进出口食品中农兽药残留检测新标准技术实用手册.pdf监控注射用水系统三大环节.doc化学药品、生物制品相关研究的指导原则.rar化学实验室常用分析测试操作技术标准应用手册.pdf药用辅料质量管理规范与现代辅料新技术应用全书.pdf化验室常用仪器设备指南.pdf高效液相色谱法邹汉法张玉奎卢佩章.pdf冻干制品的生产以及质量保证技术.ppt动物药物提取制备实用技术.pdf不合理用药分析.pdf标准物标定技术研讨会纪要-容量法标定、高效液相法标定、薄层色谱法标定技术要求.pdfsfda药品监查员培训资料.rarhplc-维护手册.docgmp企业工艺用水专题.rar2005年(版)中国药品检验标准操作规范与药品检验仪器操作规程.pdf 306种注射剂临床配伍应用检索手册.pdf《冷冻干燥技术》推荐教材与补充讲义.pdfusp29-凡例中文译稿.rar中药有效成分提取分离技术-200501-卢艳花主.pdfph计检定规程.pdf中药鉴定学复习提纲.rar最新药物制剂技术及应用.pdf中药制剂分析-刘斌(2005[1].02).pdf中药药剂学-田景振主编(2005[1].02).pdf中药药剂学.exe中药新药临床前药效及毒理研究.pdf最新国家兽药药品标准手册.pdf传染病学(第五版) 口令.pdf世界药品报告2007 world drugs report 2007.pdf实用溶剂手册.pdfusp30-nf25.rar兽药gmp企业日常监管要点.ppt化验员实用手册第六部.pdf化验员实用手册第五部.pdf化验员实用手册第四部.pdf化验员实用手册第三部.pdf化验员实用手册第二部.pdf化验员实用手册第一部.pdf有机药物合成手册.pdf药品生产质量管理规范实施指南2001.rar药用气雾剂.pdf脂质体制备及其在生物医学中的应用.pdf。
ICH-GCP E6(R2)中文版

E6(R2)人用药品注册技术要求国际协调会ICH协调指导原则ICH指导委员会2016年11月9日当前版本:第四阶段中文编译:中国GCP联盟 & 临床研究大汇E6(R1)译者序公元1996年,ICH-GCP正式发布R1版,彼时之中国,了解GCP的人仅限于当时中国卫生部培养的数百名医学专家,规范的临床试验法规与体系还在起草中。
1998年3月卫生部而发布了中国第一部GCP(试行),同年5月实施;1998年国务院机构改革成立了国家药品监督管理局,1999年9月1日实施的《药品临床试验管理规范》(局令13号,已废止),在整整4年之后的2003年9月1日,我国的GCP,《药物临床试验质量管理规范》(局令第3号)颁布实施并持续至今。
受制于起步阶段的能力所限,我们的GCP法规只有70条款共计12998字,而对比ICH-GCP则有383条款共计27936单词。
R1版的ICH-GCP,2003年国家药监局中国药品生物制品检定所获权组织专家翻译,才有过中文版(未曾公开发布),陆续有过多个版本的企业/组织发布版本,而以国家药品审评中心(CDE)发布的官译稿件,时间却很明确,是在2016年8月5日才得以发布(如下图)。
可以说,无论是标准的水平高低还是时代的步伐快慢,我们都曾落后了太多太多。
人生如梦,岁月如歌,春去秋来,夏行冬至。
二十载岁月匆匆而过。
2016年11月30日,ICH正式颁布了GCP的增补件R2,标志着全球药物临床试验进入到了一个崭新的时代,无独有偶,仅仅过去了2天,2016年12月2日,中国国家食品药品监督管理总局发布了《药物临床试验质量管理规范》的第二次征求意见稿,大量新内容参考了ICH-GCP R1甚至R2,意见稿直接以超30000字的信息量向全中国全世界展现它的雄心:今天的和未来的中国药物临床试验,在经历了蹒跚学步与青春期的躁动之后,正大幅度的向着国际先进水平看齐。
天行健,君子当自强不息,“中关村玖泰药物临床试验技术创新联盟/中国药物临床试验机构联盟”携手“临床研究大汇”,有志于协助我国临床研究行业在这次革新中及时跟上时代潮流,我们在R2发布后的7日内,参考借鉴CDE的R1中文版,完成了中文版的翻译与校对工作,在此时正式向全球华语用户推送,由于时间紧,我们的工作可能有不足之处,在此虚心并诚恳的接受所有批评意见。
Section-1A-中美两国药典药品分析方法和方法验证

中国药典与美国药典概论 continued
Monographs Classification in USP-NF
Total Monographs: About 4,500
Monographs for APIs: 1402 Monographs for Finished Dosage Forms: 2454 in USP, 446 Excipients in NF Monographs for Biologicals: 153 General Chapters: About 300 Supplementary Texts: General Notices, Reagents, Indicators, and Solutions, Description and Solubility
源自The United States Pharmacopeia and the National Formulary (USP–NF) Food Chemicals Codex USP Dietary Supplements Compendium USP Medicines Compendium (MC) Reference Standards Other Resources – Pharmacopeial Forum – FCC Forum – USP Dictionary – Chromatographic Columns
两卷副刊内容编排第一卷副刊发表在二月八月一日生效第二卷副刊发表在六月十二月一日生效15中国药典与美国药典概论中国药典与美国药典概论continueduspnfactivitiesrevisionstouspnfuspnfstandardrevisionsacceleratedrevisionserratainterimrevisionannouncementsirasrevisionbulletinspharmacopeialforumpf?????uspnf相关行为uspnfuspnf修订标准修订加快修订勘误表暂行修定公告iras修订通报药典论坛pf相关行为?????1617figure1
2015版药典药用辅料公示稿反馈意见汇总

项目名称聚氧乙烯(35)蓖麻油(供注射用)反馈意见的回复聚山梨酯80(供注射用)药用辅料通则醋酸、DL-酒石酸、氯化钠(供注射用)、聚乙二醇(供注射用)、聚山梨酯80(供注射用)麦芽糊精氯化钠(供注射用)丙二醇(供注射用)二氧化碳DL-苹果酸海藻糖(注射用)质量标准修改建议氧化钙附录 XIX R 药用辅料性能指标研究指导原则反馈意见1、关于性状:公示稿中性状描述为“本品为白色或类白色糊状物或粘稠液体”,而巴斯夫公司Kolliphor EL的进口注册标准(标准号:JX20060034)中性状描述为“本品在26℃以上为淡黄色油状液体” 。
从我司多年使用情况来看,该品种在26℃以上时性状为淡黄色油状液体,在低温时为类白色或淡黄色糊状物,在贮存过程中颜色会慢慢变深一点,但在有效期内各项指标符合注册标准要求。
2、关于粘度:目前我们企业已按进口注册标准配备了相应的检测仪器,按现行标准检测操作简易,省时,且结果准确。
因此,我们建议仍按进口注册标准方法检测。
3、关于无菌:Kolliphor EL(蓖麻油聚烃氧酯35)进口注册标准对微生物限度进行了控制。
我公司紫杉醇注射液为无菌过滤工艺,最终的成品可保证无菌。
因此,我们认为按进口注册标准控制Kolliphor EL(蓖麻油聚烃氧酯35)的质量可满足生产工艺要求。
如按无菌要求控制,则会增加企业的生产和检验成本。
4.我司建议在“聚氧乙烯(35)蓖麻油”品名下增设“供注射用”的参考标准,由辅料供应商和注射剂生产企业建立内控标准并参考执行。
待辅料供应1.建议药典委员会能考虑到目前全国聚山梨酯80(供注射用)市场的不成熟,参照现行版欧洲药典标准限度合理提升供注射用吐温80的质量标准(如油酸含量限度定为应65.0%),为药品生产及物料供应市场的完善提供缓冲时间。
本次征求意见稿中,在水分和油酸含量等项目上的要求远远高出美国、欧洲等国家的药典标准。
我公司的生脉注射液为中药提取注射液,药品中的有效成分并不明确,如果过高地要求聚梨山酯80中的油酸纯度,或许会打破原有的亲水亲油平衡,可能发生如按原有处方生产无法保证药品疗效,甚至会导致处方更改,影响到市场临床用药。
周建平-药用辅料功能性指标与制剂质量共19页文档

Page 5
☆ 我国药用辅料标准执行简况
China Pharmaceutical University
据不完全统计,我国现使用的药用辅料总数约564种,具有药用质量 标准的占比例较低
✓ 总体分布
2019版中国药典中收载药用辅料132种,占辅料总数 部颁标准33种, 地方标准31种, 美国药典和欧盟药典标准27种, 国际、化工和企业标准341种,
解聚反应; 7)改善药物产生免疫反应及其它类似反应。
8)其他:应“公认为安全的物质”(Generally recognized As Safe)
GRAS级:是美国食品法律中非常重要、独特和庞杂的食品/食物成分类别,介于常规 食物/食物成分与食品添加剂之间,对食品工业快速创新和发展起到了重要支撑作用
2020/6/4
2020/6/4
Page 7
China Pharmaceutical University
二、药用辅料质量与功能性指标的关系
质量标准(制订部门较多、要求参差不齐) 国家药典标准 部颁标准 地方标准 行业标准
总体功能和作用 改善、提高药品的成型性 稳定性 依从性 安全性 有效性 ……
2020/6/4
2020/6/4
Page 9
China Pharmaceutical University
☆ 药用辅料质量与功能性指标的关系
根据质量与功能性指标基本含义,两者关系:
因此: 所以:
产品质量必然涵盖其核心功能, 核心功能是产品质量价值所在。
功能性指标是产品质量的核心; 无功能化指标就没有产品质量。
质量标准中必须含功能性指标!
1、国内现状:
核心技术缺乏、产业水平落后(欧美等发达国家30年?) 生产规模小(集中度差)、品种少、规格不精细 质量欠稳定(标准、管理、理念等)、服务不到位(成本?)
从质量源于设计看欧美药政机构对发酵源原料药的药品主文件审评

摘要药品生产的供应链全球化正在变得越来越复杂,药品质量和安全性风险相应的也在急剧增加。
越来越多的关注和资源都在不断的集中于确保物料的安全性、真实性和完整性。
原料药作为药品中的主要活性组分,正在受到越来越严格的控制。
然而,在原料药当中,发酵来源的原料药因其复杂的发酵源杂质组成一直是生产企业质量控制和药政机构文件审评的难点。
欧洲药品管理局近期发布的指南《抗生素中相关杂质的质量标准设定》[1]正式版为这类原料药的质量控制提供了法规依据,填补了现行法规的空白。
人用药品注册技术要求国际协调委员会发布的指南《Q11原料药的研发与生产》[2]为企业从质量源于设计角度理解原料药的研发、生产和注册文件编写提供了指导。
深入的研读这类指南以及现有的药品主文件将会对今后此类原料药的文件编写提供具有实际操作意义的帮助。
和合成工艺相比,发酵工艺更加易变和不受控。
因此,工艺中存在发酵步骤的原料药其杂质属性也更加复杂和难以预测。
ICH Q3A[3]、Q3C[4]、VICH GL10[5]和GL11[6]等指南对原料药中杂质的含量和界定的申报提供了指导,但是这些指南明确指出其不涵盖发酵和半合成产品。
欧洲药典通则《2034》[7]章节也针对原料药中杂质的含量和界定的申报提供了类似的依据,但是同样声明其不适用于上述类型的产品。
本文从近期欧洲药品管理局发布的指南《抗生素中相关杂质的质量标准设定》入手,结合近两年国际主流药政机构发布的其他指南以及近期通过官方审评的药品主文件及其审评意见,从质量源于设计的角度对官方审评特点进行探究, 为国内企业的药品主文件编写提供较为科学的、切合实际的指导。
关键词:药物主文件;原料药;质量源于设计;风险QbD-Based DMF Reviewing Aspects of EU and US Agencies forFermentation-Derived Drug SubstancesThe supply chain of drug production grows increasingly complex, and the risks to drug quality and safety correspondingly proliferate, more attention and resources are being focused on securing the materials and assuring their authenticity and integrity as they make their way through the supply chain. As the major active substance of drug product, APIs are monitored more and more strictly. However, there is one type of fermentation-derived active substances which have complex impurities components and are always the black spots for both quality controlling of manufacturer and DMF reviewing of agencies. The final Guideline on Setting Specifications for Related Impurities, recently issued by EMA provide basis for their quality control and filled the guides’ bank. ICH released Q11 Development and Manufacture of Drug Substances, which help the manufacturer to understand the development, manufacturing and regulatory submission of API from QbD aspects. It is necessary to deeply understand these associated guides and submitted DMF/ASMF, which would give us practical help to compile documentation in future.Compared to synthesis process, fermentation processes are more variable and less controllable, so the impurity profile of an active substance whose manufacturing process involves fermentation may be more complex and less predictable. ICH Q3 and the VICH GL10/GL11 guidelines set thresholds for the identification, reporting and qualification of related impurities in active substances, however, these guidelines clearly indicate that fermentation products and their semi synthetic derivatives are excluded from the guide scope. The similar definitions for excluded substances are described in the Ph.Eur. general monograph 2034 ‘Substances for Pharmaceutical Use’.This paper focused on the guidelines issued recently by main regulatory organizations, based on the submitted DMF/ASMF and assessment opinions of agencies to them. It attempts to explore the review characteristics of agencies, further provide scientific and practical guidance to domestic manufacturer for DMF compiling.Keywords: Drug Master Files, DMF, API, QbD,Risk Assessment目录第1章综述 (1)第2章发酵源原料药的特性 (4)2.1 从工艺角度看发酵源原料药的特性 (4)2.2 从质量标准角度看发酵源原料药的特性 (10)2.3 从药品主文件编写角度看发酵原料药的特性 (13)2.4 现行欧美法规对发酵源原料药的特殊要求 (13)第3章美国药监局对发酵源原料药的药品主文件审评 (16)3.1 美国药监局对药品主文件的技术要求和审评流程 (16)3.2 美国药监局对药品主文件审评新动向 (17)第4章欧洲药检局关于发酵源原料药的药品主文件审评 (20)4.1 欧洲官方对药品主文件的技术要求和审评流程 (20)4.2 欧洲官方对药品主文件文件审评新动向 (23)第5章从质量源于设计看发酵源原料药的药品主文件审评 (25)5.1 从质量源于设计看欧洲官方对发酵源原料药的药品主文件审评 (26)5.2 从质量源于设计看美国药监局对发酵源原料药的药品主文件审评 (27)5.3 从质量源于设计看欧洲药品质量理事会对原料药药品主文件的审评 (29)第6章结论与讨论 (33)第1章综述欧洲2012年6月30日,欧洲药品管理局(European Medicines Agency, 简称EMA) 发布了《抗生素中相关杂质的质量标准设定》。
中美两国药用辅料分类管理的比较

2 美国辅料分类管理概况
2. 1 美国药典对药用辅料的分类[7] USP- NF( 美国药典- 国家处方集) 按用途将辅
料分为 40 种, 即酸化剂、增塑剂、气雾剂用抛射剂、 聚合物薄膜、包合剂、空气取代剂、乙醇改性剂、碱化 剂、溶剂、吸湿剂、消沫剂、二氧化碳吸附剂、黏稠剂、 抗微生物防腐剂、抗氧剂、栓剂基质、混悬剂及/ 或增 稠剂、缓冲剂、甜味剂、片剂黏合剂、冻干用溶剂、螯 合剂、包衣剂、片剂及/ 或胶囊稀释剂、着色剂、复合 剂、干燥剂、片剂崩解剂、片剂及/ 或胶囊润滑剂、补 剂、柔软剂、乳化或/ 和增溶剂、助滤剂、调香剂或/ 和 香料、助流剂/ 抗黏着剂、保湿剂、软膏基质、防水剂、 润湿及/ 或增溶剂、赋形剂( 芳香及/ 或甜化、油脂化 剂、固体运送剂、无菌溶液) 等。 2. 2 辅料审批分类及审批管理
卫生部于 1988 年将新辅料分为两类: 即我国创 制的或国外仅有文献报道的药用辅料( 须报送药理 学研究、急性毒性试验、长期毒性试验、致突变试验、 生殖毒性试验、致癌试验等资料) 、已有的化学物质 首次作为辅料应用于制剂( 须报送药理学研究、急性 毒性试验资料, 其他的资料可不要求) 、和国外已经 批准并应用于制剂的药用辅料, 以及已有的食品添 加剂首次作为辅料应用于制剂的。卫生部按照类别 的不同规定相应的申报资料, 却未就具体的给药途 径进行更进一步的分类。
Chinese Pharmacopoeia & National Standards

Drug Administrative Law in China 药品管理法》 《药品管理法》的有关条款
• Article 102 Drugs refer to articles which are used in the prevention, treatment and diagnosis of human diseases and intended for the regulation of the physiological functions of human beings, for which indications, usage and dosage are established Including Chinese crude drugs, prepared slices of crude drugs, traditional Chinese medicine preparations, chemical drug substances & their preparations (Note: TCM administered strictly as drug, not as dietary supplements or health food ,in China)
Chinese Pharmacopoeia & Nati中国药典》
Chinese Pharmacopeia Commission 中国国家药典委员会 2010.3
Beijing
Drug Administrative Law in China 药品管理法》 《药品管理法》的有关条款
Drug Administrative Law in China 药品管理法》 《药品管理法》的有关条款
• Article 10 A drug shall be produced in conformity with the National Drug Standard & with the production processes approved (by SFDA) • Article 11 The raw materials and excipients for manufacture of pharmaceutical products shall meet the requirements for medicinal use ( difference between raw materials and drug substances ) • 第十条 药品必须按照国家药品 标准和国务院药品监督管理部 门批准的生产工艺进行生产 • 第十一条 生产药品所需的原料、 生产药品所需的原料、 辅料,必须符合药用要求( 辅料,必须符合药用要求(注 意原料与原料药的区别; 意原料与原料药的区别;药用 要求的重要指标之一即国家药 品标准) 品标准)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
各国药用辅料标准对比手册(数字版)V1.0用户手册1简介作为信息化时代的国家药品标准的实现形式和集大成者,《各国药用辅料标准对比手册》(数字版)作为全数字化中英文对照出版物,旨在为海内外广大用户系统使用及研究世界各主要国家药典所收载的药用辅料标准提供数字化支撑平台。
本用户手册对《各国药用辅料标准对比手册》(数字版)的意义和内容,以及用户安装使用方法进行了详细介绍和说明。
2编委会主 编张 伟副主编 兰 奋 钱忠直执行主编 涂家生 洪小栩编 委 (按姓氏笔画排序)龙海燕 兰 奋 刘雁鸣 孙会敏 孙春萌李崇林 李慧义 杨美成 杨 锐 张 伟陈 刚 陈 英 陈桂良 罗卓雅 洪小栩袁耀佐 钱忠直 凌 霄 涂家生参与工作人员许华玉 尚 悦 杨春雨 靳桂民 康笑博唐力新 周 怡 王 绯 田润涛 任重远张 军 宋宗华3前言党中央国务院高度重视食品药品安全工作,已将其提高到国家公共安全战略的地位。
药用辅料是药品的重要组成部分,对提高药品制剂的稳定性、改善药物生物利用度、保证药品的安全有效、质量可控发挥着不可替代的作用。
健全药用辅料标准体系,提升药用辅料标准水平、科学合理设立检测项目和限度规定、保证药用辅料的质量是开展国家药品标准提高行动计划的重要内容,也是保证药品质量的重要手段。
《中国药典》2015 年版(以下简称2015 年版药典)已于2015 年12月1 日正式施行。
其主要变化之一就是更加突出了药用辅料对制剂的重要作用,更加注重药用辅料标准的制定。
收载品种数量大幅增加,安全性控制更加严格、质量检测技术进一步完善,标准整体水平显著提升。
为全面展示我国药用辅料发展水平,了解2015 年版药典药用辅料标准状况,分析国内外药用辅料标准的异同,深入开展药用辅料质量研究,缩小与国外药用辅料标准的差距,推动我国药用辅料行业健康发展,国家药典委员会组织全国有关药品检验所和研究机构,翻译了现行版《美国药典》、《欧洲药典》、《日本药局方》中收载的药用辅料标准,编写了《各国药用辅料标准对比手册》。
本书包括各国药典收载的药用辅料标准共计1182 个品种,其中《中国药典》2010 年版132 个、2015 年版270 个、《美国药典》第38 版516 个、《欧洲药典》8.5 版277 个、《日本药局方》第16 版133 个。
通过对药用辅料标准相关信息及检测项目逐项进行比对,各国药用辅料标准在设定的质控项目、检测方法、检测限度方面的差异一目了然,为国内外药品和药用辅料研发、生产、使用单位及监管部门全面了解各国药用辅料标准整体情况以及各国标准之间的差异提供了有价值的参考。
本书涵盖内容丰富,分析比对详尽。
为方便读者使用,在编写过程中还开发了中、英文数字化软件,内容包括本书收载的各国药用辅料标准相应的中文版及英文版比对。
随着国内外药用辅料快速发展,我委将密切跟踪国内外药用辅料技术和标准的发展趋势,更多更快地更新各国药用辅料标准信息,以便使业界及时了解国内外药用辅料标准制修订的最新动态。
同时,也为今后深入开展各国药典之间的标准协调与合作,进一步促进药用辅料的国际国内贸易发展发挥重要的作用。
国家药典委员会还将以在线版《各国药用辅料标准对比手册》为基础,利用数字化、信息化技术加快药品标准信息服务平台的建设,提供更多的各国药品标准自动比对和质量标准分析的服务功能,读者可按权限在线升级电子版的相关标准信息。
由于水平和经验有限,时间仓促,本书内容疏漏之处在所难免。
在此,敬请广大读者给予批评指正。
编 者国家药典委员会2016年2月4版权声明一、《各国药用辅料标准对比手册》(数字版)由国家药典委员主编,并独家委托科迈恩(北京)科技有限公司研制开发。
二、《各国药用辅料标准对比手册》(数字版)(内容包括但不仅限于正文、通则等)的版权归国家药典委员会所有。
三、文献引用方式:国家药典委员会.各国药用辅料标准对比手册(数字版)[M/CD],北京:中国医药科技出版社.2016(Chinese Pharmacopoeia Commissions. Handbook of Standard Comparison of Pharmaceutical Excipients in Pharmacopoeias. (Digital Edition) [M/CD], Beijing: China Medical Science Press. 2016)。
©2015-2016 国家药典委员会版权所有。
未经书面许可,不得转载、复制、拷贝,违者将依法追究。
5免责声明一、《各国药用辅料标准对比手册》(数字版)仅供帮助读者理解与使用药典之用途,不作为法律依据和实际执行规范,也不承担相应的法律责任。
特此声明。
二、《各国药用辅料标准对比手册》(数字版)内容如与药典印刷版不一致之处,以印刷版为准。
三、《各国药用辅料标准对比手册》(数字版)的最终解释权归国家药典委员会所有。
四、安装并使用《各国药用辅料标准对比手册》(数字版)的用户,将视为接受包括上述版权声明及免责声明在内的《软件授权使用协议》,否则请勿安装及使用本软件。
符号说明版本:凡标注该图标的功能仅在平台版本中提供。
提示:该信息包含细节说明,用于正文的补充。
警告:该信息包含需要特别留意的注意事项。
PRO6目录1 简介 (1)2 编委会 (2)3 前言 (3)4 版权声明 (5)5 免责声明 (6)6 目录 (8)7 软件的安装与激活 (10)7.1 产品配置清单 (10)7.2 计算机系统要求 (10)7.3 软件的安装 (11)7.4 软件的在线激活 (11)7.5 在线更新 (14)8 软件操作指南 (15)8.1 各国药用辅料标准对比系统 (15)8.1.1 药品标准对比分析界面 (15)8.1.2 药品标准的智能对比 (16)8.1.3 药品标准的摘要对比 (16)8.1.4 药典中英文版本切换 (17)8.1.5 自定义药典对比 (18)8.1.6 自定义品种对比 (19)8.1.7 各国辅料标准统计功能 (20)8.2 数据库检索 (21)8.3 用户界面功能介绍 (22)8.3.1 选择用户界面语言 (22)8.3.2 更改品种索引方式 (22)8.3.3 设置目录显示级别 (22)8.3.4 软件介绍及版权说明 (23)8.3.5 软件在线更新功能简介 (23)8.3.6 自定义书签的设置 (24)8.3.7 介绍及功能演示视频 (24)9 附录 (25)9.1 各国药用辅料标准收载品种索引 (25)9.2 售后及技术支持 (46)7软件的安装与激活7.1产品配置清单您所购买的《各国药用辅料标准对比手册》(数字版)数字出版物由如下内容组成:产品代码项目名称200.001 201.001 202.001 203.001 《各国药用辅料标准对比手册》(数字版)USB闪存安装盘《各国药用辅料标准对比手册》(数字版)用户授权密钥《各国药用辅料标准对比手册》(数字版)用户手册《各国药用辅料标准对比手册》(数字版)安装指南7.2计算机系统要求《各国药用辅料标准对比手册》(数字版)的计算机推荐安装配置详见下表。
类别推荐配置支持的操作系统中央处理器内存硬盘显卡USB接口网络适配器Microsoft Windows XP/Vista/7/8/8.1 32位及64位操作系统推荐使用Intel Core系列4核处理器或同等性能CPU 最小2GB1GB可用空间集成图形加速卡1个百兆网卡或无线网卡7.3软件的安装将产品包装内的闪存盘插入计算机的USB接口中,双击Setup.exe程序图标,启动《各国药用辅料标准对比手册》(数字版)安装程序。
并根据提示信息指引完成整个安装过程。
图1 《各国药用辅料标准对比手册》(数字版)安装程序界面如果程序属性的数字签名一栏的发布者不是“科迈恩(北京)科技有限公司”,则表明此安装包无效或已损坏,此时请与出版社联系重新获取安装程序。
7.4软件的在线激活在尚未激活软件的计算机上启动程序时,将提示未发现用户许可信息(图2),此时请单击对话框中的“在线激活”按钮,进行软件的在线激活。
图2 用户许可信息提示对话框在激活过程中请确保您的计算机已连接至Internet。
首先,请输入由5组字母组成的产品密钥(图3),该密钥可在安装U盘的背面找到。
图3 在线激活程序产品密钥界面在接下来的对话框(图4),请从列表中选择要激活的许可,然后单击“完成”。
待服务器端的产品密钥有效性验证通过后,整个激活程序即告完成。
图 4在线激活程序选择激活及完成界面您所购买的软件的副本只允许在1台计算机上被激活及使用。
因此请务必在需要运行该软件的计算机上执行软件安装及激活操作。
在激活完成后,请继续妥善保管好您的产品密钥,如果您需要安装软件的计算机无法与Internet 连接,则请采用离线方式激活您的软件。
具体操作方法请咨询我们的售后服务部门。
7.5在线更新我们将密切跟踪国内外药用辅料技术和标准的发展,及时更新软件所收载的各国药用辅料标准信息。
您可通过软件所提供的在线更新功能,自动检查并免费下载安装最新版软件及数据库。
图5 《各国药用辅料标准对比手册》(数字版)新版本提示信息8软件操作指南8.1各国药用辅料标准对比系统8.1.1药品标准对比分析界面图6 各国药典药用辅料标准对比系统界面《各国药用辅料标准对比手册》(数字版)软件是专为国家药品标准所开发的专业综合数据服务平台,其由数字药品标准阅读系统、药品标准对比系统、药品标准查询系统,以及国家药品标准结构化数据库系统等4部分组成。
软件的整体图形用户界面设计美观大方、功能丰富、操作简便,支持面向海内外的广大药品行业用户的数字药品标准阅读、智能对比、查询等丰富功能。
药品标准正文浏览窗口依托自主知识产权的国家药品标准数字引擎,实现了对国家药品标准的浏览、中英文对比、多国药典收载品种智能对比、检索、本地化语言,以及各类图谱数据显示等综合阅读功能。
在与药典印刷版保持内容与排版高度统一、美观大方的基础上,药品标准数字引擎为用户提供更好的交互式阅读体验,并为专业用户全面、深入地掌握及使用国家药品标准提供技术支撑平台。
以下对该数字化药品标准阅读系统的使用方法进行详细说明。
8.1.2药品标准的智能对比图7 药品标准的智能对比示例在药用辅料智能对比模式下,不同国家药用辅料标准将按照检测项目的相似程度实现自动智能合并及对比,克服了各个国家药典在体例结构及检测项目设置上的显著差异。
从而实现不同国家药用辅料标准的规范化信息加工和国际协调,从而更好地对同一品种在各国药典所收载标准的质量控制水平的整体评价及收载项目的横向比较。
图8 对比方式工具栏操作方法:首先按下“药品标准”工具栏中的“智能对比”按钮,接下来从品种索引列表或检索窗格选择待查询的具体品种,该品种的内容即以智能对比的方式予以呈现。
