电子排布式 电子排布图 原子结构示意图比较大全
1.1.2构造原理与电子排布式

➢人教版(2019)选择性必修二 第一章 原子结构与性质 第一节 原子结构
源于 光谱 学事 实
➢ 思考与讨论6
铬和铜的价层电子排布式分别有如下两种写法,哪一个正确?正确的那个 符不符合构造原理?如不符合,又是根据什么填充电子的?
铬 根据构造原理:3d44s2
根据光谱:3d54s1
铜 3d94s2 × 3d104s1 √ 不符合构造原理!
②价层电子排布式: 省略其他电子,只书写价层能级电子的排布式。
如: 元素原子 价层电子排布式
Fe
3d64s2
③元素周期表只给出价层电子排布式。如:
学习评价:写出Na、Al、Cl 、Zn 、Br价层电子排布式。
➢人教版(2019)选择性必修二 第一章 原子结构与性质 第一节 原子结构
➢ 思考与讨论5
氦氖
氩
氪
氙
氡
气 奥
1s2 2s22p6 3s23p6 4s24p6 5s25p6 6s26p6 7s27p6
(1)稀有气体最外层电子排布通式: ns2np6(氦除外)
稀有气体最外层电子排布特点:
最外能层都只有s和p两个能级,且都已排满(8个)(氦除外)——相对稳 定结构。
➢ 思考与讨论2
当原子序数较大时,书写电子排布式比较繁索,如溴的电子排布式为:
小结1:重难点知识显性化 原子结构的表征方法
原子结构 示意图
意义 将每个能层上的电子总数表示在原子核外的式子 实例
电子排布式
简化电 子排布式
意义 用数字在能级符号右上角标明该能级上排布的电子 数,这就是电子排布式
实例 繁琐,把内层电子达 意义 到稀有气体结构的部分以相应稀有气体的元素符号
元素
电子排布
第1课时 原子核外电子的排布(24张)

(4)该微粒的还原性很弱,失去1个电子后变为原 子,原子的氧化性很强,这种微粒的符号是_____。
解析 (1)该微粒为中性微粒,即核电荷数等于核外 电子数,为18号元素氩。 (2)该微粒能使溴水褪色,即为还原性微粒,且出现 浑浊,即有难溶性的非金属单质。符合条件的为硫 元素。 (3)该微粒得到一个电子可变成原子,故为19号元素 钾。 (4)该微粒失去一个电子可变成原子,故为17号元素 氯。
答案 失去。
能量较高的电子排布在离原子核较远的
电子层上,原子核对电子的吸引能力弱,故易
4.核外电子的排布规律 分析下表填写下列空白: 稀有气体元素原子的核外电子排布 各电子层的电子数 K
2He(氦) 10Ne(氖) 18Ar(氩) 36Kr(氪) 54Xe(氙) 86Rn(氡)
L 8 8 8 8 8
答案
原子结构示意图中各电子层上的电子
数目必须遵守核外电子的排布规律,该结构 示意图中最外层电子数为9,不符合排布规律。
4.分析离子结构示意图,概括离子的核电荷数 与核外电子数的关系。 答案 阳离子核外电子数小于核电荷数,阴离 子核外电子数大于核电荷数,其差值均为它们 所带的电荷数。
5.原子形成阳离子或阴离子后,其电子层结构 发生了哪些变化? 答案 原子形成阳离子后,要减少一个电子层, 形成阴离子后电子层数不变,但最外层电子数增 多,它们都达到了稳定结构。
答案
(1)Ar
(2)S2-
(3)K+
(4)Cl-
8.A、B、C三种元素,其中有一种金属元素,A、 B原子的电子层数相同,B、C原子的最外层电子 数相同。又知这三种元素原子的最外层电子数之 和为17,原子核中的质子数之和为31。试通过计 算确定这三种元素的名称。 解析 设元素A、B原子最外层电子数分别为y和x,
原子结构核外电子排布.ppt

心
(2)若 H2、D2、T2 混合在一起是纯净物还是混合物?
问 题
突
破
提示:(1)是单质,H、D 都是 H 元素的原子,即只有一种元素 实
验
组成。
积 累
探
究
(2)纯净物,因 H2、D2 都表示氢气这一种物质。
课
时
达
标
反
馈
二、原子结构与元素性质的关系
基
础
知
一般规律:
识 导
学
最外层 得失电 主要化
核
构成简单离子
学 核
心
问
3.原子组成与结构的表示
题 突
破
(1)原子符号
实
验
积
质量数
累 探
元素符号
究
质子数
课 时
达
标
反
馈
基
础
知
识
(2)原子(或离子)结构示意图
导 学
如钠原子的结构示意图:
核
心
问
题
电子数
突 破
核电荷数
实
验
积
累
探
究
电子层
课
时
达
标
反
馈
基
础
4.元素、核素、同位素
知 识
导
(1)元素、核素、同位素之间的关系
题 突
破
18 电子微粒 C2H6、CH3OH、CH3F、H2N-NH2 等
实 验 积
②阴离子:S2-、HS-、Cl-、O22-
累 探
究
③阳离子:K+、Ca2+
课 时
达
核外电子总数 ①Na+、NH+ 4 、H3O+
标 反
原子核外电子排布

③ 1s 2s
2p
29
1s 1 氢 2 氦 3 4 5 6 10 13 14 18 19 20 锂 铍 硼 碳 氖 铝 硅 氩 钾 钙 H He Li Be B C Ne Al Si Ar K Ca Sc 1 2 2 2 2 2 2 2 2 2 2 2 2
2s
2p
3s
3p
3d
4s
每个电子层最多可容纳的电子数为 2n2
K
轨道数 电子数
L
M
N
1 2
4 8
9 18
16 32
8
2、能量最低原理
体系的能量越低越稳定
9
2、能量最低原理
电子排布时
总是先占据能量较低的原子轨道,
当能量较低的原子轨道占满后,
电子再依次进入能量较高的原子轨道
怎样判断原子轨道能量的高低呢?
10
(1) 原子轨道的能量主要是由电子层 和电子亚层决定的
16
(2) 电子在原子轨道中的排布顺序
电子排布式:
22s22p63s23p5 Cl 原子: 1s 17
所有能级均写出,体现排布全貌;
书写格式: ①元素符号; ②轨道符号(带电子层数) ③电子个数(右上角)
17
N:1s2 2s2 2p3 Z = 26 Fe:1s2 2s2 2p6 3s2 3p6 3d6 4s2
Fe3+ [Ar] 3d 5
21
22
(2) 电子在原子轨道中的排布顺序
若要表示电子自旋方向,可用原子轨道图式表示:
轨道表示式:
17Cl:
1s
2s
2p
3s
3p
23
电子结构式
25
原子核外电子排布

钠 Na 2 2 6 1
镁 Mg 2 2 6 2
铝 Al 2 2 6 2 1
硅 Si 2 2 6 2 2
磷 P 22623
硫 S 22624
氯 Cl 2 2 6 2 5
氩 Ar 2 2 6 2 6
(备注:斜体元素为锕系、镧系,初高中理科教师群 100035163,Chol-2NBD 整理)
周原元元
镤 Pa 2 2 6 2 6 10 2 6 10 14 2 6 10 2 2 6 1 2
铀 U 2 2 6 2 6 10 2 6 10 14 2 6 10 3 2 6 1 2
镎 Np 2 2 6 2 6 10 2 6 10 14 2 6 10 4 2 6 1 2
钚 Pu 2 2 6 2 6 10 2 6 10 14 2 6 10 6 2 6
261
2
58 铈 Ce 2 2 6 2 6 10 2 6 10 1 2 6 1
2
59 镨 Pr 2 2 6 2 6 10 2 6 10 3 2 6
2
6(32) 60 钕 Nd 2 2 6 2 6 10 2 6 10 4 2 6
2
61 钷 Pm 2 2 6 2 6 10 2 6 10 5 2 6
2
62 釤 Sm 2 2 6 2 6 10 2 6 10 6 2 6
2
40 锆 Zr 2 2 6 2 6 10 2 6 2
2
41 铌 Nb 2 2 6 2 6 10 2 6 4
1
42 鉬 Mo 2 2 6 2 6 10 2 6 5
1
43 锝 Tc 2 2 6 2 6 10 2 6 5
2
44 钌 Ru 2 2 6 2 6 10 2 6 7
1
电子的核外排布

≥4个
稳定(不得失)
在化学反应中 易失去电子
在化学反应中 易得到电子
总结:元素的性质,特别是化学性质,跟它的原
子的 最外层电子数
关系密切。
练习:
下面的结构示意图正确的是:( )
+3 2 1 A
+3 3 B
+11 2 8 1 +11 2 9
C
D
练习:
画出下列原子的结构示意图:
7N
12Mg
17Cl
部分金属元素的原子结构示意图
3、下列具有相似化学性质的元素组别
是: C、D
。
A.
B.
C.
D.
同学们有没有想过电子是 怎样围绕原子核做高速运
动的呢?
三、原子核外电子的不同运动区域
多电子原子核外电子的分层运动状况
核外电子分层排布
电子按能量高低在核外分层排布。 1234567 K LMNOPQ
由内到外,能量逐渐升高
核外电子的分层排布(又叫分层运动)
电子层符号 K L M N O P Q
电子层序数(n) 1 2 3 4 5 6 7
电子离核的距离 近
远
电子具有的能量 低
高
2、原子结构示意图
如: Na
核内质子数
电子层
原子核
每个电子层上的电子数
称有气体元素原子电子层排布
各电子层的电子数
核电 元素名 元素
荷数 称 符号 K
L
M
N
O
P
最外层电子 数
2
氦
He
2
2
10
氖
Ne
2
8
8
18
氩
Ar
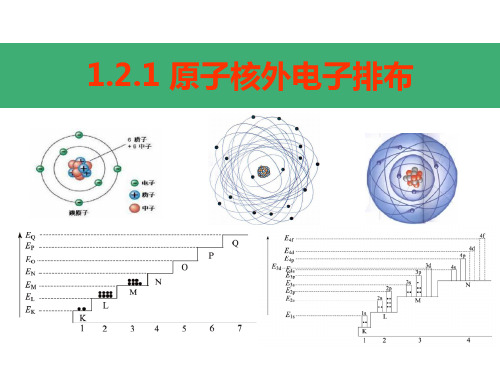
1.2.1 原子核外电子排布
元素的金属性、非金属性。
二、元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性 的变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外 电子排布周期性变化的必然结果。
随堂练习:
1、R元素形成的化合物RH3,其中R的化合价是其 最低负化合价,则R元素最高价氧化物的化学式是:
111
88
77
N(氮) O(氧) F(氟)
70
66
64
Ne(氖) —
11~17 号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷)
原子半
径/pm
186
160
143
117
110
S(硫) 104
Cl(氯) Ar(氩)
99
—
提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。 (2)表中数据的单位是pm(皮米),1pm=10-12m。
1.2.1 原子核外电子排布
一、原子核外电子排布 原子结构示意图
一、原子核外电子排布
各电子层排布的电子数
电子层(从里到外为K、L、M······层) 核电荷数
原子核
一、原子核外电子排布
1、原子核外电子排布
(1)核外电子按能量高低分层排布(运动)
电子层: 根据电子的能量差异和通常运动区域离核
(能层)
〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子 半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表 示原子半径,根据数据表作图,表示出3~9、11~17的元素的 原子最外层电子数与原子半径的函数图像。
3~9号 元素
原子半 径/pm
高一化学原子核外电子排布

1、原子核外电子的分层排布
原子核
电子层
+1
+2
+10
核电荷数
该电子层 上的电子
H
He
Ne原子的核外电子分层排布
+8
+12
+18
O
Mg
Ar
原子结构示意图 第3层
第2层 第1层
+15 2 8 5
K层 L层 M层
核电荷数为1~20元素的原子结构示意图
核外电子是分层排布的,由里向外,
K Ca 由能量低的轨道到能量高的轨道。
+17 2 8 8
氯离子Cl-
氧化镁的形成
4.下列结构示意图中,表示原子结构的是( D )
+11 2 8
+17 2 8 8
+16 2 8 8
A
B
C
5.用下面的结构示意图的字母填空:
+3 2 1
D
(1)属于金属原子的是__________; (2)属于非金属原子的是________; (3)属于离子结构示意图的是____; (4)具有稳定结构的是__________。
知道你们这些年是怎么过来的呢!当然啦,你们也不知道爹的情况!”耿兰听爹这样说话,那双好看的丹凤眼立马就瞪圆了,奇怪地 问:“怎么,爹和哥哥姐姐们后来这七年多的时间里不在一起哇?”耿老爹故作轻松地说:“当然啦,要不你哥哥姐姐们怎么会拉回 来这么一个‘寿喜’呢!”不成想郭氏一听这话就哭出声来了。她吃力地扭头看着丈夫结结巴巴地说:“他爹你,你说什么,你们爷 儿们,怎么,怎么会不在一起?这,这,这七年多之前,小直子才,才多大啊!还,还有这个,‘寿,寿什么’,都,都是怎么……” 耿正、耿英和耿直都强忍着眼泪。耿英对娘说:“娘,你看啊,俺们三个和爹现在不都好好的嘛!这就行了。而且啊,爹还给你带回 来这么好的一个老儿子呢!至于俺们以前都受了什么苦,那又有什么关系呢!再说啦,这人啊,要想活出个样子来,那里有不受苦的 道理呢!”看娘慢慢止住眼泪了,耿英看看哥哥和弟弟,他俩都微微点点头。耿英就对爹、娘和妹妹说:“那就让俺来说说俺们这边 哇!俺们先是去了景德镇,在那里,在那里俺们开了一个小饭铺,哥哥给起的名字是‘南北小饭庄’,做得还不错,赚了一些银子呢! 三年多之后,俺们认识了稷山的一个姓李的老乡。后来这近四年,俺们三个是在杭州做丝绸生意来着。这个生意做得好极了,俺们赚 了不少银子。算算时间该回家了,俺们就在去年的腊月初九动身,一路赶回来了!巧的是爹和尚武也正好是那天回来了,俺们是在咱 们家南面的五道庙前会合的,这不就一起回来了!”郭氏又开始掉眼泪了,说:“英子啊,你就挑拣好听的说哇,你当娘是傻子啊, 你还没有和娘说,你们和你爹是怎么分开的啊!”耿兰也说:“你们托张伯伯带回来的书信中,不是说在汉口镇上开粮油零售店的吗? 怎么你们三个又给跑景德镇去了啊?还有,爹呢?爹怎么没有和你们一起去哇?”耿英怔一怔,故意轻松地说:“啊,是了,俺怎么 忘了说之前的事儿了呢!那,俺还是再补上之前的发生的事情哇!”想一想,耿英又将汉口镇遭遇洪灾,父子们无奈过江,在武昌镇 白家暂住……大致述说一番。说到半年之后,爹爹带着他们离开白家继续沿江南下时,耿英的言词表情明显不自然起来。含糊其词几 句以后,她竟然说:“俺们忘记不了这家人的好,返回来的途中还顺路去看望了她们呢!她们也给俺们带回来了很贵重的礼物,就放 在那个软皮箱里呢!对了爹,小青姐姐和东伢子在俺们走后的那年秋上就结婚了,他们的男娃儿叫小东伢,这过了年已经六岁了!东 伢子种了好多菜地,还养了大骡车……”耿兰的眼珠子转一转,很不满意地打断了姐姐那似乎没完没了,且还那么兴致勃勃的唠叨, 明显不耐烦地说:“姐,你别扯远了哇!你说爹想带你们去一个
电子排布式

原子结构与性质1、电子排布式:如:氧原子电子排布式:1s2 2s2 2p42、电子排布图:3、原子结构示意图:4、核外电子排布:5、电子式:6、结构式:H-O-H练习1:1、A、B、C、D、E代表5种元素。
请填空:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为________;(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的元素符号为________;(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为______________________________________________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E 的元素符号为________,其基态原子的电子排布式为____________________________________________________。
(5)F元素的原子最外层电子排布式为n s nn p n+1,则n=________;原子中能量最高的是________电子,其原子轨道呈________形。
解析:(1)由题意知,A元素基态原子核外电子排布式为1s22s22p3,所以A为氮元素。
(2)氩为18号元素,B的负一价离子电子层结构与氩相同,所以B为氯,C为钾。
(3)因为D元素正三价离子的3d能级为半充满即3d5,由此推知D元素基态原子的核外电子排布式为1s22s22p63s23p63d64s2,因此为铁元素。
(4)E元素基态原子的M层全充满,且N层没有成对电子,只有一个未成对电子,由此推出核外电子排布式为:1s22s22p63s23p63d104s1,因此为铜元素(5)s能级只有1个原子轨道,故最多只能容纳2个电子,即n=2,所以元素F的原子最外层电子排布式为2s22p3,由此可知F是N元素;根据核外电子排布的能量最低原理,可知氮原子的核外电子中2p能级的能量最高,p电子的原子轨道呈纺锤形。
电子排布式、电子排布图、原子结构示意图比较大全

族IA IIA ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0周期表中纵列数第1列第2列第3列第4列第5列第6列第7列第8列第9列第10列第11列第12列第13列第14列第15列第16列第17列第18列第一周期(1-2号)原子序数元素符号名称1 H 氢2 He 氦2种元素电子排布式 1s 11s 2电子排布图原子结构示意图第二周期(3-10号)原子序数元素符号名称3 Li 锂4 Be 铍5 B 硼6 C 碳7 N 氮8 O 氧9 F 氟10 Ne 氖8种元素电子排布式 1s 22s 1 1s 22s 21s 22s 22p 11s 22s 22p 21s 22s 22p 31s 22s 22p 41s 22s 22p 51s 22s 22p 6电子排布图原子结构示意图第三周期(11-18号)原子序数元素符号名称11 Na 钠12 Mg 镁13 Al 铝14 Si 硅15 P 磷16 S 硫17 Cl 氯18 Ar 氩8种元素电子排布式1s 22s 22p 63s 11s 22s 22p 63s 21s 22s 22p 63s 23p 11s 22s 22p 63s 23p 21s 22s 22p 63s 23p 31s 22s 22p 63s 23p 41s 22s 22p 63s 23p 51s 22s 22p 63s 23p 6电子排布图原子结构示意图第四周期18种(19-36号)原子序数元素符号名称19 K 钾20 Ca 钙21 Sc 钪22 Ti 钛23 V 钒24 Cr 铬25 Mn 锰26 Fe 铁27 Co 钴28 Ni 镍29 Cu 铜30 Zn 锌31 Ga 镓32 Ge 锗33 As 砷34 Se 硒35 Br 溴36 Kr 氪电子排布式【Ar 】4s 11s 22s 22p 63s 23p 64s 21s 22s 22p 63s 23p 63d 14s2【Ar 】3d 24s 21s 22s 22p 63s 23p 63d 34s21s 22s 22p 63s 23p 63d 54s 1【Ar 】3d 24s 21s 22s 22p 63s 23p 63d 64s2【Ar 】3d 74s 21s 22s 22p 63s 23p 63d 84s21s 22s 22p 63s 23p 63d 104s 11s 22s 22p 63s 23p 63d 104s21s 22s 22p 63s 23p 63d 104s 24p 11s 22s 22p 63s 23p 63d 104s 24p2【Ar 】3d 104s 24p 31s 22s 22p 63s 23p 63d 104s 24p4【Ar 】3d 104s 24p 5【Ar 】3d 104s 24p 6第五周期18种37-54号价电子排布式4s 14s 23d 14s 23d 24s 23d 34s 23d 54s 13d 54s 23d 64s 23d 74s 23d 84s 23d104s 13d 104s 24s 24p 14s 24p 24s 24p 34s 24p 44s 24p 54s 24p 6第六周期32种55-86号 镧系电子排布图价电子排布图第七周期?种满32种87-满118号锕系原子结构示意图共价键分类s-s σ键s-p σ键p-p σ键p-p Π键分子或离子CO 2SO 2 CO 32-CH 4NH 4+ 中心原子杂化轨道类型spsp2sp3a 64+2=65-1=4x 234H 2O NH 3b221sp3sp3中心原子上的孤对电子数0100分子或离子的价层电子对数2334VSEPR模型名称直线形平面三角形平面三角形正四面体形正四面体形分子或离子的立体构型名称直线形V形平面三角形正四面体形正四面体形形成配合物的条件:①配位体有孤电子对;②中心原子有空轨道。
原子核外电子排布

1个质子带一个单位正电荷 中子不显电性 1个电子带一个单位负电荷
P30表1-7
已知一个质子的质量为1.673×10-27Kg,一个中子的质量 为1.675×10-27Kg,一个电子的质量为9.109 ×10-31Kg,一 个12C原子的质量的1/12为1.661×10-27Kg,求质子、中子、 电子的相对质量。 构成原子的 微粒 电子 原子核
质子
中子
电性和电量 1个质子带一个 1个电子带一个 中子不显电 单位正电荷 单位负电荷 性 质量/kg 9.109×10-31 1.673×10-27 1.675×10-31 相对质量 1/1836 1.007≈1 1.008≈1
问题解决:P30
原子 质子数 中子数 质子数+中子 (Z) (N) 数(A) 相对原 子质量
次外层最多只能容纳18个电子
倒数第三层最多只能容纳32个电子
3.原子结构与元素性质的关系(结构决定性质) 4.原子结构示意图 离子结构示意图
练习: ⒈原子核外电子是分层 排布的 ⒉金属元素的原子最外层一般 <4 个电子,在 化学反应中易 失去 电子形成与稀有气体原子 电子层排布相同的阳离子(稳定结构)。 ⒊非金属元素的原子最外层一般 ≧4 个电子, 在化学反应中易 得到 电子形成与稀有气体原 子电子层排布相同的阴离子(稳定结构)。 ⒋化学反应中,原子核不发生变化,但原子的 发生变化,元素的化学性质主要决定于原子结 构中的 最外层电子数目 。
核外电子(Z)
关系式1:(电性关系) 核电荷数=核内质子数=核外电子数=原子序数 关系式2:(质量关系) 质量数(A)=质子数(Z)+中子数(N) 请指出Al、Al3+中所含的质子数和电子数。
二、构成原子的微粒之间的数量关系
原子核外电子排布

核外电子的排布规律
如果将来填满第八周期,此周期将有多少种元素? 分析下表填写下列空白:
稀有气体元素原子的核外电子排布 各电子层的电子数 K
2He(氦) 10Ne(氖) 18Ar(氩) 36Kr(氪) 54Xe(氙) 86Rn(氡)
L 8 8 8 8 8
M
N
O
P
2 2 2 2 2 2 8 18 8 8 8 18 18
Si P
H2SO4 强酸
Cl
HClO4 最强酸
S
非金属性逐渐增强
14Si
15P
16S
17Cl
对应氧化物 氧化物的水化物 酸性强弱 单质与H2反应条件
SiO2
弱酸
P2O5
H4SiO4 H3PO4
Cl2O7 SO3 H2SO4 HClO4
最强酸
中强酸 强酸 逐渐增强 加热
高温
加热 点燃或光照
气态氢化物及稳定性
Mg、水、 酚酞
大量气泡、溶液 变红
加热前——无明显现象, 加热后——大量气泡, 红色明显
2Na + 2H2O ═ 2NaOH + H2 ↑
Mg + 2H2O ═ △ Mg(OH)2 + H2 ↑ (缓慢)
结论:Mg的金属性不如Na
第二组实验:Mg、Al与盐酸反应 反应物 Mg、盐酸 现 象
反应迅速,产生 大量气泡 反应较慢,缓 缓产生气泡
L 8 8 8 8 8
M
N
O
P
2 2 2 2 2 2 8 18 8 8 8 18 18
18 32 18
2 2
8 18 32 32 18 8 8 18 32 50 32 18 8
原子核外电子的排布 课件

4
【思路点拨】解答本题要注意以下三点:
【自主解答】(1)L层有8个电子,则M层有4个电子,故A 为硅(Si)。(2)当次外层为K层时,最外层电子数为3,是
硼(B)
; 当次外层为L层时,最外层电子数
为1.5×8=12,违背了排布规律,故不可能。
(3)C元素原子的质子数为10+1=11,故为钠,故+1价离子是 Na+。(4) -2价离子次外层电子数是最外层电子数的 1 ,当
4
次外层为K层时,其核外电子排布为2、8,与Ne
电子层排布相同,则其原子的质子数为10-2 = 8,为氧元 素,写出O2-结构示意图即可;当次外层为L层时,最外层 则有32个电子,故不可能。
【典例2】下列说法正确的是 A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强 B.元素性质的周期性变化是由原子核外电子排布的周期性 变化所决定的 C.同周期非金属氧化物对应的水化物的酸性从左到右依次 增强 D.第三周期元素的离子半径从左到右逐渐减小 【易错选项】C
【易错剖析】 (1)易错选项分析 本题易错选C的原因在于对知识掌握不准确,将“最高价氧 化物的水化物”错误地认为是“氧化物的水化物”,正确 说法是“同周期非金属最高价氧化物对应的水化物的酸性 从左到右依次增强”。
(2)其他错误选项分析 【标准答案】B
1.(2011·漳州高一检测)元素的性质呈周期性变化的根 本原因是( ) A.元素相对原子质量递增 B.原子半径呈周期性变化 C.原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化 【解析】选C。元素的性质呈周期性变化的根本原因是核外 电子排布呈周期性变化,其他周期性变化都是由它引起的。
原子结构示意图

原子的构成:
原子核 小而重、带正电(核电荷数) 原子
(不带电)
核外电子 每个电子带一个单位负电荷
氧原子(O)的结构示意图: 8个质子
质子数=核电荷数=核外电子数
电子排布 离核距离:近 能量:低
远 高
+8
原子核
带正电
电子分层排布的规律:
电子排布
离核距离:近 能量:低
远 高
1.由内而外,逐层排布 2.每层最多容纳2n2个电子 3.最外层电子数不超过8个
(第一层则不超过2个)
n为电子层数
氧原子(O)的结构示意图: 质子数=核电荷数=核外电子数 电子排布
离核距离:近
远
能量:低
高
1.由内而外,逐层排布 2.每层最多容纳2n2个电子 3.最外层电子数不超过8个
(第一层则不超过2个)
电子分层排布的规律: 1.由内而外,逐层排布 2.每层最多容纳2n2个电子 3.最外层电子数不超过8个
原子结构示意图:
元素周期表:
质子数
质子数=核电荷数
电子分层排布的规律: 1.由内而外,逐层排布 2.每层最多容纳2n2个电子(n为电子层数) 3.最外层电子数不超过8个(第一层则不超过2个)
(第一层则不超过2个)
制约条件
①快速判断示意图的正误 ②书写电子数比较多,
达到第三层以上时使用;
电子分层排布的规律: 1.由内而外,逐层排布 2.每层最多容纳2n2个电子 3.最外层电子数不超过8个
(第一层则不超过2个)
制约条件
①快速判断示意图的正误 ②书写电子数比较多,
达到第三层以上时使用;
钙(Ca)原子:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
族
IA IIA ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0周期表中纵列数第1列第2列
第3列
第4列
第5列
第6列
第7列
第8列
第9列
第10列
第11列
第12列
第13列
第14列
第15列
第16列
第17列
第18列第一周期(1-2号)
原子序数元素符号名称
1 H 氢
2 He 氦
2种元素电子排布式 1s 1
1s 2
电子排布图
原子结构
示意图
第二周期(3-10号)
原子序数元素符号名称
3 Li 锂
4 Be 铍
5 B 硼
6 C 碳
7 N 氮
8 O 氧
9 F 氟10 Ne 氖
8种元素电子排布式 1s 22s 1 1s 22s 2
1s 22s 22p 1
1s 22s 22p 2
1s 22s 22p 3
1s 22s 22p 4
1s 22s 22p 5
1s 22s 22p 6
电子排布图
原子结构示意图
第三周期(11-18号)
原子序数元素符号名称
11 Na 钠12 Mg 镁13 Al 铝14 Si 硅15 P 磷16 S 硫17 Cl 氯18 Ar 氩8种元素电子排布式1s 22s 22p 63s 1
1s 22s 22p 63s 2
1s 22s 22p 63s 23p 1
1s 22s 22p 63s 23p 2
1s 22s 22p 63s 23p 3
1s 22s 22p 63s 23p 4
1s 22s 22p 63s 23p 5
1s 22s 22p 63s 23p 6
电子排布图
原子结构示意图
第四周期18种(19-36号)原子序数元素符号名称
19 K 钾
20 Ca 钙
21 Sc 钪
22 Ti 钛23 V 钒
24 Cr 铬
25 Mn 锰26 Fe 铁
27 Co 钴28 Ni 镍
29 Cu 铜
30 Zn 锌
31 Ga 镓
32 Ge 锗
33 As 砷
34 Se 硒
35 Br 溴
36 Kr 氪
电子排布式
【Ar 】4s 1
1s 22s 22p 63s 23p 64s 2
1s 22s 22p 63s 23p 63d 14s
2
【Ar 】3d 24s 2
1s 22s 22p 63s 23p 63d 34s
2
1s 22s 22p 63s 23p 63d 54s 1
【Ar 】3d 24s 2
1s 22s 22p 63s 23p 63d 64s
2
【Ar 】3d 74s 2
1s 22s 22p 63s 23p 63d 84s
2
1s 22s 22p 63s 23p 63d 104s 1
1s 22s 22p 63s 23p 63d 104s 2
1s 22s 22p 63s 23p 63d 104s 24p 1
1s 22s 22p 63s 23p 63d 104s 24p 2
【Ar 】3d 104s 24p 3
1s 22s 22p 63s 23p 63d 104s 24p 4
【Ar 】3d 104s 24p 5
【Ar 】3d 104s 24p 6
第五周期18种
37-54号价电子排布式
4s 1
4s 23d 14s 23d 24s 2
3d 34s 23d 54s 13d 54s 2
3d 64s 23d 74s 2
3d 84s 2
3d
10
4s 13d 104s 24s 24p 14s 24p 24s 24p 34s 24p 44s 24p 54s 24p 6
第六周期32种55-86号 镧系电子排布图
价电子排布图
第七周期?种
满32种87-满118号
锕系
原子结构示意图
共价键分类
s-sσ键
s-pσ键
p-pσ键p-pΠ键分子或离子CO 2SO 2 CO 32-CH 4NH 4+ 中心原子杂
化轨道类型
sp
sp2sp3
a 64+2=65-1=4x 234H 2O NH 3b
2
21sp3sp3
中心原子上
的孤对电子数0100
分子或离子的
价层电子对数
2
3
3
4
VSEPR模型名称直线形
平面三角形平面三角形正四面体形正四面体形
分子或离子的立体构型名称
直线形V形平面三角形正四面体形正四面体形
配合物形成:颜色改变、溶解度改变
无机含氧酸分子酸性
1、对于同一种元
素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。
2、含氧酸的通式
可写成(HO)mROn,R相同,n值越大,酸性越强。
注意:碳酸因溶解度较小,酸性弱。
1-36号元素电子排布式、电子排布图、原子结构示意图比较·分子结构与性质学习参考 开远一中高三化学备课组周艳芳编拟
Ⅷ 电子云和原子轨道:
(1)电子运动的特点:①质量极小 ②运动空间极小 ③极高速运动。
电子运动只能用统计的观点来描述它在原子核外各处出现的概率——电子云。
常把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图成为原子轨道。
S的原子轨道是球形的(右下图), 能层序数越大,原子轨道的半径越大。
ns np (n≥2) nd (n≥3) nf (n≥4)
P的原子轨道(右下图)是哑铃状(或纺锤形)的,每个P能级有3个轨道,互相垂直,分别以Px、Py、Pz为符号。
P原子轨道的平均半径也随能层序数增大而增大。
能层序数n越大,原子轨道的半径越大。
这是由于1s,2s,3s……电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
分子结构与性质
杂化轨道类型sp3 sp sp2
中心原子上的孤对电子数=1/2(a-xb) a为中心原子的价电子数;x为与中心原子结合的原子数;用价层电子对互斥模型判断下列分子或离子的构型VSEPR模型杂化轨道数=中心原子孤对电子对数+中心原子结合的原子数
b为与中心原子结合的原子最多能接受的电子数 氢为1,其它原子=8-该原子的价电子数。
AB X 型 价层电子对互斥理论对几种分子或离子的立体构型推测
族行周期元素种类 分子或离子的
立体构型
+11
+321
+11281
+19
2881+422+523
+624
+725+826
+927+1028
+22
+17287+16286+15285
+14284+13283
+12282
+20
2882
+21
2892
+18288
+36
28188
+22
28102
+23
28112
+24
28131+25
28132
+26
28142
+27
28152
+28
28162
+29
28181
+30
28182
+31
28183
+32
28184
+33
28185+34
28186+3528187
轴对称镜面对称
形成配合物的条件:①配位体有孤电子对;②中心原子有空轨道。
法二:价层电子对数=(中心原子价层电子数+配原子数×n+电荷数)/2说明:配原子为H,X-F,Cl,Br,I
n=1;配原子为O,S n=0;配原子为N n=-1。
电荷数:带正电减带负电加。
