华东理工大学物理化学课件
合集下载
华东理工大学《物理化学》课件7.8 Arrhenius公式

(2) 延长反应时间;
(3) 加入适当催化剂。
进一步讨论
从热力学和动力学两个角度来看温度的影响
d ln K
r
H
o m
dT
RT 2
d ln{k} Ea dT RT 2
• 吸热反应:升温有利于实际反应(生产) • 放热反应:视具体情况具体分析
Arrhenius公式几种表达方法
速率系数
d ln{ k} dT
k Ae Ea /(RT )
活化能
速率系数
d ln{ k} dT
Ea RT 2
k Ae Ea /(RT )
指前因子
玻尔兹曼因子
阿仑尼乌斯活化能Ea
Ea
de f
RT
2
dlnk
dT
物理意义—反应物中活化分子的平均摩尔能量与
反应物分子总体的平均摩尔能量之差。
如温度变化范围不大,Ea可看作常数,
lnk Ea lnA 或
• 实验测定不同温度 T 下对应的速率系数 k 。 以 ln{k} ~ 1/T 作图,通过斜率和截距计算 活化能和指前因子。
• 活化能越大,斜率绝对值越大,直线越陡
• 对于一个给定的反应来说,在低温范围内, 反应的速率随温度的变化更敏感。
• 对于活化能不同的反应,当升高温度时, 活化能大的反应的速率增加的倍数比活化 能小的反应的速率增加的倍数大。
7.8 温度对反应速率的影响
温度对反应速率影响—改变速率常数或速率系数
范特霍夫规则(1884) kt10 C / kt 2 ~ 4
dlnk
dT
Ea RT 2
k Ae Ea /(RT )
贝特洛经验式 (1862) k AeDT
柯奇经验式(1893) k AT meE0 /(RT )
华东理工大学高分子物理 PPT

(HN-(CH2)5-CO)n
1、3、2 依照聚合物的结构特征命名
特别多缩聚物是两种单体通过官能团间缩合反 应制备的。
在结构上与单体有差别。可依照结构单元 的结构来命名,前面冠以“聚”字。 例如对苯二甲酸和乙二醇制备的聚合物叫聚 (对苯二甲酸乙二酯),由己二胺和己二酸反应 制备的叫聚己二酰已二胺等等。 有一些聚合物结构中已看不出单体来源了。更 需要由聚合物的结构特征命名,
称呼,并能与应用联系在一起。 例如: 聚甲基丙烯酸甲酯-----有机玻璃,
塑料类聚合物---酚醛树脂,脲醛树脂,醇酸树脂。 有时也将聚氯乙烯-------俗称氯乙烯树脂。
将橡胶类聚合物---------加上后缀“橡胶”, 例如: 丁二烯和苯乙烯共聚物--------丁苯橡胶,
丁二烯和丙烯腈共聚物-------丁腈橡胶, 乙烯和丙烯共聚物-------乙丙橡胶等等。
而像尼龙一66,聚对苯二甲酸乙二醇酯等的线型 高分子,其主链骨架原子还含有非碳原子又称杂 链高分子:
O
O
[ NH
(
CH2
)
6
NH
C ( CH2 )4 C ]n
尼龙-66
OO
[ O CH2 CH2 O C
C ]n
聚对苯二甲酸乙二醇酯
线型高分子通常是指可溶解在溶剂中的,固态时能 够是玻璃态的热塑性塑料,有的聚合物在常温下呈 柔顺性材料,也有的是弹性体。
聚亚苯基苯并二恶唑
HO OH
+ HOOC
COOH
HClH2N NH2HCl
[
O N
O N
]n
聚亚苯基苯并二噻唑
HS HClH2N
NH2HCl
+ HOOC
SH
华东理工大学《物理化学》课件2.11 热力学第三定律

c 106 / J K 3 mol 1
CO(g)
-110.525 197.674 29.16 30.46 32.59 28.70
0.14 4.64
H2O(g)
-241.818 188.825 33.60 36.32 39.96 31.80
4.47 5.10
CO 2(g)
-393.509 213.74 37.20 47.32 52.97 22.59 56.15 -24.85
298.15K和1000K时的
、
r
H
om
r Smo-
和
。 rGmo-
解:由附录查得f源自Hom/kJ
mol
1
Smo- / J K 1 mol 1
C
op,m
(300K
)
/
J
K
1
mol
1
C
op,m
(600K
)
/
J
K
1
mol
1
C
op,m
(900K
)
/
J
K
1
mol
1
a / J K 1 mol 1
b 103 / J K 2 mol 1
r
H
om
T r Smo-
标准摩尔生成吉氏函数
定义:由最稳定单质生成某物质B的标摩 尔反应吉氏函数,符号用 fGmo- (B) 。
CO
O 1
rGmo
22
CO 2
1 2
O2+
O
+
2
C
CO 2
f Gmo
rGmo
CO
f Gmo
C
基准
华东理工 物理化学 第一章2

关于状态函数和过程变量的区别:
状态函数仅由系统的状态决定,其变化
仅与初终状态有关,与具体过程无关,可以
用全微分表示(dX)。
过程变量既与系统的初终状态有关,还
与具体过程有关,不能用全微分表示(dQ)。
3. 可以直接观察或测量的四个基本的 状态函数
◆ 压力 p ——作用于单位面积上的法向力。 单位:Pa 1atm=101325Pa ◆ 体积 V ——物质所占据空间的大小。 单位:m3 ◆ 温度 T ——物质冷热程度的度量。 热力学温标 单位:K(开尔文,简称开)
化学平衡-化学反应达到平衡,没有由于化 学反应而产生的系统组成随时间的变化。 恒温 T=T环=常数 恒压 p=p外=常数
状态函数——由平衡态单值决定的那些
性质,统称为状态函数。 状态函数的基本特征:
状态一定,状态函数的量值也一定;
如果状态发生变化 ,则状态函数量值的 变化仅决定于系统的初态和终态 ,与所 经历的具体过程无关。
(1) 封闭系统——有能量得失,无物质进出
(2) 敞开系统——有能量得失,有物质进出 (3) 孤立系统——无能量得失,无物质进出
封闭系统
W
Q
气体
敞开系统
进料
W+Q
出料
孤立系统
杜瓦瓶(绝热装置)
杜瓦瓶加入NaOH溶液和含HCl的玻璃球,当打 破玻璃球时,将发生中和反应。
2. 状态和状态函数
状态——系统一切性质的总和 平衡态和非平衡态
理想气体状态方程 pV=nRT
2 n a 范德华方程 p 2 (V nb) nRT V
思考题: 对于A-B二元系,状态方程式如何写?
纯物质
V V ( p, T , n )
华东理工大学《物理化学》课件4.1 两组分气液相图

2
f 22101 (T恒定)
L a LV
x3 x2 x1
y3
y2 y1
bV
xo
A-B二组分液态混合物恒温减压过程的变化
2.理想混合物的恒压相图 液相线(泡点线) 气相线(露点线) 液相面 气相面 气液共存面
C6H5CH3(A)——C6H6(B)
2.理想混合物的恒压相图
液相线(泡点线) 气相线(露点线) 液相面
nV nL
xo xL yV xo
ox yo
m1
m2
L1
L2
m2 L1 m1 L2
(A)甲苯—苯(B)
例 如有200molxB=0.500mol的C6H5CH3(A) —C6H6(B)混合 物,当压力为101.325kPa, 温度为95.3℃时,试计算闪蒸后
气液两相的数量。
解: 总组成点即图4–2的o点,由 图读得yV=0.621,xL=0.400,代入 式(4–1),
液相线:p ~ x,恒 温下蒸气压随液相组 成的变化。对理想溶 液来说是直线。
液相线
C6H5CH3(A)——C6H6(B)
1.理想混合物的恒温相图
pA p(1 yB ) pA* (1 xB )
pB pyB pB* xB
p pA* xA pB* xB
yA
yB
pA* pB* pB* ( pB* pA* ) yB
b
x2
y2 y1
x1
气相面
a
气液共存面
A-B二组分液态混合物恒压升温过程的变化
理想混合物的恒温相图
L+V L
V
恒压相图
C6H5CH3(A)——C6H6(B) C6H5CH3(A)——C6H6(B)
f 22101 (T恒定)
L a LV
x3 x2 x1
y3
y2 y1
bV
xo
A-B二组分液态混合物恒温减压过程的变化
2.理想混合物的恒压相图 液相线(泡点线) 气相线(露点线) 液相面 气相面 气液共存面
C6H5CH3(A)——C6H6(B)
2.理想混合物的恒压相图
液相线(泡点线) 气相线(露点线) 液相面
nV nL
xo xL yV xo
ox yo
m1
m2
L1
L2
m2 L1 m1 L2
(A)甲苯—苯(B)
例 如有200molxB=0.500mol的C6H5CH3(A) —C6H6(B)混合 物,当压力为101.325kPa, 温度为95.3℃时,试计算闪蒸后
气液两相的数量。
解: 总组成点即图4–2的o点,由 图读得yV=0.621,xL=0.400,代入 式(4–1),
液相线:p ~ x,恒 温下蒸气压随液相组 成的变化。对理想溶 液来说是直线。
液相线
C6H5CH3(A)——C6H6(B)
1.理想混合物的恒温相图
pA p(1 yB ) pA* (1 xB )
pB pyB pB* xB
p pA* xA pB* xB
yA
yB
pA* pB* pB* ( pB* pA* ) yB
b
x2
y2 y1
x1
气相面
a
气液共存面
A-B二组分液态混合物恒压升温过程的变化
理想混合物的恒温相图
L+V L
V
恒压相图
C6H5CH3(A)——C6H6(B) C6H5CH3(A)——C6H6(B)
华东理工大学《物理化学》课件15.4 拉普拉斯方程、开尔文方程

§15-4 拉普拉斯方程
一、存在弯曲界面时的力平衡条件
纯物质液滴于恒容、恒温下 达到气液平衡。(纯物质的
目的在于保持 不变,且
ni( ) 0)
p( )
p( )
dAs dV ( )
Laplace方程
此方程并不受推导时恒容条件的限制
讨论:气体中的液滴:
As 4π r 2 , dAs 8π rdr
2
2 cos 纯物质的饱和蒸气压将
产生影响。即液体半径r
与其饱和蒸气压存在一 定的依赖关系。
1.液体的饱和蒸气压随液体压力的变化
(g) T , p
(g) T , p
(l) T , p
(l) T, p(l)
(g) T, p ' (g) T , p (l) T, p(l) (l) T, p
(4)液体中的气泡
弯曲液面对液体饱和蒸气压 的影响,其实质是液体压力 对液体饱和蒸气压的影响。
平面液体中的气泡
pg pl 2 / r p 2 / r p总
(5)微小晶体的熔点 开尔文方程也可用于计算微小晶体的饱和蒸气压。
3.亚稳状态
(1)过饱和蒸气
pr p , 加入凝结核心。
(2)过热液体 pr p外 2 / r 不能满足,加入气化核心。
T2 T1
vap H m
1 298.15
8.3145 0.1048 44.01 103
K
1
3.3342 103 K 1
T2 299.92K T T2 T1 1.77K
(3)过冷液体 微小晶体的饱和蒸气压大于一般晶体的饱和
蒸气压,加入凝固核心。 (4)过饱和溶液 微小晶体的饱和蒸气压大于一般晶体的饱和
蒸气压,加入凝固核心。
一、存在弯曲界面时的力平衡条件
纯物质液滴于恒容、恒温下 达到气液平衡。(纯物质的
目的在于保持 不变,且
ni( ) 0)
p( )
p( )
dAs dV ( )
Laplace方程
此方程并不受推导时恒容条件的限制
讨论:气体中的液滴:
As 4π r 2 , dAs 8π rdr
2
2 cos 纯物质的饱和蒸气压将
产生影响。即液体半径r
与其饱和蒸气压存在一 定的依赖关系。
1.液体的饱和蒸气压随液体压力的变化
(g) T , p
(g) T , p
(l) T , p
(l) T, p(l)
(g) T, p ' (g) T , p (l) T, p(l) (l) T, p
(4)液体中的气泡
弯曲液面对液体饱和蒸气压 的影响,其实质是液体压力 对液体饱和蒸气压的影响。
平面液体中的气泡
pg pl 2 / r p 2 / r p总
(5)微小晶体的熔点 开尔文方程也可用于计算微小晶体的饱和蒸气压。
3.亚稳状态
(1)过饱和蒸气
pr p , 加入凝结核心。
(2)过热液体 pr p外 2 / r 不能满足,加入气化核心。
T2 T1
vap H m
1 298.15
8.3145 0.1048 44.01 103
K
1
3.3342 103 K 1
T2 299.92K T T2 T1 1.77K
(3)过冷液体 微小晶体的饱和蒸气压大于一般晶体的饱和
蒸气压,加入凝固核心。 (4)过饱和溶液 微小晶体的饱和蒸气压大于一般晶体的饱和
蒸气压,加入凝固核心。
华东理工大学《物理化学》课件15.9 表面活性剂、兰缪尔吸附等温式(新)
铺展润湿过程
G As 液,固 气,液 气,固 def 液,固 气,液 气,固 G / As
4.不溶性单分子膜
(1)-As关系
膜天平示意图
(2)LB膜
(3)双层膜和囊泡
X膜 Z膜 Y膜
(4)膜的表面结构
18-Ar-18,2Br-1的LB膜 的AFM图象
尺度/
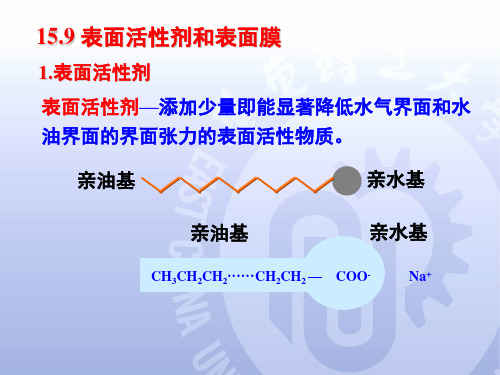
在水溶液中 亲水基团为 阴离子,主 要有:羧酸 盐,硫酸酯 盐,磺酸盐 磷酸酯盐、 脂肪酰-肽 缩合物等。
在水溶液中 亲水基团既 有阳离子, 主要为铵盐 和季铵盐又 有阴离子, 如羧酸盐, 硫酸酯盐, 磺酸盐等。
在水溶液中 不电离,主 要由聚环氧 烷基构成, 还有一部分 多醇为基础 结构。
2.胶束和临界胶束浓度
尔吸附等温式中的吸附系数b;(2) CHCl3(g)的平衡压力为
6.667kPa时的吸附量 (STP)。(3) 如何用作图法检验此吸附是
否确属兰缪尔吸附。
解: (1)
bp 1 bp
b
p
82.5
13.375 93.8
82.5
k
Pa1
0.546 kPa1
例:在273.15 K时测定吸附质 CHCl3(g)在活性炭上的吸附作 用。当 CHCl3(g) 的平衡压力为13.375 kPa 及吸附达饱和时, 每克活性炭吸附 CHCl3(g) 的量分别为82.5 cm3 (STP)和93.8 cm3 (STP)。设该吸附服从兰缪尔吸附等温式,试求:(1) 兰缪
"for his discoveries and investigations in surface
chemistry”
1903年毕业于哥伦比亚大学矿业学院。留学德 国,师从能斯特。1906年获哥丁根大学博士学 位。
华东理工大学《物理化学》课件16.5 电解质溶液的传递性质

解:
阴极:Au 3 3e Au(s)
阳
极
:3 H 2
2O
3e
3 4
O2 (g)
3H
z
3,Au
,
3 4
O2
t Q 1763 s 7.05 104 s I 0.025
例:用强度为0.025A的电流通过硝酸金(Au(NO3)3) 溶液,当阴极上有1.20gAu(s)析出时,试计算:(a)
H3O+与OH-的导电机理
影响因素 离子浓度、其它离子种类、温度
17
2.离子迁移数
t
def
I I I
def
Q Q Q
t def
I I I
def
Q Q Q
t t 1
迁移数与电迁移率的关系
t
u u u
t
u u u
18
迁移数的实验测定 (1)希托夫法
n电解后 n电解前 n电极反应 n迁移
Λm v z u v z u F v z u u F
u
t (u
u )
t m vzF
u
t (u
u )
t m v z F
31
由摩尔电导率求解离度
Λm v z u v z u F v z u u F
Λm
vz
u
u
F
如忽略 u 、u 与 u 、u 的差别
n迁移 1.391103mol 1.00810-3mol 0.723103mol 0.340103mol
n 迁移是负值,说明电解中 Ag+是迁出阳极的,它的绝对值正
比于 Ag+担负的电量。
银库仑计沉积出 0.723103mol 的 Ag,正比于总电量。
阴极:Au 3 3e Au(s)
阳
极
:3 H 2
2O
3e
3 4
O2 (g)
3H
z
3,Au
,
3 4
O2
t Q 1763 s 7.05 104 s I 0.025
例:用强度为0.025A的电流通过硝酸金(Au(NO3)3) 溶液,当阴极上有1.20gAu(s)析出时,试计算:(a)
H3O+与OH-的导电机理
影响因素 离子浓度、其它离子种类、温度
17
2.离子迁移数
t
def
I I I
def
Q Q Q
t def
I I I
def
Q Q Q
t t 1
迁移数与电迁移率的关系
t
u u u
t
u u u
18
迁移数的实验测定 (1)希托夫法
n电解后 n电解前 n电极反应 n迁移
Λm v z u v z u F v z u u F
u
t (u
u )
t m vzF
u
t (u
u )
t m v z F
31
由摩尔电导率求解离度
Λm v z u v z u F v z u u F
Λm
vz
u
u
F
如忽略 u 、u 与 u 、u 的差别
n迁移 1.391103mol 1.00810-3mol 0.723103mol 0.340103mol
n 迁移是负值,说明电解中 Ag+是迁出阳极的,它的绝对值正
比于 Ag+担负的电量。
银库仑计沉积出 0.723103mol 的 Ag,正比于总电量。
华东理工大学《物理化学》课件4.5 两组分液固相图

开始析出Sb
L Sb Sa
SaSb
开始析出Sa 液相消失 的降温
t(时间)
液 相 完 全 互 溶 , 固 相 完 全 互 溶
液 相 完 全 互 溶 , 固 相 部 分 互 溶
液 相 完 全 互 溶 , 固 相 完 全 不 互 溶
液 相 部 分 互 溶 , 固 相 完 全 不 互 溶
L+SA SA+SC1
V i
L i
pyAA pA* xA A
pyBB K Hx,B xB x,B
理想气体
i 1
理想稀溶液
A=1 x,B=1
1. 多组分系统的气液平衡
V i
L i
pyAA pA* xA A
pyA pA* xA
pyBB K Hx,B xB x,B
pyB K Hx,B xB
2. 多组分系统的液液平衡和液固平衡
3.固相完全不互溶且生成化合物的系统
稳定化合物 A:四氯化碳 B:对二甲苯
3.固相完全不互溶且生成化合物的系统
稳定化合物 A:四氯化碳 B:对二甲苯
L SA L SC1 SA SC1
L
水硫酸二元系相图
L SC1 L SC2
SC1+SC2
不稳定 化合物
SC S A L1 f 0
CaF2(A) CaCl 2(B) 相图
B
333
46.8
B
343
47.8
B
353
48.8
B
363
49.8
B
373
50.8
B
382
51.8
B
相图绘制——溶解度法
2.液相完全互溶固相完全不互溶的两组分系统
华东理工大学《物理化学》课件5.1 平衡常数

5.1 引言
◆ 化学平衡 当化学反应达到极限,宏观上 长时间没有发生变化(系统中反应物和产 物的种类和数量上不随时间改变),系统 即处于化学平衡状态。 化学平衡研究就是要找出平衡时温度、压 力与系统组成的关系。
证明平衡常数的存在; 建立由热性质数据计算平衡常数的方法。
Le Chatelier 原理
(2)
0
1 2
N2
3 2
H2
NH 3
(3) 0 2NH 3 N2 3H2
rGmo (2) rGmo (3)
rGmo (2)
1 2
r
G
o m
(1)
K o (2) K o (1)1/ 2
RT ln K (2) RT ln K (1) / 2 RT ln K (1) 1 2
降为10.13kPa;(3)在原料气中掺入水蒸气,C6H5C2H5 与H2O的数量比为1:9,总压仍为101.325kPa。
解: C6H5C2H5 C6H5C2H3 H2
初始 1mol
0
0
平衡 (1-α)mol
αmol
αmol
(1)
p
B
B
a2
1
101.325kPa
K p K n
B'
nBeq'
量,其中还包括所有不参加反应的惰性气体,它们在反
应的计量方程中的化学计量数为零,因而对 无贡献B。 B
(1) 计算理论转化率 (a)
例1 乙烯水合制乙醇,C2H4+H2O=C2H5OH,在200℃时,K f
=0.240×10-3
kPa-1,试求该温度下压力为3.45MPa时的
K
,
p
并计算乙烯与水蒸气配料比为1:1(物质的量之比)时,乙烯的
华东理工大学物理化学第三章2-2

X i 1 ni X i
K
X dT dp p p,n j T ,n j
K i 1
X i dni
一定温度、压力下并保持各物质相 对数量不变,积分得:
X dX
0 K
X
ni
0
K i 1
X i dni i 1 X i dni i 1 X i dni
V nAVA nBVB
VA (V nBVB ) / nA {(18.0152/ 1000)[1002.935 51.832nB / mol 0.1394( nB / mol) 2 ( nB / mol)(51.832 0.2788nB / mol)]}cm 3 mol1 [(18.0152/ 1000)(1002.935 0.1394( nB / mol) 2 ]cm 3 mol1 [18.0681 0.00251 ( nB / mol) 2 ]cm 3 T , p
Xi 和Xi* 都是1mol物质 i 对 X 的贡献
1mol 物 质 i 对 混合物系统 X
1mol 物 质 i 对
纯组分系统 X
的贡献。
的贡献
以体积V 代替X 进行说明 (1)在20℃、101325Pa下, H2O(A)与
C2H5OH(B)混合
Xi 是在系统恒定 T, p 和其它物质的量时,改 变1mol i 物质引起的系统广延性质 X 的变化。
X X i n i
def
T , p , n j i
Xi 是一个状态函数,强度性质
X X (T , p, n1 , n2 , , nK )
X X (T , p, x1 , x2 , , x K 1 , n)
华东理工大学《物理化学》课件1.3 物质的pvT关系和相变现象

定义波义耳温度TB :
Z p
T , p0
0
波义耳温度是物质(气体)的一个特性 Z 大,气体难压缩;Z 小,气体易压缩 波义耳温度高,气体易液化
1.4 包括流体相和固相的状态图 和相图
1.包括流体相和固相的状态图
/s/1bpNqJX9
1.包括流体相和固相的状态图
V
2.气液相变
l
l
kj
i
h
ijk-相平衡,气体凝结趋
势与液体挥发趋势相当
pijk-饱和蒸气的压力,
kj
液体的饱和蒸气压 饱和液体
饱和蒸气
i h
★流体pV图恒温线上的水平线段是存在气液相变 化的特征
3.饱和蒸气与饱和液体性质随温度变化
kci—双节线,气液共存
区的边界线
ck—饱和液体线, p*~V m(l)
水的相图
oa-水的气液平衡线;水的饱
和蒸气压随温度的变化; 水的沸点随压力的变化
ob-水的气固平衡线;冰的饱
和蒸气压随温度的变化
oc-水的液固平衡线;水的冰
点随压力的变化
o (oa,ob,oc 三线的交点)-水的三相点
★如果系统中存在互相平衡的气液固三相,它的 温度与压力是唯一的, p=610.5Pa (4.579mmHg), t=0.01℃
1.3 流体的状态图,气液相变和 临界现象
1.流体的状态图 理想气体
★分子之间假设没有相互作用(吸引和排斥)
★分子本身没有体积。 pV = nRT
Boyle 定律 Gay Lussac定律 Avogadro定律
恒温面 恒压面
恒压线 恒温线
理想气体的pV图、pT图 、VT图
()T
()V
华东理工大学《物理化学》课件2.6 亥氏函数吉氏函数,热力学基本方程

dAT ,V d-W dAT ,V d-W R
AT ,V W AT ,V WR
不可逆程度
dAT ,V d-W
返回章首
不做非体积功时
W 0
dAT ,V ,W 0 0
dAT ,V ,W 0 0 AT ,V ,W 0 0
恒温恒容不做非体积功时,亥氏函数在可逆 中不变,在不可逆过程中减小,亥氏函数增大则是 不可能的。
不可逆程度
dAT ,V ,W 0
4.恒温恒压过程
T环dS d-Q 0
d-W d-W pdV d-W d( pV )
TdS dU d( pV ) d-W 0
dGT , p d-W 0
dGT , p d-W GT , p W dGT , p d-W R GT , p WR
T
p U A V S V T
S A G T V T p
返回章首
吉布斯–亥姆霍兹方程
(A/T) T V
U T2
,
(A/T)
(1/ T )
V
U
(G / T T
)
p
H T2
,
(G / T )
(1/T )
p
H
返回章首
4. 麦克斯韦关系式
dH
H S
dS p
H p
S
dp
dA A dT A dV
T V
V T
dG
G T
p
dT
G p
T
dp
dU TdS pdV dH TdS Vdp dA SdT pdV dG SdT Vdp
T U H S V S p
V
H p
S
G p
dZ MdX NdY
物理化学 华东理工第三章1-1

V
0
VBdnB
0
VAdnA nBVB nAVA V
(3)集合公式
X dX T X dT dp p p,n j T ,n j
K n i K i 1 0 1 i i
K i 1
X i d ni
xB=0.207
def
X n i
T , p,n j i
V
V dn
0 B
1
B
VB
( 2 )一定状态、一定浓度 xB 的溶液,可视
为是以A和B的比例等于溶液浓度的混合方式
同时加入的。
0.207mol B
0.793mol A
xB=0.207
0.207 0.793
以体积V 代替X 进行说明 (1)在20℃、101325Pa下, H2O(A)与
C2H5OH(B)混合
若体积具有加和性,则:
id * * * * * Vm x AVA xBVB (VA VB ) x A VB ~ y kx b
id 实际: Vm Vm
( 2)在 20℃ 、 101325Pa下,不断将 C2H5OH(B) 加入10 mol H2O(A)中 若体积具有加和性,则:
dGi = -Si dT + Vi dp
如:H i U i pVi
Ai U i TSi
G / p T ,n
V Vi n i
j
V
T , p ,n ji T ,n j
G / p T ,n j ni T , p ,n ji G i p T ,n j
华东理工大学《物理化学》课件17.3 电化学系统的热力学

1.标准氢电极(SHE)
H
(
a H
)
e
1 2
H2(
p)
能否测定单个电极 的界面电势差
氢电极
氢电极符号 H (aq) | H 2 | Pt 或 H (aq) | H 2 , Pt
标准氢电极 pH2 po 0.1MPa 2.电极反应的标准电势
) 标准氢电极|| 指定电极(
aH 1
电极反应的电势 E
当物质B在、 两相中分配,
~B ~B
开路下的电化学平衡
dU dQR dWR TdS pdV dAs
K ~ ( )
比较 dU TdS pdV
i dni( ) dAs
得
K ~ ( )
1 i1
~ ( )
i dni( ) 0 或
B B 0
1 i1
1 B
瓦尔特 海曼 能斯特
4.电池反应电势的温度系数
(G/T)p =S
E 1 rGm r Sm T p zF T p zF
G Η TS
Δr Hm
zF E
T
E T
p
由电动势法测定所得的摩尔反应焓与量热法所得的比较
反应
Ag
1 2
Hg 2 Cl 2
AgCl
Hg
Pb 2AgCl PbCl2 2Ag
dU dQR dWR TdS pdV dAs zFEd
K ( )
比较 dU TdS pdV
~ i dni( ) dAs
1 i1
K ( )
得
~ i dni( ) dW电' R zFEd
1 i1
( )
或
B ~ B W电' R zFE
华东理工大学《物理化学》课件7.1 简单级数反应

Ⅰ.化学动力学基本原理
7.2 化学反应的速率
0
B
B
B
d B1dnB
转化速率 反应速率
(V 恒定)
def d 1 dnB dt B dt
def 1 d 1 dnB V dt V BV dt
def 1 dcB cB dV B dt BV dt 1 dcB B dt
• 分级数
, , ,
• 反应级数 n
A = kAcAcB cC
P
=
k
P
c
A
cB
cC
k = - kA kP
A P
(2)非幂函数型速率方程
kcAcB 1 k' cA' cB '
k、k’ —速率方程系数
7.4 反应速率方程的积分形式
间歇式反应器(V 恒定)
v 1 dcB ,
半衰期与cA0 成正比,与
kA 成反比。t1/ 2
cA0 2kA
2.一级反应(n=1)
aA bB pP
速率方程
A
dcA dt
kAcA
dx dt
kA cA0
x
速率方程的积分形式
cA cA0
1 cA
dcA
t
0 kAdtБайду номын сангаас
ln{cA } ln{cA0 x} kA t ln{cA0 }
kA
速率系数的值与浓度单位无关。
半衰期与kA 成反比,与cA0
无关。t1/ 2
ln 2 kA
一级反应 (CH 3 )3 CBr H 2O (CH 3 )3 COH HBr
叔丁基溴在丙酮和水的混合溶剂(含水10%)中 水解生成叔丁醇的动力学实验结果
华理物化ppt chap1(1-2)

相——系统中具有完全相同的物理性质和化学 组成的均匀部分。 组成的均匀部分。 单相系统:系统中只有一个相时称为单相系 单相系统: 或称均相系统 均相系统。 统,或称均相系统。 多相系统: 多相系统:系统中有两个或两个以上的相共 存时称为多相系统。 存时称为多相系统。
返回章首
相、相变化、相平衡、饱和蒸气 压
6
逻辑框架:
三个层次:宏观层次、从微观到 宏观层次、微观层次 两个部分:普遍规律、物质特性 三种方法:实验方法、经验半经 验方法、理论方法
7
8
9
10
该实例涉及到《物理化学》的所有问题: 该实例涉及到《物理化学》的所有问题: 1.物料计量和输送
2.分离——精馏、吸收、萃取 3.反应——反应器、裂解炉、电解槽
决定物质聚集状态的两个因素
物质分子的运动:平动、转动、振动 平动、转动、 平动 ~无序热运动 物质分子间的作用:色散力、偶极力、 色散力、偶极力 色散力 诱导力、氢键 电荷转移、电子云斥力 氢键、电荷转移 诱导力 氢键 电荷转移 电子云斥力 ~使分子有序排列
两类最基本的宏观平衡性质
关系,即一定数量物质的压力、 ◆ pVT 关系,即一定数量物质的压力、体积 和温度间的依赖关系。 和温度间的依赖关系。 热性质,主要是热容、相变焓、生成焓 ◆ 热性质,主要是热容、相变焓、生成焓、 燃烧焓、熵等。 燃烧焓、熵等。
返回章首
状态函数:由状态单值决定的系统性质。 状态函数的基本特征:系统的状态一定,状 态函数的值一定。如果状态发生变化,则状 态函数的变化值,仅决定于系统的初终状态 而与过程无关。 例如: 都是状态函数。 例如:p , V,T 都是状态函数。 Q , W 是过程变量。 是过程变量。
状态函数的数学特征: Z 是状态函数,且 Z = f (x, ) y 则dZ 是全微分 dZ = pdx +Q y d
华东理工大学《物理化学》课件7.9 动力学实验方法
lg0.59 lg58.0
0.29 41.7
2.1
n 2 ,为二级反应。若以 lgA对 lgcA作图,应得直线,
其斜率即为 n,截距为 lgkA。对于本题 cA pA / RT ,作
图可得, n 2.0 , kA 0.85dm3 mol1 min1 。
速率方程为
A
0.85dm 3
mol 1
aA bB pP
Y
t 0 : cA0
cB0
0
Y0
bp
tt:
cA0 x
cB0 a x
x a
Yt
t : 0
cB0
b a
cA0
p a cA0
Y
任一时刻 Y=YM+YA+YB+YP Y—某物理量,YM —反应介质等对Y的贡献。
如果各物质对Y的贡献分别与它们的浓度成正比:
t 0: t t: t :
后,得出结论。 2.作图法:是否满足图的特征,得出结论。
例 过氧化二叔丁基在气相分解。 (CH3 )3COOC(CH 3 )3 C2H6 2CH3COCH 3
在恒容的等温反应器中,充以纯过氧化二叔丁基, 系统的总压随着反应的进行而增加。在不同时间 测得系统的总压数据如表所示,求反应级数和速 率系数。
n
lg A1 lgcA1
A2 cA2
(1)初速率法
所得级数常用nc表示,称为真级数。
(2)一次法
lgA nlgcA lgkA
所 得 级 数 常 用 nt 表 示 。 如 nt>nc , 预 示 产 物对反应有阻滞作用, 如nt<nc ,预示产物有 加速作用,即自催化反应。
(3)孤立变数法 A kAcAcB
华东理工大学《物理化学》课件15.6-吉布斯吸附等温式、杨氏方程

c2
/ c2
T
RT bc2
RT
在稀溶液范围内
Γ
(1) 2
与
c
2
成正比关系。
例 2 在浓度较大时,下列经验方程能较好地表示溶 液的气液界(表)面张力与浓度的关系:
A Blnc2 ,A、B 为常数。试导出吸附与温
度浓度的关系式。
解: c2 B c2
(1) 2
c2 B / c2
恒温下水溶液表面张力
与浓度c2的关系
丁酸水溶液和NaCl水溶液 的气液界面张力随液相组
成的变化
丁酸水溶液和NaCl水溶 液的吸附等温线
例 1 在稀溶液范围内,气液界(表)面张力与体相浓 度间一般存在如下的线性关系: bc2 ,试导 出单位界面吸附量随浓度的变化。
解:
c2
T
b
(1) 2
• 这种方法所需仪器简单,测定结果也较精确,一 般可达到千分之几,而且实验条件可严格控制。 由于测定时是将毛细管内的弯月面当作球面的一 部分,最好接触角为零,否则由于接触角的滞后 作用,难得到准确结果。
• 另外,管内径须洁净,但对毛细孔截面形状要求 不严格。碱性溶液对玻璃毛细管有一定的腐蚀性。 因此,此法在实际应用中受到一定的限制。
NH4Cl、KNO3等无机
盐类,以及蔗糖、甘露
醇等多羟基有机物。
(2)曲线B:
c2
T
0
恒温下水溶液表面张力
与浓度c2的关系
Γ (1) 2
0
正吸附
醇、醛、酮、羧酸、酯等有机物—表面活性物质。
(3)曲线C:
c2
T
0
Γ (1) 2
0
正吸附
肥皂、8碳以上直链有机 酸的碱金属盐、高碳直链
