应用电化学期末复习试题.doc
应用电化学复习题

山东理工大学成人高等教育应用电化学复习题一、填空题1. 相转移的电解法:在有利于电解进行的相中进行反应,生成物进入另外一相。
2. 氯碱工业:电解氯化钠水溶液生产得到烧碱、氯气、。
目前存在三种电解生产方法,三种方法分别采用不同的电解槽:、和。
是最新的一种,已经基本取代另两种电解槽。
3. 化学电源(battery,化学电池,电池):将氧化—还原反应的直接转变为的装置。
4. 电镀一般分为、、和熔盐电镀等几种类型。
5. 电化学体系借助于实现电能的输入或输出,是实施电极反应的场所。
6. 通常用、或等隔离两电极区的溶液,以减少辅助电极上的反应对干扰。
7.在测量工作电极的电势时,参比电极内的溶液和被研究体系的溶液组成往往不一样,为降低或消除液接电势,常选用; 为减小未补偿的溶液电阻,常使用。
8.化学电源的分类:从工作性质和储存方式,分为、、、和四大类。
9. 电化学工业上使用的隔膜一般可分为和两种。
10.化学电源的组成:由正、负极和及和外壳等组成。
一次电池主要包括:、、锌银电池、锂一次电池、锌空气电池等。
11.二次电次又称,在充放周期内可反复充电使用。
主要包括:、、、、锌卤素电池等。
12.电化学热力学研究的是电化学反应的-----的关系,研究与的相互转换。
13.电化学过程中,界面张力和表面吸附的影响因素:、、、和外电势。
第1页共5页14.界面张力与电极电势之间存在一定的依赖关系为曲线。
二、简答题1. 简述双电层理论概要2.何为“零电荷电势”?3. 简述双电层理论概要4.简述电极反应种类和机理:5.简述电催化的类型6.何为缓蚀剂?说明其防蚀机理。
三、论述题1.金属电沉积过程中表面活性物质的作用。
2. 何为缓蚀剂?说明其防蚀机理。
3. 试从阳极保护和阴极保护论述电化学防腐的方法4.试举例论述氯酸盐和高氯酸盐的电合成过程及原理。
第2页共5页参考答案:一、填空题1.电合成2. 氢气离子膜槽隔膜槽汞槽离子膜槽3. 化学能电能4.单金属电镀、合金电镀、复合电镀5.电极电极6. 烧结玻璃、多孔陶瓷或离子交换膜工作电极7. 盐桥鲁金(Luggin)毛细管8. 一次电池或原电池(primary battery)、二次电池或可充电电池、蓄电池(secondary battery, rechargeable battery)、储备电池(storage battery)和燃料电池(fuel cell)9. 多孔膜离子交换膜10. 隔膜及电解液普通锌锰电池(中性锌锰电池)、碱性锌锰电池11. 蓄电池铅酸蓄电池、镉镍电池、钠硫电池、Ni-MH电池、12. 方向和限度-----电动势和Gibbs自由能化学能与电能13. 温度、界面物质的性质、溶液组成、双电层14. 电毛细二、简答题1. 电极与溶液界面的双电层由若干假想的层组成内层: 靠近电极表面的一层,由被吸附粒子和溶剂分子组成.--- 对于水溶液,由于水的强极性,实际上最靠近电极的是水分子形成的偶极层,然后才是水化离子形成的剩余电荷层扩散区: 由于电场的作用,有一个处于高浓度双电层和溶液本体之间的区域,这个区域内的溶质浓度呈现梯度变化溶液本体: 这部分粒子浓度均一,溶液处于均相状态2. 可以由毛细曲线中任意一点上的斜率求出该电极电势下的表面电荷密度q。
应用电化学复习题(整理)

应用电化学复习题1.在其它条件不变时,电解质溶液的摩尔电导率随溶液浓度的增加而( )(A) 增大(B) 减小(C) 先增后减(D) 不变2.在298K的含下列离子的无限稀释的溶液中,离子摩尔电导率最大的是( )(a)A13+(b)Mg2+(c)H+(d)K+3.298K时,有浓度均为0.001mol·kg-1的下列电解质溶液,其离子平均活度系数最大的是( )(a) CuS04(b) CaCl2(c) LaCl3(d) NaCl4.298K时有相同浓度的NaOH(1)和NaCl(2)溶液,两个Na+的迁移数t1与t2之间的关系为( )(a) t1 = t2(b) t1 > t2(c)t1 < t2(d)无法比较5.NaCl稀溶液的摩尔电导率Λm与Na+、、C1-的淌度U+、U-之间关系为( )(a)Λm= U+ + U- (b)Λm=U+/F + U—/F(c)Λm= U+F + U-F (d)Λm= 2 (U+ + U-)6.Al2(S04)3的化学势μ与Al3+、SO42-的化学势μ+,、μ-之间的关系为( )(a) μ = μ++μ-(b) μ =2μ++3μ-(c) μ =3μ++2μ-(d) μ = μ+· μ-7.298 K 时,在下列电池Pt│H2(p∃)│H+(a=1)‖CuSO4(0.01 mol·kg-1)┃Cu(s)右边溶液中加入0.1 mol·kg-1 Na2SO4溶液时(不考虑稀释效应), 则电池的电动势将:(A) 上升(B) 下降(C) 基本不变(D) 无法判断8.下列对原电池的描述哪个是不准确的:( )(A) 在阳极上发生氧化反应(B) 电池内部由离子输送电荷(C) 在电池外线路上电子从阴极流向阳极(D) 当电动势为正值时电池反应是自发的9.如下说法中,正确的是:( )(A) 原电池反应的∆H < Q p(B) 原电池反应的∆H = Q r(C) 原电池反应体系的吉布斯自由能减少值等于它对外做的电功(D) 原电池工作时越接近可逆过程,对外做电功的能力愈大10.若算得电池反应的电池电动势为负值时,表示此电池反应是:( )(A) 正向进行(B) 逆向进行(C) 不可能进行(D) 反应方向不确定11.当电池的电动势E=0时,表示:()(A) 电池反应中,反应物的活度与产物活度相等(B) 电池中各物质都处于标准态(C) 正极与负极的电极电势相等(D) 电池反应的平衡常数K a=112. 在电池中,当电池反应达到平衡时,电池的电动势等于:( ) (A) 标准电动势 (B) ln RTK zF $ (C) 零 (D) 不确定13. 等温下,电极-溶液界面处电位差主要决定于: ( )(A) 电极表面状态(B) 溶液中相关离子浓度(C) 电极的本性和溶液中相关离子活度(D) 电极与溶液接触面积的大小14. 某电池反应为 2 Hg(l)+O 2+2 H 2O(l)=2 Hg 2++4 OH -,当电池反应达平衡时,电池的 E 必然是: ( )(A) E >0 (B) E =E ∃ (C) E <0 (D) E =015. 测定溶液的 pH 值的最常用的指示电极为玻璃电极, 它是:( )(A) 第一类电极 (B) 第二类电极(C) 氧化还原电极 (D) 氢离子选择性电极16. 有三种电极表示式: (1) Pt,H 2(p ∃)│H +(a =1), (2)Cu │Pt,H 2(p ∃)│H +(a =1),(3)Cu │Hg(l)│Pt,H 2(p ∃)│H +(a =1),则氢电极的电极电势彼此关系为 :( )(A) 逐渐变大 (B) 逐渐变小(C) 不能确定 (D) 彼此相等 17. 对应电池Ag(s)|AgCl(s)|KCl(aq)|Hg 2Cl 2(s)|Hg(l)的化学反应是: ( )(A) 2Ag(s)+Hg 22+(aq) = 2Hg(l) +2Ag +(B) 2Hg+2Ag + = 2Ag +Hg 22+(C) 2AgCl+2Hg = 2Ag +Hg 2Cl 2(D) 2Ag+Hg 2Cl 2 = 2AgCl +2Hg18. 下列电池的电动势,哪个与Br -的活度无关:( ) (A) Ag(s)|AgBr(s)|KBr(aq)|Br 2(l),Pt(B) Z n(s)|ZnBr 2(aq)|Br 2(l),Pt(C) P t,H 2(g)|HBr(aq)|Br 2(l),Pt(D) Hg(l)|Hg 2Br 2(s)|KBr(aq)||AgNO 3(aq)|Ag(s)19. 298 K 时, 在下列电池 Pt │H 2(p ∃)│H +(a =1)‖CuSO 4(0.01 mol ·kg -1)│Cu(s)右边溶液中通入 NH 3, 电池电动势将:( )(A) 升高 (B) 下降 (C) 不变 (D) 无法比较20. 如果规定标准氢电极的电极电势为1V ,则可逆电极的电极电势Ф0值和电池的电动势E 0值将有何变化 ( )(a)E0,Ф0各增加1V (b)E0和Ф0各减小1V(c)E0不变,Ф0增加1V (d)E0不变,Ф0减小1V21.下列电池中,电动势与Cl-的活度无关的是 ( )(a).Zn(s)|ZnCl2(a)|Cl2(p0)|Pt (b).Zn(s)|ZnCl2(a1)||KCI(a2)|AgCI(s)|Ag(c).Ag(s)|AgCI|KCI(a)|CI2(p0)|Pt(d).Pt|H2(p0)|HCI(a)|Cl2(p0)|Pt22.某电池反应为2Hg(1)+02+2H2O(1)=2Hg2++40H-,当电池反应达平衡时,电池的E必然是 (a)E>0 (b)E=E0 (c)E<0 (d)E=023.金属与溶液间电势差的大小和符号主要取决于 ( )(a)金属的表面性质 (b)溶液中金属离子的浓度(c)金属与溶液的接触面积 (d)金属的本性和溶液中原有的金属离子浓度24.不能用于测定溶液pH值的电极是 ( )(a)氢电极 (b)醌氢醌电极 (c)玻璃电极 (d)CI-|AgCI(s)|Ag电极25.下列4组组成不同的混合溶液,当Pb(s)插入各组溶液时,金属Sn有可能被置换出来的是(已知Ф0 (Sn2+,Sn)=-0.136VФ0 (Pb2+,Pb)=- 0.126V ( )(a)a(Sn2+)=1.0,a(Pb2+)=1.0 (b)a(Sn2+)=0.1,a(Pb2+)=1.0(c)a(Sn2+)=l.0,a(Pb2+)=0.1 (d)a(Sn2+)=0.5,a(Pb2+)=0.526.常见的燃料电池为: Pt,H2(p1)|NaOH(aq)|O2(p2),Pt,设其电动势为E1,如有另一电池可以表示为:Cu(s)|Pt|H2(p)|NaOH(aq)|O2(p)|Pt|Cu(s),其电动势为E2,若保持各物质的活度相同,则E1与E2的关系为:()(A) E1>E2(B) E1<E2(C) E1=E2(D) 无法判断27.极谱分析仪所用的测量阴极属于下列哪一种?( )(A) 浓差极化电极(B) 电化学极化电极(C) 难极化电极(D) 理想可逆电极28.用铜电极电解CuCl2的水溶液,不考虑超电势,在阳极上将会发生什么反应。
应用电化学习题复习及答案

应用电化学复习题和习题答案第一章习题解答1.用Ag 做电极,AgNO 3溶液的浓度为0.00739g/g(水),通电一段时间后,阳极上有0.078gAg (s )析出,而阳极区内含0.236gAgNO 3和23.14g 水,求t (Ag +)和t (NO 3-)。
解:Ag →Ag ++e -Ag ++e -→Agn 原=23.4×0.00739/169=1.023×10-3mol n 析=0.078/107=7.29×10-4mol n 后=0.236/169=1.396×10-3mol n 迁=n 原+n 析-n 后=5.36×10-4t (Ag +)=n 迁(Ag +)/n 析=0.735 t(NO 3-)=1- t (Ag +)=0.2652.25℃时在电导池中盛有浓度0.02mol/dm ³的KCl 溶液,测得电阻为82.4Ω,若在同一电导池中盛有浓度为0.0025mol/dm ³的k 2SO 4溶液,测得电阻为326Ω,已知25℃时0.02mol/dm ³的KCl 溶液的电导率为0.2768 S/m ,试求(1)电导池常数(2)0.0025mol.dm ³的K 2SO 4溶液的电导率和摩尔电导率。
(1)K cell =K kcl /G kcl =K kcl ×R kcl =82.4×0.2768=22.81 (2)K K2SO4=K cell ×G K2SO4=K cell /R K2SO4=0.07 S/m ΛK2SO4=K K2SO4/C=28×10-3 S/(m ·mol)3. 25℃时AgCl 饱和溶液的电导率为3.41×10-4S/m ,已知同温下水的电导率为1.6×10-4S/m,计算25℃时AgCl 的溶解度。
2012、2013年第一学年应用电化学期末考试题

2012、2013年第一学年应用电化学期末考试题2012—2013年第一学年《应用电化学》期末考试题适用专业:应用化学一、填空题(共10题,每空1分,共30分)1、电化学研究对象应包括______________、___________、___________三部分。
2、构成原电池的必要条件①_____________(区别于一般电池)、②____________(区别于腐蚀电池)、③______________。
3、电极和溶液接触后,在电极和溶液的相界面会自然形成的双电层,这是电量相等符号相反的两个电荷层,双电层可分为____________、____________、____________。
4、电极过程的液相传质有_____________、____________、____________。
5、三电极两回路中的三电极分别是____________、____________、____________,两回路为极化回路(串联回路)和测量回路(并联回路)。
6、在生产实际中最常遇到的气体电极是____________、____________、____________。
7、化学电源通常分为四类分别是_____________、____________、____________、____________。
8、金属腐蚀按腐蚀机理可分为____________、____________、____________三大类。
9、电镀的主要作用是____________、____________、____________。
10、已知0.011-mol己二酸溶液的pH=____________,并计算在同一温度下?L0.11-mol己二酸溶液的pH=____________。
L二、选择题(共15题,每题2分,共30分)1、在电解时正极是__________,负极是__________;在原电池中正极是__________,负极是__________。
黄冈师范学院应用电化学期末复习题

黄冈师范学院应用电化学期末复习题应用电化学复习题①一、填空题。
(每空0.5分,共15分)1.电化学是研究_______和______之间相互转化过程有关规律的科学。
其中在三电极电化学体系中,三个电极分别对应_______、________和_______。
2.化学电源按照其工作性质和储存方式可以分为_______、_______、_______和________四大类。
3.电镀生产工艺流程一般包括_______、________和_______三大步。
4.电极反应的催化作用根据电催化剂的性质可以分为________和_______两大类5.某些腐蚀金属系统毋须外加电流,只要添加一些能促使______、形成_______或形成________的物质,就能降低_______,这些物质称为缓蚀剂。
6.电位型传感器通过测定______的值来确定物质的浓度。
7.槽电压由________、阴阳极_______、溶液电阻引起的_________及电解槽的各种_________组成。
8.与物理传感器不同,化学传感器的检测对象是________要求传感器的材料必须具有_________的功能。
9.氧气在不同电极上的电催化还原可能包括______和_____两种途径。
10.金属电沉积是指简单金属离子或络离子通过_____方法在固体(导体或半导体)表面上______为_______附属于电极表面,从而获得一金属层的过程。
二、单项选择。
(从下列各题四个备选答案中选出一个正确答案,并将其代号写在答题纸上。
每小题2分,共20分。
)1.以下哪一项不是影响电镀层质量的因素( )A.阳极B.阴极C.电镀工艺条件D.镀液的性能2.以下哪项不是评价电催化性能的方法( )A.热重分析法B.旋转圆盘电极伏安法C.计时电位法D.循环伏安法3.以下哪一项不是优良的电子传递媒介体应具有的性质( )A.能稳定吸附或滞留在电极表面B.与被催化的物质之间发生快速的电子传递C.呈现可逆电极反应的动力学特征D.对氧气具有反应活性。
广东石油化工学院14级《应用电化学》期末复习题

《应用电化学》复习题题一选择题1.下列哪一种放电条件对电池的放电容量和性能有利()A温度在20~40℃之间放电、间歇放电;B深度放电、高温放电;C连续放电、放电倍率较大放电;D低温放电、30%左右的额定容量放电。
2.单位质量或单位体积的电池所输出的电量(单位为A∙h∙kg-1或A∙h∙L-1)指的是电池的()A额定容量;B比容量;C放电倍率;D比能量。
3.对于可溶正极锂电池(如Li/SOCl2),其中可溶指的是()A Li可溶于溶剂中,形成有机电解液;B正极(SOCl2)可溶于溶剂中,形成有机电解液;C无机支持电解质可溶于溶剂中,形成有机电解液;D有机支持电解质可溶于溶剂中,形成有机电解液;4.燃料电池与一般电池的本质区别在于()A能量供给连续,燃烧和氧化剂由外部提供B能量转化效率高,低或零污染排放;C高度可靠,操作简单;D比能量和比功率高,建设周期短。
5.有一个电池上的标号是LR6,它的含义是:()A碱性锌锰圆柱形5号电池;B碱性锌锰圆柱形7号电池;C碱性锌氧化银圆柱形5号电池;D碱性锌氧化银圆柱形1号电池。
6.碱性Ni/Cd电池密封的工作原理主要是:()A负极的有效容量是正极的1.3-2.0倍;B正极的有效用量是负极的1.3-2.0倍;C正负极的有效容量基本相同,O2通过渗透膜到达负极使之还原消除;D正负极的有效容量基本相同,O2通过渗透膜到达正极使之还原消除。
7.开路电压OCV是指:()A没有电流流过外电路时电池正负极两级的电势差;B是指无负荷情况下的电池电压;C是指电池有电流流过时的端电压D是指电池放电电池终止时的电压值。
8.金属共沉积的基本条件是:φ1.析≈φ2.析,为了使两种离子共同析出,下列所采用的方法中不一定可行的是()A调节离子浓度;B调节电流密度C调节反应温度D加入络合剂9.在光亮硫酸盐镀铜中,阳极材料选用下列哪一种比较合适()A普通铜板B电解铜板C4%~30%的磷铜板D0.04%~0.3%的磷铜板10.有机膦酸盐镀铜(HEDP镀铜)的P H范围是8-10,其中HEDP与Cu2+的主要络合形式是():A〔Cu(C2H5P2O7)〕-B〔Cu(C2H4P2O7)〕2-C〔Cu(C2H3P2O7)2〕8-D〔Cu(C2H6P2O7)〕011.关于电镀液中的主盐,下列说法错误的是():A主盐浓度高,镀层较粗糙;B主盐浓度低,允许通过的电流密度小C主盐浓度低,沉积速度快;D常见的主盐是硫酸盐和氯化物。
应用电化学复习题

1. 什么是电极极化?如何降低电极极化?2. 请简述BDM(Bockris-Davanathan-Muller)双电层理论要点。
3. 什么是电毛细现象?什么是零电荷电势?物种在电极表面的吸附主要分哪几类?任何物种在电极与溶液接触的界面上具有的能量与其在溶液本体中所具有的能量是不同的,这就导致了该物种界面张力γ的存在。
界面张力与电极电势ϕ有关,随电极电势的变化而变化。
这种界面张力与电极电势之间具有一定依赖关系的现象称为电毛细现象(electrocapillarity)。
零电荷电势是研究电极/溶液界面性质的一个基本参考点第一种类型:由于电极表面过剩电荷的存在,离子通过静电引力吸附于电极表面,属于这类吸附的物种通常为简单的阴离子和阳离子。
这类吸附物的吸附量与电极表面电荷密度的关系极大。
第二种类型:憎水的有机化合物(中性有机分子)取代电极表面吸附的极性水分子而吸附于电极表面, 当电极/溶液界面被强烈极化时,水分子紧密地吸附于界面,用偶极矩较小的分子取代水分子在能量上是不利的。
这时的吸附只能发生在零电荷电势点附近,此处水分子可以较容易地被取代,而且这类物质的吸附量在零电荷电势点最大,但随着电极表面电荷密度偏离零电荷电势点,吸附量也逐渐降低。
第三种类型:核外电子排布为d10的金属离子,如Zn2+、Cd2+、Tl+、In3+在与阴离子形成配合物后吸附于电极表面。
这类吸附要求阴离子(如SCN-)本身能在电极上发生吸附,其特征是随电极表面电荷的增加而增加,然后再下降。
第四种类型:是过渡金属配合物的吸附,这类吸附与第三种类型不同,其吸附特征可以通过电极表面荷电情况和d电子的分布来了解。
第五种类型:前四种类型的吸附速度较快,而该类吸附需要一定时间才能完成。
在这类吸附过程中,配合物中的金属能与电极间形成金属-金属键,但其速度是很慢的。
这类吸附除与金属配合物有关外,还与电极材料的性质、电极表面的荷电情况有关。
4. 金属电化学腐蚀的种类以及防护措施。
《应用电化学》复习题-应化2014级

《应用电化学》复习题1.如何设计电化学反应体系?答:㈠电极工作电极 要求:①电化学反应不会因电极自身所发生的反应而受到影响②电极不发生反应,能在较大的电位区域中测定;③电极面积不宜太大电极表面最好应是均一平滑的,且能够通过简单的方法进行表面进化等等 分类:Ⅰ固体 惰性固体电极材料:玻碳、Pt 、Au 、Ag 、Pb 、导电玻璃。
Ⅱ液体液体电极(Hg 、Hg 齐):有可重现的均相表面,容易制备,H2析出超电势高。
辅助电极 要求:①与工作电极组成回路,使工作电极上电流流畅 ②辅助电极上可以安排为气体的析出反应或工作电极的逆反应,以使电解液组分不变③对工作电极影响轻度小④表面积大使极化作用主要作用于工作电极上,电阻小,不易极化,对形状、位置有要求。
参比电极 要求:① 用于测定研究电极的电极电势②提供热力学参比 ③是可逆电极,其电极电势符合Nerest 方程④应具有良好的电势稳定性和重现性等⑤不同体系采用不同参比电极㈡隔膜 要求:①导电②离子通透性③阴阳两极的产物不互相干扰㈢电解质溶液(介质)作用:①在电化学体系中起导电和反应物双重作用②电解质只起导电作用时,不发生氧化还原反应③固体电解质为具有离子导电性的晶态或非晶态物质2.试说明参比电极应具有的性能和用途。
参比电极(reference electrode ,简称RE):是指一个已知电势的接近于理想不极化的电极,参比电极上基本没有电流通过,用于测定研究电极(相对于参比电极)的电极电势。
既然参比电极是理想不极化电极,它应具备下列性能:应是可逆电极,其电极电势符合Nernst 方程;参比电极反应应有较大的交换电流密度,流过微小的电流时电极电势能迅速恢复原状;应具有良好的电势稳定性和重现性等。
不同研究体系可以选择不同的参比电极,水溶液体系中常见的参比电极有:饱和甘汞电极(SCE)、Ag/AgCl 电极、标淮氢电极(SHE 或NHE)等。
许多有机电化学测量是在非水溶剂中进行的,尽管水溶液参比电极也可以使用,但不可避免地会给体系带入水分,影响研究效果,因此,建议最好使用非水参比体系。
《应用电化学》复习题.(2019-11.11)doc

《应用电化学》复习题一、选择题()1、下列设备中不能用于测定锂离子电池充放倍率电性能测定的设备是:(A)新威电池测试仪;(B)CHI660系列电化学工作站;(C)化成-分容柜(仪);(D)电池内阻测试仪。
()2、一般锂离子电池、铅酸电池及的镍氢电池标准电压通常分别为:(A)3.6V、2.0V和1.2V;(B)1.5V、1.2V和3.2V;(C)1.5V、2.0V和3.2V;(D)1.2V、2.0V和3.7。
()3、测定镍镉电池Ni(OH)2活性物质综合电化学性能的最方便的仪器,应选用如下的:(A)CHI660 EIS;(B)Neware 化成;(C)CHI660 CV技术;(D)Neware 分容。
()4、CHI660系列电化学工作站,你用过的型号是:(A)CHI660A;(B)CHI660B;(C)CHI660D;(D)CHI660E。
()5、氢氧化镍电性能CV测试所使用的“三电极体系”三个电极分别为:(A)工作电极(Ni(OH)2/Pt)、对电极(Pt)、参比电极(Hg2Cl2);(B)阴极(Pt)、阳极(Hg2Cl2)、辅助电极(Pt);(C)正极(Ni(OH)2/Pt)、负极(Cu箔)、零极(Al箔);(D)工作电极(Hg2Cl2)、对电极(石墨)、参比电极(AgCl)。
()6、有关化学电源(如锂离子电池、镍氢或镍镉电池)生产或特性描述,下列正确的是:(A)锂离子电池生产工艺对生产环境要求一般;(B)镍氢或镍镉电池的生产对环境要求严格;(C)锂离子电池生产过程最怕水分和氧气;(D)电池的车间按序可分为:制片/拉浆/装配/化成/包装/分容。
()7、下列有关锂离子电池的正极构造(结构)描述或者说明中,错误的是:(A)锂离子电池的正极活性物质通常为钴酸锂、三元材料或者锰酸锂等;(B)锂离子电池正极由活性物质、导电剂、粘接剂、集流体及极耳等组成;(C)锂离子电池正极导电剂通常为石墨、或炭黑、或石墨烯;(D)锂离子电池正极导电剂通常为Super-P,添加剂为碳纳米管等。
电化学期末考试题及答案

电化学期末考试题及答案一、选择题(每题2分,共20分)1. 电化学中,原电池的工作原理是基于哪种化学反应?A. 氧化还原反应B. 酸碱中和反应C. 双置换反应D. 聚合反应答案:A2. 什么是法拉第定律?A. 描述电流与电荷关系的定律B. 描述电流与电压关系的定律C. 描述电流与电阻关系的定律D. 描述电流与电势关系的定律答案:A3. 在电化学电池中,哪一极是阳极?A. 正极B. 负极C. 正负极都可以D. 无法确定答案:B4. 电化学腐蚀中,哪种金属更容易被腐蚀?A. 纯金属B. 合金C. 合金中较活泼的金属D. 合金中较不活泼的金属答案:C5. 什么是电化学传感器?A. 用于测量电信号的传感器B. 用于测量化学信号的传感器C. 将化学信号转换为电信号的传感器D. 将电信号转换为化学信号的传感器答案:C6. 电化学中的过电位是指什么?A. 电池实际电压与理论电压之差B. 电池理论电压与实际电压之和C. 电池实际电压与理论电压之积D. 电池理论电压与实际电压之比答案:A7. 什么是电化学抛光?A. 通过电化学反应去除金属表面的氧化层B. 通过电化学反应去除金属表面的杂质C. 通过电化学反应使金属表面光滑D. 通过电化学反应改变金属的晶体结构答案:C8. 电化学合成中,电解液的作用是什么?A. 提供电子B. 提供离子C. 提供电场D. 提供热量答案:B9. 什么是电化学阻抗谱?A. 描述电化学系统阻抗随频率变化的图谱B. 描述电化学系统阻抗随时间变化的图谱C. 描述电化学系统阻抗随温度变化的图谱D. 描述电化学系统阻抗随压力变化的图谱答案:A10. 电化学中的电镀过程涉及到哪种类型的电池?A. 原电池B. 燃料电池C. 电解池D. 太阳能电池答案:C二、填空题(每空1分,共20分)1. 电化学中,电池的电动势(E)等于_______电势(E°)减去过电位(η)。
答案:标准2. 电化学腐蚀可以分为两类:_______腐蚀和_______腐蚀。
《应用电化学》考题

《应用电化学》期末考试题(总分100分,考试时间100分钟)一、填空题(每空一分,共20分)1. 一般电化学体系为三电极体系,相应的三个电极为( )、( )和( )。
化学电源一般分为( )极,电解池则分为( )极。
对于化学电源和电解装置,( )电极和( )电极通常合二为一。
2. 影响电催化活性的主要因素有催化剂的( ),( )以及( )。
3. 时空产率的单位为( ),氯碱工业三种方法采用的电解槽式分别为( )、( )和( )。
4. 电化学传感器可分为( )、( )和( )型传感器。
5. 在ϕ-pH 图中,有H +或OH -参加的非氧化还原反应是( )纵坐标的直线;有H +或OH -参加的氧化还原反应是一条( )的线;没有H +或OH -参加的氧化还原反应是( )纵坐标的直线。
二、选择题(每题2分,共20分)1. 电毛细现象是界面张力随( )变化的现象。
A 、溶液密度B 、电极电位C 、电极电流D 、溶液正负离子数 2. 电解水溶液,镍电极上的K η=0.40 V ,当k i 增加到原来的10倍时,η的值为( ) (提示:已知k i b a lg +=η中的b 为0.15V )A 、0.35VB 、0.55VC 、0.63VD 、0.49V 3. 电池容量的大小与正负电极__________与电池大小__________。
( ) A 、有关、无关 B 、有关、有关 C 、无关、无关 D 、无关、有关 4. 具有记忆效应的电池是( )A 、锌镍电池B 、镉镍电池C 、镍氢电池D 、镉银电池 5. 影响电极金属结晶生长的主要因素要看( )A 、电解液组成B 、过电位C 、电流密度D 、金属本质及离子价态 6. 按阴离子使金属失去钝化能力的强弱,下列离子的排列顺序正确的是( )A 、-Br > -Cl > -OH > -24SO B 、 -Br > -OH > -24SO > -Cl C 、-Cl > -Br > -OH > -24SO D 、-24SO > -OH > -Br > -Cl7. 金属钝化分为化学钝化、阳极钝化和机械钝化,钢锯条烤蓝和铅在硫酸中表面覆盖盐层引起腐蚀速率降低分别属于( )A 、化学钝化、机械钝化B 、化学钝化、阳极钝化C 、阳极钝化、化学钝化D 、机械钝化、化学钝化 8. 下列哪一条不属于Futuron 工艺对传统工艺的改进( )A 、Futuron 活化剂代替传统的活化剂B 、Cu-link Futuron 代替传统的催化剂C 、化学镀镍(铜)部分省去D 、不再需要预镀镍 9. 形稳阳极的最大特点不包括下面哪一条( ) A 、不受腐蚀 B 、尺寸稳定 C 、寿命长 D 、氧超电势低10. 一个有机电合成产品要工业化必须达到以下指标中不包括哪一条( ) A 、电流效率>50% B 、电解能耗> 8kW·h·kg -1最终产物C 、在电解液中最终产物浓度>10%D 、最终产物能简单分离三、判断题(每题2分,共10分)1. Tafel 公式中的常数a 与电极材料、电极表面状态、溶液组成以及实验温度有关,并且Tafel 方程使用于不存在物质传递对电流影响的情况。
电化学期末考试卷及答案

电化学期末考试卷及答案一、选择题(每题2分,共20分)1. 以下哪个不是电化学电池的组成部分?A. 阳极B. 阴极C. 电解质D. 电流表答案:D2. 以下哪个反应不是电化学反应?A. Cu2+ + 2e^- → CuB. 2H2O → 2H2 + O2C. Fe + Cu2+ → Fe2+ + CuD. NaCl → Na+ + Cl-答案:B3. 标准电极电势的基准物质是:A. Ag/AgClB. H2/H+C. Fe/Fe2+D. Cu/Cu2+答案:B4. 以下哪个电极是惰性电极?A. Cu电极B. Ag电极C. Pt电极D. Zn电极答案:C5. 以下哪个物质不能作为电解质?A. NaClB. H2SO4C. CH3COOHD. Cu答案:D6. 以下哪个电池是原电池?A. 铅酸电池B. 锂离子电池C. 镍氢电池D. 燃料电池答案:A7. 以下哪个电池是充电电池?A. 铅酸电池B. 镍氢电池C. 银锌电池D. 铝空气电池答案:B8. 以下哪个电池是碱性电池?A. 铅酸电池B. 碱性电池C. 锂离子电池D. 镍氢电池答案:B9. 以下哪个电池是燃料电池?A. 铅酸电池B. 燃料电池C. 锂离子电池D. 镍氢电池答案:B10. 以下哪个电池是太阳能电池?A. 硅太阳能电池B. 铅酸电池C. 锂离子电池D. 燃料电池答案:A二、填空题(每题2分,共20分)1. 电化学电池由________、________和________三部分组成。
答案:阳极、阴极、电解质2. 标准电极电势是指________。
答案:在标准状态下,电极与其对应的离子之间的电势差3. 电解质溶液中的离子迁移现象称为________。
答案:离子迁移4. 电池的电动势(EMF)等于________与________之差。
答案:阳极电势、阴极电势5. 电化学腐蚀过程中,金属发生________反应,非金属发生________反应。
06级应用电化学复习题090524

06级应化、化工专业《应用电化学》复习一. 基本理论1.电化学是研究电子导体和离子导体形成的带电界面现象及其变化的科学。
2. 分别解释电化学极化和浓差极化答:在电极反应的一系列步骤中,由电荷传递步骤控制整个电极过程的速度,称为电化学极化。
由于反应物和生成物的液相传质步骤受阻,出现浓度梯度引起的极化,称浓差极化。
3.浓差极化是由于扩散速度慢,而造成电极表面溶液与本体溶液浓度差别所引起的极化。
4. 稳定电位φS--- 不可逆电极,J=0,电荷转移达到平衡,物质转移不平衡,此稳态下的电极电位。
如硫酸铜溶液中的铁电极,氯化锌(酸性)溶液中的锌,即腐蚀电位。
5.析出电位:电镀时,电压越高,则阴极电位越负。
阴极电位负移到一定值时,才开始有金属析出。
刚开始析出金属时的阴极电位称析出电位。
析出电位与所镀金属性质和镀液有关。
金属析出电位正移越多,镀液的深镀能力越好。
6. 活化与钝化:测定电位—时间曲线时,若电极电位偏离平衡电位向负方向变化,则电极趋向于活化。
若电极电位偏离平衡电位向正方向变化,则电极趋向于钝化。
7.电极的极化:极化是电流通过电极时,电极电位偏离平衡电位的现象.8.交换电流密度J0越小,溶液中金属离子在阴极表面放电越困难,阴极极化越大。
二. 金属腐蚀与防护1. 腐蚀电池由阴极、阳极、电解质溶液和连接阴极和阳极的电子导体构成。
2. 缝隙腐蚀、沉积物腐蚀、水线腐蚀和因土质差异发生的管道腐蚀都是由氧浓差电池引起。
3. 根据Fe-H2O体系E-p H 图,将介质的p H值调整到9--13 ,可防止铁腐蚀。
4.什么叫腐蚀微电池?现有一含铜杂质的锌片,请叙述它在酸性溶液中的腐蚀原理。
答:腐蚀微电池:由于金属的电势与所含杂质的电势不同,构成以金属和杂质为电极的微小短路电池,引起金属的腐蚀。
在酸性溶液中,H+在微阴极铜杂质获得电子:2 H++2e-=H2,产生氢气,促使铜杂质附近的锌失去电子:Zn-2e -=Zn 2+ ,锌作为腐蚀微电池的阳极而被腐蚀。
复习-应用电化学 2011.10

一、填空题1、化学电源又叫电池,是将氧化还原反应的____________转变为____________的装置。
化学电源按照其工作性质和存储方式可分为一次电池和_____________、储备电池和_______________四大类。
2、一次电池有许多类型,按照电解液的不同可以分为__________________、_________________、_____________________和固体电解质电池。
3、锌锰电池是至今使用最为广泛的一种一次电池。
盐类电解液的锌锰电池可表示为_________________________________________,负极反应为________________________________,正极反应为_____________________________,电池反应为___________________________________________。
该电池放电电压比较平稳,但自放电现象明显,每年约损失30%。
碱性电解液锌锰电池自放电小、内阻小、放电电压比盐类电解液电池要高且稳定得多,其电池表达式为________________________________________________________,负极反应为____________________________,正极反应为__________________________,其电池反应为____________________________________________。
二、名词解释2、金属电沉积4、电流效率与电能效率5、金属的电化学腐蚀三、简答题1、简述铅酸蓄电池的正、负极电极反应和电池反应,并叙述影响其寿命和容量减小的原因及铅酸蓄电池的改进方法。
2、试写出氯酸钠电合成的主要反应及总反应,高氯酸钠电合成的电极反应与总反应。
3、什么叫金属的电结晶?电结晶动力学步骤有哪些?4、什么是氯碱工业?试比较氯碱工业中三种不同电解槽的优缺点。
应用电化学期末复习题
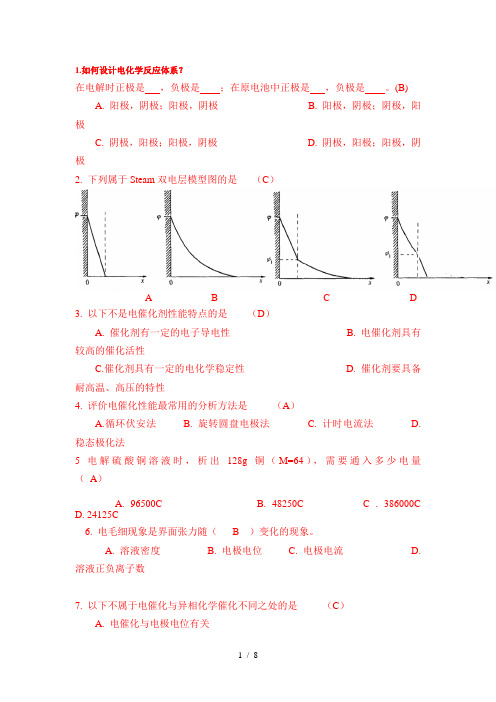
1.如何设计电化学反应体系?在电解时正极是,负极是;在原电池中正极是,负极是。
(B)A. 阳极,阴极;阳极,阴极B. 阳极,阴极;阴极,阳极C. 阴极,阳极;阳极,阴极D. 阴极,阳极;阳极,阴极2. 下列属于Steam双电层模型图的是(C)A B C D3. 以下不是电催化剂性能特点的是(D)A. 催化剂有一定的电子导电性B. 电催化剂具有较高的催化活性C.催化剂具有一定的电化学稳定性D. 催化剂要具备耐高温、高压的特性4. 评价电催化性能最常用的分析方法是(A)A.循环伏安法B. 旋转圆盘电极法C. 计时电流法D. 稳态极化法5电解硫酸铜溶液时,析出128g铜(M=64),需要通入多少电量(A)A. 96500CB. 48250C C . 386000CD. 24125C6. 电毛细现象是界面张力随( B )变化的现象。
A. 溶液密度B. 电极电位C. 电极电流D. 溶液正负离子数7. 以下不属于电催化与异相化学催化不同之处的是(C)A. 电催化与电极电位有关B. 溶液中不参加电极反应的离子和溶剂分子常常对电催化有明显影响C. 电催化不能应用在离子浓度较高的溶液中D. 电催化通常在相对较低的温度下即可起到催化作用8. 电池容量的大小与电池大小( ),与放点条件 ( )(A )A. 有关,有关 B. 有关,无关 C. 无关,有关 D. 无关,无关9. 下列关于电池寿命的叙述中错误的是 (D )A. 在一定条件下,电池工作到不能使用的工作时间B. 二次电池报废以前,在一定的充放电条件下,电池经历的充放电次数为其循环寿命C. 贮存寿命是指电池性能或电池容量降低到额定指标以下时的贮存时间D. 燃料电池的循环寿命较长10.电解水溶液,镍电极上的,当i k 增加到原来的10倍时,η的值为( B )(提示:已知中的b 为0.15V ) A.0.35V B. 0.50V C. 0.63V D.0.49V11. 一个有机电合成产品要实现工业化必须达到以下指标中不包括哪一条 ( B )A.电流效率>50%B. 电解能耗>81kW h kg-⋅⋅最终产物C. 在电解液中最终产物浓度>10%D. 最终产物能简单分离12. 在其他条件不变时,电解质溶液的摩尔电导率随溶液浓度的增加而( B )A. 增大B.降低C. 先增后减D.不变13. 下列对化学电源的描述哪个是不准确的:CA. 在阳极上发生氧化反应B. 电池内部由离子传输电荷C. 在电池外线路上电子从阴极流向阳极D. 当电动势为正值时电池反应是自发的14.电解水溶液,镍电极上的,当i k增加到原来的8倍时,η的值为(B )(提示:已知式中的b为0.12V,ln2=0.301),A. 0.25VB. 0.46VC. 0.53VD. 0.49V15. 镀镍液一般为酸性,以硫酸镍和氯化镍为主盐,以( B )为缓冲剂。
第章--应用电化学--习题及答案(精品).doc

第十章应用电化学习题及答案10-1 水的标准生成自由能是-237. 191kJ molT,求在25C时电解纯水的理论分解电压。
解:H2O=H2 +1/202,电子转移数为2,则有△ G = - 〃 F E mf= -237.191kJ mol-1^), -237191=-2X 96485 XE mf, E mf= 1.229V10-2 298. 15K 时测得电池:Pt(s) H2( p。
)| HC10) | Hg2Cl2(s) | Hg(l)的电动势与HC1溶液的质量摩尔浓度的关系如下bx 103/(mol kg-1) 75. 08 37. 69 18. 87 5. 04 晶/ V 0. 4119 0. 4452 0. 4787 0.5437求(1) £°甘乘(2) b= 0. 07508 mol kg^ 时HC1 溶液的/±。
解:负极反应:H2-2e -2H+正极反应:Hg2Cl2 +2e-2Hg +2CF电池反应:H2+ Hg2Cl2 -2H++2Hg +2CF所以有:E mf= E H-RT/2Fln [ a^H sW = E«_RT/2Fln (a^HC i^a(HCl)=a (H+) a(Cl )=( /士b/b'")2Emf=E°%-(2R〃F)ln(b/"°)对于稀溶液,ln/±=-A,(I/b— 1一1价电解质I=b(1)E m汁QRT/F) ln(Z?/Z?e)=E e tti + QRT/F) A' (Z?/Z?6)0'5 ,以E m^(2RT/F)ln(b/b Q)对(b/b"作图,直线的截距砂廿汞=0.2685 V(2) E mf=£e w - QRT/F) ln(b/b°) - (2RT/F) In/士, y± =0.81510-3 298. 2K 时,在有玻璃电极的电池中,加入pH = 4. 00的缓冲溶液,测得电动势为0. 1122V;则当电动势为0. 2305V时,溶液的pH为多少?解:pH r= pH, +F(E-E S)/(2.303RT)= 6.0010-4 求298. 15K时下列电池中待测液pH值(所需电极电势数值自查)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、什么是应用电化学?举例说明电化学主要应用领域有哪些?电化学是研究化学能和电能Z间相互转化以及相关的定律和规则的科学。
而应用电化学是将有关的电化学原理应用于与实际生产过程相关的领域,其任务是多种多样的,其屮重要的领域有:电池:锂电池、燃料电池、太阳能电池,金屈的表面精饰,电化学腐蚀和防腐,电化学分离技术,电化学分析,电化为传感器的开发以及无机、有机化合物的电解合成等。
2、什么是E电位?E电位是否影响电泳速度?&电位:在扩散层中存在的一个开始发牛流动的界面的电位。
要影响电泳速度,具体如下:电泳:外加电场下,胶体溶液中固相胶体粒了的移动现彖。
此时,g (Zeta)电位也称为电动电势。
电泳速度v为:v = g £ E / K兀n £:介电常数,E:电场强度,K:与粒了有关的常数,H:粘度。
3、简要说明电化学体系三要素。
电化学体系必须有阳极、阴极和电解质。
发牛氧化作用的极称为阳极;发牛还原反应的极称为阴极。
电解质起导电作用。
按反应类型來说,电极反应属于氧化还原反应,但与一般的有许多不同。
电极的作用表现在两个方而:一是电子通路,可以使氧化反应和还原反应分别在不同地点进行;二是电极表面是反应地点,起着相当于界相催化反应中催化剂的作用。
所以,可以将电极反应看作是特殊的异相氧化还原反应。
4、什么是法拉第定律?法拉第定律有限制条件吗?法拉第定律通电于电解质溶液中,(1)在电极上起作用物质的数虽与通入的电虽成正比;(2)将儿个电解池串联,通入电流后在各个溶液的两极上起作用物质的当量数相同。
法拉第定律可描述为:Q二n F (Q电量,n电极上1摩尔物质电解时所需电子的摩尔数(当量数),F法拉第常数(96500库仑)。
法拉第定律没有限制条件,在任何压力、温度下都适用。
5、电势分析法的应用与计算示例。
例题:以银电极为指示电极,双液接饱和甘汞电极为参比电极,用O.1OOO mol/L AgNO〈标准溶液滴定含Cl•试液,得到的原始数据如下(电势突越时的部分数据)。
用二级微商法求出滴定终点时消耗的AgNOn标准溶液体积?滴加体积(mL)24.0024.2024.3024.4024.5024.6024.70电位E (V)0.1830.1940.2330.3160.3400.3510.358解:将原始数据按二级微商法处理,得: 表中的一级微商和二级微商由后项减前项比体积差得到,例:0,316 -0. 233 =24.40 - 24. 30 —212E _ 0・24-0・83 丽—24.45 —24・35由表中的数据可见,二级微商等于零时所对应的体积值应在24. 30-24. 40mL之间,准确值可以由内插法计算出:4. 4V 甘24・30 +〔(24.40-24. 30) X—=24,34 ml (4・ 4+5.9)滴入的AgNO3体积(mL)测虽电位E(V)AEA V A2E TV24.000.1740.0924.100.1830.2().1 124.200.194 2.80.3924.300.233 4.40.8324.400.316-5.90.2424.500.340・1・30」124.600.351-0.40.0724.700.358将钙离子选择电极和饱和甘汞龟槻S 入100. OOmL 水样中,用直接电势法测定水 样中的Ca2・o 25'C 时,测得钙离子电极电势为一0. 0619V (对SCE ),加入0・0731mol/L 的Ca (NO 3)2标准溶液1・OOmL,搅拌平衡后,测得钙离子电极电势为一0・0483V (对SCE ) 。
试计算原水样中Ca2•的浓度?例题:在0. 1000mol/L F0溶液中,插入Pt 电极(+〉和SCE (-),在259时测得 电池电动势为0. 395V,问有多少Fe2•被氧化成Fe"6、简要说明pH 值、离子活度(或浓度)的测定原理和方法。
1. pH 测定原理与方法指示电极: pH 玻璃膜电极 参比电极饱和甘汞电极爭玻璃电池电动势为: 常数K 包括:外参比电极电势 内参比电极电势 不对称电势 液接电势E"甘束域購+ 了港捲 =%*5/血一(%6/“+甲喪)+竽浪樓=jcs 一J丄心.+ 了1・・・E 二疋+生空欧阴P2. pH 的实用定义(比较法来确定待测溶液的pH )两种溶液,pH 已知的标准缓冲溶液S 和pH 待测的试液X 。
测定各自的 电动势为:B S =K% + 2:.翠竹皿若测定条件完全一致,则Ks 二K3,两式相减得:式中pHs 已知,实验测出尿和/后,即可计算出试液的pHx , ICPAC 推 荐上式作为pH 的实用定义。
使用时,尽量使温度保持恒定并选用与待测溶 液pH 接近的标准缓冲溶液。
温度1 V 0. 05M 草酸三 氧钾 25 X?饱和洒 石酸牴钾 0.05M 邻苯 二甲t&Wff0. Olinol/LHJ 砂 25^Ca (0l02 10 1.6713.9969・ 330 13.011 15 1.6733.9969・ 276 12. 820 20 1.6763.9989・ 226 12. 637 25 1.6803. 5594.()03 9・ 182 12. 460 30 1.6813. 5514.010 9. 112 12. 292 35 1.688 3. 517 4.019 9. 105 12. 130 401.694 3. 547 4. 029 9.07211.975pHx 二 pHs +2. 303R77F3•离子活度(或浓度)的测定原理与方法离子选择性电极作正极时,对阳离子响应的电极,取正号;对阴离子响应的电极,取负号。
标准曲线法:用测定离子的纯物质配制一系列不同浓度的标准溶液,并用总离子强度调节缓冲溶液(Totlc Ionic Strength Adjustment Buffer简称TISAB)保持溶液的离子强度相对稳定,分别测定各溶液的电势值,并绘制E - log d关系曲线。
注意:离子活度系数保持不变时,膜电势才与log ci呈线性关系:K 士乞遊Tig社士警西igcF严 + 2.303MTISAB的作用①保持较大且相对稳定的离子强度,使活度系数恒定;②维持溶液在适宜的pH范围内,满足离子电极的要求;③掩蔽干扰离子。
测F•过程所使用的TISAB典型组成:lmol/L的NaCl0. 25mol/L 的HAc和0. 75mol/L 的NaAc0. 001mol/L的柠檬酸钠标准加入法:设某一试液体积为W),其待测离子的浓度为Cx测定的工作电池电动势为E\,贝IJ:L二K•士2型評C x)式中:"i为游离态待测离了占总浓產的分数;刃是活度系数;CX是待测离子的总浓度往试僉中准确加入一小体积〃(大约为W)的1/100的用待测离子的纯物质配制的标准溶液,浓度为Cs(约为Cx的10啼)。
由于可认为溶液体积基本不变。
浓度增量为:zlc=Cs Vs/Vo再次测定工作电池的电动势为E2:Er二K +生色°廻lg(X・Yr Cx + X“MC)nF可以认为Yi^ Kio ,…心小。
贝IJ: 4E二E L E,二卑譽魄(1 +鲁)令s s= 2・ 303RTnF••• C x- ZJC(10 JE/s - I)'7、简要介绍库仑分析法的原理与分析过程。
1.基本原理法拉第第一定律:物质在电极上析出产物的质量W与电解池的电量Q成正比法拉第第二定律:F n式中:M为物质的摩尔质量(g) , Q为电量(1库仑=1安培XI秒),F为法拉第常数(1F=96485库仑),〃为电极反应中转移的电子数。
・在25°C, 101.325kPa下,每库仑电量析出0.1741 mL混合气体,将将离子选择性电极(指示电极)和参比电极插入试液可以组成测定各种离子活度的电池,电池电动势为测得的库仑计中的混合气体的体积换算成标准状态下的体积V (mL),则可按下式计算被测物质的质量。
m =——Q每库仑电量析L BO.1 74厶混合气体nFM V M V= ---- x ------------------- = ------ --------- -- -------------------nF 0.174 \tnL • C1 n x 96485c • mol~]0.1741mL • C~]VMMO・例:用控制电位库仑法测定溶液中Fe2(SO4)3的含量时•使F"♦定量地在钳电极上还原成Fe2♦.电解完毕后,库仑计混合气体的体积为39.3 mL(23°C, 101992 Pa).计算试液中Fe2(SO4)3的含量.•解:将混合气体换算成标准状态下的体积PV=nRT 昭—即2T\ _ 丁2—竺込」0L992如X39.沁X缈P x T2101.325好么296 K=39.沁Fe2(SO4)3的含量为VM39.8/w L x 400g ・m()V{八川“m = ------------------- — = --------------------- : ---- = 0.434g16798mL - mol n16798加厶加o/ x 28、死停终点法在电解池中插入两个Pt电极作指示电极,并在这两个电极上加一个(50 ~ 200 mV )的小恒电压,在线路中串联一个灵敏的检流计G,滴定到达终点时,由于溶液中形成一对可逆电对或一对可逆电对消失,使钠电极的电流发生变化或停止变化,指示终点到达,这种指示终点的办法称为死停终点法・例:测定AsO33-含量时,可以在0. lmol - 1-1 H2S04介质,0.2 mol - 1-1 KBr辅助电解质中,电解产生的Br2滴定剂滴定AsO33-,两个工作电极都是Pt电极・电极反应为:阴极2H+ + 2e- = H2・阳极2Br 一= Br2 + 2e -・电生的Br2立即少溶液中的AsO33-反应・AsO33- + Br2 + H20 = As043- + 2Br -+ 2H+・计量点前,溶液中只有业-而不存在业2 ,只有可逆电对的一种状态,指示线路中无电流通过,检流计的光点停在零点(溶液中As043- /AsO33-为不可逆电对,有过电位)・当AsO33-反应完毕,溶液小有剩余Br2则产生Br2 /Br -可逆电对,所加小电压可使Br -和Br2在指示电极上发生电极反应•指示阴极Br2 + 2e - 2Br -•指示阳极2Br - — Br2 + 2e -・检流计上有电流通过,检流计光点突然有较大的偏转,而指示终点到达・死停终点法常用于氧化还原滴定体系,特别是以电住卤素为滴定剂的库仑滴定小应用最广9、影响电流效率的因素是什么?如何消除?(1)溶剂的电极反应;(2)溶液屮杂质的电解反应;(3)水中溶解氧;(4)电解产物的再反应;(5)充电电容。
